Method Article
4D Mikroskopi: Nomarski Mikroskobu Kullanarak Caenorhabditis elegans Embriyonik Gelişiminin Çözülmesi
Bu Makalede
Özet
Burada, Caenorhabditis elegans embriyolarının hazırlanması ve monte edilmesi, 4D mikroskop altında gelişimin kaydedilmesi ve hücre soyunun izlenmesi için bir protokol sunuyoruz.
Özet
4D mikroskopi, farklı hayvanlarda embriyonik gelişim sürecini çözmek için paha biçilmez bir araçtır. Son yıllarda, Caenorhabditis elegans , gelişimi incelemek için en iyi modellerden biri olarak ortaya çıkmıştır. Optik açıdan bakıldığında, boyutu ve şeffaf gövdesi bu nematodu DIC (Diferansiyel Girişim Kontrastı veya Nomarski) mikroskopisi için ideal bir örnek haline getirir. Bu makalede, C. elegans nematodlarının yetiştirilmesi, embriyolarının hazırlanması ve monte edilmesi, 4D mikroskopi ve hücre soyağacı takibinin yapılması için bir protokol gösterilmektedir. Yöntem, Nomarski görüntülerinin çok odaklı hızlandırılmış kayıtlarına ve belirli bir yazılımla yapılan analizlere dayanmaktadır. Bu teknik, hücresel düzeyde embriyonik gelişim dinamiklerini ortaya koymaktadır. Iğ oryantasyonundaki problemler, hücre göçü, apoptoz veya hücre kaderi spesifikasyonu gibi mutantlardaki herhangi bir embriyonik kusur etkili bir şekilde tespit edilebilir ve puanlanabilir. Embriyonun hemen hemen her bir hücresi, embriyonun hareket etmeye başladığı ana kadar takip edilebilir. Bir C. elegans embriyosunun tüm hücre soyunun 4D DIC mikroskopisi ile izlenmesi zahmetlidir, ancak belirli bir yazılımın kullanılması bu görevi büyük ölçüde kolaylaştırır. Ek olarak, bu tekniğin laboratuvarda uygulanması kolaydır. 4D mikroskopi çok yönlü bir araçtır ve embriyonik gelişimin benzersiz bir analizini yapma olasılığını açar.
Giriş
4D mikroskopi, araştırmacıların biyolojik bir numunenin hücre dinamiklerini hem mekansal hem de zaman içinde kaydetmelerini ve ölçmelerini sağlayan çok odaklı bir hızlandırılmış kayıt sistemidir. Hücre kültürleri, mayalar veya canlı dokular 4D analize tabi tutulabilir, ancak bu teknik özellikle canlı embriyoların gelişimini analiz etmek için uygundur. Bu analizin çözünürlüğü, embriyonun her bir hücresinin seviyesine ulaşır. Her hücre bölünmesi tespit edilebilir ve hücre hareketleri zamanla izlenebilir. Hücre kaderleri, hücrelerin kazandığı konum ve şekle göre değerlendirilir. Nomarski optiklerinin kullanımı, odak düzlemine müdahale eden ortogonal polarize ışık huzmeleri kullanarak lekesiz şeffaf numunelerin kontrastını arttırır. Elde edilen görüntüler üç boyutlu görünür, bir tarafta aydınlatılır.
Çekirdeklerin otomatik tespiti ve hücre soylarının oluşturulması için konfokal mikroskopi ve GFP transgenik hayvanların kullanımına dayanan diğer yöntemler geliştirilmiştir 1,2. Bu sistemlerin avantajı açıktır: Yazılım, her çekirdeği belirli bir süre boyunca manuel olarak işaretleme ihtiyacını büyük ölçüde geçersiz kılar (geç aşamalarda bazı manuel denetimler gerekmesine rağmen). Bununla birlikte, hücre farklılaşması, göç, apoptoz veya ceset yutulması sırasında meydana gelenler gibi hücre şekli veya membran dinamiklerindeki değişiklikleri içeren hücresel süreçler, floresan etiketli çekirdek görüntülerinde siyah bir arka plan olarak gizli kalır.
Buna karşılık, 4D Nomarski mikroskobu (DIC mikroskobu, Diferansiyel Girişim Kontrast mikroskobu olarak da adlandırılır), vahşi tip veya mutant hayvanların gelişimi sırasında meydana gelen hem çekirdekleri hem de hücre şekli değişikliklerini gösterir. Bu, standart mikroskoplar kullanarak hücre soyağacı izlemesine izin verir ve yalnızca iletilen ışığı kullanır. Belirli ifade kalıplarını göstermek dışında transgenik hayvanları kullanmaya genel bir ihtiyaç yoktur, bu durumda floresan taramaları birbirine karışabilir. Bu nedenle, bu, DIC mikroskobu 3,4,5,6,7 altında vurgulanabilen embriyogenez veya apoptoz gibi dinamik hücre süreçleri üzerinde çalışan birçok laboratuvar için en uygun yaklaşım olabilir.
Mikroskobik görüntüleri yakalamak ve kaydedilen örnekte hücre soylarını, 3B modelleri, hücre geçiş yollarını vb. Yeniden yapılandırmak için çeşitli esnek ve kullanıcı dostu programlar mevcuttur. Standart bir deneyde, görüntüler, sayısı numune kalınlığına bağlı olan sabit bir mesafede, bir dizi odak düzleminde elde edilir. Analizin zamansal çözünürlüğü, tarama sıklığı artırılarak optimize edilebilir. Kayıt süresi için bilgisayar depolama kapasitesi dışında neredeyse hiçbir sınır yoktur. Örneğin, bir C. elegans embriyo gelişim analizi için, 12 saat boyunca her 30 saniyede bir 30 odak düzleminde (her biri 1 mikron adım) rutin olarak görüntüler elde ediyoruz.
Bu sistemler, Caenorhabditis elegans 8,9,10, Drosophila melanogaster 11, diğer nematod embriyoları12,13, tardigradlar 14,15 ve hatta erken fare embriyoları 16 gibi çeşitli hayvan embriyolarının analizine uygulanmıştır. Tek şart, mikroskop altında slayt hazırlığında gelişebilen şeffaf bir embriyoya sahip olmaktır.
Özetle, DIC tabanlı 4D mikroskopi özellikle 1) küçük, şeffaf hayvanların embriyonik gelişimini analiz etmek için yararlıdır: hücre soyunun, hücre göç yollarının izlenmesi, 3D modellerin oluşturulması, vb. 2) gen ekspresyon kalıplarını tanımlamak; 3) mayadan insan hücrelerine kadar hücre kültürü dinamiklerini incelemek; 4) doku dinamiklerini veya embriyo parçalarını analiz etmek; 5) hücre ölümü kinetiğini ve ceset yutulmasını ölçmek; ve 6) embriyonik gelişimsel özelliklere dayalı karşılaştırmalı filojeni analizi yapmak. Bu konulardan herhangi birine (veya benzerlerine) ilgi varsa, 4D mikroskopi kullanılabilir.
Protokol
1. Petri tabaklarında C. elegans yetiştirin
- NGM plakaları hazırlayın ve besin kaynağı olarak E. coli OP50 ile tohumlayın (Şekil 1). C. elegans'ı tarif edildiği gibi büyütün ve koruyun17. Tohumlanmış plakaları 4 ° C'de bir aya kadar saklayın.
- Solucanları eklemeden önce plakaları istenen sıcaklığa ayarlayın.
- Solucanları aktarmak için, eski bir plakadan bir parça agar çıkarın ve taze bir tabağa yerleştirin.
- Alternatif olarak, steril bir solucan toplayıcı (bir Pasteur pipetinin ucuna monte edilmiş, düzleştirilmiş bir ucu olan 1 inçlik 32 gauge platin tel parçası) ile tek hayvanları yakalayın ve yeni plakaya yerleştirin.
- Solucanları istenen sıcaklıkta büyütün.
- C. elegans solucanlarını standart sıcaklık olan 20 ° C'de büyütün. Bununla birlikte, ısıya duyarlı mutantların gelişimini analiz etmek için, genellikle 25 ° C'de bir gece inkübasyonu gerçekleştirin. Belirli mutantlara bağlı olarak, bu inkübasyonun süresini ve sıcaklığını gerektiği gibi ayarlayın.
2. Embriyoları monte etmeden önce 4D mikroskopi kaydını hazırlayın (Şekil 2)
- Embriyoyu hazırlamadan önce mikroskop ve sıcaklık kontrollerini ayarlayın. C. elegans embriyoları çok hızlı bir şekilde bölünür. Embriyoları monte ettikten hemen sonra kayda başlamaya hazır olun.
- Kayıt sıcaklığını 15 °C, 20 °C veya 25 °C olarak ayarlayın.
- Embriyoları rutin olarak 25 ° C'de kaydedin. Fenotiplerini göstermek için ısıya duyarlı mutantları kısıtlayıcı sıcaklıkta kaydedin. Bir WT kontrolünü (farklı bir preparatta yapılırsa) mutantlarla aynı sıcaklıkta kaydedin.
NOT: WT embriyoları, hücre soyunda ek farklılıklar olmaksızın 25 ° C'de daha hızlı ve 15 ° C'de daha yavaş gelişir. Mikroskopları sıcaklık kontrollü bir odaya yerleştirin. Sürgüyü soğutarak veya ısıtarak ek kontrol son derece arzu edilir. Bu, suyun mikroskop hedefi ve kondenserin etrafındaki metal bir halka aracılığıyla belirli bir sıcaklıkta dolaştırılmasıyla sağlanabilir. Amaç ve hazırlık, daldırma yağı ile doğrudan temas halindedir ve sıcaklık transferi verimlidir. Bu sistem, kayıt sıcaklığının hassas bir şekilde kontrol edilmesini ve embriyo gelişimi sırasında sıcaklık değişimlerinin gerçekleştirilmesini sağlar.
- Embriyoları rutin olarak 25 ° C'de kaydedin. Fenotiplerini göstermek için ısıya duyarlı mutantları kısıtlayıcı sıcaklıkta kaydedin. Bir WT kontrolünü (farklı bir preparatta yapılırsa) mutantlarla aynı sıcaklıkta kaydedin.
- Mikroskopi yazılımında kayıt parametrelerini tanımlayın.
- Standart bir C. elegans kaydı için (floresan taramaları olmadan) şunları seçin:
Her biri 1 mikron mesafede 30 odak düzleminden oluşan z-yığınları.
Her z-yığınının başlangıcı arasında 30 saniyelik aralıklar.
1500 z-yığını (12,5 saatlik kayıt).
NOT: Hem ticari hem de açık kaynaklı mikroskop kontrol programları, görüntüleri yakalamak için bu iş akışını tanımlamak için kullanılabilir. Şimdi mikroskop kaydetmeye hazır.
- Standart bir C. elegans kaydı için (floresan taramaları olmadan) şunları seçin:
3. Embriyoları hazırlayın ve monte edin
- Güzel bir görüntü elde etmenin ilk adımı olarak ince, homojen bir agar pedi hazırlayın (Şekil 3).
- Deiyonize suda 50 ml% 4.5'lik bir agar çözeltisi hazırlayın. Mikrodalgada kaynamaya ısıtın ve 3 ml'lik cam tüplere 0.5 – 1 ml dökün.
- Kurulaşmayı önlemek için tüpleri balmumu filmi ile dikkatlice kapatın. Kapalı agar tüpleri oda sıcaklığında iki aya kadar saklanabilir.
- Laboratuvar tezgahında, 80 ° C'de bir ısı bloğuna sahip olun:
içinde ince bir boya fırçası bulunan saf petrol jölesi (erimiş) bir test tüpü.
Pasteur pipet içeren damıtılmış su içeren bir test tüpü.
NOT: Bu, gerekli tüm malzemelerin sıcak olmasını ve agarın pedi yapma sürecinde katılaşmamasını sağlar. - Balmumu filmini agar tüplerinden birinin üstünden çıkarın ve agar'ı eritmek için bir alkol brülörü üzerinde dikkatlice ısıtın. Cam tüpten atılan sıcak agar yanıklara neden olabileceğinden dikkatli olun.
- Agar eritildikten sonra, agar'ı sıvı halde tutmak için tüpü ısı bloğuna yerleştirin.
- Alternatif olarak, agar tüplerini bir brülör kullanmadan eritmek için deneyden 1 saat önce ısı bloğuna yerleştirin. Erimiş agar bir gün sonra atılmalıdır.
- Bir plastik parçası üzerine diğer iki kişi arasına bir mikroskop slaytı (Slayt A) yerleştirin.
- Başka bir slayt alın (Slayt B) ve bir elinizde parmaklarınızla tutun.
- Öte yandan, sıcak Pasteur pipetini kullanarak Slayt A'nın ortasına küçük bir damla erimiş agar yerleştirin.
- Slaytlar A ve B arasında çok ince bir ped oluşturmak için hemen B slaytını agar damlasına bastırın.
- Embriyoları monte edin.
- Toplayıcı ile 5-10 gravid hermafrodit toplayın ve bunları suyla dolu bir saat ustası bardağına yerleştirin.
- Hermafrodit nematodlarını kesmek ve stereomikroskop altında uterustan erken yumurtaları (1-4 hücre) çıkarmak için bir neşter kullanın.
- 3.1.10 adımındaki slaytı alın ve agar pedini Slayt A'da göstermek için yavaşça Slayt B'yi kaydırın.
- Kılcal bir tüp ile pipetleyerek agar pedinin ortasına erken bir yumurta yerleştirin.
- Alternatif olarak, agar pedine bir dizi embriyo içeren bir damla pipet yerleştirin ve daha sonra erken evre embriyoları arayın. Bu adımı stereomikroskop altında yapın.
- Gerekirse, yumurtayı kürdanın ucuna yapıştırılmış bir kirpikle dürterek hareket ettirin.
- Kılcal pipetle fazla suyu çıkarın.
NOT: Bir kılcal pipet, bir Pasteur pipeti bir alkol brülörü üzerinde ısıtıp her iki ucundan çekerek kolayca hazırlanabilir. - Hazırlığı dikkatlice bir kapak fişi ile örtün. Hava kabarcıklarını önlemek için, kapak kaymasının bir kenarını slaytın üzerine yerleştirin ve kapak kaymasını yavaşça ve eğik bir şekilde preparasyona örtmek için bitişik kenar boyunca bir neşteri yavaşça kaydırın.
- Agar pedini çevreleyen alanın 3/4'ünü suyla doldurmak için pipet kullanın. Alanın 1 / 4'ünü hava ile bırakın.
- Uzun kayıt süreleri boyunca kurumasını önlemek için kapak kapağını petrol jölesi ile kapatın.
- İnce fırçayı, ince bir erimiş petrol jölesi tabakasını kapak kapağının kenarına uzatmak için kullanın.
NOT: Şimdi hazırlık kayıt için hazır.
4. DIC'yi ayarlayın ve 4D mikroskopi kaydını başlatın
- Slaytı mikroskop aşamasına yerleştirin. Düşük büyütme hedefini (5x veya 10x) kullanarak embriyoyu odaklayın.
- 100x daldırma hedefine geçin.
- Nomarski görüntüsü elde etmek için mikroskobun optik bileşenlerini ayarlayın.
- Kondenseri odaklayın.
- Kondenserin diyaframını tamamen açın ve alan diyaframını kapatın (bu, daha yüksek bir sayısal diyafram açıklığı ve dolayısıyla daha yüksek çözünürlük sağlayacaktır).
- Mikroskoptaki her iki polarizörün de maksimum ışık sönmesine neden olacak şekilde yönlendirildiğini kontrol edin.
- Wollaston prizmasını çevirerek embriyonun bir taraftan aydınlatılmış üç boyutlu güzel bir görüntüsünü elde edin. Embriyonun diğer tarafta aydınlatılmasının etkisini elde etmek için prizmayı diğer yöne çevirin.
NOT: Bu adımlar, kayıttan önce bir test numunesi üzerinde gerçekleştirilebilir, böylece analiz edilen numunede yalnızca ince ayar yapılması gerekir.
- Görüntü yakalamayı mikroskopta başlatın.
5. 4D filmi analiz edin (Şekil 4).
NOT: Kayıt tamamlandıktan sonra, hücre kökenini yeniden yapılandırmak ve analiz etmek için hücre kökeni izleme yazılımını kullanın.
Hücre soyu izleme yazılımı, hücre kültürlerindeki veya doku fragmanlarındaki embriyonik gelişim veya dinamiklerin ayrıntılı analizlerini yapmak için güçlü bir araçtır. Program, hücre bölünmeleri, hücre döngüsü uzunluğu, göç veya apoptozun yanı sıra kinetiği de dahil olmak üzere, kaydedilen her hücrenin tam hücre soyunun oluşturulmasını içeren numunenin hücresel dinamikleri hakkında çeşitli veri setlerini çıkarır ve nicelleştirir. Ek olarak, hücre farklılaşması, hücrenin morfolojik değişiklikleri veya spesifik belirteçlerin ekspresyonu ile puanlanabilir. Temel olarak, yazılım ekranı iki pencere görüntüler: sol pencerede, 4D film ileri ve geri veya yukarı ve aşağı üst veya alt seviyelere oynatılabilir, böylece her hücre kayıt boyunca zaman ve mekanda takip edilebilir. Sağ dulda, hücre soyu oluşturulur. 4B filmde bir hücre çekirdeğine tıklamak, soy penceresinde hücre adı, kaderi ve uzamsal koordinatların bilgilerini depolayan bir nokta oluşturur. Belirli bir hücrenin hücre soyundan, 4B filmi ileri doğru oynatarak ve zaman içinde o belirli hücrenin mitozunu işaretlemek için periyodik olarak çekirdeğe tıklanarak oluşturulur. Kaydedilen hücrelerin her biri için bu işlemin tekrarlanması, embriyonun veya numunenin tam hücre soyunu oluşturur. Her hücrenin uzamsal koordinatları için depolanan bilgiler daha sonra 3B embriyo modellerini ve hücre göç yollarını yeniden yapılandırmak için kullanılır.
- Soy izleme yazılımını açın ve üst çubuk menüsüne gidip aşağıdakileri seçerek yeni bir proje oluşturun:
Dosya | Yeni proje. - Kayıt sıcaklığına bağlı olarak hücre soyağacı şablonunu seçin: 25 °C'de kayıt için DB08, 20 °C'de kayıt için DB10 ve 15 °C'de kayıt için DB12.
- Ortaya çıkan pencerede kayıt parametrelerini ayarlayın: tarama sayısı (genellikle 1500), taramalar arasındaki süre (30 saniye), düzey sayısı (30) ve düzeyler arasındaki mesafe (1 mikron).
- Görüntü dosyasını ve biçimini seçin.
- Görüntülerin kaydedildiği görüntü dizinini seçin.
- Görüntülerin tek görüntü (düzey ve zaman başına bir görüntü) olarak mı yoksa çok görüntülü z yığınları olarak mı kaydedileceğini seçin.
- Dosya adını ve görüntü biçimini belirleyin. Rutin olarak, tek görüntüler aşağıdaki adlar altında kaydedilir:
X0000L00C1 (tarama 0, seviye 0, kanal 1 için)
X0000L01C1 (tarama 0, seviye 1, kanal 1 için)
X0000L02C1 (tarama 0, düzey 2, kanal 1 için)
...
X0001L00C1 (tarama 1, düzey 0, kanal 1 için)
X0001L01C1 (tarama 1, düzey 1, kanal 1 için)
...
X0300L04C1 (tarama 300, seviye 4, kanal 1 için)
...
NOT: Görüntüleri sıkıştırılmış bir biçimde kaydetmek, sabit diskinizde yer tasarrufu sağlar.
- Işık kanallarını tanımlayın: DIC optikleri için 1, GFP için 2, RFP için 3, vb. 4B kayıtta kullanılanları ekleyin. Bunları tespit etmek için "kanal işleme etkin" i tıklayın.
- Embriyonun hücre soyunu izlemeye başlayın. Ekran artık iki ana pencere içeriyor: video penceresi ve hücre kökeni penceresi.
- Soy penceresinde, bir soy dalı seçin ve video penceresinde bu hücreye karşılık gelen hücre çekirdeğini tıklatmak için fareyi kullanın.
- İmleç tuşlarını kullanarak 4B filmi ileri, geri veya yukarı veya aşağı bir seviyede oynatarak hücreyi uzamsal olarak ve zaman içinde takip edin.
- Periyodik olarak hücre çekirdeğine tıklayın. Bu, soy dalında bir nokta oluşturur ve şu anda hücrenin uzamsal koordinatlarını kaydeder. Sonuç olarak, hücre soyu ilerler ve embriyonun 3D rekonstrüksiyonları mümkündür.
- return tuşuna tıklayarak mitozu işaretleyin. Ardından yavru hücrelerden birini seçin ve daha önce olduğu gibi izleyin.
- Embriyonik hücrelerin geri kalanının tüm hücre soyunu izlemesi veya apoptoz geçirenler gibi ilgilenilen spesifik hücreleri takip etmesi için işlemi tekrarlayın (5.6.1 ila 5.6.4 arasındaki adımlar).
- Mutant soyu kalıplaşmış WT C. elegans hücre soyu ile karşılaştırın.
Sonuçlar
İndirgenmiş glutatyonu (GSH) yenilemek için gerekli olan ve nematodda redoks homeostazını sürdürmeye dahil olan glutatyon redüktaz enzimini kodlayan gsr-1 geni için bir C. elegans mutantının embriyonik gelişimini karakterize etmek için, erken embriyonik arrest fenotip18'e neden olan fonksiyon aleli olan bir gsr-1 (tm3574) delesyon mutantının 4D mikroskopisini gerçekleştirdik. Hem WT hem de dengeli gsr-1 (tm3574) mutant C. elegans nematodları, besin kaynağı17 olarak E. coli OP50 ile tohumlanan NGM plakalarında yetiştirildi. gsr-1 (tm3574) solucanları iki nesil boyunca 20 ° C'de heterozigot olarak yetiştirildi ve daha sonra homozigot solucanları ayıran (anne yükü sayesinde yetişkinliğe kadar büyüyebilen) embriyo analizinden önce bir gecede inkübasyon için 25 ° C'ye kaydırıldı. Yoğuşmayı önlemek için solucan plakalar karton kutular içinde inkübe edildi (Şekil 1). Genç embriyoları çıkarmak için gravid nematodları kesilerek açıldı.
Aynı koşullar altında mutantın embriyonik gelişimini stereotiplenmiş WT'ye karşı karşılaştırmak için, bir WT (kontrol olarak) ve bir gsr-1 (tm3574) embriyosu yan yana aynı preparasyona yerleştirildi. 4D mikroskopi iş akışı, DIC optikleri ile donatılmış standart bir motorlu dik mikroskop üzerinde çalıştırıldı. Mikroskop kontrol programında seçilen kayıt parametreleri şunlardı: her biri 1 mikron mesafede 30 odak düzleminin z-yığınları, her bir z-yığınının başlangıcı ile 1500 z-yığını arasında 30 saniyelik aralıklar (12.5 saatlik kayıt). Kayıt sıcaklığı 25 ° C'ye ayarlandı (hem odada hem de mikroskop aşamasında) (Şekil 2).
Kayıt tamamlandıktan sonra, görüntü dosyası açıldı ve video penceresinde gösterilen hücre çekirdeklerine tıklanarak soy izleme yazılımı kullanılarak hücre soyu yeniden yapılandırıldı (Şekil 4). İzlenen gsr-1 (tm3574) mutant embriyonik hücre soyu arka planda tasvir edilen C. elegans WT soyu ile karşılaştırıldı. Önemli bir sonuç, embriyonik gelişim sırasında hücre döngüsünün ilerleyici bir gecikmesinin tespit edilmesiydi. Sonuç olarak, mutant embriyolar ara aşamalarda tutuklanırken, WT embriyoları ilerledi ve sonunda larva olarak yumurtadan çıktı.
Embriyoların mikroskop altında hazırlanması ve doğrudan gözlemlenmesi veya geç embriyonik belirteçlere karşı antikorlarla immünoboyama, WT'ye kıyasla mutantta yüksek oranda genç embriyonun varlığını ortaya çıkarabilir. Bununla birlikte, hücre döngüsü gecikmesinin doğrudan kanıtı ve kesin nicelleştirilmesi, yalnızca bir 4D mikroskopi deneyi ile zarif ve kolay bir şekilde gösterilebilir. Hücre farklılaşması veya apoptoz gibi embriyonik gelişimin diğer önemli özellikleri (Şekil 5), tek bir deneyde gelişimin birçok yönünün ayrıntılı bir analizini sunan 4D mikroskopi kullanılarak dinamik bir şekilde görselleştirilebilir.

Şekil 1: C. elegans nematodları laboratuvar koşullarında yetişmektedir. Nematodlar E. coli tohumlu NGM plakalarında yetiştirilir, karton kutularda saklanır ve 15 °C, 20 °C veya 25 °C'de inkübe edilir.
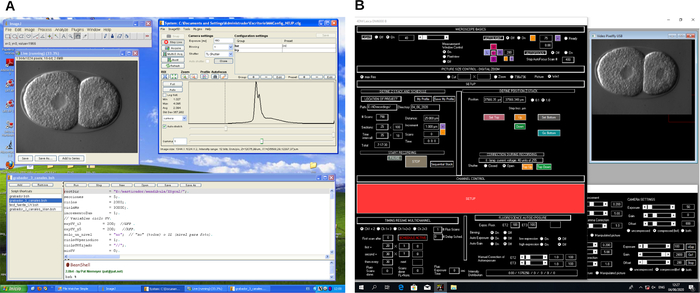
Şekil 2: 4D mikroskopi kayıt yazılımının ekran görüntüsü. İki farklı mikroskop kontrol yazılımı programı örneği (A ve B). Bu programlar, 4D mikroskopi kaydı sırasında mikroskop ve görüntü yakalamayı kontrol etmek için iş akışları oluşturur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 3: Agar pedinin hazırlanması ve montajı ile ilgili C. elegans embriyosunun seri fotoğrafları gösterilmektedir. A . Hazırlanmış agar tüpleri. B-C. Agar pedinin hazırlanması. D. Kısmen suyla dolu kaydırın. E. Slaytın petrol jölesi ile kapatılması. F. Son hazırlık. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
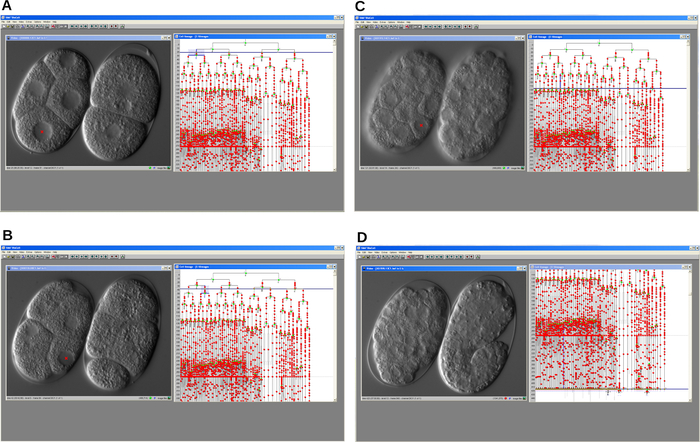
Şekil 4: Hücre soy izleyici yazılımının seri ekran görüntüleri. Program, bir hücre döngüsü gecikme mutantının (solda) ve bir WT (sağda) C. elegans embriyosunun embriyonik hücre soyunun yeniden yapılandırılmasına izin verir. A. Gelişimin erken bir adımı. B-C. Her iki embriyonun gelişimi zamanla ilerler. D. WT embriyosu düzgün gelişir ve uzamaya başlarken, mutant tutuklanır. Her durumda program video penceresini ve soy penceresini görüntüler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
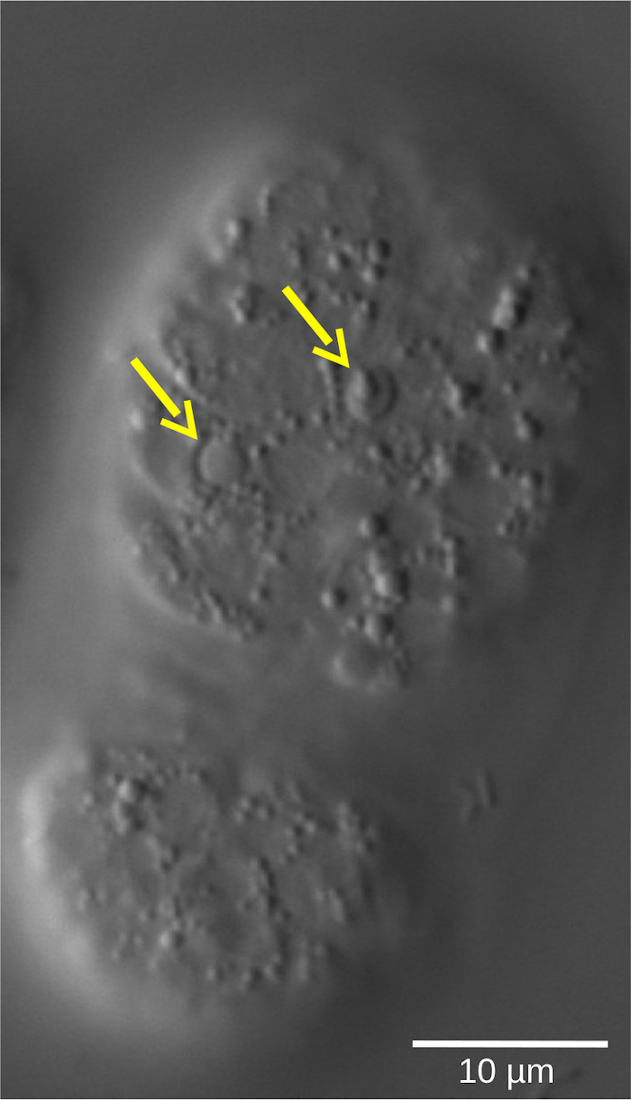
Şekil 5: Bir C. elegans WT embriyosundaki apoptotik hücrelerin mercimek refraktil şekli. Morfolojik özelliklerle tanımlanan hücre kaderi, 4D mikroskopi ile değerlendirilebilir. Resim, fasulye aşamasında bir C. elegans embriyosunu göstermektedir. Canlı hücreler, granüler bir sitoplazma ile çevrili pürüzsüz şekilli çekirdekler gösterir. Buna karşılık, apoptotik hücreler (sarı oklar) yoğunlaşır ve mercimek benzeri, refraktil bir şekil alır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Modern biyolojideki en büyük zorluklardan biri, çok hücreli organizmaların gelişimini anlamaktır. C. elegans, gelişmekte olan embriyoda hücre çoğalması ve hücre farklılaşması arasındaki ince koordinasyonu incelemek için en uygun modellerden biri olarak ortaya çıkmıştır. Optik açıdan bakıldığında, şeffaf gövdesi ve küçük boyutu bu nematodu DIC mikroskobu için ideal bir örnek haline getirir. Benzer özelliklere sahip diğer organizmalar da 4D mikroskopi analizine tabi tutulmuştur 11,12,13,14,15,16.
Bu gelişimsel çalışmalar için, ileri veya geri genetik ile gen inaktivasyonu, embriyogenezdeki katılımına dair bir ipucu sağlar. Bir genin gelişimde rol oynadığı kanıtlandıktan sonra, bir sonraki adım, doğru vücut planının oluşturulmasındaki rolünü tanımlamaktır. İmmün boyama çoğu model için seçilen yaklaşımdır. Bu teknik, hücre farklılaşmasındaki veya spesifik belirteçlerin ekspresyonundaki sorunları aydınlatır. Bununla birlikte, bu yaklaşımın önemli bir sınırlaması, yalnızca gelişimin sabit bir noktasında tek veya daha fazla işaretleyicinin ifadesinin statik bir görünümünü sağlamasıdır. Bu belirteçlerin gelişim boyunca dinamik bir görünümü ancak farklı embriyoların farklı zaman noktalarında boyanmasıyla elde edilebilir. Ek olarak, bu tür sabit örneklerde hücre soyu rekonstrüksiyonu mümkün değildir.
4D mikroskopi, embriyonik gelişimi incelemek için tamamlayıcı bir yaklaşımdır. Bu teknik, hücre düzeyinde çözünürlükte gelişim dinamiklerini ortaya koymaktadır. Embriyodaki iğ oryantasyonundaki problemler, hücre göçü, apoptoz, hücre kaderi spesifikasyonu gibi herhangi bir kusur, araştırmacı tarafından ileri ve geri görselleştirilebilen, nicelleştirilebilen ve puanlanabilen bir 4D filmde ortaya çıkacaktır. Bu tekniği kullanarak, embriyodaki hemen hemen her hücre, embriyonun hareket etmeye başladığı ana kadar takip edilebilir. Sadece görünür ışık ve Nomarski optikleri ile 4D mikroskopiye tabi tutulan embriyolar fotohasara maruz kalmaz. Floresan taramalar, bir genin ne zaman ve nerede ifade edildiğini tespit etmek için kayıt içinde de birleştirilebilir. Önemli fotohasara maruz kalan embriyolar, standart bir WT soy embriyosuna kıyasla güçlü UV ışınlamasına neden olan hücre döngüsü uzantısı ile tanımlanır. Bu durumda, UV lamba yoğunluğunu düşürerek ve kamera hassasiyetini veya pozlama süresini artırarak fotohasar azaltılabilir. Morfolojik özellikler ve moleküler belirteçler, herhangi bir mutantın embriyonik gelişimini netleştirmeye yardımcı olabilir.
Bir 4D mikroskopi sisteminin kurulması laboratuarda uygulanması kolaydır ve bazı uygulamalardan sonra, hücre dinamiklerinin eşsiz bir analizini ve hücre kültürlerinin soy izlemesini ve mikroskop alanındaki her hücrenin çözünürlük seviyesinde yaşayan şeffaf örnekleri mümkün kılar. DIC görüntülerinde hücre soyağacı izleme hala elle işlenir. Zaman alıcıdır ve yazılım aynı hücreyi işaretleyen farklı soy dalları gibi soy hatalarını tespit etse de, hatalar mümkündür. GFP etiketli hücrelerin otomatik tespiti iyi geliştirilmiş2 olsa da, işaretsiz hücrelere ve görünür ışık görüntülerine dayanan tamamlayıcı soy izleme yazılımı hala erken aşamadadır ve tam bir embriyo analizi için gerçekten yararlı değildir. Hiç şüphesiz görüntü tanıma sistemlerinin görünür ışık mikroskobu alanına uygulanması bu alanda büyük bir ilerlemeyi beraberinde getirecektir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Yazarlar, Rioja Salud Vakfı (Fondos FEDER) ve İspanya Ministerio de Ciencia, Innovación y Universidades (MCIU) (Grant PGC2018-094276-B-I00) desteğine teşekkür etmek istiyor. Cristina Romero Aranda, AECC'den (Asociación Española Contra el Cáncer) bir burs ile finanse edilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Caenorhabditis elegans (N2) | GCG (Caenorhabditis Genetics Center) | N2 | WT C. elegans strain. Can be requested at GCG (Caenorhabditis Genetics Center): https://cgc.umn.edu/ |
| Caenorhabditis elegans (VZ454) | GCG (Caenorhabditis Genetics Center) | VZ454 | gsr-1(tm3574) C. elegans mutant strain. Can be requested at GCG (Caenorhabditis Genetics Center): https://cgc.umn.edu/ |
| Cell Lineage Tracing software | SIMI | Simi BioCell | This is the software to reconstruct the embryo cell lineage. For a detailed explanation check at: http://www.simi.com/en/products/cell-research/simi-biocell.html |
| Microscope camera | Hamamatsu | Orca-R2 | Miscroscope camera for both transmitted and UV light |
| Microscope control software | Caenotec | Time to Live | This software controls the microscope to perform the 4D image capture. Can be requested at: Caenotec Prof. Ralf Schnabel Kleine Dorfstr. 9 38312 Börßum, Germany, Ph: ++49 151 11653356 r.schnabel(at)tu-bs.de |
| Microscope control software | Micro-manager | Micro-manager | This software controls the microscope to perform the 4D image capture. Can be downloaded at: https://micro-manager.org/ |
| Motorized microscope | Leica | Leica DM6000 | Motorized upright microscope to perform 4D microscopy |
| Standard equipment in a Molecular Biology lab. | |||
| Stereomicroscope | Leica | MZ16FA | Steromicroscope to manipulate nematodes and prepare embryos. |
Referanslar
- Hardin, J. Imaging embryonic morphogenesis in C. elegans. Methods in Cell Biology. 106, 377-412 (2011).
- Mace, D. L., Weisdepp, P., Gevirtzman, L., Boyle, T., Waterston, R. H. A high-fidelity cell lineage tracing method for obtaining systematic spatiotemporal gene expression patterns in Caenorhabditis elegans. G3: Genes, Genomes, Genetics (Bethesda). 3 (5), 851-863 (2013).
- Nieto, C., et al. ccz-1 mediates the digestion of apoptotic corpses in C. elegans. Journal of Cell Science. 123 (12), 2001-2007 (2010).
- Cabello, J., et al. PDR-1/hParkin negatively regulates the phagocytosis of apoptotic cell corpses in Caenorhabditis elegans. Cell Death & Disease. 5, 1120 (2014).
- Pinto, S. M., Almendinger, J., Cabello, J., Hengartner, M. O. Loss of Acetylcholine Signaling Reduces Cell Clearance Deficiencies in Caenorhabditis elegans. PLOS One. 11 (2), 0149274 (2016).
- Sáenz-Narciso, B., Gómez-Orte, E., Zheleva, A., Gastaca, I., Cabello, J. Control of developmental networks by Rac/Rho small GTPases: How cytoskeletal changes during embryogenesis are orchestrated. Bioessays. 38 (12), 1246-1254 (2016).
- Zheleva, A. Reduction of mRNA export unmasks different tissue sensitivities to low mRNA levels during Caenorhabditis elegans development. PLOS Genetics. 15 (9), 1008338 (2019).
- Schnabel, R., Hutter, H., Moerman, D., Schnabel, H. Assessing normal embryogenesis in Caenorhabditis elegans using a 4D microscope: variability of development and regional specification. Developmental Biology. 184 (2), 234-265 (1997).
- Verbrugghe, K. J. C., Chan, R. C. Imaging C. elegans Embryos using an Epifluorescent Microscope and Open Source Software. Journal of Visualized Experiments. (49), e2625 (2011).
- Boyd, L., Hajjar, C., O'Connell, K. Time-lapse Microscopy of Early Embryogenesis in Caenorhabditis elegans. Journal of Visualized Experiments. (54), e2852 (2011).
- Urbach, R., Schnabel, R., Technau, G. M. The pattern of neuroblast formation, mitotic domains and proneural gene expression during early brain development in Drosophila. Development. 130 (16), 3589-3606 (2003).
- Dolinski, C., Borgonie, G., Schnabel, R., Baldwin, J. G. Buccal capsule development as a consideration for phylogenetic analysis of Rhabditida (Nemata). Development Genes and Evolution. 208 (9), 495-503 (1998).
- Houthoofd, W., Jacobsen, K., Mertens, C., Vangestel, S., Coomans, A., Borgonie, G. Embryonic cell lineage of the marine nematode Pellioditis marina. Developmental Biology. 258 (1), 57-69 (2003).
- Hejnol, A., Schnabel, R. The eutardigrade Thulinia stephaniae has an indeterminate development and the potential to regulate early blastomere ablations. Development. 132 (6), 1349-1361 (2005).
- Hejnol, A., Schnabel, R. What a couple of dimensions can do for you: Comparative developmental studies using 4D microscopy-examples from tardigrade development. Integrative and Comparative Biology. 46 (2), 151-161 (2006).
- Bischoff, M., Parfitt, D. E., Zernicka-Goetz, M. Formation of the embryonic-abembryonic axis of the mouse blastocyst: relationships between orientation of early cleavage divisions and pattern of symmetric/asymmetric divisions. Development. 135 (5), 953-962 (2008).
- Mora-Lorca, J. A. Glutathione reductase gsr-1 is an essential gene required for Caenorhabditis elegans early embryonic development. Free Radical Biology and Medicine. 96, 446-461 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır