Method Article
4D-микроскопия: разгадка Caenorhabditis elegans Эмбриональное развитие с использованием микроскопии Номарского
В этой статье
Резюме
Здесь мы представляем протокол подготовки и монтажа эмбрионов Caenorhabditis elegans , регистрации развития под 4D-микроскопом и отслеживания клеточной линии.
Аннотация
4D-микроскопия является бесценным инструментом для разгадки эмбрионального процесса развития у разных животных. За последние десятилетия Caenorhabditis elegans стал одной из лучших моделей для изучения развития. С оптической точки зрения ее размер и прозрачное тело делают эту нематоду идеальным образцом для ДВС-матрицы (Дифференциальный интерференционный контраст или Номарский) микроскопии. Эта статья иллюстрирует протокол выращивания нематод C. elegans , подготовки и монтажа их эмбрионов, выполнения 4D-микроскопии и отслеживания клеточной линии. Метод основан на мультифокальных покадровых записях изображений Номарского и анализе с помощью специального программного обеспечения. Эта методика выявляет динамику эмбрионального развития на клеточном уровне. Любой эмбриональный дефект у мутантов, такой как проблемы с ориентацией веретена, миграцией клеток, апоптозом или спецификацией судьбы клеток, может быть эффективно обнаружен и оценен. Практически за каждой клеткой эмбриона можно следить до того момента, пока эмбрион не начнет двигаться. Отслеживание полной клеточной линии эмбриона C. elegans с помощью 4D-микроскопии DIC является трудоемким, но использование специального программного обеспечения значительно облегчает эту задачу. Кроме того, этот метод легко реализовать в лаборатории. 4D-микроскопия является универсальным инструментом и открывает возможность выполнения беспрецедентного анализа эмбрионального развития.
Введение
4D-микроскопия представляет собой мультифокальную систему покадровой записи, которая позволяет исследователям регистрировать и количественно оценивать динамику клеток биологического образца как пространственно, так и с течением времени. Клеточные культуры, дрожжи или живые ткани могут быть подвергнуты 4D-анализу, но этот метод особенно подходит для анализа развития живых эмбрионов. Разрешение этого анализа достигает уровня каждой отдельной клетки эмбриона. Каждое деление клеток может быть обнаружено, и движения клеток могут быть прослежены с течением времени. Судьба клеток оценивается в соответствии с положением и формой, которую приобретают клетки. Использование оптики Номарского усиливает контрастность незапятнанных прозрачных образцов с использованием ортогонально поляризованных световых пучков, которые мешают в фокальной плоскости. Полученные изображения кажутся трехмерными, освещенными с одной стороны.
Разработаны другие методы, основанные на использовании конфокальной микроскопии и трансгенных животных GFP для автоматического обнаружения ядер и генерации клеточныхлиний 1,2. Преимущество этих систем очевидно: программное обеспечение значительно переопределяет необходимость ручной маркировки каждого ядра в течение определенного периода времени (хотя на поздних стадиях требуется некоторый ручной контроль). Однако клеточные процессы, связанные с изменениями в форме клеток или динамике мембран, такие как те, которые происходят во время дифференцировки клеток, миграции, апоптоза или поглощения трупа, остаются скрытыми в виде черного фона на флуоресцентно-меченых изображениях ядер.
Напротив, 4D-микроскопия Номарского (также называемая DIC-микроскопией, дифференциальная интерференционная контрастная микроскопия) показывает как ядра, так и изменения формы клеток, которые происходят во время развития диких или мутантных животных. Это позволяет отслеживать клеточную линию с помощью стандартных микроскопов, используя только проходящий свет. Нет общей необходимости использовать трансгенных животных, за исключением демонстрации конкретных моделей экспрессии, и в этом случае флуоресцентное сканирование может быть интеркалировано. Таким образом, это может быть оптимальным подходом для многих лабораторий, работающих над динамическими клеточными процессами, такими как эмбриогенез или апоптоз, которые могут быть выделены при микроскопии ДВС-синдрома 3,4,5,6,7.
Доступно несколько гибких и удобных программ для захвата микроскопических изображений и реконструкции клеточных линий, 3D-моделей, путей миграции клеток и т. Д. В записанном образце. В стандартном эксперименте изображения получаются в серии фокальных плоскостей, на постоянном расстоянии, количество которых зависит от толщины образца. Временное разрешение анализа может быть оптимизировано за счет увеличения частоты сканирования. Практически нет ограничений на продолжительность записи, кроме емкости компьютера. Например, для анализа развития эмбриона C. elegans мы обычно получаем изображения на 30 фокальных плоскостях (1 микрон-шаг каждая) каждые 30 секунд в течение 12 часов.
Эти системы были применены для анализа нескольких эмбрионов животных, таких как Caenorhabditis elegans 8,9,10, Drosophila melanogaster11, других эмбрионов нематод12,13, тихоходок14,15 и даже ранних эмбрионов мышей16. Единственным требованием является наличие прозрачного эмбриона, способного развиваться на под микроскопом препарате слайда.
Таким образом, 4D-микроскопия на основе ДВС-синдрома особенно полезна для 1) анализа эмбрионального развития мелких прозрачных животных: отслеживания клеточной линии, путей миграции клеток, создания 3D-моделей и т. Д.; 2) определение паттернов экспрессии генов; 3) изучение динамики клеточных культур, от дрожжей до клеток человека; 4) анализ динамики тканей или фрагментов эмбриона; 5) количественная оценка кинетики гибели клеток и поглощения трупов; и 6) проведение сравнительного филогенного анализа на основе особенностей эмбрионального развития. Если есть интерес к какой-либо из этих тем (или подобных), можно использовать 4D-микроскопию.
протокол
1. Выращивайте C. elegans на чашках Петри
- Приготовьте пластины NGM и засыпьте их кишечной палочкой OP50 в качестве источника пищи (рисунок 1). Выращивайте и поддерживайте C. elegans , как описано17. Храните семенные тарелки при температуре 4 °C до одного месяца.
- Отрегулируйте пластины до нужной температуры перед добавлением червей.
- Чтобы перенести червей, снимите кусок агара со старой тарелки и поместите его на свежую тарелку.
- В качестве альтернативы можно отловить одиночных животных с помощью стерильного сборщика червей (1-дюймовый кусок платиновой проволоки 32-го калибра с уплощенным наконечником, установленный на кончике пипетки Пастера) и поместить их на новую пластину.
- Выращивайте червей при нужной температуре.
- Выращивают червей C. elegans при 20 °C, стандартной температуре. Однако, чтобы проанализировать развитие термочувствительных мутантов, выполняют ночную инкубацию, обычно при 25 °C. Отрегулируйте продолжительность и температуру этой инкубации по мере необходимости, в зависимости от конкретного мутанта.
2. Подготовьте запись 4D-микроскопии перед установкой эмбрионов (рисунок 2)
- Установите микроскоп и контроль температуры перед подготовкой эмбриона. Эмбрионы C. elegans делятся очень быстро. Будьте готовы начать запись сразу после установки эмбрионов.
- Отрегулируйте температуру записи до 15 °C, 20 °C или 25 °C.
- Обычно регистрируйте эмбрионы при температуре 25 °C. Записывайте термочувствительных мутантов при ограничительной температуре, чтобы показать их фенотипы. Запишите контроль WT (если он выполнен в другом препарате) при той же температуре, что и мутанты.
ПРИМЕЧАНИЕ: Эмбрионы WT развиваются быстрее при 25 °C и медленнее при 15 °C без дополнительных различий в клеточной линии. Поместите микроскопы в помещение с контролируемой температурой. Дополнительное управление путем охлаждения или нагрева затвора очень желательно. Это может быть достигнуто путем циркуляции воды при определенной температуре через металлическое кольцо вокруг объектива микроскопа и конденсатора. Цель и препарат находятся в непосредственном контакте через погружное масло, и передача температуры эффективна. Эта система позволяет точно контролировать температуру записи и выполнять температурные сдвиги во время развития эмбриона.
- Обычно регистрируйте эмбрионы при температуре 25 °C. Записывайте термочувствительных мутантов при ограничительной температуре, чтобы показать их фенотипы. Запишите контроль WT (если он выполнен в другом препарате) при той же температуре, что и мутанты.
- Определите параметры записи в программном обеспечении для микроскопии.
- Для стандартной записи C. elegans (без флуоресцентного сканирования) выберите:
z-стеки из 30 фокальных плоскостей, на расстоянии 1 микрон каждый.
Интервалы 30 секунд между началом каждого z-стека.
1500 z-стеков (12,5 часов записи).
ПРИМЕЧАНИЕ: Для определения этого рабочего процесса для захвата изображений могут использоваться как коммерческие, так и открытые программы управления микроскопом. Теперь микроскоп готов к записи.
- Для стандартной записи C. elegans (без флуоресцентного сканирования) выберите:
3. Подготовьте и смонтируйте эмбрионы
- Подготовьте тонкую однородную агаровую прокладку в качестве первого шага в получении красивого изображения (рисунок 3).
- Приготовьте 50 мл 4,5% раствора агара в деионизированной воде. Разогреть до кипения в микроволновой печи и разлить 0,5 – 1 мл в стеклянные пробирки по 3 мл.
- Тщательно запечатайте трубки восковой пленкой, чтобы избежать высыхания. Герметичные агаровые трубки могут храниться при комнатной температуре до двух месяцев.
- На лабораторном стенде имейте тепловой блок при 80 °C с:
пробирка чистого вазелина (расплавленного), с тонкой кистью для краски внутри.
пробирка с дистиллированной водой, содержащая пипетку Пастера.
ПРИМЕЧАНИЕ: Это гарантирует, что все необходимые материалы будут горячими, и агар не затвердеет в процессе изготовления прокладки. - Снимите восковую пленку с верхней части одной из агаровых трубок и тщательно нагрейте ее над спиртовой горелкой, чтобы расплавить агар. Соблюдайте осторожность, так как горячий агар, выброшенный из стеклянной трубки, может вызвать ожоги.
- Как только агар расплавится, поместите трубку в тепловой блок, чтобы сохранить агар в жидкой форме.
- В качестве альтернативы поместите агаровые трубки в тепловой блок за 1 час до эксперимента, чтобы расплавить их без использования горелки. Расплавленный агар следует выбросить через один день.
- Поместите предметное стекло микроскопа (слайд А) между двумя другими на кусок пластика.
- Возьмите еще один слайд (слайд B) и держите его пальцами в одной руке.
- Другой рукой поместите небольшую каплю расплавленного агара в центр слайда А, используя теплую пипетку Пастера.
- Немедленно нажмите слайд B на каплю агара, чтобы создать очень тонкую прокладку между слайдами A и B. Держите эти слайды зажатыми вместе до шага 3.2.3.
- Монтируйте эмбрионы.
- Соберите 5-10 гравидных гермафродитов с помощью сборщика и поместите их в стекло часовщика, наполненное водой.
- Используйте скальпель, чтобы разрезать гермафродитовые нематоды и извлечь ранние яйцеклетки (1-4 клетки) из матки под стереомикроскопом.
- Снимите слайд с шага 3.1.10 и осторожно соскользните с слайда B, чтобы обнажить агаровую подушку на слайде A.
- Поместите раннее яйцо в центр агаровой подушечки путем пипетки капиллярной трубкой.
- В качестве альтернативы, пипетка капли, содержащей набор эмбрионов, на агаровую прокладку, а затем поиск эмбрионов на ранней стадии. Сделайте этот шаг под стереомикроскопом.
- При необходимости переместите яйцо, подталкивая его ресницей, приклеенной к концу зубочистки.
- Удалите лишнюю воду капиллярной пипеткой.
ПРИМЕЧАНИЕ: Капиллярную пипетку можно легко приготовить, нагрев пипетку Пастера над спиртовой горелкой и вытащив ее с обоих концов. - Тщательно накройте препарат крышкой. Чтобы избежать пузырьков воздуха, поместите один край крышки на слайд и осторожно проведите скальпелем вдоль соседнего края, чтобы медленно и косо задрапировать крышку на препарат.
- Используйте пипетку, чтобы заполнить 3/4 пространства, окружающего агаровую прокладку, водой. Оставьте 1/4 пространства с воздухом.
- Запечатайте крышку вазелином, чтобы избежать высыхания в течение длительных периодов записи.
- Используйте тонкую щетку, чтобы протянуть тонкий слой расплавленного вазелина по краю крышки.
ПРИМЕЧАНИЕ: Теперь подготовка готова к записи.
4. Отрегулируйте DIC и начните запись 4D-микроскопии
- Поместите слайд на ступень микроскопа. Сфокусируйте эмбрион с помощью объектива с низким увеличением (5x или 10x).
- Перейдите на цель 100-кратного погружения.
- Отрегулируйте оптические компоненты микроскопа, чтобы получить изображение Номарского.
- Сфокусируйте конденсатор.
- Полностью откройте отверстие конденсатора и закройте поле диафрагмы (это обеспечит более высокую числовую диафрагму и, следовательно, большее разрешение).
- Убедитесь, что оба поляризатора на микроскопе ориентированы на максимальное затухание света.
- Поверните призму Волластона, чтобы получить красивое трехмерное изображение эмбриона, освещенное с одной стороны. Поверните призму в другую сторону, чтобы получить эффект освещения эмбриона на другой стороне.
ПРИМЕЧАНИЕ: Эти шаги могут быть выполнены на испытательном образце перед записью, так что требуется только тонкая настройка анализируемого образца.
- Запустите захват изображения в микроскоп.
5. Проанализируйте 4D-фильм (рисунок 4).
ПРИМЕЧАНИЕ: Как только запись будет завершена, используйте программное обеспечение для отслеживания клеточной линии для реконструкции и анализа клеточной линии.
Программное обеспечение для отслеживания клеточной линии является мощным инструментом для выполнения детального анализа эмбрионального развития или динамики в клеточных культурах или фрагментах тканей. Программа извлекает и количественно оценивает несколько наборов данных о клеточной динамике образца, которые включают генерацию полной клеточной линии каждой зарегистрированной клетки, включая клеточные деления, длину клеточного цикла, миграцию или апоптоз, а также ее кинетику. Кроме того, дифференцировка клеток может быть оценена морфологическими изменениями клетки или экспрессией специфических маркеров. По сути, экран программного обеспечения отображает два окна: в левом окне 4D-фильм можно воспроизводить вперед и назад или вверх и вниз до верхнего или нижнего уровней, чтобы за каждой ячейкой можно было следить во времени и пространстве на протяжении всей записи. На правой вдове генерируется клеточная линия. Нажатие на ядро клетки в 4D-фильме генерирует точку в окне линии, в которой хранится информация о названии ячейки, судьбе и пространственных координатах. Клеточная линия конкретной клетки генерируется путем воспроизведения 4D-фильма вперед и периодического щелчка по ядру, чтобы отметить митоз этой конкретной клетки с течением времени. Повторение этого процесса для каждой из зарегистрированных клеток генерирует полную клеточную линию эмбриона или образца. Сохраненная информация для пространственных координат каждой клетки позже используется для реконструкции 3D-моделей эмбрионов и путей миграции клеток.
- Откройте программное обеспечение для трассировки линий и создайте новый проект, перейдя в меню верхней панели и выбрав:
Файл | Новый проект. - Выберите шаблон клеточной линии в зависимости от температуры записи: DB08 для записи при 25 °C, DB10 для записи при 20 °C и DB12 для записи при 15 °C.
- Установите параметры записи в появившемся окне: количество сканирований (обычно 1500), время между сканированиями (30 секунд), количество уровней (30) и расстояние между уровнями (1 микрон).
- Выберите файл изображения и формат.
- Выберите каталог изображений, в котором они были сохранены.
- Выберите, следует ли сохранять изображения как одиночные изображения (одно изображение на уровень и время) или как z-стеки с несколькими изображениями.
- Определите имя файла и формат изображения. Обычно отдельные изображения сохраняются под следующими именами:
X0000L00C1 (для сканирования 0, уровень 0, канал 1)
X0000L01C1 (для сканирования 0, уровень 1, канал 1)
X0000L02C1 (для сканирования 0, уровень 2, канал 1)
...
X0001L00C1 (для сканирования 1, уровень 0, канал 1)
X0001L01C1 (для сканирования 1, уровень 1, канал 1)
...
X0300L04C1 (для сканирования 300, уровень 4, канал 1)
...
ПРИМЕЧАНИЕ: Сохранение изображений в сжатом формате экономит место на жестком диске.
- Определите световые каналы: 1 для оптики DIC, 2 для GFP, 3 для RFP и т.д. Добавьте те, которые использовались в 4D-записи. Нажмите «Обработка каналов включена», чтобы обнаружить их.
- Начните прослеживать клеточную линию эмбриона. Экран теперь содержит два основных окна: окно видео и окно клеточной линии.
- В окне родословной выберите ветвь линии и с помощью мыши щелкните ядро ячейки, соответствующее этой клетке, в окне видео.
- Следуйте за ячейкой пространственно и с течением времени, воспроизводя 4D-фильм вперед, назад или вверх или вниз по уровню с помощью клавиш курсора.
- Периодически нажимайте на ядро клетки. Это генерирует точку в ветви линии и регистрирует пространственные координаты ячейки в это время. В результате клеточная линия прогрессирует, и возможны 3D-реконструкции эмбриона.
- Отметьте митоз, щелкнув клавишу возврата. Затем выберите одну из дочерних ячеек и следуйте за ней, как и раньше.
- Повторите процесс (этапы с 5.6.1 по 5.6.4) для остальных эмбриональных клеток, чтобы проследить полную клеточную линию или проследить за конкретными клетками, представляющими интерес, такими как те, которые подвергаются апоптозу.
- Сравните мутантную линию со стереотипной клеточной линией WT C. elegans .
Результаты
Чтобы охарактеризовать эмбриональное развитие мутанта C. elegans для гена gsr-1, кодирующего фермент глутатионредуктазу, необходимый для регенерации восстановленного глутатиона (GSH) и участвующий в поддержании окислительно-восстановительного гомеостаза у нематоды, мы выполнили 4D-микроскопию мутанта делеции gsr-1 (tm3574), который является аллелем потери функции, вызывающим раннюю эмбриональную остановку фенотипа18. Как WT, так и сбалансированные gsr-1 (tm3574) мутантные нематоды C. elegans были выращены на пластинах NGM, засеянных E. coli OP50 в качестве источника пищи17. Червей gsr-1 (tm3574) выращивали как гетерозиготных при 20 °C в течение двух поколений, а затем сегрегировали гомозиготных червей (которые способны расти до зрелого возраста благодаря материнской нагрузке) смещали до 25 °C для ночной инкубации перед анализом эмбриона. Червячные пластины инкубировали в картонных коробках, чтобы избежать конденсации (рисунок 1). Гравидные нематоды были разрезаны для извлечения молодых эмбрионов.
Чтобы сравнить эмбриональное развитие мутанта со стереотипным WT в одинаковых условиях, ЭМБРИОН WT (в качестве контроля) и gsr-1 (tm3574) были помещены на один и тот же препарат рядом друг с другом. Рабочий процесс 4D-микроскопии выполнялся на стандартном моторизованном вертикальном микроскопе, оснащенном оптикой DIC. Выбранными параметрами записи в программе управления микроскопом были: z-стеки из 30 фокальных плоскостей на расстоянии 1 микрон каждый, интервалы 30 секунд между началом каждого z-стека и 1500 z-стеками (12,5 часов записи). Температура записи была скорректирована до 25 °C (как в помещении, так и на сцене микроскопа) (рисунок 2).
Как только запись была завершена, файл изображений был открыт, и клеточная линия была реконструирована с помощью программного обеспечения для трассировки линий, щелкнув по ядрам клеток, показанным в окне видео (рисунок 4). Прослеживаемую линию мутантных эмбриональных клеток gsr-1 (tm3574) сравнивали с линией C. elegans WT, изображенной на заднем плане. Основным результатом стало обнаружение прогрессирующей задержки клеточного цикла во время эмбрионального развития. Как следствие, мутантные эмбрионы останавливались на промежуточных стадиях, тогда как эмбрионы WT прогрессировали и, наконец, вылуплялись как личинки.
Подготовка и непосредственное наблюдение за эмбрионами под микроскопом или иммуноокрашивание антителами против поздних эмбриональных маркеров может выявить наличие высокого процента молодых эмбрионов у мутанта по сравнению с WT. Остановка эмбриона может быть выведена как наиболее правдоподобное объяснение. Тем не менее, прямое доказательство и точная количественная оценка задержки клеточного цикла могут быть элегантно и легко показаны и количественно определены только с помощью эксперимента с 4D-микроскопией. Другие важные особенности эмбрионального развития, такие как дифференцировка клеток или апоптоз (рисунок 5), также могут быть визуализированы динамическим образом с использованием 4D-микроскопии, которая предлагает подробный анализ нескольких аспектов развития в одном эксперименте.

Рисунок 1: Нематоды C. elegans , растущие в лабораторных условиях. Нематоды выращиваются на пластинах NGM с семенами E. coli, хранятся в картонных коробках и инкубируются при 15 °C, 20 °C или 25 °C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
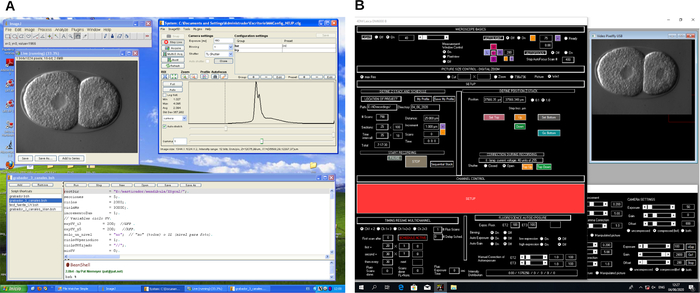
Рисунок 2: Снимок экрана программного обеспечения для записи 4D-микроскопии. Пример двух различных программ управления микроскопом (A и B). Эти программы создают рабочие процессы для управления микроскопом и захвата изображения во время записи 4D-микроскопии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Серийные фотографии подготовки агаровой прокладки и монтажа эмбриона C. elegans . А. Приготовленные агаровые тубы. Б-С. Приготовление агаровой прокладки. Д. Горка частично заполнена водой. Э. Запечатывание горки вазелином. Ф. Заключительная подготовка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
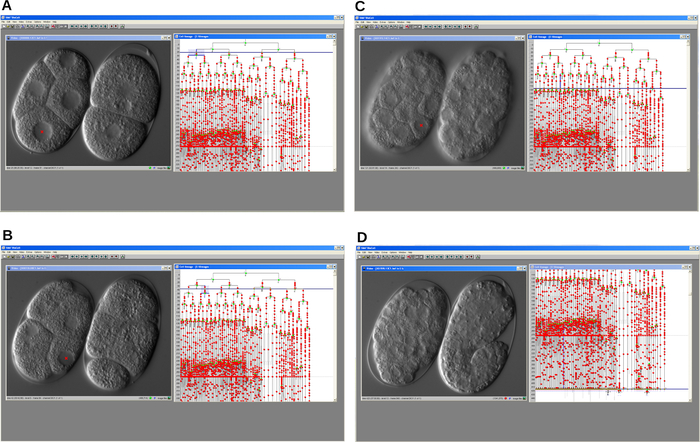
Рисунок 4: Последовательные снимки экрана программного обеспечения трассировки клеточной линии. Программа позволяет реконструировать эмбриональную клеточную линию мутанта задержки клеточного цикла (слева) и эмбриона WT (справа) C. elegans . A. Ранний этап развития. Б-С. Развитие обоих эмбрионов прогрессирует с течением времени. D. ЭМБРИОН WT развивается должным образом и начинает удлинение, в то время как мутант останавливается. Во всех случаях программа отображает окно видео и окно родословной. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
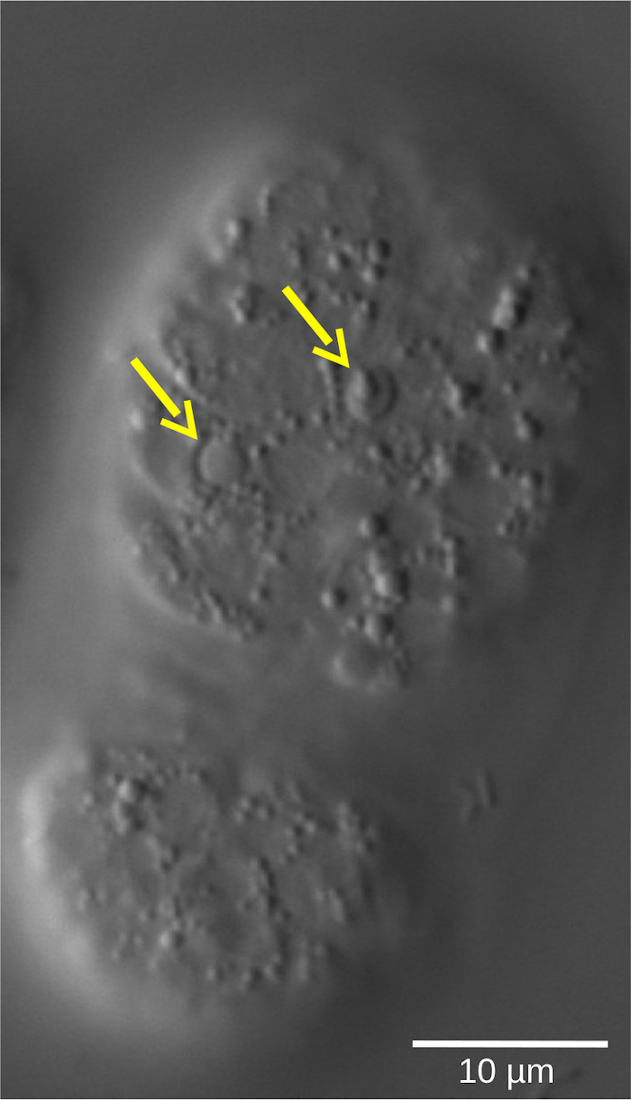
Рисунок 5: Чечевица рефракционная форма апоптотических клеток в эмбрионе C. elegans WT. Судьба клеток, определяемая морфологическими характеристиками, может быть оценена с помощью 4D-микроскопии. На снимке показан эмбрион C. elegans в стадии бобов. Живые клетки показывают гладковидные ядра, окруженные зернистой цитоплазмой. Напротив, апоптотические клетки (желтые стрелки) конденсируются и принимают чечевичную, рефракционную форму. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Одной из основных проблем в современной биологии является понимание развития многоклеточных организмов. C. elegans стал одной из наиболее подходящих моделей для изучения тонкой координации между пролиферацией клеток и дифференцировкой клеток у развивающегося эмбриона. С оптической точки зрения ее прозрачное тело и небольшие размеры делают эту нематоду идеальным образцом для ДВС-микроскопии. Другие организмы с аналогичными характеристиками также были подвергнуты 4D-микроскопическому анализу 11,12,13,14,15,16.
Для этих исследований развития инактивация гена либо прямой, либо обратной генетикой дает ключ к его участию в эмбриогенезе. После того, как было доказано, что ген играет роль в развитии, следующим шагом является определение его точной роли в создании правильного плана тела. Иммуноокрашивание является выбранным подходом для большинства моделей. Этот метод проясняет проблемы дифференцировки клеток или экспрессии специфических маркеров. Однако основным ограничением этого подхода является то, что он обеспечивает только статический вид выражения одного или нескольких маркеров в фиксированной точке разработки. Динамический вид этих маркеров на протяжении всего развития может быть получен только путем окрашивания различных эмбрионов в разные моменты времени. Кроме того, реконструкция клеточной линии невозможна в таких фиксированных образцах.
4D-микроскопия является дополнительным подходом к изучению эмбрионального развития. Этот метод выявляет динамику развития при разрешении на клеточном уровне. Любой дефект в эмбрионе, такой как проблемы с ориентацией веретена, миграция клеток, апоптоз, спецификация судьбы клеток и т. Д., Будет отображаться в 4D-фильме, который может быть визуализирован вперед и назад, количественно оценен и оценен исследователем. Используя эту технику, практически каждая клетка эмбриона может контролироваться до того момента, когда эмбрион начинает двигаться. Эмбрионы, подвергнутые 4D-микроскопии только видимым светом и оптикой Номарского, не страдают от фотоповреждений. Флуоресцентное сканирование также может быть интеркалировано в записи, чтобы определить, когда и где экспрессируется ген. Эмбрионы, которые страдают от значительных фотоповреждений, идентифицируются по расширению клеточного цикла, которое вызывает сильное ультрафиолетовое облучение по сравнению со стандартным эмбрионом линии WT. В этом случае фотоповреждения могут быть уменьшены путем снижения интенсивности ультрафиолетовой лампы и увеличения чувствительности камеры или времени экспозиции. Морфологические характеристики и молекулярные маркеры могут помочь прояснить эмбриональное развитие любого мутанта.
Создание системы 4D-микроскопии легко реализовать в лаборатории и, после некоторой практики, позволяет проводить непревзойденный анализ динамики клеток и отслеживание линий клеточных культур и живых прозрачных образцов на уровне разрешения каждой клетки в поле микроскопа. Трассировка клеточной линии на изображениях DIC по-прежнему обрабатывается вручную. Это отнимает много времени, и, хотя программное обеспечение обнаруживает ошибки родословной, такие как разные ветви линии, отмечающие одну и ту же клетку, возможны ошибки. В то время как автоматическое обнаружение клеток, меченых GFP, хорошо развито2, дополнительное программное обеспечение для отслеживания родословной, основанное на немаркированных клетках и изображениях видимого света, все еще находится на ранней стадии и не очень полезно для полного анализа эмбриона. Без сомнения, применение систем распознавания изображений в области микроскопии видимого света приведет к большому прогрессу в этой области.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы отметить поддержку со стороны Фонда Риохи Салуд (Fondos FEDER) и Испанского министерства по делам науки, инноваций и университетов (MCIU) (грант PGC2018-094276-B-I00). Кристина Ромеро Аранда финансируется стипендией AECC (Asociación Española Contra el Cáncer).
Материалы
| Name | Company | Catalog Number | Comments |
| Caenorhabditis elegans (N2) | GCG (Caenorhabditis Genetics Center) | N2 | WT C. elegans strain. Can be requested at GCG (Caenorhabditis Genetics Center): https://cgc.umn.edu/ |
| Caenorhabditis elegans (VZ454) | GCG (Caenorhabditis Genetics Center) | VZ454 | gsr-1(tm3574) C. elegans mutant strain. Can be requested at GCG (Caenorhabditis Genetics Center): https://cgc.umn.edu/ |
| Cell Lineage Tracing software | SIMI | Simi BioCell | This is the software to reconstruct the embryo cell lineage. For a detailed explanation check at: http://www.simi.com/en/products/cell-research/simi-biocell.html |
| Microscope camera | Hamamatsu | Orca-R2 | Miscroscope camera for both transmitted and UV light |
| Microscope control software | Caenotec | Time to Live | This software controls the microscope to perform the 4D image capture. Can be requested at: Caenotec Prof. Ralf Schnabel Kleine Dorfstr. 9 38312 Börßum, Germany, Ph: ++49 151 11653356 r.schnabel(at)tu-bs.de |
| Microscope control software | Micro-manager | Micro-manager | This software controls the microscope to perform the 4D image capture. Can be downloaded at: https://micro-manager.org/ |
| Motorized microscope | Leica | Leica DM6000 | Motorized upright microscope to perform 4D microscopy |
| Standard equipment in a Molecular Biology lab. | |||
| Stereomicroscope | Leica | MZ16FA | Steromicroscope to manipulate nematodes and prepare embryos. |
Ссылки
- Hardin, J. Imaging embryonic morphogenesis in C. elegans. Methods in Cell Biology. 106, 377-412 (2011).
- Mace, D. L., Weisdepp, P., Gevirtzman, L., Boyle, T., Waterston, R. H. A high-fidelity cell lineage tracing method for obtaining systematic spatiotemporal gene expression patterns in Caenorhabditis elegans. G3: Genes, Genomes, Genetics (Bethesda). 3 (5), 851-863 (2013).
- Nieto, C., et al. ccz-1 mediates the digestion of apoptotic corpses in C. elegans. Journal of Cell Science. 123 (12), 2001-2007 (2010).
- Cabello, J., et al. PDR-1/hParkin negatively regulates the phagocytosis of apoptotic cell corpses in Caenorhabditis elegans. Cell Death & Disease. 5, 1120 (2014).
- Pinto, S. M., Almendinger, J., Cabello, J., Hengartner, M. O. Loss of Acetylcholine Signaling Reduces Cell Clearance Deficiencies in Caenorhabditis elegans. PLOS One. 11 (2), 0149274 (2016).
- Sáenz-Narciso, B., Gómez-Orte, E., Zheleva, A., Gastaca, I., Cabello, J. Control of developmental networks by Rac/Rho small GTPases: How cytoskeletal changes during embryogenesis are orchestrated. Bioessays. 38 (12), 1246-1254 (2016).
- Zheleva, A. Reduction of mRNA export unmasks different tissue sensitivities to low mRNA levels during Caenorhabditis elegans development. PLOS Genetics. 15 (9), 1008338 (2019).
- Schnabel, R., Hutter, H., Moerman, D., Schnabel, H. Assessing normal embryogenesis in Caenorhabditis elegans using a 4D microscope: variability of development and regional specification. Developmental Biology. 184 (2), 234-265 (1997).
- Verbrugghe, K. J. C., Chan, R. C. Imaging C. elegans Embryos using an Epifluorescent Microscope and Open Source Software. Journal of Visualized Experiments. (49), e2625 (2011).
- Boyd, L., Hajjar, C., O'Connell, K. Time-lapse Microscopy of Early Embryogenesis in Caenorhabditis elegans. Journal of Visualized Experiments. (54), e2852 (2011).
- Urbach, R., Schnabel, R., Technau, G. M. The pattern of neuroblast formation, mitotic domains and proneural gene expression during early brain development in Drosophila. Development. 130 (16), 3589-3606 (2003).
- Dolinski, C., Borgonie, G., Schnabel, R., Baldwin, J. G. Buccal capsule development as a consideration for phylogenetic analysis of Rhabditida (Nemata). Development Genes and Evolution. 208 (9), 495-503 (1998).
- Houthoofd, W., Jacobsen, K., Mertens, C., Vangestel, S., Coomans, A., Borgonie, G. Embryonic cell lineage of the marine nematode Pellioditis marina. Developmental Biology. 258 (1), 57-69 (2003).
- Hejnol, A., Schnabel, R. The eutardigrade Thulinia stephaniae has an indeterminate development and the potential to regulate early blastomere ablations. Development. 132 (6), 1349-1361 (2005).
- Hejnol, A., Schnabel, R. What a couple of dimensions can do for you: Comparative developmental studies using 4D microscopy-examples from tardigrade development. Integrative and Comparative Biology. 46 (2), 151-161 (2006).
- Bischoff, M., Parfitt, D. E., Zernicka-Goetz, M. Formation of the embryonic-abembryonic axis of the mouse blastocyst: relationships between orientation of early cleavage divisions and pattern of symmetric/asymmetric divisions. Development. 135 (5), 953-962 (2008).
- Mora-Lorca, J. A. Glutathione reductase gsr-1 is an essential gene required for Caenorhabditis elegans early embryonic development. Free Radical Biology and Medicine. 96, 446-461 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены