Method Article
4D顕微鏡:ノマルスキ顕微鏡を用いた カエノラブディティス・エレガンス 胚発生の解明
要約
ここでは、 Caenorhabditis elegans胚を 調製および移植し、4D顕微鏡下での発生を記録し、細胞系譜を追跡するためのプロトコルを提示する。
要約
4D顕微鏡検査は、さまざまな動物の胚発生過程を解明するための非常に貴重なツールです。過去数十年にわたり、 Caenorhabditis elegansは 開発を研究するための最良のモデルの1つとして浮上してきました。光学的観点からは、そのサイズと透明な体は、この線虫をDIC(差動干渉コントラストまたはノマルスキー)顕微鏡検査のための理想的な試料にする。この記事では、 C. elegans 線虫の増殖、胚の調製と移植、4D 顕微鏡検査、細胞系譜トレースの実行を行うためのプロトコルを示します。この方法は、ノマルスキー画像の多焦点タイムラプス記録と特定のソフトウェアによる解析に基づいています。この技術は、細胞レベルでの胚発生ダイナミクスを明らかにする。紡錘体の配向、細胞遊走、アポトーシスまたは細胞運命仕様の問題など、突然変異体の胚性欠損は、効率的に検出およびスコアリングすることができる。胚の事実上すべての単一細胞は、胚が動き始める瞬間まで追跡することができる。4D DIC顕微鏡によるC. elegans 胚の完全な細胞系譜の追跡は手間がかかりますが、特定のソフトウェアを使用するとこの作業が大幅に容易になります。さらに、この手法はラボで簡単に実装できます。4D顕微鏡は汎用性の高いツールであり、胚発生の比類のない分析を実行する可能性を開きます。
概要
4D顕微鏡は多焦点タイムラプス記録システムであり、研究者は生体試料の細胞ダイナミクスを空間的および経時的に登録および定量化することができます。細胞培養物、酵母または生体組織を4D分析に供することができるが、この技術は、生きている胚の発生を分析するのに特に適しています。この分析の分解能は、胚のすべての単一細胞のレベルに達する。各細胞分裂を検出することができ、細胞の動きを経時的に追跡することができる。細胞の運命は、細胞が獲得する位置と形状に従って評価されます。Nomarski光学系の使用は、焦点面で干渉する直交偏光ビームを使用して、染色されていない透明なサンプルのコントラストを高めます。結果として得られる画像は、片側に照らされて3次元的に見えます。
核の自動検出および細胞系譜の生成のための共焦点顕微鏡法およびGFPトランスジェニック動物の使用に基づく他の方法が開発されている1、2。これらのシステムの利点は明らかです:ソフトウェアは、一定期間にわたって各核を手動でマーキングする必要性を大幅に上書きします(ただし、後期段階では手動監視が必要です)。しかし、細胞の分化、遊走、アポトーシス、または死体の巻き込みの間に起こるような、細胞形状または膜ダイナミクスの変化を伴う細胞プロセスは、蛍光標識された核画像において黒い背景として隠されたままである。
対照的に、4D Nomarski顕微鏡(DIC顕微鏡、微分干渉コントラスト顕微鏡とも呼ばれる)は、野生型または変異型の動物の発生中に起こる核および細胞形状の変化の両方を示す。これにより、透過光のみを使用する標準的な顕微鏡を用いた細胞系譜トレースが可能になる。特定の発現パターンを示すことを除いて、トランスジェニック動物を使用する一般的な必要性はなく、その場合、蛍光スキャンをインターカレートすることができる。したがって、これは、DIC顕微鏡3、4、5、6、7の下で強調することができる胚発生やアポトーシスなどの動的細胞プロセスに取り組む多くの研究室にとって最適なアプローチである可能性があります。
顕微鏡画像をキャプチャし、記録されたサンプル内の細胞系譜、3Dモデル、細胞遊走経路などを再構築するために、いくつかの柔軟でユーザーフレンドリーなプログラムが利用可能です。標準的な実験では、画像は一定の距離で一連の焦点面で取得され、その数はサンプルの厚さに依存する。解析の時間分解能は、スキャン頻度を上げることで最適化できます。コンピュータの記憶容量以外の記録期間に制限は事実上ありません。例えば、 C. elegansの 胚発生解析では、30秒ごとに12時間、30の焦点面(それぞれ1ミクロンステップ)で画像を日常的に取得します。
これらのシステムは、Caenorhabditis elegans8、9、10、Dショウジョウエメラノガスター11、他の線虫胚12、13、遅行性14、15、さらには初期マウス胚16などのいくつかの動物胚の分析に適用されている。唯一の要件は、顕微鏡下でスライド調製物上で発達することができる透明な胚を有することである。
要約すると、DICベースの4D顕微鏡は、1)小型で透明な動物の胚発生の解析(細胞系譜、細胞遊走経路の追跡、3Dモデルの生成など)に特に有用です。2)遺伝子発現パターンを定義する工程;3)酵母からヒト細胞までの細胞培養ダイナミクスの研究;4)組織ダイナミクスまたは胚断片を分析する工程;5)細胞死動態および死体巻き込みを定量化する工程;6)胚発生特性に基づく比較系統解析を行う工程。これらのトピック(または類似のトピック)のいずれかに興味がある場合は、4D顕微鏡を使用することができます。
プロトコル
1.ペトリ皿で C.エレガンス を育てる
- NGMプレートを用意し、大腸菌OP50を食物源として播種する(図1)。17に記載されているようにC.エレガンスを成長させ、維持する。播種したプレートを4°Cで最大1ヶ月間保管する。
- ワームを追加する前にプレートを所望の温度に調整する。
- ワームを移すには、古いプレートから寒天の塊を取り除き、それを新しいプレートに置きます。
- あるいは、滅菌ワームピッカー(パスツールピペットの先端に取り付けられた、平らな先端を持つ1インチの32ゲージプラチナワイヤー)で単一の動物を捕獲し、新しいプレートに置きます。
- 所望の温度でワームを育てる。
- C.エレガンスワームを標準温度である20°Cで成長させる。しかしながら、熱感受性変異体の発達を分析するには、通常25°Cで一晩インキュベーションを行う。 このインキュベーションの持続時間と温度は、必要に応じて、特定の変異体に応じて調整します。
2. 胚を装着する前に4D顕微鏡記録を準備する(図2)
- 胚を準備する前に顕微鏡と温度制御をセットアップします。 C.エレガンス 胚は非常に迅速に分裂する。胚を装着した直後に記録を開始する準備をしてください。
- 記録温度を15°C、20°C、または25°Cに調整します。
- 25°Cで胚を日常的に記録する。 温度感受性変異体を制限温度で記録し、その表現型を示す。WTコントロールを変異体と同じ温度で記録する(別の調製物で行われた場合)。
注:WT胚は、細胞系譜にさらなる違いを生じることなく、25°Cでより速く、15°Cで遅く発達する。温度管理された部屋に顕微鏡を置きます。スライドを冷却または加熱することによる追加の制御が非常に望ましい。これは、顕微鏡対物レンズおよび凝縮器の周りの金属リングを通して特定の温度の水を循環させることによって達成することができる。目的と調製物は浸漬油を介して直接接触し、温度移動は効率的である。このシステムは、記録温度の正確な制御を可能にし、胚発生中に温度シフトを実行することを可能にする。
- 25°Cで胚を日常的に記録する。 温度感受性変異体を制限温度で記録し、その表現型を示す。WTコントロールを変異体と同じ温度で記録する(別の調製物で行われた場合)。
- 顕微鏡ソフトウェアで記録パラメータを定義します。
- 標準的な C. elegans 記録(蛍光スキャンなし)の場合、以下を選択します。
それぞれ1ミクロンの距離にある30の焦点面のzスタック。
各 Z スタックの先頭間の 30 秒間隔。
1500 の Z スタック (12.5 時間のレコード)。
注:商用顕微鏡制御プログラムとオープンソース顕微鏡制御プログラムの両方を使用して、画像をキャプチャするためのこのワークフローを定義できます。これで顕微鏡は記録する準備ができました。
- 標準的な C. elegans 記録(蛍光スキャンなし)の場合、以下を選択します。
3.胚を準備してマウントする
- 薄い均質な寒天パッドを、素敵な画像を得るための最初のステップとして準備します(図3)。
- 脱イオン水中に4.5%寒天溶液50mlを調製する。電子レンジで沸騰するまで加熱し、0.5 - 1 mlを3 mlのガラス管に注ぎます。
- 乾燥を避けるために、チューブをワックスフィルムで慎重に密封してください。密封された寒天管は、室温で最大2ヶ月間保存することができる。
- ラボベンチに、80°Cのヒートブロックを取り付けます。
純粋なワセリン(溶融)の試験管で、内部に細かいペイントブラシが付いています。
パスツールピペットを含む蒸留水を含む試験管。
注:これにより、必要なすべての材料が高温になり、寒天がパッドを作る過程で固化しないことが保証されます。 - 寒天管の1つの上部からワックスフィルムを取り出し、アルコールバーナーで慎重に加熱して寒天を溶かします。ガラス管から排出された熱い寒天は火傷を引き起こす可能性があるため、注意してください。
- 寒天が溶けたら、チューブをヒートブロックに入れて寒天を液体の形に保ちます。
- あるいは、実験前のヒートブロック1hに寒天管を入れ、バーナーを用いずに溶かした。溶けた寒天は1日後に捨てるべきです。
- 顕微鏡スライド(スライドA)をプラスチック片の上に他の2つのスライドの間に置きます。
- 別のスライド (スライド B) を取り、片手で指で持ちます。
- 一方、温かいパスツールピペットを使用して、スライドAの中央に溶けた寒天の小さな滴を置きます。
- すぐにスライド B を寒天ドロップに押し付けて、スライド A とスライド B の間に非常に薄いパッドを作成します。手順 3.2.3 まで、これらのスライドを挟み込んだままにします。
- 胚をマウントします。
- ピッカーで5〜10個のグラビッド雌雄同体を集め、水で満たされた時計職人のガラスに入れます。
- メスを使用して雌雄同体線虫を切り開き、実体顕微鏡下で子宮から初期の卵(1〜4細胞)を抽出する。
- 手順 3.1.10 のスライドを取り出し、スライド B をそっとスライド オフにして、スライド A の寒天パッドを露出させます。
- 毛細管でピすることによって寒天パッドの中央に初期の卵を置く。
- あるいは、胚のセットを含む一滴を寒天パッド上にピペットで移し、次いで初期段階の胚を検索する。このステップを実体顕微鏡下で行います。
- 必要に応じて、爪楊枝の端に接着したまつげで卵を動かします。
- キャピラリーピペットで余分な水分を取り除きます。
注:キャピラリーピペットは、パスツールピペットをアルコールバーナーで加熱し、両端から引っ張ることで簡単に準備できます。 - 準備をカバースリップで慎重に覆ってください。気泡を避けるため、カバースリップの片方の端をスライドの上に置き、隣接する端に沿ってメスを静かにスライドさせて、カバースリップをゆっくりと斜めに準備の上にドレープします。
- ピペットを使用して、寒天パッドを囲む空間の3/4を水で満たします。空間の1/4を空気で残します。
- カバースリップをワセリンで密封し、長時間の録音中に乾燥しないようにします。
- 細かいブラシを使用して、カバースリップの端の周りに溶けたワセリンの薄い層を伸ばします。
注:これで録音の準備が整いました。
4. DICを調整し、4D顕微鏡記録を開始する
- スライドを顕微鏡ステージに置きます。低倍率対物レンズ(5倍または10倍)を使用して胚に焦点を合わせます。
- 100倍のイマージョン目標に変更します。
- 顕微鏡の光学部品を調整して、ノマルスキー画像を取得します。
- コンデンサーに焦点を合わせます。
- コンデンサーの絞りを完全に開き、フィールド絞りを閉じます(これにより、開口数が高くなり、分解能が向上します)。
- 顕微鏡上の両方の偏光子が、最大の光消光を引き起こすように配向していることを確認してください。
- ウォラストンプリズムを回して、片側に照らされた胚の素敵な3次元画像を取得します。プリズムを反対方向に回して、反対側に胚を照らす効果を得ます。
メモ: これらの手順は、分析対象の試料に微調整のみが必要なように、記録前に試験サンプルに対して実行できます。
- 顕微鏡で画像キャプチャを起動します。
5. 4Dムービーを分析します(図4)。
メモ: 記録が完了したら、細胞系譜トレースソフトウェアを使用して、細胞系譜を再構築および分析します。
細胞系譜トレースソフトウェアは、細胞培養物または組織断片における胚発生または動態の詳細な解析を実行するための強力なツールです。このプログラムは、細胞分裂、細胞周期長、遊走またはアポトーシス、およびその動態を含む、記録されたすべての細胞の完全な細胞系譜の生成を含む、サンプルの細胞ダイナミクスに関するいくつかのデータセットを抽出して定量化します。さらに、細胞分化は、細胞の形態学的変化または特定のマーカーの発現によってスコアリングすることができる。基本的に、ソフトウェア画面には2つのウィンドウが表示されます:左側のウィンドウでは、4Dムービーを前後に再生したり、トップレベルまたはボトムレベルまで上下に再生したりして、録画中に各セルを時間と空間で追跡することができます。右側の未亡人では、細胞系譜が生成されます。4Dムービーでセルの核をクリックすると、リネージュウィンドウにポイントが生成され、セル名、運命、空間座標の情報が表示されます。特定の細胞の細胞系譜は、4Dムービーを前方に再生し、核を定期的にクリックして、時間の経過とともにその特定の細胞の有糸分裂をマークすることによって生成されます。記録された細胞の各々についてこのプロセスを繰り返すと、胚または試料の完全な細胞系譜を生成する。各細胞の空間座標に関する保存された情報は、後で3D胚モデルおよび細胞遊走経路を再構築するために使用される。
- リネージュトレースソフトウェアを開き、上部のバーメニューに移動して選択して新しいプロジェクトを作成します。
ファイルの|新しいプロジェクト。 - 記録温度に応じて細胞系譜テンプレートを選択します:25°Cで記録するためのDB08、20°Cで記録するためのDB10、および15°Cで記録するためのDB12。
- 表示ウィンドウで記録パラメータを設定します:スキャン数(通常は1500)、スキャン間隔(30秒)、レベル数(30)、レベル間の距離(1ミクロン)。
- 画像ファイルと形式を選択します。
- イメージが保存されたイメージディレクトリを選択します。
- イメージを単一のイメージ (レベルと時間ごとに 1 つのイメージ) として保存するか、マルチイメージの Z スタックとして保存するかを選択します。
- ファイル名とイメージ形式を決定します。通常、単一のイメージは次の名前で保存されます。
X0000L00C1 (スキャン 0、レベル 0、チャネル 1 の場合)
X0000L01C1 (スキャン 0、レベル 1、チャネル 1 の場合)
X0000L02C1 (スキャン 0、レベル 2、チャネル 1 の場合)
...
X0001L00C1 (スキャン 1、レベル 0、チャネル 1 の場合)
X0001L01C1 (スキャン 1、レベル 1、チャネル 1 の場合)
...
X0300L04C1 (スキャン 300、レベル 4、チャネル 1 の場合)
...
メモ: 画像を圧縮形式で保存すると、ハードディスクの空き容量を節約できます。
- 光チャンネルを定義します:DIC光学用に1つ、GFP用に2つ、RFP用に3つなど。4Dレコーディングで使用されたものを追加します。「チャネル処理が有効」をクリックして検出します。
- 胚の細胞系譜の追跡を開始する。画面には、ビデオウィンドウと細胞系譜ウィンドウの2つの主要なウィンドウが含まれるようになりました。
- リネージュウィンドウで、リネージュ分岐を選択し、マウスを使用してビデオウィンドウ上のこのセルに対応するセル核をクリックします。
- カーソルキーを使用して、4Dムービーを前後、またはレベルを上下に再生して、セルを空間的かつ時間経過とともに追跡します。
- 定期的に細胞核をクリックします。これにより、リネージュ分岐に点が生成され、この時点でのセルの空間座標が登録されます。その結果、細胞系譜が進行し、胚の3D再構成が可能となる。
- リターンキーをクリックして有糸分裂をマークします。次に、娘セルの1つを選択し、以前と同じようにそれに従います。
- 残りの胚細胞についてこのプロセス(ステップ5.6.1~5.6.4)を繰り返して、完全な細胞系譜をトレースするか、アポトーシスを起こしている細胞などの関心のある特定の細胞を追跡します。
- 変異系譜をステレオタイプのWT C. elegans 細胞系譜と比較する。
結果
酵素グルタチオンレダクターゼをコードする酵素gsr-1のC. elegans変異体の胚発生を特徴付けるために、還元型グルタチオン(GSH)の再生に必要であり、線虫における酸化還元恒常性の維持に関与する、我々は、初期胚停止表現型18を引き起こす機能喪失対立遺伝子であるgsr-1(tm3574)欠失変異体の4D顕微鏡検査を行った。WTおよび平衡gsr−1(tm3574)変異体C.エレガンス線虫の両方を、食物源として大腸菌OP50を播種したNGMプレート上で増殖させた17。gsr-1(tm3574)ワームを20°Cでヘテロ接合型として2世代にわたって増殖させ、次いで分離ホモ接合型ワーム(母体負荷のおかげで成体まで成長することができる)を25°Cにシフトさせ、胚分析前に一晩インキュベーションした。ワームプレートは、結露を避けるために段ボール箱内でインキュベートしました(図1)。グラビッド線虫を切断して若い胚を抽出した。
同一条件下での変異体対ステレオタイプWTの胚発生を比較するために、WT(対照として)および gsr-1 (tm3574)胚を、同じ調製物上に隣り合って配置した。4D顕微鏡のワークフローは、DIC光学系を備えた標準的な電動直立顕微鏡で実行されました。顕微鏡制御プログラムで選択された記録パラメータは、それぞれ1ミクロンの距離にある30の焦点面のzスタック、各zスタックの開始と1500のzスタックとの間の30秒間隔(記録の12.5時間)であった。記録温度を25°Cに調整した(室内と顕微鏡ステージ上の両方)(図2)。
記録が完了すると、画像ファイルを開き、ビデオウィンドウに表示されている細胞核をクリックして、系統トレースソフトウェアを使用して細胞系譜を再構築しました(図4)。トレースされた gsr−1(tm3574) 変異胚性細胞系譜を、背景に描かれた C. elegans WT系統と比較した。主要な結果は、胚発生中の細胞周期の漸進的遅延の検出であった。その結果、変異胚は中間段階で停止し、WT胚は進行し、最終的に幼虫として孵化した。
顕微鏡下での胚の調製および直接観察、または後期胚マーカーに対する抗体による免疫染色は、WTと比較して変異体中の若い胚の高い割合の存在を明らかにする可能性がある。しかし、細胞周期遅延の直接的な証明と正確な定量化は、4D顕微鏡実験を通じてのみエレガントかつ容易に示し、定量化することができます。細胞分化やアポトーシス(図5)などの胚発生の他の重要な特徴も、1回の実験で発生の複数の側面を詳細に分析できる4D顕微鏡法を使用して、動的な方法で視覚化することができます。

図1:実験室条件下で増殖する C.エレガンス 線虫。線虫は 、大腸菌を播種したNGMプレート上で増殖させ、段ボール箱に保管し、15°C、20°C、または25°Cのいずれかでインキュベート します。この図の拡大版を表示するには、ここをクリックしてください。
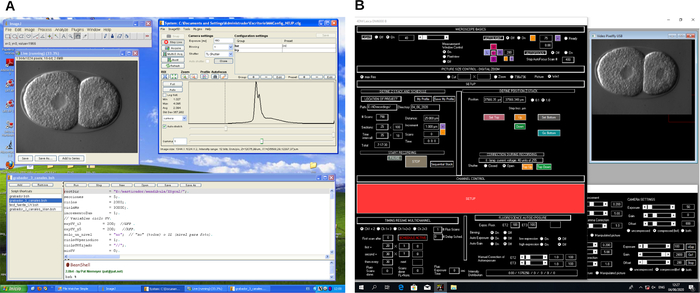
図2:4D顕微鏡記録ソフトウェアのスクリーンショット。 2つの異なる顕微鏡制御ソフトウェアプログラム(A および B)の例。これらのプログラムは、4D顕微鏡記録中に顕微鏡と画像キャプチャを制御するワークフローを作成します。 この図の拡大版を表示するには、ここをクリックしてください。

図3:寒天パッド調製および装着の C.elegans胚の 連続写真を示す。A. 寒天管を用意した。 紀元前 寒天パッドの調製。 D. 部分的に水で満たされたスライド。 E. スライドをワセリンで密封する。 F. 最終準備。 この図の拡大版を表示するには、ここをクリックしてください。
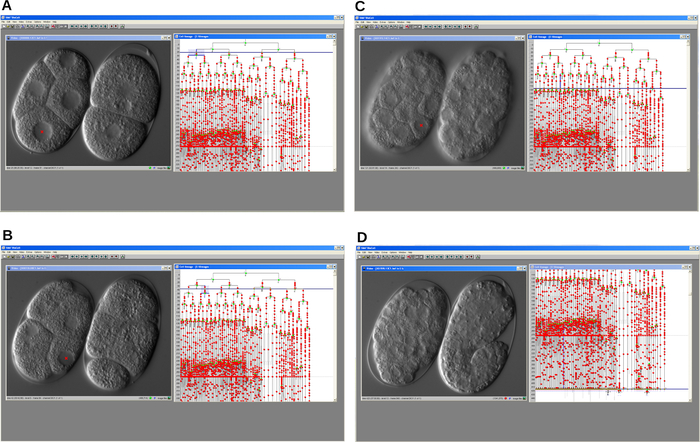
図4:細胞系譜トレーサーソフトウェアのシリアルスクリーンショット。 このプログラムは、細胞周期遅延変異体(左)およびWT(右) C.エレガンス胚の 胚性細胞系譜の再構築を可能にする。ある。開発の初期段階。紀元前両方の胚の発生は時間の経過とともに進行する。D. WT胚は適切に発達し、伸長を開始するが、変異体は停止する。いずれの場合も、プログラムはビデオウィンドウとリネージュウィンドウを表示します。 この図の拡大版を表示するには、ここをクリックしてください。
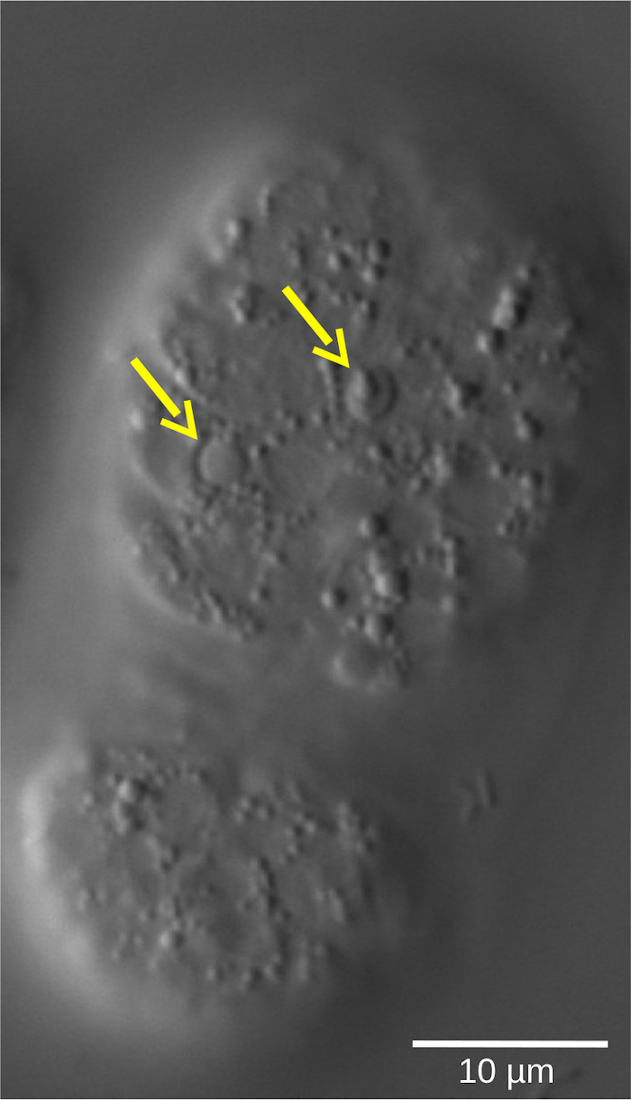
図5: C. elegans WT胚におけるアポトーシス細胞のレンズ豆屈折性形状。形態学的特徴によって定義される細胞の運命は、4D顕微鏡によって評価することができる。画像は、豆期の C.エレガンス 胚を示す。生細胞は、顆粒状の細胞質に囲まれた滑らかな形の核を示す。これに対して、アポトーシス細胞(黄色矢印)は凝縮し、レンズ豆状の屈折しやすい形状をとる。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
現代生物学における大きな課題の1つは、多細胞生物の発生を理解することです。C. elegansは、発生中の胚における細胞増殖と細胞分化との間の微細な協調を研究するための最も適したモデルの1つとして浮上している。光学的には、その透明な体と小さなサイズにより、この線虫はDIC顕微鏡検査に理想的な試料となっています。同様の特徴を有する他の生物も、4D顕微鏡分析11、12、13、14、15、16に供されている。
これらの発生学的研究にとって、順遺伝学または逆遺伝学のいずれかによる遺伝子不活性化は、胚発生への関与の手がかりを提供する。遺伝子が発達において役割を果たすことが証明されたら、次のステップは、正しいボディプランの確立におけるその正確な役割を定義することです。免疫染色は、ほとんどのモデルで選択されたアプローチです。この技術は、細胞分化または特異的マーカーの発現における問題を解明する。しかし、このアプローチの主な制限は、開発中の固定点における単一または複数のマーカーの発現の静的ビューのみを提供することである。発生中のこれらのマーカーの動的ビューは、異なる時点で異なる胚を染色することによってのみ得ることができる。加えて、このような固定試料では細胞系譜再構成は不可能である。
4D顕微鏡は、胚発生を研究するための補完的なアプローチです。この技術は、細胞レベルの分解能で発生ダイナミクスを明らかにする。紡錘体の向き、細胞移動、アポトーシス、細胞運命の仕様などの問題など、胚の欠陥は4Dムービーに現れ、研究者によって前後に視覚化され、定量化され、スコアリングされます。この技術を使用すると、胚のほぼすべての細胞を、胚が動き始める瞬間まで追跡することができます。可視光線とノマルスキー光学のみで4D顕微鏡検査を受けた胚は、光損傷を受けません。蛍光スキャンを記録内にインターカレートして、遺伝子がいつどこで発現するかを検出することもできます。著しい光損傷を受ける胚は、標準的なWT系統胚と比較して強いUV照射を引き起こす細胞周期延長によって同定される。その場合、UVランプの強度を下げ、カメラの感度や露光時間を増やすことで、光ダメージを低減することができます。形態学的特徴および分子マーカーは、任意の変異体の胚発生を明らかにするのに役立ち得る。
4D顕微鏡システムのセットアップはラボで簡単に実装でき、いくつかの練習の後、顕微鏡分野のあらゆる細胞の分解能レベルで、細胞培養物と生きた透明標本の細胞ダイナミクスと系統トレースの比類のない分析を可能にします。DIC画像上の細胞系譜トレースは、依然として手作業で処理されます。時間がかかり、同じセルに異なる系統枝をマーキングするなど系統誤差をソフトウェアで検出しますが、間違いはあります。GFP標識細胞の自動検出はよく開発されていますが2、マークされていない細胞と可視光画像に基づく相補的な系統追跡ソフトウェアはまだ初期段階にあり、完全な胚解析にはり役に立ちません。可視光顕微鏡の分野への画像認識システムの応用は、この分野に大きな進歩をもたらすことは間違いありません。
開示事項
著者らは開示するものは何もありません。
謝辞
著者らは、Rioja Salud Foundation(Fondos FEDER)とスペインのInnovación y Universidades (MCIU)のMinisterio de Ciencia(Grant PGC2018-094276-B-I00)からの支援に感謝したいと考えている。クリスティーナ・ロメロ・アランダはAECC(スペイン社会協会)のフェローシップから資金提供を受けています。
資料
| Name | Company | Catalog Number | Comments |
| Caenorhabditis elegans (N2) | GCG (Caenorhabditis Genetics Center) | N2 | WT C. elegans strain. Can be requested at GCG (Caenorhabditis Genetics Center): https://cgc.umn.edu/ |
| Caenorhabditis elegans (VZ454) | GCG (Caenorhabditis Genetics Center) | VZ454 | gsr-1(tm3574) C. elegans mutant strain. Can be requested at GCG (Caenorhabditis Genetics Center): https://cgc.umn.edu/ |
| Cell Lineage Tracing software | SIMI | Simi BioCell | This is the software to reconstruct the embryo cell lineage. For a detailed explanation check at: http://www.simi.com/en/products/cell-research/simi-biocell.html |
| Microscope camera | Hamamatsu | Orca-R2 | Miscroscope camera for both transmitted and UV light |
| Microscope control software | Caenotec | Time to Live | This software controls the microscope to perform the 4D image capture. Can be requested at: Caenotec Prof. Ralf Schnabel Kleine Dorfstr. 9 38312 Börßum, Germany, Ph: ++49 151 11653356 r.schnabel(at)tu-bs.de |
| Microscope control software | Micro-manager | Micro-manager | This software controls the microscope to perform the 4D image capture. Can be downloaded at: https://micro-manager.org/ |
| Motorized microscope | Leica | Leica DM6000 | Motorized upright microscope to perform 4D microscopy |
| Standard equipment in a Molecular Biology lab. | |||
| Stereomicroscope | Leica | MZ16FA | Steromicroscope to manipulate nematodes and prepare embryos. |
参考文献
- Hardin, J. Imaging embryonic morphogenesis in C. elegans. Methods in Cell Biology. 106, 377-412 (2011).
- Mace, D. L., Weisdepp, P., Gevirtzman, L., Boyle, T., Waterston, R. H. A high-fidelity cell lineage tracing method for obtaining systematic spatiotemporal gene expression patterns in Caenorhabditis elegans. G3: Genes, Genomes, Genetics (Bethesda). 3 (5), 851-863 (2013).
- Nieto, C., et al. ccz-1 mediates the digestion of apoptotic corpses in C. elegans. Journal of Cell Science. 123 (12), 2001-2007 (2010).
- Cabello, J., et al. PDR-1/hParkin negatively regulates the phagocytosis of apoptotic cell corpses in Caenorhabditis elegans. Cell Death & Disease. 5, 1120 (2014).
- Pinto, S. M., Almendinger, J., Cabello, J., Hengartner, M. O. Loss of Acetylcholine Signaling Reduces Cell Clearance Deficiencies in Caenorhabditis elegans. PLOS One. 11 (2), 0149274 (2016).
- Sáenz-Narciso, B., Gómez-Orte, E., Zheleva, A., Gastaca, I., Cabello, J. Control of developmental networks by Rac/Rho small GTPases: How cytoskeletal changes during embryogenesis are orchestrated. Bioessays. 38 (12), 1246-1254 (2016).
- Zheleva, A. Reduction of mRNA export unmasks different tissue sensitivities to low mRNA levels during Caenorhabditis elegans development. PLOS Genetics. 15 (9), 1008338 (2019).
- Schnabel, R., Hutter, H., Moerman, D., Schnabel, H. Assessing normal embryogenesis in Caenorhabditis elegans using a 4D microscope: variability of development and regional specification. Developmental Biology. 184 (2), 234-265 (1997).
- Verbrugghe, K. J. C., Chan, R. C. Imaging C. elegans Embryos using an Epifluorescent Microscope and Open Source Software. Journal of Visualized Experiments. (49), e2625 (2011).
- Boyd, L., Hajjar, C., O'Connell, K. Time-lapse Microscopy of Early Embryogenesis in Caenorhabditis elegans. Journal of Visualized Experiments. (54), e2852 (2011).
- Urbach, R., Schnabel, R., Technau, G. M. The pattern of neuroblast formation, mitotic domains and proneural gene expression during early brain development in Drosophila. Development. 130 (16), 3589-3606 (2003).
- Dolinski, C., Borgonie, G., Schnabel, R., Baldwin, J. G. Buccal capsule development as a consideration for phylogenetic analysis of Rhabditida (Nemata). Development Genes and Evolution. 208 (9), 495-503 (1998).
- Houthoofd, W., Jacobsen, K., Mertens, C., Vangestel, S., Coomans, A., Borgonie, G. Embryonic cell lineage of the marine nematode Pellioditis marina. Developmental Biology. 258 (1), 57-69 (2003).
- Hejnol, A., Schnabel, R. The eutardigrade Thulinia stephaniae has an indeterminate development and the potential to regulate early blastomere ablations. Development. 132 (6), 1349-1361 (2005).
- Hejnol, A., Schnabel, R. What a couple of dimensions can do for you: Comparative developmental studies using 4D microscopy-examples from tardigrade development. Integrative and Comparative Biology. 46 (2), 151-161 (2006).
- Bischoff, M., Parfitt, D. E., Zernicka-Goetz, M. Formation of the embryonic-abembryonic axis of the mouse blastocyst: relationships between orientation of early cleavage divisions and pattern of symmetric/asymmetric divisions. Development. 135 (5), 953-962 (2008).
- Mora-Lorca, J. A. Glutathione reductase gsr-1 is an essential gene required for Caenorhabditis elegans early embryonic development. Free Radical Biology and Medicine. 96, 446-461 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved