Method Article
التسجيل الكهربائي لمناطق القشرة الدماغية التي تم التلاعب بها باستخدام فيروس مرتبط بال أدينو يستهدف كوفلين في الفئران
In This Article
Summary
تصف هذه المقالة بروتوكولا للتلاعب بالأهداف الجزيئية في قشرة الدماغ باستخدام الفيروسات المرتبطة بال أدينو ورصد آثار هذا التلاعب أثناء اليقظة والنوم باستخدام التسجيلات الكهربائية.
Abstract
استخدام التسجيلات الكهربائية القشرية (ECoG) في القوارض ذات الصلة لأبحاث النوم ودراسة مجموعة واسعة من الحالات العصبية. تستخدم الفيروسات المرتبطة بال أدينو (AAVs) بشكل متزايد لتحسين فهم دوائر الدماغ ووظائفها. كان التلاعب بوساطة AAV لخلايا محددة و / أو المكونات الجزيئية الدقيقة مفيدا للغاية لتحديد الدوائر التنظيمية للنوم الجديدة / الجزيئات والبروتينات الرئيسية التي تساهم في الآثار السلبية لفقدان النوم. على سبيل المثال، يمنع تثبيط نشاط الكوفلين البروتيني الخيطي الذي يقطع أكتين باستخدام AAV ضعف الذاكرة الناجم عن الحرمان من النوم. هنا، يتم وصف بروتوكول يجمع بين التلاعب في وظيفة كوفلين في منطقة قشرة الدماغ مع تسجيل نشاط ECoG لدراسة ما إذا كان الكفيلين القشري يعدل إشارات ECoG اليقظة والنوم. يتم إجراء حقن AAV خلال نفس العملية الجراحية مثل زرع أقطاب ECoG والكهربائية (EMG) في الفئران البالغة من الذكور والإناث. الفئران مخدرة ورؤوسها حليقة بعد تنظيف الجلد وشق، يتم تحديد إحداثيات ستيريوتاكسيك من القشرة الحركية، ويتم ثقب الجمجمة في هذا الموقع. يتم وضع قنية مملوءة مسبقا مع AAV التعبير عن كوفلينS3D، وهو شكل غير نشط من كوفلين ، ببطء في الأنسجة القشرية. بعد ضخ AAV ، يتم تثبيت البراغي المغطاة بالذهب (أقطاب ECoG) من خلال الجمجمة وترسيخها في الجمجمة مع إدخال أسلاك ذهبية في عضلات الرقبة (أقطاب EMG). يسمح للحيوانات ثلاثة أسابيع للتعافي وضمان التعبير الكافي عن cofilinS3D. يتم التحقق من المنطقة المصابة ونوع الخلية باستخدام الكيمياء المناعية ، ويتم تحليل ECoG باستخدام التحديد البصري لولايات اليقظة والتحليل الطيفي. وباختصار، فإن هذا النهج المنهجي المشترك يسمح بالتحقيق في المساهمة الدقيقة للمكونات الجزيئية التي تنظم مورفولوجيا الخلايا العصبية والاتصال بتنظيم نشاط قشرة الدماغ المتزامنة أثناء اليقظة والنوم.
Introduction
تستخدم تسجيلات تخطيط الدماغ الكهربائي (أو الكهربائي الكهربائي عموما [ECoG] في القوارض) والتسجيلات الكهربية (EMG) على نطاق واسع في أبحاث النوم وكذلك على نطاق أوسع في علم الأعصاب والأعصاب والطب النفسي. في تركيبة, هذه الإشارات الكهربية تسمح لتحديد الدول اليقظة والتحديد الكمي اللاحقة لمدة الدولة وتكوين الطيفية, على حد سواء في البشر والقوارض1,2,3,4. وقد كان هذا القياس الكمي مفيدا لفهم كيفية تعديل النوم في الحالات المرضية مثل الأمراض العصبية والنماذج5و6و7 أو عن طريق التعديل الوراثي8و9. على سبيل المثال، تبين أن خروج المغلوب (KO) من الجينات المختلفة المرتبطة بالاتصالات العصبية لتغيير مدة اليقظة والنوم في كل من الماوس والفاكهة يطير10،11،12،13. لمعالجة التعويض التنموي المحتمل الناشئ عن دراسة KO كامل الجسم في القوارض والسماح للسيطرة الدقيقة على التلاعب الجيني ، فإن الطريقة الفعالة للتلاعب بالتعبير الجيني هي استخدام الفيروسات المرتبطة بال أدينو (AAVs). ويمكن استخدام التلاعب الجيني AAV بوساطة إلى أسفل أو upregulate هدف جزيئي معين وتقييد التلاعب إلى مجموعة خلايا محددة باستخدام أنواع مختلفة من المروجين14. AAVs تستخدم أيضا على نطاق واسع كوسيلة التسليم في تتجمع بانتظام بين متباعدة يكرر palindromic قصيرة (CRISPR) / Cas9 التكنولوجيا15،16. وتسمح هذه المنهجيات بتحسين التحكم الزمني والمكاني في التلاعب الجيني، الذي يرتبط عموما بتعبير المراسل الذي يسمح بالقياز الكمي للمنطقة المصابة باستخدام الفلورة المناعية.
AAVs تمثل أيضا الناقل الرئيسي للتلاعب نوع الخلية الخاصة من نشاط الخلايا العصبية عن طريق علم الوراثة البصرية وchemogenetics17,18,19, التي استخدمت على نطاق واسع في البحوث الحديثة على الأمراض العصبية, سلوك, الإدراك, والنوم20,21,22. في أبحاث النوم ، كان تطبيق علم الوراثة البصرية لتنشيط أو تثبيط مناطق معينة من الدماغ ، مثل الدماغ الأمامي القاعدي ، وتحت المهاد ، وtegmentum تحت الأضلاع ، مفيدا لتحديد أدوارهم في التحكم في الإثارة ، والنوم البطيء الموجة (المعروف أيضا باسم النوم غير السريع لحركة العين) ، والنوم (أو النوم السريع لحركة العين) ، والكاتابلكسي23، 24،25. وعلاوة على ذلك، ساعدت التلاعبات بوساطة AAV في توضيح الدوائر التنظيمية الهامة للنوم والجزيئات التي تساهم في الآثار السلبية لفقدان النوم26و27و28. على سبيل المثال، بروتين واحد تبين أن متورطة في ضعف الذاكرة الناجم عن الحرمان من النوم هو كوفلين29،30. هذا البروتين هو بروتين قطع أكتين خيوط التي تشارك في إعادة تنظيم خيوط أكتين عن طريق ملزمة جسديا إلى أكتين وتعزيز تفكيك خيوط بطريقة ديناميكية31. تثبيط نشاط كوفلين باستخدام نهج AAV بوساطة ثبت لمنع فقدان العمود الفقري، فضلا عن اللدونة متشابك والعجز في الذاكرة الناجمة عن الحرمان من النوم في الفئران29. بشكل جماعي ، تؤكد هذه الدراسات على فائدة وأهمية التلاعب بوساطة AAV لفهم تنظيم النوم وعواقب الحرمان من النوم في القوارض.
هنا ، يتم وصف بروتوكول يجمع بين زرع قطب ECoG و EMG والتسجيل مع التلاعب بوظيفة الكفيلين في منطقة قشرة الدماغ من الفئران البرية (WT) باستخدام AAV. وبشكل أكثر دقة، يتم حقن AAV (النمط المصلي 9) الذي يعبر عن تسلسل الترميز لشكل فوسفوميميتيك من كوفلين الماوس (cofilinS3D)،مما يجعله غير نشط32،33، في قشرة المحرك (M1 و M2). يتم زرع قطب ECoG مباشرة في موقع الحقن لضمان تسجيل النشاط القشري المتزامن للخلايا المصابة. يتم إجراء تسجيل ECoG / EMG لمدة 24 ساعة في ظل ظروف غير مضطربة بعد ثلاثة أسابيع من الجراحة للسماح بالتعافي والتكيف والتعبير العالي عن cofilinS3D. ثم يستخدم التسجيل لتحديد حالات اليقظة والتحليل الطيفي ECoG ، كما هو موضح في الدراسات السابقة11،34. يمكن أن تكشف هذه المنهجية على وجه التحديد كيف يعدل الكفيل القشري اليقظة وإشارات ECoG أثناء النوم في الفئران. هذا المزيج من التسجيلات الكهربية والتلاعب الجيني بوساطة AAV وثيق الصلة بشكل خاص للتحقيق في أدوار العناصر الجزيئية المختلفة في وظائف الدماغ المحددة ويمكن تطبيقه على منطقة الدماغ القشرية (وشبه القشرية) ذات الاهتمام في WT والفئران المعدلة وراثيا من كلا الجنسين وحتى الأنواع الأخرى.
Protocol
وقد وافقت لجنة رعاية الحيوان على جميع الأساليب، وهي تتفق مع المبادئ التوجيهية للمجلس الكندي لرعاية الحيوان. راجع جدول المواد للكواشف والمعدات والمواد المستخدمة في هذا البروتوكول.
1. إعداد الجراحة
- إعداد أقطاب ECoG و EMG
- لكل حيوان، وإعداد ثلاثة أقطاب ECoG: باستخدام الحديد لحام، ووضع قطرة صغيرة من لحام خالية من الرصاص على غطاء المسمار من المسمار المغطى بالذهب، ولحام 4 مم طويلة، 0.2 مم قطرها سلك ذهبي (غير معزول) على الجزء العلوي من الغطاء المسمار باستخدام لحام خالية من الرصاص(الشكل 1A). إعداد أقطاب 2 مع السلك الذهب على التوالي، واحد مع زاوية 45 درجة من العمودي.
- لكل حيوان، وإعداد اثنين من الأقطاب EMG: قطع واحد 0.2 مم قطرها سلك الذهب إلى طول 1.5 سم والثانية واحدة إلى 2 سم. منحنى كلا الأسلاك لهذه لاحتضان منحنى الجمجمة تصل إلى عضلات الرقبة، والحفاظ على نهاية مستقيمة التي سيتم لحام إلى الموصل(الشكل 1B).
- لكل حيوان، قم بإعداد موصل واحد: استخدم موصلا من 6 قنوات (5 مم × 8 مم × 8 مم + دبابيس معدنية 3 مم)، وأضف لحاما خاليا من الرصاص إلى 5 من دبابيس المعدن ال 6 (مع حذف دبوس وسط واحد؛ الشكل 1C). قم بتغطية الجزء العلوي من الموصل بشريط لتجنب تسرب القمامة أو المياه.
- إعداد AAVs ومضخة حقنة
- إعداد اختبار AAV (هنا، AAV9-CaMKIIα0.4-cofilinS3D-HA) و / أو AAV التحكم (هنا، AAV9-CaMKIIα0.4-eGFP) عن طريق تمييع الأسهم AAV مزيج (es) (هنا، AAVs في محلول من المالحة العازلة الفوسفات التي تحتوي على السطحي غير الأيونية [0.001٪]) مع المالحة المعقمة للحصول على التيتر الفيروسي المطلوب (عموما 1012-13 نسخ الجينوم [GC]/mL) والحجم المطلوب لعدد الفئران المراد علاجها.
ملاحظة: يتطلب الحجم المحقون 1 ميكرولتر لكل منطقة قشرية لكل فأر إعداد 2 ميكرولتر. - إصلاح حقنة واحدة 10 ميكرولتر إلى مضخة حقنة وملئه بالماء المقطر.
- ملء أنبوب PE50 واحد من طول 60 سم تقريبا مع الماء المقطر باستخدام حقنة 1 مل وإبرة 21 G. الأهم من ذلك، ترك إبرة 21G والمحاقن في مكان بعد ملء. توصيل أنبوب PE50 مع مضخة حقنة; اترك الإبرة/الحقنة 21 G على طرف واحد من أنبوب PE50، وربط الطرف الآخر بحقنة 10 ميكرولتر.
- بمجرد تثبيت الأنبوب على حقنة 10 ميكرولتر ، قم بإزالة الإبرة في الطرف الآخر ، ودفع المكبس من حقنة 10 ميكرولتر لملء الفجوة التي خلفتها الإبرة بالماء.
ملاحظة: تأكد من عدم وجود فقاعة الهواء، وأن الأنبوب مليء تماما بالماء. - تثبيت قنية 28 G في نهاية الأنبوب حيث تمت إزالة الإبرة. دفع الماء في القنية مع حقنة 10 ميكرولتر لملء تماما. إصلاح القنية بإحكام إلى الذراع ستيريوتاكسيك.
- إعداد اختبار AAV (هنا، AAV9-CaMKIIα0.4-cofilinS3D-HA) و / أو AAV التحكم (هنا، AAV9-CaMKIIα0.4-eGFP) عن طريق تمييع الأسهم AAV مزيج (es) (هنا، AAVs في محلول من المالحة العازلة الفوسفات التي تحتوي على السطحي غير الأيونية [0.001٪]) مع المالحة المعقمة للحصول على التيتر الفيروسي المطلوب (عموما 1012-13 نسخ الجينوم [GC]/mL) والحجم المطلوب لعدد الفئران المراد علاجها.
- إعداد الحيوانات
ملاحظة: C57BL6/J الفئران الذكور والإناث من ~ 12 أسابيع من العمر كانت مكيفة سابقا لمدة 2 أسابيع على الأقل للسكن في أقفاص فردية وضوء 12 ساعة: 12 ساعة دورة مظلمة مع الغذاء والماء libitum الإعلانية والوصول إلى مكعب خشبي.- وزن الفئران بعناية، وحقن intraperitoneally مزيج من الكيتامين / xylazine (120/10 ملغ / كغ) للتخدير. انتظر حوالي 10 دقائق للتخدير العميق.
- حلق الشعر من الجزء الخلفي من الأذنين إلى الجزء الأمامي من الرأس بين العينين باستخدام أداة تشذيب الشعر.
ملاحظة: كن حذرا جدا عدم قطع شعيرات (حماية شعيرات بإصبع أثناء الحلاقة) كما سوف شعيرات التشذيب تعديل المدخلات الحسية والنشاط ECoG35،36. - أضف قطرة سخية من مرهم العيون على كل عين لمنع الجفاف. تحقق من عمق التخدير بانتظام أثناء العملية عن طريق قرص إصبع القدم من مخلب الخلفي. تزويد الماوس مع 0.5-1.5٪ isoflurane لضمان التخدير العميق إذا ظهر رد فعل قرصة إصبع القدم.
2. حقن AAV intracortical مع مضخة حقنة
ملاحظة: تنفيذ كافة الخطوات التالية باستخدام أدوات معقمة وفي بيئة نظيفة. استخدم الإيثانول بنسبة 70٪ لغسل الأدوات المعقمة وغسل الأقطاب الكهربائية المعدة في القسم 1.1 وكذلك مسامير المرساة (مسامير غير مغطاة بالذهب) قبل بدء الجراحة.
- إصلاح بعناية رأس الماوس على جهاز ستيريوتاكسيك مع قضبان الأذن.
ملاحظة: تأكد من الرأس لا تتحرك أفقيا. - سحب بلطف لسان الحيوان من الفم لتجنب الاختناق، وإصلاح أنف الماوس مع محول ستيريوتاكسيك.
ملاحظة: مراقبة التنفس بشكل متكرر أثناء العملية. - تعقيم منطقة حلق الرأس مع الإيثانول 70٪ وعقد الجلد مع ملقط Graefe غرامة اضافية، وقطع الجلد من قاعدة الأذنين إلى مستوى العينين مع مقص الأنسجة. استخدم أربعة مشابك جراحية لتمديد الجلد وفضح الجمجمة (اثنان على كل جانب من الشق؛ انظر الشكل 1D).
- خدش سطح الجمجمة مع طرف مقص حاد: مع تجنب الغرز العظام، وإزالة periosteum وخلق خطوط متداخلة في اتجاهين أو أكثر. إزالة شظايا العظام، وتجفيف الجمجمة مع الإيثانول 70٪.
ملاحظة: الخدش وs streaking سوف تساعد على جعل المونتاج تسجيل أكثر قوة من خلال تحسين الالتزام الاسمنت إلى الجمجمة (انظر أدناه). - مع قنية ثابتة على الذراع ستيريوتاكسيك، وتحديد موقع bregma (أي، التقاطع بين الجمجمة التاجية والغرز القوسي؛ الشكل 1D) وlamda (أي، التقاطع بين خياطة القوس الجمجمة وخط مستقيم يربط خياطة لامدويد اليسار واليمين؛ الشكل 1D)، ونلاحظ إحداثيات ستيريوتاكسيك لكل منهما. إذا كان الفرق بين إحداثيات z (المحور العمودي) للبريغما و لامدا أكبر من 0.3 مم، قم بضبط ارتفاع الأنف باستخدام المحول الاستريوتاكسيكي حتى يتم محاذاة موضع z من البريغما واللامدا.
- وضع علامة على موضع القنية على الجمجمة بقلم في هذه الإحداثيات (القشرة الحركية): 1.5 مم من اليمين الجانبي إلى خط الوسط و1.5 مم أمامي إلى البريغما. ثقب الجمجمة بعناية في موضع القنية مع بت حفر 0.7 ملم في اتجاه عمودي على سطح الجمجمة (محاذاة مع المحور الرأسي). غسل الجمجمة المثقوبة مع طرف القطن المعقمة مشربة مع محلول 10٪ بروفيدون اليود.
- تحميل القنية مع فقاعة الهواء 1 ميكرولتر عن طريق سحب المكبس حقنة 10 ميكرولتر مرة أخرى من قبل 1 ميكرولتر. تحميل اختبار AAV (هنا AAV9-CaMKIIα0.4-CofilinS3D-HA) أو AAV التحكم (هنا AAV9-CaMKIIα0.4-eGFP) في القنية التي تم تحميلها سابقا مع فقاعة الهواء: خلط AAV عن طريق الأنابيب ببطء صعودا وهبوطا، pipet 1.7 μL على طبق بيتري معقمة، و أسبيرات 1.5 ميكرولتر من الحل في القنية عن طريق سحب ببطء المكبس من حقنة 10 ميكرولتر. وضع علامة على موقف فقاعة الهواء على أنبوب PE50 للسماح لتتبع الحقن.
- محاذاة القنية مع ثقب على الجمجمة لوضع عمودي من القنية للوصول إلى الحافة العليا من الجمجمة (أي سطح الجمجمة). من سطح الجمجمة، خفض ببطء القنية بنسبة 1.5 ملم (لتصل إلى 1.5 ملم تحت سطح الجمجمة وطبقة الخامس من قشرة المحرك).
ملاحظة: كن حذرا جدا لعدم خفض القنية كثيرا لتجنب آفة لا لزوم لها من أنسجة الدماغ. - بدء ضخ حقنة لحقن 1 ميكرولتر من AAV على مدى 40 دقيقة (السرعة: 0.025 ميكرولتر / دقيقة للحد من تلف الأنسجة). تتبع الحقن على أنبوب PE50 مع حركة فقاعة الهواء، وإجراء تعديلات إذا لزم الأمر.
- بعد الانتهاء من الحقن، اترك القنية في مكانها لمدة 5 دقائق لضمان الانتشار الكافي وتجنب التدفق الخلفي. ثم، ببطء وبعناية رفع الذراع ستيريوتاكسيك لإزالة القنية من القشرة.
3. ECoG / EMG زرع القطب
- باستخدام ملقط كيلي على التوالي، المسمار ببطء قطب ECoG واحد (مع الأسلاك الذهبية على التوالي) في المحور الرأسي (نفس الزاوية التي تم ثقب الثقب) في الحفرة حيث تم حقن AAV. ترك ما لا يقل عن 2.5 ملم من المسمار من الجمجمة لتقليل الأضرار التي لحقت دورا والقشرة الدماغية (أي، لعمق تقريبي من 1.1 ملم من سطح الجمجمة؛ الشكل 1D).
- وضع علامة على موقف القطب ECoG الخلفي والقطب المرجعي على الجمجمة مع قلم في هذه الإحداثيات: القطب الخلفي (القشرة البصرية) 1.5 ملم الحق الجانبي إلى خط الوسط و 1.5 ملم الأمامية إلى لامبدا، القطب المرجعي (القشرة الحسية سوماتوسوري) 2.6 ملم الحق الجانبي إلى خط الوسط و 0.7 ملم الخلفي إلى bregma. أيضا، بمناسبة موقف ثلاثة مسامير الصيانة (بوصفها المراسي بين الجمجمة وأسمنت الأسنان لترسيخ المونتاج الرأس) على نصف الكرة الأيسر مع عدم وجود إحداثيات محددة، ولكن بعيدة قدر الإمكان عن بعضها البعض ومن أقطاب ECoG.
- ثقب بعناية الجمجمة في وضع ملحوظ من الأقطاب الكهربائية الأخرى ومسامير مرساة مع بت الحفر 0.7 ملم. بيرس في اتجاه عمودي على سطح الجمجمة لكل المسمار (أي المحور العمودي للقطب الخلفي ولكن مع زاوية من المحور الرأسي لمواقع أخرى). غسل الجمجمة مثقوبة مع محلول 10٪ بروفيدون اليود، ومنع الثقوب مع قطع صغيرة، تدحرجت من ماسحات مهمة حساسة قبل تثبيت مسامير لمنع النزيف والتلوث.
- باستخدام ملقط كيلي على التوالي، المسمار مسامير الصيانة في نصف الكرة الأيسر ومن ثم المسمار القطبين الماضيين في نصف الكرة الأيمن. تأكد من المسمار مع نفس الزاوية التي كانت مثقوبة ثقوب وترك ما لا يقل عن 2.5 ملم من كل المسمار من الجمجمة (الشكل 1D).
ملاحظة: لتحقيق أقصى قدر من صلابة المونتاج النهائي وجودة الإشارات الكهربية، يجب الحرص على عدم لمس أي المسمار عند تثبيت واحد المقبل. - ضع بضع قطرات صغيرة من أسمنت الأسنان في وسط الفضاء مثل حلقة داخل مسامير. أدخل الطرف المنحني لقطب EMG واحد (تم إعداده في الخطوة 1.1.2) حوالي 1-2 مم في عضلات الرقبة عن طريق الإمساك بالطرف المنحني باستخدام ملقط #5 Dumont ورفع الجلد فوق العضلات باستخدام ملقط Graefe فائق الغرامة. ثم ضع الجانب المنحني ومرفق القطب الكهربائي في أسمنت الأسنان. كرر لEMG القطب الثاني.
ملاحظة: يجب محاذاة الطرف المستقيم لقطب EMG الأطول مع قطب ECoG الأمامي وقطب EMG الأقصر مع قطب ECoG الخلفي. تأكد من أن قطبي EMG لا يلمسان بعضهما البعض أو أي من البراغي. - تغطية عيون الفئران، وتطبيق الضوء لمدة 3-5 دقائق للمساعدة في ترسيخ التماسك. بمجرد أن تتماسك أقطاب EMG بقوة ، قم بتغطية قاعدة أقطاب ECoG وقاعدة مسامير المرساة مع أسمنت الأسنان لتشكيل كفاف على شكل تاج. تغطية عيون الفئران، وتطبيق الضوء لمدة 3-5 دقائق للمساعدة في ترسيخ التماسك.
ملاحظة: لا تطبق الأسمنت على أطراف القطب ECoG و EMG (سلك ذهبي سيتم لحامه على الموصل) أو على الجلد. - ملء وسط المونتاج مع الاسمنت الاكريليك مختلطة سابقا. أثناء التصلب الاسمنتي، قم بإزالة المشابك الجراحية الأربعة التي تحمل الجلد (واغسلها فورا بماسحات مهمة حساسة).
ملاحظة: لا تطبق الأسمنت على أطراف القطب ECoG و EMG (سلك ذهبي سيتم لحامه على الموصل) أو على الجلد. - خياطة الجلد في الجزء الخلفي والجبهة من المونتاج بحيث لا تتعرض الجمجمة (ولكن تجنب تمتد الجلد كثيرا) باستخدام إبرة خياطة (13 ملم 3/8 ج) وmonofilament القابلة للامتصاص الاصطناعية.
- عقد موصل فوق المونتاج مع ملقط منحني، ومحاذاة بعناية السلك الذهبي من الأقطاب الكهربائية مع دبابيس موصل. الأطراف القطب لحام لدبابيس موصل مع الحديد لحام.
ملاحظة: المضي قدما بسرعة لتجنب ارتفاع درجة الحرارة والضرر الذي لحق الأنسجة القشرية. تأكد من أن كل قطب كهربائي يقوم باتصال جيد مع دبوس الموصل المقابل، وأن الأقطاب الكهربائية غير متصلة ببعضها البعض. - إزالة الماوس من الإطار ستيريوتاكسيك. قم بتغطية المساحة الفارغة بين الموصل والرأس باستخدام الاسمنت الأكريليك المختلط سابقا من خلال تغطية جميع الاتصالات بين الأقطاب الكهربائية ودبابيس الموصل.
ملاحظة: تجنب تسرب الاسمنت داخل الموصل عن طريق الضغط على الماوس مع الموصل فوق الرأس (الرأس مستقيم لا يميل). - وزن الماوس ووضعه في قفص نظيف (ويفضل أن تكون مجهزة غطاء غير متشابكة) على لوحة الحرارة (السكن الفردية لتجنب الأضرار التي لحقت المونتاج الرأس). مراقبة الحيوان بانتظام، وإدارة 0.1 ملغم/كغ من البوبرينورفين تحت الجلد عند الصحوة، و 12 ساعة في وقت لاحق إذا كان الحيوان يظهر علامات الألم (على سبيل المثال، موقف غير طبيعي، عيون حولت).
ملاحظة: يجب ألا تتجاوز زيادة الوزن بالنسبة لوزن ما قبل الجراحة 1.5 غرام.
4. التسجيلات
- فئران المنزل بشكل فردي لتجنب الأضرار التي لحقت رئيس المونتاج نتيجة للاستمالة المتبادلة، فضلا عن الضرر والتشابك من الكابلات تسجيل.
ملاحظة: لهذا البروتوكول، تم إيواء الفئران مع إمكانية الوصول إلى الغذاء والماء ومكعب خشبي، وأجريت المراقبة اليومية. - ربط الفئران لتسجيل الكابلات 2 أسابيع بعد الجراحة للتكيف مع ظروف الكابلات.
- تسجيل إشارات ECoG/EMG لمدة 24 ساعة (أو أطول / أقصر اعتمادا على أسئلة البحث).
ملاحظة: تم إنجاز تسجيل إشارة ECoG/EMG باستخدام كابل وموصل دوار (للسماح بتدوير الكابل) وصندوق قابل للارتداء من 36 قناة ومكبر للصوت تم توصيله بجهاز كمبيوتر. يتم أخذ عينات من الإشارات عند 256 هرتز (أو أكثر اعتمادا على أسئلة البحث) ويتم تسجيلها باستخدام برامج تجارية (انظر جدول المواد). لضمان التعبير الفيروسي الكافي ، يجب إجراء التجارب بعد 3 أسابيع على الأقل من حقن AAV ، كما هو موضح سابقا29،37. - بعد التسجيل، التضحية بالفئران عن طريق خلع عنق الرحم (أو طرق أخرى اعتمادا على بروتوكول المناعة)، وحصاد الدماغ لتثبيط المناعة.
النتائج
بعد التسجيلات الكهربية، يتم استخدام immunofluorescence لتحديد المنطقة المصابة بالحقن AAV والتحقق من صحة التعبير عنcofilin S3D (الشكل 2). يمكن إجراء التخسين المناعي باستخدام منهجية مشابهة لما تم وصفه سابقا29،37،38،39. AAV يعبر عن شكل غير نشط من كوفلين تنصهر مع hemagglutinin (HA) - الوسم (cofilinS3D-HA) ، والتي يتم الكشف عنها عن طريق immunofluorescence باستخدام الأجسام المضادة لها وأجسام مضادة ثانوية (اليكسا فلور 488). الخلايا العصبية المثيرة المصابة (هنا، المستهدفة بالبروتين المعتمد على الكالسيوم / كالمودولين كيناز الثاني ألفا [CamKIIα] المروج السيطرة على التعبير عن المتحولين الواردة في AAV) ملطخة بالأجسام المضادة ل HA. ويشار إلى عدوى ناجحة من قبل تلطيخ الخلايا العصبية في القشرة الحركية المحيطة موقع الحقن (الشكل 2A, B). في هذا المثال التمثيلي، لم تظهر قشرة الدماغ في نصف الكرة الآخر أي تلطيخ ملحوظ. ومع ذلك ، بالنظر إلى أن الخلايا العصبية المثيرة يمكن أن تؤدي إلى مناطق الدماغ البعيدة ، فإن التلطيخ في نصف الكرة الأرضية ليس بالضرورة مؤشرا على الحقن غير الناجح. وأظهر ارتفاع التكبير في المنطقة المصابة تلطيخ أجسام الخلايا وإسقاطاتها، مما يؤكد أن خلايا محددة فقط من المنطقة القشرية المستهدفة أصيبت(الشكل 2C).
يمكن أيضا إجراء تلطيخ مشترك مع علامات الخلايا العصبية المثيرة (على سبيل المثال ، ناقل الغلوتامات المركبات 1 ، CaMKIIα) للتحقق من صحة خصوصية نوع الخلية. بدلا من ذلك، يمكن إجراء تلطيخ مشترك مع علامات الخلايا العصبية المثبطة أو الخلايا الفلكية في حالة استهداف هذه الخلايا باستخدام مروجين مختلفين. كما تم تنفيذ تلطيخ مشترك من كوفلينS3D-HA وCaMKIIα في نفس الحيوان لمنطقة أكثر الخلفي لموقع الحقن التي لا تزال تظهر تلطيخ المضادة HA في القشرة الحركية(الشكل 2D). تظهر صورة التكبير الأعلى للمنطقة الخلايا التي تعبر بوضوح عن كوفلينS3D-HA (أليكسا فلور 488، الشكل 2E)وCaMKIIα (أليكسا فلور 568، الشكل 2F). ويكشف التراكب من cofilinS3D-HA و CaMKIIα تلطيخ أن معظم (إن لم يكن كل) الخلايا الملطخة لكوفلينS3D-HA هي أيضا إيجابية لCaMKIIα (الشكل 2G). تدعم هذه الملاحظة خصوصية العدوى للخلايا العصبية المثيرة.
لتقييم تأثير التلاعب بالكوفلين على نشاط ECoG ، يتم استخدام إشارات ECoG و EMG لإجراء تحديد مرئي لولايات اليقظة (اليقظة ، نوم الموجة البطيء ، النوم التناقضي). ويتم ذلك على 4-s العهود بسبب التغير السريع في حالة اليقظة في الماوس2، وهنا ، لتسجيل كامل 24 ساعة. وتشمل التحليلات القياسية حساب بنية النوم ومتغيرات التحليل الطيفي، كما أجريت سابقا لمجموعاتالبيانات المختلفة11و12و13و28و34. وعلى وجه الخصوص، فإن التحليل الطيفي لإشارة مجموعة ال ECoG لمختلف الدول سيفهرس تكوين الدولة وجودتها. لإزالة الاختلافات التي يمكن أن تنشأ، على سبيل المثال، من أعماق مختلفة من الأقطاب الكهربائية، يمكن التعبير عن بيانات التحليل الطيفي بالنسبة إلى القوة الإجمالية لجميع الدول من معين(الشكل 3A). وبالنظر إلى السعة النسبية المنخفضة جدا لنشاط ECoG في الترددات الأعلى ، فقد تم تحويل أطياف الطاقة النسبية لليقظة ، والنوم البطيء للموجة ، والنوم التناقضي إلى تصور أكثر ملاءمة ومقارنة النشاط في نفس الوقت بترددات منخفضة وعالية. يشير هذا التحليل إلى الاختلافات الخاصة بالدولة في النشاط الطيفي في ظل ظروف تعطيل الكفيلين(الشكل 3B). وبشكل أكثر دقة، تشير هذه النتائج الأولية التي تجمع بين الفئران الذكور والإناث إلى أن تعطيل الكفيلين يزيد بشكل كبير من القوة الطيفية في الترددات السريعة (14-30 هرتز) أثناء اليقظة وفي الترددات البطيئة (1-4 هرتز) أثناء النوم التناقضي، مع ترك نشاط ECoG أثناء النوم البطيء الموجة دون أن يتأثر بشكل رئيسي. وبالإضافة إلى ذلك، يبدو أن تعطيل cofilin لزيادة التباين بين الماوس في نشاط ECoG (ملحوظ بشكل خاص من أشرطة الخطأ لليقظة في الشكل 3B).
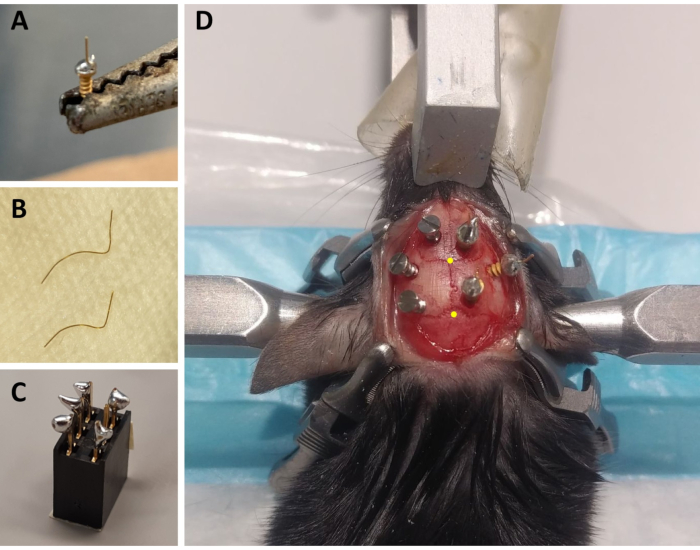
الشكل 1:إعداد مكونات المونتاج ECoG /EMG ومثال تمثيلي لوضع القطب ECoG. (أ)قطب ECoG: 4 مم طويلة، 0.2 مم قطرها سلك ذهبي (غير معزول) تنصهر على رأس المسمار المغطى بالذهب (1.9 مم قطر الرأس، 1.14 مم الخيط قطر رئيسي، 3.6 مم الطول الإجمالي) باستخدام لحام خالية من الرصاص. (B) أقطاب EMG: سلكان ذهبيان (1.5 و 2 سم) منحنيان لاحتضان منحنى الجمجمة حتى عضلة الرقبة ، ويتم الاحتفاظ بالطرف الآخر مباشرة ليتم لحامه إلى الموصل. (C) موصل 6 قنوات: يضاف لحام خالية من الرصاص إلى 5 من 6 دبابيس معدنية (حذف واحد في الوسط) من الموصل (5 مم × 8 ملم × 8 ملم + 3 ملم دبابيس معدنية). الجزء العلوي من الموصل مغطى بشريط لتجنب تسرب القمامة/ المياه. (د)مثال لتحديد المواقع من مسامير الصيانة الثلاثة على الجمجمة في نصف الكرة الأيسر وثلاثة أقطاب ECoG (بما في ذلك القطب المرجعي) على نصف الكرة الأيمن. ويشار إلى الإحداثيات المجسمة الدقيقة لأقطاب ECoG في الخطوتين 2.6 و3.2 وتم حسابها وفقا لموقع البريغما واللامدا (التي تشير إليها النقاط الصفراء). الاختصارات: ECoG = القشرة الكهربائية؛ EMG = الكهروميوغرافيا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
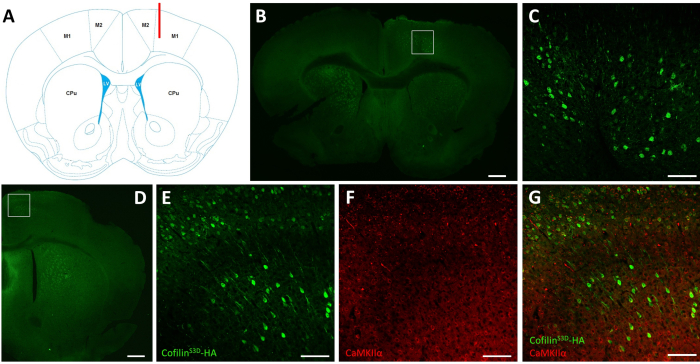
الشكل 2: التمثيل المناعي لتحديد المنطقة المصابة AAV ونوع الخلية. (أ)تمثيل تخطيطي يظهر موقع حقن الشريحة التاجية المعروضة في اللوحة B. الموضع هو 1.1 مم الأمامي إلى bregma، وكان الهدف من القنية (هو مبين باللون الأحمر) إلى طبقات الخامس من القشرة الحركية الأولية اليمنى (M1). تمثيل تعديل من فرانكلين وباكسينوس40. (ب) مناعة HA للكشف عن التعبير cofilinS3D-HA في الخلايا العصبية هو مبين لشريحة تاجية من الدماغ الكامل تقع ما يقرب من 1.1 مم الأمامي إلى bregma. المنطقة المصابة أساسا المترجمة إلى طبقات الخامس والسادس (طبقات تحت الحبوب) من القشريات الحركية الأولية والثانوية الحق (M1 و M2). شريط المقياس = 500 ميكرومتر. يمثل المربع المنطقة الموضحة في C. (C) تكبير أعلى للمنطقة المصابة يظهر تلطيخ الخلايا المصابة وتأكيد التعبير عن cofilinS3D-HA في طبقات أعمق من قشرة المحرك. شريط المقياس = 100 ميكرومتر (D) مناعة مشتركة من HA وCaMKIIα لتقييم خصوصية نوع الخلية الموضحة لشريحة تاجية من نصف الكرة الأيمن تقع حوالي 0.5 مم الأمامي إلى bregma وبالتالي، الخلفي إلى موقع الحقن (نفس الماوس كما هو الحال في لوحات B و C). المنطقة المصابة موضعية إلى القشريات الحركية (M1 و M2 أساسا). شريط المقياس = 500 ميكرومتر. يمثل المربع المنطقة الموضحة في E و F و G. (E) تكبير أعلى للمنطقة المصابة يظهر تلطيخ الخلايا المصابة وتأكيد التعبير عن cofilinS3D-HA. شريط المقياس = 100 ميكرومتر (F) تكبير أعلى للمنطقة المصابة يظهر تلطيخ الخلايا الإيجابية CaMKIIα. شريط المقياس = 100 ميكرومتر (G) تكبير أعلى للمنطقة المصابة يظهر الوسم المشترك للكوفلينS3D-HA وCaMKIIα ، مما يؤكد أن الخلايا المصابة إيجابية CaMKIIα. شريط المقياس = 100 ميكرومتر. المختصرات: AAV = فيروس مرتبط بال أدينو؛ M1 = القشرة الحركية الأساسية. M2 = القشرة الحركية الثانوية; CPu = بوتامين caudate (المخطط)؛ LV = البطين الجانبي; HA = هيماغلوتينين; CamKIIα = الكالسيوم / كالمودولين تعتمد على البروتين كيناز الثاني ألفا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
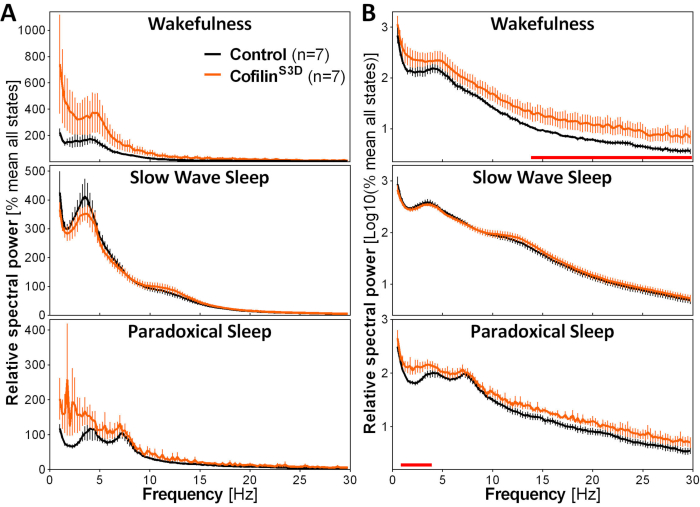
الشكل 3: أطياف الطاقة التمثيلية لليقظة ، وبطء نوم الموجة ، والنوم التناقضي الذي تم الحصول عليه بعد التلاعب الفيروسي بوظيفة الكفيلين. ذكر (ن = 5 لكل مجموعة) وأنثى (ن = 2 لكل مجموعة) الفئران حقن مع AAV9-CaMKIIα0.4-cofilinS3D-HA (titer الفيروسية 2.58 × 1013 GC / مل) أو مع عنصر تحكم A تم تسجيلAV (AAV9-CaMKIIα0.4-eGFP 1.25 ×10 13 GC/mL؛ نصف titer الاختبار للتحكم في الإشارة المحسنة لهذا التحكم AAV) في الطبقة الخامسة من القشرة الحركية لمدة 24 ساعة، وخضعت الإشارة الكهربائية القشرية للتحليل الطيفي (تحويل فورييه السريع لحساب القوة الطيفية بين 0.5 و 30 هرتز بدقة 0.25-هرتز). (أ)أطياف الطاقة خلال الدول الثلاث اليقظة أعرب نسبة إلى القوة الكلية لجميع الدول. (ب)سجل أطياف الطاقة النسبية التي تحولت إلى أكثر ملاءمة تمثل اختلافات المجموعة في الترددات العالية. قمع نشاط الكوفلين في القشرة الحركية باستخدام AAV9-CaMKIIα0.4-cofilinS3D-HA يزيد بشكل كبير من النشاط الكهربائي في نطاق بيتا (14-30 هرتز) أثناء اليقظة ، وفي نطاق دلتا (1-4 هرتز) أثناء النوم متناقض بالمقارنة مع حقن التحكم (خطوط حمراء فوق محاور x تشير مان ويتني U-اختبارعلى تردد الفرقة السلطة p < 0.05). المختصرات: AAV = الفيروس المرتبط بال أدينو GC = نسخ الجينوم؛ HA = هيماغلوتينين; CamKIIα = الكالسيوم / كالمودولين تعتمد على البروتين كيناز الثاني ألفا; eGFP = البروتين الفلوري الأخضر المحسن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول طريقة دقيقة ومباشرة لمراقبة نشاط ECoG و EMG أثناء التلاعب بالأهداف الجزيئية باستخدام AAVs. للمقارنة الكافية بين المجموعات، يوصى بشدة بالتخطيط دائما للإجراءات الجراحية (حقن AAV وزرع الأقطاب الكهربائية) في نفس اليوم لاختبار الحيوانات والتحكم فيها، وتسجيل إشاراتها الكهربية في وقت واحد. للحصول على تعبير فيروسي مماثل بين الاختبار والتحكم ، من المستحسن حقن نفس التيتر الفيروسي. في هذه الحالة، انخفض titer الفيروسية للسيطرة AAV إلى نصف اختبار AAV لضمان التعبير الفيروسي مماثلة. يجب على المجربين توخي الحذر الشديد مع قياسات الإحداثيات الاستريوتاكسيكية لضمان انخفاض التباين بين الحيوانات في منطقة الدماغ / استهداف الطبقة القشرية. بالإضافة إلى ذلك ، بالنظر إلى أن عمق الحقن يتم حسابه من سطح الجمجمة ، وأن سمك الجمجمة يختلف باختلاف العمر والجنس ، يجب دائما التحقق من وضع القنية باستخدام علم الأنسجة بعد البروتوكول أو الكيمياء المناعية (على سبيل المثال ، الشكل 2)لضمان تحديد المواقع / عمق الحقن بشكل كاف ، وينبغي تعديل الإحداثيات الاستريوتاكسيكية إذا لزم الأمر. في جميع أنحاء حقن AAV 40 دقيقة، من المهم جدا لرصد سرعة الحقن للكشف بسرعة وتصحيح القضايا المحتملة مثل انسداد المضخة. بعض الخطوات التجريبية هي أيضا حاسمة للحصول على إشارات الفيزيولوجيا الكهربائية الأمثل. على سبيل المثال، لا يفرط في crew أثناء زرع القطب. يجب أن تخرج البراغي من الجمجمة بمقدار 2.5 ملم على الأقل لتقليل الأضرار التي لحقت بالقشرة الدماغية وتشكيل ندبة جلتية. بعد ذلك ، من المهم للغاية أيضا أن أ) تجنب تطبيق الأسمنت على أطراف الأقطاب الكهربائية ، 2) ضمان لحام سريع للأقطاب الكهربائية إلى الموصل ، و3) تأكد من عدم وجود اتصال بين الأقطاب الكهربائية.
الإجراء المعروض هنا لتسجيل ECoG و EMG راسخ للغاية وبسيط ويستخدم على نطاق واسع لمراقبة اليقظة والنوم في الفئران2و11و13و34. يمكن إجراء تسجيلات ECoG و EMG المستمرة لعدة أيام متتالية (وحتى أسابيع) وتوليد مجموعة بيانات غنية جدا يمكن استخدامها لأداء عدة خطوط من التحليل تتضمن متغيرات تتعلق باليقظة وكمية النوم والهندسة المعمارية2و11و12 (على سبيل المثال ، الوقت الذي يقضيه في حالات مختلفة لكل فترات ضوئية ومظلمة ، وعدد الحلقات في كل ولاية ، توزيع النوم على مدار 24 ساعة) واليقظة والمحتوى الطيفي للنوم34و41 (على سبيل المثال، الطاقة في نطاقات تردد مختلفة [على غرار الشكل 3]،والنشاط الخالي من النطاق)، وخصائص الموجات الفردية42و43و44 (على سبيل المثال، اتساع الموجة البطيئة والمنحدر). عند استخدامها في تركيبة مع التلاعب الجزيئي بوساطة AAV ، فإن الميزة الإضافية هي تجنب التعويض التنموي المحتمل الذي يمكن أن يحدث في الحيوانات المعدلة وراثيا. مع الممارسة، يمكن إجراء الإجراء كله، بما في ذلك حقن AAV 40 دقيقة، في حوالي 90 دقيقة. يجب أن يكون معدل الوفيات منخفضا (جدا) لأن الجراحة طفيفة التوغل.
الاستخدام المتزامن لتسجيل ECoG / EMG والتلاعب المستهدف مع AAV يوفر مجموعة متنوعة من المزايا والتطبيقات الأخرى. فعلى سبيل المثال، تكون دقة الاستهداف الاستريوتاكزي، عند أدائها على نحو كاف، عالية جدا ويمكن تكرارها ومفيدة لتحديد الدور المحدد لمنطقة معينة من الدماغ (و/أو نوع الخلية أو عنصر جزيئي داخل المنطقة) في تنظيم النوم أو العمليات الفسيولوجية الأخرى. وبالتالي يمكن استهداف العديد من المناطق القشرية المختلفة بسهولة باستخدام تعديلات البروتوكول الحالي. وعلاوة على ذلك، يمكن توجيه عمليات التلاعب المستهدفة باستخدام مركبات الكربون الهيدروفلورية إلى منطقة قشرية/تحت القشرية تختلف عن مواقع تسجيل المركبات الكهربائية. في مثل هذه الحالات، يمكن تغطية ثقب التجشؤ لحقن AAV بواسطة غطاء زجاجي صغير ثابت باستخدام أسمنت الأسنان (أو شمع العظام). لتعزيز خصوصية، وبناء AAV غالبا ما يتضمن المروج الذي يسمح العدوى المستهدفة من نوع الخليةالدقيقة 14. تم استخدام مروج CamKIIα في البروتوكول الحالي لاستهداف الخلايا الهرمية المثيرة14و29و45على وجه التحديد من قشرة المحرك. وقد مكنت هذه الاستراتيجية تعطيل cofilin (باستخدام cofilinS3D)32،33 في الخلايا العصبية مثير من القشرة الحركية ومراقبة التغيرات الخاصة للدولة في نشاط ECoG ( الشكل3). لتقييم فعالية العدوى / النقل ، يمكن لمستخدمي البروتوكول في المستقبل الجمع بين بروتوكول AAV-ECoG المقدم مع واحد من التلطيخ المشترك عن طريق الفلورة المناعية ، واستخدام صور التكبير العالية لحساب عدد الخلايا التي تظهر وضع علامات مزدوجة من العدد الإجمالي للخلايا التي تظهر وسمة واحدة للهدف (هنا ، الخلايا العصبية المعبرة عن CaMKIIα). في دراسة حديثة، تم استخدام طريقة AAV-ECoG مماثلة لتلك الموصوفة هنا للإفراط في التعبير عن البروتين الهش المرتبط بمتلازمة التخلف العقلي X 1 (FXR1) في جميع الخلايا العصبية في القشرة الحركية باستخدام AAV يحتوي على مروج synapsin وكشف عن تأثير هذا التلاعب على توزيع حالة اليقظة والمحتوى الطيفي28. توضح هذه النتائج كيف يمكن أن يكشف التلاعب بجزيء معين في منطقة الدماغ المستهدفة باستخدام AAVs عن أدوار في تنظيم معلمات اليقظة / النوم المحددة.
أحد قيود البروتوكول الموصوف هو الآفة الصغيرة لأنسجة الدماغ التي تحدث مع وضع القنية قبل إجراء حقن AAV ، والتي يمكن أن تكون مصحوبة أيضا باستجابة التهابية. وهذا يمكن أن يكون مصدر قلق خاص عند إجراء حقن AAV في المناطق تحت القشرية وينبغي دائما معالجتها باستخدام ضوابط كافية. وبدلا من ذلك، يمكن أن يتبع البروتوكول الحالي تحديد كمي للغليوسيس التفاعلي و/أو التنشيط المجهري (على سبيل المثال، استخدام الفلورة المناعية) لضمان مستويات مماثلة في مجموعات التحكم والاختبار، وبالتالي، على قراءات مجموعة ال ECoG. ويتعلق القيد الثاني بخطر وجود اتصال سيئ بين القطب الكهربائي والموصل، مما قد يؤدي إلى إشارة كهربية كهربية سيئة باستمرار أو في بعض الأحيان. سوف مشدود بقوة، لحام، والأقطاب الكهربائية عززت تقليل وقوع هذه المسألة. ويرتبط القيد الثالث بالحيوانات التي يتم ربطها عبر مونتاج الرأس أثناء التسجيل ، مما قد يحد من الحركة والسلوكيات الأخرى ، على الأقل إلى حد ما ، ويؤدي أحيانا إلى تلف الكابلات وفقدان الإشارة. وأخيرا، فإن البروتوكول المعروض هو أكثر ملاءمة للفئران البالغة، بالنظر إلى أن حجم الجمجمة للحيوانات الأصغر سنا قد يسبب صعوبات في تركيب المونتاج الرأس يصور، كما هو موضح سابقا2.
كما ينطبق تسجيل ECoG/EMG المشترك والتلاعب بوساطة AAV لهدف دقيق على مجالات البحث بخلاف علم الأعصاب للنوم. من بين أمور أخرى، يمكن استخدامه لدراسة والتلاعب أحداث الصرع في النماذج الحيوانية من الاستيلاء وهو أداة قوية لتعديل ذبذبات الدماغ المشاركة في ترميز الذاكرة وتوطيد46،47. وبناء على ذلك، تشمل التطبيقات المحتملة بالتأكيد مجالات البحوث الأساسية في الطب النفسي والأعصاب، بما في ذلك الأمراض العصبية. بالإضافة إلى القدرة على التعبير عن شكل غير نشط من جزيء، يمكن أن تستخدم AAVs وقد استخدمت للتعبير المفرط أو downregulate (على سبيل المثال، الجيش الملكي النيبالي الصغيرة التدخل، CRISPR/Cas9) أو لإنقاذ التعبير عن جزيء في KO كامل الجسم. الأهم من ذلك ، فإن المنهجية المزدوجة للبروتوكول الحالي تنطبق أيضا على أنواع الثدييات الأخرى مثل الفئران والقوارض النهارية التي تمثل نماذج مثيرة للاهتمام لفهم كل من النوم والتنكس العصبي48،49.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم تمويل العمل من قبل كرسي البحوث الكندية في علم وظائف الأعضاء الجزيئية النوم. ويشكر المؤلفان كلوي بروفوست وكارولين بوشار على المساعدة التقنية.
Materials
| Name | Company | Catalog Number | Comments |
| Surgery peparation | |||
| 21 G needle | Terumo | NN-2125R | |
| 6-channel connector | ENA AG | BPHF2-O6S-E-3.2 | Connector used in this manuscript, but discontinued. See potential replacement below |
| Distrelec | 300-93-672 | Potential replacement for discontinued connector above | |
| C57BL6/J mice | Jackson Laboratory | 000664 | B6 | Animals bred on site |
| Pluronic F-68 | Non-ionic surfactant | ||
| Gold wire 0.2 mm diameter | Delta scientific | 920-862-41 | Non-insulated |
| Hamilton syringe (10 μL) | Fisher Scientific | 14815279 | |
| Infusion syringe Pump CMA 402 | Harvard Apparatus | CMA8003110 | |
| Injection cannula 28 G | Plastics one | C313l-SPCL | |
| Isoflurane | Baxter | CA2L9100 | |
| Ketamine (10 mg/mL) | SANDOZ | 4550 | |
| Lead-free solder | AIM | SN100C | |
| Lubricating ophthalmic ointment | ALLERGAN | 210889 | |
| PE 50 Catheter thin wall | Plastics one | C232CT | |
| Flat fillister head self tapping screws | MORRIS | FF00CE125 | ECoG electrode gold covered; Dimension : 1.9 mm head diameter, 1.14 mm thread major diameter, 3.6 mm length |
| Soldering iron | Weller | WES51 | |
| Syringe 1 mL | BD | 309659 | |
| Trimmer | Harvard Apparatus | 72-9063 | |
| Xylazine (20 mg/mL) | Bayer | 2169592 | |
| Intracortical AAV injection with syringe pump | |||
| 0.7 mm drill bit | Dremel | 628 | |
| AAV9-CaMKIIα0.4-cofilinS3D-HA | UPenn Viral Core | ||
| AAV9-CaMKIIα0.4-eGFP | UPenn Viral Core | ||
| Cotton tippped applicators | Medicom | 806 | |
| Drill | Dremel | 8050-N/18 | |
| Extra-fine Graefe forceps | Fine science tools | 11150-10 | |
| Stereotaxic arm | Stoelting | 51604U | |
| Stereotaxic frame | Stoelting | 51600 | |
| Surgical clamps | Fine science tools | 18050-28 | |
| Tissue scissor | Magna Stainless | M4-124 | |
| ECoG/EMG electrode implantation | |||
| Buprenorphine (0.3 mg/mL) | CEVA | 57133-02 | |
| Curved forceps | Fine science tools | 11001-12 | |
| Delicate task wipers | Kimtech | 34120 | |
| Dental acrylic cement | Yates Motloid | 44115 | |
| Dumont #5 forceps | Fine science tools | 91150-20 | |
| Extra fine Graefe forceps | Fine science tools | 11150-10 | |
| Kelly forceps | Fine science tools | 13002-10 | |
| Liquid acrylic | Yates Motloid | 44119 | |
| Monocryl plus suture needle 13 mm 3/8c rev cutting | Ethicon | MCP494 | |
| Providone-iodine 10% | Triad disposables | 10-8208 | |
| RelyX Unicem 2, Adhesive Resin Cement A2 | 3M | 56849 | |
| Immunofluorescence and ECoG recording | |||
| 36-Channel EEG Wearable Headbox | LaMONT Medical | 832-000350 | |
| CaMKII alpha Monoclonal Antibody (Cba-2) | Invitrogen | 13-7300 | Dilution 1:500 |
| Conductors Awg PVC Insulation Cable | Calmont Wire & Cables | HC-0819075R0 | |
| Donkey anti-Mouse IgG secondary Ab, Alexa Fluor 568 | Invitrogen | A10037 | Dilution 1:1000 |
| Goat anti-Rabbit IgG secondary Ab, Alexa Fluor 488 | Invitrogen | A-11008 | Dilution 1:500 |
| HA-Tag (C29F4) Rabbit mAb | Cell signaling | 3724 | Dilution 1:800 |
| Programmable Amplifier | LaMONT Medical | 815-000002-S2 | |
| Stellate Harmonie | Natus | HSYS-REC-LT2 | |
| Swivel connector | Crist Instrument Company Inc. | 4-TBC-9-S |
References
- Campbell, I. G. EEG recording and analysis for sleep research. Current Protocols in Neuroscience. , (2009).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Current Protocols in Mouse Biology. 2 (1), 55-74 (2012).
- Bastien, C. H., et al. Insomnia and sleep misperception. Pathologie Biologie. 62 (5), 241-251 (2014).
- Malafeev, A., et al. Automatic artefact detection in single-channel sleep EEG recordings. Journal of Sleep Research. 28 (2), 12679 (2019).
- Latreille, V., et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease. Brain. 139, 1189-1199 (2016).
- Rodrigues Brazete, J., et al. Electroencephalogram slowing predicts neurodegeneration in rapid eye movement sleep behavior disorder. Neurobiology of Aging. 37, 74-81 (2016).
- Kent, B. A., Strittmatter, S. M., Nygaard, H. B. Sleep and EEG power spectral analysis in three transgenic mouse models of Alzheimer's disease: APP/PS1, 3xTgAD, and Tg2576. Journal of Alzheimers Disease. 64 (4), 1325-1336 (2018).
- Chang, A. M., et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiology International. 33 (5), 561-573 (2016).
- Shi, G., Wu, D., Ptacek, L. J., Fu, Y. H. Human genetics and sleep behavior. Current Opinion in Neurobiology. 44, 43-49 (2017).
- Nakai, Y., et al. Calcineurin and its regulator sra/DSCR1 are essential for sleep in Drosophila. Journal of Neuroscience. 31 (36), 12759-12766 (2011).
- El Helou, J., et al. Neuroligin-1 links neuronal activity to sleep-wake regulation. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9974-9979 (2013).
- Freyburger, M., et al. EphA4 is involved in sleep regulation but not in the electrophysiological response to sleep deprivation. Sleep. 39 (3), 613-624 (2016).
- Seok, B. S., et al. The effect of Neuroligin-2 absence on sleep architecture and electroencephalographic activity in mice. Molecular Brain. 11 (1), 52 (2018).
- Haery, L., et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation. Frontiers in Neuroanatomy. 13, 93 (2019).
- Schmidt, F., Grimm, D. CRISPR genome engineering and viral gene delivery: a case of mutual attraction. Biotechnology Journal. 10 (2), 258-272 (2015).
- Wang, D., Zhang, F., Gao, G. CRISPR-based therapeutic genome editing: strategies and in vivo delivery by AAV vectors. Cell. 181 (1), 136-150 (2020).
- Havekes, R., et al. Transiently increasing cAMP levels selectively in hippocampal excitatory neurons during sleep deprivation prevents memory deficits caused by sleep loss. Journal of Neuroscience. 34 (47), 15715-15721 (2014).
- Fuller, P. M., Yamanaka, A., Lazarus, M. How genetically engineered systems are helping to define, and in some cases redefine, the neurobiological basis of sleep and wake. Temperature. 2 (3), 406-417 (2015).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ono, D., Yamanaka, A. Hypothalamic regulation of the sleep/wake cycle. Neuroscience Research. 118, 74-81 (2017).
- Shiromani, P. J., Peever, J. H. New neuroscience tools that are identifying the sleep-wake circuit. Sleep. 40 (4), 032 (2017).
- Oishi, N., et al. Artificial association of memory events by optogenetic stimulation of hippocampal CA3 cell ensembles. Molecular Brain. 12 (1), 2 (2019).
- Anaclet, C., et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control. Journal of Neuroscience. 38 (22), 5168-5181 (2018).
- Chen, K. S., et al. A hypothalamic switch for REM and non-REM sleep. Neuron. 97 (5), 1168-1176 (2018).
- Torontali, Z. A., Fraigne, J. J., Sanghera, P., Horner, R., Peever, J. The sublaterodorsal tegmental nucleus functions to couple brain state and motor activity during REM sleep and wakefulness. Current Biology. 29 (22), 3803-3813 (2019).
- Rolls, A., et al. Optogenetic disruption of sleep continuity impairs memory consolidation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13305-13310 (2011).
- Ognjanovski, N., Broussard, C., Zochowski, M., Aton, S. J. Hippocampal network oscillations rescue memory consolidation deficits caused by sleep loss. Cerebral Cortex. 28 (10), 3711-3723 (2018).
- Khlghatyan, J., et al. Fxr1 regulates sleep and synaptic homeostasis. EMBO Journal. 39 (21), 103864 (2020).
- Havekes, R., et al. Sleep deprivation causes memory deficits by negatively impacting neuronal connectivity in hippocampal area CA1. Elife. 5, 13424 (2016).
- Wong, L. W., Tann, J. Y., Ibanez, C. F., Sajikumar, S. The p75 neurotrophin receptor is an essential mediator of impairments in hippocampal-dependent associative plasticity and memory induced by sleep deprivation. Journal of Neuroscience. 39 (28), 5452-5465 (2019).
- Mizuno, K. Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular Signalling. 25 (2), 457-469 (2013).
- Nagaoka, R., Abe, H., Obinata, T. Site-directed mutagenesis of the phosphorylation site of cofilin: its role in cofilin-actin interaction and cytoplasmic localization. Cell Motility and the Cytoskeleton. 35 (3), 200-209 (1996).
- Elam, W. A., et al. Phosphomimetic S3D cofilin binds but only weakly severs actin filaments. Journal of Biological Chemistry. 292 (48), 19565-19579 (2017).
- Areal, C. C., Cao, R., Sonenberg, N., Mongrain, V. Wakefulness/sleep architecture and electroencephalographic activity in mice lacking the translational repressor 4E-BP1 or 4E-BP2. Sleep. 43 (2), (2020).
- Vyazovskiy, V., Borbely, A. A., Tobler, I. Unilateral vibrissae stimulation during waking induces interhemispheric EEG asymmetry during subsequent sleep in the rat. Journal of Sleep Research. 9 (4), 367-371 (2000).
- Sitnikova, E. Neonatal sensory deprivation promotes development of absence seizures in adult rats with genetic predisposition to epilepsy. Brain Research. 1377, 109-118 (2011).
- Tudor, J. C., et al. Sleep deprivation impairs memory by attenuating mTORC1-dependent protein synthesis. Science Signaling. 9 (425), 41 (2016).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293 (2015).
- Dufort-Gervais, J., et al. Neuroligin-1 is altered in the hippocampus of Alzheimer's disease patients and mouse models, and modulates the toxicity of amyloid-beta oligomers. Scientific Reports. 10 (1), 6956 (2020).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates, Third edition. , (2007).
- Lina, J. M., O'Callaghan, E. K., Mongrain, V. Scale-free dynamics of the mouse wakefulness and sleep electroencephalogram quantified using Wavelet-Leaders. Clocks & Sleep. 1 (1), 50-64 (2019).
- Massart, R., et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes. Translational Psychiatry. 4, 347 (2014).
- Freyburger, M., Poirier, G., Carrier, J., Mongrain, V. Shorter duration of non-rapid eye movement sleep slow waves in EphA4 knockout mice. Journal of Sleep Research. 26 (5), 539-546 (2017).
- Hubbard, J., et al. Rapid fast-delta decay following prolonged wakefulness marks a phase of wake-inertia in NREM sleep. Nature Communications. 11 (1), 3130 (2020).
- Johansen, J. P., et al. Optical activation of lateral amygdala pyramidal cells instructs associative fear learning. Proceedings of the National Academy of Sciences of the United States of America. 107 (28), 12692-12697 (2010).
- Boyce, R., Glasgow, S. D., Williams, S., Adamantidis, A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science. 352 (6287), 812-816 (2016).
- Bandarabadi, M., et al. Dynamic modulation of theta-gamma coupling during rapid eye movement sleep. Sleep. 42 (12), 182 (2019).
- Estrada, C., et al. Transcranial magnetic stimulation and aging: Effects on spatial learning and memory after sleep deprivation in Octodon degus. Neurobiology of Learning and Memory. 125, 274-281 (2015).
- Hurley, M. J., et al. The long-lived Octodon degus as a rodent drug discovery model for Alzheimer's and other age-related diseases. Pharmacology & Therapeutics. 188, 36-44 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved