Method Article
使用腺相关病毒在小鼠中瞄准科菲林操纵的大脑皮层区域的电皮质记录
摘要
本文描述了使用腺相关病毒操作大脑皮层分子靶点的规程,以及使用电皮质记录监测这种操作在觉醒和睡眠期间的影响。
摘要
在啮齿动物中使用电皮质(ECoG)记录与睡眠研究和各种神经系统疾病的研究有关。腺相关病毒 (AAV) 越来越多地用于增进对大脑回路及其功能的理解。AAV介于特定细胞群和/或精确分子成分的操作对于识别新的睡眠调节回路/分子和导致睡眠损失不利影响的关键蛋白质非常有用。例如,使用 AAV 抑制长丝作用素切除蛋白科菲林的活动可防止睡眠剥夺引起的记忆障碍。在这里,描述了一个协议,结合了大脑皮层区域的科菲林功能的操作与ECoG活动的记录,以检查皮质科菲林是否调节觉醒和睡眠ECoG信号。AAV注射与成年雄性小鼠和雌性小鼠植入ECoG和电极(EMG)电极的外科手术相同。老鼠麻醉了,头都剃了。皮肤清洁和切口后,确定运动皮层的立体定向坐标,头骨在此位置被刺穿。预填充AAV表达科菲林S3D的管子,一种非活性形式的科菲林,慢慢地被放置在皮质组织中。AAV输液后,金盖螺丝(ECoG电极)拧过头骨,用插入颈部肌肉(EMG电极)的金丝粘在头骨上。动物可以三个星期恢复,并确保足够的表达科菲林S3D。使用免疫造血术验证受感染区域和细胞类型,使用警戒状态的视觉识别和光谱分析分析ECoG。总之,这种综合方法论方法可以研究分子成分对调节神经元形态和连接对清醒和睡眠期间同步大脑皮层活动调节的精确贡献。
引言
脑电图(或啮齿动物一般电皮质学[ECoG])和电致像(EMG)录音被广泛用于睡眠研究,以及更广泛的神经科学、神经学和精神病学。综合起来,这些电生理信号允许识别警惕状态,并随后量化状态持续时间和光谱组成,包括人类和啮齿动物1,2,3,4。这种量化有助于理解睡眠是如何在病理条件下(如神经退行性疾病和模型5、6、7或基因改造8、9)中改变的。例如,与神经元通信相关的不同基因的敲除(KO)被证明可以改变小鼠和果蝇10、11、12、13的清醒和睡眠时间。为了解决啮齿动物全身KO研究产生的潜在发育补偿问题,并允许更精细地控制基因操纵,操纵基因表达的有效方法是使用腺相关病毒(AAV)。AAV介质的基因操纵可用于降低或调高给定的分子靶点,并利用不同类型的促进剂将操纵限制在特定细胞群中。AAV也广泛用作交付方法,在集群定期间歇短回音重复(CRISPR)/Cas9技术15,16。这些方法允许更好地在时间和空间上控制遗传操作,这通常与记者的表达有关,允许使用免疫荧光对感染区域进行量化。
AAV还代表通过光遗传学和化学遗传学17,18,19的细胞类型特定操作神经元活动的主要载体,这些载体已广泛应用于最近关于神经退行性疾病、行为、认知和睡眠20、21、22的研究中。在睡眠研究中,光遗传学对激活或抑制某些大脑区域(如基底前脑、下丘脑和下腹血糖)的应用,有助于确定它们在控制唤醒、慢波睡眠(也称为非快速眼动睡眠)、自相矛盾的睡眠(或快速眼动睡眠)和阴极23中的作用。 24,25。此外,AAV调解的操作有助于阐明重要的睡眠调节电路和分子导致睡眠损失的不利影响26,27,28。例如,一种蛋白质被证明与睡眠剥夺引起的记忆障碍有关,是科菲林29,30。这种蛋白质是一种细丝作用素分离蛋白,通过物理结合作用和促进长丝的拆解在动态的方式31参与行动素丝的重组。使用 AAV 介导的方法抑制科菲林活动被证明可以防止脊椎丧失以及突触可塑性和记忆缺陷引起的小鼠睡眠剥夺29。总的来说,这些研究强调了AAV介导操作的有用性和相关性,以了解睡眠调节和啮齿动物睡眠剥夺的后果。
在这里,描述了一个协议,结合ECoG和EMG电极植入和记录与操作科菲林功能在大脑皮层区域的野生类型(WT)小鼠使用AAV。更确切地说,AAV(血清型9)表示小鼠科菲林(cofilinS3D)磷化形式的编码序列,使其处于非活动状态32,33,被注射到运动皮层(M1和M2)中。ECoG 电极直接植入注射部位,以确保记录受感染细胞的同步皮质活性。ECoG/EMG 记录在手术后三周内在不受干扰的条件下进行 24 小时,以便恢复、适应和高科菲林S3D表达。然后,录音用于识别警戒状态和ECoG光谱分析,如前一研究11,34所述。这种方法可以具体揭示皮质科菲林如何调节小鼠的觉醒和睡眠ECoG信号。这种电生理记录和AAV介质基因操作的结合对于研究各种分子元素在特定大脑功能中的作用特别相关,可以应用于WT和转基因两性小鼠以及其他物种感兴趣的皮质(和皮下)大脑区域。
研究方案
所有方法都得到了加拿大 动物护理委员会 的批准,并且符合加拿大动物护理理事会的准则。请参阅本协议中使用的试剂、设备和材料材料 表 。
1. 手术准备
- ECoG 和 EMG 电极的制备
- 对于每只动物,准备三个ECoG电极:使用焊接铁,在镀金螺丝的螺钉盖上放置一小滴无铅焊料,使用无铅焊料在螺帽顶部焊接一根4毫米长、直径0.2毫米的金丝(非绝缘)。准备2个电极与金丝直立,一个与45°角从垂直。
- 对于每只动物,准备两个EMG电极:将一根直径为0.2毫米的金丝切成1.5厘米,第二根一到2厘米。弯曲两根电线,让这些连接线拥抱头骨的曲线到颈部肌肉,保持直端,将焊接到连接器(图1B)。
- 对于每只动物,准备一个连接器:使用 6 通道连接器(5 毫米 x 8 毫米 x 8 毫米 x 3 毫米金属销),并将无铅焊接器添加到 6 个金属销中的 5 个(省略一个中间销; 图1C)。用胶带盖住连接器顶部,以避免垃圾或水渗入。
- 准备 AAV 和注射器泵
- 准备测试 AAV (这里, AAV9- 卡姆基®0.4 - 科菲林S3D-HA) 和 /或控制 AAV (这里, AAV9- 卡姆基®0.4-eGFP) 通过稀释股票 AAV 组合 (这里, AAV在磷酸盐缓冲盐水溶液中含有非离子表面活性剂[0.001%])与无菌盐水,以获得所需的病毒滴答声(一般为1012-13 基因组拷贝[GC]/mL)和治疗小鼠数量所需的体积。
注:每只小鼠的皮质区域注射体积为 1 μL,需要准备 2 μL。 - 将一个 10 μL 注射器固定在注射器泵上,并将其装满蒸馏水。
- 使用 1 mL 注射器和 21 G 针将一根长度约 60 厘米的 PE50 管装满蒸馏水。重要的是,在灌装后将 21G 针头和注射器留在原位。将 PE50 管与注射器泵连接;将 21 G 针头/注射器放在 PE50 管的一端,并将另一端连接到 10 μL 注射器。
- 一旦管固定在 10 μL 注射器上,将针头移开另一端,并推动 10 μL 注射器的活塞,用水填补针头留下的间隙。
注意:确保没有气泡,并确保管子完全充满水。 - 在拔掉针头的管子末端安装一个 28 G 的管子。用 10 μL 注射器将水推入管中,以完全填充水。将管子紧紧固定在立体定向手臂上。
- 准备测试 AAV (这里, AAV9- 卡姆基®0.4 - 科菲林S3D-HA) 和 /或控制 AAV (这里, AAV9- 卡姆基®0.4-eGFP) 通过稀释股票 AAV 组合 (这里, AAV在磷酸盐缓冲盐水溶液中含有非离子表面活性剂[0.001%])与无菌盐水,以获得所需的病毒滴答声(一般为1012-13 基因组拷贝[GC]/mL)和治疗小鼠数量所需的体积。
- 动物准备
注:C57BL6/J 12周年龄的雄性小鼠和雌性小鼠以前被调整至少2周,以容纳在单独的笼子和12小时光:12-h的暗循环与广告脂质食物和水,并进入一个木立方体。- 小心地称量小鼠,并在腹内注射氯胺酮/西拉津(120/10毫克/千克)的混合物进行麻醉。等待约10分钟的深度麻醉。
- 使用修剪头发器将头发从耳朵后部剃到眼睛之间的头部前部。
注意:要小心不要剪胡须(剃须时用手指保护胡须),因为胡须修剪会修改感官输入和ECoG活性35,36。 - 在每只眼睛上加入一滴大方的眼药膏,以防止脱水。通过从后爪捏脚趾来验证手术过程中麻醉的深度。为鼠标提供 0.5-1.5% 异黄素,以确保在出现脚趾捏反射时进行深度麻醉。
2. 带注射器泵的带内性 AAV 注射
注:在清洁环境中,用消毒仪器执行以下所有步骤。在开始手术之前,使用 70% 乙醇进一步清洗消毒仪器,并清洗第 1.1 节中准备的电极以及锚螺钉(非金盖螺钉)。
- 用耳塞小心地将鼠标头固定在立体定向式仪器上。
注意:确保头部不会横向移动。 - 轻轻地将动物的舌头从嘴里拉出来,以避免窒息,然后用立体定向适配器固定鼠标的鼻子。
注意:在手术过程中经常监测呼吸。 - 用70%的乙醇消毒头部剃须区域,用额外的细格莱夫钳子保持皮肤,用组织剪刀将皮肤从耳朵底部切到眼睛的水平。使用四个手术夹来伸展皮肤和暴露头骨(切口两侧各两个;见图1D)。
- 用锋利的剪刀尖划伤头骨表面:在避免骨缝合时,去除腹膜,在两个或多个方向上形成重叠的条纹。取出骨头碎片,用70%的乙醇干燥头骨。
注:刮伤和条纹将有助于通过改善水泥对头骨的粘附性,使记录蒙太奇更坚固(见下文)。 - 将管子固定在立体定向手臂上,确定胸腺的位置(即头骨冠状和下垂缝合线之间的交叉点; 图1D)和兰姆达(即头骨下垂缝合线和连接左右羔羊形缝合线的直线之间的交叉点; 图1D),并注意每个的立体定向坐标。如果布雷格玛和兰姆达的 z 坐标(垂直轴)之间的差大于 0.3 mm,则使用立体定向适配器调整鼻子的高度,直到布雷格玛和兰姆达的 z 位置对齐。
- 在这些坐标(运动皮层)用笔标记头骨上的管子位置:1.5 毫米横向右到中线,1.5 毫米前到布雷格玛。用与头骨表面垂直的方向(与垂直轴对齐)小心地用 0.7 mm 钻头刺穿管位的头骨。用浸渍10%丙酮-碘溶液浸渍的无菌棉尖清洗穿孔头骨。
- 将 10 μL 注射器活塞拉回 1 μL,将管子与 1 μL 气泡一起加载。将测试 AAV(此处 AAV9- 卡姆基®0.4-科菲林S3D-HA)或控制 AAV(此处 AAV9-CaMKI®0.4-eGFP)加载到以前加载空气气泡的管子中:通过上下缓慢管道混合 AAV, 在无菌的 Petri 盘上吸管 1.7 μL,通过缓慢地拉动 10 μL 注射器的活塞,在管子中吸气 1.5 μL 溶液。标记 PE50 管上的气泡位置,以便跟踪喷射。
- 将管子与头骨上的孔对齐,使管子的垂直位置达到头骨的上边缘(即头骨表面)。从头骨表面,慢慢降低1.5毫米(达到1.5毫米以下的头骨表面和运动皮层的V层)。
注意:要非常小心,不要过多地降低管结,以避免脑组织的不必要病变。 - 启动注射器泵,在 40 分钟内注射 1 μL 的 AAV(速度:0.025 μL/min,以尽量减少组织损伤)。根据气泡的运动跟踪 PE50 管上的注水情况,并在需要时进行调整。
- 注射完成后,将管位放置 5 分钟,以确保充分扩散并避免回流。然后,缓慢而小心地抬起立体式手臂,将管状物从皮层中取出。
3. ECoG/EMG电极植入
- 使用直 Kelly 钳子,在注入 AAV 的孔中缓慢拧一个 ECoG 电极(用直金丝)在垂直轴(与孔被穿孔的角度相同)。将至少2.5毫米的螺丝从头骨中取出,以尽量减少对杜拉和大脑皮层的损害(即从头骨表面大约1.1毫米的深度:图1D)。
- 在这些坐标上用笔标记后ECoG电极的位置和头骨上的参考电极:后电极(视觉皮层)1.5毫米横向右至中线,1.5毫米前向兰姆达,参考电极(声生皮层)2.6毫米横向右至中线,后向0.7毫米至布雷格马。此外,标记三个维护螺丝的位置(作为头骨和牙齿水泥之间的锚,以凝固头部蒙太奇)在左半球没有特定的坐标,但尽可能远离对方和ECoG电极。
- 用 0.7 mm 钻头小心地刺穿其他电极和锚螺钉的标记位置的头骨。每个螺丝垂直于头骨表面的方向穿孔(即后电极的垂直轴,但与其他部位的垂直轴的角度)。在安装螺丝以防止出血和污染之前,用 10% 的丙酮碘溶液清洗穿孔的头骨,然后用细小的卷起的任务雨刷器堵塞孔。
- 使用直 Kelly 钳子,拧左半球的维护螺钉,然后拧紧右半球的最后两个电极。确保用与孔被刺穿相同的角度拧,并留下至少2.5毫米的每颗螺丝的头骨(图1D)。
注意:为了最大限度地提高最终蒙太奇的坚固性和电生理信号的质量,在安装下一个时要小心不要碰任何螺丝。 - 将几滴牙科水泥放在螺丝内环状空间的中心。使用 Dumont #5钳子保持弯曲的四肢,并用超细的格雷夫钳子将皮肤提升到肌肉上方,从而将一个 EMG 电极的弯曲端(在步骤 1.1.2 处准备)插入颈部肌肉中,大约为 1-2 mm。然后,将电极的弯曲侧和肘部放在牙科水泥中:重复第二个 EMG 电极。
注:较长的 EMG 电极的直端应与前 ECoG 电极和较短的 EMG 电极与后 ECoG 电极对齐。确保两个 EMG 电极不会相互接触或任何螺丝。 - 遮住老鼠的眼睛,用光照3-5分钟,帮助巩固。一旦 EMG 电极牢牢握住,用牙科水泥覆盖 ECoG 电极的底座和锚螺丝的底座,形成冠状轮廓。遮住老鼠的眼睛,用光照3-5分钟,帮助巩固。
注意:不要在 ECoG 和 EMG 电极四肢(将焊接到连接器的金丝)或皮肤上涂抹水泥。 - 用以前混合的丙烯酸水泥填充蒙太奇的中心。在水泥凝固过程中,取出支撑皮肤的四个手术夹(并立即用精致的任务雨刷器清洗这些夹子)。
注意:不要在 ECoG 和 EMG 电极四肢(将焊接到连接器的金丝)或皮肤上涂抹水泥。 - 用缝合针(13 mm 3/8 c)和合成可吸收的单丝,缝合蒙太奇背部和前部的皮肤,使头骨不暴露(但避免过多伸展皮肤)。
- 用弯曲的钳子将蒙太奇上方的连接器握住,并小心地将电极的金线与接头销对齐。焊接极四肢,以连接器针与焊接铁。
注意:快速行动,避免过热和皮质组织受损。确保每个电极与相应的连接器销保持良好接触,并确保电极之间没有连接。 - 将鼠标从立体定型框中取出。通过覆盖电极和连接器销之间的所有连接,用以前混合的丙烯酸水泥覆盖连接器和头部之间的空位。
注意:通过将鼠标与头部上方的连接器握住(头直不倾斜),避免水泥渗入连接器内部。 - 称量鼠标,并将其放在一个干净的笼子里(最好配有无网盖)放在热垫上(个人住房,以避免头部蒙太奇受损)。定期监测动物,并在醒来时皮下施用0.1毫克/千克丁丙诺啡,如果动物出现疼痛迹象(如姿势异常、眼睛斜视),则12小时后进行。
注:相对于手术前体重的体重增加不应超过1.5克。
4. 录音
- 房子老鼠单独避免损坏头部蒙太奇由于相互梳理,以及损坏和缠绕的录音电缆。
注:对于这个协议,老鼠被安置在食物、水和木立方体的辅助脂肪中,并进行了日常监测。 - 将小鼠连接到手术后 2 周的记录电缆,以适应布线条件。
- 记录 ECoG/EMG 信号 24 小时(或更长/更短,具体取决于研究问题)。
注:ECoG/EMG 信号记录是使用电缆、旋转连接器(允许电缆旋转)、36 通道可穿戴框和连接到计算机的放大器完成的。信号以 256 Hz(或更多取决于研究问题)取样,并用商业软件记录(参见材料表)。为了确保足够的病毒表达,实验应在AAV注射后至少3周进行,如前所述29,37。 - 录音后,通过颈椎错位(或其他方法取决于免疫染色方案)来牺牲小鼠,并收获大脑进行免疫染色。
结果
在电生理记录后,免疫荧光用于定义通过 AAV 注射感染的区域,并验证 cofilinS3D的表达(图 2)。免疫染色可以使用类似之前描述的29,37,38,39的方法进行。AAV表示一种不活跃形式的柯菲林与血凝素 (HA)-Tag (科菲林S3D-HA)融合在一起,通过免疫荧光使用抗 HA 抗体和辅助抗体 (Alexa Fluor 488) 检测到。受感染的兴奋神经元(这里,以钙/镇静蛋白依赖蛋白激酶IIα[CamKII]]促进者控制AAV中所含的转基因表达)被染色与抗HA抗体。注射部位周围的运动皮层神经元的染色(图2A,B)表明成功感染。在这个具有代表性的例子中,另一个半球的大脑皮层没有表现出任何明显的污渍。然而,鉴于兴奋神经元可以投射到遥远的大脑区域,在反边半球的染色并不一定是注射不成功的迹象。受感染区域的放大度较高,显示细胞体和投影的染色,确认只有目标皮质区域的特定细胞被感染(图2C)。
还可与兴奋神经元标记(例如,车辆谷氨酸运输机 1、CaMKII®)共同染色,以验证细胞类型特异性。或者,可以与抑制神经元或星座标记共同染色,以防这些细胞使用不同的促进剂作为攻击目标。同一动物还对科菲林S3D-HA和CaMKII®进行了共同染色,使注射部位的后部区域更加明显,但运动皮层中仍显示抗HA染色(图2D)。该区域的更高放大图像显示细胞清晰地表达科菲林S3D-HA(亚历克萨氟488, 图2E)和CaMKII®(亚历克萨氟568, 图2F)。科菲林S3D-HA和CaMKII®染色剂的叠加表明,大多数(如果不是全部)细胞染色的科菲林S3D-HA也积极为CaMKII®(图2G)。此观察支持兴奋神经元感染的特异性。
为了评估 cofilin 操纵对 ECoG 活动的影响,ECoG 和 EMG 信号用于对警惕状态(觉醒、慢波睡眠、自相矛盾的睡眠)进行视觉识别。这是在4年代完成的,因为鼠标2的警惕状态迅速变化,在这里,为一个完整的24小时记录。标准分析包括睡眠结构和光谱分析变量的计算,如以前针对不同的数据集 11、12、13、28、34 进行。特别是,对不同状态的 ECoG 信号进行光谱分析,将指标状态组成和质量。例如,为了消除电极不同深度可能产生的差异,可以相对于给定动物所有状态的总功率(图3A)表示光谱分析数据。鉴于 ECoG 活动在高频率下的相对振幅非常低,唤醒、慢波睡眠和自相矛盾睡眠的相对功率光谱已日志转换为更充分的可视化,并同时比较低频和高频的活动。此分析表明在 cofilin 灭活条件下光谱活性的状态特定差异 (图 3B)。更确切地说,这些结合雄性小鼠和雌性小鼠的初步发现指出,在清醒期间和在自相矛盾的睡眠过程中,在慢频(1-4 Hz)中,cofilin灭活显著增加了光谱功率,而在慢波睡眠期间离开ECoG活动则主要不受影响。此外,cofilin 失活似乎增加了 ECoG 活动中的鼠标间变异性(从错误栏中特别明显地注意到图 3B中的觉醒性)。
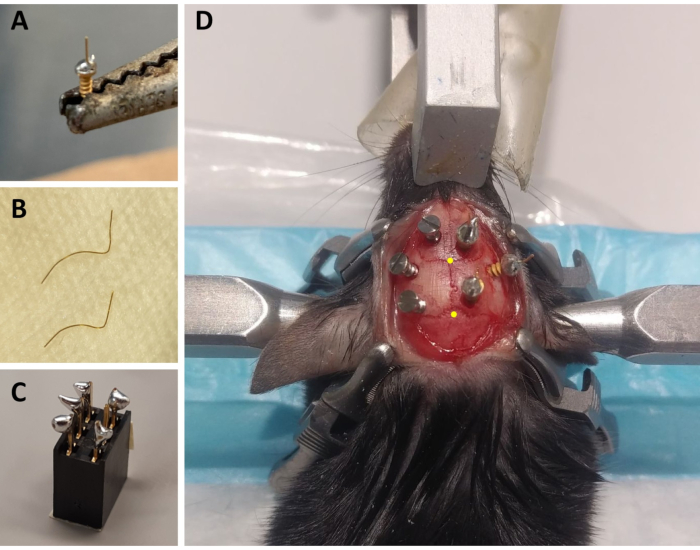
图1:ECoG/EMG蒙太奇组件的制备和ECoG电极放置的代表性示例。(A) ECoG 电极:一条长 4 毫米、直径 0.2 毫米的金丝(非绝缘)融合在无铅焊料的金盖螺丝(1.9 毫米头直径、1.14 毫米螺纹主直径、3.6 mm 总长度)的头部。(B) EMG电极:两根金丝(1.5和2厘米)弯曲,将头骨的曲线拥抱到颈部肌肉,另一端保持直线焊接至连接器。(C) 6 通道连接器:无铅焊接器添加到连接器的 6 个金属销中的 5 个(中间省略一个)(5 毫米 x 8 毫米 x 8 毫米 x 3 毫米金属销)。连接器顶部用胶带覆盖,以避免垃圾/水渗入。(D) 左半球头骨和右半球三个ECoG电极(包括参考电极)的三个维护螺钉的定位示例。ECoG 电极的精确立体定向坐标以第 2.6 步和 3.2 步表示,并且是根据布雷格玛和兰姆达的位置(黄点表示)计算的。缩写:ECoG = 电皮质;EMG = 电图。请单击此处查看此图的较大版本。
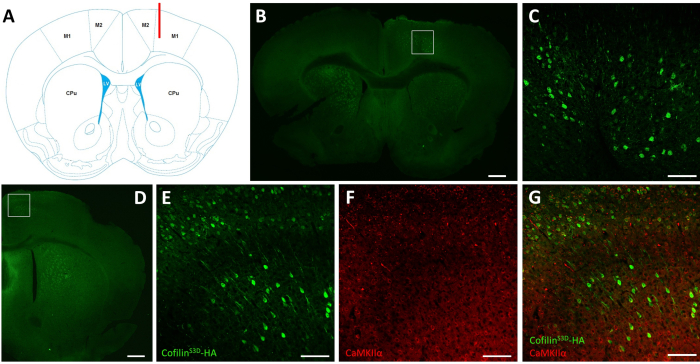
图2:代表免疫染色,以定义AAV感染区和细胞类型。(A) 示意图显示B面板中显示的日冕切片的注射部位。位置是1.1毫米前额的布雷格玛,和管(以红色显示)是针对第五层的权利主运动皮层(M1)。代表修改从富兰克林和帕西诺斯40。(B) 医管局免疫染色,以检测神经元中显示的科菲林S3D-HA表达,用于整个大脑的冠状片,该切片位于布雷格玛前部约1.1毫米处。感染区域主要定位为右主和次级运动皮质(M1 和 M2)的 V 层和 VI 层(外层)。秤杆 = 500 μm。方形表示C(C)中显示的区域 更高的放大度,显示受感染细胞的污渍,并确认在运动皮层的深层中显示科菲林S3D-HA的表达。规模栏 = 100 μm.(D) HA 和 CaMKII® 的联合免疫染色,以评估右半球日冕切片的细胞类型特异性,该切片位于布雷格玛前部约 0.5 毫米,因此,注射部位的后部(与 B 面板和 C 面板中的鼠标相同)。感染区域定位为运动皮质(M1,主要是M2)。秤杆 = 500 μm。该方块表示 E、F 和 G(E)中显示的区域,感染区域的放大倍数更高,显示受感染细胞的染色和确认科菲林S3D-HA的表达。比例杆 = 100 μm.(F) 显示卡姆基®阳性细胞染色的感染区域的更高放大倍数。比例栏 = 100 μm.(G) 感染区域的放大倍数更高,显示科菲林S3D-HA 和 CaMKII® 的联合标签,确认受感染细胞为 CaMKII® 阳性。秤杆 = 100 μm。缩写:AAV = 腺相关病毒;M1 = 主电机皮层;M2 = 辅助电机皮层;CPu = 烧焦的普塔门 (纹状体);LV = 横向心室;哈+血凝素;卡姆基®= 钙/镇静蛋白依赖蛋白激酶IIα。 请单击此处查看此图的较大版本。
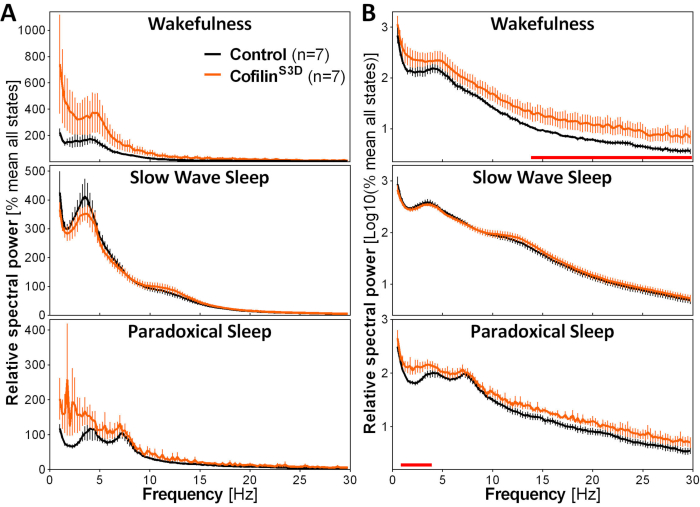
图3:在病毒操纵科菲林功能后获得的觉醒、慢波睡眠和自相矛盾睡眠的代表功率光谱。雄性(每组5~5只)和雌性(每组2只)注射AAV 9-CaMKI®0.4-科菲林S3D-HA(病毒滴答声2.58×1013 GC/mL)或控制A 在电机皮层 V 层的 AAV9-CaMKII®0.4-eGFP 1.25 ×10 13 GC/mL;用于控制此控制 AAV 增强信号的测试滴答声的一半记录为 24 小时, 电皮质信号要经过光谱分析(快速福瑞尔转换,以 0.25-Hz 分辨率计算 0.5 至 30 Hz 之间的光谱功率)。(A) 三个警惕状态期间的功率光谱表示相对于所有州的总功率。(B) 相对功率光谱日志转换为更充分地表示更高频率的组差异。使用 AAV9-CaMKI®0.4-科菲林S3D-HA 抑制运动皮层中的铜蛋白活动显著增加在唤醒期间测试版范围内 (14-30 Hz) 中的电皮质活动, 与对照注射相比,在自相矛盾的睡眠期间(1-4 Hz)的三角洲范围(x轴上方的红线表示曼-惠特尼U-测试频段功率p<0.05)。缩写: AAV = 腺相关病毒 GC = 基因组副本;哈+血凝素;CamKI+= 钙/镇静蛋白依赖蛋白激酶IIα;eGFP = 增强型绿色荧光蛋白。请单击此处查看此图的较大版本。
讨论
该协议描述了一种精确而直接的方法,在使用 AAV 操作分子目标时监控 ECoG 和 EMG 活动。为了进行充分的组间比较,强烈建议在测试和控制动物的同一天始终计划外科手术(AAV注射和电极植入),并同时记录其电生理信号。为了在测试和控制动物之间获得类似的病毒表达,注射相同的病毒滴答声是可取的。在本例中,控制 AAV 的病毒滴答声已减少到测试 AAV 的一半,以确保类似的病毒表达。实验者应该非常小心地测量立体定向坐标,以确保在大脑区域/皮质层靶点的低动物间变异性。此外,鉴于注射深度是从头骨表面计算的,而且头骨厚度随年龄和性别而变化,因此应始终使用协议后组织学或免疫造血术(如 图2)验证管位,以确保注射的充分定位/深度,必要时应调整立体定向坐标。在整个 40 分钟的 AAV 注射过程中,监控注射速度以快速检测和纠正泵阻塞等潜在问题非常重要。一些实验步骤对于获得最佳的电生理信号也至关重要。例如,在电极植入过程中不要过度拧干:螺丝应坚持出头骨至少2.5毫米,以尽量减少对大脑皮层的损害和胶质疤痕的形成。之后,避免将水泥涂在电极的四肢上也非常重要,ii) 确保电极快速焊接到连接器上,iii) 确保电极之间没有接触。
这里介绍的ECoG和EMG记录程序是非常成熟,简单,并广泛用于监测唤醒和睡眠的小鼠2,11,13,34。连续的 ECoG 和 EMG 录音可以连续执行几天(甚至数周),并生成非常丰富的数据集,可用于执行多个分析行,包括与觉醒和睡眠量相关的变量和架构 2、11、12(例如,每个光和暗时期在不同状态下花费的时间、每个状态的情节数、 24小时睡眠分布)、觉醒和睡眠光谱含量34、41(例如,不同频段的功率[类似于图3],无尺度活动),以及单波42、43、44(例如慢波振幅和坡度)的特征。当与 AAV 介质分子操作相结合时,另一个优势是避免了转基因动物中可能发生的潜在发育补偿。通过练习,整个过程,包括40分钟的AAV注射,可以在大约90分钟内完成。死亡率应该(非常)低,因为手术是微创的。
同时使用 ECoG/EMG 记录和 AAV 进行定向操作,提供了各种其他优势和应用。例如,立体定向目标的精度,当充分执行时,是非常高和可复制的,有助于确定给定的大脑区域(和/或区域内的细胞类型或分子元素)在调节睡眠或其他生理过程中的具体作用。因此,使用当前协议的适应,可以轻松地瞄准几个不同的皮质区域。此外,使用 AAV 的目标操作可以定向到与 ECoG 记录站点不同的皮质/皮下区域。在这种情况下,AAV 注射的毛刺孔可以用牙科水泥(或骨蜡)固定的小玻璃盖片覆盖。为了增强特异性,AAV 结构通常包括一个促进器,允许精确细胞类型14的定向感染。在本协议中,使用CamKII®促进器专门瞄准运动皮层的兴奋金字塔细胞14、29、45。该策略使焦精(使用科菲林S3D)32,33在运动皮层的兴奋神经元和观察ECoG活动状态特定的变化(图3)的灭活性。为了评估感染/转导功效,未来的协议用户可以将呈现的 AAV-ECoG 协议与免疫荧光共染的方案相结合,并使用高放大倍率图像计算显示目标单标签的细胞总数中的双标签细胞数量(这里,CaMKII® 表达神经元)。在最近的一项研究中,AAV-ECoG方法与这里描述的方法类似,它使用含有突触促进器的AAV在运动皮层的所有神经元中过度表达脆弱的X智力迟钝综合征相关蛋白质1(FXR1),并揭示了这种操作对警惕状态分布和光谱含量的影响28。这些发现说明了使用 AAV 在目标大脑区域操纵给定分子如何揭示特定觉醒/睡眠参数调节中的作用。
所述协议的一个限制是脑组织在进行 AAV 注射之前与管子放置发生的小病变,这也可能伴有炎症反应。在皮下区域进行 AAV 注射时,这可能特别令人关注,并且应始终使用适当的控制来解决。或者,在目前的协议之后,可以量化活性胶质疏松和/或微胶质活化(例如,使用免疫荧光),以确保控制和测试组的类似水平,因此,在ECoG读数上。第二个限制与电极和连接器之间连接不良的风险有关,这可能导致持续或偶尔的坏电生理信号。固体拧紧、焊接和粘固电极将最大限度地减少此问题的发生率。第三个限制与动物在录音过程中通过头部蒙太奇系绳有关,这可能会限制运动和其他行为,至少在一定程度上,偶尔会导致布线损坏和信号丢失。最后,鉴于年轻动物的头骨大小可能会在安装描绘的头蒙太奇时出现困难,因此所呈现的协议更适合成年小鼠,如前2所述。
ECoG/EMG 记录和 AAV 介于精确目标的操纵相结合也适用于睡眠神经科学以外的研究领域。除其他外,它可以用来研究和操纵癫痫发作模型中的癫痫事件,是调节大脑振荡涉及记忆编码和巩固的有力工具46,47。因此,潜在的应用当然包括精神病学和神经学的基础研究领域,包括神经退行性疾病。除了表达分子非活动形式的能力外,AAV 还可以而且已经用于过度表达或降低调节(例如,小干扰RNA、CRISPR/Cas9)或拯救全身 KO 中分子的表达。重要的是,目前协议的双重方法也适用于其他哺乳动物物种,如大鼠和日间啮齿动物,代表有趣的模型,以了解睡眠和神经退化48,49。
披露声明
作者没有什么可透露的。
致谢
这项工作由加拿大睡眠分子生理学研究主席资助。作者感谢克洛埃·普罗沃斯特和卡罗琳·布查德的技术帮助。
材料
| Name | Company | Catalog Number | Comments |
| Surgery peparation | |||
| 21 G needle | Terumo | NN-2125R | |
| 6-channel connector | ENA AG | BPHF2-O6S-E-3.2 | Connector used in this manuscript, but discontinued. See potential replacement below |
| Distrelec | 300-93-672 | Potential replacement for discontinued connector above | |
| C57BL6/J mice | Jackson Laboratory | 000664 | B6 | Animals bred on site |
| Pluronic F-68 | Non-ionic surfactant | ||
| Gold wire 0.2 mm diameter | Delta scientific | 920-862-41 | Non-insulated |
| Hamilton syringe (10 μL) | Fisher Scientific | 14815279 | |
| Infusion syringe Pump CMA 402 | Harvard Apparatus | CMA8003110 | |
| Injection cannula 28 G | Plastics one | C313l-SPCL | |
| Isoflurane | Baxter | CA2L9100 | |
| Ketamine (10 mg/mL) | SANDOZ | 4550 | |
| Lead-free solder | AIM | SN100C | |
| Lubricating ophthalmic ointment | ALLERGAN | 210889 | |
| PE 50 Catheter thin wall | Plastics one | C232CT | |
| Flat fillister head self tapping screws | MORRIS | FF00CE125 | ECoG electrode gold covered; Dimension : 1.9 mm head diameter, 1.14 mm thread major diameter, 3.6 mm length |
| Soldering iron | Weller | WES51 | |
| Syringe 1 mL | BD | 309659 | |
| Trimmer | Harvard Apparatus | 72-9063 | |
| Xylazine (20 mg/mL) | Bayer | 2169592 | |
| Intracortical AAV injection with syringe pump | |||
| 0.7 mm drill bit | Dremel | 628 | |
| AAV9-CaMKIIα0.4-cofilinS3D-HA | UPenn Viral Core | ||
| AAV9-CaMKIIα0.4-eGFP | UPenn Viral Core | ||
| Cotton tippped applicators | Medicom | 806 | |
| Drill | Dremel | 8050-N/18 | |
| Extra-fine Graefe forceps | Fine science tools | 11150-10 | |
| Stereotaxic arm | Stoelting | 51604U | |
| Stereotaxic frame | Stoelting | 51600 | |
| Surgical clamps | Fine science tools | 18050-28 | |
| Tissue scissor | Magna Stainless | M4-124 | |
| ECoG/EMG electrode implantation | |||
| Buprenorphine (0.3 mg/mL) | CEVA | 57133-02 | |
| Curved forceps | Fine science tools | 11001-12 | |
| Delicate task wipers | Kimtech | 34120 | |
| Dental acrylic cement | Yates Motloid | 44115 | |
| Dumont #5 forceps | Fine science tools | 91150-20 | |
| Extra fine Graefe forceps | Fine science tools | 11150-10 | |
| Kelly forceps | Fine science tools | 13002-10 | |
| Liquid acrylic | Yates Motloid | 44119 | |
| Monocryl plus suture needle 13 mm 3/8c rev cutting | Ethicon | MCP494 | |
| Providone-iodine 10% | Triad disposables | 10-8208 | |
| RelyX Unicem 2, Adhesive Resin Cement A2 | 3M | 56849 | |
| Immunofluorescence and ECoG recording | |||
| 36-Channel EEG Wearable Headbox | LaMONT Medical | 832-000350 | |
| CaMKII alpha Monoclonal Antibody (Cba-2) | Invitrogen | 13-7300 | Dilution 1:500 |
| Conductors Awg PVC Insulation Cable | Calmont Wire & Cables | HC-0819075R0 | |
| Donkey anti-Mouse IgG secondary Ab, Alexa Fluor 568 | Invitrogen | A10037 | Dilution 1:1000 |
| Goat anti-Rabbit IgG secondary Ab, Alexa Fluor 488 | Invitrogen | A-11008 | Dilution 1:500 |
| HA-Tag (C29F4) Rabbit mAb | Cell signaling | 3724 | Dilution 1:800 |
| Programmable Amplifier | LaMONT Medical | 815-000002-S2 | |
| Stellate Harmonie | Natus | HSYS-REC-LT2 | |
| Swivel connector | Crist Instrument Company Inc. | 4-TBC-9-S |
参考文献
- Campbell, I. G. EEG recording and analysis for sleep research. Current Protocols in Neuroscience. , (2009).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Current Protocols in Mouse Biology. 2 (1), 55-74 (2012).
- Bastien, C. H., et al. Insomnia and sleep misperception. Pathologie Biologie. 62 (5), 241-251 (2014).
- Malafeev, A., et al. Automatic artefact detection in single-channel sleep EEG recordings. Journal of Sleep Research. 28 (2), 12679 (2019).
- Latreille, V., et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease. Brain. 139, 1189-1199 (2016).
- Rodrigues Brazete, J., et al. Electroencephalogram slowing predicts neurodegeneration in rapid eye movement sleep behavior disorder. Neurobiology of Aging. 37, 74-81 (2016).
- Kent, B. A., Strittmatter, S. M., Nygaard, H. B. Sleep and EEG power spectral analysis in three transgenic mouse models of Alzheimer's disease: APP/PS1, 3xTgAD, and Tg2576. Journal of Alzheimers Disease. 64 (4), 1325-1336 (2018).
- Chang, A. M., et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiology International. 33 (5), 561-573 (2016).
- Shi, G., Wu, D., Ptacek, L. J., Fu, Y. H. Human genetics and sleep behavior. Current Opinion in Neurobiology. 44, 43-49 (2017).
- Nakai, Y., et al. Calcineurin and its regulator sra/DSCR1 are essential for sleep in Drosophila. Journal of Neuroscience. 31 (36), 12759-12766 (2011).
- El Helou, J., et al. Neuroligin-1 links neuronal activity to sleep-wake regulation. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9974-9979 (2013).
- Freyburger, M., et al. EphA4 is involved in sleep regulation but not in the electrophysiological response to sleep deprivation. Sleep. 39 (3), 613-624 (2016).
- Seok, B. S., et al. The effect of Neuroligin-2 absence on sleep architecture and electroencephalographic activity in mice. Molecular Brain. 11 (1), 52 (2018).
- Haery, L., et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation. Frontiers in Neuroanatomy. 13, 93 (2019).
- Schmidt, F., Grimm, D. CRISPR genome engineering and viral gene delivery: a case of mutual attraction. Biotechnology Journal. 10 (2), 258-272 (2015).
- Wang, D., Zhang, F., Gao, G. CRISPR-based therapeutic genome editing: strategies and in vivo delivery by AAV vectors. Cell. 181 (1), 136-150 (2020).
- Havekes, R., et al. Transiently increasing cAMP levels selectively in hippocampal excitatory neurons during sleep deprivation prevents memory deficits caused by sleep loss. Journal of Neuroscience. 34 (47), 15715-15721 (2014).
- Fuller, P. M., Yamanaka, A., Lazarus, M. How genetically engineered systems are helping to define, and in some cases redefine, the neurobiological basis of sleep and wake. Temperature. 2 (3), 406-417 (2015).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ono, D., Yamanaka, A. Hypothalamic regulation of the sleep/wake cycle. Neuroscience Research. 118, 74-81 (2017).
- Shiromani, P. J., Peever, J. H. New neuroscience tools that are identifying the sleep-wake circuit. Sleep. 40 (4), 032 (2017).
- Oishi, N., et al. Artificial association of memory events by optogenetic stimulation of hippocampal CA3 cell ensembles. Molecular Brain. 12 (1), 2 (2019).
- Anaclet, C., et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control. Journal of Neuroscience. 38 (22), 5168-5181 (2018).
- Chen, K. S., et al. A hypothalamic switch for REM and non-REM sleep. Neuron. 97 (5), 1168-1176 (2018).
- Torontali, Z. A., Fraigne, J. J., Sanghera, P., Horner, R., Peever, J. The sublaterodorsal tegmental nucleus functions to couple brain state and motor activity during REM sleep and wakefulness. Current Biology. 29 (22), 3803-3813 (2019).
- Rolls, A., et al. Optogenetic disruption of sleep continuity impairs memory consolidation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13305-13310 (2011).
- Ognjanovski, N., Broussard, C., Zochowski, M., Aton, S. J. Hippocampal network oscillations rescue memory consolidation deficits caused by sleep loss. Cerebral Cortex. 28 (10), 3711-3723 (2018).
- Khlghatyan, J., et al. Fxr1 regulates sleep and synaptic homeostasis. EMBO Journal. 39 (21), 103864 (2020).
- Havekes, R., et al. Sleep deprivation causes memory deficits by negatively impacting neuronal connectivity in hippocampal area CA1. Elife. 5, 13424 (2016).
- Wong, L. W., Tann, J. Y., Ibanez, C. F., Sajikumar, S. The p75 neurotrophin receptor is an essential mediator of impairments in hippocampal-dependent associative plasticity and memory induced by sleep deprivation. Journal of Neuroscience. 39 (28), 5452-5465 (2019).
- Mizuno, K. Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular Signalling. 25 (2), 457-469 (2013).
- Nagaoka, R., Abe, H., Obinata, T. Site-directed mutagenesis of the phosphorylation site of cofilin: its role in cofilin-actin interaction and cytoplasmic localization. Cell Motility and the Cytoskeleton. 35 (3), 200-209 (1996).
- Elam, W. A., et al. Phosphomimetic S3D cofilin binds but only weakly severs actin filaments. Journal of Biological Chemistry. 292 (48), 19565-19579 (2017).
- Areal, C. C., Cao, R., Sonenberg, N., Mongrain, V. Wakefulness/sleep architecture and electroencephalographic activity in mice lacking the translational repressor 4E-BP1 or 4E-BP2. Sleep. 43 (2), (2020).
- Vyazovskiy, V., Borbely, A. A., Tobler, I. Unilateral vibrissae stimulation during waking induces interhemispheric EEG asymmetry during subsequent sleep in the rat. Journal of Sleep Research. 9 (4), 367-371 (2000).
- Sitnikova, E. Neonatal sensory deprivation promotes development of absence seizures in adult rats with genetic predisposition to epilepsy. Brain Research. 1377, 109-118 (2011).
- Tudor, J. C., et al. Sleep deprivation impairs memory by attenuating mTORC1-dependent protein synthesis. Science Signaling. 9 (425), 41 (2016).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293 (2015).
- Dufort-Gervais, J., et al. Neuroligin-1 is altered in the hippocampus of Alzheimer's disease patients and mouse models, and modulates the toxicity of amyloid-beta oligomers. Scientific Reports. 10 (1), 6956 (2020).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates, Third edition. , (2007).
- Lina, J. M., O'Callaghan, E. K., Mongrain, V. Scale-free dynamics of the mouse wakefulness and sleep electroencephalogram quantified using Wavelet-Leaders. Clocks & Sleep. 1 (1), 50-64 (2019).
- Massart, R., et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes. Translational Psychiatry. 4, 347 (2014).
- Freyburger, M., Poirier, G., Carrier, J., Mongrain, V. Shorter duration of non-rapid eye movement sleep slow waves in EphA4 knockout mice. Journal of Sleep Research. 26 (5), 539-546 (2017).
- Hubbard, J., et al. Rapid fast-delta decay following prolonged wakefulness marks a phase of wake-inertia in NREM sleep. Nature Communications. 11 (1), 3130 (2020).
- Johansen, J. P., et al. Optical activation of lateral amygdala pyramidal cells instructs associative fear learning. Proceedings of the National Academy of Sciences of the United States of America. 107 (28), 12692-12697 (2010).
- Boyce, R., Glasgow, S. D., Williams, S., Adamantidis, A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science. 352 (6287), 812-816 (2016).
- Bandarabadi, M., et al. Dynamic modulation of theta-gamma coupling during rapid eye movement sleep. Sleep. 42 (12), 182 (2019).
- Estrada, C., et al. Transcranial magnetic stimulation and aging: Effects on spatial learning and memory after sleep deprivation in Octodon degus. Neurobiology of Learning and Memory. 125, 274-281 (2015).
- Hurley, M. J., et al. The long-lived Octodon degus as a rodent drug discovery model for Alzheimer's and other age-related diseases. Pharmacology & Therapeutics. 188, 36-44 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。