Method Article
Enregistrement électrocorticographique des zones du cortex cérébral manipulées à l’aide d’un virus adéno-associé ciblant la cofiline chez la souris
Dans cet article
Résumé
Cet article décrit un protocole pour la manipulation de cibles moléculaires dans le cortex cérébral à l’aide de virus adéno-associés et pour surveiller les effets de cette manipulation pendant l’éveil et le sommeil à l’aide d’enregistrements électrocorticographiques.
Résumé
L’utilisation d’enregistrements électrocorticographiques (ECoG) chez les rongeurs est pertinente pour la recherche sur le sommeil et pour l’étude d’un large éventail de maladies neurologiques. Les virus adéno-associés (AAV) sont de plus en plus utilisés pour améliorer la compréhension des circuits cérébraux et de leurs fonctions. La manipulation médiée par l’AAV de populations cellulaires spécifiques et/ ou de composants moléculaires précis a été extrêmement utile pour identifier de nouveaux circuits/molécules régulateurs du sommeil et des protéines clés contribuant aux effets néfastes de la perte de sommeil. Par exemple, l’inhibition de l’activité de la cofiline, une protéine filamenteuse coupant l’actine, à l’aide d’AAV, prévient les troubles de la mémoire induits par la privation de sommeil. Ici, un protocole est décrit qui combine la manipulation de la fonction de cofiline dans une zone du cortex cérébral avec l’enregistrement de l’activité ECoG pour examiner si la cofiline corticale module les signaux ECoG d’éveil et de sommeil. L’injection d’AAV est effectuée au cours de la même intervention chirurgicale que l’implantation d’électrodes ECoG et électromyographiques (EMG) chez des souris mâles et femelles adultes. Les souris sont anesthésisées et leur tête est rasée. Après le nettoyage de la peau et l’incision, les coordonnées stéréotaxiques du cortex moteur sont déterminées et le crâne est percé à cet endroit. Une canule préremplie avec un AAV exprimant la cofilineS3D,une forme inactive de cofiline, est lentement positionnée dans le tissu cortical. Après l’infusion d’AAV, des vis recouvertes d’or (électrodes ECoG) sont vissées à travers le crâne et cimentées au crâne avec des fils d’or insérés dans les muscles du cou (électrodes EMG). Les animaux ont droit à trois semaines pour récupérer et assurer une expression suffisante de la cofilineS3D. La zone infectée et le type de cellule sont vérifiés à l’aide de l’immunohistochimie, et l’ECoG est analysé à l’aide de l’identification visuelle des états de vigilance et de l’analyse spectrale. En résumé, cette approche méthodologique combinée permet d’enquêter sur la contribution précise des composants moléculaires régulant la morphologie neuronale et la connectivité à la régulation de l’activité synchronisée du cortex cérébral pendant l’éveil et le sommeil.
Introduction
Les enregistrements électroencéphalographiques (ou généralement électrocorticographiques [ECoG] chez les rongeurs) et électromyographiques (EMG) sont largement utilisés dans la recherche sur le sommeil ainsi que plus largement dans les neurosciences, la neurologie et la psychiatrie. En combinaison, ces signaux électrophysiologiques permettent l’identification des états de vigilance et la quantification ultérieure de la durée de l’état et de la composition spectrale, tant chez l’homme que chez les rongeurs1,2,3,4. Une telle quantification a été utile pour comprendre comment le sommeil est modifié dans des conditions pathologiques telles que les maladies neurodégénératives et les modèles5,6,7 ou par modification génétique8,9. Par exemple, il a été démontré que le knockout (KO) de différents gènes liés à la communication neuronale modifiait la durée de l’éveil et du sommeil chez la souris et la mouche des fruits10,11,12,13. Pour s’attaquer à la compensation développementale potentielle découlant de l’étude de l’KO du corps entier chez les rongeurs et pour permettre un contrôle plus fin de la manipulation génétique, un moyen efficace de manipuler l’expression des gènes consiste à utiliser des virus adéno-associés (AAV). Une manipulation génétique médiée par l’AAV peut être utilisée pour régularier à la baisse ou à la hausse une cible moléculaire donnée et pour limiter la manipulation à une population cellulaire spécifique en utilisant différents types de promoteurs14. Les AAV sont également largement utilisés comme méthode d’administration dans la technologie CRISPR (Clustered Regularly Interspaced short palindromic repeats)/Cas915,16. Ces méthodologies permettent un meilleur contrôle temporel et spatial de la manipulation génétique, qui est généralement associée à l’expression d’un rapporteur permettant la quantification de la zone infectée par immunofluorescence.
Les AAV représentent également le principal vecteur de manipulations spécifiques au type cellulaire de l’activité neuronale via l’optogénétique et la chimiogénétique17,18,19, qui ont été largement utilisées dans des recherches récentes sur les maladies neurodégénératives, le comportement, la cognition et le sommeil20,21,22. Dans la recherche sur le sommeil, l’application de l’optogénétique pour l’activation ou l’inhibition de certaines régions du cerveau, telles que le cerveau antérieur basal, l’hypothalamus et le tegmentum sous-latéral, a été utile pour déterminer leurs rôles dans le contrôle de l’excitation, du sommeil à ondes lentes (également connu sous le nom de sommeil à mouvement oculaire non rapide), du sommeil paradoxal (ou sommeil à mouvement oculaire rapide) et de la cataplexie23, 24,25. En outre, les manipulations médiées par l’AAV ont permis d’élucider d’importants circuits de régulation du sommeil et des molécules contribuant aux effets néfastes de la perte de sommeil26,27,28. Par exemple, une protéine qui s’est avérée impliquée dans les troubles de la mémoire induits par la privation de sommeil est la cofiline29,30. Cette protéine est une protéine filamenteuse coupant l’actine qui participe à la réorganisation des filaments d’actine en se liant physiquement à l’actine et en favorisant le désassemblage des filaments de manière dynamique31. Il a été démontré que l’inhibition de l’activité de la cofiline à l’aide d’une approche médiée par l’AAV prévient la perte de colonne vertébrale ainsi que la plasticité synaptique et les déficits de mémoire induits par la privation de sommeil chez la souris29. Collectivement, ces études soulignent l’utilité et la pertinence des manipulations médiées par l’AAV pour comprendre la régulation du sommeil et les conséquences de la privation de sommeil chez les rongeurs.
Ici, un protocole est décrit qui combine l’implantation et l’enregistrement d’électrodes ECoG et EMG avec la manipulation de la fonction cofiline dans une zone du cortex cérébral de souris de type sauvage (WT) à l’aide d’un AAV. Plus précisément, un AAV (sérotype 9) exprimant la séquence codante d’une forme phosphomimétique de la cofiline de souris (cofilineS3D),la rendant inactive32,33,est injecté dans le cortex moteur (M1 et M2). Une électrode ECoG est implantée directement sur le site d’injection pour assurer l’enregistrement de l’activité corticale synchronisée des cellules infectées. L’enregistrement ECoG/EMG est effectué pendant 24 heures dans des conditions non perturbées trois semaines après la chirurgie pour permettre la récupération, l’adaptation et l’expression élevée de cofilineS3D. L’enregistrement est ensuite utilisé pour l’identification des états de vigilance et l’analyse spectrale ECoG, comme décrit dans les études précédentes11,34. Cette méthodologie peut révéler spécifiquement comment la cofiline corticale module les signaux ECoG de l’éveil et du sommeil chez la souris. Cette combinaison d’enregistrements électrophysiologiques et de manipulation génétique médiée par l’AAV est particulièrement pertinente pour étudier les rôles de divers éléments moléculaires dans des fonctions cérébrales spécifiques et pourrait être appliquée à des zones cérébrales corticales (et sous-corticales) d’intérêt chez les souris WT et génétiquement modifiées des deux sexes et même d’autres espèces.
Protocole
Toutes les méthodes ont été approuvées par le Comité d’éthique de l’expérimentation animale de la Recherche CIUSSS-NIM et sont conformes aux lignes directrices du Conseil canadien des soins aux animaux. Voir le Tableau des matériaux pour les réactifs, l’équipement et les matériaux utilisés dans ce protocole.
1. Préparation chirurgicale
- Préparation des électrodes ECoG et EMG
- Pour chaque animal, préparez trois électrodes ECoG : à l’aide d’un fer à souder, placez une petite goutte de soudure sans plomb sur le bouchon à vis d’une vis recouverte d’or et soudez un fil d’or de 4 mm de long et de 0,2 mm de diamètre (non isolé) sur le dessus du bouchon à vis à l’aide de la soudure sans plomb (Figure 1A). Préparez 2 électrodes avec le fil d’or droit vers le haut, et une avec un angle de 45 ° par rapport à la verticale.
- Pour chaque animal, préparez deux électrodes EMG : coupez un fil d’or de 0,2 mm de diamètre sur une longueur de 1,5 cm et un second sur 2 cm. Courbez les deux fils pour qu’ils embrassent la courbe du crâne jusqu’aux muscles du cou, en gardant une extrémité droite qui sera soudée au connecteur (Figure 1B).
- Pour chaque animal, préparez un connecteur : utilisez un connecteur à 6 canaux (5 mm x 8 mm x 8 mm + broches métalliques de 3 mm) et ajoutez une soudure sans plomb à 5 des 6 broches métalliques (en omettant une broche du milieu; Figure 1C). Couvrez le haut du connecteur avec du ruban adhésif pour éviter les déchets ou les infiltrations d’eau.
- Préparation des AAV et de la pompe à seringue
- Préparer l’AAV d’essai(ici, AAV 9-CaMKIIα0.4-cofilineS3D-HA)et/ou l’AAV témoin (ici, AAV 9-CaMKIIα0.4-eGFP) en diluant le(s) mélange(s) d’AAV d’origine (ici, AAV dans une solution de solution saline tamponnée au phosphate contenant un tensioactif non ionique [0,001%]) avec une solution saline stérile pour obtenir le titre viral souhaité (généralement10 copies du génome 12-13 [GC]/mL) et le volume requis pour le nombre de souris à traiter.
REMARQUE: Un volume injecté de 1 μL par zone corticale par souris nécessite la préparation de 2 μL. - Fixez une seringue de 10 μL à une pompe à seringue et remplissez-la d’eau distillée.
- Remplissez un tube PE50 d’environ 60 cm de longueur avec de l’eau distillée à l’aide d’une seringue de 1 mL et d’une aiguille de 21 G. Il est important de laisser l’aiguille et la seringue 21G en place après le remplissage. Connectez le tube PE50 à la pompe à seringue; laisser l’aiguille/seringue de 21 G à une extrémité du tube PE50 et raccorder l’autre extrémité à la seringue de 10 μL.
- Une fois le tube fixé à la seringue de 10 μL, retirez l’aiguille à l’autre extrémité et poussez le piston de la seringue de 10 μL pour combler l’espace laissé par l’aiguille avec de l’eau.
REMARQUE: Assurez-vous qu’il n’y a pas de bulle d’air et que le tube est complètement rempli d’eau. - Installez une canule de 28 G à l’extrémité du tube où l’aiguille a été retirée. Poussez l’eau dans la canule avec la seringue de 10 μL pour la remplir complètement. Fixez fermement la canule au bras stéréotaxique.
- Préparer l’AAV d’essai(ici, AAV 9-CaMKIIα0.4-cofilineS3D-HA)et/ou l’AAV témoin (ici, AAV 9-CaMKIIα0.4-eGFP) en diluant le(s) mélange(s) d’AAV d’origine (ici, AAV dans une solution de solution saline tamponnée au phosphate contenant un tensioactif non ionique [0,001%]) avec une solution saline stérile pour obtenir le titre viral souhaité (généralement10 copies du génome 12-13 [GC]/mL) et le volume requis pour le nombre de souris à traiter.
- Préparation des animaux
REMARQUE: Les souris mâles et femelles C57BL6 / J âgées d’environ 12 semaines ont déjà été adaptées pendant au moins 2 semaines pour loger dans des cages individuelles et à un cycle d’obscurité de 12 h: 12 heures avec de la nourriture et de l’eau ad libitum et l’accès à un cube en bois.- Peser soigneusement les souris et injecter par voie intrapéritonéale un mélange de kétamine/xylazine (120/10 mg/kg) pour l’anesthésie. Attendez environ 10 minutes pour une anesthésie profonde.
- Rasez les cheveux de l’arrière des oreilles à l’avant de la tête entre les yeux à l’aide d’une tondeuse à cheveux.
REMARQUE: Faites très attention à ne pas couper les moustaches (protégez les moustaches avec un doigt pendant le rasage) car la coupe des moustaches modifiera les entrées sensorielles et l’activité ECoG35,36. - Ajoutez une goutte généreuse de pommade ophtalmique sur chaque œil pour prévenir la déshydratation. Vérifiez régulièrement la profondeur de l’anesthésie pendant la procédure en pinçant un orteil de la patte postérieure. Fournir à la souris 0,5-1,5% d’isoflurane pour assurer une anesthésie profonde si un réflexe de pincement des orteils apparaît.
2. Injection intracorticale d’AAV avec une pompe à seringue
REMARQUE: Effectuez toutes les étapes suivantes avec des instruments stérilisés et dans un environnement propre. Utilisez de l’éthanol à 70 % pour laver davantage les instruments stérilisés et pour laver les électrodes préparées à la section 1.1 ainsi que les vis d’ancrage (vis non recouvertes d’or) avant de commencer la chirurgie.
- Fixez soigneusement la tête de la souris sur l’appareil stéréotaxique avec des barres d’oreille.
REMARQUE: Assurez-vous que la tête ne bouge pas latéralement. - Tirez doucement la langue de l’animal hors de la bouche pour éviter la suffocation et fixez le nez de la souris avec l’adaptateur stéréotaxique.
REMARQUE: Surveillez la respiration fréquemment pendant la procédure. - Stérilisez la zone rasée de la tête avec 70% d’éthanol et en tenant la peau avec une pince Graefe extra fine, coupez la peau de la base des oreilles au niveau des yeux avec des ciseaux à tissu. Utilisez quatre pinces chirurgicales pour étirer la peau et exposer le crâne (deux de chaque côté de l’incision; voir la figure 1D).
- Grattez la surface du crâne avec une pointe de ciseaux pointue: tout en évitant les sutures osseuses, retirez le périoste et créez des stries qui se chevauchent dans deux directions ou plus. Retirez les fragments d’os et séchez le crâne avec 70% d’éthanol.
REMARQUE: Les rayures et les stries aideront à rendre le montage d’enregistrement plus robuste en améliorant l’adhérence du ciment au crâne (voir ci-dessous). - Avec la canule fixée au bras stéréotaxique, identifiez l’emplacement du bregma (c.-à-d. l’intersection entre les sutures coronale et sagittale du crâne; Figure 1D) et lambda (c.-à-d. l’intersection entre la suture sagittale du crâne et une ligne droite reliant la suture lambdoïde gauche et droite; Figure 1D), et notez les coordonnées stéréotaxiques de chacun. Si la différence entre les coordonnées z (axe vertical) du bregma et du lambda est supérieure à 0,3 mm, ajustez la hauteur du nez à l’aide de l’adaptateur stéréotaxique jusqu’à ce que la position z de bregma et lambda soit alignée.
- Marquez la position de la canule sur le crâne avec un stylo à ces coordonnées (cortex moteur) : 1,5 mm latéral droit à médian et 1,5 mm antérieur à bregma. Percez soigneusement le crâne à la position de la canule avec un foret de 0,7 mm dans une direction perpendiculaire à la surface du crâne (alignée avec l’axe vertical). Lavez le crâne percé avec une pointe de coton stérile imprégnée d’une solution de providone-iode à 10%.
- Chargez la canule avec une bulle d’air de 1 μL en tirant le piston de la seringue de 10 μL vers l’arrière de 1 μL. Chargez l’AAV d’essai (ici AAV 9-CaMKIIα0.4-CofilinS3D-HA)ou l’AAV de contrôle (ici AAV9-CaMKIIα0.4-eGFP)dans la canule préalablement chargée avec la bulle d’air : mélanger l’AAV en pipetant lentement de haut en bas, pipeter 1,7 μL sur une boîte de Petri stérile, et aspirer 1,5 μL de la solution dans la canule en tirant lentement le piston de la seringue de 10 μL. Marquez la position de la bulle d’air sur le tube PE50 pour permettre le suivi de l’injection.
- Alignez la canule avec le trou sur le crâne pour que la position verticale de la canule atteigne le bord supérieur du crâne (c.-à-d. la surface du crâne). À partir de la surface du crâne, abaissez lentement la canule de 1,5 mm (pour atteindre 1,5 mm sous la surface du crâne et la couche V du cortex moteur).
REMARQUE: Faites très attention à ne pas trop abaisser la canule pour éviter une lésion inutile du tissu cérébral. - Démarrez la pompe à seringue pour injecter 1 μL d’AAV sur une durée de 40 min (vitesse : 0,025 μL/min pour minimiser les lésions tissulaires). Gardez une trace de l’injection sur le tube PE50 avec le mouvement de la bulle d’air et effectuez des ajustements si nécessaire.
- Une fois l’injection terminée, laissez la canule en place pendant 5 minutes pour assurer une diffusion suffisante et éviter les refoulements. Ensuite, soulevez lentement et soigneusement le bras stéréotaxique pour retirer la canule du cortex.
3. Implantation d’électrodes ECoG/EMG
- À l’aide de pinces Kelly droites, vissez lentement une électrode ECoG (avec un fil d’or droit) dans l’axe vertical (même angle que le trou a été percé) dans le trou où l’AAV a été injecté. Laisser au moins 2,5 mm de la vis hors du crâne pour minimiser les dommages à la dura et au cortex cérébral (c.-à-d. pour une profondeur approximative de 1,1 mm de la surface du crâne; Figure 1D).
- Marquez la position de l’électrode ECoG postérieure et de l’électrode de référence sur le crâne avec un stylo à ces coordonnées : électrode postérieure (cortex visuel) 1,5 mm latérale droite à médiane et 1,5 mm antérieure à lambda, électrode de référence (cortex somatosensoriel) 2,6 mm latérale droite à médiane et 0,7 mm postérieure à bregma. Marquez également la position de trois vis de maintenance (agissant comme des ancrages entre le crâne et le ciment dentaire pour solidifier le montage de la tête) sur l’hémisphère gauche sans coordonnées spécifiques, mais aussi éloignées que possible les unes des autres et des électrodes ECoG.
- Percez soigneusement le crâne à la position marquée des autres électrodes et des vis d’ancrage avec le foret de 0,7 mm. Percer dans une direction perpendiculaire à la surface du crâne pour chaque vis (c.-à-d. axe vertical pour l’électrode postérieure, mais avec un angle par rapport à l’axe vertical pour les autres sites). Lavez le crâne percé avec une solution de providone-iode à 10% et bloquez les trous avec de petits essuie-glaces roulés avant d’installer les vis pour éviter les saignements et la contamination.
- À l’aide des pinces Kelly droites, vissez les vis d’entretien dans l’hémisphère gauche, puis vissez les deux dernières électrodes dans l’hémisphère droit. Assurez-vous de visser avec le même angle que les trous ont été percés et de laisser au moins 2,5 mm de chaque vis hors du crâne (Figure 1D).
REMARQUE: Pour maximiser la solidité du montage final et la qualité des signaux électrophysiologiques, veillez à ne toucher aucune vis lors de l’installation de la suivante. - Placez quelques petites gouttes de ciment dentaire au centre de l’espace en forme d’anneau à l’intérieur des vis. Insérez l’extrémité incurvée d’une électrode EMG (préparée à l’étape 1.1.2) d’environ 1 à 2 mm dans les muscles du cou en tenant l’extrémité incurvée à l’aide de pinces Dumont #5 et en soulevant la peau au-dessus des muscles avec une pince Graefe extra-fine. Ensuite, placez le côté incurvé et le coude de l’électrode dans le ciment dentaire; répétez l’opération pour la deuxième électrode EMG.
REMARQUE: L’extrémité droite de l’électrode EMG plus longue doit être alignée avec l’électrode ECoG antérieure et celle de l’électrode EMG plus courte avec l’électrode ECoG postérieure. Assurez-vous que les deux électrodes EMG ne se touchent pas ou ne touchent pas l’une des vis. - Couvrez les yeux des souris et appliquez de la lumière pendant 3 à 5 minutes pour aider à la solidification du ciment. Une fois que les électrodes EMG tiennent fermement, couvrez la base des électrodes ECoG et la base des vis d’ancrage avec du ciment dentaire pour former un contour en forme de couronne. Couvrez les yeux des souris et appliquez de la lumière pendant 3 à 5 minutes pour aider à la solidification du ciment.
REMARQUE: N’appliquez pas de ciment sur les extrémités des électrodes ECoG et EMG (fil d’or qui sera soudé au connecteur) ou sur la peau. - Remplissez le centre du montage avec du ciment acrylique préalablement mélangé. Pendant la solidification du ciment, retirez les quatre pinces chirurgicales qui maintiennent la peau (et lavez-les immédiatement avec des essuie-glaces délicats).
REMARQUE: N’appliquez pas de ciment sur les extrémités des électrodes ECoG et EMG (fil d’or qui sera soudé au connecteur) ou sur la peau. - Suturer la peau à l’arrière et à l’avant du montage pour que le crâne ne soit pas exposé (mais évitez de trop étirer la peau) à l’aide d’une aiguille de suture (13 mm 3/8 c) et d’un monofilament synthétique résorbable.
- Tenez le connecteur au-dessus du montage avec des pinces incurvées et alignez soigneusement le fil doré des électrodes avec les broches du connecteur. Soudez les extrémités de l’électrode aux broches de connexion avec le fer à souder.
REMARQUE: Procédez rapidement pour éviter la surchauffe et les dommages au tissu cortical. Assurez-vous que chaque électrode entre en contact avec la broche du connecteur correspondante et que les électrodes ne sont pas connectées les unes aux autres. - Retirez la souris du cadre stéréotaxique. Couvrez l’espace vide entre le connecteur et la tête avec du ciment acrylique préalablement mélangé en recouvrant toutes les connexions entre les électrodes et les broches du connecteur.
REMARQUE: Évitez les infiltrations de ciment à l’intérieur du connecteur en tenant la souris avec le connecteur au-dessus de la tête (tête droite et non penchée). - Pesez la souris et placez-la dans une cage propre (de préférence équipée d’un couvercle non maillé) sur un coussin chauffant (boîtier individuel pour éviter d’endommager le montage de la tête). Surveillez l’animal régulièrement et administrez 0,1 mg/kg de buprénorphine par voie sous-cutanée au réveil, et 12 h plus tard si l’animal présente des signes de douleur (p. ex. posture anormale, yeux plissés).
REMARQUE: Le gain de poids par rapport au poids pré-chirurgical ne doit pas dépasser 1,5 g.
4. Enregistrements
- Souris domestiques individuellement pour éviter d’endommager le montage de la tête à la suite d’un toilettage mutuel ainsi que d’endommager et d’enchevêtrer les câbles d’enregistrement.
REMARQUE: Pour ce protocole, les souris ont été logées avec un accès ad libitum à la nourriture, à l’eau et à un cube en bois, et une surveillance quotidienne a été effectuée. - Connectez les souris aux câbles d’enregistrement 2 semaines après la chirurgie pour les adapter aux conditions de câblage.
- Enregistrez les signaux ECoG/EMG pendant 24 heures (ou plus longtemps/plus court selon les questions de recherche).
REMARQUE: L’enregistrement du signal ECoG / EMG a été effectué à l’aide d’un câble, d’un connecteur pivotant (pour permettre la rotation du câble), d’un boîtier portable à 36 canaux et d’un amplificateur connecté à un ordinateur. Les signaux sont échantillonnés à 256 Hz (ou plus selon les questions de recherche) et enregistrés avec un logiciel commercial (voir la Table des matériaux). Pour assurer une expression virale suffisante, les expériences doivent être effectuées au moins 3 semaines après l’injection d’AAV, comme décrit précédemment29,37. - Après l’enregistrement, sacrifiez les souris par luxation cervicale (ou d’autres méthodes selon le protocole d’immunocoloration) et récoltez le cerveau pour l’immunocoloration.
Résultats
Après enregistrements électrophysiologiques, l’immunofluorescence est utilisée pour définir la zone infectée par l’injection d’AAV et pour valider l’expression de la cofilineS3D (Figure 2). L’immunocoloration peut être réalisée en utilisant une méthodologie similaire à ce qui a été décrit précédemment29,37,38,39. L’AAV exprime une forme inactive de cofiline fusionnée avec un marqueur d’hémagglutinine (HA) (cofilineS3D-HA),qui est détectée par immunofluorescence à l’aide d’un anticorps anti-HA et d’un anticorps secondaire (Alexa Fluor 488). Les neurones excitateurs infectés (ici, ciblés par un promoteur de la protéine kinase II alpha [CamKIIα] dépendant du calcium/calmoduline contrôlant l’expression du transgène contenu dans l’AAV) sont colorés avec l’anticorps anti-HA. Une infection réussie est indiquée par la coloration des neurones dans le cortex moteur entourant le site d’injection (Figure 2A, B). Dans cet exemple représentatif, le cortex cérébral de l’autre hémisphère n’a montré aucune coloration notable. Néanmoins, étant donné que les neurones excitateurs peuvent se projeter dans des zones cérébrales éloignées, la coloration dans l’hémisphère controlatéral n’est pas nécessairement une indication d’une injection infructueuse. Un grossissement plus élevé de la zone infectée a montré une coloration des corps cellulaires et des projections, confirmant que seules des cellules spécifiques de la zone corticale ciblée étaient infectées (Figure 2C).
La co-coloration avec des marqueurs de neurones excitateurs (par exemple, transporteur vésiculeux de glutamate 1, CaMKIIα) peut également être effectuée pour valider la spécificité du type cellulaire. Alternativement, la co-coloration avec des marqueurs de neurones inhibiteurs ou d’astrocytes peut être effectuée dans le cas où ces cellules sont ciblées à l’aide de différents promoteurs. La co-coloration de la cofilineS3D-HAet de CaMKIIα a également été réalisée chez le même animal pour une zone plus postérieure au site d’injection qui présentait encore une coloration anti-HA dans le cortex moteur (Figure 2D). L’image de grossissement plus élevé de la zone montre des cellules exprimant clairement la cofilineS3D-HA(Alexa Fluor 488, Figure 2E) et CaMKIIα (Alexa Fluor 568, Figure 2F). La superposition de la coloration cofilineS3D-HAet CaMKIIα révèle que la plupart (sinon la totalité) des cellules colorées pour la cofilineS3D-HAsont également positives pour CaMKIIα(Figure 2G). Cette observation soutient la spécificité de l’infection pour les neurones excitateurs.
Pour évaluer l’impact de la manipulation de la cofiline sur l’activité ECoG, les signaux ECoG et EMG sont utilisés pour effectuer une identification visuelle des états de vigilance (éveil, sommeil à ondes lentes, sommeil paradoxal). Cela se fait sur les époques 4-s en raison du changement rapide de l’état de vigilance chez la souris2, et ici, pour un enregistrement complet de 24 heures. Les analyses standard comprennent le calcul de l’architecture du sommeil et des variables d’analyse spectrale, comme cela a été effectué précédemment pour différents ensembles de données11,12 , 13,28,34. En particulier, l’analyse spectrale du signal ECoG des différents états permettra d’indexer la composition et la qualité de l’état. Pour éliminer les différences qui pourraient survenir, par exemple, de différentes profondeurs des électrodes, les données d’analyse spectrale peuvent être exprimées par rapport à la puissance totale de tous les états d’un animal donné(Figure 3A). Compte tenu de la très faible amplitude relative de l’activité ECoG dans les fréquences plus élevées, les spectres de puissance relative pour l’éveil, le sommeil à ondes lentes et le sommeil paradoxal ont été transformés en logarithme pour visualiser et comparer simultanément l’activité dans les basses et hautes fréquences. Cette analyse indique des différences spécifiques à l’état dans l’activité spectrale dans des conditions d’inactivation de la cofiline (Figure 3B). Plus précisément, ces résultats préliminaires combinant des souris mâles et femelles soulignent que l’inactivation de la cofiline augmente considérablement la puissance spectrale dans les fréquences rapides (14-30 Hz) pendant l’éveil et dans les fréquences lentes (1-4 Hz) pendant le sommeil paradoxal, tout en laissant l’activité ECoG pendant le sommeil à ondes lentes principalement inchangée. En outre, l’inactivation de la cofiline semble augmenter la variabilité inter-souris de l’activité ECoG (particulièrement perceptible dans les barres d’erreur pour l’éveil dans la figure 3B).
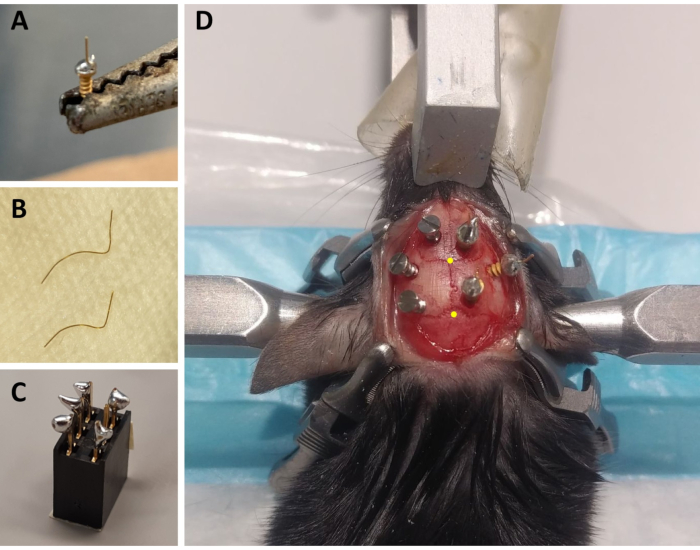
Figure 1: Préparation des composants de montage ECoG/EMG et exemple représentatif du placement des électrodes ECoG. (A) Une électrode ECoG : un fil d’or de 4 mm de long, 0,2 mm de diamètre (non isolé) est fusionné sur la tête d’une vis recouverte d’or (diamètre de tête de 1,9 mm, diamètre majeur de filetage de 1,14 mm, longueur totale de 3,6 mm) à l’aide d’une soudure sans plomb. (B) électrodes EMG: deux fils d’or (1,5 et 2 cm) sont incurvés pour embrasser la courbe du crâne jusqu’au muscle du cou, et l’autre extrémité est maintenue droite pour être soudée au connecteur. (C) Un connecteur à 6 canaux: une soudure sans plomb est ajoutée à 5 des 6 broches métalliques (en omettant une au milieu) du connecteur (5 mm x 8 mm x 8 mm + broches métalliques de 3 mm). Le haut du connecteur est recouvert de ruban adhésif pour éviter les infiltrations de litière et d’eau. (D) Exemple du positionnement des trois vis de maintenance sur le crâne de l’hémisphère gauche et des trois électrodes ECoG (dont une électrode de référence) sur l’hémisphère droit. Les coordonnées stéréotaxiques précises des électrodes ECoG sont indiquées aux étapes 2.6 et 3.2 et ont été calculées en fonction de l’emplacement du bregma et du lambda (qui sont indiqués par les points jaunes). Abréviations : ECoG = électrocorticographique; EMG = électromyographique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
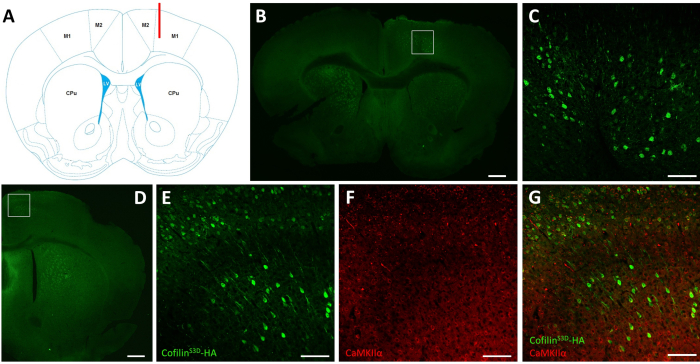
Figure 2: Immunocoloration représentative pour définir la zone infectée par l’AAV et le type de cellule. (A) Représentation schématique montrant le site d’injection de la tranche coronale présentée dans le panneau B. La position est de 1,1 mm avant le bregma, et la canule (en rouge) a été ciblée sur les couches V du cortex moteur primaire droit (M1). Représentation modifiée à partir de Franklin et Paxinos40. (B) Immunocoloration de l’AH pour détecter l’expression de la cofilineS3D-HAdans les neurones montrés pour une tranche coronale du cerveau entier située à environ 1,1 mm avant le bregma. La zone infectée se localise principalement dans les couches V et VI (couches infragranulaires) des cortex moteurs primaire et secondaire droit (M1 et M2). Barre d’échelle = 500 μm. Le carré représente la zone montrée en C. (C) Grossissement plus élevé de la zone infectée montrant la coloration des cellules infectées et confirmant l’expression de la cofilineS3D-HAdans les couches plus profondes du cortex moteur. Barre d’échelle = 100 μm. (D) Co-immunocoloration de HA et CaMKIIα pour évaluer la spécificité du type cellulaire montrée pour une tranche coronale de l’hémisphère droit située à environ 0,5 mm avant le bregma et donc postérieur au site d’injection (même souris que dans les panneaux B et C). La zone infectée se localise dans les cortex moteurs (M1 et principalement M2). Barre d’échelle = 500 μm. Le carré représente la zone indiquée en E, F et G. (E) Grossissement plus élevé de la zone infectée montrant la coloration des cellules infectées et confirmant l’expression de la cofilineS3D-HA. Barre d’échelle = 100 μm. (F) Grossissement plus élevé de la zone infectée montrant une coloration des cellules CaMKIIα positives. Barre d’échelle = 100 μm. (G) Grossissement plus élevé de la zone infectée montrant un co-étiquetage de la cofilineS3D-HAet CaMKIIα, confirmant que les cellules infectées sont CaMKIIα-positives. Barre d’échelle = 100 μm. Abréviations : AAV = virus adéno-associé; M1 = cortex moteur primaire; M2 = cortex moteur secondaire; CPu = putamen caudé (striatum); LV = ventricule latéral; HA= hémagglutinine; CamKIIα = protéine kinase II alpha dépendante du calcium/calmoduline. Veuillez cliquer ici pour voir une version agrandie de cette figure.
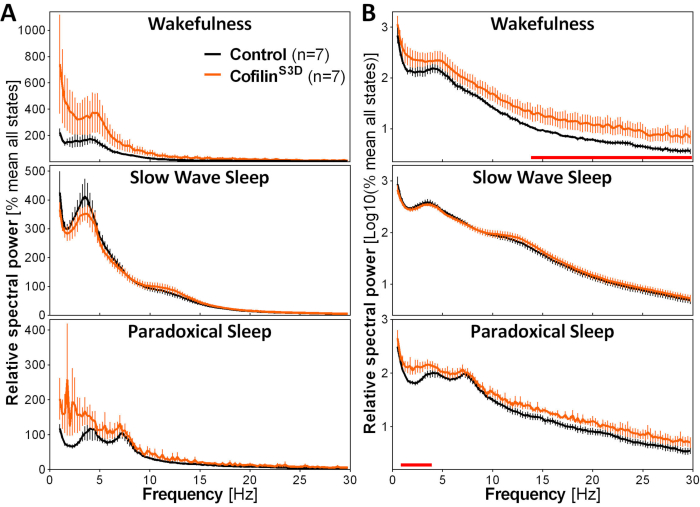
Figure 3: Spectres de puissance représentatifs de l’éveil, du sommeil à ondes lentes et du sommeil paradoxal obtenus après manipulation virale de la fonction cofiline. Des souris mâles (n = 5 par groupe) et femelles(n = 2 par groupe) aux souris ayant reçu une AAV 9-CaMKIIα0.4-cofilineS3D-HA(titre viral 2,58 ×10 13 GC/mL) ou une AAV de contrôle (AAV 9-CaMKIIα0.4-eGFP 1,25 × 1013 GC/mL ; la moitié du titre d’essai pour contrôler le signal amélioré de cet AAV de contrôle) dans la couche V du cortex moteur ont été enregistrées pendant 24 h, et le signal électrocorticographique a été soumis à une analyse spectrale (transformée de Fourier rapide pour calculer la puissance spectrale entre 0,5 et 30 Hz avec une résolution de 0,25 Hz). (A) Spectres de puissance au cours des trois états de vigilance exprimés par rapport à la puissance totale de tous les états. (B) Spectres de puissance relative log-transformés pour représenter plus adéquatement les différences de groupe dans les fréquences plus élevées. La suppression de l’activité de la cofiline dans le cortex moteur à l’aide de l’AAV 9-CaMKIIα0.4-cofilineS3D-HAaugmente significativement l’activité électrocorticographique dans la gamme bêta (14-30 Hz) pendant l’éveil, et dans la gamme delta (1-4 Hz) pendant le sommeil paradoxal par rapport aux injections de contrôle (les lignes rouges au-dessus des axes x indiquent mann-Whitney U -test sur la puissance de la bande de fréquences p < 0,05). Abréviations : AAV = virus adéno-associé GC = copies du génome; HA= hémagglutinine; CamKIIα = protéine kinase II alpha dépendante du calcium/calmoduline; eGFP = protéine fluorescente verte améliorée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole décrit une méthode précise et simple pour surveiller l’activité ECoG et EMG lors de la manipulation de cibles moléculaires à l’aide d’AAV. Pour une comparaison adéquate entre les groupes, il est fortement recommandé de toujours planifier les interventions chirurgicales (injection d’AAV et implantation d’électrodes) le même jour pour les animaux d’essai et de contrôle, et d’enregistrer simultanément leurs signaux électrophysiologiques. Pour obtenir une expression virale similaire entre les animaux d’essai et les animaux témoins, l’injection du même titre viral est souhaitable. En l’espèce, le titre viral de l’AAV témoin avait été réduit à la moitié de l’AAV testé pour assurer une expression virale similaire. Les expérimentateurs doivent être très prudents avec les mesures des coordonnées stéréotaxiques pour assurer une faible variabilité entre les animaux dans le ciblage de la zone cérébrale / couche corticale. De plus, étant donné que la profondeur d’injection est calculée à partir de la surface du crâne et que l’épaisseur du crâne varie selon l’âge et le sexe, l’emplacement de la canule doit toujours être vérifié à l’aide de l’histologie ou de l’immunohistochimie post-protocole (p. ex., la figure 2)pour assurer un positionnement et une profondeur d’injection adéquats, et les coordonnées stéréotaxiques doivent être ajustées si nécessaire. Tout au long de l’injection d’AAV de 40 minutes, il est très important de surveiller la vitesse d’injection pour détecter et corriger rapidement les problèmes potentiels tels que le blocage de la pompe. Certaines étapes expérimentales sont également cruciales pour obtenir des signaux électrophysiologiques optimaux. Par exemple, ne pas trop visser pendant l’implantation de l’électrode; les vis doivent sortir du crâne d’au moins 2,5 mm pour minimiser les dommages au cortex cérébral et la formation d’une cicatrice gliale. Par la suite, il est également extrêmement important de i) éviter d’appliquer du ciment aux extrémités des électrodes, ii) assurer une soudure rapide des électrodes au connecteur et iii) s’assurer qu’il n’y a pas de contact entre les électrodes.
La procédure présentée ici pour l’enregistrement ECoG et EMG est extrêmement bien établie, simple et largement utilisée pour surveiller l’éveil et le sommeil chez les souris2,11,13,34. Les enregistrements ECoG et EMG continus peuvent être effectués pendant plusieurs jours consécutifs (et même des semaines) et générer un ensemble de données très riche qui peut être utilisé pour effectuer plusieurs lignes d’analyse comprenant des variables liées à l’éveil et à la quantité de sommeil et à l’architecture2,11,12 (par exemple, le temps passé dans différents états par période de lumière et d’obscurité, le nombre d’épisodes de chaque état, Distribution du sommeil sur 24 heures), l’éveil et le contenu spectral du sommeil34,41 (par exemple, puissance dans différentes bandes de fréquences [similaire à la figure 3], activité sans échelle) et caractéristiques des ondes individuelles42,43,44 (par exemple, amplitude et pente des ondes lentes). Lorsqu’il est utilisé en combinaison avec des manipulations moléculaires médiées par l’AAV, un avantage supplémentaire est d’éviter la compensation développementale potentielle qui peut se produire chez les animaux transgéniques. Avec la pratique, toute la procédure, y compris l’injection d’AAV de 40 minutes, peut être effectuée en environ 90 minutes. Le taux de mortalité devrait être (très) faible car la chirurgie est peu invasive.
L’utilisation simultanée de l’enregistrement ECoG/EMG et de la manipulation ciblée avec AAV offre une variété d’autres avantages et applications. Par exemple, la précision du ciblage stéréotaxique, lorsqu’il est correctement effectué, est très élevée et reproductible et est utile pour déterminer le rôle spécifique d’une région cérébrale donnée (et / ou d’un type cellulaire ou d’un élément moléculaire dans la région) dans la régulation du sommeil ou d’autres processus physiologiques. Plusieurs zones corticales différentes peuvent ainsi être facilement ciblées en utilisant des adaptations du protocole actuel. De plus, les manipulations de cibles à l’aide d’AAV pourraient être dirigées vers une zone corticale/sous-corticale différente des sites d’enregistrement ECoG. Dans de tels cas, le trou de bavure pour l’injection d’AAV pourrait être recouvert d’un petit couvercle en verre fixé à l’aide de ciment dentaire (ou de cire d’os). Pour une spécificité accrue, la construction AAV comprend souvent un promoteur qui permet une infection ciblée d’un type cellulaire précis14. Un promoteur CamKIIα a été utilisé dans le présent protocole pour cibler spécifiquement les cellules pyramidales excitatrices14,29,45du cortex moteur. Cette stratégie a permis l’inactivation de la cofiline (en utilisant la cofilineS3D)32,33 dans les neurones excitateurs du cortex moteur et l’observation de changements spécifiques à l’état dans l’activité ECoG (Figure 3). Pour évaluer l’efficacité de l’infection / transduction, les futurs utilisateurs du protocole pourraient combiner le protocole AAV-ECoG présenté avec celui de la co-coloration par immunofluorescence, et utiliser des images à fort grossissement pour calculer le nombre de cellules montrant un double étiquetage du nombre total de cellules montrant un seul étiquetage de la cible (ici, neurones exprimant CaMKIIα). Dans une étude récente, une méthode AAV-ECoG similaire à celle décrite ici a été utilisée pour surexprimer la protéine 1 liée au syndrome de retard mental de l’X fragile (FXR1) dans tous les neurones du cortex moteur à l’aide d’un AAV contenant un promoteur de synapsine et a révélé un effet de cette manipulation sur la distribution de l’état de vigilance et le contenu spectral28. Ces résultats illustrent comment la manipulation d’une molécule donnée dans une région cérébrale cible à l’aide d’AAV peut révéler des rôles dans la régulation de paramètres spécifiques d’éveil / sommeil.
Une limitation du protocole décrit est la petite lésion du tissu cérébral survenant avec la mise en place de la canule avant d’effectuer l’injection d’AAV, qui pourrait également être accompagnée d’une réponse inflammatoire. Cela pourrait être particulièrement préoccupant lors de l’injection d’AAV dans les zones sous-corticales et devrait toujours être abordé en utilisant des contrôles adéquats. Alternativement, le protocole actuel pourrait être suivi par la quantification de la gliose réactive et/ou de l’activation microgliale (par exemple, en utilisant l’immunofluorescence) pour assurer des niveaux similaires dans les groupes témoins et d’essai et, par conséquent, sur la lecture ECoG. Une deuxième limitation concerne le risque de mauvaise connexion entre une électrode et le connecteur, ce qui pourrait entraîner un signal électrophysiologique continu ou parfois mauvais. Des électrodes solidement vissées, soudées et cimentées minimiseront l’incidence de ce problème. Une troisième limitation est liée au fait que les animaux sont attachés via le montage de la tête pendant l’enregistrement, ce qui pourrait limiter la locomotion et d’autres comportements, au moins dans une certaine mesure, et entraîner parfois des dommages au câblage et une perte de signal. Enfin, le protocole présenté est plus approprié pour les souris adultes, étant donné que la taille du crâne des animaux plus jeunes peut entraîner des difficultés dans l’installation du montage de tête représenté, comme décrit précédemment2.
L’enregistrement combiné ECoG/EMG et la manipulation médiée par AAV d’une cible précise sont également applicables à des domaines de recherche autres que les neurosciences du sommeil. Entre autres, il pourrait être utilisé pour étudier et manipuler les événements épileptiques dans des modèles animaux de crise et est un outil puissant pour moduler les oscillations cérébrales impliquées dans le codage et la consolidation de la mémoire46,47. En conséquence, les applications potentielles englobent certainement les domaines de la recherche fondamentale en psychiatrie et en neurologie, y compris les maladies neurodégénératives. En plus de la capacité d’exprimer une forme inactive d’une molécule, les AAV peuvent et ont été utilisés pour surexprimer ou réduire la normale (par exemple, l’ARN interférent petit, CRISPR / Cas9) ou pour sauver l’expression d’une molécule dans un KO du corps entier. Il est important de noter que la double méthodologie du protocole actuel est également applicable à d’autres espèces de mammifères telles que les rats et les rongeurs diurnes qui représentent des modèles intéressants pour comprendre à la fois le sommeil et la neurodégénérescence48,49.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les travaux ont été financés par la Chaire de recherche du Canada en physiologie moléculaire du sommeil. Les auteurs remercient Chloé Provost et Caroline Bouchard pour leur aide technique.
matériels
| Name | Company | Catalog Number | Comments |
| Surgery peparation | |||
| 21 G needle | Terumo | NN-2125R | |
| 6-channel connector | ENA AG | BPHF2-O6S-E-3.2 | Connector used in this manuscript, but discontinued. See potential replacement below |
| Distrelec | 300-93-672 | Potential replacement for discontinued connector above | |
| C57BL6/J mice | Jackson Laboratory | 000664 | B6 | Animals bred on site |
| Pluronic F-68 | Non-ionic surfactant | ||
| Gold wire 0.2 mm diameter | Delta scientific | 920-862-41 | Non-insulated |
| Hamilton syringe (10 μL) | Fisher Scientific | 14815279 | |
| Infusion syringe Pump CMA 402 | Harvard Apparatus | CMA8003110 | |
| Injection cannula 28 G | Plastics one | C313l-SPCL | |
| Isoflurane | Baxter | CA2L9100 | |
| Ketamine (10 mg/mL) | SANDOZ | 4550 | |
| Lead-free solder | AIM | SN100C | |
| Lubricating ophthalmic ointment | ALLERGAN | 210889 | |
| PE 50 Catheter thin wall | Plastics one | C232CT | |
| Flat fillister head self tapping screws | MORRIS | FF00CE125 | ECoG electrode gold covered; Dimension : 1.9 mm head diameter, 1.14 mm thread major diameter, 3.6 mm length |
| Soldering iron | Weller | WES51 | |
| Syringe 1 mL | BD | 309659 | |
| Trimmer | Harvard Apparatus | 72-9063 | |
| Xylazine (20 mg/mL) | Bayer | 2169592 | |
| Intracortical AAV injection with syringe pump | |||
| 0.7 mm drill bit | Dremel | 628 | |
| AAV9-CaMKIIα0.4-cofilinS3D-HA | UPenn Viral Core | ||
| AAV9-CaMKIIα0.4-eGFP | UPenn Viral Core | ||
| Cotton tippped applicators | Medicom | 806 | |
| Drill | Dremel | 8050-N/18 | |
| Extra-fine Graefe forceps | Fine science tools | 11150-10 | |
| Stereotaxic arm | Stoelting | 51604U | |
| Stereotaxic frame | Stoelting | 51600 | |
| Surgical clamps | Fine science tools | 18050-28 | |
| Tissue scissor | Magna Stainless | M4-124 | |
| ECoG/EMG electrode implantation | |||
| Buprenorphine (0.3 mg/mL) | CEVA | 57133-02 | |
| Curved forceps | Fine science tools | 11001-12 | |
| Delicate task wipers | Kimtech | 34120 | |
| Dental acrylic cement | Yates Motloid | 44115 | |
| Dumont #5 forceps | Fine science tools | 91150-20 | |
| Extra fine Graefe forceps | Fine science tools | 11150-10 | |
| Kelly forceps | Fine science tools | 13002-10 | |
| Liquid acrylic | Yates Motloid | 44119 | |
| Monocryl plus suture needle 13 mm 3/8c rev cutting | Ethicon | MCP494 | |
| Providone-iodine 10% | Triad disposables | 10-8208 | |
| RelyX Unicem 2, Adhesive Resin Cement A2 | 3M | 56849 | |
| Immunofluorescence and ECoG recording | |||
| 36-Channel EEG Wearable Headbox | LaMONT Medical | 832-000350 | |
| CaMKII alpha Monoclonal Antibody (Cba-2) | Invitrogen | 13-7300 | Dilution 1:500 |
| Conductors Awg PVC Insulation Cable | Calmont Wire & Cables | HC-0819075R0 | |
| Donkey anti-Mouse IgG secondary Ab, Alexa Fluor 568 | Invitrogen | A10037 | Dilution 1:1000 |
| Goat anti-Rabbit IgG secondary Ab, Alexa Fluor 488 | Invitrogen | A-11008 | Dilution 1:500 |
| HA-Tag (C29F4) Rabbit mAb | Cell signaling | 3724 | Dilution 1:800 |
| Programmable Amplifier | LaMONT Medical | 815-000002-S2 | |
| Stellate Harmonie | Natus | HSYS-REC-LT2 | |
| Swivel connector | Crist Instrument Company Inc. | 4-TBC-9-S |
Références
- Campbell, I. G. EEG recording and analysis for sleep research. Current Protocols in Neuroscience. , (2009).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Current Protocols in Mouse Biology. 2 (1), 55-74 (2012).
- Bastien, C. H., et al. Insomnia and sleep misperception. Pathologie Biologie. 62 (5), 241-251 (2014).
- Malafeev, A., et al. Automatic artefact detection in single-channel sleep EEG recordings. Journal of Sleep Research. 28 (2), 12679 (2019).
- Latreille, V., et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease. Brain. 139, 1189-1199 (2016).
- Rodrigues Brazete, J., et al. Electroencephalogram slowing predicts neurodegeneration in rapid eye movement sleep behavior disorder. Neurobiology of Aging. 37, 74-81 (2016).
- Kent, B. A., Strittmatter, S. M., Nygaard, H. B. Sleep and EEG power spectral analysis in three transgenic mouse models of Alzheimer's disease: APP/PS1, 3xTgAD, and Tg2576. Journal of Alzheimers Disease. 64 (4), 1325-1336 (2018).
- Chang, A. M., et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiology International. 33 (5), 561-573 (2016).
- Shi, G., Wu, D., Ptacek, L. J., Fu, Y. H. Human genetics and sleep behavior. Current Opinion in Neurobiology. 44, 43-49 (2017).
- Nakai, Y., et al. Calcineurin and its regulator sra/DSCR1 are essential for sleep in Drosophila. Journal of Neuroscience. 31 (36), 12759-12766 (2011).
- El Helou, J., et al. Neuroligin-1 links neuronal activity to sleep-wake regulation. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9974-9979 (2013).
- Freyburger, M., et al. EphA4 is involved in sleep regulation but not in the electrophysiological response to sleep deprivation. Sleep. 39 (3), 613-624 (2016).
- Seok, B. S., et al. The effect of Neuroligin-2 absence on sleep architecture and electroencephalographic activity in mice. Molecular Brain. 11 (1), 52 (2018).
- Haery, L., et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation. Frontiers in Neuroanatomy. 13, 93 (2019).
- Schmidt, F., Grimm, D. CRISPR genome engineering and viral gene delivery: a case of mutual attraction. Biotechnology Journal. 10 (2), 258-272 (2015).
- Wang, D., Zhang, F., Gao, G. CRISPR-based therapeutic genome editing: strategies and in vivo delivery by AAV vectors. Cell. 181 (1), 136-150 (2020).
- Havekes, R., et al. Transiently increasing cAMP levels selectively in hippocampal excitatory neurons during sleep deprivation prevents memory deficits caused by sleep loss. Journal of Neuroscience. 34 (47), 15715-15721 (2014).
- Fuller, P. M., Yamanaka, A., Lazarus, M. How genetically engineered systems are helping to define, and in some cases redefine, the neurobiological basis of sleep and wake. Temperature. 2 (3), 406-417 (2015).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ono, D., Yamanaka, A. Hypothalamic regulation of the sleep/wake cycle. Neuroscience Research. 118, 74-81 (2017).
- Shiromani, P. J., Peever, J. H. New neuroscience tools that are identifying the sleep-wake circuit. Sleep. 40 (4), 032 (2017).
- Oishi, N., et al. Artificial association of memory events by optogenetic stimulation of hippocampal CA3 cell ensembles. Molecular Brain. 12 (1), 2 (2019).
- Anaclet, C., et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control. Journal of Neuroscience. 38 (22), 5168-5181 (2018).
- Chen, K. S., et al. A hypothalamic switch for REM and non-REM sleep. Neuron. 97 (5), 1168-1176 (2018).
- Torontali, Z. A., Fraigne, J. J., Sanghera, P., Horner, R., Peever, J. The sublaterodorsal tegmental nucleus functions to couple brain state and motor activity during REM sleep and wakefulness. Current Biology. 29 (22), 3803-3813 (2019).
- Rolls, A., et al. Optogenetic disruption of sleep continuity impairs memory consolidation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13305-13310 (2011).
- Ognjanovski, N., Broussard, C., Zochowski, M., Aton, S. J. Hippocampal network oscillations rescue memory consolidation deficits caused by sleep loss. Cerebral Cortex. 28 (10), 3711-3723 (2018).
- Khlghatyan, J., et al. Fxr1 regulates sleep and synaptic homeostasis. EMBO Journal. 39 (21), 103864 (2020).
- Havekes, R., et al. Sleep deprivation causes memory deficits by negatively impacting neuronal connectivity in hippocampal area CA1. Elife. 5, 13424 (2016).
- Wong, L. W., Tann, J. Y., Ibanez, C. F., Sajikumar, S. The p75 neurotrophin receptor is an essential mediator of impairments in hippocampal-dependent associative plasticity and memory induced by sleep deprivation. Journal of Neuroscience. 39 (28), 5452-5465 (2019).
- Mizuno, K. Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular Signalling. 25 (2), 457-469 (2013).
- Nagaoka, R., Abe, H., Obinata, T. Site-directed mutagenesis of the phosphorylation site of cofilin: its role in cofilin-actin interaction and cytoplasmic localization. Cell Motility and the Cytoskeleton. 35 (3), 200-209 (1996).
- Elam, W. A., et al. Phosphomimetic S3D cofilin binds but only weakly severs actin filaments. Journal of Biological Chemistry. 292 (48), 19565-19579 (2017).
- Areal, C. C., Cao, R., Sonenberg, N., Mongrain, V. Wakefulness/sleep architecture and electroencephalographic activity in mice lacking the translational repressor 4E-BP1 or 4E-BP2. Sleep. 43 (2), (2020).
- Vyazovskiy, V., Borbely, A. A., Tobler, I. Unilateral vibrissae stimulation during waking induces interhemispheric EEG asymmetry during subsequent sleep in the rat. Journal of Sleep Research. 9 (4), 367-371 (2000).
- Sitnikova, E. Neonatal sensory deprivation promotes development of absence seizures in adult rats with genetic predisposition to epilepsy. Brain Research. 1377, 109-118 (2011).
- Tudor, J. C., et al. Sleep deprivation impairs memory by attenuating mTORC1-dependent protein synthesis. Science Signaling. 9 (425), 41 (2016).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293 (2015).
- Dufort-Gervais, J., et al. Neuroligin-1 is altered in the hippocampus of Alzheimer's disease patients and mouse models, and modulates the toxicity of amyloid-beta oligomers. Scientific Reports. 10 (1), 6956 (2020).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates, Third edition. , (2007).
- Lina, J. M., O'Callaghan, E. K., Mongrain, V. Scale-free dynamics of the mouse wakefulness and sleep electroencephalogram quantified using Wavelet-Leaders. Clocks & Sleep. 1 (1), 50-64 (2019).
- Massart, R., et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes. Translational Psychiatry. 4, 347 (2014).
- Freyburger, M., Poirier, G., Carrier, J., Mongrain, V. Shorter duration of non-rapid eye movement sleep slow waves in EphA4 knockout mice. Journal of Sleep Research. 26 (5), 539-546 (2017).
- Hubbard, J., et al. Rapid fast-delta decay following prolonged wakefulness marks a phase of wake-inertia in NREM sleep. Nature Communications. 11 (1), 3130 (2020).
- Johansen, J. P., et al. Optical activation of lateral amygdala pyramidal cells instructs associative fear learning. Proceedings of the National Academy of Sciences of the United States of America. 107 (28), 12692-12697 (2010).
- Boyce, R., Glasgow, S. D., Williams, S., Adamantidis, A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science. 352 (6287), 812-816 (2016).
- Bandarabadi, M., et al. Dynamic modulation of theta-gamma coupling during rapid eye movement sleep. Sleep. 42 (12), 182 (2019).
- Estrada, C., et al. Transcranial magnetic stimulation and aging: Effects on spatial learning and memory after sleep deprivation in Octodon degus. Neurobiology of Learning and Memory. 125, 274-281 (2015).
- Hurley, M. J., et al. The long-lived Octodon degus as a rodent drug discovery model for Alzheimer's and other age-related diseases. Pharmacology & Therapeutics. 188, 36-44 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon