Method Article
Электрокортикографическая запись областей коры головного мозга, манипулируемых с использованием аденоассоциированного вируса, нацеленного на кофилин у мышей
В этой статье
Резюме
В данной статье описан протокол манипуляции молекулярными мишенями в коре головного мозга с использованием аденоассоциированных вирусов и для мониторинга последствий этой манипуляции во время бодрствования и сна с помощью электрокортикографических записей.
Аннотация
Использование электрокортикографических (ECoG) записей у грызунов имеет отношение к исследованиям сна и изучению широкого спектра неврологических состояний. Аденоассоциациированные вирусы (AAV) все чаще используются для улучшения понимания мозговых цепей и их функций. AAV-опосредованное манипулирование конкретными клеточными популяциями и / или точными молекулярными компонентами было чрезвычайно полезным для выявления новых регуляторных цепей / молекул сна и ключевых белков, способствующих неблагоприятным последствиям потери сна. Например, ингибирование активности нителезного актин-разрывающего белка кофилина с использованием AAV предотвращает ухудшение памяти, вызванное лишением сна. Здесь описан протокол, который сочетает в себе манипуляции функцией кофилина в области коры головного мозга с записью активности ECoG, чтобы изучить, модулирует ли кортикальный кофилин сигналы ECoG бодрствования и сна. Инъекция AAV выполняется во время той же хирургической процедуры, что и имплантация ECoG и электромиографических (EMG) электродов у взрослых самцов и самок мышей. Мышей обезболивают, а их головы бреют. После чистки кожи и разреза определяют стереотаксические координаты моторной коры, и в этом месте прокалывают череп. Канюля, предварительно заполненная AAV-экспрессирующим кофилиномS3D,неактивной формой кофилина, медленно позиционируется в кортикальной ткани. После инфузии AAV покрытые золотом винты (электроды ECoG) прокручиваются через череп и цементируются к черепу золотыми проводами, вставленными в мышцы шеи (электроды ЭМГ). Животным предоставляется три недели для восстановления и обеспечения достаточной экспрессии кофилинаS3D. Инфицированная область и тип клеток проверяются с помощью иммуногистохимии, а ECoG анализируется с использованием визуальной идентификации состояний бдительности и спектрального анализа. Таким образом, этот комбинированный методологический подход позволяет исследуть точный вклад молекулярных компонентов, регулирующих морфологию нейронов и связность, в регуляцию синхронизированной активности коры головного мозга во время бодрствования и сна.
Введение
Электроэнцефалографические (или, как правило, электрокортикографические [ECoG] у грызунов) и электромиографические (ЭМГ) записи широко используются в исследованиях сна, а также в более широком смысле в неврологии, неврологии и психиатрии. В совокупности эти электрофизиологические сигналы позволяют идентифицировать состояния бдительности и последующую количественную оценку длительности состояния и спектрального состава, как у человека, так и у грызунов1,2,3,4. Такая количественная оценка была полезна для понимания того, как сон модифицируется при патологических состояниях, таких как нейродегенеративные заболевания и модели5,6,7 или путем генетической модификации8,9. Например, было показано, что нокаут (KO) различных генов, связанных с нейронной связью, изменяет продолжительность бодрствования и сна как умыши,так и у плодовой мухи10,11,12,13. Чтобы справиться с потенциальной компенсацией развития, возникающей в результате изучения нокаута всего тела у грызунов, и обеспечить более тонкий контроль генетических манипуляций, эффективным способом манипулирования экспрессией генов является использование аденоациациированных вирусов (AAV). Генетическая манипуляция, опосредованная AAV, может быть использована для понижения или повышения регуляции данной молекулярной мишени и ограничения манипуляции определенной клеточной популяцией с использованием различных типов промоторов14. AAV также широко используются в качестве метода доставки в кластеризованных регулярно чередуемых коротких палиндромных повторах (CRISPR)/Cas9 технологии15,16. Эти методологии позволяют улучшить временной и пространственный контроль генетических манипуляций, что, как правило, связано с экспрессией репортера, позволяющего количественно оценить зараженную область с использованием иммунофлуоресценции.
AAV также представляют собой основной вектор для специфических для типа клеток манипуляций нейронной активностью с помощью оптогенетики и хемогенетики17,18,19,которые широко использовались в последних исследованиях нейродегенеративных заболеваний, поведения, познания и сна20,21,22. В исследованиях сна применение оптогенетики для активации или ингибирования определенных областей мозга, таких как базальный передний мозг, гипоталамус и сублатеродорзальный тегментум, было полезно для определения их роли в контроле возбуждения, медленного сна (также известного как сон без быстрого движения глаз), парадоксального сна (или быстрого сна движения глаз) и катаплексии23, 24,25. Кроме того, манипуляции, опосредованные AAV, помогли прояснить важные регуляторные цепи сна и молекулы, способствующие неблагоприятным последствиям потери сна26,27,28. Например, одним из белков, который, как было показано, участвует в ухудшении памяти, вызванном лишениемсна,является кофилин29,30. Этот белок представляет собой нитевидный актин-разрывающий белок, который участвует в реорганизации актиновых нитей путем физического связывания с актином и содействия разборке нитей динамическим образом31. Было показано, что ингибирование активности кофилина с использованием AAV-опосредованного подхода предотвращает потерю позвоночника, а также синаптическую пластичность и дефицит памяти, вызванные лишением сна у мышей29. В совокупности эти исследования подчеркивают полезность и актуальность манипуляций, опосредованных AAV, для понимания регуляции сна и последствий лишения сна у грызунов.
Здесь описан протокол, который сочетает имплантацию электродов ECoG и EMG с манипуляцией функцией кофилина в области коры головного мозга мышей дикого типа (WT) с использованием AAV. Точнее, в моторную кору вводится AAV (серотип 9), экспрессирующий кодировую последовательность фосфомиметической формы мышиного кофилина (cofilinS3D),делающий его неактивным32,33. Электрод ECoG имплантируется непосредственно в место инъекции для обеспечения регистрации синхронизированной кортикальной активности инфицированных клеток. Запись ECoG/EMG проводится в течение 24 ч в ненарушенном состоянии через три недели после операции, чтобы обеспечить восстановление, адаптацию и экспрессиюS3D с высоким содержанием кофилина. Затем запись используется для идентификации состояний бдительности и спектрального анализа ECoG, как описано в предыдущих исследованиях11,34. Эта методология может конкретно показать, как кортикальный кофилин модулирует сигналы ECoG бодрствования и сна у мышей. Эта комбинация электрофизиологических записей и генетических манипуляций, опосредованных AAV, особенно актуальна для исследования роли различных молекулярных элементов в конкретных функциях мозга и может быть применена к кортикальной (и подкорковой) области (областям) мозга, представляющим интерес у WT и генетически модифицированных мышей обоих полов и даже других видов.
протокол
Все методы были одобрены Комитетом по экстериментации животных Recherche CIUSSS-NIM и соответствуют руководящим принципам Канадского совета по уходу за животными. Смотрите Таблицу материалов для реагентов, оборудования и материалов, используемых в этом протоколе.
1. Подготовка к операции
- Подготовка электродов ECoG и EMG
- Для каждого животного подготовьте три электрода ECoG: с помощью паяльника поместите небольшую каплю бессвинцового припоя на винтовую крышку винта, покрытого золотом, и припаяйте золотую проволоку длиной 4 мм диаметром 0,2 мм (неизолированную) на верхнюю часть винтовой крышки с помощью бессвинцового припоя(рисунок 1A). Подготовьте 2 электрода с золотой проволокой прямо вверх и один с углом 45° от вертикали.
- Для каждого животного готовят два электрода ЭМГ: нарезают одну золотую проволоку диаметром 0,2 мм длиной 1,5 см и вторую до 2 см. Изогнуты оба провода, чтобы они охватывали кривую черепа до мышц шеи, сохраняя прямой конец, который будет припаянным к разъему(рисунок 1B).
- Для каждого животного подготовьте один разъем: используйте 6-канальный разъем (5 мм x 8 мм x 8 мм + металлические контакты 3 мм) и добавьте бессвинцовый припой к 5 из 6 металлических контактов (опустив один средний контакт; Рисунок 1С). Закройте верхнюю часть разъема лентой, чтобы избежать попадания мусора или воды.
- Подготовка ААВ и шприцевого насоса
- Подготовьте тест AAV (здесь AAV 9-CaMKIIα0.4-cofilinS3D-HA)и/или контрольный AAV (здесь AAV9-CaMKIIα0.4-eGFP) путем разбавления стоковой смеси (es) AAV (здесь AAV в растворе фосфатно-буферного физиологического раствора, содержащего неионное поверхностно-активное вещество [0,001%]) стерильным физиологическим раствором для получения желаемого вирусного титра (обычно10 12-13 копий генома [GC]/мл) и необходимого объема для количества мышей, поддающихся лечению.
ПРИМЕЧАНИЕ: Инъекционный объем 1 мкл на кортикальный участок на мышь требует приготовления 2 мкл. - Закрепите один шприц 10 мкл к шприцевом насосу и наполните его дистиллированной водой.
- Наполните одну трубку PE50 длиной около 60 см дистиллированной водой, используя шприц объемом 1 мл и иглу 21 г. Важно оставить иглу 21G и шприц на месте после заполнения. Подключите трубку PE50 к шприцевым насосом; оставьте иглу/шприц 21 г на одном конце трубки PE50 и соедините другой конец со шприцем 10 мкл.
- Как только трубка будет прикреплена к шприцу 10 мкл, удалите иглу на другом конце и нажмите поршень шприца 10 мкл, чтобы заполнить пробел, оставленный иглой, водой.
ПРИМЕЧАНИЕ: Убедитесь, что нет пузырька воздуха, и что трубка полностью заполнена водой. - Установите канюлю 28 Г на конец трубки, где была удалена игла. Протолкнуть воду в канюлю шприцем 10 мкл, чтобы полностью заполнить ее. Плотно прикрепите канюлю к стереотаксической руке.
- Подготовьте тест AAV (здесь AAV 9-CaMKIIα0.4-cofilinS3D-HA)и/или контрольный AAV (здесь AAV9-CaMKIIα0.4-eGFP) путем разбавления стоковой смеси (es) AAV (здесь AAV в растворе фосфатно-буферного физиологического раствора, содержащего неионное поверхностно-активное вещество [0,001%]) стерильным физиологическим раствором для получения желаемого вирусного титра (обычно10 12-13 копий генома [GC]/мл) и необходимого объема для количества мышей, поддающихся лечению.
- Заготовка животных
ПРИМЕЧАНИЕ: Самцы и самки мышей C57BL6/J возрастом ~12 недель ранее были адаптированы в течение не менее 2 недель к размещению в отдельных клетках и к 12-х летнему светлому: 12-ч темному циклу с пищей и водой ad libitum и доступом к деревянному кубу.- Тщательно взвесьте мышей и вводят внутрибрюшинно смесь кетамина / ксилазина (120/10 мг / кг) для анестезии. Подождите примерно 10 минут для глубокой анестезии.
- Сбривайте волосы от задней части ушей до передней части головы между глазами с помощью триммера для волос.
ПРИМЕЧАНИЕ: Будьте очень осторожны, чтобы не разрезать усы (защитить усы пальцем во время бритья), так как обрезка усов изменит сенсорные входы и активность ECoG35,36. - Добавьте щедрую каплю офтальмологической мази на каждый глаз, чтобы предотвратить обезвоживание. Регулярно проверяйте глубину анестезии во время процедуры, зажимая ноготь от задней лапы. Обеспечьте мышь 0,5-1,5% изофлурана, чтобы обеспечить глубокую анестезию при появлении рефлекса защемления на носе.
2. Интракортикальная инъекция AAV со шприцевым насосом
ПРИМЕЧАНИЕ: Выполните все следующие шаги со стерилизованными инструментами и в чистой среде. Используйте 70% этанол для дальнейшей промывки стерилизованных инструментов и для промывки электродов, приготовленных в разделе 1.1, а также анкерных винтов (винтов, не покрытых золотом) перед началом операции.
- Аккуратно зафиксируйте головку мыши на стереотаксическом аппарате с помощью ушных вкладышей.
ПРИМЕЧАНИЕ: Убедитесь, что голова не движется в боковом движении. - Осторожно вытяните язык животного изо рта, чтобы избежать удушья, и зафиксируйте нос мыши стереотаксическим адаптером.
ПРИМЕЧАНИЕ: Часто контролируйте дыхание во время процедуры. - Стерилизуют бритый участок головы 70% этанолом и, удерживая кожу дополнительными тонкими щипцами Graefe, разрезают кожу от основания ушей до уровня глаз тканевыми ножницами. Используйте четыре хирургических зажима, чтобы растянуть кожу и обнажить череп (по два с каждой стороны разреза; см. Рисунок 1D).
- Поцарапайте поверхность черепа острым кончиком ножниц: избегая костных швов, удалите надкостницу и создайте перекрывающиеся полосы в двух и более направлениях. Удалите костные фрагменты и высушите череп 70% этанолом.
ПРИМЕЧАНИЕ: Царапины и расчесывание помогут сделать монтаж записи более надежным, улучшив сцепление цемента с черепом (см. Ниже). - С помощью канюли, закрепленной на стереотаксической руке, определите расположение брегмы (т. е. пересечение коронального и сагиттального швов черепа; Рисунок 1D) и лямбда (т.е. пересечение между сагиттальным швом черепа и прямой линией, соединяющей левый и правый лямбдовидный шов; Рисунок 1D), и обратите внимание на стереотаксические координаты каждого из них. Если разница между координатами z (вертикальной осью) брегмы и лямбды больше 0,3 мм, отрегулируйте высоту носа с помощью стереотаксического адаптера до тех пор, пока положение z брегмы и лямбды не будет выровнено.
- Отметьте положение канюли на черепе ручкой по этим координатам (моторная кора): 1,5 мм латерально справа до средней линии и 1,5 мм с передней до брегмы. Осторожно проткните череп в положении канюли сверлом 0,7 мм в направлении, перпендикулярном поверхности черепа (выровненном с вертикальной осью). Промыть проколотый череп стерильным хлопковым наконечником, пропитанным 10% раствором провидона-йода.
- Загрузите канюлю пузырьком воздуха 1 мкл, оттянув поршень шприца 10 мкл назад на 1 мкл. Загрузите тестируемый AAV (здесь AAV9-CaMKIIα0.4-CofilinS3D-HA) или контрольный AAV (здесь AAV9-CaMKIIα0.4-eGFP) в канюлю, предварительно загруженную воздушным пузырьком: смешайте AAV, медленно пипетируя вверх и вниз, пипеткой 1,7 мкл на стерильной чашке Петри и аспирируйте 1,5 мкл раствора в канюле, медленно потянув поршень шприца 10 мкл. Отметьте положение пузырька воздуха на трубке PE50, чтобы обеспечить отслеживание впрыска.
- Выровняйте канюлю с отверстием на черепе, чтобы вертикальное положение канюли достигло верхнего края черепа (т. Е. Поверхности черепа). От поверхности черепа медленно опустите канюлю на 1,5 мм (чтобы достичь 1,5 мм ниже поверхности черепа и слоя V моторной коры).
ПРИМЕЧАНИЕ: Будьте очень осторожны, чтобы не опустить канюлю слишком сильно, чтобы избежать ненужного поражения мозговой ткани. - Запустите шприцевой насос для инъекции 1 мкл AAV в течение 40 мин (скорость: 0,025 мкл/мин для минимизации повреждения тканей). Отслеживайте впрыск на трубке PE50 с движением пузырька воздуха и при необходимости вносите коррективы.
- После того, как инъекция будет завершена, оставьте канюлю на месте в течение 5 минут, чтобы обеспечить достаточную диффузию и избежать обратного потока. Затем медленно и осторожно поднимите стереотаксическую руку, чтобы удалить канюлю из коры.
3. Имплантация электродов ECoG/EMG
- Используя прямые щипцы Келли, медленно вкрутите один электрод ECoG (с прямой золотой проволокой) в вертикальную ось (под тем же углом, под которым было пробито отверстие) в отверстие, куда был впрыскен AAV. Оставьте не менее 2,5 мм винта из черепа, чтобы свести к минимуму повреждение твердой мозговой оболочки и коры головного мозга (т.е. на приблизительную глубину 1,1 мм от поверхности черепа); Рисунок 1D).
- Обозначьте положение заднего электрода ECoG и опорного электрода на черепе ручкой по следующим координатам: задний электрод (зрительная кора) 1,5 мм латеральный справа до средней линии и 1,5 мм с передней до лямбды, опорный электрод (соматосенсорная кора) 2,6 мм боковой справа до средней линии и 0,7 мм с задней стороны к брегме. Кроме того, отметьте положение трех крепежных винтов (действующих как анкеры между черепом и зубным цементом для затвердения монтажа головы) в левом полушарии без конкретных координат, но как можно дальше друг от друга и от электродов ECoG.
- Осторожно проткните череп в отмеченном положении других электродов и анкерных винтов сверлом 0,7 мм. Прокалывайте в направлении, перпендикулярном поверхности черепа для каждого винта (т.е. вертикальной оси для заднего электрода, но с углом от вертикальной оси для других участков). Промыть проколотый череп 10% раствором провидона-йода и заблокировать отверстия небольшими, свернутыми кусочками деликатных стеклоочистителей перед установкой винтов, чтобы предотвратить кровотечение и загрязнение.
- Используя прямые щипцы Келли, прикрутите поддерживающие винты в левом полушарии, а затем прикрутите последние два электрода в правом полушарии. Убедитесь, что вы прикрутили с тем же углом, под которым были пробиты отверстия, и оставили не менее 2,5 мм каждого винта из черепа(рисунок 1D).
ПРИМЕЧАНИЕ: Чтобы максимизировать прочность конечного монтажа и качество электрофизиологических сигналов, будьте осторожны, чтобы не коснуться ни одного винта при установке следующего. - Поместите несколько небольших капель зубного цемента в центр кольцеподобного пространства внутри винтов. Вставьте изогнутый конец одного электрода ЭМГ (подготовленного на этапе 1.1.2) примерно на 1-2 мм в мышцы шеи, удерживая изогнутую конечность с помощью щипцов Дюмона #5 и поднимая кожу над мышцами сверхтонкими щипцами Грефе. Затем поместите изогнутую сторону и колено электрода в зубной цемент; повторить для второго электрода ЭМГ.
ПРИМЕЧАНИЕ: Прямой конец более длинного электрода ЭМГ должен быть выровнен с передним электродом ECoG, а более короткий электрод EMG с задним электродом ECoG. Убедитесь, что два электрода ЭМГ не касаются друг друга или любого из винтов. - Закройте глаза мышей и примените свет на 3-5 минут, чтобы помочь затвердеть цементу. Как только электроды ЭМГ крепко удерживаются, покройте основание электродов ECoG и основание анкерных винтов зубным цементом, чтобы сформировать коронкообразный контур. Закройте глаза мышей и примените свет на 3-5 минут, чтобы помочь затвердеть цементу.
ПРИМЕЧАНИЕ: Не наносите цемент на конечности электродов ECoG и EMG (золотая проволока, которая будет припаята к разъему) или на кожу. - Заполните центр монтажа предварительно смешанным акриловым цементом. Во время затвердевания цемента удалите четыре хирургических зажима, удерживающих кожу (и немедленно вымойте их деликатными дворниками).
ПРИМЕЧАНИЕ: Не наносите цемент на конечности электродов ECoG и EMG (золотая проволока, которая будет припаята к разъему) или на кожу. - Зашивайте кожу сзади и спереди монтажа так, чтобы череп не подвергался воздействию (но избегайте слишком сильного растяжения кожи) с помощью шовной иглы (13 мм 3/8 c) и синтетического рассасывающегося монофиламента.
- Держите разъем над монтажом изогнутыми щипцами, и аккуратно выровняйте золотой провод электродов с контактами разъема. Припаяйте конечности электродов к контактам соединителя с паяльником.
ПРИМЕЧАНИЕ: Действуйте быстро, чтобы избежать перегрева и повреждения кортикальной ткани. Убедитесь, что каждый электрод хорошо контактирует с соответствующим контактом разъема и что электроды не соединены друг с другом. - Извлеките мышь из стереотаксической рамки. Закройте пустое пространство между разъемом и головкой предварительно смешанным акриловым цементом, закрыв все соединения между электродами и контактами разъема.
ПРИМЕЧАНИЕ: Избегайте проникновения цемента внутрь разъема, удерживая мышь с разъемом над головкой (голова прямо не наклоняется). - Взвесьте мышь и поместите ее в чистую клетку (желательно оснащенную несетчатой крышкой) на грелку (индивидуальный корпус во избежание повреждения монтажа головы). Регулярно контролируйте животное и вводите 0,1 мг / кг бупренорфина подкожно после пробуждения и через 12 ч, если животное проявляет признаки боли (например, ненормальная осанка, прищуренные глаза).
ПРИМЕЧАНИЕ: Прибавка в весе по отношению к предоперационной массе не должна превышать 1,5 г.
4. Записи
- Дом мышей индивидуально, чтобы избежать повреждения головного монтажа в результате взаимного груминга, а также повреждения и запутывания записывающих кабелей.
ПРИМЕЧАНИЕ: Для этого протокола мышей размещали с доступом ad libitum к пище, воде и деревянному кубу, и проводился ежедневный мониторинг. - Подключите мышей к записывающим кабелям через 2 недели после операции для адаптации к условиям прокладки кабелей.
- Записывайте сигналы ECoG/EMG в течение 24 ч (или дольше/короче в зависимости от исследовательских вопросов).
ПРИМЕЧАНИЕ: Запись сигнала ECoG/EMG осуществлялась с помощью кабеля, поворотного разъема (для обеспечения вращения кабеля), 36-канальной носимой коробки и усилителя, который был подключен к компьютеру. Сигналы сэмплируются при частоте 256 Гц (или более в зависимости от исследовательских вопросов) и записываются с помощью коммерческого программного обеспечения (см. Таблицу материалов). Чтобы обеспечить достаточную вирусную экспрессию, эксперименты следует проводить не менее чем через 3 недели после инъекции AAV, как описаноранее 29,37. - После записи жертвуйте мышей шей при вывихе шейки матки (или другими методами в зависимости от протокола иммуноокрашивания) и собирайте мозг для иммуноокрашивания.
Результаты
После электрофизиологических записей иммунофлуоресценция используется для определения области, инфицированной инъекцией AAV, и для проверки экспрессии кофилинаS3D (рисунок 2). Иммуноокрашивание может быть выполнено с использованием методики, аналогичной той, что была описанаранее 29,37,38,39. AAV экспрессирует неактивную форму кофилина, слитую с гемагглютинином (HA)-Tag (кофилинS3D-HA),которая обнаруживается иммунофлуоресценцией с использованием антитела против ГК и вторичного антитела (Alexa Fluor 488). Инфицированные возбуждающие нейроны (здесь, нацеленные на кальций/кальмодулин-зависимую протеинкиназу II альфа [CamKIIα] промотор, контролирующий экспрессию трансгена, содержащегося в AAV) окрашивают антителом против ГК. На успешную инфекцию указывает окрашивание нейронов в моторной коре, окружающей место инъекции(рисунок 2A,B). В этом репрезентативном примере кора головного мозга другого полушария не показала какого-либо заметного окрашивания. Тем не менее, учитывая, что возбуждающие нейроны могут проецироваться на отдаленные области мозга, окрашивание в контралатеральном полушарии не обязательно является признаком неудачной инъекции. Более высокое увеличение инфицированной области показало окрашивание клеточных тел и проекций, подтверждая, что были инфицированы только специфические клетки целевой области коры(рисунок 2C).
Совместное окрашивание маркерами возбуждающих нейронов (например, везикулярным транспортером глутамата 1, CaMKIIα) также может быть выполнено для проверки типоспецифичности клеток. Альтернативно, совместное окрашивание маркерами тормозных нейронов или астроцитов может быть выполнено в случае, если эти клетки нацелены с использованием различных промотеров. Совместное окрашивание кофилинаS3D-HAи CaMKIIα также проводилось у того же животного для области, более постороннее места инъекции, которая все еще показывала окрашивание анти-ГК в моторной коре(рисунок 2D). На изображении области с более высоким увеличением показаны клетки, четко экспрессивающие кофилинS3D-HA(Alexa Fluor 488, рисунок 2E)и CaMKIIα (Alexa Fluor 568, рисунок 2F). Суперпозиция окрашивания кофилиномS3D-HAи CaMKIIα показывает, что большинство (если не все) клеток, окрашенных для кофилинаS3D-HA,также положительны для CaMKIIα(рисунок 2G). Это наблюдение подтверждает специфичность инфекции для возбуждающих нейронов.
Для оценки влияния манипуляций с кофилином на активность ECoG используются сигналы ECoG и EMG для выполнения визуальной идентификации состояний бдительности (бодрствование, медленный сон, парадоксальный сон). Делается это на 4-х эпохах из-за быстрой смены состояния бдительности у мыши2,а здесь, для полноценной 24-х ч записи. Стандартные анализы включают вычисление архитектуры сна и переменных спектрального анализа, как проводилось ранее для различных наборов данных11,12,13,28,34. В частности, спектральный анализ ECoG сигнала различных состояний будет индексировать состав и качество состояния. Чтобы устранить различия, которые могли возникнуть, например, из разных глубин электродов, данные спектрального анализа могут быть выражены относительно общей мощности всех состояний данного животного(рисунок 3А). Учитывая очень низкую относительную амплитуду активности ECoG на более высоких частотах, спектры относительной мощности для бодрствования, медленного сна и парадоксального сна были преобразованы для более адекватной визуализации и одновременного сравнения активности на низких и высоких частотах. Данный анализ указывает на специфические для состояния различия в спектральной активности в условиях инактивации кофилина(рисунок 3В). Точнее, эти предварительные результаты, объединяющие самцов и самок мышей, указывают на то, что инактивация кофилина значительно увеличивает спектральную мощность на быстрых частотах (14-30 Гц) во время бодрствования и на медленных частотах (1-4 Гц) во время парадоксального сна, оставляя активность ECoG во время медленного сна в основном незатронутой. Кроме того, инактивация кофилина, по-видимому, увеличивает вариабельность активности ECoG между мышами (особенно заметно из полос ошибок для бодрствования на рисунке 3B).
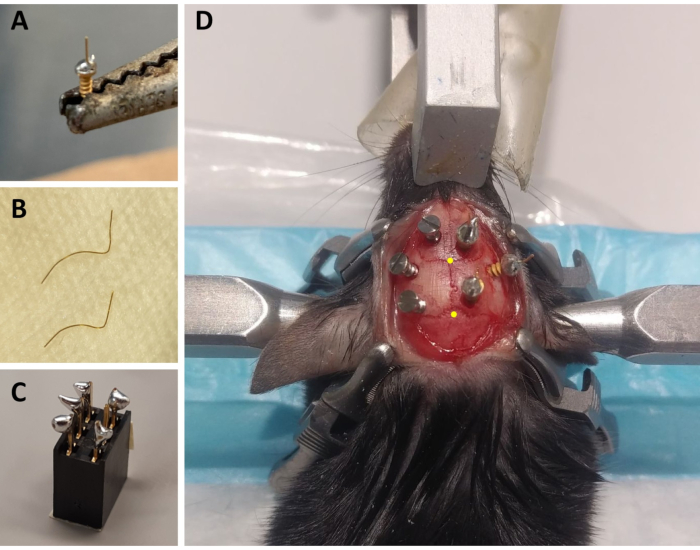
Рисунок 1:Подготовка монтажных компонентов ECoG/EMG и репрезентативный пример размещения электродов ECoG. (A)Электрод ECoG: золотая проволока длиной 4 мм, диаметром 0,2 мм (неизолированная) сплавлена на головке позолоченный винт (диаметр головки 1,9 мм, основной диаметр резьбы 1,14 мм, общая длина 3,6 мм) с использованием бессвинцового припоя. (B)Электроды ЭМГ: два золотых провода (1,5 и 2 см) изогнуты, чтобы охватить изгиб черепа до мышцы шеи, а другой конец держится прямо, чтобы быть припаянным к разъему. (C)6-канальный разъем: бессвинцовый припой добавляется к 5 из 6 металлических контактов (исключая один посередине) разъема (5 мм x 8 мм x 8 мм + 3 мм металлические контакты). Верхняя часть разъема покрыта лентой, чтобы избежать проникновения мусора / воды. (D)Пример позиционирования трех поддерживающие винты на черепе левого полушария и трех электродов ECoG (включая электрод отсчета) на правом полушарии. Точные стереотаксические координаты электродов ECoG указаны на шагах 2.6 и 3.2 и рассчитаны в соответствии с местоположением брегмы и лямбды (которые обозначены желтыми точками). Сокращения: ECoG = электрокортикографическая; ЭМГ = электромиографическая. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
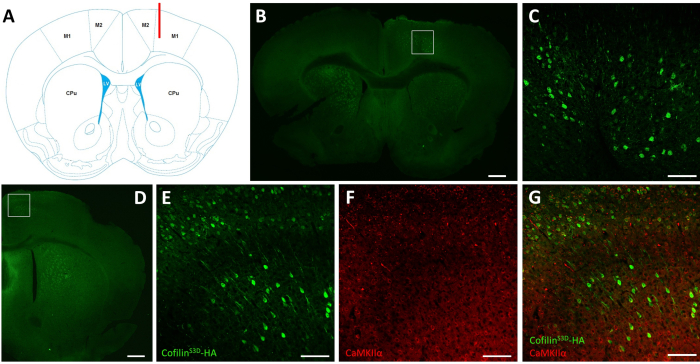
Рисунок 2:Репрезентативное иммуноокрашивание для определения AAV-инфицированной области и типа клеток. (A)Схематическое изображение, показывающее место инъекции коронального среза, представленное на панели B. Положение составляет 1,1 мм к брегме, а канюля (показана красным цветом) была нацелена на слои V правой первичной моторной коры (M1). Представление изменено из Franklin and Paxinos40. (B)Иммуноокрашивание ГК для обнаружения экспрессии кофилинаS3D-HAв нейронах, показанное для коронального среза полного мозга, расположенного примерно на 1,1 мм перед брегмой. Зараженная область в основном локализуется в слоях V и VI (инфрагранулярные слои) правой первичной и вторичной двигательной коры (М1 и М2). Шкала бара = 500 мкм. Квадрат представляет собой площадь, показанную в C. (C) Более высокое увеличение инфицированной области, показывающее окрашивание инфицированных клеток и подтверждающее экспрессию кофилинаS3D-HAв более глубоких слоях моторной коры. Шкала bar = 100 мкм.(D)Коиммуноразражание ГК и CaMKIIα для оценки типоспецифичности клеток, показанных для коронального среза правого полушария, расположенного примерно на 0,5 мм к брегме и, следовательно, позадней части места инъекции (та же мышь, что и на панелях B и C). Зараженная область локализуется в двигательной коре (М1 и в основном М2). Шкала бара = 500 мкм. Квадрат представляет собой площадь, показанную в E, F и G. (E)Более высокое увеличение инфицированной области, показывающее окрашивание инфицированных клеток и подтверждающее экспрессию кофилинаS3D-HA. Шкала бара = 100 мкм. (F) Более высокое увеличение инфицированной области, показывающее окрашивание CaMKIIα-положительных клеток. Шкала бара = 100 мкм.(G)Более высокое увеличение инфицированной области показывает ко-маркировку кофилинаS3D-HAи CaMKIIα, подтверждая, что инфицированные клетки являются CaMKIIα-положительными. Шкала бара = 100 мкм. Сокращения: AAV = аденоациированный вирус; M1 = первичная моторная кора; M2 = вторичная моторная кора; CPu = хвостатое путамен (полосатое тело); LV = боковой желудочек; HA= гемагглютинин; CamKIIα = кальций/кальмодулин-зависимая протеинкиназа II альфа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
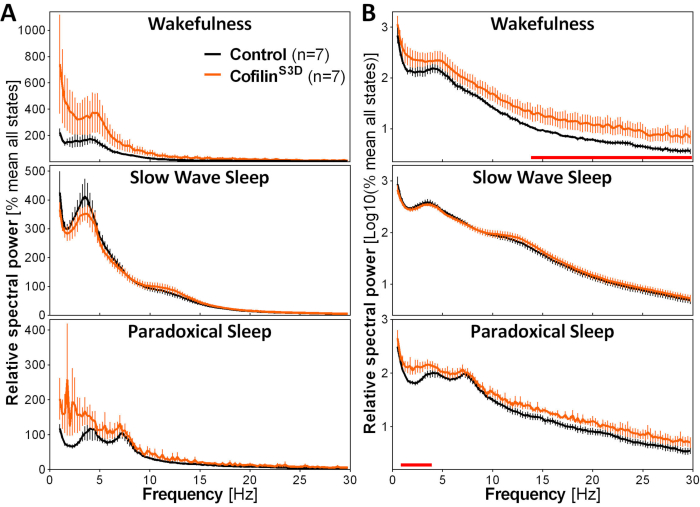
Рисунок 3:Репрезентативные спектры мощности для бодрствования, медленного сна и парадоксального сна, полученные после вирусных манипуляций с функцией кофилина. Самцов (n = 5 на группу) и самок (n= 2 на группу) мышей, вводимых с AAV 9-CaMKIIα0.4-кофилиномS3D-HA(вирусный титр 2,58 ×10 13 ГК/мл) или с контрольным AAV (AAV 9-CaMKIIα0.4-eGFP 1,25 × 1013 ГК/мл; половина титра теста для контроля усиленного сигнала этого контрольного AAV) в слое V моторной коры регистрировали в течение 24 ч, а электрокортикографический сигнал подвергали спектральному анализу (быстрое преобразование Фурье для расчета спектральной мощности от 0,5 до 30 Гц с разрешением 0,25 Гц). (A)Спектры мощности во время трех состояний бдительности, выраженные относительно общей мощности всех состояний. (B)Относительная мощность спектров логарифмической трансформации для более адекватного представления групповых различий на более высоких частотах. Подавление активности кофилина в моторной коре с помощью AAV 9-CaMKIIα0.4-кофилинаS3D-HAзначительно повышает электрокортикографическую активность в бета-диапазоне (14-30 Гц) во время бодрствования и в дельта-диапазоне (1-4 Гц) во время парадоксального сна по сравнению с контрольными инъекциями (красные линии над осями x указывают на Mann-Whitney U-testна частотный диапазон мощности p < 0,05). Сокращения: AAV = аденоассоциированный вирус GC = копии генома; HA= гемагглютинин; CamKIIα = кальций/кальмодулин-зависимая протеинкиназа II альфа; eGFP = улучшенный зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот протокол описывает точный и простой метод мониторинга активности ECoG и EMG во время манипулирования молекулярными мишенями с использованием AAV. Для адекватного сравнения между группами настоятельно рекомендуется всегда планировать хирургические процедуры (инъекция AAV и имплантация электродов) в один и тот же день для подопытных и контрольных животных и одновременно записывать их электрофизиологические сигналы. Для получения аналогичной вирусной экспрессии между искомым и контрольными животными желательно вводить один и тот же вирусный титр. В настоящем случае вирусный титр контрольного AAV был снижен до половины тестового AAV для обеспечения аналогичной вирусной экспрессии. Экспериментаторы должны быть очень осторожны с измерениями стереотаксических координат, чтобы обеспечить низкую изменчивость между животными в нацеливаниях на область мозга / кортикальный слой. Кроме того, учитывая, что глубина инъекции рассчитывается по поверхности черепа и что толщина черепа варьируется в зависимости от возраста и пола, размещение канюли всегда должно быть проверено с использованием постпротоколя гистологии или иммуногистохимии (например, рисунок 2),чтобы обеспечить адекватное позиционирование / глубину инъекции, и стереотаксические координаты должны быть скорректированы при необходимости. В течение 40-минутного впрыска AAV очень важно контролировать скорость впрыска, чтобы быстро обнаружить и исправить потенциальные проблемы, такие как засорение насоса. Некоторые экспериментальные этапы также имеют решающее значение для получения оптимальных электрофизиологических сигналов. Например, не переворачивайте во время имплантации электрода; винты должны торчать из черепа не менее чем на 2,5 мм, чтобы свести к минимуму повреждение коры головного мозга и образование глиального рубца. После этого также чрезвычайно важно: i) избегать нанесения цемента на конечности электродов, ii) обеспечить быструю пайку электродов к разъему и iii) убедиться, что между электродами нет контакта.
Процедура, представленная здесь для записи ECoG и EMG, чрезвычайно хорошо зарекомендовала себя, проста и широко используется для мониторинга бодрствования и сна у мышей2,11,13,34. Непрерывные записи ECoG и EMG могут выполняться в течение нескольких последовательных дней (и даже недель) и генерировать очень богатый набор данных, который можно использовать для выполнения нескольких линий анализа, включающих переменные, связанные с бодрствованием и количеством сна и архитектурой2,11,12 (например, время, проведенное в разных состояниях на светлый и темный периоды, количество эпизодов каждого состояния, 24-ч распределение сна), бодрствование и спектральное содержание сна34,41 (например, мощность в различных полосах частот [аналогично рисунку 3],бесмасштабная активность) и характеристики отдельных волн42,43,44 (например, амплитуда медленных волн и наклон). При использовании в сочетании с AAV-опосредованными молекулярными манипуляциями дополнительным преимуществом является избежание потенциальной компенсации развития, которая может произойти у трансгенных животных. С практикой вся процедура, включая 40-минутную инъекцию AAV, может быть выполнена примерно за 90 минут. Уровень смертности должен быть (очень) низким, так как операция является минимально инвазивной.
Одновременное использование записи ECoG/EMG и целевых манипуляций с AAV предлагает множество других преимуществ и применений. Например, точность стереотаксического таргетирования, при адекватном выполнении, очень высока и воспроизводима и полезна для определения конкретной роли данной области мозга (и/или типа клетки или молекулярного элемента в области) в регуляции сна или других физиологических процессов. Таким образом, несколько различных областей коры могут быть легко нацелены с использованием адаптаций текущего протокола. Кроме того, целевые манипуляции с использованием AAV могут быть направлены на кортиковую / подкорковую область, отличавшуюся от сайтов записи ECoG. В таких случаях отверстие заусенца для инъекции AAV может быть закрыто небольшим стеклянным покровным листом, закрепленным с помощью зубного цемента (или костного воска). Для повышения специфичности конструкция AAV часто включает в себя промотор, который позволяет целенаправленное инфицирование точного типа клеток14. Промотор CamKIIα был использован в настоящем протоколе для лечения возбуждающих пирамидальных клеток14,29,45моторной коры. Эта стратегия позволила инактивировать кофилин (с использованием кофилинаS3D)32,33 в возбуждающих нейронах моторной коры и наблюдать специфические для состояния изменения активности ECoG(рисунок 3). Для оценки эффективности инфекции /трансдукции будущие пользователи протокола могут объединить представленный протокол AAV-ECoG с протоколом совместного окрашивания иммунофлуоресценцией и использовать изображения с высоким увеличением для расчета количества клеток, показывающих двойную маркировку из общего числа клеток, показывающих одинарную маркировку мишени (здесь CaMKIIα-экспрессирующие нейроны). В недавнем исследовании метод AAV-ECoG, аналогичный описанной здесь, был использован для сверхэкспрессии хрупкого белка 1, связанного с синдромом умственной отсталости X (FXR1), во всех нейронах моторной коры с использованием AAV, содержащего промотор синапсина, и выявил влияние этой манипуляции на распределение состояния бдительности и спектральное содержание28. Эти результаты иллюстрируют, как манипулирование данной молекулой в целевой области мозга с использованием AAV может выявить роли в регуляции конкретных параметров бодрствования / сна.
Ограничением описанного протокола является небольшое поражение мозговой ткани, происходящее при размещении канюли перед выполнением инъекции AAV, которое также может сопровождаться воспалительной реакцией. Это может вызывать особую озабоченность при выполнении инъекций AAV в подкорковые области и всегда должно решаться с помощью адекватных элементов управления. Альтернативно, за текущим протоколом может последовать количественная оценка реактивного глиоза и/или активации микроглии (например, с использованием иммунофлуоресценции) для обеспечения аналогичных уровней в контрольной и тестовой группах и, следовательно, в показаниях ECoG. Второе ограничение связано с риском плохого соединения между электродом и разъемом, что может привести к непрерывному или иногда плохому электрофизиологическому сигналу. Прочно привинченные, спаянные и цементированные электроды сведут к минимуму возникновение этой проблемы. Третье ограничение связано с тем, что животные привязываются через монтаж головы во время записи, что может ограничить передвижение и другое поведение, по крайней мере, в некоторой степени, и иногда приводить к повреждению кабелей и потере сигнала. Наконец, представленный протокол больше подходит для взрослых мышей, учитывая, что размер черепа более молодых животных может вызвать трудности при установке изображенного монтажа головы, как описаноранее 2.
Комбинированная запись ECoG / EMG и AAV-опосредованная манипуляция точной мишенью также применимы к областям исследований, отличных от нейробиологии сна. Среди прочего, он может быть использован для изучения и манипулирования эпилептическими событиями на животных моделях судорог и является мощным инструментом для модуляции колебаний мозга, участвующих в кодировании и консолидации памяти46,47. Соответственно, потенциальные приложения, безусловно, охватывают области фундаментальных исследований в психиатрии и неврологии, включая нейродегенеративные заболевания. В дополнение к способности экспрессировать неактивную форму молекулы, AAV могут и использовались для сверхэкспрессии или понижения регуляции (например, малоинтерферирующей РНК, CRISPR / Cas9) или для спасения экспрессии молекулы в ко всего тела. Важно отметить, что двойная методология текущего протокола также применима к другим видам млекопитающих, таким как крысы и суточные грызуны, которые представляют собой интересные модели для понимания как сна, так и нейродегенерации48,49.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Работа финансировалась Канадской исследовательской кафедрой молекулярной физиологии сна. Авторы благодарны Хлое Провост и Кэролайн Бушар за техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Surgery peparation | |||
| 21 G needle | Terumo | NN-2125R | |
| 6-channel connector | ENA AG | BPHF2-O6S-E-3.2 | Connector used in this manuscript, but discontinued. See potential replacement below |
| Distrelec | 300-93-672 | Potential replacement for discontinued connector above | |
| C57BL6/J mice | Jackson Laboratory | 000664 | B6 | Animals bred on site |
| Pluronic F-68 | Non-ionic surfactant | ||
| Gold wire 0.2 mm diameter | Delta scientific | 920-862-41 | Non-insulated |
| Hamilton syringe (10 μL) | Fisher Scientific | 14815279 | |
| Infusion syringe Pump CMA 402 | Harvard Apparatus | CMA8003110 | |
| Injection cannula 28 G | Plastics one | C313l-SPCL | |
| Isoflurane | Baxter | CA2L9100 | |
| Ketamine (10 mg/mL) | SANDOZ | 4550 | |
| Lead-free solder | AIM | SN100C | |
| Lubricating ophthalmic ointment | ALLERGAN | 210889 | |
| PE 50 Catheter thin wall | Plastics one | C232CT | |
| Flat fillister head self tapping screws | MORRIS | FF00CE125 | ECoG electrode gold covered; Dimension : 1.9 mm head diameter, 1.14 mm thread major diameter, 3.6 mm length |
| Soldering iron | Weller | WES51 | |
| Syringe 1 mL | BD | 309659 | |
| Trimmer | Harvard Apparatus | 72-9063 | |
| Xylazine (20 mg/mL) | Bayer | 2169592 | |
| Intracortical AAV injection with syringe pump | |||
| 0.7 mm drill bit | Dremel | 628 | |
| AAV9-CaMKIIα0.4-cofilinS3D-HA | UPenn Viral Core | ||
| AAV9-CaMKIIα0.4-eGFP | UPenn Viral Core | ||
| Cotton tippped applicators | Medicom | 806 | |
| Drill | Dremel | 8050-N/18 | |
| Extra-fine Graefe forceps | Fine science tools | 11150-10 | |
| Stereotaxic arm | Stoelting | 51604U | |
| Stereotaxic frame | Stoelting | 51600 | |
| Surgical clamps | Fine science tools | 18050-28 | |
| Tissue scissor | Magna Stainless | M4-124 | |
| ECoG/EMG electrode implantation | |||
| Buprenorphine (0.3 mg/mL) | CEVA | 57133-02 | |
| Curved forceps | Fine science tools | 11001-12 | |
| Delicate task wipers | Kimtech | 34120 | |
| Dental acrylic cement | Yates Motloid | 44115 | |
| Dumont #5 forceps | Fine science tools | 91150-20 | |
| Extra fine Graefe forceps | Fine science tools | 11150-10 | |
| Kelly forceps | Fine science tools | 13002-10 | |
| Liquid acrylic | Yates Motloid | 44119 | |
| Monocryl plus suture needle 13 mm 3/8c rev cutting | Ethicon | MCP494 | |
| Providone-iodine 10% | Triad disposables | 10-8208 | |
| RelyX Unicem 2, Adhesive Resin Cement A2 | 3M | 56849 | |
| Immunofluorescence and ECoG recording | |||
| 36-Channel EEG Wearable Headbox | LaMONT Medical | 832-000350 | |
| CaMKII alpha Monoclonal Antibody (Cba-2) | Invitrogen | 13-7300 | Dilution 1:500 |
| Conductors Awg PVC Insulation Cable | Calmont Wire & Cables | HC-0819075R0 | |
| Donkey anti-Mouse IgG secondary Ab, Alexa Fluor 568 | Invitrogen | A10037 | Dilution 1:1000 |
| Goat anti-Rabbit IgG secondary Ab, Alexa Fluor 488 | Invitrogen | A-11008 | Dilution 1:500 |
| HA-Tag (C29F4) Rabbit mAb | Cell signaling | 3724 | Dilution 1:800 |
| Programmable Amplifier | LaMONT Medical | 815-000002-S2 | |
| Stellate Harmonie | Natus | HSYS-REC-LT2 | |
| Swivel connector | Crist Instrument Company Inc. | 4-TBC-9-S |
Ссылки
- Campbell, I. G. EEG recording and analysis for sleep research. Current Protocols in Neuroscience. , (2009).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Current Protocols in Mouse Biology. 2 (1), 55-74 (2012).
- Bastien, C. H., et al. Insomnia and sleep misperception. Pathologie Biologie. 62 (5), 241-251 (2014).
- Malafeev, A., et al. Automatic artefact detection in single-channel sleep EEG recordings. Journal of Sleep Research. 28 (2), 12679 (2019).
- Latreille, V., et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease. Brain. 139, 1189-1199 (2016).
- Rodrigues Brazete, J., et al. Electroencephalogram slowing predicts neurodegeneration in rapid eye movement sleep behavior disorder. Neurobiology of Aging. 37, 74-81 (2016).
- Kent, B. A., Strittmatter, S. M., Nygaard, H. B. Sleep and EEG power spectral analysis in three transgenic mouse models of Alzheimer's disease: APP/PS1, 3xTgAD, and Tg2576. Journal of Alzheimers Disease. 64 (4), 1325-1336 (2018).
- Chang, A. M., et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiology International. 33 (5), 561-573 (2016).
- Shi, G., Wu, D., Ptacek, L. J., Fu, Y. H. Human genetics and sleep behavior. Current Opinion in Neurobiology. 44, 43-49 (2017).
- Nakai, Y., et al. Calcineurin and its regulator sra/DSCR1 are essential for sleep in Drosophila. Journal of Neuroscience. 31 (36), 12759-12766 (2011).
- El Helou, J., et al. Neuroligin-1 links neuronal activity to sleep-wake regulation. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9974-9979 (2013).
- Freyburger, M., et al. EphA4 is involved in sleep regulation but not in the electrophysiological response to sleep deprivation. Sleep. 39 (3), 613-624 (2016).
- Seok, B. S., et al. The effect of Neuroligin-2 absence on sleep architecture and electroencephalographic activity in mice. Molecular Brain. 11 (1), 52 (2018).
- Haery, L., et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation. Frontiers in Neuroanatomy. 13, 93 (2019).
- Schmidt, F., Grimm, D. CRISPR genome engineering and viral gene delivery: a case of mutual attraction. Biotechnology Journal. 10 (2), 258-272 (2015).
- Wang, D., Zhang, F., Gao, G. CRISPR-based therapeutic genome editing: strategies and in vivo delivery by AAV vectors. Cell. 181 (1), 136-150 (2020).
- Havekes, R., et al. Transiently increasing cAMP levels selectively in hippocampal excitatory neurons during sleep deprivation prevents memory deficits caused by sleep loss. Journal of Neuroscience. 34 (47), 15715-15721 (2014).
- Fuller, P. M., Yamanaka, A., Lazarus, M. How genetically engineered systems are helping to define, and in some cases redefine, the neurobiological basis of sleep and wake. Temperature. 2 (3), 406-417 (2015).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ono, D., Yamanaka, A. Hypothalamic regulation of the sleep/wake cycle. Neuroscience Research. 118, 74-81 (2017).
- Shiromani, P. J., Peever, J. H. New neuroscience tools that are identifying the sleep-wake circuit. Sleep. 40 (4), 032 (2017).
- Oishi, N., et al. Artificial association of memory events by optogenetic stimulation of hippocampal CA3 cell ensembles. Molecular Brain. 12 (1), 2 (2019).
- Anaclet, C., et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control. Journal of Neuroscience. 38 (22), 5168-5181 (2018).
- Chen, K. S., et al. A hypothalamic switch for REM and non-REM sleep. Neuron. 97 (5), 1168-1176 (2018).
- Torontali, Z. A., Fraigne, J. J., Sanghera, P., Horner, R., Peever, J. The sublaterodorsal tegmental nucleus functions to couple brain state and motor activity during REM sleep and wakefulness. Current Biology. 29 (22), 3803-3813 (2019).
- Rolls, A., et al. Optogenetic disruption of sleep continuity impairs memory consolidation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13305-13310 (2011).
- Ognjanovski, N., Broussard, C., Zochowski, M., Aton, S. J. Hippocampal network oscillations rescue memory consolidation deficits caused by sleep loss. Cerebral Cortex. 28 (10), 3711-3723 (2018).
- Khlghatyan, J., et al. Fxr1 regulates sleep and synaptic homeostasis. EMBO Journal. 39 (21), 103864 (2020).
- Havekes, R., et al. Sleep deprivation causes memory deficits by negatively impacting neuronal connectivity in hippocampal area CA1. Elife. 5, 13424 (2016).
- Wong, L. W., Tann, J. Y., Ibanez, C. F., Sajikumar, S. The p75 neurotrophin receptor is an essential mediator of impairments in hippocampal-dependent associative plasticity and memory induced by sleep deprivation. Journal of Neuroscience. 39 (28), 5452-5465 (2019).
- Mizuno, K. Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular Signalling. 25 (2), 457-469 (2013).
- Nagaoka, R., Abe, H., Obinata, T. Site-directed mutagenesis of the phosphorylation site of cofilin: its role in cofilin-actin interaction and cytoplasmic localization. Cell Motility and the Cytoskeleton. 35 (3), 200-209 (1996).
- Elam, W. A., et al. Phosphomimetic S3D cofilin binds but only weakly severs actin filaments. Journal of Biological Chemistry. 292 (48), 19565-19579 (2017).
- Areal, C. C., Cao, R., Sonenberg, N., Mongrain, V. Wakefulness/sleep architecture and electroencephalographic activity in mice lacking the translational repressor 4E-BP1 or 4E-BP2. Sleep. 43 (2), (2020).
- Vyazovskiy, V., Borbely, A. A., Tobler, I. Unilateral vibrissae stimulation during waking induces interhemispheric EEG asymmetry during subsequent sleep in the rat. Journal of Sleep Research. 9 (4), 367-371 (2000).
- Sitnikova, E. Neonatal sensory deprivation promotes development of absence seizures in adult rats with genetic predisposition to epilepsy. Brain Research. 1377, 109-118 (2011).
- Tudor, J. C., et al. Sleep deprivation impairs memory by attenuating mTORC1-dependent protein synthesis. Science Signaling. 9 (425), 41 (2016).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293 (2015).
- Dufort-Gervais, J., et al. Neuroligin-1 is altered in the hippocampus of Alzheimer's disease patients and mouse models, and modulates the toxicity of amyloid-beta oligomers. Scientific Reports. 10 (1), 6956 (2020).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates, Third edition. , (2007).
- Lina, J. M., O'Callaghan, E. K., Mongrain, V. Scale-free dynamics of the mouse wakefulness and sleep electroencephalogram quantified using Wavelet-Leaders. Clocks & Sleep. 1 (1), 50-64 (2019).
- Massart, R., et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes. Translational Psychiatry. 4, 347 (2014).
- Freyburger, M., Poirier, G., Carrier, J., Mongrain, V. Shorter duration of non-rapid eye movement sleep slow waves in EphA4 knockout mice. Journal of Sleep Research. 26 (5), 539-546 (2017).
- Hubbard, J., et al. Rapid fast-delta decay following prolonged wakefulness marks a phase of wake-inertia in NREM sleep. Nature Communications. 11 (1), 3130 (2020).
- Johansen, J. P., et al. Optical activation of lateral amygdala pyramidal cells instructs associative fear learning. Proceedings of the National Academy of Sciences of the United States of America. 107 (28), 12692-12697 (2010).
- Boyce, R., Glasgow, S. D., Williams, S., Adamantidis, A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science. 352 (6287), 812-816 (2016).
- Bandarabadi, M., et al. Dynamic modulation of theta-gamma coupling during rapid eye movement sleep. Sleep. 42 (12), 182 (2019).
- Estrada, C., et al. Transcranial magnetic stimulation and aging: Effects on spatial learning and memory after sleep deprivation in Octodon degus. Neurobiology of Learning and Memory. 125, 274-281 (2015).
- Hurley, M. J., et al. The long-lived Octodon degus as a rodent drug discovery model for Alzheimer's and other age-related diseases. Pharmacology & Therapeutics. 188, 36-44 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены