Method Article
Registro eletrocorticográfico de áreas do córtex cerebral manipulado usando um vírus associado ao Adeno visando cofilina em camundongos
Neste Artigo
Resumo
Este artigo descreve um protocolo para a manipulação de alvos moleculares no córtex cerebral usando vírus associados ao adeno e para monitorar os efeitos dessa manipulação durante a vigília e o sono usando gravações eletrocorticográficas.
Resumo
O uso de gravações eletrocorticográficas (ECoG) em roedores é relevante para a pesquisa do sono e para o estudo de uma ampla gama de condições neurológicas. Os vírus associados ao Adeno (AAVs) são cada vez mais usados para melhorar a compreensão dos circuitos cerebrais e suas funções. A manipulação mediada por AAV de populações celulares específicas e/ou de componentes moleculares precisos tem sido tremendamente útil para identificar novos circuitos/moléculas regulatórias do sono e proteínas-chave que contribuem para os efeitos adversos da perda do sono. Por exemplo, a inibição da atividade de cofilina de proteína de corte de fistoso de actina usando AAV previne o prejuízo de memória induzido pela privação do sono. Aqui, é descrito um protocolo que combina a manipulação da função de cofilina em uma área de córtex cerebral com o registro da atividade ECoG para examinar se cofilina cortical modula os sinais de ECoG de vigília e sono. A injeção de AAV é realizada durante o mesmo procedimento cirúrgico que a implantação de eletrodos eletrodos eletromiográficos e eletromiográficos (EMG) em camundongos adultos masculinos e femininos. Os ratos são anestesiados, e suas cabeças são raspadas. Após a limpeza da pele e a incisão, coordenadas estereoxilicas do córtex motor são determinadas, e o crânio é perfurado neste local. Uma cânula pré-preenchida com um AAV expressando cofilinaS3D, uma forma inativa de cofilina, é lentamente posicionada no tecido cortical. Após a infusão de AAV, os parafusos cobertos de ouro (eletrodos ECoG) são aparafusados pelo crânio e cimentados ao crânio com fios dourados inseridos nos músculos do pescoço (eletrodos EMG). Os animais têm três semanas de recuperação e para garantir expressão suficiente de cofilinaS3D. A área infectada e o tipo celular são verificados por meio da imunohistoquímica, e o ECoG é analisado por meio da identificação visual de estados de vigilância e análise espectral. Em resumo, essa abordagem metodológica combinada permite a investigação da contribuição precisa dos componentes moleculares que regulam a morfologia neuronal e a conectividade à regulação da atividade do córtex cerebral sincronizado durante a vigília e o sono.
Introdução
Gravações eletroencefalográficas (ou geralmente eletrocorticográficas [ECoG] em roedores) e eletromiográficas (EMG) são amplamente utilizadas em pesquisas de sono, bem como de forma mais ampla em neurociência, neurologia e psiquiatria. Em combinação, esses sinais eletrofisiológicos permitem a identificação de estados de vigilância e a quantificação subsequente da duração do Estado e da composição espectral, tanto em humanos quanto em roedores1,2,3,4. Tal quantificação tem sido útil para entender como o sono é modificado em condições patológicas como doenças neurodegenerativas e modelos5,6,7 ou por modificação genética8,9. Por exemplo, o nocaute (KO) de diferentes genes ligados à comunicação neuronal mostrou-se alterar a duração da vigília e do sono tanto no camundongo quanto na mosca da fruta10,11,12,13. Para combater a compensação potencial do desenvolvimento decorrente do estudo do KO de corpo inteiro em roedores e permitir um controle mais fino da manipulação genética, uma maneira eficiente de manipular a expressão genética é usar vírus associados ao adeno (AAVs). Uma manipulação genética mediada pela AAV pode ser usada para diminuir ou regulamentar um determinado alvo molecular e restringir a manipulação a uma população celular específica usando diferentes tipos de promotores14. Os AAVs também são amplamente utilizados como um método de entrega na tecnologia palindômica curta interespaçada (CRISPR)/Cas915,16. Essas metodologias permitem um melhor controle temporal e espacial da manipulação genética, o que geralmente está associado à expressão de um repórter que permite quantificação da área infectada usando imunofluorescência.
Os AAVs também representam o principal vetor para manipulações específicas do tipo celular da atividade neuronal via optogenética e quimioterapia17,18,19, que têm sido amplamente utilizados em pesquisas recentes sobre doenças neurodegenerativas, comportamento, cognição e sono20,21,22. Na pesquisa do sono, a aplicação de optogenética para a ativação ou inibição de determinadas regiões cerebrais, como o cérebro basal, hipotálamo e tegmentum sublaterodor, tem sido útil para determinar seus papéis no controle do sono de ondas lentas (também conhecido como sono de movimento ocular não rápido), sono paradoxal (ou sono rápido do movimento ocular) e cataplexy23, 24,25. Além disso, as manipulações mediadas pela AAV ajudaram a elucidar importantes circuitos e moléculas regulatórias do sono que contribuem para os efeitos adversos da perda de sono26,27,28. Por exemplo, uma proteína que se mostra implicada no prejuízo de memória induzido pela privação do sono é a cofilina29,30. Esta proteína é uma proteína de corte de actina que participa da reorganização dos filamentos actin, vinculando fisicamente a actina e promovendo a desmontagem dos filamentos de forma dinâmica31. A inibição da atividade de cofilina usando uma abordagem mediada por AAV foi demonstrada para prevenir a perda da coluna vertebral, bem como a plasticidade sináptica e os déficits de memória induzidos pela privação do sono em camundongos29. Coletivamente, esses estudos enfatizam a utilidade e a relevância das manipulações mediadas pela AAV para entender a regulação do sono e as consequências da privação do sono em roedores.
Aqui, é descrito um protocolo que combina implantação e gravação de eletrodos ECoG e EMG com a manipulação da função de cofilina em uma área de córtex cerebral de camundongos do tipo selvagem (WT) usando um AAV. Mais precisamente, um AAV (sorotipo 9) expressando a sequência de codificação de uma forma fosfomimetic do cofilin do mouse (cofilinS3D),tornando-o inativo32,33, é injetado no córtex do motor (M1 e M2). Um eletrodo ECoG é implantado diretamente no local da injeção para garantir o registro da atividade cortical sincronizada das células infectadas. A gravação do ECoG/EMG é conduzida por 24 horas em condições não perturbadas três semanas após a cirurgia para permitir recuperação, adaptação e alta expressãode cofilin S3D. O registro é então utilizado para identificação de estados de vigilância e análise espectral ECoG, conforme descrito em estudos anteriores11,34. Essa metodologia pode revelar especificamente como a cofilina cortical modula os sinais de ECoG de vigília e sono em camundongos. Esta combinação de gravações eletrofisiológicas e manipulação genética mediada por AAV é particularmente relevante para investigar os papéis de vários elementos moleculares em funções cerebrais específicas e poderia ser aplicada à área cerebral cortical (e subcortical) de interesse em WT e camundongos geneticamente modificados de ambos os sexos e até mesmo outras espécies.
Protocolo
Todos os métodos foram aprovados pelo Comité d'éthique de l'expérimentation animale do Recherche CIUSSS-NIM e estão de acordo com as diretrizes do Conselho Canadense de Cuidados com Animais. Consulte a Tabela de Materiais para reagentes, equipamentos e materiais utilizados neste protocolo.
1. Preparação para cirurgia
- Preparação de eletrodos ECoG e EMG
- Para cada animal, prepare três eletrodos ECoG: usando um ferro de solda, coloque uma pequena gota de solda sem chumbo na tampa do parafuso de um parafuso coberto de ouro, e solda um fio dourado de 4 mm de comprimento e 0,2 mm de diâmetro (não isolado) na parte superior da tampa do parafuso usando a solda sem chumbo(Figura 1A). Prepare 2 eletrodos com o fio de ouro em linha reta para cima, e um com um ângulo de 45° da vertical.
- Para cada animal, prepare dois eletrodos EMG: corte um fio dourado de 0,2 mm de diâmetro a um comprimento de 1,5 cm e um segundo de um a 2 cm. Curve ambos os fios para que estes abracem a curva do crânio até os músculos do pescoço, mantendo uma extremidade reta que será soldada ao conector(Figura 1B).
- Para cada animal, prepare um conector: utilize um conector de 6 canais (5 mm x 8 mm x 8 mm + 3 mm de pinos metálicos) e adicione solda sem chumbo a 5 dos 6 pinos metálicos (omitindo um pino médio; Figura 1C). Cubra a parte superior do conector com fita adesiva para evitar o lixo ou a infiltração de água.
- Preparação de AAVs e bomba de seringa
- Prepare o teste AAV (aqui, AAV9-CaMKIIα0.4-cofilinS3D-HA) e/ou o controle AAV (aqui, AAV9-CaMKIIα0.4-eGFP) diluindo o axila AAV mix(es) (aqui, AAVs em uma solução de soro fisiológico tamponado com fosfato contendo surfactante não iônico [0,001%]) com soro fisiológico estéril para obter o titer viral desejado (geralmente 1012-13 cópias de genoma [GC]/mL) e o volume necessário para o número de camundongos a serem tratados.
NOTA: Um volume injetado de 1 μL por área cortical por mouse requer a preparação de 2 μL. - Fixar uma seringa de 10 μL em uma bomba de seringa e encha-a com água destilada.
- Encha um tubo PE50 de aproximadamente 60 cm de comprimento com água destilada usando uma seringa de 1 mL e uma agulha de 21 G. É importante ressaltar, deixe a agulha 21G e a seringa no lugar após o enchimento. Conecte o tubo PE50 com a bomba de seringa; Deixe a agulha/seringa de 21 G em uma extremidade do tubo PE50 e conecte a outra extremidade à seringa de 10 μL.
- Uma vez fixado o tubo na seringa de 10 μL, remova a agulha na outra extremidade e empurre o pistão da seringa de 10 μL para preencher a lacuna deixada pela agulha com água.
NOTA: Certifique-se de que não há bolha de ar, e que o tubo está completamente cheio de água. - Instale uma cânula de 28 G na extremidade do tubo onde a agulha foi removida. Empurre a água para dentro da cânula com a seringa de 10 μL para preenchê-la completamente. Fixar a cânula firmemente no braço estereotaxic.
- Prepare o teste AAV (aqui, AAV9-CaMKIIα0.4-cofilinS3D-HA) e/ou o controle AAV (aqui, AAV9-CaMKIIα0.4-eGFP) diluindo o axila AAV mix(es) (aqui, AAVs em uma solução de soro fisiológico tamponado com fosfato contendo surfactante não iônico [0,001%]) com soro fisiológico estéril para obter o titer viral desejado (geralmente 1012-13 cópias de genoma [GC]/mL) e o volume necessário para o número de camundongos a serem tratados.
- Preparação de animais
NOTA: Os camundongos c57BL6/J masculinos e femininos de ~12 semanas de idade foram previamente adaptados por pelo menos 2 semanas para a habitação em gaiolas individuais e para um ciclo escuro de 12 h: 12 h com comida e água ad libitum e acesso a um cubo de madeira.- Pesar cuidadosamente os camundongos e injetar intraperitoneally uma mistura de cetamina/xilazina (120/10 mg/kg) para anestesia. Espere aproximadamente 10 min por anestesia profunda.
- Raspe o cabelo da parte de trás das orelhas para a frente da cabeça entre os olhos usando um aparador de cabelo.
NOTA: Tenha muito cuidado para não cortar os bigodes (proteja os bigodes com um dedo durante a barba) pois o corte do whisker modificará as entradas sensoriais e a atividade ECoG35,36. - Adicione uma generosa gota de pomada oftálmica em cada olho para evitar a desidratação. Verifique a profundidade da anestesia regularmente durante o procedimento, beliscando um dedo do pé da pata traseira. Forneça ao mouse isoflurane de 0,5-1,5% para garantir anestesia profunda se aparecer um reflexo de beliscão do dedo do dedo.
2. Injeção intracortical de AAV com uma bomba de seringa
NOTA: Execute todas as etapas a seguir com instrumentos esterilizados e em um ambiente limpo. Use 70% de etanol para lavar ainda mais os instrumentos esterilizados e lavar eletrodos preparados na seção 1.1, bem como parafusos de ancoragem (parafusos não cobertos de ouro) antes de iniciar a cirurgia.
- Fixar cuidadosamente a cabeça do mouse no aparelho estereotaxico com barras de ouvido.
NOTA: Certifique-se de que a cabeça não está se movendo lateralmente. - Puxe suavemente a língua do animal para fora da boca para evitar sufocamento, e fixar o nariz do mouse com o adaptador estereotílico.
NOTA: Monitore a respiração com frequência durante o procedimento. - Esterilize a área raspada da cabeça com 70% de etanol e segurando a pele com um fórceps graefe extra fino, corte a pele da base das orelhas até o nível dos olhos com tesoura de tecido. Use quatro grampos cirúrgicos para esticar a pele e expor o crânio (dois em cada lado da incisão; ver Figura 1D).
- Coce a superfície do crânio com uma ponta afiada da tesoura: evitando suturas ósseas, remova o periosteum e crie listras sobrepostas em duas ou mais direções. Remova os fragmentos ósseos e seque o crânio com 70% de etanol.
NOTA: O arranhão e o streaking ajudarão a tornar a montagem de gravação mais robusta, melhorando a adesão do cimento ao crânio (veja abaixo). - Com a cânula fixada ao braço estereotaxico, identifique a localização do bregma (ou seja, a intersecção entre as suturas coronais do crânio e sagita; Figura 1D) e lambda (ou seja, a intersecção entre a sutura sagital do crânio e uma linha reta ligando a sutura lambdoide esquerda e direita; Figura 1D), e observe as coordenadas estereoxilicas de cada um. Se a diferença entre as coordenadas z (eixo vertical) do bregma e lambda for superior a 0,3 mm, ajuste a altura do nariz usando o adaptador estereotaxico até que a posição z de bregma e lambda esteja alinhada.
- Marque a posição da cânula no crânio com uma caneta nestas coordenadas (córtex motor): 1,5 mm lateral direito à linha média e 1,5 mm anterior a bregma. Fure cuidadosamente o crânio na posição da cânula com uma broca de 0,7 mm em direção perpendicular à superfície do crânio (alinhada com o eixo vertical). Lave o crânio perfurado com uma ponta de algodão estéril impregnada com uma solução de 10% de iodo providone.
- Carregue a cânula com uma bolha de ar de 1 μL puxando o pistão de seringa de 10 μL de volta por 1 μL. Carregue o teste AAV (aqui AAV9-CaMKIIα0.4-CofilinS3D-HA) ou o AAV de controle (aqui AAV9-CaMKIIα0.4-eGFP) na cânula previamente carregada com a bolha de ar: misture o AAV lentamente tubulando para cima e para baixo, pipet 1.7 μL em uma placa de Petri estéril, e aspirar 1,5 μL da solução na cânula puxando lentamente o pistão da seringa de 10 μL. Marque a posição da bolha de ar no tubo PE50 para permitir o rastreamento da injeção.
- Alinhe a cânula com o orifício no crânio para a posição vertical da cânula para alcançar a borda superior do crânio (ou seja, superfície do crânio). Da superfície do crânio, abaixe lentamente a cânula em 1,5 mm (para atingir 1,5 mm abaixo da superfície do crânio e camada V do córtex do motor).
NOTA: Tenha muito cuidado para não baixar muito a cânula para evitar lesões desnecessárias do tecido cerebral. - Inicie a bomba de seringa para injetar 1 μL de AAV ao longo de 40 min (velocidade: 0,025 μL/min para minimizar danos teciduais). Acompanhe a injeção no tubo PE50 com o movimento da bolha de ar e faça ajustes, se necessário.
- Após a injeção ser concluída, deixe a cânula no lugar por 5 minutos para garantir a difusão suficiente e evitar o fluxo de volta. Em seguida, levante lentamente e cuidadosamente o braço estereotaxic para remover a cânula do córtex.
3. Implantação de eletrodos ECoG/EMG
- Usando fórceps de Kelly retos, aparar lentamente um eletrodo ECoG (com fio de ouro reto) no eixo vertical (mesmo ângulo que o orifício foi perfurado) no orifício onde o AAV foi injetado. Deixe pelo menos 2,5 mm do parafuso fora do crânio para minimizar danos ao córtex dura e cerebral (ou seja, para uma profundidade aproximada de 1,1 mm da superfície do crânio; Figura 1D).
- Marque a posição do eletrodo ECoG posterior e o eletrodo de referência no crânio com uma caneta nestas coordenadas: eletrodo posterior (córtex visual) 1,5 mm lateral direito à linha média e 1,5 mm anterior à lambda, eletrodo de referência (córtex somatosensorial) 2,6 mm lateral direito à linha média e 0,7 mm posterior a bregma. Além disso, marque a posição de três parafusos de manutenção (atuando como âncoras entre o crânio e o cimento dental para solidificar a montagem da cabeça) no hemisfério esquerdo sem coordenadas específicas, mas o mais distante possível um do outro e dos eletrodos ECoG.
- Fure cuidadosamente o crânio na posição marcada dos outros eletrodos e parafusos de ancoragem com a broca de 0,7 mm. Perfurar em direção perpendicular à superfície do crânio para cada parafuso (ou seja, eixo vertical para o eletrodo posterior, mas com um ângulo do eixo vertical para outros locais). Lave o crânio perfurado com uma solução de 10% de providone-iodo e bloqueie os orifícios com pequenos e enrolados pedaços de limpadores de tarefas delicados antes de instalar os parafusos para evitar sangramento e contaminação.
- Usando os fórceps de Kelly retos, dane-se os parafusos de manutenção no hemisfério esquerdo e, em seguida, aparafusar os dois últimos eletrodos no hemisfério direito. Certifique-se de parafuso com o mesmo ângulo que os orifícios foram perfurados e para deixar pelo menos 2,5 mm de cada parafuso fora do crânio(Figura 1D).
NOTA: Para maximizar a solidez da montagem final e a qualidade dos sinais eletrofisiológicos, tenha cuidado para não tocar em nenhum parafuso ao instalar o próximo. - Coloque algumas pequenas gotas de cimento dental no centro do espaço tipo anel dentro dos parafusos. Insira a extremidade curva de um eletrodo EMG (preparado na etapa 1.1.2) aproximadamente 1-2 mm nos músculos do pescoço, segurando a extremidade curva usando dumont #5 fórceps e levantando a pele acima dos músculos com fórceps graefe extra-finos. Em seguida, coloque o lado curvo e o cotovelo do eletrodo no cimento dentário; repetir para o segundo eletrodo EMG.
NOTA: A extremidade reta do eletrodo EMG mais longo deve ser alinhada com o eletrodo ECoG anterior e o do eletrodo EMG mais curto com o eletrodo ECoG posterior. Certifique-se de que os dois eletrodos EMG não estão se tocando ou qualquer um dos parafusos. - Cubra os olhos dos ratos e aplique luz por 3-5 minutos para ajudar a solidificação do cimento. Uma vez que os eletrodos EMG estejam firmemente segurando, cubra a base dos eletrodos ECoG e a base da âncora parafusos com cimento dental para formar um contorno em forma de coroa. Cubra os olhos dos ratos e aplique luz por 3-5 minutos para ajudar a solidificação do cimento.
NOTA: Não aplique cimento nas extremidades eletrodo ECoG e EMG (fio dourado que será soldado no conector) ou na pele. - Encha o centro da montagem com cimento acrílico previamente misturado. Durante a solidificação do cimento, remova os quatro grampos cirúrgicos que seguram a pele (e lave-os imediatamente com delicadas limpezas de tarefas).
NOTA: Não aplique cimento nas extremidades eletrodo ECoG e EMG (fio dourado que será soldado no conector) ou na pele. - Suturar a pele na parte de trás e a frente da montagem para que o crânio não fique exposto (mas evite esticar demais a pele) usando uma agulha de sutura (13 mm 3/8 c) e monofilamento sintético absorvível.
- Segure o conector acima da montagem com fórceps curvas e alinhe cuidadosamente o fio dourado dos eletrodos com os pinos do conector. Extremidades de eletrodos de solda para pinos conectores com o ferro de solda.
NOTA: Proceda rapidamente para evitar superaquecimento e danos ao tecido cortical. Certifique-se de que cada eletrodo faça um bom contato com o pino conector correspondente, e que os eletrodos não estejam conectados entre si. - Remova o mouse do quadro estereotaxic. Cubra o espaço vazio entre o conector e a cabeça com cimento acrílico previamente misturado, cobrindo todas as conexões entre eletrodos e pinos do conector.
NOTA: Evite a infiltração de cimento dentro do conector segurando o mouse com o conector acima da cabeça (cabeça reta não inclinada). - Pesar o mouse e colocá-lo em uma gaiola limpa (de preferência equipado com uma tampa não-meshed) em uma almofada de calor (caixa individual para evitar danos à montagem da cabeça). Monitore o animal regularmente, e administre 0,1 mg/kg de buprenorfina subcutânea ao acordar, e 12h depois, se o animal mostrar sinais de dor (por exemplo, postura anormal, olhos esguiosos).
NOTA: O ganho de peso em relação ao peso pré-operatório não deve exceder 1,5 g.
4. Gravações
- Casa ratos individualmente para evitar danos à montagem da cabeça como resultado de aliciamento mútuo, bem como danos e emaranhamento dos cabos de gravação.
NOTA: Para este protocolo, os ratos foram alojados com acesso ad libitum a alimentos, água e um cubo de madeira, e foi realizado monitoramento diário. - Conecte os camundongos à gravação de cabos 2 semanas após a cirurgia para adaptação às condições de cabeamento.
- Registos ECoG/EMG por 24 h (ou mais curto/mais curto, dependendo das perguntas de pesquisa).
NOTA: A gravação de sinal ECoG/EMG foi realizada usando um cabo, um conector giratório (para permitir a rotação do cabo), uma caixa vestível de 36 canais e um amplificador, que estava conectado a um computador. Os sinais são amostrados a 256 Hz (ou mais dependendo das questões de pesquisa) e registrados com software comercial (ver tabela de materiais). Para garantir a expressão viral suficiente, os experimentos devem ser feitos pelo menos 3 semanas após a injeção de AAV, como descrito anteriormente29,37. - Após o registro, sacrifique os camundongos por luxação cervical (ou outros métodos dependendo do protocolo de imunossucultura), e colde o cérebro para imunossucultura.
Resultados
Após gravações eletrofisiológicas, a imunofluorescência é usada para definir a área infectada pela injeção de AAV e validar a expressão da cofilinaS3D (Figura 2). A imunossuagem pode ser realizada utilizando uma metodologia semelhante à descrita anteriormente29,37,38,39. O AAV expressa uma forma inativa de cofilina fundida com uma hemagglutina (HA)-Tag (cofilinS3D-HA), que é detectada por imunofluorescência usando um anticorpo anti-HA e um anticorpo secundário (Alexa Fluor 488). Os neurônios excitatórios infectados (aqui, direcionados com uma proteína dependente de cálcio/calmodulin quinase II alfa [CamKIIα] promotor que controla a expressão do transgene contido no AAV) estão manchados com o anticorpo anti-HA. Uma infecção bem sucedida é indicada pela coloração dos neurônios no córtex motor ao redor do local da injeção (Figura 2A, B). Neste exemplo representativo, o córtex cerebral do outro hemisfério não mostrou nenhuma mancha perceptível. No entanto, dado que os neurônios excitatórios podem projetar áreas cerebrais distantes, a coloração no hemisfério contralateral não é necessariamente uma indicação de injeção mal sucedida. A ampliação mais elevada da área infectada mostrou coloração de corpos celulares e projeções, confirmando que apenas células específicas da área cortical alvo foram infectadas(Figura 2C).
A co-coloração com marcadores de neurônios excitatórios (por exemplo, transportador de glutamato vesicular 1, CaMKIIα) também pode ser realizada para validar a especificidade do tipo celular. Alternativamente, a co-coloração com marcadores de neurônios inibitórios ou astrócitos pode ser realizada no caso dessas células serem alvo usando diferentes promotores. A co-coloração da cofilinaS3D-HA e CaMKIIα também foi realizada no mesmo animal para uma área mais posterior ao local de injeção que ainda apresentava manchas anti-HA no córtex motor(Figura 2D). A imagem de ampliação mais alta da área mostra células expressando claramente cofilinaS3D-HA (Alexa Fluor 488, Figura 2E) e CaMKIIα (Alexa Fluor 568, Figura 2F). A superposição da coloração cofilinaS3D-HA e CaMKIIα revela que a maioria (se não todas) células manchadas para cofilinaS3D-HA também são positivas para CaMKIIα (Figura 2G). Esta observação suporta a especificidade da infecção para neurônios excitatórios.
Para avaliar o impacto da manipulação de cofilina na atividade ECoG, os sinais ECoG e EMG são usados para realizar uma identificação visual de estados de vigilância (vigília, sono de ondas lentas, sono paradoxal). Isso é feito em épocas de 4-s por causa da rápida mudança no estado de vigilância no mouse2, e aqui, para uma gravação completa de 24 horas. As análises padrão incluem a computação da arquitetura do sono e variáveis de análise espectral, realizadas anteriormente para diferentes conjuntos de dados11,12,13,28,34. Em particular, a análise espectral do sinal ECoG dos diferentes estados irá indexar a composição e a qualidade do estado. Para remover diferenças que poderiam surgir, por exemplo, de diferentes profundidades dos eletrodos, os dados de análise espectral podem ser expressos em relação ao poder total de todos os estados de um determinado animal(Figura 3A). Dada a baixa amplitude relativa da atividade ECoG em frequências mais altas, espectros de potência relativa para a vigília, sono de ondas lentas e sono paradoxal foram transformados em troncos para visualizar mais adequadamente e simultaneamente comparar a atividade em frequências baixas e altas. Esta análise indica diferenças específicas do estado na atividade espectral em condições de inativação de cofilina (Figura 3B). Mais precisamente, esses achados preliminares que combinam camundongos machos e fêmeas apontam que a inativação de cofilina aumenta significativamente a potência espectral em frequências rápidas (14-30 Hz) durante a vigília e em frequências lentas (1-4 Hz) durante o sono paradoxal, deixando a atividade ECoG durante o sono de ondas lentas principalmente não afetadas. Além disso, a inativação de cofilina parece aumentar a variabilidade entre camundongos na atividade ECoG (particularmente perceptível das barras de erro para a vigília na Figura 3B).
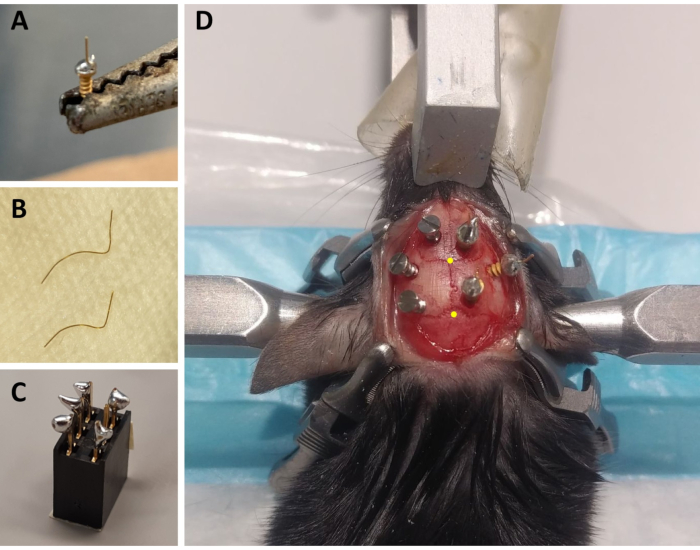
Figura 1: Preparação de componentes de montagem ECoG/EMG e exemplo representativo da colocação de eletrodos ECoG. (A) Um eletrodo ECoG: um fio dourado de 4 mm de comprimento e 0,2 mm de diâmetro (não isolado) é fundido na cabeça de um parafuso coberto de ouro (1,9 mm de diâmetro da cabeça, 1,14 mm de diâmetro principal, comprimento total de 3,6 mm) usando solda sem chumbo. (B) Eletrodos EMG: dois fios de ouro (1,5 e 2 cm) são curvados para abraçar a curva do crânio até o músculo do pescoço, e a outra extremidade é mantida em linha reta para ser soldada ao conector. (C) Um conector de 6 canais: solda sem chumbo é adicionado a 5 dos 6 pinos metálicos (omitindo um no meio) do conector (5 mm x 8 mm x 8 mm + pinos metálicos de 3 mm). A parte superior do conector está coberta com fita adesiva para evitar infiltração de lixo/água. (D) Exemplo do posicionamento dos três parafusos de manutenção no crânio do hemisfério esquerdo e dos três eletrodos ECoG (incluindo um eletrodo de referência) no hemisfério direito. As coordenadas estéreo estéreóxica precisas dos eletrodos ECoG são indicadas nas etapas 2.6 e 3.2 e foram calculadas de acordo com a localização do bregma e lambda (que são indicados pelos pontos amarelos). Abreviaturas: ECoG = eletrocorticográfico; EMG = eletromiográfico. Clique aqui para ver uma versão maior desta figura.
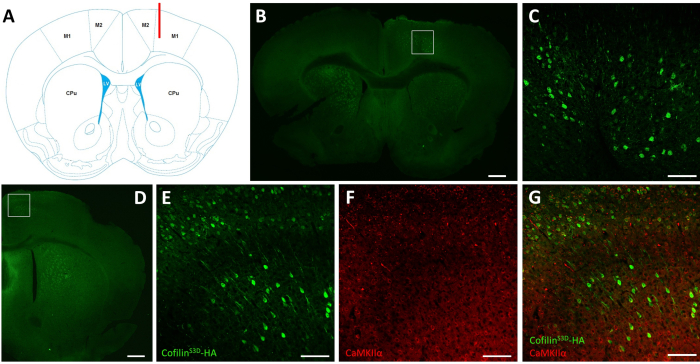
Figura 2: Imunostaining representativo para definir a área infectada pelo AAV e o tipo celular. (A) Representação esquemática mostrando o local de injeção da fatia coronal apresentada no painel B. A posição é 1,1 mm anterior ao bregma, e a cânula (mostrada em vermelho) foi direcionada para camadas V do córtex do motor primário direito (M1). Representação modificada de Franklin e Paxinos40. (B) Imunostaining de HA para detectar cofilinaexpressão S3D-HA em neurônios mostrados para uma fatia coronal do cérebro completo localizado aproximadamente 1,1 mm anterior ao bregma. A área infectada localiza principalmente as camadas V e VI (camadas infragranulares) dos cortices motores primários e secundários certos (M1 e M2). Barra de escala = 500 μm. O quadrado representa a área mostrada em C. (C) Ampliação mais elevada da área infectada mostrando a coloração de células infectadas e confirmando a expressão de cofilinaS3D-HA em camadas mais profundas do córtex motor. Barra de escala = 100 μm. (D) Co-imunosmunagem de HA e CaMKIIα para avaliar a especificidade do tipo celular mostrada para uma fatia coronal do hemisfério direito localizada aproximadamente 0,5 mm anterior a bregma e, portanto, posterior ao local de injeção (mesmo mouse dos painéis B e C). A área infectada se localiza em cortices motorizados (M1 e principalmente M2). Barra de escala = 500 μm. O quadrado representa a área mostrada em E, F e G. (E) Ampliação mais elevada da área infectada mostrando coloração de células infectadas e confirmando expressão de cofilinaS3D-HA. Barra de escala = 100 μm. (F) Ampliação mais elevada da área infectada mostrando coloração de células caMKIIα-positivas. Barra de escala = 100 μm. (G) Ampliação mais elevada da área infectada mostrando co-rotulagem de cofilinaS3D-HA e CaMKIIα, confirmando que as células infectadas são CaMKIIα-positivo. Barra de escala = 100 μm. Abreviaturas: AAV = vírus associado ao adeno; M1 = córtex motor primário; M2 = córtex motor secundário; CPu = caudate putamen (estriato); LV = ventrículo lateral; HA= hemaglutinina; CamKIIα = proteína dependente de cálcio/calmodulina quinase II alfa. Clique aqui para ver uma versão maior desta figura.
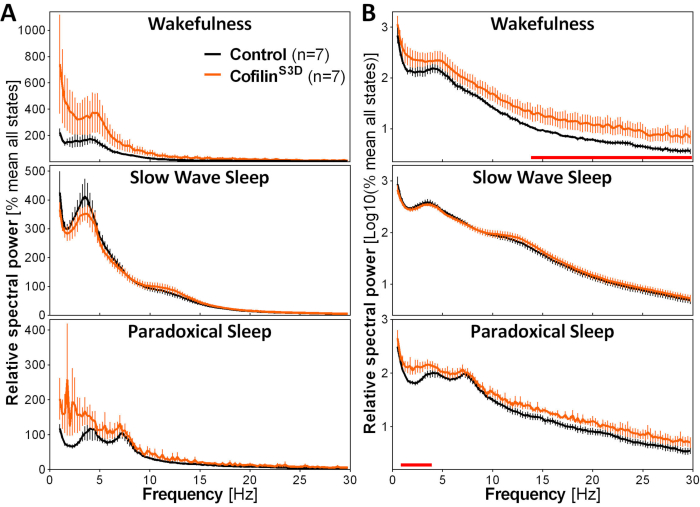
Figura 3: Espectros de poder representativos para a vigília, sono de ondas lentas e sono paradoxal obtido após manipulação viral da função cofilina. Camundongos machos (n = 5 por grupo) e femininos (n = 2 por grupo) injetados com AAV9-CaMKIIα0,4-cofilinS3D-HA (titer viral 2,58 × 1013 GC/mL) ou com um controle AAV (AAV9-CaMKIIα0.4-eGFP 1.25 × 1013 GC/mL; metade do título de teste para controlar o sinal aprimorado deste controle AAV) na camada V do córtex motor foram registrados por 24h, e o sinal eletrocorticográfico foi submetido à análise espectral (transformação rápida do Fourier para calcular a potência espectral entre 0,5 e 30 Hz com resolução de 0,25-Hz). (A) Espectros de energia durante os três estados de vigilância expressos em relação ao poder total de todos os estados. (B) Espectro de energia relativo transformado em log para representar de forma mais adequada as diferenças de grupo em frequências mais altas. A supressão da atividade de cofilina no córtex motor usando AAV9-CaMKIIα0.4-cofilinS3D-HA aumenta significativamente a atividade eletrocorticgráfica na faixa beta (14-30 Hz) durante a vigília, e na faixa delta (1-4 Hz) durante o sono paradoxal em comparação com as injeções de controle (linhas vermelhas acima de eixos x indicam mann-Whitney U-teste na potência da banda de frequência p < 0,05). Abreviaturas: AAV = vírus associado ao adeno GC = cópias do genoma; HA= hemaglutinina; CamKIIα = proteína dependente de cálcio/calmodulina quinase II alfa; eGFP = proteína fluorescente verde aprimorada. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve um método preciso e simples para monitorar a atividade de ECoG e EMG durante a manipulação de alvos moleculares usando AAVs. Para uma comparação adequada entre grupos, é altamente recomendável planejar sempre procedimentos cirúrgicos (injeção de AAV e implantação de eletrodos) no mesmo dia para animais de teste e controle, e registrar seus sinais eletrofisiológicos simultaneamente. Para obter expressão viral semelhante entre os animais de teste e controle, é desejável injetar o mesmo título viral. No presente caso, o título viral de controle AAV foi reduzido para metade do teste AAV para garantir expressão viral semelhante. Os experimentadores devem ter muito cuidado com as medidas das coordenadas estereotribíficas para garantir baixa variabilidade entre animais na área cerebral/segmentação de camadas corticais. Além disso, dado que a profundidade de injeção é calculada a partir da superfície do crânio, e que a espessura do crânio varia de acordo com a idade e o sexo, a colocação da cânula deve ser sempre verificada usando histologia pós-protocolo ou imunhistoquímica (por exemplo, Figura 2) para garantir o posicionamento adequado/profundidade da injeção, e as coordenadas estereotaxas devem ser ajustadas se necessário. Ao longo da injeção AAV de 40 min, é muito importante monitorar a velocidade de injeção para detectar rapidamente e corrigir problemas potenciais, como o bloqueio da bomba. Algumas etapas experimentais também são cruciais para obter sinais eletrofisiológicos ideais. Por exemplo, não sobresacrew durante a implantação de eletrodos; os parafusos devem ficar fora do crânio em pelo menos 2,5 mm para minimizar os danos ao córtex cerebral e a formação de uma cicatriz gliana. Posteriormente, também é tremendamente importante para i) evitar a aplicação de cimento nas extremidades dos eletrodos, ii) garantir uma solda rápida dos eletrodos ao conector, e iii) certificar-se de que não há contato entre os eletrodos.
O procedimento aqui apresentado para gravação de ECoG e EMG é extremamente bem estabelecido, simples e amplamente utilizado para monitorar a vigília e o sono em camundongos2,11,13,34. Gravações contínuas de ECoG e EMG podem ser realizadas por vários dias consecutivos (e até semanas) e gerar um conjunto de dados muito rico que pode ser usado para executar várias linhas de análise que compreendem variáveis relacionadas à vigília e quantidade de sono e arquitetura2,11,12 (por exemplo, tempo gasto em diferentes estados por períodos claros e escuros, número de episódios de cada estado, Distribuição 24-h do sono), vigília e sono espectralconteúdo 34,41 (por exemplo, potência em diferentes faixas de frequência [semelhante à Figura 3], atividade livre de escala) e características de ondas individuais42,43,44 (por exemplo, amplitude de ondas lentas e inclinação). Quando usado em combinação com manipulações moleculares mediadas por AAV, uma vantagem adicional é evitar uma compensação potencial de desenvolvimento que pode ocorrer em animais transgênicos. Com a prática, todo o procedimento, incluindo a injeção de AAV de 40 min, pode ser realizado em aproximadamente 90 min. A taxa de mortalidade deve ser (muito) baixa, pois a cirurgia é minimamente invasiva.
O uso simultâneo da gravação ECoG/EMG e manipulação direcionada com a AAV oferece uma variedade de outras vantagens e aplicativos. Por exemplo, a precisão do direcionamento estereotaxal, quando adequadamente realizada, é muito alta e replicável e é útil para determinar o papel específico de uma determinada região cerebral (e/ou um tipo de célula ou um elemento molecular dentro da região) na regulação do sono ou outros processos fisiológicos. Várias áreas corticais diferentes podem, portanto, ser facilmente direcionadas usando adaptações do protocolo atual. Além disso, as manipulações de alvos usando AAVs podem ser direcionadas para uma área cortical/subcortical diferente dos locais de gravação do ECoG. Nesses casos, o orifício de rebarba para injeção de AAV pode ser coberto por um pequeno deslizamento de vidro fixado usando cimento dental (ou cera óssea). Para uma especificidade aprimorada, a construção do AAV geralmente inclui um promotor que permite a infecção direcionada de uma célula precisa tipo14. Um promotor camkiiα foi usado no presente protocolo para especificamente atingir células piramigráficasexcitatórias 14,29,45do córtex motor. Essa estratégia possibilitou a inativação da cofilina (utilizando cofilinaS3D)32,33 em neurônios excitatórios do córtex motor e a observação de alterações específicas do estado na atividade ECoG(Figura 3). Para avaliar a eficácia da infecção/transdução, os futuros usuários do protocolo poderiam combinar o protocolo AAV-ECoG apresentado com uma das co-colorações por imunofluorescência, e usar imagens de alta ampliação para calcular o número de células que mostram rotulagem dupla do número total de células que mostram rotulagem única do alvo (aqui, neurônios expressantes camkiiα). Em um estudo recente, um método AAV-ECoG semelhante ao descrito aqui foi usado para expressar a frágil proteína relacionada à síndrome do retardo mental X 1 (FXR1) em todos os neurônios do córtex motor usando um AAV contendo um promotor de sinápsia e revelou um efeito dessa manipulação na distribuição do estado de vigilância e conteúdo espectral28. Esses achados ilustram como a manipulação de uma determinada molécula em uma região cerebral alvo usando AAVs pode revelar papéis na regulação de parâmetros específicos de vigília/sono.
Uma limitação do protocolo descrito é a pequena lesão do tecido cerebral que ocorre com a colocação de cânula antes de realizar a injeção de AAV, que também poderia ser acompanhada por uma resposta inflamatória. Isso pode ser particularmente preocupante ao realizar a injeção de AAV em áreas subcorticais e deve ser sempre abordado usando controles adequados. Alternativamente, o protocolo atual poderia ser seguido pela quantificação da gliose reativa e/ou da ativação microglial (por exemplo, utilizando imunofluorescência) para garantir níveis semelhantes nos grupos de controle e teste e, portanto, na leitura do ECoG. Uma segunda limitação diz respeito ao risco de má conexão entre um eletrodo e o conector, o que poderia resultar em um sinal eletrofisiológico continuamente ou ocasionalmente ruim. Eletrodos solidamente aparafusados, soldados e cimentados minimizarão a incidência deste problema. Uma terceira limitação está relacionada com animais sendo amarrados através da montagem da cabeça durante a gravação, o que poderia limitar a locomoção e outros comportamentos, pelo menos até certo ponto, e ocasionalmente resultar em danos de cabeamento e perda de sinal. Por fim, o protocolo apresentado é mais adequado para camundongos adultos, uma vez que o tamanho do crânio de animais mais jovens pode causar dificuldades na instalação da montagem da cabeça retratada, como descrito anteriormente2.
A gravação combinada de ECoG/EMG e a manipulação mediada por AAV de um alvo preciso também são aplicáveis a campos de pesquisa que não sejam a neurociência do sono. Entre outros, poderia ser usado para estudar e manipular eventos epilépticos em modelos animais de convulsão e é uma poderosa ferramenta para modular as oscilações cerebrais envolvidas na codificação e consolidação da memória46,47. Assim, as aplicações potenciais certamente abrangem os campos da pesquisa fundamental em psiquiatria e neurologia, incluindo doenças neurodegenerativas. Além da capacidade de expressar uma forma inativa de uma molécula, os AAVs podem e têm sido usados para superexpressar ou diminuir (por exemplo, RNA de pequena interferência, CRISPR/Cas9) ou para resgatar a expressão de uma molécula em um KO de corpo inteiro. É importante ressaltar que a metodologia dupla do protocolo atual também é aplicável a outras espécies de mamíferos, como ratos e roedores diurnos que representam modelos interessantes para entender tanto o sono quanto a neurodegeneração48,49.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O trabalho foi financiado pela Canada Research Chair em Fisiologia Molecular do Sono. Os autores agradecem a Chloé Provost e Caroline Bouchard por ajuda técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Surgery peparation | |||
| 21 G needle | Terumo | NN-2125R | |
| 6-channel connector | ENA AG | BPHF2-O6S-E-3.2 | Connector used in this manuscript, but discontinued. See potential replacement below |
| Distrelec | 300-93-672 | Potential replacement for discontinued connector above | |
| C57BL6/J mice | Jackson Laboratory | 000664 | B6 | Animals bred on site |
| Pluronic F-68 | Non-ionic surfactant | ||
| Gold wire 0.2 mm diameter | Delta scientific | 920-862-41 | Non-insulated |
| Hamilton syringe (10 μL) | Fisher Scientific | 14815279 | |
| Infusion syringe Pump CMA 402 | Harvard Apparatus | CMA8003110 | |
| Injection cannula 28 G | Plastics one | C313l-SPCL | |
| Isoflurane | Baxter | CA2L9100 | |
| Ketamine (10 mg/mL) | SANDOZ | 4550 | |
| Lead-free solder | AIM | SN100C | |
| Lubricating ophthalmic ointment | ALLERGAN | 210889 | |
| PE 50 Catheter thin wall | Plastics one | C232CT | |
| Flat fillister head self tapping screws | MORRIS | FF00CE125 | ECoG electrode gold covered; Dimension : 1.9 mm head diameter, 1.14 mm thread major diameter, 3.6 mm length |
| Soldering iron | Weller | WES51 | |
| Syringe 1 mL | BD | 309659 | |
| Trimmer | Harvard Apparatus | 72-9063 | |
| Xylazine (20 mg/mL) | Bayer | 2169592 | |
| Intracortical AAV injection with syringe pump | |||
| 0.7 mm drill bit | Dremel | 628 | |
| AAV9-CaMKIIα0.4-cofilinS3D-HA | UPenn Viral Core | ||
| AAV9-CaMKIIα0.4-eGFP | UPenn Viral Core | ||
| Cotton tippped applicators | Medicom | 806 | |
| Drill | Dremel | 8050-N/18 | |
| Extra-fine Graefe forceps | Fine science tools | 11150-10 | |
| Stereotaxic arm | Stoelting | 51604U | |
| Stereotaxic frame | Stoelting | 51600 | |
| Surgical clamps | Fine science tools | 18050-28 | |
| Tissue scissor | Magna Stainless | M4-124 | |
| ECoG/EMG electrode implantation | |||
| Buprenorphine (0.3 mg/mL) | CEVA | 57133-02 | |
| Curved forceps | Fine science tools | 11001-12 | |
| Delicate task wipers | Kimtech | 34120 | |
| Dental acrylic cement | Yates Motloid | 44115 | |
| Dumont #5 forceps | Fine science tools | 91150-20 | |
| Extra fine Graefe forceps | Fine science tools | 11150-10 | |
| Kelly forceps | Fine science tools | 13002-10 | |
| Liquid acrylic | Yates Motloid | 44119 | |
| Monocryl plus suture needle 13 mm 3/8c rev cutting | Ethicon | MCP494 | |
| Providone-iodine 10% | Triad disposables | 10-8208 | |
| RelyX Unicem 2, Adhesive Resin Cement A2 | 3M | 56849 | |
| Immunofluorescence and ECoG recording | |||
| 36-Channel EEG Wearable Headbox | LaMONT Medical | 832-000350 | |
| CaMKII alpha Monoclonal Antibody (Cba-2) | Invitrogen | 13-7300 | Dilution 1:500 |
| Conductors Awg PVC Insulation Cable | Calmont Wire & Cables | HC-0819075R0 | |
| Donkey anti-Mouse IgG secondary Ab, Alexa Fluor 568 | Invitrogen | A10037 | Dilution 1:1000 |
| Goat anti-Rabbit IgG secondary Ab, Alexa Fluor 488 | Invitrogen | A-11008 | Dilution 1:500 |
| HA-Tag (C29F4) Rabbit mAb | Cell signaling | 3724 | Dilution 1:800 |
| Programmable Amplifier | LaMONT Medical | 815-000002-S2 | |
| Stellate Harmonie | Natus | HSYS-REC-LT2 | |
| Swivel connector | Crist Instrument Company Inc. | 4-TBC-9-S |
Referências
- Campbell, I. G. EEG recording and analysis for sleep research. Current Protocols in Neuroscience. , (2009).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Current Protocols in Mouse Biology. 2 (1), 55-74 (2012).
- Bastien, C. H., et al. Insomnia and sleep misperception. Pathologie Biologie. 62 (5), 241-251 (2014).
- Malafeev, A., et al. Automatic artefact detection in single-channel sleep EEG recordings. Journal of Sleep Research. 28 (2), 12679 (2019).
- Latreille, V., et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease. Brain. 139, 1189-1199 (2016).
- Rodrigues Brazete, J., et al. Electroencephalogram slowing predicts neurodegeneration in rapid eye movement sleep behavior disorder. Neurobiology of Aging. 37, 74-81 (2016).
- Kent, B. A., Strittmatter, S. M., Nygaard, H. B. Sleep and EEG power spectral analysis in three transgenic mouse models of Alzheimer's disease: APP/PS1, 3xTgAD, and Tg2576. Journal of Alzheimers Disease. 64 (4), 1325-1336 (2018).
- Chang, A. M., et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiology International. 33 (5), 561-573 (2016).
- Shi, G., Wu, D., Ptacek, L. J., Fu, Y. H. Human genetics and sleep behavior. Current Opinion in Neurobiology. 44, 43-49 (2017).
- Nakai, Y., et al. Calcineurin and its regulator sra/DSCR1 are essential for sleep in Drosophila. Journal of Neuroscience. 31 (36), 12759-12766 (2011).
- El Helou, J., et al. Neuroligin-1 links neuronal activity to sleep-wake regulation. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9974-9979 (2013).
- Freyburger, M., et al. EphA4 is involved in sleep regulation but not in the electrophysiological response to sleep deprivation. Sleep. 39 (3), 613-624 (2016).
- Seok, B. S., et al. The effect of Neuroligin-2 absence on sleep architecture and electroencephalographic activity in mice. Molecular Brain. 11 (1), 52 (2018).
- Haery, L., et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation. Frontiers in Neuroanatomy. 13, 93 (2019).
- Schmidt, F., Grimm, D. CRISPR genome engineering and viral gene delivery: a case of mutual attraction. Biotechnology Journal. 10 (2), 258-272 (2015).
- Wang, D., Zhang, F., Gao, G. CRISPR-based therapeutic genome editing: strategies and in vivo delivery by AAV vectors. Cell. 181 (1), 136-150 (2020).
- Havekes, R., et al. Transiently increasing cAMP levels selectively in hippocampal excitatory neurons during sleep deprivation prevents memory deficits caused by sleep loss. Journal of Neuroscience. 34 (47), 15715-15721 (2014).
- Fuller, P. M., Yamanaka, A., Lazarus, M. How genetically engineered systems are helping to define, and in some cases redefine, the neurobiological basis of sleep and wake. Temperature. 2 (3), 406-417 (2015).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ono, D., Yamanaka, A. Hypothalamic regulation of the sleep/wake cycle. Neuroscience Research. 118, 74-81 (2017).
- Shiromani, P. J., Peever, J. H. New neuroscience tools that are identifying the sleep-wake circuit. Sleep. 40 (4), 032 (2017).
- Oishi, N., et al. Artificial association of memory events by optogenetic stimulation of hippocampal CA3 cell ensembles. Molecular Brain. 12 (1), 2 (2019).
- Anaclet, C., et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control. Journal of Neuroscience. 38 (22), 5168-5181 (2018).
- Chen, K. S., et al. A hypothalamic switch for REM and non-REM sleep. Neuron. 97 (5), 1168-1176 (2018).
- Torontali, Z. A., Fraigne, J. J., Sanghera, P., Horner, R., Peever, J. The sublaterodorsal tegmental nucleus functions to couple brain state and motor activity during REM sleep and wakefulness. Current Biology. 29 (22), 3803-3813 (2019).
- Rolls, A., et al. Optogenetic disruption of sleep continuity impairs memory consolidation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13305-13310 (2011).
- Ognjanovski, N., Broussard, C., Zochowski, M., Aton, S. J. Hippocampal network oscillations rescue memory consolidation deficits caused by sleep loss. Cerebral Cortex. 28 (10), 3711-3723 (2018).
- Khlghatyan, J., et al. Fxr1 regulates sleep and synaptic homeostasis. EMBO Journal. 39 (21), 103864 (2020).
- Havekes, R., et al. Sleep deprivation causes memory deficits by negatively impacting neuronal connectivity in hippocampal area CA1. Elife. 5, 13424 (2016).
- Wong, L. W., Tann, J. Y., Ibanez, C. F., Sajikumar, S. The p75 neurotrophin receptor is an essential mediator of impairments in hippocampal-dependent associative plasticity and memory induced by sleep deprivation. Journal of Neuroscience. 39 (28), 5452-5465 (2019).
- Mizuno, K. Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular Signalling. 25 (2), 457-469 (2013).
- Nagaoka, R., Abe, H., Obinata, T. Site-directed mutagenesis of the phosphorylation site of cofilin: its role in cofilin-actin interaction and cytoplasmic localization. Cell Motility and the Cytoskeleton. 35 (3), 200-209 (1996).
- Elam, W. A., et al. Phosphomimetic S3D cofilin binds but only weakly severs actin filaments. Journal of Biological Chemistry. 292 (48), 19565-19579 (2017).
- Areal, C. C., Cao, R., Sonenberg, N., Mongrain, V. Wakefulness/sleep architecture and electroencephalographic activity in mice lacking the translational repressor 4E-BP1 or 4E-BP2. Sleep. 43 (2), (2020).
- Vyazovskiy, V., Borbely, A. A., Tobler, I. Unilateral vibrissae stimulation during waking induces interhemispheric EEG asymmetry during subsequent sleep in the rat. Journal of Sleep Research. 9 (4), 367-371 (2000).
- Sitnikova, E. Neonatal sensory deprivation promotes development of absence seizures in adult rats with genetic predisposition to epilepsy. Brain Research. 1377, 109-118 (2011).
- Tudor, J. C., et al. Sleep deprivation impairs memory by attenuating mTORC1-dependent protein synthesis. Science Signaling. 9 (425), 41 (2016).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293 (2015).
- Dufort-Gervais, J., et al. Neuroligin-1 is altered in the hippocampus of Alzheimer's disease patients and mouse models, and modulates the toxicity of amyloid-beta oligomers. Scientific Reports. 10 (1), 6956 (2020).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates, Third edition. , (2007).
- Lina, J. M., O'Callaghan, E. K., Mongrain, V. Scale-free dynamics of the mouse wakefulness and sleep electroencephalogram quantified using Wavelet-Leaders. Clocks & Sleep. 1 (1), 50-64 (2019).
- Massart, R., et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes. Translational Psychiatry. 4, 347 (2014).
- Freyburger, M., Poirier, G., Carrier, J., Mongrain, V. Shorter duration of non-rapid eye movement sleep slow waves in EphA4 knockout mice. Journal of Sleep Research. 26 (5), 539-546 (2017).
- Hubbard, J., et al. Rapid fast-delta decay following prolonged wakefulness marks a phase of wake-inertia in NREM sleep. Nature Communications. 11 (1), 3130 (2020).
- Johansen, J. P., et al. Optical activation of lateral amygdala pyramidal cells instructs associative fear learning. Proceedings of the National Academy of Sciences of the United States of America. 107 (28), 12692-12697 (2010).
- Boyce, R., Glasgow, S. D., Williams, S., Adamantidis, A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science. 352 (6287), 812-816 (2016).
- Bandarabadi, M., et al. Dynamic modulation of theta-gamma coupling during rapid eye movement sleep. Sleep. 42 (12), 182 (2019).
- Estrada, C., et al. Transcranial magnetic stimulation and aging: Effects on spatial learning and memory after sleep deprivation in Octodon degus. Neurobiology of Learning and Memory. 125, 274-281 (2015).
- Hurley, M. J., et al. The long-lived Octodon degus as a rodent drug discovery model for Alzheimer's and other age-related diseases. Pharmacology & Therapeutics. 188, 36-44 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados