Method Article
マウスにおけるコフィリンを標的とするアデノ関連ウイルスを用いて操作した大脳皮質領域の電気コルチコチコ
要約
本稿では、アデノ関連ウイルスを用いた大脳皮質の分子標的の操作と、電気コルチコチコの記録を用いた覚醒および睡眠中のこの操作の影響をモニタリングするためのプロトコルについて説明する。
要約
げっ歯類の電気コルチコグラフィー(ECoG)録音の使用は、睡眠研究と神経学的状態の広い範囲の研究に関連しています。アデノ関連ウイルス(AAV)は、脳回路とその機能の理解を深めるためにますます使用されています。特定の細胞集団や正確な分子成分のAAV媒介操作は、睡眠喪失の悪影響に寄与する新しい睡眠調節回路/分子および主要タンパク質を同定するのに非常に有用であった。例えば、AAVを用いた糸状アクチン切断タンパク質コフィリンの阻害活性は、睡眠不足誘発記憶障害を防止する。ここで、大脳皮質領域におけるコフィリン機能の操作とECoG活性の記録を組み合わせて、皮質コフィリンが覚醒および睡眠ECoG信号を調節するかどうかを調べるプロトコルが記載されている。AAV注射は、成人の雄マウスおよび雌マウスにおけるECoGおよび筋電図(EMG)電極の注入と同じ外科的処置の間に行われる。マウスは麻酔を受け、頭は剃ります。皮膚洗浄および切開後、運動皮質の立体的座標が決定され、頭蓋骨はこの場所に突き刺さる。コフィリンの非活性形態であるコフィリンS3Dを発現するAAVを事前に充填したカニューレは、皮質組織にゆっくりと配置される。AAV注入後、金で覆われたネジ(ECoG電極)は頭蓋骨を通してねじ込まれ、首の筋肉に挿入された金線(EMG電極)で頭蓋骨に固定されます。動物は回復し、コフィリンS3Dの十分な発現を確保するために3週間を許可されています。感染領域と細胞型は免疫学化学を用いて検証され、ECoGは警戒状態の視覚的同定とスペクトル解析を用いて分析される。要約すると、この結合された方法論的アプローチは、覚醒と睡眠中の同期大脳皮質活動の調節に対する神経形態および結合性を調節する分子成分の正確な寄与の調査を可能にする。
概要
脳波(または一般的にげっ歯類の電気コルチコグラフィー[ECoG])および電気的研究(EMG)の記録は、睡眠研究だけでなく、神経科学、神経学、精神医学においてより広く使用されています。組み合わせて、これらの電気生理学的シグナルは、警戒状態の同定と、その後の状態持続時間およびスペクトル組成の定量化を、ヒトおよびげっ歯類1、2、3、4の両方で可能にする。このような定量化は、神経変性疾患やモデル5、6、7などの病理学的状態において睡眠がどのように修飾されているかを理解するのに有用であった。例えば、神経伝達に関連する異なる遺伝子のノックアウト(KO)は、マウスとフルーツフライ10、11、12、13の両方で覚醒および睡眠の持続時間を変化することが示された。げっ歯類の全身KOの研究から生じる潜在的な発達補償に取り組み、遺伝子操作のより細かい制御を可能にするために、遺伝子発現を操作する効率的な方法は、アデノ関連ウイルス(AAV)を使用することです。AAV媒介性遺伝子操作は、特定の分子標的をダウンまたはアップレキュアに使用し、異なるタイプのプロモーター14を使用して特定の細胞集団に対する操作を制限することができる。AAVは、クラスター化された定期的に間隔を空けた短いパリンドローム反復(CRISPR)/Cas9技術15,16の配信方法としても広く使用されている。これらの方法論は、一般的に免疫蛍光を使用して感染領域の定量を許可するレポーターの発現に関連付けられている遺伝子操作のより良い時間的および空間的制御を可能にする。
AAVはまた、光遺伝学および化学遺伝学を介した神経活動の細胞型特異的操作の主なベクターを表す17,18,19,神経変性疾患に関する最近の研究で広く使用されている, 行動, 認知, 睡眠20,21,22.睡眠研究では、基底前脳、視床下部、および亜側面性テグメンタムなどの特定の脳領域の活性化または阻害のための光遺伝学の適用は、覚醒、遅波睡眠(非急速眼球運動睡眠とも呼ばれる)、逆説的な睡眠(または眼球運動睡眠)、およびカタプレックスの制御における彼らの役割を決定するのに有用であった。 24、25。さらに、AAV媒介操作は、睡眠喪失26、27、28の悪影響に寄与する重要な睡眠調節回路および分子を解明するのに役立った。例えば、睡眠不足による記憶障害に関与することが示されている1つのタンパク質は、コフィリン29,30である。このタンパク質は、アクチンに物理的に結合し、かつ動的にフィラメントの分解を促進することによってアクチンフィラメントの再編成に関与する糸状のアクチン断裂タンパク質である31。AAV媒介型アプローチを用いたコフィリン活性の阻害は、マウス29における睡眠不足によって誘発されるシナプス可塑性および記憶障害と同様に脊椎喪失を防ぐことが示された。総称して、これらの研究は、睡眠調節とげっ歯類の睡眠不足の結果を理解するためのAAV媒介操作の有用性と関連性を強調する。
ここで、AAVを用いた野生型(WT)マウスの大脳皮質領域におけるコフィリン機能の操作とECoGおよびEMG電極注入および記録を組み合わせたプロトコルについて説明する。より正確には、マウスコフィリンのホスホミメティック形態の符号化配列を発現するAAV(血清型9)(コフィリンS3D)を、非活性32、33にレンダリングし、運動皮質(M1およびM2)に注入される。ECoG電極は、感染細胞の同期皮質活性の記録を確実にするために、注射部位に直接埋め込まれる。ECoG/EMGの記録は回復、適応および高コフィリンS3Dの表現を可能にするために外科の3週間後に乱れない条件下で24時間行われる。記録は、以前の研究11、34で説明したように、警戒状態とECoGスペクトル分析の識別に使用されます。この方法論は、皮質コフィリンがマウスの覚醒および睡眠ECoG信号をどのように調節するかを具体的に明らかにすることができる。この電気生理学的記録とAAV媒介遺伝子操作の組み合わせは、特定の脳機能における様々な分子元素の役割を調査するのに特に関連しており、WTおよび男女および他の種の遺伝子組み換えマウスに関心のある皮質(および皮質下)脳領域に適用することができる。
プロトコル
すべての方法は、レシェルシュ CIUSSS-NIMのコミテ・デ・エシク・ド・エクスペリメンテーション動物 によって承認され、カナダ動物ケア評議会のガイドラインに従っています。このプロトコルで使用する試薬、装置、および材料については、 資料表 を参照してください。
1. 手術準備
- ECoG電極およびEMG電極の調製
- 各動物に対して、3つのECoG電極を準備します:はんだ付けアイロンを使用して、金で覆われたネジのネジキャップに鉛フリーはんだの小さな滴を置き、鉛フリーはんだを使用してスクリューキャップの上に長さ0.2mmの直径0.2mmの金線(非絶縁)をはんだ付けします(図1A)。金線をまっすぐ上にして2つの電極を準備し、1つは垂直から45°の角度で準備します。
- 各動物のために、2つのEMG電極を準備する:1つの0.2 mm直径の金線を1.5cmの長さに、第2の1から2cmに切る。これらの両方のワイヤーをカーブして、頭蓋骨の曲線を首の筋肉まで受け入れ、コネクタにはんだ付けされるまっすぐな端を保ちます(図1B)。
- 各動物のために、1つのコネクタを準備する:6チャネルコネクタ(5 mm x 8 mm x 8 mm + 3 mmの金属ピン)を使用し、6つの金属ピンの5に鉛フリーはんだを追加します(1つの中間ピンを省略します)。 図1C)。コネクタの上部にテープを貼り、ごみや水の浸入を防ぐ。
- AAVとシリンジポンプの調製
- テスト AAV (ここでは、AAV9-CaMKIIα0.4-コフィリンS3D-HA) および/またはコントロール AAV (ここでは、AAV9-CaMKIIα0.4-eGFP) ストック AAV ミックス (ここでは、 無菌生理食塩水を含むリン酸緩衝生理食塩水の溶液中のAAVは、所望のウイルス力価(一般に1012-13 ゲノムコピー[GC]/mL)および治療するマウスの数に必要な体積を得る滅菌塩基線を有する。
注:マウス1本当たりの皮質面積あたり1μLの注入体積は、2μLの調製が必要です。 - 10 μLのシリンジをシリンジポンプに固定し、蒸留水で満たします。
- 1 mLの注射器と21G針を用いて、約60cmの長さのPE50チューブを蒸留水で満たします。重要なことに、充填後に21G針と注射器を所定の位置に置いておきます。PE50チューブをシリンジポンプに接続します。PE50チューブの一方の端に21 Gの針/注射器を残し、もう一方の端を10 μLのシリンジに接続します。
- チューブを10 μLのシリンジに固定したら、もう一方の端の針を取り外し、10 μLのシリンジのピストンを押して針が残した隙間を水で埋めます。
注:気泡がないことを確認し、チューブが完全に水で満たされていることを確認してください。 - 針を取り外したチューブの端に28 Gカニューレを取り付けます。10 μL のシリンジでカニューレに水を入れ、完全に充填します。カニューレをステレオタクシックアームにしっかりと固定します。
- テスト AAV (ここでは、AAV9-CaMKIIα0.4-コフィリンS3D-HA) および/またはコントロール AAV (ここでは、AAV9-CaMKIIα0.4-eGFP) ストック AAV ミックス (ここでは、 無菌生理食塩水を含むリン酸緩衝生理食塩水の溶液中のAAVは、所望のウイルス力価(一般に1012-13 ゲノムコピー[GC]/mL)および治療するマウスの数に必要な体積を得る滅菌塩基線を有する。
- 動物の準備
注:C57BL6/Jの雄および雌マウスは、以前は、個々のケージに収容するために少なくとも2週間、およびアドリビタムの食べ物と水と木製の立方体へのアクセスと12-hの光:12-h暗いサイクルに適応しました。- 慎重にマウスを計量し、腹腔内にケタミン/キシラジン(120/10 mg/kg)の混合物を麻酔用に注入する。深部麻酔のために約10分待ちます。
- ヘアトリマーを使用して、耳の後ろから目の前頭まで髪を剃ります。
注:ウィスカーのトリミングは感覚入力とECoGアクティビティ35、36を変更するので、ひげをカットしないように注意してください(シェービング中に指でウィスカーを保護します)。 - 脱水を防ぐために、各目に眼軟膏の寛大な滴を追加します。後足からつまんで、手順中に定期的に麻酔の深さを確認します。つま先ピンチ反射が現れた場合、深部麻酔を確実にするために、0.5〜1.5%のイソフルランをマウスに提供します。
2. 注射器ポンプを用いた皮質内AAV注入
メモ:滅菌された器具とクリーンな環境で、次の手順をすべて実行します。70% エタノールを使用して、滅菌された器具をさらに洗浄し、手術を開始する前にセクション1.1で準備された電極とアンカースクリュー(金で覆われたネジ以外)を洗浄します。
- 耳の棒でステレオタックス装置のマウスの頭部を注意深く固定します。
メモ:ヘッドが横に動いないことを確認してください。 - 窒息を避けるために動物の舌を口からそっと引っ張り出し、ステレオタックスアダプターでマウスの鼻を固定します。
注:手順中に頻繁に呼吸を監視します。 - 70%エタノールで頭部の剃った領域を殺菌し、余分な細かいGraefe鉗子で皮膚を保持することによって、ティッシュはさみで目の根元から皮膚を切り取る。皮膚を伸ばし、頭蓋骨を露出させるために4つの外科用クランプを使用してください(切開の両側に2つ; 図1Dを参照)。
- 鋭利なはさみ先端で頭蓋骨の表面を傷つける:骨縫合を避けながら、骨膜を取り除き、2つ以上の方向に重なり合う筋を作成します。骨片を取り除き、70%エタノールで頭蓋骨を乾燥させます。
注:スクラッチとストリーキングは、頭蓋骨にセメントの付着性を向上させることによって、記録モンタージュをより堅牢にするのに役立ちます(下記参照)。 - カニューレを立体性アームに固定して、ブレグマの位置(すなわち、頭蓋骨の冠と矢状の縫合線の間の交差)を特定する。 図1D)そしてλ(すなわち、頭蓋骨矢状縫合糸と左右のラムドイド縫合糸を結ぶ直線との間の交差; 図1D)を示し、それぞれのステレオタキシック座標をメモします。ブレグマとラムダの z 座標 (縦軸) の差が 0.3 mm より大きい場合は、bregma とラムダの z 位置が揃うまで、ステレオタキスティック アダプターを使用して鼻の高さを調整します。
- これらの座標(運動皮質)でペンで頭蓋骨のカニューレの位置をマークする:正中線に1.5ミリメートルの横の右とブレグマに1.5ミリメートル前)。頭蓋骨の位置に頭蓋骨を慎重に突き刺し、0.7 mm のドリルビットを、頭蓋骨の表面に垂直な方向に(垂直軸に合わせて配置)します。10%プロビトンヨウ素溶液を含浸させた無菌綿の先端でピアスされた頭蓋骨を洗います。
- 10 μL のシリンジピストンを 1 μL引き戻して、1 μL の気泡でカニューレをロードします。テストAAV(ここではAAV9-CaMKIIα0.4-CofilinS3D-HA)またはコントロールAAV(ここではAAV9-CaMKIIα0.4-eGFP)を以前に気泡をロードしたカニューレにロードする:AAVをゆっくりと上下にピペットで混ぜ、 滅菌ペトリ皿に1.7 μLをパイプし、10 μLシリンジのピストンをゆっくりと引っ張ってカニューレに1.5 μLの溶液を吸引します。PE50チューブのエアバブルの位置をマークして、射出の追跡を可能にします。
- カニューレの垂直位置が頭蓋骨の上端(すなわち、頭蓋骨の表面)に達するために、頭蓋骨の穴にカニューレを合わせます。頭蓋骨の表面から、カニューレを1.5mmゆっくりと下げます(頭蓋骨表面と運動皮質の層Vの下に1.5mmに達する)。
注:脳組織の不必要な病変を避けるためにカニューレを下げ過ぎないように非常に注意してください。 - 40分の間に1 μLのAAVを注入するためにシリンジポンプを開始します(速度:0.025 μL/minで組織の損傷を最小限に抑えます)。空気泡の動きとPE50チューブの注入を追跡し、必要に応じて調整を行います。
- 注入が完了したら、カニューレを5分間所定の位置に置いて、十分な拡散を確保し、逆流を避けます。その後、ゆっくりと慎重に立ち上げて、皮質からカニューレを取り除きます。
3. ECoG/EMG電極注入
- まっすぐなケリー鉗子を使用して、AAVが注入された穴の縦軸(穴が突き刺されたのと同じ角度)の1つのECoG電極(ストレートゴールドワイヤー付き)をゆっくりとねじ込みます。硬膜および大脳皮質の損傷を最小限に抑えるために、頭蓋骨から少なくとも2.5mmのネジを残します(すなわち、頭蓋骨表面からおよそ1.1mmの深さのために)。図1D)。
- 後部ECoG電極と頭蓋骨の参照電極の位置を、これらの座標のペンでマークします:後方電極(視覚皮質)正中線への1.5mm横右およびラムダへの1.5mm前センチメートル、参照電極(体性感覚皮質)2.6mm横から中線への横2.6mm横方と0.7mm後方からbregmaにマークします。また、左半球の3つのメンテナンスネジ(頭のモンタージュを固めるために頭のモンタージュを固めるために固定として機能する)の位置を、特定の座標なしでマークしますが、お互いからできるだけ遠く離れてECoG電極から。
- 0.7 mmドリルビットで、他の電極とアンカーネジのマークされた位置に頭蓋骨を慎重に突き刺します。各ねじの頭蓋骨表面に垂直な方向に突き刺す(すなわち、後方電極の垂直軸が、他の部位の垂直軸からの角度を有する)。10%プロビドネヨウ素溶液で突き刺さった頭蓋骨を洗い、出血や汚染を防ぐためにネジを取り付ける前に、繊細なタスクワイパーの小さなロールピースで穴をブロックします。
- まっすぐなケリー鉗子を使用して、左半球のメンテナンスネジをねじ込み、右半球の最後の2つの電極をねじ込みます。穴が貫通した角度と同じ角度でねじ込み、各ネジの少なくとも2.5 mmを頭蓋骨から取り出すようにしてください(図1D)。
注:最終的なモンタージュの固さと電気生理学的な信号の品質を最大限に引き出すために、次の1つを取り付けるときにネジに触れないように注意してください。 - ねじの中のリングのようなスペースの中央に、歯科用セメントを数滴入れてください。1つのEMG電極(ステップ1.1.2で準備)の湾曲した端を、デュモン#5鉗子を使用して湾曲した四肢を保持し、超微細なグレイフ鉗子で筋肉の上の皮膚を持ち上げることによって、首の筋肉に約1〜2mmを挿入します。次に、電極の湾曲した側面と肘を歯科用セメントに入れます。2番目のEMG電極について繰り返します。
注:長いEMG電極のストレートエンドは、前ECoG電極と後部ECoG電極を備えた短いEMG電極の電極と一致する必要があります。2つのEMG電極が互いに接触していないことを確認するか、ネジを使用しないでください。 - マウスの目を覆い、セメント固化を助けるために3〜5分間光を当ててください。EMG電極がしっかりと保持されたら、ECoG電極のベースとアンカーネジのベースを歯科用セメントで覆い、クラウン型の輪郭を形成します。マウスの目を覆い、セメント固化を助けるために3〜5分間光を当ててください。
注:ECoGおよびEMG電極の先端(コネクタにはんだ付けされる金線)や皮膚にセメントを適用しないでください。 - 以前に混合されたアクリルセメントでモンタージュの中心を埋めます。セメント固化の間に、皮膚を保持する4つの外科用クランプを取り外します(そして、繊細なタスクワイパーですぐに洗います)。
注:ECoGおよびEMG電極の先端(コネクタにはんだ付けされる金線)や皮膚にセメントを適用しないでください。 - 縫合針(13mm 3/8c)と合成吸収性モノフィラメントを使用して、頭蓋骨が露出しないように(しかし、皮膚を伸ばしすぎないように)モンタージュの後部と前面の皮膚を縫合します。
- コネクタをモンタージュの上に曲がった鉗子で持ち、電極の金線をコネクタピンに慎重に合わせます。はんだ付け鉄でピンをコネクタに対するはんだ電極の極。
注:皮質組織の過熱や損傷を避けるために迅速に進んでください。各電極が対応するコネクタピンと良好に接触していること、および電極が互いに接続していないことを確認します。 - ステレオタキシック フレームからマウスを削除します。コネクタとヘッドの間の空きスペースを、以前に混合したアクリルセメントで覆い、電極とコネクタピンの間のすべての接続をカバーします。
注:ヘッドの上にコネクタを持つマウス(ヘッドをまっすぐに傾いていない)で、コネクタ内のセメントの浸潤を避けてください。 - マウスの重量を量り、ヒートパッド(ヘッドモンタージュの損傷を避けるために個々のハウジング)のきれいなケージ(できれば非メッシュの蓋を備えています)に入れます。動物を定期的に監視し、目覚め時に0.1mg/kgのブプレノルフィンを皮下に投与し、動物が痛みの徴候を示す場合は12時間後(例えば、異常な姿勢、目を細めた)投与する。
注:手術前の体重に対する体重増加は1.5 gを超えてはなりません。
4. 録音
- マウスを個別に収容して、相互のグルーミングや記録ケーブルの損傷や絡み合いの結果としてヘッドモンタージュの損傷を避けます。
注:このプロトコルでは、マウスは食料、水、木製の立方体へのアドリビタムアクセスで収容され、毎日の監視が行われました。 - ケーブルの状態に適応するために手術後2週間でマウスを記録ケーブルに接続します。
- ECoG/EMG信号を24時間記録します(研究の質問に応じて長く/短く)。
メモ:ECoG/EMG信号記録は、ケーブル、スイベルコネクタ(ケーブルの回転を可能にする)、36チャンネルウェアラブルボックス、およびコンピュータに接続されたアンプを使用して行われました。信号は256 Hz(または研究の質問に応じて)でサンプリングされ、商用ソフトウェアで記録されます(材料表を参照)。十分なウイルス発現を確実にするために、実験は、AAV注射後少なくとも3週間、前に説明した29、37に従って行われるべきである。 - 記録後、頸部脱臼(または免疫染色プロトコルに依存する他の方法)によってマウスを犠牲にし、免疫染色のために脳を収穫する。
結果
電気生理学的記録後、免疫蛍光を用いてAAV注射により感染した領域を定義し、コフィリンS3Dの発現を検証する(図2)。免疫染色は、前に述べたものと同様の方法論を用いて行うことができる29,37,38,39.AAVは、抗HA抗体および二次抗体(Alexa Fluor 488)を用いて免疫蛍光によって検出されるヘマグルチニン(HA)-Tag(コフィリンS3D-HA)と融合した不活性な形態のコフィリンを発現する。感染した興奮性ニューロン(ここでは、カルシウム/カルモジュリン依存性プロテインキナーゼIIα[CamKIIα]AAVに含まれるトランスジーンの発現を制御するプロモーターを標的とする)を抗HA抗体で染色する。感染の成功は、注射部位を取り巻く運動皮質のニューロンの染色によって示される(図2A、B)。この代表例では、他の半球の大脳皮質は目立つ染色を示さなかった。それにもかかわらず、興奮性ニューロンが遠くの脳領域に投影できることを考えると、対側半球での染色は必ずしも注射に失敗したことを示すものではない。感染領域の高倍率は、細胞体および突起の染色を示し、標的皮質領域の特定の細胞のみが感染したことを確認した(図2C)。
興奮性ニューロンのマーカーによる共染色(例えば、静脈状グルタミン酸トランスポーター1、CaMKIIα)も細胞型特異性を検証するために行うことができる。あるいは、阻害性ニューロンまたはアストロサイトのマーカーによる共染色は、これらの細胞が異なるプロモーターを用いて標的化された場合に行うことができる。コフィリンS3D-HAとCaMKIIαの共染色も、運動皮質に抗HA染色を示した注射部位に対してより後部の領域について同じ動物でも行われた(図2D)。この領域のより高い拡大画像は、コフィリンS3D-HA(AlexaFluor 488、 図2E)およびCaMKIIα(Alexa Fluor 568、 図2F)を明確に発現する細胞を示す。コフィリンS3D-HAとCaMKIIα染色の重ね合わせにより、コフィリンS3D-HAに染色された細胞の大部分(すべてではないにしても)がCaMKIIαにも陽性であることを明らかにしている(図2G)。この観察は興奮性ニューロンの感染の特異性を支持する。
ECoG活性に対するコフィリン操作の影響を評価するために、ECoGおよびEMG信号は警戒状態(覚醒、遅い波の睡眠、逆説的な睡眠)の視覚的同定を行うために使用される。これは、マウス2の警戒状態の急速な変化のために4 sエポックで行われ、ここで、完全な24時間の記録のために行われます。標準分析には、睡眠アーキテクチャとスペクトル分析変数の計算が含まれます。特に、異なる状態のECoG信号のスペクトル解析は、状態の組成と品質を指標とする。例えば、電極の異なる深さから生じる可能性のある違いを取り除くために、スペクトル分析データは、与えられた動物のすべての状態の総電力に対する相対的に表現することができる(図3A)。高い周波数におけるECoG活性の相対振幅が非常に低いことを考えると、覚醒、遅い波の睡眠、および逆説的な睡眠のための相対的なパワースペクトルは、より適切に視覚化し、低い周波数と高い周波数での活動を同時に比較するためにログ変換されています。この分析は、コフィリン不活性化の条件下でのスペクトル活性の状態特異的な違いを示す(図3B)。より正確には、男性マウスと雌マウスを組み合わせたこれらの予備的な知見は、コフィリン不活性化が覚醒時の高速周波数(14〜30Hz)および逆説的な睡眠中の遅い周波数(1〜4Hz)でスペクトルパワーを有意に増加させ、遅波睡眠中のECoG活性は主に影響を受けないと指摘している。また、コフィリンの不活性化は、ECoG活性におけるマウス間変動を増加させるように見える(特に、図3Bの覚醒のための誤差バーから顕著である)。
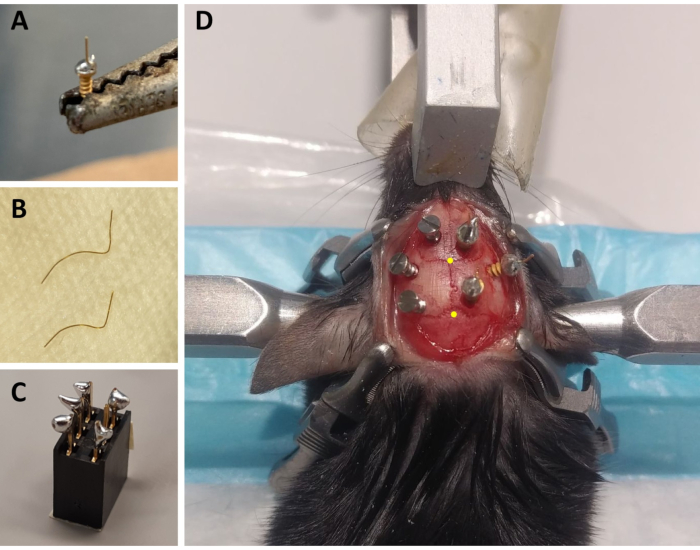
図1: ECoG/EMGモンタージュ部品の製造とECoG電極配置の代表例(A)ECoG電極:長さ4mm、直径0.2mmの金線(非絶縁)は、鉛フリーの半田を使用して金で覆われたねじ(1.9mmのヘッド直径、1.14mmの糸の大口径、3.6mmの全長)の頭に融合する。(B)EMG電極:2本の金線(1.5と2cm)が首の筋肉まで頭蓋骨の曲線を受け入れるように湾曲し、もう一方の端はコネクタにまっすぐはんだ付けされるように保たれる。(C)6チャンネルコネクタ:リードフリーはんだはコネクタ(5mm x 8 mm x 8 mm + 3 mmの金属ピン)の6つの金属ピン(中央に1本を省略)の5に追加します。コネクタの上部は、ごみ/水の浸入を避けるためにテープで覆われています。(D) 左半球の頭蓋骨上の3つのメンテナンスねじと右半球の3つのECoG電極(参照電極を含む)の位置付けの例。ECoG電極の正確な立体座標は、ステップ2.6と3.2で示され、ブレグマとラムダの位置に応じて計算されています(これは黄色の点で示されます)。略語: ECoG = 電気コルチコグラフィ;EMG = 筋電図。この図の大きなバージョンを表示するには、ここをクリックしてください。
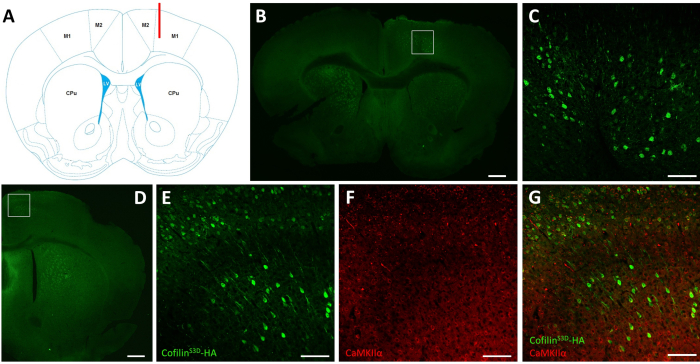
図2: AAV感染領域および細胞型を定義する代表的な免疫染色(A)パネルBに提示されたコロナスライスの注入部位を示す概略図。位置はブレグマに対して1.1mm前から、カニューレ(赤色で示す)は右一次運動皮質(M1)の層Vを対象とした。フランクリンとパキシノス40から変更された表現.(B)ブレグマに約1.1mm前から位置する完全な脳のコロナスライスについて示されるニューロンにおけるコフィリンS3D-HA発現を検出するHAの免疫染色。感染した領域は主に、右の一次および二次運動皮質(M1およびM2)の層VおよびVI(赤外線層)に局地化する。スケールバー= 500 μmこの正方形は、C.(C)感染細胞の染色を示す感染領域の高倍率および運動皮質のより深い層におけるコフィリンS3D-HAの発現を確認する。スケールバー=100μm(D)HAとCaMKIIαの共同免疫染色は、ブレグマに約0.5mm前部に位置する右半球のコロナスライスに対して示される細胞型特異性を評価し、したがって、注射部位(パネルBおよびCと同じマウス)に後部を示した。感染した領域は運動皮質(M1および主にM2)に局地する。スケールバー= 500 μmこの正方形は、E、F、およびG(E)感染細胞の染色およびコフィリンS3D-HAの発現を示す感染領域の高倍率で示す領域を表す。スケールバー=100μm(F)CaMKIIα陽性細胞の染色を示す感染領域の高倍率。スケールバー=100μm(G)コフィリンS3D-HA及びCaMKIIαの共標識を示す感染領域の高倍率を示し、感染細胞がCaMKIIα陽性であることを確認した。スケールバー= 100 μm略語: AAV = アデノ関連ウイルス;M1 =一次運動皮質;M2 = 二次運動皮質;CPu = コーデートプタメン (線条体);LV =側索心室;HA= ヘマグルチニン;カムキイα =カルシウム/カルモジュリン依存性プロテインキナーゼII α。この図の大きなバージョンを表示するには、ここをクリックしてください。
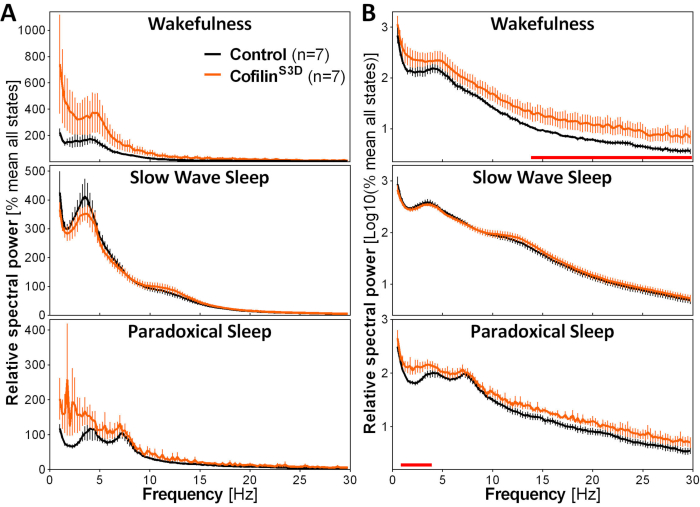
図3:コフィリン機能のウイルス操作後に得られた覚醒、遅波睡眠、および逆説的な睡眠のための代表的なパワースペクトル。AAV9-CaMKIIα0.4-コフィリンS3D-HA(ウイルスタイター2.58×1013 GC/mL)またはコントロールAAV(AAV9-CaMKIIα0.4-eGFP 1.2 ×5)を注射したマウス(n= 5/1グループあたり2)このコントロールAAV)の強化信号を制御する試験用タイターの半分を、24時間記録した運動皮質のレイヤVで、 そして、電気コルチコチコの信号は、スペクトル分析(0.25Hz解像度で0.5と30 Hzの間のスペクトルパワーを計算するために高速フーリエ変換)を受けました。(A) 全ての州の総電力に対して表される3つの警戒状態の間のパワースペクトル。(B) 相対パワースペクトルは、より高い周波数でのグループの違いをより適切に表すために、ログ変換。AAV9-CaMKIIα0.4-コフィリンS3D-HAを用いた運動皮質におけるコフィリン活性の抑制は、覚醒時のベータ範囲(14〜30Hz)および逆説的睡眠中のデルタ範囲(1〜4 Hz)において、コントロールインジェクション(x軸上の赤線はマン・ホイットニー U-周波数<0.0<バンド<0.0.0)を比較して有意に増加させる。略語: AAV = アデノ関連ウイルス GC = ゲノムコピー;HA= ヘマグルチニン;カムキイα =カルシウム/カルモジュリン依存性プロテインキナーゼIIアルファ;eGFP = 強化された緑色蛍光タンパク質。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、AAVを使用した分子標的の操作中にECoGおよびEMG活性を監視する正確かつ簡単な方法を記述する。グループ間の適切な比較のために、テストとコントロール動物のために同じ日に常に外科的処置(AAV注入および電極注入)を計画し、同時にそれらの電気生理学的信号を記録することを強く推奨する。試験動物と対照動物との間で同様のウイルス発現を得るためには、同じウイルス用タイターを注入することが望ましい。本例では、コントロールAAVのウイルス・チターは、類似のウイルス発現を確保するために試験AAVの半分に減少していた。実験者は、脳領域/皮質層ターゲティングにおける動物間変動性が低いように、立体的座標の測定に非常に注意する必要があります。さらに、射出深度が頭蓋骨表面から計算され、頭蓋骨の厚さが年齢や性別によって変化することを考えると、カニューレの配置は、プロトコル後の神学または免疫体化学(例えば、 図2)を使用して常に検証し、適切な位置/深度の注入を確実にし、必要に応じて立体座標を調整する必要があります。40分AAV注入を通して、ポンプ閉塞などの潜在的な問題を迅速に検出し、修正するために注入速度を監視することは非常に重要です。いくつかの実験ステップは、最適な電気生理学的信号を得るためにも重要です。例えば、電極注入の間にねじを締めないでください。大脳皮質の損傷や、グリア瘢痕の形成を最小限に抑えるために、ネジは頭蓋骨から少なくとも2.5mmで突き出す必要があります。その後、i)電極の先端にセメントを塗布することを避け、ii)電極をコネクタに迅速にはんだ付けし、iii)電極間に接触がないことを確認することも非常に重要です。
ECoGおよびEMGの記録のためにここに提示されるプロシージャは非常によく確立され、簡単で、マウス2、11、13、34の覚醒および睡眠を監視するために広く使用される。連続ECoGとEMGの録音は、連続した数日間(および数週間)実行することができ、覚醒と睡眠量とアーキテクチャ2、11、12(例えば、光と暗い期間ごとに異なる状態で過ごした時間、各状態のエピソードの数)に関連する変数を含む分析のいくつかの行を実行するために使用することができる非常に豊富なデータセットを生成することができます 睡眠の24時間分布)、覚醒および睡眠スペクトル含有量34、41(例えば、異なる周波数帯のパワー[図3]に似た、スケールフリー活性)、および個々の波の特性42、43、44(例えば、遅波振幅および傾斜)。AAV媒介分子操作と組み合わせて使用する場合、トランスジェニック動物で起こり得る潜在的な発達補償の回避が追加の利点である。練習では、40分AAV注入を含む全ての手順は、約90分で行うことができる。手術は低侵襲であるため、死亡率は(非常に)低くする必要があります。
AAVによるECoG/EMG記録とターゲット操作の同時使用は、他にもさまざまな利点と用途を提供します。例えば、立体的ターゲティングの精度は、適切に行われると、非常に高く、複製可能であり、睡眠または他の生理学的プロセスの調節における特定の脳領域(および/または細胞タイプまたは領域内の分子要素)の特定の役割を決定するのに有用である。したがって、いくつかの異なる皮質領域は、現在のプロトコルの適応を使用して容易に標的化することができる。さらに、AAVを用いた標的操作は、ECoG記録部位とは異なる皮質/皮質下領域に向けられる可能性がある。このような場合、AAV注入のためのバリ穴は、歯科用セメント(または骨ワックス)を使用して固定された小さなガラスカバースリップで覆われることができた。特異性を高めるため、AAV構築には、多くの場合、正確な細胞タイプ14の標的感染を可能にするプロモーターが含まれている。CamKIIαプロモーターは、運動皮質の興奮性錐体細胞14、29、45を特異的に標的化するために本プロトコルで使用された。この戦略は、コフィリンの不活性化(コフィリンS3Dを使用)32、33の運動皮質の興奮性ニューロンにおける、およびECoG活性における状態特異的変化の観察を可能にした(図3)。感染/伝達効果を評価するために、将来のプロトコルユーザーは、提示されたAAV-ECoGプロトコルと免疫蛍光による共染色の1つを組み合わせ、高倍率画像を使用して、標的の単一標識を示す細胞の総数のうち二重標識を示す細胞の数を計算することができます(ここでは、CaMKIIα発現ニューロン)。最近の研究では、ここで説明したものと同様のAAV-ECoG法を用いて、シナプシンプロモーターを含むAAVを用いて運動皮質のすべてのニューロンにおいて脆弱X精神遅滞症候群関連タンパク質1(FXR1)を過剰発現させ、この操作が警戒状態分布およびスペクトル含有量28に及ぼす影響を明らかにした。これらの知見は、AAVを使用して標的脳領域内の特定の分子を操作することによって、特定の覚醒/睡眠パラメータの調節における役割を明らかにする方法を示している。
記載されたプロトコルの制限は、AAV注射を行う前にカニューレ配置で起こる脳組織の小さな病変であり、これはまた、炎症反応を伴うことがある。これは、皮質下領域で AAV 注入を実行する場合に特に懸念される可能性があり、適切な制御を使用して常に取り組む必要があります。.あるいは、現在のプロトコルは、リアクティブなグリオシスおよび/または微小グリア活性化(例えば、免疫蛍光を使用して)の定量化を行い、制御および試験群で同様のレベルを確保し、したがってECoG読み出しでそれに続く可能性がある。第2の制限は、電極とコネクタの間の接続不良のリスクに関連し、連続的または時折悪い電気生理学的信号をもたらす可能性があります。しっかりとねじ込み、はんだ付け、およびセメント電極は、この問題の発生を最小限に抑えます。第3の制限は、記録中にヘッドモンタージュを介してつながれる動物に関連しており、少なくともある程度移動やその他の行動を制限し、時にはケーブルの損傷と信号損失を引き起こし得る。最後に、提示されたプロトコルは、若い動物の頭蓋骨の大きさが、前述の2のように、描かれた頭部モンタージュの設置に困難を引き起こす可能性があることを考えると、成体マウスに適している。
ECoG/EMGの記録とAAV媒介的な正確な標的の操作を組み合わせることは、睡眠の神経科学以外の研究分野にも適用可能である。とりわけ、発作の動物モデルにおけるてんかん事象の研究および操作に使用することができ、記憶符号化および統合46、47に関与する脳振動を調節するための強力なツールである。したがって、潜在的な応用は確かに神経変性疾患を含む精神医学と神経学の基礎研究の分野を包含する。AAVは、非活性な分子の発現能力に加えて、過剰発現または下方調節(例えば、小干渉RNA、CRISPR/Cas9)、または全身KO中の分子の発現を救うために使用され、使用されています。重要なことに、現在のプロトコルの二重方法論は、睡眠と神経変性48、49の両方を理解する興味深いモデルを表すラットおよび日経げっ歯類のような他の哺乳類種にも適用可能である。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、睡眠分子生理学のカナダ研究委員長によって資金提供されました。著者たちは、クロエ・プロボストとキャロライン・ブシャールに技術的な助けを求めて感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Surgery peparation | |||
| 21 G needle | Terumo | NN-2125R | |
| 6-channel connector | ENA AG | BPHF2-O6S-E-3.2 | Connector used in this manuscript, but discontinued. See potential replacement below |
| Distrelec | 300-93-672 | Potential replacement for discontinued connector above | |
| C57BL6/J mice | Jackson Laboratory | 000664 | B6 | Animals bred on site |
| Pluronic F-68 | Non-ionic surfactant | ||
| Gold wire 0.2 mm diameter | Delta scientific | 920-862-41 | Non-insulated |
| Hamilton syringe (10 μL) | Fisher Scientific | 14815279 | |
| Infusion syringe Pump CMA 402 | Harvard Apparatus | CMA8003110 | |
| Injection cannula 28 G | Plastics one | C313l-SPCL | |
| Isoflurane | Baxter | CA2L9100 | |
| Ketamine (10 mg/mL) | SANDOZ | 4550 | |
| Lead-free solder | AIM | SN100C | |
| Lubricating ophthalmic ointment | ALLERGAN | 210889 | |
| PE 50 Catheter thin wall | Plastics one | C232CT | |
| Flat fillister head self tapping screws | MORRIS | FF00CE125 | ECoG electrode gold covered; Dimension : 1.9 mm head diameter, 1.14 mm thread major diameter, 3.6 mm length |
| Soldering iron | Weller | WES51 | |
| Syringe 1 mL | BD | 309659 | |
| Trimmer | Harvard Apparatus | 72-9063 | |
| Xylazine (20 mg/mL) | Bayer | 2169592 | |
| Intracortical AAV injection with syringe pump | |||
| 0.7 mm drill bit | Dremel | 628 | |
| AAV9-CaMKIIα0.4-cofilinS3D-HA | UPenn Viral Core | ||
| AAV9-CaMKIIα0.4-eGFP | UPenn Viral Core | ||
| Cotton tippped applicators | Medicom | 806 | |
| Drill | Dremel | 8050-N/18 | |
| Extra-fine Graefe forceps | Fine science tools | 11150-10 | |
| Stereotaxic arm | Stoelting | 51604U | |
| Stereotaxic frame | Stoelting | 51600 | |
| Surgical clamps | Fine science tools | 18050-28 | |
| Tissue scissor | Magna Stainless | M4-124 | |
| ECoG/EMG electrode implantation | |||
| Buprenorphine (0.3 mg/mL) | CEVA | 57133-02 | |
| Curved forceps | Fine science tools | 11001-12 | |
| Delicate task wipers | Kimtech | 34120 | |
| Dental acrylic cement | Yates Motloid | 44115 | |
| Dumont #5 forceps | Fine science tools | 91150-20 | |
| Extra fine Graefe forceps | Fine science tools | 11150-10 | |
| Kelly forceps | Fine science tools | 13002-10 | |
| Liquid acrylic | Yates Motloid | 44119 | |
| Monocryl plus suture needle 13 mm 3/8c rev cutting | Ethicon | MCP494 | |
| Providone-iodine 10% | Triad disposables | 10-8208 | |
| RelyX Unicem 2, Adhesive Resin Cement A2 | 3M | 56849 | |
| Immunofluorescence and ECoG recording | |||
| 36-Channel EEG Wearable Headbox | LaMONT Medical | 832-000350 | |
| CaMKII alpha Monoclonal Antibody (Cba-2) | Invitrogen | 13-7300 | Dilution 1:500 |
| Conductors Awg PVC Insulation Cable | Calmont Wire & Cables | HC-0819075R0 | |
| Donkey anti-Mouse IgG secondary Ab, Alexa Fluor 568 | Invitrogen | A10037 | Dilution 1:1000 |
| Goat anti-Rabbit IgG secondary Ab, Alexa Fluor 488 | Invitrogen | A-11008 | Dilution 1:500 |
| HA-Tag (C29F4) Rabbit mAb | Cell signaling | 3724 | Dilution 1:800 |
| Programmable Amplifier | LaMONT Medical | 815-000002-S2 | |
| Stellate Harmonie | Natus | HSYS-REC-LT2 | |
| Swivel connector | Crist Instrument Company Inc. | 4-TBC-9-S |
参考文献
- Campbell, I. G. EEG recording and analysis for sleep research. Current Protocols in Neuroscience. , (2009).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Current Protocols in Mouse Biology. 2 (1), 55-74 (2012).
- Bastien, C. H., et al. Insomnia and sleep misperception. Pathologie Biologie. 62 (5), 241-251 (2014).
- Malafeev, A., et al. Automatic artefact detection in single-channel sleep EEG recordings. Journal of Sleep Research. 28 (2), 12679 (2019).
- Latreille, V., et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease. Brain. 139, 1189-1199 (2016).
- Rodrigues Brazete, J., et al. Electroencephalogram slowing predicts neurodegeneration in rapid eye movement sleep behavior disorder. Neurobiology of Aging. 37, 74-81 (2016).
- Kent, B. A., Strittmatter, S. M., Nygaard, H. B. Sleep and EEG power spectral analysis in three transgenic mouse models of Alzheimer's disease: APP/PS1, 3xTgAD, and Tg2576. Journal of Alzheimers Disease. 64 (4), 1325-1336 (2018).
- Chang, A. M., et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiology International. 33 (5), 561-573 (2016).
- Shi, G., Wu, D., Ptacek, L. J., Fu, Y. H. Human genetics and sleep behavior. Current Opinion in Neurobiology. 44, 43-49 (2017).
- Nakai, Y., et al. Calcineurin and its regulator sra/DSCR1 are essential for sleep in Drosophila. Journal of Neuroscience. 31 (36), 12759-12766 (2011).
- El Helou, J., et al. Neuroligin-1 links neuronal activity to sleep-wake regulation. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9974-9979 (2013).
- Freyburger, M., et al. EphA4 is involved in sleep regulation but not in the electrophysiological response to sleep deprivation. Sleep. 39 (3), 613-624 (2016).
- Seok, B. S., et al. The effect of Neuroligin-2 absence on sleep architecture and electroencephalographic activity in mice. Molecular Brain. 11 (1), 52 (2018).
- Haery, L., et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation. Frontiers in Neuroanatomy. 13, 93 (2019).
- Schmidt, F., Grimm, D. CRISPR genome engineering and viral gene delivery: a case of mutual attraction. Biotechnology Journal. 10 (2), 258-272 (2015).
- Wang, D., Zhang, F., Gao, G. CRISPR-based therapeutic genome editing: strategies and in vivo delivery by AAV vectors. Cell. 181 (1), 136-150 (2020).
- Havekes, R., et al. Transiently increasing cAMP levels selectively in hippocampal excitatory neurons during sleep deprivation prevents memory deficits caused by sleep loss. Journal of Neuroscience. 34 (47), 15715-15721 (2014).
- Fuller, P. M., Yamanaka, A., Lazarus, M. How genetically engineered systems are helping to define, and in some cases redefine, the neurobiological basis of sleep and wake. Temperature. 2 (3), 406-417 (2015).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ono, D., Yamanaka, A. Hypothalamic regulation of the sleep/wake cycle. Neuroscience Research. 118, 74-81 (2017).
- Shiromani, P. J., Peever, J. H. New neuroscience tools that are identifying the sleep-wake circuit. Sleep. 40 (4), 032 (2017).
- Oishi, N., et al. Artificial association of memory events by optogenetic stimulation of hippocampal CA3 cell ensembles. Molecular Brain. 12 (1), 2 (2019).
- Anaclet, C., et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control. Journal of Neuroscience. 38 (22), 5168-5181 (2018).
- Chen, K. S., et al. A hypothalamic switch for REM and non-REM sleep. Neuron. 97 (5), 1168-1176 (2018).
- Torontali, Z. A., Fraigne, J. J., Sanghera, P., Horner, R., Peever, J. The sublaterodorsal tegmental nucleus functions to couple brain state and motor activity during REM sleep and wakefulness. Current Biology. 29 (22), 3803-3813 (2019).
- Rolls, A., et al. Optogenetic disruption of sleep continuity impairs memory consolidation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13305-13310 (2011).
- Ognjanovski, N., Broussard, C., Zochowski, M., Aton, S. J. Hippocampal network oscillations rescue memory consolidation deficits caused by sleep loss. Cerebral Cortex. 28 (10), 3711-3723 (2018).
- Khlghatyan, J., et al. Fxr1 regulates sleep and synaptic homeostasis. EMBO Journal. 39 (21), 103864 (2020).
- Havekes, R., et al. Sleep deprivation causes memory deficits by negatively impacting neuronal connectivity in hippocampal area CA1. Elife. 5, 13424 (2016).
- Wong, L. W., Tann, J. Y., Ibanez, C. F., Sajikumar, S. The p75 neurotrophin receptor is an essential mediator of impairments in hippocampal-dependent associative plasticity and memory induced by sleep deprivation. Journal of Neuroscience. 39 (28), 5452-5465 (2019).
- Mizuno, K. Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular Signalling. 25 (2), 457-469 (2013).
- Nagaoka, R., Abe, H., Obinata, T. Site-directed mutagenesis of the phosphorylation site of cofilin: its role in cofilin-actin interaction and cytoplasmic localization. Cell Motility and the Cytoskeleton. 35 (3), 200-209 (1996).
- Elam, W. A., et al. Phosphomimetic S3D cofilin binds but only weakly severs actin filaments. Journal of Biological Chemistry. 292 (48), 19565-19579 (2017).
- Areal, C. C., Cao, R., Sonenberg, N., Mongrain, V. Wakefulness/sleep architecture and electroencephalographic activity in mice lacking the translational repressor 4E-BP1 or 4E-BP2. Sleep. 43 (2), (2020).
- Vyazovskiy, V., Borbely, A. A., Tobler, I. Unilateral vibrissae stimulation during waking induces interhemispheric EEG asymmetry during subsequent sleep in the rat. Journal of Sleep Research. 9 (4), 367-371 (2000).
- Sitnikova, E. Neonatal sensory deprivation promotes development of absence seizures in adult rats with genetic predisposition to epilepsy. Brain Research. 1377, 109-118 (2011).
- Tudor, J. C., et al. Sleep deprivation impairs memory by attenuating mTORC1-dependent protein synthesis. Science Signaling. 9 (425), 41 (2016).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293 (2015).
- Dufort-Gervais, J., et al. Neuroligin-1 is altered in the hippocampus of Alzheimer's disease patients and mouse models, and modulates the toxicity of amyloid-beta oligomers. Scientific Reports. 10 (1), 6956 (2020).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates, Third edition. , (2007).
- Lina, J. M., O'Callaghan, E. K., Mongrain, V. Scale-free dynamics of the mouse wakefulness and sleep electroencephalogram quantified using Wavelet-Leaders. Clocks & Sleep. 1 (1), 50-64 (2019).
- Massart, R., et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes. Translational Psychiatry. 4, 347 (2014).
- Freyburger, M., Poirier, G., Carrier, J., Mongrain, V. Shorter duration of non-rapid eye movement sleep slow waves in EphA4 knockout mice. Journal of Sleep Research. 26 (5), 539-546 (2017).
- Hubbard, J., et al. Rapid fast-delta decay following prolonged wakefulness marks a phase of wake-inertia in NREM sleep. Nature Communications. 11 (1), 3130 (2020).
- Johansen, J. P., et al. Optical activation of lateral amygdala pyramidal cells instructs associative fear learning. Proceedings of the National Academy of Sciences of the United States of America. 107 (28), 12692-12697 (2010).
- Boyce, R., Glasgow, S. D., Williams, S., Adamantidis, A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science. 352 (6287), 812-816 (2016).
- Bandarabadi, M., et al. Dynamic modulation of theta-gamma coupling during rapid eye movement sleep. Sleep. 42 (12), 182 (2019).
- Estrada, C., et al. Transcranial magnetic stimulation and aging: Effects on spatial learning and memory after sleep deprivation in Octodon degus. Neurobiology of Learning and Memory. 125, 274-281 (2015).
- Hurley, M. J., et al. The long-lived Octodon degus as a rodent drug discovery model for Alzheimer's and other age-related diseases. Pharmacology & Therapeutics. 188, 36-44 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved