Method Article
הקלטה אלקטרוקורטיקוגרפית של אזורי קליפת המוח מניפולציה באמצעות וירוס הקשור אדנו מיקוד Cofilin בעכברים
In This Article
Summary
מאמר זה מתאר פרוטוקול למניפולציה של מטרות מולקולריות בקליפת המוח באמצעות וירוסים הקשורים אדנו לניטור ההשפעות של מניפולציה זו במהלך ערנות ושינה באמצעות הקלטות אלקטרוקורטיקוגרפיות.
Abstract
השימוש בהקלטות אלקטרוקורטיקוגרפיות (ECoG) במכרסמים רלוונטי למחקר שינה ולחקר מגוון רחב של מצבים נוירולוגיים. וירוסים הקשורים אדנו (AAVs) משמשים יותר ויותר כדי לשפר את ההבנה של מעגלי המוח ואת הפונקציות שלהם. המניפולציה בתיווך AAV של אוכלוסיות תאים ספציפיות ו/או של רכיבים מולקולריים מדויקים הייתה שימושית מאוד לזיהוי מעגלים/מולקולות רגולטוריות שינה חדשים וחלבונים מרכזיים התורמים להשפעות השליליות של אובדן שינה. לדוגמה, עיכוב הפעילות של קופילין חלבון ניתוק אקטין חוטי באמצעות AAV מונע ליקוי זיכרון הנגרמת מחוסר שינה. כאן, פרוטוקול מתואר המשלב את המניפולציה של תפקוד cofilin באזור קליפת המוח עם הקלטה של פעילות ECoG כדי לבחון אם cofilin קליפת המוח מווסת את האותות ערות ושינה ECoG. הזרקת AAV מבוצעת במהלך אותו הליך כירורגי כמו השתלת אלקטרודות ECoG ואלקטרומיוגרפיה (EMG) בעכברים זכר ונקבה בוגרים. עכברים הם מרדים, וראשיהם מגולחים. לאחר ניקוי העור וחבטה, נקבעים קואורדינטות סטריאוטקסיות של קליפת המוח המוטורית, והגולגולת מנוקבת במיקום זה. צינורית ממולאת מראש עם AAV מבטא cofilinS3D, צורה לא פעילה של cofilin, ממוקם לאט ברקמת קליפת המוח. לאחר עירוי AAV, ברגים מצופים זהב (אלקטרודות ECoG) מוברגים דרך הגולגולת ומחזקים לגולגולת עם חוטי זהב המוחדרים לשרירי הצוואר (אלקטרודות EMG). בעלי החיים מורשים שלושה שבועות להתאושש ולהבטיח ביטוי מספיק של cofilinS3D. האזור הנגוע וסוג התא מאומתים באמצעות אימונוהיסטוכימיה, וה- ECoG מנותח באמצעות זיהוי חזותי של מצבי דריכות וניתוח ספקטרלי. לסיכום, גישה מתודולוגית משולבת זו מאפשרת לחקור את התרומה המדויקת של רכיבים מולקולריים המסדירים את המורפולוגיה העצבית ואת הקישוריות לוויסות פעילות קליפת המוח המסונכרנת במהלך ערנות ושינה.
Introduction
הקלטות אלקטרואנצפלוגרפיות (או בדרך כלל אלקטרוקורטיקוגרפיות [ECoG] במכרסמים) והקלטות אלקטרומיוגרפיות (EMG) נמצאות בשימוש נרחב במחקר שינה, כמו גם באופן רחב יותר במדעי המוח, הנוירולוגיה והפסיכיאטריה. בשילוב, אותות אלקטרופיזיולוגיים אלה מאפשרים זיהוי של מצבי דריכות וכימות לאחר מכן של משך המדינה והרכב ספקטרלי, הן בבני אדם והן מכרסמים1,2,3,4. כימות כזה היה שימושי כדי להבין כיצד שינה משתנה בתנאים פתולוגיים כגון מחלות ניווניות ומודלים5,6,7 או על ידי שינוי גנטי8,9. לדוגמה, הנוקאאוט (KO) של גנים שונים הקשורים לתקשורת עצבית הוכח כמשתנה את משך הערנות והשינה הן בעכבר והן בזבוב הפירות10,11,12,13. כדי להתמודד עם פיצוי התפתחותי פוטנציאלי הנובע ממחקר של KO גוף מלא במכרסמים ולאפשר שליטה עדינה יותר של מניפולציה גנטית, דרך יעילה לתפעל ביטוי גנים היא להשתמש בווירוסים הקשורים אדנו (AAVs). מניפולציה גנטית בתיווך AAV יכולה לשמש כדי למטה - או upregulate יעד מולקולרי נתון ולהגביל את המניפולציה לאוכלוסיית תאים מסוימת באמצעות סוגים שונים של מקדמים14. AAVs משמשים גם באופן נרחב כשיטת מסירה בחזרות פלינדרומיות קצרות משולבות באופן קבוע (CRISPR)/Cas9טכנולוגיית 15,16. מתודולוגיות אלה מאפשרות שליטה זמנית ומרחבית טובה יותר במניפולציה גנטית, הקשורה בדרך כלל לביטוי של כתב המאפשר כימות של האזור הנגוע באמצעות אימונופלואורסצנטיות.
AAVs מייצגים גם את הווקטור העיקרי עבור מניפולציות ספציפיות לסוג התא של פעילות עצבית באמצעות אופטוגנטיקה וכימוגנטיקה17,18,19, אשר היו בשימוש נרחב במחקר האחרון על מחלות ניווניות, התנהגות, קוגניציה, ושינה20,21,22. במחקר שינה, היישום של אופטוגנטיקה להפעלה או עיכוב של אזורי מוח מסוימים, כגון המוח המבסאלי, ההיפותלמוס, ו tegmentum sublaterodorsal, היה שימושי כדי לקבוע את תפקידם בשליטה על עוררות, שינה בגל איטי (הידוע גם בשם שינה תנועות עיניים לא מהירה), שינה פרדוקסלית (או שינה תנועת עיניים מהירה), ו cataplexy23, 24,25. יתר על כן, מניפולציות בתיווך AAV עזרו לברוח מעגלי שינה חשובים רגולטוריים ומולקולות התורמות להשפעות השליליות של אובדן שינה26,27,28. לדוגמה, חלבון אחד שהוכח כמי ש מעורב בפגיעה בזיכרון הנגרמת מחוסר שינה הוא cofilin29,30. חלבון זה הוא חלבון ניתוק אקטין חוטי המשתתף בארגון מחדש של חוטי actin על ידי מחייב פיזית לפעול ולקדם את פירוק הסיבים באופן דינמי31. עיכוב פעילות cofilin באמצעות גישה בתיווך AAV הוכח כדי למנוע אובדן עמוד השדרה, כמו גם פלסטיות סינפטית ליקויי זיכרון הנגרמים על ידי מניעת שינה בעכברים29. באופן קולקטיבי, מחקרים אלה מדגישים את התועלת והרלוונטיות של מניפולציות בתיווך AAV כדי להבין את ויסות השינה ואת ההשלכות של מניעת שינה במכרסמים.
כאן, פרוטוקול מתואר המשלב ECoG ו EMG אלקטרודה השתלה והקלטה עם מניפולציה של תפקוד cofilin באזור קליפת המוח של עכברים מסוג בר (WT) באמצעות AAV. ליתר דיוק, AAV (serotype 9) מבטא את רצף הקידוד של צורה phosphomimetic של cofilin העכבר (cofilinS3D), עיבוד זה לא פעיל32,33, מוזרק בקליפת המוח המוטורית (M1 ו- M2). אלקטרודה ECoG מושתל ישירות באתר ההזרקה כדי להבטיח הקלטה של הפעילות הקליפתית המסונכרנת של התאים הנגועים. הקלטת ECoG/EMG נערכת במשך 24 שעות בתנאים ללא הפרעה שלושה שבועות לאחר הניתוח כדי לאפשר התאוששות, הסתגלות וביטויS3D קופלין גבוה. ההקלטה משמשת לאחר מכן לזיהוי מצבי דריכות וניתוח ספקטרלי ECoG, כפי שתואר במחקרים קודמים11,34. מתודולוגיה זו יכולה לחשוף באופן ספציפי כיצד cofilin קליפת המוח מווסת ערנות לישון אותות ECoG בעכברים. שילוב זה של הקלטות אלקטרופיזיולוגיות ומניפולציה גנטית בתיווך AAV רלוונטי במיוחד כדי לחקור את התפקידים של אלמנטים מולקולריים שונים בתפקודי מוח ספציפיים וניתן להחיל אותו על אזורי מוח קליפת המוח (ותת-קורטיקלי) של עניין WT ועכברים מהונדסים גנטית משני המינים ואפילו מינים אחרים.
Protocol
כל השיטות אושרו על ידי Comité d'éthique de l'expérimentation animale של Recherche CIUSSS-NIM והם בהתאם להנחיות המועצה הקנדית לטיפול בבעלי חיים. עיין בטבלת החומרים עבור ריאגנטים, ציוד וחומרים המשמשים בפרוטוקול זה.
1. הכנה לניתוח
- הכנת אלקטרודות ECoG ו- EMG
- עבור כל חיה, הכינו שלוש אלקטרודות ECoG: באמצעות מגהץ הלחמה, הניחו טיפה קטנה של הלחמה נטולת עופרת על מכסה הבורג המכוסה בזהב, והלחמו חוט זהב באורך 4 מ"מ ובקוטר 0.2 מ"מ (לא מבודד) על גבי מכסה הבורג באמצעות הלחמה נטולת עופרת(איור 1A). הכן 2 אלקטרודות עם חוט הזהב ישר למעלה, ואחד עם זווית של 45° מהאנכי.
- עבור כל בעל חיים, להכין שתי אלקטרודות EMG: לחתוך חוט זהב אחד בקוטר 0.2 מ"מ לאורך של 1.5 ס"מ והשני אחד עד 2 ס"מ. עקום שני החוטים עבור אלה לאמץ את העקומה של הגולגולת עד לשרירי הצוואר, שמירה על קצה ישר כי יהיה מולחם למחבר (איור 1B).
- עבור כל בעל חיים, הכינו מחבר אחד: השתמשו במחבר בעל 6 ערוצים (5 מ"מ x 8 מ"מ x 8 מ"מ + פיני מתכת 3 מ"מ), והוסיפו הלחמה נטולת עופרת ל-5 מתוך 6 סיכות המתכת (השמטת סיכה אמצעית אחת; איור 1C). לכסות את החלק העליון של המחבר עם סרט כדי למנוע המלטה או חדירת מים.
- הכנת AAVs ומשאבת מזרק
- הכן את המבחן AAV (כאן, AAV9-CaMKIIα0.4-cofilinS3D-HA) ו/או השליטה AAV (כאן, AAV9-CaMKIIα0.4-eGFP) על ידי דילול תמהיל AAV המניה (כאן, AAVs בתמיסה של תמיסת מלח חוצצת פוספט המכילה פעילי שטח לא יוניים [0.001%]) עם תמיסת מלח סטרילית כדי להשיג את הטיטר הנגיפי הרצוי (בדרך כלל 1012-13 עותקים גנום [GC]/mL) ואת הנפח הנדרש עבור מספר העכברים שיש לטפל.
הערה: נפח מוזרק של 1 μL לכל אזור קליפת המוח לכל עכבר דורש הכנה של 2 μL. - תקן מזרק אחד של 10 μL למשאבת מזרק ומלא אותו במים מזוקקים.
- מלא צינור PE50 אחד באורך של כ -60 ס"מ במים מזוקקים באמצעות מזרק 1 מ"ל ומחט 21 G. חשוב לציין, להשאיר את מחט 21G ומזרק במקום לאחר המילוי. חבר את צינור PE50 עם משאבת המזרק; להשאיר את המחט 21 G / מזרק בקצה אחד של צינור PE50, ולחבר את הקצה השני למזרק 10 μL.
- לאחר הצינור קבוע מזרק 10 μL, להסיר את המחט בקצה השני, ולדחוף את הבוכנה של מזרק 10 μL כדי למלא את הפער שנותר על ידי המחט עם מים.
הערה: ודא שאין בועת אוויר, וכי הצינור מלא לחלוטין במים. - התקן צינורית 28 גרם בסוף הצינור שבו המחט הוסרה. לדחוף מים לתוך הצינורית עם מזרק 10 μL כדי למלא אותו לחלוטין. תקן את הצינורית בחוזקה לזרוע הסטריאוטקסית.
- הכן את המבחן AAV (כאן, AAV9-CaMKIIα0.4-cofilinS3D-HA) ו/או השליטה AAV (כאן, AAV9-CaMKIIα0.4-eGFP) על ידי דילול תמהיל AAV המניה (כאן, AAVs בתמיסה של תמיסת מלח חוצצת פוספט המכילה פעילי שטח לא יוניים [0.001%]) עם תמיסת מלח סטרילית כדי להשיג את הטיטר הנגיפי הרצוי (בדרך כלל 1012-13 עותקים גנום [GC]/mL) ואת הנפח הנדרש עבור מספר העכברים שיש לטפל.
- הכנת בעלי חיים
הערה: עכברים זכרים ונקבות C57BL6 / J של ~ 12 שבועות הותאמו בעבר לפחות שבועיים לדיור בכלובים בודדים ולמעגל כהה 12 שעות: 12 שעות עם מזון ומים ad libitum וגישה לקוביית עץ.- בזהירות לשקול את העכברים, ולהזריק תוך אלפיות תערובת של קטמין / קסילאצין (120/10 מ"ג/ק"ג) להרדמה. המתן כ-10 דקות להרדמה עמוקה.
- לגלח את השיער מהחלק האחורי של האוזניים לחזית הראש בין העיניים באמצעות גוזם שיער.
הערה: היזהר מאוד לא לחתוך את השפם (להגן על השפם עם אצבע במהלך הגילוח) כמו חיתוך שפם ישנה תשומות חושיות ופעילות ECoG35,36. - הוסיפו טיפה נדיבה של משחה עיניים על כל עין כדי למנוע התייבשות. לאמת את עומק ההרדמה באופן קבוע במהלך ההליך על ידי צביטת בוהן מהכוו"ח האחורית. ספק לעכבר איזופלוראן 0.5-1.5% כדי להבטיח הרדמה עמוקה אם מופיע רפלקס צביטת בוהן.
2. הזרקת AAV תוך-קורקטית עם משאבת מזרק
הערה: בצע את כל השלבים הבאים עם מכשירים מעוקרים ובסביבה נקייה. השתמש 70% אתנול כדי לשטוף עוד יותר מכשירים מעוקרים ולשטוף אלקטרודות שהוכנו בסעיף 1.1, כמו גם ברגי עוגן (ברגים שאינם מצופים בזהב) לפני תחילת הניתוח.
- תקן בזהירות את ראש העכבר על המנגנון הסטריאוטקסי עם מוטות אוזניים.
הערה: ודא שהראש אינו זז לרוחב. - מוציא בעדינות את לשונו של החיה מהפה כדי למנוע חנק, ותקן את האף של העכבר באמצעות המתאם הסטריאוטקסי.
הערה: לפקח על הנשימה לעתים קרובות במהלך ההליך. - לחטא את האזור המגולח של הראש עם 70% אתנול ועל ידי החזקת העור עם מלקחיים Graefe עדין נוסף, לחתוך את העור מבסיס האוזניים לרמה של העיניים עם מספריים רקמה. השתמשו בארבעה מלחציים כירורגיים כדי למתוח את העור ולחשוף את הגולגולת (שניים בכל צד של החתך; ראו איור 1D).
- לגרד את פני הגולגולת עם קצה מספריים חד: תוך הימנעות תפרי עצם, להסיר את periosteum וליצור פסים חופפים בשני כיוונים או יותר. הסר את שברי העצם, ולייבש את הגולגולת עם 70% אתנול.
הערה: השריטות והפסים יעזרו להפוך את מונטאז ההקלטה לחזק יותר על ידי שיפור הדבקות של הבטון בגולגולת (ראה להלן). - עם הצינורית קבוע לזרוע סטריאוטקסית, לזהות את המיקום של bregma (כלומר, הצומת בין הגולגולת קורונל ותפרים קשתיים; איור 1D) ומבדה (כלומר, הצומת בין תפל סגיטלי הגולגולת לקו ישר המחבר את התבל השמאלי והיני; איור 1D), ושימו לב לקואורדינטות הסטריאוטקסיות של כל אחד מהם. אם ההבדל בין קואורדינטות z (ציר אנכי) של ברגמה למבדה גדול מ-0.3 מ"מ, התאם את גובה האף באמצעות המתאם הסטריאוטקסי עד למיקום z של ברגמה ומבדה מיושרים.
- סמן את המיקום של הצינורית על הגולגולת עם עט בקואורדינטות אלה (קליפת המוח המוטורית): 1.5 מ"מ לרוחב מימין לקו האמצע ו 1.5 מ"מ הקדמי ברגמה. בזהירות לנקב את הגולגולת במיקום של הצינורית עם מקדחה 0.7 מ"מ בכיוון מאונך אל פני הגולגולת (מיושר עם הציר האנכי). לשטוף את הגולגולת פירסינג עם קצה כותנה סטרילי ספוג עם 10% לספק פתרון יוד.
- לטעון את הצינורית עם בועת אוויר 1 μL על ידי משיכת בוכנה מזרק 10 μL בחזרה על ידי 1 μL. לטעון את הבדיקה AAV (כאן AAV9-CaMKIIα0.4-CofilinS3D-HA) או את השליטה AAV (כאן AAV9-CaMKIIα0.4-eGFP) לתוך הצינורית שנטענה בעבר עם בועת האוויר: לערבב את AAV על ידי צנרת איטית למעלה ולמטה, pipet 1.7 μL על צלחת פטרי סטרילית, ולשאוף 1.5 μL של הפתרון בצינורית על ידי משיכה איטית הבוכנה של מזרק 10 μL. לסמן את המיקום של בועת האוויר על צינור PE50 כדי לאפשר מעקב של הזריקה.
- יישר את הצינורית עם החור על הגולגולת למיקום האנכי של הצינורית כדי להגיע לקצה העליון של הגולגולת (כלומר, משטח הגולגולת). מפני השטח של הגולגולת, להוריד לאט את הצינורית על ידי 1.5 מ"מ (כדי להגיע 1.5 מ"מ מתחת לפני השטח הגולגולת שכבה V של קליפת המוח המוטורית).
הערה: היזהר מאוד לא להוריד את הצינורית יותר מדי כדי למנוע נגע מיותר של רקמת המוח. - התחל את משאבת המזרק כדי להזריק 1 μL של AAV במהלך 40 דקות (מהירות: 0.025 μL / min כדי למזער את הנזק לרקמות). עקוב אחר ההזרקה בצינור PE50 עם התנועה של בועת האוויר, ולבצע התאמות במידת הצורך.
- לאחר השלמת ההזרקה, להשאיר את הצינורית במקום במשך 5 דקות כדי להבטיח דיפוזיה מספקת ולמנוע זרימה בחזרה. לאחר מכן, לאט ובזהירות להרים את הזרוע סטריאוטקסית כדי להסיר את הצינורית מקליפת המוח.
3. השתלת אלקטרודה ECoG/EMG
- באמצעות מלקחיים קלי ישרים, לאט לאט בורג אלקטרודה ECoG אחת (עם חוט זהב ישר) בציר האנכי (אותה זווית כי החור היה פירסינג) בחור שבו AAV הוזרק. השאר לפחות 2.5 מ"מ של הבורג מתוך הגולגולת כדי למזער את הנזק dura ו קליפת המוח (כלומר, עבור עומק משוער של 1.1 מ"מ מפני הגולגולת; איור 1D).
- סמן את המיקום של אלקטרודת ECoG האחורית ואת אלקטרודת הייחוס על הגולגולת עם עט בקואורדינטות אלה: אלקטרודה אחורית (קליפת המוח החזותית) 1.5 מ"מ לרוחב ישר לאמצע קו ו 1.5 מ"מ הקדמי למבדה, אלקטרודה התייחסות (קליפת המוח הסומטו-סנסורית) 2.6 מ"מ לרוחב ישר לאמצע ו 0.7 מ"מ אחורי ברגמה. כמו כן, לסמן את המיקום של שלושה ברגי תחזוקה (מתנהג כעוגנים בין הגולגולת ומלט שיניים כדי לחזק את מונטאז 'הראש) על חצי הכדור השמאלי ללא קואורדינטות ספציפיות, אבל רחוק ככל האפשר אחד מהשני ואלקטרודות ECoG.
- בזהירות לנקב את הגולגולת במיקום המסומן של האלקטרודות האחרות ברגי עוגן עם מקדחה 0.7 מ"מ. פירס בכיוון מאונך למשטח הגולגולת עבור כל בורג (כלומר, ציר אנכי עבור האלקטרודה האחורית אך עם זווית מהציר האנכי לאתרים אחרים). לשטוף את הגולגולת פירסינג עם פתרון 10% לספק יוד, ולחסום את החורים עם חתיכות קטנות, מגולגל של מגבי משימה עדינים לפני התקנת הברגים כדי למנוע דימום וזיהום.
- בעזרת מלקחיים קלי ישרים, בורג ברגי התחזוקה בחצי הכדור השמאלי ולאחר מכן בורג שתי האלקטרודות האחרונות בחצי הכדור הימני. הקפידו להתעסק באותה זווית כי החורים נוקבו ולהשאיר לפחות 2.5 מ"מ מכל בורג מחוץ לגולגולת(איור 1D).
הערה: כדי למקסם את המוצקות של המונטאז 'הסופי ואת איכות האותות האלקטרופיזיולוגיים, היזהר לא לגעת בשום בורג בעת התקנת הבא. - מניחים כמה טיפות קטנות של מלט דנטלי במרכז החלל דמוי הטבעת בתוך הברגים. הכנס את הקצה המעוקל של אלקטרודה EMG אחת (מוכן בשלב 1.1.2) כ 1-2 מ"מ בשרירי הצוואר על ידי החזקת הגפיים המעוקלות באמצעות מלקחיים #5 דומונט והרמת העור מעל השרירים עם מלקחיים גראפה עדינים במיוחד. לאחר מכן, מניחים את הצד המעוקל והמרפק של האלקטרודה במלט הדנטלי; חזור על אלקטרודה EMG השני.
הערה: הקצה הישר של אלקטרודה EMG ארוכה יותר צריך להיות מיושר עם אלקטרודה ECoG הקדמית וזה של אלקטרודה EMG קצרה יותר עם אלקטרודה ECoG האחורית. ודא ששתי האלקטרודות EMG לא נוגעות זו בזו או באף אחד מהברגים. - לכסות את העיניים של העכברים, ולהחיל אור במשך 3-5 דקות כדי לעזור התגבשות מלט. לאחר אלקטרודות EMG מחזיקים בחוזקה, לכסות את הבסיס של אלקטרודות ECoG ואת הבסיס של ברגי עוגן עם מלט שיניים כדי ליצור קווי המתאר בצורת כתר. לכסות את העיניים של העכברים, ולהחיל אור במשך 3-5 דקות כדי לעזור התגבשות מלט.
הערה: אין למרוח מלט על הגפיים האלקטרודה ECoG ו- EMG (חוט זהב שיולחם למחבר) או על העור. - ממלאים את מרכז המונטאז' במלט אקריליק מעורב בעבר. במהלך התגבשות המלט, להסיר את ארבעת מלחציים כירורגיים מחזיק את העור (ולשטוף אותם מיד עם מגבי משימה עדינים).
הערה: אין למרוח מלט על הגפיים האלקטרודה ECoG ו- EMG (חוט זהב שיולחם למחבר) או על העור. - לתבל את העור בחלק האחורי ואת החלק הקדמי של מונטאז ', כך הגולגולת לא חשוף (אבל להימנע מתיחה העור יותר מדי) באמצעות מחט תפר (13 מ"מ 3/8 c) ו monofilament סינתטי נספג.
- החזק את המחבר מעל המונטאז' עם מלקחיים מעוקלים, ויישר בזהירות את חוט הזהב של האלקטרודות עם סיכות המחבר. הגפיים האלקטרודה הלחמה לפיני מחבר עם ברזל הלחמה.
הערה: יש להמשיך במהירות כדי להימנע מהתחממות יתר ונזק לרקמת קליפת המוח. ודא כי כל אלקטרודה יוצרת קשר טוב עם סיכת המחבר המתאים, וכי האלקטרודות אינן מחוברות זו לזו. - הסר את העכבר מהמסגרת הסטריאוטקסית. לכסות את החלל הריק בין המחבר לבין הראש עם מלט אקרילי מעורב בעבר על ידי כיסוי כל החיבורים בין אלקטרודות וסיכות מחבר.
הערה: הימנע חדירת מלט בתוך המחבר על ידי החזקת העכבר עם המחבר מעל הראש (הראש ישר לא נוטה). - שקול את העכבר ומניח אותו בכלוב נקי (רצוי מצויד במכסה שאינו רשת) על כרית חום (דיור אישי כדי למנוע נזק למונטאז 'הראש). לפקח על החיה באופן קבוע, ולנהל 0.1 מ"ג / קילוגרם של buprenorphine תת עורית עם התעוררות, ו 12 שעות מאוחר יותר אם החיה מראה סימנים של כאב (למשל, יציבה חריגה, עיניים מפוסזלות).
הערה: עלייה במשקל ביחס למשקל טרום הניתוח לא יעלה על 1.5 גרם.
4. הקלטות
- עכברי בית בנפרד כדי למנוע נזק למונטאז 'הראש כתוצאה של טיפוח הדדי, כמו גם נזק והסתבכות של כבלי ההקלטה.
הערה: לפרוטוקול זה שוכנו עכברים עם גישה למזון, מים וקוביית עץ, ונערך ניטור יומי. - חבר את העכברים להקלטת כבלים שבועיים לאחר הניתוח להסתגלות לתנאי כבלים.
- הקלט אותות ECoG/EMG למשך 24 שעות (או ארוך/קצר יותר בהתאם לשאלות מחקר).
הערה: הקלטת אותות ECoG/EMG הושגה באמצעות כבל, מחבר מסתובב (כדי לאפשר סיבוב של הכבל), תיבה לבישה בת 36 ערוצים ומגבר, שהיה מחובר למחשב. אותות נדגמים ב- 256 הרץ (או יותר בהתאם לשאלות מחקר) ומוקלטים בתוכנה מסחרית (ראה טבלת החומרים). כדי להבטיח ביטוי ויראלי מספיק, ניסויים צריכים להיעשות לפחות 3 שבועות לאחר הזרקת AAV, כפי שתואר בעבר29,37. - לאחר ההקלטה, להקריב את העכברים על ידי נקע צוואר הרחם (או שיטות אחרות בהתאם לפרוטוקול החיסוני), לקצור את המוח עבור חיסון.
תוצאות
לאחר הקלטות אלקטרופיזיולוגיות, אימונופלואורסצנטיות משמשת להגדרת האזור הנגוע בהזרקת AAV ולאימות הביטוי של cofilinS3D (איור 2). חיסונים יכולים להתבצע באמצעות מתודולוגיה דומה למה שתואר בעבר29,37,38,39. AAV מבטא צורה לא פעילה של cofilin התמזג עם hemagglutinin (HA)-תג (cofilinS3D-HA), אשר מזוהה על ידי אימונופלואורסצנטיות באמצעות נוגדן אנטי HA ונוגדן משני (אלכסה פלור 488). נוירוני העירור הנגועים (כאן, ממוקדים עם חלבון תלוי סידן / calmodulin תלוי קינאז II אלפא [CamKIIα] מקדם השולט הביטוי של transgene הכלול AAV) מוכתמים בנוגדן נגד HA. זיהום מוצלח מסומן על ידי הכתמת הנוירונים בקליפת המוח המוטורית המקיפה את אתר ההזרקה (איור 2A,B). בדוגמה מייצגת זו, קליפת המוח של חצי הכדור האחר לא הראתה כתמים בולטים. עם זאת, בהתחשב בכך נוירונים מעוררים יכולים להקרין לאזורי מוח רחוקים, כתמים בחצי הכדור הנגדי אינו בהכרח אינדיקציה להזרקה לא מוצלחת. הגדלה גבוהה יותר של האזור הנגוע הראתה כתמים של גופי תאים ותחזיות, המאשר כי רק תאים ספציפיים של אזור קליפת המוח הממוקדת נדבקו (איור 2C).
כתמים משותפים עם סמנים של נוירונים מעוררים (למשל, משגר גלוטמט ריסקול 1, CaMKIIα) יכולים להתבצע גם כדי לאמת את הספציפיות לסוג התא. לחלופין, כתמים משותפים עם סמנים של נוירונים מעכבים או אסטרוציטים יכול להתבצע במקרה תאים אלה ממוקדים באמצעות מקדמים שונים. כתמים משותפים של cofilinS3D-HA ו- CaMKIIα בוצעו גם באותה חיה עבור אזור אחורי יותר לאתר ההזרקה שעדיין הראה כתמים נגד HA בקליפת המוח המוטורית (איור 2D). תמונת ההגדלה הגבוהה יותר של האזור מציגה תאים המבטאים בבירור קופיליןS3D-HA (אלכסה פלור 488, איור 2E)ו- CaMKIIα (Alexa Fluor 568, איור 2F). הסופרפוזיציה של cofilinS3D-HA ו- CaMKIIα מכתים מגלה כי רוב (אם לא כולם) תאים מוכתמים עבור cofilinS3D-HA הם גם חיוביים עבור CaMKIIα (איור 2G). תצפית זו תומכת הספציפיות של הזיהום עבור נוירונים מעוררים.
כדי להעריך את ההשפעה של מניפולציה cofilin על פעילות ECoG, אותות ECoG ו- EMG משמשים לביצוע זיהוי חזותי של מצבי דריכות (ערנות, שנת גל איטית, שינה פרדוקסלית). זה נעשה על 4-s תקופות בגלל השינוי המהיר במצב ערנות בעכבר2, וכאן, להקלטה מלאה 24 שעות ביממה. ניתוחים סטנדרטיים כוללים חישוב של ארכיטקטורת שינה ומשתני ניתוח ספקטרליים, כפי שנערך בעבר עבור ערכות נתונים שונות11,12,13,28,34. בפרט, ניתוח ספקטרלי של אות ECoG של המדינות השונות יהיה אינדקס הרכב ומצב ואיכות. כדי להסיר הבדלים שעלולים להתעורר, למשל, ממעמקים שונים של האלקטרודות, נתוני ניתוח ספקטרליים יכולים לבוא לידי ביטוי ביחס לכוח הכולל של כל המצבים של בעל חיים נתון (איור 3A). בהתחשב משרעת יחסית נמוכה מאוד של פעילות ECoG בתדרים גבוהים יותר, ספקטרום כוח יחסי עבור ערנות, שנת גל איטית, ושינה פרדוקסלית הפכו יומן כדי לדמיין כראוי יותר בו זמנית להשוות את הפעילות בתדרים נמוכים וגבוהים. ניתוח זה מצביע על הבדלים ספציפיים למצב בפעילות הספקטרלית בתנאים של אי-פעילות קופילין(איור 3B). ליתר דיוק, ממצאים ראשוניים אלה המשלבים עכברים זכרים ונקבות מצביעים על כך שהפעלת cofilin מגבירה באופן משמעותי את כוח הספקטרלי בתדרים מהירים (14-30 הרץ) במהלך ערנות ובתדרים איטיים (1-4 הרץ) במהלך שינה פרדוקסלית, תוך השארת פעילות ECoG במהלך שינה בגל איטי בעיקר לא מושפעת. בנוסף, נראה כי אי-פעילות cofilin מגבירה את השונות בין העכברים בפעילות ECoG (בולטת במיוחד מפסי שגיאה לערות באיור 3B).
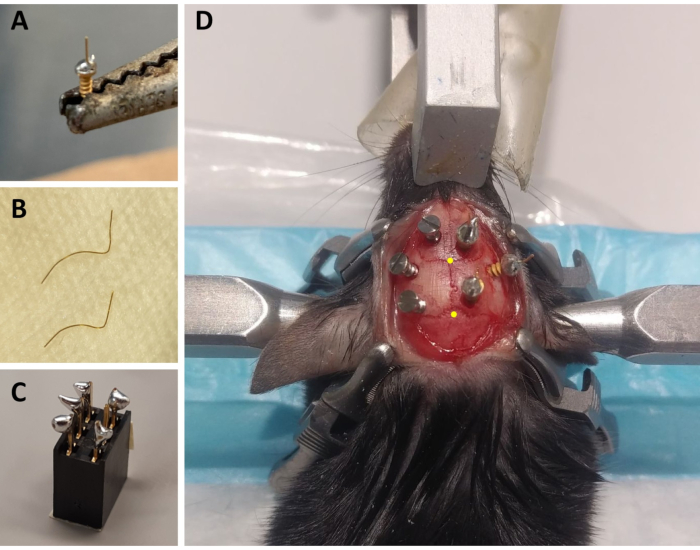
איור 1: הכנת רכיבי מונטאז' ECoG/EMG ודוגמה מייצגת למיקום אלקטרודה ECoG. (A)אלקטרודה ECoG: חוט זהב באורך 4 מ"מ, בקוטר 0.2 מ"מ (לא מבודד) מותך על ראשו של בורג מצופה זהב (קוטר ראש 1.9 מ"מ, קוטר ראשי של חוט 1.14 מ"מ, אורך כולל של 3.6 מ"מ) באמצעות הלחמה ללא עופרת. (B)אלקטרודות EMG: שני חוטי זהב (1.5 ו -2 ס"מ) מעוקלים כדי לאמץ את עקומת הגולגולת עד לשריר הצוואר, והקצה השני נשמר ישר כדי להיות מולחם למחבר. (C)מחבר 6 ערוצים: הלחמה ללא עופרת מתווספת ל -5 מתוך 6 סיכות המתכת (השמטת אחד באמצע) של המחבר (5 מ"מ x 8 מ"מ x 8 מ"מ + פיני מתכת 3 מ"מ). החלק העליון של המחבר מכוסה בסרט כדי למנוע חדירת פסולת / מים. (D)דוגמה למיקום שלושת ברגי התחזוקה על הגולגולת של האונה השמאלית ושל שלוש אלקטרודות ECoG (כולל אלקטרודה ייחוס) בחצי הכדור הימני. הקואורדינטות הסטראוטקסיות המדויקות של אלקטרודות ECoG מסומנות בשלבים 2.6 ו -3.2 ומחושבות לפי מיקום ברגמה ומבדה (המצוינות על ידי הנקודות הצהובות). קיצורים: ECoG = אלקטרוקורטיקוגרפיה; EMG = אלקטרומיוגרפיה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
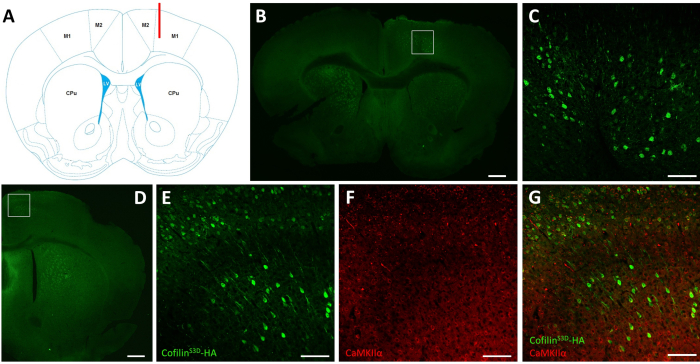
איור 2: חיסון מייצג להגדרת האזור וסוג התא הנגועים ב-AAV. (A)ייצוג סכמטי המציג את אתר ההזרקה של הפרוסה קורונלית המוצגת בלוח ב '. המיקום הוא 1.1 מ"מ הקדמי ברגמה, ואת הצינורית (מוצג באדום) היה ממוקד שכבות V של קליפת המוח המוטורית העיקרית הימנית (M1). ייצוג שונה מפרנקלין ופקסינוס40. (B)חיסונים של HA כדי לזהות cofilinS3D- ביטוי HA נוירונים המוצגים עבור פרוסה קורונל של המוח המלא הממוקם כ 1.1 מ"מ קהורית ברגמה. האזור הנגוע ממקם בעיקר לשכבות V ו- VI (שכבות אינפרא-גרנליות) של קליפות המוח המוטוריות העיקריות והמשניות הימניות (M1 ו- M2). סרגל קנה מידה = 500 מיקרומטר. הכיכר מייצגת את האזור המוצג ב- C. (C) הגדלה גבוהה יותר של האזור הנגוע המציג כתמים של תאים נגועים ומאשרת ביטוי של cofilinS3D-HA בשכבות עמוקות יותר של קליפת המוח המוטורית. סרגל קנה מידה = 100 מיקרומטר. (D)חיסון משותף של HA ו- CaMKIIα כדי להעריך את הספציפיות של סוג התא המוצג עבור פרוסה קורונית של חצי הכדור הימני הממוקם כ 0.5 מ"מ הקדמי ברגמה ולכן, אחורי לאתר ההזרקה (אותו עכבר כמו בלוחות B ו- C). האזור הנגוע לוקליזציה לקורטיפים מוטוריים (M1 ובעיקר M2). סרגל קנה מידה = 500 מיקרומטר. הכיכר מייצגת את האזור המוצג ב- E, F ו- G. (E) הגדלה גבוהה יותר של האזור הנגוע המציג כתמים של תאים נגועים ומאשרת ביטוי של cofilinS3D-HA. סרגל קנה מידה = 100 מיקרומטר. (F)הגדלה גבוהה יותר של האזור הנגוע מראה כתמים של תאים חיוביים CaMKIIα. סרגל קנה מידה = 100 מיקרומטר. (G) הגדלה גבוהה יותר של האזור הנגוע המציג תיוג משותף של cofilinS3D-HA ו- CaMKIIα, המאשר כי תאים נגועים הם CaMKIIα חיובי. סרגל קנה מידה = 100 מיקרומטר. קיצורים: AAV = וירוס הקשורים אדנו; M1 = קליפת המוח המוטורית העיקרית; M2 = קליפת המוח המוטורית המשנית; CPu = caudate putamen (סטריאטום); LV = חדר לרוחב; HA = המגלוטין; CamKIIα = סידן/קלמודולין תלוי חלבון קינאז II אלפא. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
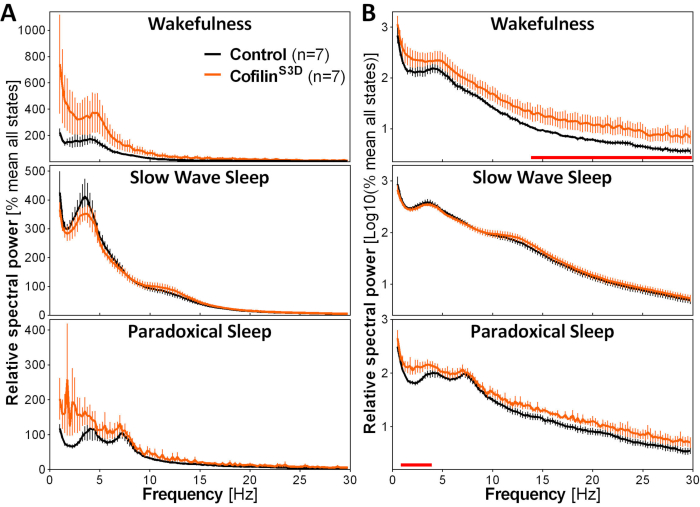
איור 3: ספקטרום כוח מייצג לערות, שנת גל איטית ושינה פרדוקסלית המתקבלת לאחר מניפולציה ויראלית של תפקוד הקופילין. זכר (n = 5 לכל קבוצה) ונקבה (n = 2 לכל קבוצה) עכברים מוזרקים עם AAV9-CaMKIIα0.4-cofilinS3D-HA (טיטר ויראלי 2.58 × 1013 GC / mL) או עם AAV שליטה (AAV9-CaMKIIα0.4-eGFP 1.25 × 1013 GC / mL; חצי של titer הבדיקה כדי לשלוט עבור האות המשופר של AAV שליטה זו) בשכבה V של קליפת המוח המוטורית נרשמו עבור 24 שעות, והאות האלקטרוקורטיקוגרפי היה נתון לניתוח ספקטרלי (מהר פורייה Transform לחישוב כוח ספקטרלי בין 0.5 ל-30 הרץ ברזולוציה של 0.25 הרץ). (א)ספקטרום הכוח במהלך שלוש מדינות הדריכות שבאה לידי ביטוי ביחס לכוח הכולל של כל המדינות. (B)ספקטרום הספקטרום היחסי השתנה לייצוג הולם יותר של הבדלי קבוצות בתדרים גבוהים יותר. דיכוי פעילות cofilin בקליפת המוח המוטורית באמצעות AAV9-CaMKIIα0.4-cofilinS3D-HA מגביר באופן משמעותי את הפעילות האלקטרוקורטיקוגרפית בטווח הבטא (14-30 הרץ) במהלך ערנות, ובטווח הדלתא (1-4 הרץ) במהלך שינה פרדוקסלית בהשוואה להזרקות בקרה (קווים אדומים מעל x צירים מצביעים על מאן-ויטני U- מבחן על כוח רצועת תדר p < 0.05). קיצורים: AAV = וירוס הקשורים אדנו GC = עותקי גנום; HA = המגלוטין; CamKIIα = סידן/קלמודולין תלוי חלבון קינאז II אלפא; eGFP = חלבון פלואורסצנטי ירוק משופר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר שיטה מדויקת ופשוטה לניטור פעילות ECoG ו- EMG במהלך מניפולציה של מטרות מולקולריות באמצעות AAVs. לשם השוואה מספקת בין קבוצות, מומלץ מאוד לתכנן תמיד הליכים כירורגיים (הזרקת AAV והשתלת אלקטרודה) באותו יום עבור חיות בדיקה ובקרה, ולתעד את האותות האלקטרופיזיולוגיים שלהם בו זמנית. כדי להשיג ביטוי ויראלי דומה בין בעלי החיים בדיקה ושליטה, הזרקת אותו טיטר ויראלי רצוי. במקרה הנוכחי, טיטר ויראלי של שליטה AAV צומצם למחצית הבדיקה AAV כדי להבטיח ביטוי ויראלי דומה. הנסיינים צריכים להיות זהירים מאוד עם מדידות של קואורדינטות סטריאוטקזמיות כדי להבטיח שונות נמוכה בין בעלי חיים באזור המוח / פילוח שכבה קליפת המוח. בנוסף, בהתחשב בכך שעומק ההזרקה מחושב מפני השטח של הגולגולת, וכי עובי הגולגולת משתנה בהתאם לגיל ולמין, יש תמיד לאמת את מיקום הצינורית באמצעות היסטולוגיה פוסט-פרוטוקולית או אימונוהיסטוכימיה (למשל, איור 2) כדי להבטיח מיקום נאות / עומק הזרקה, ויש להתאים את הקואורדינטות הסטריאוטקזיות במידת הצורך. במהלך הזרקת AAV של 40 דקות, חשוב מאוד לעקוב אחר מהירות ההזרקה כדי לזהות ולתקן במהירות בעיות פוטנציאליות כגון חסימת משאבה. כמה צעדים ניסיוניים חיוניים גם כדי להשיג אותות אלקטרופיזיולוגיים אופטימליים. לדוגמה, לא לצווח יתר במהלך השתלת אלקטרודה; ברגים צריכים לבלוט מתוך הגולגולת על ידי לפחות 2.5 מ"מ כדי למזער את הנזק קליפת המוח ואת היווצרות של צלקת גליה. לאחר מכן, זה גם מאוד חשוב i) להימנע החלת מלט על הגפיים של האלקטרודות, ii) להבטיח הלחמה מהירה של האלקטרודות למחבר, ו- iii) לוודא כי אין מגע בין האלקטרודות.
ההליך המוצג כאן להקלטת ECoG ו- EMG מבוסס היטב, פשוט, בשימוש נרחב לניטור ערנות ושינה בעכברים2,11,13,34. הקלטות רציפות של ECoG ו- EMG יכולות להתבצע במשך מספר ימים רצופים (ואפילו שבועות) וליצור ערכת נתונים עשירה מאוד שניתן להשתמש בה כדי לבצע מספר שורות של ניתוח הכוללות משתנים הקשורים להתעוררות וכמות שינה וארכיטקטורה2,11,12 (למשל, זמן שהושקע במצבים שונים לכל תקופות אור וחושך, מספר פרקים של כל מדינה, התפלגות של שינה של 24 שעות), ערנות ותוכן ספקטרלי לשינה34,41 (למשל, כוח ברצועות תדרים שונות [בדומה לאיור 3], פעילות ללא קנה מידה), ומאפיינים של גלים בודדים42,43,44 (למשל, משרעת גל איטי ושיפוע). כאשר נעשה שימוש בשילוב עם מניפולציות מולקולריות בתיווך AAV, יתרון נוסף הוא הימנעות של פיצוי התפתחותי פוטנציאלי שיכול להתרחש בבעלי חיים מהונדסים. עם תרגול, ההליך כולו, כולל הזרקת AAV 40 דקות, יכול להתבצע בכ 90 דקות. שיעור התמותה צריך להיות (מאוד) נמוך כמו הניתוח הוא זעיר פולשני.
השימוש בו זמנית בהקלטת ECoG/EMG ומניפולציה ממוקדת עם AAV מציע מגוון יתרונות ויישומים אחרים. לדוגמה, הדיוק של פילוח סטריאוטקסי, כאשר מבוצע כראוי, הוא גבוה מאוד וניתן לשכפול והוא שימושי כדי לקבוע את התפקיד הספציפי של אזור מוח נתון (ו / או סוג תא או אלמנט מולקולרי בתוך האזור) בוויסות השינה או תהליכים פיזיולוגיים אחרים. לפיכך, ניתן למקד בקלות מספר אזורים קליפתיים באמצעות התאמות של הפרוטוקול הנוכחי. יתר על כן, מניפולציות יעד באמצעות AAVs יכול להיות מופנה לאזור קליפת המוח / subcortical שונה מאתרי ההקלטה ECoG. במקרים כאלה, חור בר להזרקת AAV יכול להיות מכוסה על ידי כיסוי זכוכית קטן קבוע באמצעות מלט שיניים (או שעוות עצם). עבור ספציפיות משופרת, בניית AAV כוללת לעתים קרובות מקדם המאפשר זיהום ממוקד של סוג תא מדויק14. מקדם CamKIIα שימש בפרוטוקול הנוכחי במיוחד למקד במיוחד תאים פירמידלייםמעוררים 14,29,45של קליפת המוח המוטורית. אסטרטגיה זו אפשרה את ההנטרלה של cofilin (באמצעות cofilinS3D)32,33 בנוירונים מעוררים של קליפת המוח המוטורית והתבוננות בשינויים ספציפיים למצב בפעילות ECoG ( איור3). כדי להעריך את יעילות הזיהום/טרנסדוקציה, משתמשי פרוטוקול עתידיים יכולים לשלב את פרוטוקול AAV-ECoG שהוצג עם אחד של כתמים משותפים על ידי immunofluorescence, ולהשתמש בתמונות הגדלה גבוהה כדי לחשב את מספר התאים המציגים תיוג כפול מתוך המספר הכולל של תאים המציגים תיוג יחיד של היעד (כאן, נוירונים מבטאים CaMKIIα). במחקר שנערך לאחרונה, שיטת AAV-ECoG דומה לזו המתוארת כאן שימשה לביטוי יתר של חלבון שברירי X הקשור לתסמונת פיגור שכלי 1 (FXR1) בכל הנוירונים של קליפת המוח המוטורית באמצעות AAV המכיל מקדם סינפסין וחשף השפעה של מניפולציה זו על הפצת מצב ערנות ותוכן ספקטרלי28. ממצאים אלה ממחישים כיצד מניפולציה של מולקולה נתונה באזור מוח היעד באמצעות AAVs יכולה לחשוף תפקידים בוויסות של פרמטרים ספציפיים של ערנות/שינה.
מגבלה של הפרוטוקול המתואר היא הנגע הקטן של רקמת המוח המתרחשת עם מיקום צינורית לפני ביצוע הזרקת AAV, אשר יכול להיות מלווה גם בתגובה דלקתית. זה יכול להיות דאגה מיוחדת בעת ביצוע הזרקת AAV באזורים subcortical ותמיד צריך להיות מטופל באמצעות פקדים נאותים. לחלופין, הפרוטוקול הנוכחי יכול להיות מלווה בכימות של גליוזיס תגובתי ו / או של הפעלה microglial (למשל, באמצעות immunofluorescence) כדי להבטיח רמות דומות בקבוצות בקרה ובדיקה ולכן, על קריאת ECoG. מגבלה שנייה מתייחסת לסיכון של חיבור רע בין אלקטרודה למחבר, אשר עלול לגרום לאות אלקטרופיזיולוגי רע ברציפות או מדי פעם רע. אלקטרודות מוברגות, מולחימות ובמלט מוצקות ימזערו את שכיחותה של בעיה זו. מגבלה שלישית קשורה לבעלי חיים שנקשרים דרך מונטאז' הראש במהלך ההקלטה, מה שעלול להגביל את הקטר והתנהגויות אחרות, לפחות במידה מסוימת, ולעיתים לגרום לנזק לכבלים ולאובדן אותות. לבסוף, הפרוטוקול המוצג מתאים יותר לעכברים בוגרים, בהתחשב בכך שגודל הגולגולת של בעלי חיים צעירים עלול לגרום לקשיים בהתקנת מונטאז 'הראש המתואר, כפי שתואר קודם לכן2.
הקלטה משולבת של ECoG/EMG ומניפולציה בתיווך AAV של מטרה מדויקת חלה גם על תחומי מחקר שאינם מדעי המוח של השינה. בין היתר, זה יכול לשמש כדי ללמוד ולתפעל אירועים אפילפטיים במודלים בעלי חיים של התקף והוא כלי רב עוצמה כדי לווסת תנודות המוח המעורבות קידוד זיכרון ואיחוד46,47. בהתאם, יישומים פוטנציאליים בהחלט מקיפים את תחומי המחקר הבסיסי בפסיכיאטריה ונוירולוגיה, כולל מחלות ניווניות. בנוסף ליכולת לבטא צורה לא פעילה של מולקולה, AAVs יכול לשמש כדי להגזים או downregulate (למשל, RNA קטן מפריע, CRISPR / Cas9) או כדי להציל את הביטוי של מולקולה ב KO גוף מלא. חשוב לציין, המתודולוגיה הכפולה של הפרוטוקול הנוכחי חלה גם על מינים יונקים אחרים כגון חולדות ומכרסמים יומיים המייצגים מודלים מעניינים כדי להבין הן שינה נוירודגנרציה48,49.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
העבודה מומנה על ידי יו"ר המחקר הקנדי בפיזיולוגיה מולקולרית של שינה. המחברים מודים לקלואה פרובוסט ולקרוליין בושארד על העזרה הטכנית.
Materials
| Name | Company | Catalog Number | Comments |
| Surgery peparation | |||
| 21 G needle | Terumo | NN-2125R | |
| 6-channel connector | ENA AG | BPHF2-O6S-E-3.2 | Connector used in this manuscript, but discontinued. See potential replacement below |
| Distrelec | 300-93-672 | Potential replacement for discontinued connector above | |
| C57BL6/J mice | Jackson Laboratory | 000664 | B6 | Animals bred on site |
| Pluronic F-68 | Non-ionic surfactant | ||
| Gold wire 0.2 mm diameter | Delta scientific | 920-862-41 | Non-insulated |
| Hamilton syringe (10 μL) | Fisher Scientific | 14815279 | |
| Infusion syringe Pump CMA 402 | Harvard Apparatus | CMA8003110 | |
| Injection cannula 28 G | Plastics one | C313l-SPCL | |
| Isoflurane | Baxter | CA2L9100 | |
| Ketamine (10 mg/mL) | SANDOZ | 4550 | |
| Lead-free solder | AIM | SN100C | |
| Lubricating ophthalmic ointment | ALLERGAN | 210889 | |
| PE 50 Catheter thin wall | Plastics one | C232CT | |
| Flat fillister head self tapping screws | MORRIS | FF00CE125 | ECoG electrode gold covered; Dimension : 1.9 mm head diameter, 1.14 mm thread major diameter, 3.6 mm length |
| Soldering iron | Weller | WES51 | |
| Syringe 1 mL | BD | 309659 | |
| Trimmer | Harvard Apparatus | 72-9063 | |
| Xylazine (20 mg/mL) | Bayer | 2169592 | |
| Intracortical AAV injection with syringe pump | |||
| 0.7 mm drill bit | Dremel | 628 | |
| AAV9-CaMKIIα0.4-cofilinS3D-HA | UPenn Viral Core | ||
| AAV9-CaMKIIα0.4-eGFP | UPenn Viral Core | ||
| Cotton tippped applicators | Medicom | 806 | |
| Drill | Dremel | 8050-N/18 | |
| Extra-fine Graefe forceps | Fine science tools | 11150-10 | |
| Stereotaxic arm | Stoelting | 51604U | |
| Stereotaxic frame | Stoelting | 51600 | |
| Surgical clamps | Fine science tools | 18050-28 | |
| Tissue scissor | Magna Stainless | M4-124 | |
| ECoG/EMG electrode implantation | |||
| Buprenorphine (0.3 mg/mL) | CEVA | 57133-02 | |
| Curved forceps | Fine science tools | 11001-12 | |
| Delicate task wipers | Kimtech | 34120 | |
| Dental acrylic cement | Yates Motloid | 44115 | |
| Dumont #5 forceps | Fine science tools | 91150-20 | |
| Extra fine Graefe forceps | Fine science tools | 11150-10 | |
| Kelly forceps | Fine science tools | 13002-10 | |
| Liquid acrylic | Yates Motloid | 44119 | |
| Monocryl plus suture needle 13 mm 3/8c rev cutting | Ethicon | MCP494 | |
| Providone-iodine 10% | Triad disposables | 10-8208 | |
| RelyX Unicem 2, Adhesive Resin Cement A2 | 3M | 56849 | |
| Immunofluorescence and ECoG recording | |||
| 36-Channel EEG Wearable Headbox | LaMONT Medical | 832-000350 | |
| CaMKII alpha Monoclonal Antibody (Cba-2) | Invitrogen | 13-7300 | Dilution 1:500 |
| Conductors Awg PVC Insulation Cable | Calmont Wire & Cables | HC-0819075R0 | |
| Donkey anti-Mouse IgG secondary Ab, Alexa Fluor 568 | Invitrogen | A10037 | Dilution 1:1000 |
| Goat anti-Rabbit IgG secondary Ab, Alexa Fluor 488 | Invitrogen | A-11008 | Dilution 1:500 |
| HA-Tag (C29F4) Rabbit mAb | Cell signaling | 3724 | Dilution 1:800 |
| Programmable Amplifier | LaMONT Medical | 815-000002-S2 | |
| Stellate Harmonie | Natus | HSYS-REC-LT2 | |
| Swivel connector | Crist Instrument Company Inc. | 4-TBC-9-S |
References
- Campbell, I. G. EEG recording and analysis for sleep research. Current Protocols in Neuroscience. , (2009).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Current Protocols in Mouse Biology. 2 (1), 55-74 (2012).
- Bastien, C. H., et al. Insomnia and sleep misperception. Pathologie Biologie. 62 (5), 241-251 (2014).
- Malafeev, A., et al. Automatic artefact detection in single-channel sleep EEG recordings. Journal of Sleep Research. 28 (2), 12679 (2019).
- Latreille, V., et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease. Brain. 139, 1189-1199 (2016).
- Rodrigues Brazete, J., et al. Electroencephalogram slowing predicts neurodegeneration in rapid eye movement sleep behavior disorder. Neurobiology of Aging. 37, 74-81 (2016).
- Kent, B. A., Strittmatter, S. M., Nygaard, H. B. Sleep and EEG power spectral analysis in three transgenic mouse models of Alzheimer's disease: APP/PS1, 3xTgAD, and Tg2576. Journal of Alzheimers Disease. 64 (4), 1325-1336 (2018).
- Chang, A. M., et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiology International. 33 (5), 561-573 (2016).
- Shi, G., Wu, D., Ptacek, L. J., Fu, Y. H. Human genetics and sleep behavior. Current Opinion in Neurobiology. 44, 43-49 (2017).
- Nakai, Y., et al. Calcineurin and its regulator sra/DSCR1 are essential for sleep in Drosophila. Journal of Neuroscience. 31 (36), 12759-12766 (2011).
- El Helou, J., et al. Neuroligin-1 links neuronal activity to sleep-wake regulation. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9974-9979 (2013).
- Freyburger, M., et al. EphA4 is involved in sleep regulation but not in the electrophysiological response to sleep deprivation. Sleep. 39 (3), 613-624 (2016).
- Seok, B. S., et al. The effect of Neuroligin-2 absence on sleep architecture and electroencephalographic activity in mice. Molecular Brain. 11 (1), 52 (2018).
- Haery, L., et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation. Frontiers in Neuroanatomy. 13, 93 (2019).
- Schmidt, F., Grimm, D. CRISPR genome engineering and viral gene delivery: a case of mutual attraction. Biotechnology Journal. 10 (2), 258-272 (2015).
- Wang, D., Zhang, F., Gao, G. CRISPR-based therapeutic genome editing: strategies and in vivo delivery by AAV vectors. Cell. 181 (1), 136-150 (2020).
- Havekes, R., et al. Transiently increasing cAMP levels selectively in hippocampal excitatory neurons during sleep deprivation prevents memory deficits caused by sleep loss. Journal of Neuroscience. 34 (47), 15715-15721 (2014).
- Fuller, P. M., Yamanaka, A., Lazarus, M. How genetically engineered systems are helping to define, and in some cases redefine, the neurobiological basis of sleep and wake. Temperature. 2 (3), 406-417 (2015).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ono, D., Yamanaka, A. Hypothalamic regulation of the sleep/wake cycle. Neuroscience Research. 118, 74-81 (2017).
- Shiromani, P. J., Peever, J. H. New neuroscience tools that are identifying the sleep-wake circuit. Sleep. 40 (4), 032 (2017).
- Oishi, N., et al. Artificial association of memory events by optogenetic stimulation of hippocampal CA3 cell ensembles. Molecular Brain. 12 (1), 2 (2019).
- Anaclet, C., et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control. Journal of Neuroscience. 38 (22), 5168-5181 (2018).
- Chen, K. S., et al. A hypothalamic switch for REM and non-REM sleep. Neuron. 97 (5), 1168-1176 (2018).
- Torontali, Z. A., Fraigne, J. J., Sanghera, P., Horner, R., Peever, J. The sublaterodorsal tegmental nucleus functions to couple brain state and motor activity during REM sleep and wakefulness. Current Biology. 29 (22), 3803-3813 (2019).
- Rolls, A., et al. Optogenetic disruption of sleep continuity impairs memory consolidation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13305-13310 (2011).
- Ognjanovski, N., Broussard, C., Zochowski, M., Aton, S. J. Hippocampal network oscillations rescue memory consolidation deficits caused by sleep loss. Cerebral Cortex. 28 (10), 3711-3723 (2018).
- Khlghatyan, J., et al. Fxr1 regulates sleep and synaptic homeostasis. EMBO Journal. 39 (21), 103864 (2020).
- Havekes, R., et al. Sleep deprivation causes memory deficits by negatively impacting neuronal connectivity in hippocampal area CA1. Elife. 5, 13424 (2016).
- Wong, L. W., Tann, J. Y., Ibanez, C. F., Sajikumar, S. The p75 neurotrophin receptor is an essential mediator of impairments in hippocampal-dependent associative plasticity and memory induced by sleep deprivation. Journal of Neuroscience. 39 (28), 5452-5465 (2019).
- Mizuno, K. Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular Signalling. 25 (2), 457-469 (2013).
- Nagaoka, R., Abe, H., Obinata, T. Site-directed mutagenesis of the phosphorylation site of cofilin: its role in cofilin-actin interaction and cytoplasmic localization. Cell Motility and the Cytoskeleton. 35 (3), 200-209 (1996).
- Elam, W. A., et al. Phosphomimetic S3D cofilin binds but only weakly severs actin filaments. Journal of Biological Chemistry. 292 (48), 19565-19579 (2017).
- Areal, C. C., Cao, R., Sonenberg, N., Mongrain, V. Wakefulness/sleep architecture and electroencephalographic activity in mice lacking the translational repressor 4E-BP1 or 4E-BP2. Sleep. 43 (2), (2020).
- Vyazovskiy, V., Borbely, A. A., Tobler, I. Unilateral vibrissae stimulation during waking induces interhemispheric EEG asymmetry during subsequent sleep in the rat. Journal of Sleep Research. 9 (4), 367-371 (2000).
- Sitnikova, E. Neonatal sensory deprivation promotes development of absence seizures in adult rats with genetic predisposition to epilepsy. Brain Research. 1377, 109-118 (2011).
- Tudor, J. C., et al. Sleep deprivation impairs memory by attenuating mTORC1-dependent protein synthesis. Science Signaling. 9 (425), 41 (2016).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293 (2015).
- Dufort-Gervais, J., et al. Neuroligin-1 is altered in the hippocampus of Alzheimer's disease patients and mouse models, and modulates the toxicity of amyloid-beta oligomers. Scientific Reports. 10 (1), 6956 (2020).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates, Third edition. , (2007).
- Lina, J. M., O'Callaghan, E. K., Mongrain, V. Scale-free dynamics of the mouse wakefulness and sleep electroencephalogram quantified using Wavelet-Leaders. Clocks & Sleep. 1 (1), 50-64 (2019).
- Massart, R., et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes. Translational Psychiatry. 4, 347 (2014).
- Freyburger, M., Poirier, G., Carrier, J., Mongrain, V. Shorter duration of non-rapid eye movement sleep slow waves in EphA4 knockout mice. Journal of Sleep Research. 26 (5), 539-546 (2017).
- Hubbard, J., et al. Rapid fast-delta decay following prolonged wakefulness marks a phase of wake-inertia in NREM sleep. Nature Communications. 11 (1), 3130 (2020).
- Johansen, J. P., et al. Optical activation of lateral amygdala pyramidal cells instructs associative fear learning. Proceedings of the National Academy of Sciences of the United States of America. 107 (28), 12692-12697 (2010).
- Boyce, R., Glasgow, S. D., Williams, S., Adamantidis, A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science. 352 (6287), 812-816 (2016).
- Bandarabadi, M., et al. Dynamic modulation of theta-gamma coupling during rapid eye movement sleep. Sleep. 42 (12), 182 (2019).
- Estrada, C., et al. Transcranial magnetic stimulation and aging: Effects on spatial learning and memory after sleep deprivation in Octodon degus. Neurobiology of Learning and Memory. 125, 274-281 (2015).
- Hurley, M. J., et al. The long-lived Octodon degus as a rodent drug discovery model for Alzheimer's and other age-related diseases. Pharmacology & Therapeutics. 188, 36-44 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved