Method Article
Elektrokortikographische Aufzeichnung von Großhirnrindenbereichen manipuliert mit einem Adeno-assoziierten Virus, das auf Cofilin bei Mäusen abzielt
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt ein Protokoll zur Manipulation molekularer Ziele in der Großhirnrinde mit adeno-assoziierten Viren und zur Überwachung der Auswirkungen dieser Manipulation während wachen und Schlaf mit elektrokortikographischen Aufzeichnungen.
Zusammenfassung
Der Einsatz elektrokortikographischer (ECoG) Aufnahmen bei Nagetieren ist relevant für die Schlafforschung und für die Untersuchung einer Vielzahl neurologischer Erkrankungen. Adeno-assoziierte Viren (AAVs) werden zunehmend eingesetzt, um das Verständnis von Gehirnschaltkreisen und deren Funktionen zu verbessern. Die AAV-vermittelte Manipulation spezifischer Zellpopulationen und/oder präziser molekularer Komponenten war enorm nützlich, um neue schlafregulatorische Schaltkreise/Moleküle und Schlüsselproteine zu identifizieren, die zu den nachteiligen Auswirkungen von Schlafverlust beitragen. Zum Beispiel verhindert die Hemmung der Aktivität des filamentösen Aktin-trennenden Proteins Cofilin mit AAV eine durch Schlafentzug induzierte Gedächtnisstörung. Hier wird ein Protokoll beschrieben, das die Manipulation der Cofilinfunktion in einem Großhirnrindenbereich mit der Aufzeichnung der ECoG-Aktivität kombiniert, um zu untersuchen, ob kortikales Cofilin die Wachheits- und Schlaf-ECoG-Signale moduliert. Die AAV-Injektion wird während des gleichen chirurgischen Eingriffs wie die Implantation von ECoG- und elektromyographischen (EMG) Elektroden bei erwachsenen männlichen und weiblichen Mäusen durchgeführt. Mäuse werden betäubt und ihre Köpfe werden rasiert. Nach der Hautreinigung und dem Schnitt werden stereotaktische Koordinaten des motorischen Kortex bestimmt und der Schädel wird an dieser Stelle durchbohrt. Eine Kanüle, die mit einem AAV exprimierenden CofilinS3D, einer inaktiven Form von Cofilin, gefüllt ist, wird langsam im kortikalen Gewebe positioniert. Nach der AAV-Infusion werden goldbedeckte Schrauben (ECoG-Elektroden) durch den Schädel geschraubt und mit Golddrähten in die Nackenmuskulatur (EMG-Elektroden) an den Schädel zementiert. Die Tiere haben drei Wochen Zeit, sich zu erholen und für eine ausreichende Expression von CofilinS3Dzu sorgen. Der infizierte Bereich und der Zelltyp werden immunhistochemisch verifiziert, und die ECoG wird durch visuelle Identifizierung von Vigilanzzuständen und Spektralanalyse analysiert. Zusammenfassend lässt sich sagen, dass dieser kombinierte methodische Ansatz die Untersuchung des genauen Beitrags molekularer Komponenten zur Regulierung der neuronalen Morphologie und Konnektivität zur Regulation der synchronisierten Großhirnrindenaktivität während des Wachseins und des Schlafes ermöglicht.
Einleitung
Elektroenzephalographische (oder allgemein elektrokortikographische [ECoG] bei Nagetieren) und elektromyographische (EMG) Aufzeichnungen werden in der Schlafforschung sowie im weiteren Sinne in den Neurowissenschaften, neurologischen und psychiatrischen Bereichen umfassend verwendet. In Kombination ermöglichen diese elektrophysiologischen Signale die Identifizierung von Vigilanzzuständen und die anschließende Quantifizierung der Zustandsdauer und spektralen Zusammensetzung, sowohl bei Menschen als auch bei Nagetieren1,2,3,4. Eine solche Quantifizierung war nützlich, um zu verstehen, wie der Schlaf bei pathologischen Zuständen wie neurodegenerativen Erkrankungen und Modellen5,6,7 oder durch genetische Veränderung8,9verändert wird . Zum Beispiel wurde gezeigt, dass der Knockout (KO) verschiedener Gene, die mit neuronaler Kommunikation verbunden sind, die Dauer von Wachheit und Schlaf sowohl bei der Maus als auch bei der Fruchtfliegeverändert 10,11,12,13. Um mögliche Entwicklungskompensationen, die sich aus der Untersuchung von Ganzkörper-KO bei Nagetieren ergeben, anzugehen und eine feinere Kontrolle der Genmanipulation zu ermöglichen, ist eine effiziente Möglichkeit, die Genexpression zu manipulieren, die Verwendung von Adeno-assoziierten Viren (AAVs). Eine AAV-vermittelte genetische Manipulation kann verwendet werden, um ein bestimmtes molekulares Ziel herunter- oder hochzuregulieren und die Manipulation auf eine bestimmte Zellpopulation mit verschiedenen Arten von Promotoren zu beschränken14. AAVs werden auch ausgiebig als Abgabemethode in der geclusterten regelmäßig interspaced short palindromic repeats (CRISPR)/Cas9-Technologie15,16verwendet. Diese Methoden ermöglichen eine bessere zeitliche und räumliche Kontrolle der genetischen Manipulation, die im Allgemeinen mit der Expression eines Reporters verbunden ist, der die Quantifizierung des infizierten Bereichs mitHilfe von Immunfluoreszenz ermöglicht.
AAVs stellen auch den Hauptvektor für zelltypspezifische Manipulationen neuronaler Aktivität über Optogenetik und Chemogenetikdar 17,18,19, die in der jüngsten Forschung zu neurodegenerativen Erkrankungen, Verhalten, Kognition und Schlaf weit verbreitet sind20,21,22. In der Schlafforschung war die Anwendung der Optogenetik zur Aktivierung oder Hemmung bestimmter Hirnregionen wie basales Vorderhirn, Hypothalamus und sublaterodorales Tegmentum nützlich, um ihre Rolle bei der Kontrolle von Erregung, langsamem Schlaf (auch bekannt als nichtschneller Augenbewegungsschlaf), paradoxem Schlaf (oder schnellem Augenbewegungsschlaf) und Kataplexie zu bestimmen23. 24,25. Darüber hinaus haben AAV-vermittelte Manipulationen dazu beigetragen, wichtige Schlafregulierungskreise und Moleküle aufzuklären, die zu den nachteiligen Auswirkungen von Schlafverlust beitragen26,27,28. Zum Beispiel ist ein Protein, das nachweislich an einer durch Schlafentzug induzierten Gedächtnisstörung beteiligt ist, Cofilin29,30. Dieses Protein ist ein filamentöses Aktin-durchtrennendes Protein, das an der Reorganisation von Aktinfilamenten beteiligt ist, indem es physikalisch an Aktin bindet und die Demontage der Filamente auf dynamische Weise fördert31. Es wurde gezeigt, dass die Hemmung der Cofilinaktivität mit einem AAV-vermittelten Ansatz den Verlust der Wirbelsäule sowie synaptische Plastizität und Gedächtnisdefizite, die durch Schlafentzug bei Mäusen induziert werden, verhindert29. Insgesamt betonen diese Studien die Nützlichkeit und Relevanz von AAV-vermittelten Manipulationen, um die Schlafregulation und die Folgen von Schlafentzug bei Nagetieren zu verstehen.
Hier wird ein Protokoll beschrieben, das die Implantation und Aufzeichnung von ECoG- und EMG-Elektroden mit der Manipulation der Cofilinfunktion in einem Großhirnrindenbereich von Wildtyp-Mäusen (WT) unter Verwendung eines AAV kombiniert. Genauer gesagt wird ein AAV (Serotyp 9), der die Kodierungssequenz einer phosphomimetischen Form des Mauscofilins (CofilinS3D)exprimiert und inaktiv macht32,33, in den motorischen Kortex (M1 und M2) injiziert. Eine ECoG-Elektrode wird direkt an der Injektionsstelle implantiert, um die Aufzeichnung der synchronisierten kortikalen Aktivität der infizierten Zellen zu gewährleisten. Die ECoG/EMG-Aufzeichnung wird drei Wochen nach der Operation 24 Stunden lang unter ungestörten Bedingungen durchgeführt, um Eine Genesung, Anpassung und hoheCofilin-S3D-Expression zu ermöglichen. Die Aufzeichnung wird dann zur Identifizierung von Vigilanzzuständen und zur ECoG-Spektralanalyse verwendet, wie in früheren Studien11,34beschrieben. Diese Methodik kann spezifisch zeigen, wie kortikales Cofilin Wachheits- und Schlaf-ECoG-Signale bei Mäusen moduliert. Diese Kombination aus elektrophysiologischen Aufzeichnungen und AAV-vermittelter genetischer Manipulation ist besonders relevant, um die Rolle verschiedener molekularer Elemente in bestimmten Gehirnfunktionen zu untersuchen und könnte auf kortikale (und subkortikale) Gehirnareale von Interesse bei WT und genetisch veränderten Mäusen beiderlei Geschlechts und sogar anderen Arten angewendet werden.
Protokoll
Alle Methoden wurden vom Comité d'éthique de l'expérimentation animale der Recherche CIUSSS-NIM genehmigt und entsprechen den Richtlinien des Canadian Council on Animal Care. In der Materialtabelle finden Sie Reagenzien, Geräte und Materialien, die in diesem Protokoll verwendet werden.
1. Vorbereitung der Operation
- Aufbereitung von ECoG- und EMG-Elektroden
- Bereiten Sie für jedes Tier drei ECoG-Elektroden vor: Mit einem Lötkolben einen kleinen Tropfen bleifreies Lot auf den Schraubverschluss einer goldbedeckten Schraube legen und einen 4 mm langen Golddraht mit einem Durchmesser von 0,2 mm (nicht isoliert) auf die Oberseite des Schraubverschlusses mit dem bleifreien Lot löten (Abbildung 1A). Bereiten Sie 2 Elektroden mit dem Golddraht gerade nach oben und eine mit einem Winkel von 45 ° von der Vertikalen vor.
- Bereiten Sie für jedes Tier zwei EMG-Elektroden vor: Schneiden Sie einen Golddraht mit einem Durchmesser von 0,2 mm auf eine Länge von 1,5 cm und einen zweiten auf 2 cm. Krümmen Sie beide Drähte, damit diese die Kurve des Schädels bis zu den Nackenmuskeln umfassen, wobei ein gerades Ende erhalten bleibt, das an den Stecker gelöt wird (Abbildung 1B).
- Bereiten Sie für jedes Tier einen Stecker vor: Verwenden Sie einen 6-Kanal-Anschluss (5 mm x 8 mm x 8 mm + 3 mm Metallstifte) und fügen Sie 5 der 6 Metallstifte bleifreies Lot hinzu (ohne einen mittleren Stift; Abbildung 1C). Decken Sie die Oberseite des Steckers mit Klebeband ab, um Streu oder Wasserinfiltration zu vermeiden.
- Vorbereitung von AAVs und Spritzenpumpe
- Bereiten Sie den Test AAV (hier AAV9-CaMKIIα0.4-CofilinS3D-HA)und/oder die Kontroll-AAV (hier AAV 9-CaMKIIα0.4-eGFP) vor, indem Sie die Stamm-AAV-Mischung(en) (hier AAVs in einer Lösung aus phosphatgepufferter Kochsalzlösung, die nichtionisches Tensid [0,001%]] enthält) mit steriler Kochsalzlösung verdünnen, um den gewünschten viralen Titer (in der Regel 1012-13 Genomkopien [GC]/ml) und das erforderliche Volumen für die Anzahl der zu behandelnden Mäuse zu erhalten.
HINWEIS: Ein injiziertes Volumen von 1 μL pro kortikaler Fläche pro Maus erfordert die Vorbereitung von 2 μL. - Befestigen Sie eine 10 μL-Spritze an einer Spritzenpumpe und füllen Sie sie mit destilliertem Wasser.
- Füllen Sie ein PE50-Röhrchen von ca. 60 cm Länge mit destilliertem Wasser mit einer 1-ml-Spritze und einer 21-G-Nadel. Wichtig ist, dass Sie die 21G-Nadel und die Spritze nach dem Befüllen an Ort und Stelle lassen. Verbinden Sie das PE50-Rohr mit der Spritzenpumpe; Lassen Sie die 21 G Nadel/Spritze an einem Ende des PE50-Röhrchens und verbinden Sie das andere Ende mit der 10 μL-Spritze.
- Sobald das Röhrchen an der 10 μL-Spritze befestigt ist, entfernen Sie die Nadel am anderen Ende und drücken Sie den Kolben der 10 μL-Spritze, um die von der Nadel hinterlassene Lücke mit Wasser zu füllen.
HINWEIS: Stellen Sie sicher, dass keine Luftblase vorhanden ist und dass das Rohr vollständig mit Wasser gefüllt ist. - Installieren Sie eine 28 G Kanüle am Ende des Röhrchens, wo die Nadel entfernt wurde. Drücken Sie Wasser mit der 10 μL Spritze in die Kanüle, um sie vollständig zu füllen. Befestigen Sie die Kanüle fest am stereotaktischen Arm.
- Bereiten Sie den Test AAV (hier AAV9-CaMKIIα0.4-CofilinS3D-HA)und/oder die Kontroll-AAV (hier AAV 9-CaMKIIα0.4-eGFP) vor, indem Sie die Stamm-AAV-Mischung(en) (hier AAVs in einer Lösung aus phosphatgepufferter Kochsalzlösung, die nichtionisches Tensid [0,001%]] enthält) mit steriler Kochsalzlösung verdünnen, um den gewünschten viralen Titer (in der Regel 1012-13 Genomkopien [GC]/ml) und das erforderliche Volumen für die Anzahl der zu behandelnden Mäuse zu erhalten.
- Vorbereitung von Tieren
HINWEIS: C57BL6/ J männliche und weibliche Mäuse im Alter von ~ 12 Wochen wurden zuvor für mindestens 2 Wochen an die Unterbringung in einzelnen Käfigen und an einen 12-h hellen: 12-h-Dunkelzyklus mit ad libitum Nahrung und Wasser und Zugang zu einem Holzwürfel angepasst.- Wiegen Sie die Mäuse vorsichtig und injizieren Sie intraperitoneal eine Mischung aus Ketamin / Xylazin (120/10 mg / kg) zur Anästhesie. Warten Sie ca. 10 Minuten auf tiefe Anästhesie.
- Rasieren Sie die Haare von der Rückseite der Ohren bis zur Vorderseite des Kopfes zwischen den Augen mit einem Haarschneider.
HINWEIS: Seien Sie sehr vorsichtig, die Schnurrhaare nicht zu schneiden (schützen Sie die Schnurrhaare mit einem Finger während der Rasur), da das Trimmen von Schnurrhaaren die sensorischen Eingaben und die ECoG-Aktivität35,36verändern wird. - Fügen Sie jedem Auge einen großzügigen Tropfen Augensalbe hinzu, um Austrocknung zu verhindern. Überprüfen Sie die Tiefe der Anästhesie regelmäßig während des Eingriffs, indem Sie einen Zehen von der Hinterpfote kneifen. Versorgen Sie die Maus mit 0,5-1,5% Isofluran, um eine tiefe Betäubung zu gewährleisten, wenn ein Zehenquetschreflex auftritt.
2. Intrakortikale AAV-Injektion mit einer Spritzenpumpe
HINWEIS: Führen Sie alle folgenden Schritte mit sterilisierten Instrumenten und in einer sauberen Umgebung aus. Verwenden Sie 70% Ethanol, um sterilisierte Instrumente weiter zu waschen und Elektroden, die in Abschnitt 1.1 vorbereitet wurden, sowie Ankerschrauben (nicht goldbedeckte Schrauben) vor Beginn der Operation zu waschen.
- Befestigen Sie den Kopf der Maus vorsichtig auf dem stereotaxischen Gerät mit Ohrbügeln.
HINWEIS: Stellen Sie sicher, dass sich der Kopf nicht seitlich bewegt. - Ziehen Sie vorsichtig die Zunge des Tieres aus dem Mund, um ein Ersticken zu vermeiden, und fixieren Sie die Nase der Maus mit dem stereotaxischen Adapter.
HINWEIS: Überwachen Sie die Atmung häufig während des Eingriffs. - Sterilisieren Sie den rasierten Bereich des Kopfes mit 70% Ethanol und schneiden Sie die Haut mit einer extra feinen Graefe-Ziffe mit einer Gewebeschere von der Basis der Ohren bis zur Höhe der Augen. Verwenden Sie vier chirurgische Klemmen, um die Haut zu dehnen und den Schädel freizulegen (zwei auf jeder Seite des Schnitts; siehe Abbildung 1D).
- Kratzen Sie die Schädeloberfläche mit einer scharfen Scherenspitze: Während Sie Knochennähte vermeiden, entfernen Sie das Periost und erzeugen Sie überlappende Streifen in zwei oder mehr Richtungen. Entfernen Sie die Knochenfragmente und trocknen Sie den Schädel mit 70% Ethanol.
HINWEIS: Das Kratzen und das Streifen machen die Aufnahmemontage robuster, indem die Haftung des Zements am Schädel verbessert wird (siehe unten). - Identifizieren Sie mit der Kanüle, die am stereotaktischen Arm befestigt ist, die Position der Bregma (dh den Schnittpunkt zwischen den schädelkoronalen und sagittalen Nähten; Abbildung 1D) und Lambda (d.h. der Schnittpunkt zwischen der Schädel-Sagittal-Naht und einer geraden Linie, die die linke und rechte Lambdoid-Naht verbindet; Abbildung 1D), und notieren Sie sich die stereotaxischen Koordinaten der einzelnen Koordinaten. Wenn die Differenz zwischen den z-Koordinaten (vertikale Achse) der Bregma und des Lambda größer als 0,3 mm ist, stellen Sie die Höhe der Nase mit dem stereotaxischen Adapter ein, bis die z-Position von Bregma und Lambda ausgerichtet ist.
- Markieren Sie die Position der Kanüle auf dem Schädel mit einem Stift an diesen Koordinaten (motorischer Kortex): 1,5 mm seitlich rechts bis Mittellinie und 1,5 mm anterior bis Bregma. Durchbohren Sie den Schädel vorsichtig an der Position der Kanüle mit einem 0,7 mm Bohrer in einer Richtung senkrecht zur Schädeloberfläche (ausgerichtet mit der vertikalen Achse). Waschen Sie den durchbohrten Schädel mit einer sterilen Baumwollspitze, die mit einer 10% igen Providon-Jod-Lösung imprägniert ist.
- Laden Sie die Kanüle mit einer 1 μL Luftblase, indem Sie den 10 μL Spritzenkolben um 1 μL zurückziehen. Laden Sie den Test AAV (hier AAV9-CaMKIIα0.4-CofilinS3D-HA) oder den Kontroll-AAV (hier AAV9-CaMKIIα0.4-eGFP) in die zuvor mit der Luftblase beladene Kanüle: Mischen Sie das AAV durch langsames Pipettieren auf und ab, pipettieren Sie 1,7 μL auf eine sterile Petrischale und saugen Sie 1,5 μL der Lösung in der Kanüle an, indem Sie langsam den Kolben der 10 μL Spritze ziehen. Markieren Sie die Position der Luftblase auf dem PE50-Rohr, um die Verfolgung der Injektion zu ermöglichen.
- Richten Sie die Kanüle mit dem Loch auf dem Schädel aus, um die vertikale Position der Kanüle zu erreichen, um den oberen Rand des Schädels (dh schädeloberfläche) zu erreichen. Von der Schädeloberfläche aus die Kanüle langsam um 1,5 mm absenken (um 1,5 mm unter die Schädeloberfläche und Schicht V des motorischen Kortex zu gelangen).
HINWEIS: Seien Sie sehr vorsichtig, um die Kanüle nicht zu stark zu senken, um unnötige Läsionen des Gehirngewebes zu vermeiden. - Starten Sie die Spritzenpumpe, um 1 μL AAV über einen Zeitverlauf von 40 minuten zu injizieren (Geschwindigkeit: 0,025 μL/min, um Gewebeschäden zu minimieren). Verfolgen Sie die Injektion auf dem PE50-Rohr mit der Bewegung der Luftblase und nehmen Sie bei Bedarf Anpassungen vor.
- Nachdem die Injektion abgeschlossen ist, lassen Sie die Kanüle für 5 Minuten an Ort und Stelle, um eine ausreichende Diffusion zu gewährleisten und einen Rückfluss zu vermeiden. Heben Sie dann langsam und vorsichtig den stereotaktischen Arm an, um die Kanüle aus dem Kortex zu entfernen.
3. ECoG/EMG-Elektrodenimplantation
- Schrauben Sie mit einer geraden Kelly-Reihe langsam eine ECoG-Elektrode (mit geradem Golddraht) in die vertikale Achse (derselbe Winkel, in dem das Loch durchbohrt wurde) in das Loch, in das das AAV injiziert wurde. Lassen Sie mindestens 2,5 mm der Schraube aus dem Schädel, um Schäden an der Dura und der Großhirnrinde zu minimieren (dh für eine ungefähre Tiefe von 1,1 mm von der Schädeloberfläche; Abbildung 1D).
- Markieren Sie die Position der hinteren ECoG-Elektrode und der Referenzelektrode auf dem Schädel mit einem Stift an diesen Koordinaten: hintere Elektrode (visueller Kortex) 1,5 mm lateral rechts zur Mittellinie und 1,5 mm vor Lambda, Referenzelektrode (somatosensorischer Kortex) 2,6 mm lateral rechts zur Mittellinie und 0,7 mm posterior zu Bregma. Markieren Sie auch die Position von drei Wartungsschrauben (die als Anker zwischen Schädel und Zahnzement fungieren, um die Kopfmontage zu verfestigen) auf der linken Hemisphäre ohne spezifische Koordinaten, aber so weit wie möglich voneinander und von den ECoG-Elektroden entfernt.
- Stechen Sie den Schädel vorsichtig an der markierten Position der anderen Elektroden und Ankerschrauben mit dem 0,7 mm Bohrer. Stechen Sie für jede Schraube senkrecht zur Schädeloberfläche (d. h. vertikale Achse für die hintere Elektrode, aber mit einem Winkel von der vertikalen Achse für andere Stellen). Waschen Sie den durchbohrten Schädel mit einer 10% igen Providon-Jod-Lösung und blockieren Sie die Löcher mit kleinen, gerollten Stücken empfindlicher Scheibenwischer, bevor Sie die Schrauben installieren, um Blutungen und Verunreinigungen zu verhindern.
- Schrauben Sie mit der geraden Kelly-Sozette die Wartungsschrauben in der linken Hemisphäre und schrauben Sie dann die letzten beiden Elektroden in der rechten Hemisphäre. Stellen Sie sicher, dass Sie mit dem gleichen Winkel schrauben, in dem die Löcher durchbohrt wurden, und mindestens 2,5 mm jeder Schraube aus dem Schädelherauslassen (Abbildung 1D).
HINWEIS: Um die Festigkeit der endgültigen Montage und die Qualität der elektrophysiologischen Signale zu maximieren, achten Sie darauf, bei der Installation der nächsten keine Schraube zu berühren. - Legen Sie ein paar kleine Tropfen Zahnzement in die Mitte des ringartigen Raumes in den Schrauben. Setzen Sie das gekrümmte Ende einer EMG-Elektrode (vorbereitet in Schritt 1.1.2) etwa 1-2 mm in die Nackenmuskulatur ein, indem Sie die gekrümmte Extremität mit dumont #5-Zette halten und die Haut mit einer extrafeinen Graefe-Zette über die Muskeln heben. Dann legen Sie die gekrümmte Seite und den Ellbogen der Elektrode in den Zahnzement; Wiederholen Sie dies für die zweite EMG-Elektrode.
HINWEIS: Das gerade Ende der längeren EMG-Elektrode sollte mit der vorderen ECoG-Elektrode und das der kürzeren EMG-Elektrode mit der hinteren ECoG-Elektrode ausgerichtet sein. Stellen Sie sicher, dass sich die beiden EMG-Elektroden nicht berühren oder eine der Schrauben. - Bedecken Sie die Augen der Mäuse und tragen Sie 3-5 Minuten lang Licht auf, um die Festigung zu zementieren. Sobald die EMG-Elektroden fest halten, bedecken Sie die Basis der ECoG-Elektroden und die Basis der Ankerschrauben mit Zahnzement, um eine kronenförmige Kontur zu bilden. Bedecken Sie die Augen der Mäuse und tragen Sie 3-5 Minuten lang Licht auf, um die Festigung zu zementieren.
HINWEIS: Tragen Sie keinen Zement auf die ECoG- und EMG-Elektrodenextremitäten (Golddraht, der mit dem Stecker gelöt wird) oder auf die Haut auf. - Füllen Sie die Mitte der Montage mit zuvor gemischtem Acrylzement. Entfernen Sie während der Zementerstarrung die vier chirurgischen Klemmen, die die Haut halten (und waschen Sie diese sofort mit empfindlichen Scheibenwischern).
HINWEIS: Tragen Sie keinen Zement auf die ECoG- und EMG-Elektrodenextremitäten (Golddraht, der mit dem Stecker gelöt wird) oder auf die Haut auf. - Nähen Sie die Haut an der Rückseite und der Vorderseite der Montage, so dass der Schädel nicht freigelegt wird (aber vermeiden Sie, die Haut zu sehr zu dehnen) mit einer Nahtnadel (13 mm 3/8 c) und synthetischem resorbierbarem Monofilament.
- Halten Sie den Stecker mit einer gekrümmten Pinzette über die Montage und richten Sie den Golddraht der Elektroden vorsichtig mit den Anschlussstiften aus. Lötelektrodenextremitäten, um Pins mit dem Lötkolben zu verbindet.
HINWEIS: Gehen Sie schnell vor, um Überhitzung und Schädigung des kortikalen Gewebes zu vermeiden. Stellen Sie sicher, dass jede Elektrode einen guten Kontakt mit dem entsprechenden Anschlussstift hat und dass die Elektroden nicht miteinander verbunden sind. - Entfernen Sie die Maus aus dem stereotaktischen Rahmen. Decken Sie den leeren Raum zwischen Stecker und Kopf mit zuvor gemischtem Acrylzement ab, indem Sie alle Verbindungen zwischen Elektroden und Steckerstiften abdecken.
HINWEIS: Vermeiden Sie zementinfiltration im Inneren des Steckers, indem Sie die Maus mit dem Stecker über dem Kopf halten (Kopf gerade nicht geneigt). - Wiegen Sie die Maus und legen Sie sie in einen sauberen Käfig (vorzugsweise mit einem nicht vermaschten Deckel ausgestattet) auf einem Wärmekissen (individuelles Gehäuse, um Schäden an der Kopfmontage zu vermeiden). Überwachen Sie das Tier regelmäßig und verabreichen Sie 0,1 mg/kg Buprenorphin subkutan nach dem Erwachen und 12 Stunden später, wenn das Tier Anzeichen von Schmerzen zeigt (z. B. abnormale Haltung, blinzelende Augen).
HINWEIS: Die Gewichtszunahme im Verhältnis zum Gewicht vor der Operation sollte 1,5 g nicht überschreiten.
4. Aufnahmen
- Mäuse einzeln beherbergen, um Schäden an der Kopfmontage durch gegenseitige Pflege sowie Beschädigung und Verschränkung der Aufnahmekabel zu vermeiden.
HINWEIS: Für dieses Protokoll wurden Mäuse mit ad libitum Zugang zu Nahrung, Wasser und einem Holzwürfel untergebracht, und es wurde eine tägliche Überwachung durchgeführt. - Verbinden Sie die Mäuse 2 Wochen nach der Operation mit Aufzeichnungskabeln zur Anpassung an die Verkabelungsbedingungen.
- Zeichnen Sie ECoG/EMG-Signale für 24 Stunden auf (oder je nach Forschungsfragen länger/kürzer).
HINWEIS: Die ECoG/EMG-Signalaufzeichnung wurde mit einem Kabel, einem schwenkbaren Anschluss (um die Rotation des Kabels zu ermöglichen), einer tragbaren 36-Kanal-Box und einem Verstärker durchgeführt, der an einen Computer angeschlossen war. Signale werden bei 256 Hz (oder mehr je nach Forschungsfragen) abgetastet und mit kommerzieller Software aufgezeichnet (siehe Materialtabelle). Um eine ausreichende virale Expression zu gewährleisten, sollten Experimente mindestens 3 Wochen nach der AAV-Injektion durchgeführt werden, wie zuvor beschrieben29,37. - Opfern Sie nach der Aufzeichnung die Mäuse durch zervikale Dislokation (oder andere Methoden, abhängig vom Immunfärbungsprotokoll) und ernten Sie das Gehirn für die Immunfärbung.
Ergebnisse
Nach elektrophysiologischen Aufzeichnungen wird die Immunfluoreszenz verwendet, um den mit der AAV-Injektion infizierten Bereich zu definieren und die Expression von CofilinS3D zu validieren (Abbildung 2). Die Immunfärbung kann mit einer Methodik durchgeführt werden, die der zuvor beschriebenenMethodik 29,37,38,39ähnelt. Das AAV exprimiert eine inaktive Form von Cofilin, die mit einem Hämagglutinin (HA)-Tag (CofilinS3D-HA)verschmolzen ist und durch Immunfluoreszenz unter Verwendung eines Anti-HA-Antikörpers und eines sekundären Antikörpers (Alexa Fluor 488) nachgewiesen wird. Die infizierten exzitatorischen Neuronen (hier mit einem Calcium/Calmodulin-abhängigen Proteinkinase II alpha[CamKIIα]-Promotor,der die Expression des im AAV enthaltenen Transgens steuert) werden mit dem Anti-HA-Antikörper gefärbt. Eine erfolgreiche Infektion wird durch die Färbung der Neuronen im motorischen Kortex, der die Injektionsstelle umgibt, angezeigt (Abbildung 2A, B). In diesem repräsentativen Beispiel zeigte die Großhirnrinde der anderen Hemisphäre keine merkliche Färbung. Da erregende Neuronen jedoch auf entfernte Hirnareale projizieren können, ist die Färbung in der kontralateralen Hemisphäre nicht unbedingt ein Hinweis auf eine erfolglose Injektion. Eine höhere Vergrößerung des infizierten Bereichs zeigte eine Färbung der Zellkörper und Projektionen, was bestätigte, dass nur bestimmte Zellen des anvisierten kortikalen Bereichs infiziert waren (Abbildung 2C).
Eine Co-Färbung mit Markern exzitatorischer Neuronen (z. B. vesikulärer Glutamattransporter 1, CaMKIIα) kann ebenfalls durchgeführt werden, um die Zelltypspezifität zu validieren. Alternativ kann eine Co-Färbung mit Markern von inhibitorischen Neuronen oder Astrozyten durchgeführt werden, wenn diese Zellen mit verschiedenen Promotoren gezielt eingesetzt werden. Die Co-Färbung von CofilinS3D-HAund CaMKIIα wurde auch bei demselben Tier für einen Bereich durchgeführt, der weiter hinter der Injektionsstelle liegt und noch eine Anti-HA-Färbung im motorischen Kortex aufwies (Abbildung 2D). Das Bild mit höherer Vergrößerung des Bereichs zeigt Zellen, die Deutlichkeit von CofilinS3D-HA(Alexa Fluor 488, Abbildung 2E)und CaMKIIα (Alexa Fluor 568, Abbildung 2F)exprimieren. Die Überlagerung der CofilinS3D-HAund CaMKIIα Färbung zeigt, dass die meisten (wenn nicht alle) Zellen, die für CofilinS3D-HAgefärbt sind, auch für CaMKIIα positiv sind (Abbildung 2G). Diese Beobachtung unterstützt die Spezifität der Infektion für erregende Neuronen.
Um die Auswirkungen der Cofilin-Manipulation auf die ECoG-Aktivität zu bewerten, werden ECoG- und EMG-Signale verwendet, um eine visuelle Identifizierung von Vigilanzzuständen (Wachheit, langsamer Wellenschlaf, paradoxer Schlaf) durchzuführen. Dies geschieht auf 4-s-Epochen wegen der schnellen Änderung des Vigilanzzustands in der Maus2und hier für eine vollständige 24-Stunden-Aufnahme. Standardanalysen umfassen die Berechnung von Schlafarchitektur und Spektralanalysevariablen, wie sie zuvor für verschiedene Datensätze11,12,13,28,34durchgeführt wurden. Insbesondere die Spektralanalyse des ECoG-Signals der verschiedenen Zustände indiziert die Zustandszusammensetzung und -qualität. Um Unterschiede zu beseitigen, die beispielsweise aus unterschiedlichen Tiefen der Elektroden entstehen könnten, können Spektralanalysedaten relativ zur Gesamtleistung aller Zustände eines bestimmten Tieres ausgedrückt werden (Abbildung 3A). Angesichts der sehr geringen relativen Amplitude der ECoG-Aktivität in höheren Frequenzen wurden relative Leistungsspektren für Wachheit, langsamen Wellenschlaf und paradoxen Schlaf protokolliert, um die Aktivität in niedrigen und hohen Frequenzen besser zu visualisieren und gleichzeitig zu vergleichen. Diese Analyse zeigt zustandsspezifische Unterschiede in der spektralen Aktivität unter Bedingungen der Cofilin-Inaktivierung (Abbildung 3B). Genauer gesagt weisen diese vorläufigen Ergebnisse, die männliche und weibliche Mäuse kombinieren, darauf hin, dass die Cofilin-Inaktivierung die spektrale Leistung in schnellen Frequenzen (14-30 Hz) während des Wachzustands und in langsamen Frequenzen (1-4 Hz) während des paradoxen Schlafes signifikant erhöht, während die ECoG-Aktivität während des langsamwelligen Schlafes weitgehend unberührt bleibt. Darüber hinaus scheint die Cofilin-Inaktivierung die Variabilität zwischen den Mausen in der ECoG-Aktivität zu erhöhen (besonders auffällig durch Fehlerbalken für die Wachheit in Abbildung 3B).
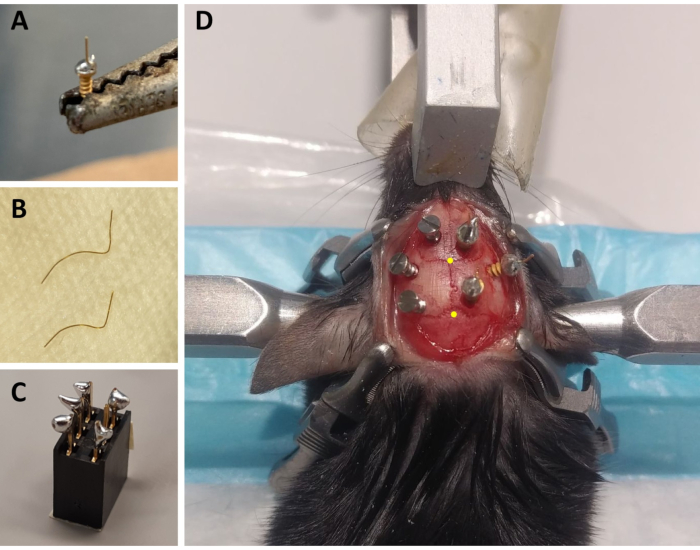
Abbildung 1: Vorbereitung von ECoG/EMG-Montagekomponenten und repräsentatives Beispiel für die Platzierung von ECoG-Elektroden. (A) Eine ECoG-Elektrode: Ein 4 mm langer Golddraht mit einem Durchmesser von 0,2 mm (nicht isoliert) wird auf dem Kopf einer goldbedeckten Schraube (1,9 mm Kopfdurchmesser, 1,14 mm Gewindedurchmesser, 3,6 mm Gesamtlänge) mit bleifreiem Lot verschmolzen. (B) EMG-Elektroden: Zwei Golddrähte (1,5 und 2 cm) sind gekrümmt, um die Krümmung des Schädels bis zum Halsmuskel zu umarmen, und das andere Ende wird gerade gehalten, um an den Stecker gelöt zu werden. (C)Ein 6-Kanal-Stecker: Bleifreies Lot wird zu 5 der 6 Metallstifte (ohne einen in der Mitte) des Steckers (5 mm x 8 mm x 8 mm + 3 mm Metallstifte) hinzugefügt. Die Oberseite des Steckers ist mit Klebeband bedeckt, um Streu / Wasserinfiltration zu vermeiden. (D) Beispiel für die Positionierung der drei Wartungsschrauben am Schädel der linken Hemisphäre und der drei ECoG-Elektroden (einschließlich einer Referenzelektrode) auf der rechten Hemisphäre. Die genauen stereotaxischen Koordinaten der ECoG-Elektroden sind in den Schritten 2.6 und 3.2 angegeben und wurden nach der Lage der Bregma und lambda (die durch die gelben Punkte gekennzeichnet sind) berechnet. Abkürzungen: ECoG = elektrokortikographisch; EMG = elektromyographisch. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
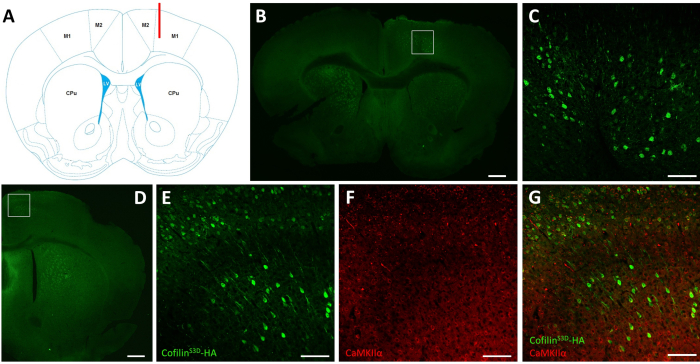
Abbildung 2: Repräsentative Immunfärbung zur Definition des AAV-infizierten Bereichs und Zelltyps. (A) Schematische Darstellung der Injektionsstelle der in Tafel B dargestellten koronalen Scheibe. Die Position ist 1,1 mm vor dem Bregma, und die Kanüle (rot dargestellt) wurde auf die Schichten V des rechten primären motorischen Kortex (M1) ausgerichtet. Darstellung modifiziert von Franklin und Paxinos40. (B) Immunfärbung von HA zum Nachweis der CofilinS3D-HA-Expressionin Neuronen, die für eine koronale Scheibe des gesamten Gehirns gezeigt wurde, die sich etwa 1,1 mm vor dem Bregma befindet. Der infizierte Bereich lokalisiert sich hauptsächlich in den Schichten V und VI (infragranulare Schichten) der rechten primären und sekundären motorischen Kortikale (M1 und M2). Maßstabsleiste = 500 μm. Das Quadrat repräsentiert den in C. (C) Gezeigten Bereich Höhere Vergrößerung des infizierten Bereichs, der eine Färbung infizierter Zellen zeigt und die Expression von CofilinS3D-HAin tieferen Schichten des motorischen Kortex bestätigt. Scale bar = 100 μm. (D) Co-Immunfärbung von HA und CaMKIIα zur Beurteilung der Zelltypspezifität, die für eine koronale Scheibe der rechten Hemisphäre gezeigt wird, die sich etwa 0,5 mm vor Bregma und damit hinter der Injektionsstelle befindet (gleiche Maus wie in den Panels B und C). Der infizierte Bereich lokalisiert sich auf motorische Kortikale (M1 und hauptsächlich M2). Maßstabsleiste = 500 μm. Das Quadrat stellt den bereichsausgedruckten Bereich dar, der in E, F und G angezeigt wird. (E) Höhere Vergrößerung des infizierten Bereichs, der eine Färbung infizierter Zellen und die Bestätigung der Expression von CofilinS3D-HA zeigt. Maßstabsbalken = 100 μm. (F) Höhere Vergrößerung des infizierten Bereichs mit Färbung von CaMKIIα-positiven Zellen. Maßstabsbalken = 100 μm. (G) Höhere Vergrößerung des infizierten Bereichs mit Co-Markierung von CofilinS3D-HAund CaMKIIα, was bestätigt, dass infizierte Zellen CaMKIIα-positiv sind. Maßstabsleiste = 100 μm. Abkürzungen: AAV = Adeno-assoziiertes Virus; M1 = primärer motorischer Kortex; M2 = sekundärer motorischer Kortex; CPu = Caudat putamen (Striatum); LV = lateraler Ventrikel; HA= Hämagglutinin; CamKIIα = Calcium/Calmodulin-abhängige Proteinkinase II alpha. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
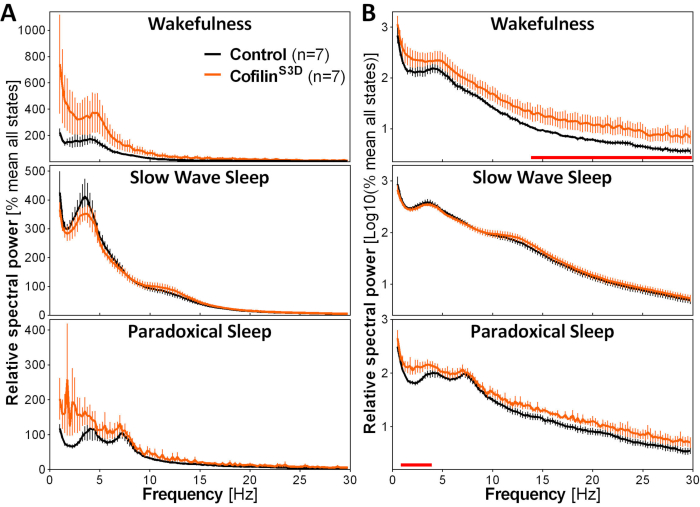
Abbildung 3: Repräsentative Leistungsspektren für Wachheit, langsamen Wellenschlaf und paradoxen Schlaf, die nach viraler Manipulation der Cofilinfunktion erhalten wurden. Männliche (n = 5 pro Gruppe) und weibliche (n = 2 pro Gruppe) Mäuse, die mit AAV 9-CaMKIIα0.4-CofilinS3D-HA(Viraltiter 2,58 × 1013 GC/ml) oder mit einem Kontroll-AAV (AAV9-CaMKIIα0.4-eGFP1,25 × 1013 GC/ml; die Hälfte des Testtiters zur Kontrolle des verstärkten Signals dieses Kontroll-AAV) in Schicht V des motorischen Kortex injiziert wurden, wurden 24 h lang aufgezeichnet, und das elektrokortikographische Signal wurde einer Spektralanalyse unterzogen (schnelle Fourier-Transformation zur Berechnung der spektralen Leistung zwischen 0,5 und 30 Hz mit einer Auflösung von 0,25 Hz). (A) Leistungsspektren während der drei Vigilanzzustände, ausgedrückt relativ zur Gesamtleistung aller Zustände. (B) Relative Leistungsspektren log-transformiert, um Gruppenunterschiede in höheren Frequenzen besser darzustellen. Die Unterdrückung der Cofilinaktivität im motorischen Kortex unter Verwendung von AAV 9-CaMKIIα0.4-CofilinS3D-HAerhöht die elektrokortikographische Aktivität im Beta-Bereich (14-30 Hz) während der Wachheit signifikant und im Delta-Bereich (1-4 Hz) während des paradoxen Schlafes im Vergleich zu Kontrollinjektionen (rote Linien über x-Achsen zeigen Mann-Whitney U-Testauf Frequenzbandleistung p < 0,05). Abkürzungen: AAV = Adeno-assoziiertes Virus GC = Genomkopien; HA= Hämagglutinin; CamKIIα = Calcium/Calmodulin-abhängige Proteinkinase II alpha; eGFP = verstärktes grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll beschreibt eine präzise und unkomplizierte Methode zur Überwachung der ECoG- und EMG-Aktivität während der Manipulation molekularer Targets mit AAVs. Für einen adäquaten Vergleich zwischen den Gruppen wird dringend empfohlen, chirurgische Eingriffe (AAV-Injektion und Elektrodenimplantation) für Versuchs- und Kontrolltiere immer am selben Tag zu planen und gleichzeitig deren elektrophysiologische Signale aufzuzeichnen. Um eine ähnliche virale Expression zwischen den Test- und Kontrolltieren zu erhalten, ist die Injektion desselben Viraltiters wünschenswert. Im vorliegenden Fall war der virale Titer der Kontroll-AAV auf die Hälfte des Test-AAV gesenkt worden, um eine ähnliche virale Expression zu gewährleisten. Experimentatoren sollten bei Messungen stereotaxischer Koordinaten sehr vorsichtig sein, um eine geringe Variabilität zwischen den Tieren im Gehirnbereich / kortikalen Schicht-Targeting zu gewährleisten. Da die Injektionstiefe aus der Schädeloberfläche berechnet wird und die Schädeldicke mit Alter und Geschlecht variiert, sollte die Platzierung der Kanüle immer mit Hilfe der Postprotokollhistologie oder Immunhistochemie (z. B. Abbildung 2)überprüft werden, um eine angemessene Positionierung / Injektionstiefe zu gewährleisten, und die stereotaktischen Koordinaten sollten bei Bedarf angepasst werden. Während der 40-minütigen AAV-Injektion ist es sehr wichtig, die Einspritzgeschwindigkeit zu überwachen, um potenzielle Probleme wie Pumpenverstopfung schnell zu erkennen und zu beheben. Einige experimentelle Schritte sind auch entscheidend, um optimale elektrophysiologische Signale zu erhalten. Zum Beispiel nicht überschrauben während der Elektrodenimplantation; Schrauben sollten mindestens 2,5 mm aus dem Schädel herausragen, um Schäden an der Großhirnrinde und die Bildung einer Glianarbe zu minimieren. Danach ist es auch enorm wichtig, i) das Auftragen von Zement auf die Extremitäten der Elektroden zu vermeiden, ii) ein schnelles Löten der Elektroden auf den Stecker zu gewährleisten und iii) sicherzustellen, dass kein Kontakt zwischen den Elektroden besteht.
Das hier vorgestellte Verfahren für die ECoG- und EMG-Aufzeichnung ist extrem gut etabliert, einfach und weit verbreitet, um Wachheit und Schlaf bei Mäusen zu überwachen2,11,13,34. Kontinuierliche ECoG- und EMG-Aufzeichnungen können für mehrere aufeinanderfolgende Tage (und sogar Wochen) durchgeführt werden und generieren einen sehr reichhaltigen Datensatz, der verwendet werden kann, um mehrere Analyselinien durchzuführen, die Variablen in Bezug auf Wachheit und Schlafmenge und Architektur2,11,12 enthalten (z. B. Zeit, die in verschiedenen Zuständen pro Hell- und Dunkelperiode verbracht wird, Anzahl der Episoden jedes Staates, 24-Stunden-Verteilung des Schlafes), Wachheit und Schlafspektralgehalt34,41 (z. B. Leistung in verschiedenen Frequenzbändern [ähnlich abbildung 3], skalenfreie Aktivität) und Eigenschaften einzelner Wellen42,43,44 (z. B. langsamwellige Amplitude und Steigung). In Kombination mit AAV-vermittelten molekularen Manipulationen ist ein weiterer Vorteil die Vermeidung potenzieller Entwicklungskompensationen, die bei transgenen Tieren auftreten können. Mit Übung kann der gesamte Eingriff, einschließlich der 40-minütigen AAV-Injektion, in ca. 90 minuten durchgeführt werden. Die Sterblichkeitsrate sollte (sehr) niedrig sein, da die Operation minimal-invasiv ist.
Der gleichzeitige Einsatz von ECoG/EMG-Aufzeichnung und gezielter Manipulation mit AAV bietet eine Vielzahl weiterer Vorteile und Anwendungen. Zum Beispiel ist die Präzision des stereotaxischen Targetings, wenn es angemessen durchgeführt wird, sehr hoch und replizierbar und ist nützlich, um die spezifische Rolle einer bestimmten Gehirnregion (und / oder eines Zelltyps oder eines molekularen Elements innerhalb der Region) bei der Regulierung des Schlafes oder anderer physiologischer Prozesse zu bestimmen. Mehrere verschiedene kortikale Bereiche können so mit Anpassungen des aktuellen Protokolls einfach anvisiert werden. Darüber hinaus könnten Zielmanipulationen mit AAVs auf einen kortikalen/subkortikalen Bereich gerichtet werden, der sich von den ECoG-Aufzeichnungsstellen unterscheidet. In solchen Fällen könnte das Gratloch für die AAV-Injektion durch einen kleinen Glasdeckel abgedeckt werden, der mit Zahnzement (oder Knochenwachs) befestigt ist. Für eine erhöhte Spezifität enthält die AAV-Konstruktion oft einen Promotor, der eine gezielte Infektion eines präzisen Zelltyps14ermöglicht. Ein CamKIIα-Promotor wurde im vorliegenden Protokoll verwendet, um gezielt auf exzitatorische Pyramidenzellen14,29,45des motorischen Kortex abzuzielen. Diese Strategie ermöglichte die Inaktivierung von Cofilin (unter Verwendung von CofilinS3D)32,33 in exzitatorischen Neuronen des motorischen Kortex und die Beobachtung zustandsspezifischer Veränderungen der ECoG-Aktivität ( Abbildung3). Um die Wirksamkeit von Infektionen /Transduktionen zu bewerten, könnten zukünftige Protokollbenutzer das vorgestellte AAV-ECoG-Protokoll mit einem der Co-Färbung durch Immunfluoreszenz kombinieren und Bilder mit hoher Vergrößerung verwenden, um die Anzahl der Zellen mit doppelter Markierung aus der Gesamtzahl der Zellen zu berechnen, die eine Einzelmarkierung des Ziels zeigen (hier CaMKIIα-exprimierende Neuronen). In einer aktuellen Studie wurde eine AAV-ECoG-Methode ähnlich der hier beschriebenen verwendet, um das fragile X-mentale Retardierungssyndrom-bezogene Protein 1 (FXR1) in allen Neuronen des motorischen Kortex unter Verwendung eines AAV, das einen Synapsinpromotor enthält, zu überexprimieren und einen Effekt dieser Manipulation auf die Verteilung des Vigilanzzustands und den spektralen Gehalt28zu zeigen. Diese Ergebnisse veranschaulichen, wie die Manipulation eines bestimmten Moleküls in einer Zielhirnregion mithilfe von AAVs die Rolle bei der Regulierung bestimmter Wachheits- / Schlafparameter aufdecken kann.
Eine Einschränkung des beschriebenen Protokolls ist die kleine Läsion des Hirngewebes, die bei der Platzierung von Kanülen vor der Durchführung der AAV-Injektion auftritt, die auch von einer Entzündungsreaktion begleitet sein kann. Dies könnte bei der Durchführung von AAV-Injektionen in subkortikalen Bereichen von besonderer Bedeutung sein und sollte immer durch geeignete Kontrollen angegangen werden. Alternativ könnte dem aktuellen Protokoll die Quantifizierung der reaktiven Gliose und/oder der mikroglialen Aktivierung (z.B. mittels Immunfluoreszenz) folgen, um ähnliche Werte in Kontroll- und Testgruppen und damit auf der ECoG-Auslesung zu gewährleisten. Eine zweite Einschränkung bezieht sich auf das Risiko einer schlechten Verbindung zwischen einer Elektrode und dem Stecker, was zu einem kontinuierlichen oder gelegentlich schlechten elektrophysiologischen Signal führen kann. Fest verschraubte, gelötete und zementierte Elektroden minimieren das Auftreten dieses Problems. Eine dritte Einschränkung bezieht sich auf Tiere, die während der Aufnahme über die Kopfmontage angebunden werden, was die Fortbewegung und andere Verhaltensweisen zumindest bis zu einem gewissen Grad einschränken und gelegentlich zu Verkabelungsschäden und Signalverlust führen kann. Schließlich ist das vorgestellte Protokoll besser für erwachsene Mäuse geeignet, da die Schädelgröße jüngerer Tiere Schwierigkeiten bei der Installation der abgebildeten Kopfmontage verursachen kann, wie zuvor beschrieben2.
Die kombinierte ECoG/EMG-Aufzeichnung und AAV-vermittelte Manipulation eines präzisen Ziels ist auch auf andere Forschungsbereiche als die Neurowissenschaften des Schlafes anwendbar. Unter anderem könnte es verwendet werden, um epileptische Ereignisse in Tiermodellen von Anfällen zu untersuchen und zu manipulieren und ist ein leistungsfähiges Werkzeug, um Gehirnschwingungen zu modulieren, die an der Gedächtniskodierung und -konsolidierung beteiligt sind46,47. Dementsprechend umfassen die Anwendungsmöglichkeiten sicherlich die Bereiche der Grundlagenforschung in der Psychiatrie und Neurologie, einschließlich neurodegenerativer Erkrankungen. Zusätzlich zu der Fähigkeit, eine inaktive Form eines Moleküls zu exprimieren, können und wurden AAVs verwendet, um zu über- oder herunterregulieren (z. B. kleininterferierende RNA, CRISPR / Cas9) oder um die Expression eines Moleküls in einem Ganzkörper-KO zu retten. Wichtig ist, dass die duale Methodik des aktuellen Protokolls auch auf andere Säugetierarten wie Ratten und Tagelnagetiere anwendbar ist, die interessante Modelle darstellen, um sowohl Schlaf als auch Neurodegeneration zu verstehen48,49.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Arbeit wurde vom Canada Research Chair in Sleep Molecular Physiology finanziert. Die Autoren danken Chloé Provost und Caroline Bouchard für die technische Hilfe.
Materialien
| Name | Company | Catalog Number | Comments |
| Surgery peparation | |||
| 21 G needle | Terumo | NN-2125R | |
| 6-channel connector | ENA AG | BPHF2-O6S-E-3.2 | Connector used in this manuscript, but discontinued. See potential replacement below |
| Distrelec | 300-93-672 | Potential replacement for discontinued connector above | |
| C57BL6/J mice | Jackson Laboratory | 000664 | B6 | Animals bred on site |
| Pluronic F-68 | Non-ionic surfactant | ||
| Gold wire 0.2 mm diameter | Delta scientific | 920-862-41 | Non-insulated |
| Hamilton syringe (10 μL) | Fisher Scientific | 14815279 | |
| Infusion syringe Pump CMA 402 | Harvard Apparatus | CMA8003110 | |
| Injection cannula 28 G | Plastics one | C313l-SPCL | |
| Isoflurane | Baxter | CA2L9100 | |
| Ketamine (10 mg/mL) | SANDOZ | 4550 | |
| Lead-free solder | AIM | SN100C | |
| Lubricating ophthalmic ointment | ALLERGAN | 210889 | |
| PE 50 Catheter thin wall | Plastics one | C232CT | |
| Flat fillister head self tapping screws | MORRIS | FF00CE125 | ECoG electrode gold covered; Dimension : 1.9 mm head diameter, 1.14 mm thread major diameter, 3.6 mm length |
| Soldering iron | Weller | WES51 | |
| Syringe 1 mL | BD | 309659 | |
| Trimmer | Harvard Apparatus | 72-9063 | |
| Xylazine (20 mg/mL) | Bayer | 2169592 | |
| Intracortical AAV injection with syringe pump | |||
| 0.7 mm drill bit | Dremel | 628 | |
| AAV9-CaMKIIα0.4-cofilinS3D-HA | UPenn Viral Core | ||
| AAV9-CaMKIIα0.4-eGFP | UPenn Viral Core | ||
| Cotton tippped applicators | Medicom | 806 | |
| Drill | Dremel | 8050-N/18 | |
| Extra-fine Graefe forceps | Fine science tools | 11150-10 | |
| Stereotaxic arm | Stoelting | 51604U | |
| Stereotaxic frame | Stoelting | 51600 | |
| Surgical clamps | Fine science tools | 18050-28 | |
| Tissue scissor | Magna Stainless | M4-124 | |
| ECoG/EMG electrode implantation | |||
| Buprenorphine (0.3 mg/mL) | CEVA | 57133-02 | |
| Curved forceps | Fine science tools | 11001-12 | |
| Delicate task wipers | Kimtech | 34120 | |
| Dental acrylic cement | Yates Motloid | 44115 | |
| Dumont #5 forceps | Fine science tools | 91150-20 | |
| Extra fine Graefe forceps | Fine science tools | 11150-10 | |
| Kelly forceps | Fine science tools | 13002-10 | |
| Liquid acrylic | Yates Motloid | 44119 | |
| Monocryl plus suture needle 13 mm 3/8c rev cutting | Ethicon | MCP494 | |
| Providone-iodine 10% | Triad disposables | 10-8208 | |
| RelyX Unicem 2, Adhesive Resin Cement A2 | 3M | 56849 | |
| Immunofluorescence and ECoG recording | |||
| 36-Channel EEG Wearable Headbox | LaMONT Medical | 832-000350 | |
| CaMKII alpha Monoclonal Antibody (Cba-2) | Invitrogen | 13-7300 | Dilution 1:500 |
| Conductors Awg PVC Insulation Cable | Calmont Wire & Cables | HC-0819075R0 | |
| Donkey anti-Mouse IgG secondary Ab, Alexa Fluor 568 | Invitrogen | A10037 | Dilution 1:1000 |
| Goat anti-Rabbit IgG secondary Ab, Alexa Fluor 488 | Invitrogen | A-11008 | Dilution 1:500 |
| HA-Tag (C29F4) Rabbit mAb | Cell signaling | 3724 | Dilution 1:800 |
| Programmable Amplifier | LaMONT Medical | 815-000002-S2 | |
| Stellate Harmonie | Natus | HSYS-REC-LT2 | |
| Swivel connector | Crist Instrument Company Inc. | 4-TBC-9-S |
Referenzen
- Campbell, I. G. EEG recording and analysis for sleep research. Current Protocols in Neuroscience. , (2009).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Current Protocols in Mouse Biology. 2 (1), 55-74 (2012).
- Bastien, C. H., et al. Insomnia and sleep misperception. Pathologie Biologie. 62 (5), 241-251 (2014).
- Malafeev, A., et al. Automatic artefact detection in single-channel sleep EEG recordings. Journal of Sleep Research. 28 (2), 12679 (2019).
- Latreille, V., et al. Electroencephalographic prodromal markers of dementia across conscious states in Parkinson's disease. Brain. 139, 1189-1199 (2016).
- Rodrigues Brazete, J., et al. Electroencephalogram slowing predicts neurodegeneration in rapid eye movement sleep behavior disorder. Neurobiology of Aging. 37, 74-81 (2016).
- Kent, B. A., Strittmatter, S. M., Nygaard, H. B. Sleep and EEG power spectral analysis in three transgenic mouse models of Alzheimer's disease: APP/PS1, 3xTgAD, and Tg2576. Journal of Alzheimers Disease. 64 (4), 1325-1336 (2018).
- Chang, A. M., et al. Circadian gene variants influence sleep and the sleep electroencephalogram in humans. Chronobiology International. 33 (5), 561-573 (2016).
- Shi, G., Wu, D., Ptacek, L. J., Fu, Y. H. Human genetics and sleep behavior. Current Opinion in Neurobiology. 44, 43-49 (2017).
- Nakai, Y., et al. Calcineurin and its regulator sra/DSCR1 are essential for sleep in Drosophila. Journal of Neuroscience. 31 (36), 12759-12766 (2011).
- El Helou, J., et al. Neuroligin-1 links neuronal activity to sleep-wake regulation. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9974-9979 (2013).
- Freyburger, M., et al. EphA4 is involved in sleep regulation but not in the electrophysiological response to sleep deprivation. Sleep. 39 (3), 613-624 (2016).
- Seok, B. S., et al. The effect of Neuroligin-2 absence on sleep architecture and electroencephalographic activity in mice. Molecular Brain. 11 (1), 52 (2018).
- Haery, L., et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation. Frontiers in Neuroanatomy. 13, 93 (2019).
- Schmidt, F., Grimm, D. CRISPR genome engineering and viral gene delivery: a case of mutual attraction. Biotechnology Journal. 10 (2), 258-272 (2015).
- Wang, D., Zhang, F., Gao, G. CRISPR-based therapeutic genome editing: strategies and in vivo delivery by AAV vectors. Cell. 181 (1), 136-150 (2020).
- Havekes, R., et al. Transiently increasing cAMP levels selectively in hippocampal excitatory neurons during sleep deprivation prevents memory deficits caused by sleep loss. Journal of Neuroscience. 34 (47), 15715-15721 (2014).
- Fuller, P. M., Yamanaka, A., Lazarus, M. How genetically engineered systems are helping to define, and in some cases redefine, the neurobiological basis of sleep and wake. Temperature. 2 (3), 406-417 (2015).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ono, D., Yamanaka, A. Hypothalamic regulation of the sleep/wake cycle. Neuroscience Research. 118, 74-81 (2017).
- Shiromani, P. J., Peever, J. H. New neuroscience tools that are identifying the sleep-wake circuit. Sleep. 40 (4), 032 (2017).
- Oishi, N., et al. Artificial association of memory events by optogenetic stimulation of hippocampal CA3 cell ensembles. Molecular Brain. 12 (1), 2 (2019).
- Anaclet, C., et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control. Journal of Neuroscience. 38 (22), 5168-5181 (2018).
- Chen, K. S., et al. A hypothalamic switch for REM and non-REM sleep. Neuron. 97 (5), 1168-1176 (2018).
- Torontali, Z. A., Fraigne, J. J., Sanghera, P., Horner, R., Peever, J. The sublaterodorsal tegmental nucleus functions to couple brain state and motor activity during REM sleep and wakefulness. Current Biology. 29 (22), 3803-3813 (2019).
- Rolls, A., et al. Optogenetic disruption of sleep continuity impairs memory consolidation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13305-13310 (2011).
- Ognjanovski, N., Broussard, C., Zochowski, M., Aton, S. J. Hippocampal network oscillations rescue memory consolidation deficits caused by sleep loss. Cerebral Cortex. 28 (10), 3711-3723 (2018).
- Khlghatyan, J., et al. Fxr1 regulates sleep and synaptic homeostasis. EMBO Journal. 39 (21), 103864 (2020).
- Havekes, R., et al. Sleep deprivation causes memory deficits by negatively impacting neuronal connectivity in hippocampal area CA1. Elife. 5, 13424 (2016).
- Wong, L. W., Tann, J. Y., Ibanez, C. F., Sajikumar, S. The p75 neurotrophin receptor is an essential mediator of impairments in hippocampal-dependent associative plasticity and memory induced by sleep deprivation. Journal of Neuroscience. 39 (28), 5452-5465 (2019).
- Mizuno, K. Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular Signalling. 25 (2), 457-469 (2013).
- Nagaoka, R., Abe, H., Obinata, T. Site-directed mutagenesis of the phosphorylation site of cofilin: its role in cofilin-actin interaction and cytoplasmic localization. Cell Motility and the Cytoskeleton. 35 (3), 200-209 (1996).
- Elam, W. A., et al. Phosphomimetic S3D cofilin binds but only weakly severs actin filaments. Journal of Biological Chemistry. 292 (48), 19565-19579 (2017).
- Areal, C. C., Cao, R., Sonenberg, N., Mongrain, V. Wakefulness/sleep architecture and electroencephalographic activity in mice lacking the translational repressor 4E-BP1 or 4E-BP2. Sleep. 43 (2), (2020).
- Vyazovskiy, V., Borbely, A. A., Tobler, I. Unilateral vibrissae stimulation during waking induces interhemispheric EEG asymmetry during subsequent sleep in the rat. Journal of Sleep Research. 9 (4), 367-371 (2000).
- Sitnikova, E. Neonatal sensory deprivation promotes development of absence seizures in adult rats with genetic predisposition to epilepsy. Brain Research. 1377, 109-118 (2011).
- Tudor, J. C., et al. Sleep deprivation impairs memory by attenuating mTORC1-dependent protein synthesis. Science Signaling. 9 (425), 41 (2016).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293 (2015).
- Dufort-Gervais, J., et al. Neuroligin-1 is altered in the hippocampus of Alzheimer's disease patients and mouse models, and modulates the toxicity of amyloid-beta oligomers. Scientific Reports. 10 (1), 6956 (2020).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates, Third edition. , (2007).
- Lina, J. M., O'Callaghan, E. K., Mongrain, V. Scale-free dynamics of the mouse wakefulness and sleep electroencephalogram quantified using Wavelet-Leaders. Clocks & Sleep. 1 (1), 50-64 (2019).
- Massart, R., et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes. Translational Psychiatry. 4, 347 (2014).
- Freyburger, M., Poirier, G., Carrier, J., Mongrain, V. Shorter duration of non-rapid eye movement sleep slow waves in EphA4 knockout mice. Journal of Sleep Research. 26 (5), 539-546 (2017).
- Hubbard, J., et al. Rapid fast-delta decay following prolonged wakefulness marks a phase of wake-inertia in NREM sleep. Nature Communications. 11 (1), 3130 (2020).
- Johansen, J. P., et al. Optical activation of lateral amygdala pyramidal cells instructs associative fear learning. Proceedings of the National Academy of Sciences of the United States of America. 107 (28), 12692-12697 (2010).
- Boyce, R., Glasgow, S. D., Williams, S., Adamantidis, A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science. 352 (6287), 812-816 (2016).
- Bandarabadi, M., et al. Dynamic modulation of theta-gamma coupling during rapid eye movement sleep. Sleep. 42 (12), 182 (2019).
- Estrada, C., et al. Transcranial magnetic stimulation and aging: Effects on spatial learning and memory after sleep deprivation in Octodon degus. Neurobiology of Learning and Memory. 125, 274-281 (2015).
- Hurley, M. J., et al. The long-lived Octodon degus as a rodent drug discovery model for Alzheimer's and other age-related diseases. Pharmacology & Therapeutics. 188, 36-44 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten