A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ROS تصوير الخلايا الحية أثناء تطوير الخلايا العصبية
In This Article
Summary
يصف هذا البروتوكول استخدام بيروكسيد الهيدروجين المشفر وراثيا (H2O2)- الاستشعار الحيوي في الخلايا العصبية ويرقات سمك الحمار الوحشي المستزرعة لتقييم أدوار الإشارات الفسيولوجية ل H2O2 أثناء تطور الجهاز العصبي. ويمكن تطبيقه على أنواع مختلفة من الخلايا وتعديلها مع العلاجات التجريبية لدراسة أنواع الأكسجين التفاعلية (ROS) في التنمية العامة.
Abstract
أنواع الأكسجين التفاعلية (ROS) هي جزيئات إشارات راسخة ، وهي مهمة في التطور الطبيعي ، وداء التوازن ، وعلم وظائف الأعضاء. من بين ROS مختلفة، بيروكسيد الهيدروجين (H2O2)يتميز أفضل فيما يتعلق بأدوار في الإشارات الخلوية. وقد تورط H2O2 خلال التنمية في عدة أنواع. فعلى سبيل المثال، تم الكشف عن زيادة عابرة في H2O2 في أجنة حمار وحشي خلال الأيام الأولى بعد الإخصاب. وعلاوة على ذلك، استنزاف مصدر الخلوية الهامة H2O2، NADPH oxidase (NOX)، يضعف تطور الجهاز العصبي مثل التمايز، والنمو المحوري، والتوجيه من خلايا العقدة الشبكية (RGCs) على حد سواء في الجسم الحي وفي المختبر. هنا ، نصف طريقة لتصوير مستويات H2O2 داخل الخلايا في الخلايا العصبية المستزرعة حمار وحشي ويرقات كاملة أثناء التطوير باستخدام جهاز الاستشعار الحيوي H2O2المشفر وراثيا ، roGFP2-Orp1. يمكن التعبير عن هذا المسبار بشكل عابر أو ثابت في يرقات حمار وحشي. وعلاوة على ذلك، يقلل قراءات قياس النسب من احتمال اكتشاف القطع الأثرية بسبب التعبير الجيني التفاضلي أو آثار الحجم. أولا، نحن نظهر كيفية عزل وزراعة RGCs المستمدة من أجنة حمار وحشي التي تعبر عن عابر roGFP2-Orp1. ثم نستخدم يرقات كاملة لمراقبة مستويات H2O2 على مستوى الأنسجة. وقد تم التحقق من صحة جهاز الاستشعار بإضافة H2O2. بالإضافة إلى ذلك، يمكن استخدام هذه المنهجية لقياس مستويات H2O2 في أنواع خلايا وأنسجة محددة عن طريق توليد معدلة وراثيا مع تعبير حساس حيوي خاص بالأنسجة. وبما أن سمك الحمار الوحشي يسهل التلاعب الجيني والتنموي، فإن النهج الذي يظهر هنا يمكن أن يكون بمثابة خط أنابيب لاختبار دور H2O2 أثناء التطور العصبي والجنيني العام في الفقاريات.
Introduction
أنواع الأكسجين التفاعلية (ROS) الإشارات ينظم تطوير وأداء الجهاز العصبي1. مصدر ROS الخلوية الهامة هي NADPH oxidases (NOX)، والتي هي بروتينات ترانسميمبرين توليد سوبر أكسيد وبيروكسيد الهيدروجين (H2O2)2. توجد إنزيمات NOX في جميع أنحاء الجهاز العصبي المركزي (CNS) ، ويساهم ROS المشتقة من NOX في تطوير الخلايا العصبية3و4و5و6. وقد ثبت صيانة وتمايز الخلايا الجذعية العصبية، وإنشاء قطبية الخلايا العصبية، و نمو نيوريت، و اللدونة متشابك تتطلب مستويات كافية من ROS7،8،9،10،11. من ناحية أخرى، إنتاج غير المنضبط من ROS بواسطة NOXes تسهم في الاضطرابات العصبية بما في ذلك مرض الزهايمر، والتصلب المتعدد، وإصابات الدماغالرضية 12،13،14. وبالتالي، فإن إنتاج ROS ذات الصلة من الناحية الفسيولوجية أمر بالغ الأهمية للحفاظ على ظروف صحية.
وقد سهل تطوير أجهزة الاستشعار البيولوجية المشفرة وراثيا الكشف عن ال ROS الخلوية بشكل كبير. ومن المزايا الهامة لأجهزة الاستشعار البيولوجية المشفرة وراثيا زيادة الاستبانة الزمنية والمكانية لإشارة ROS، حيث يمكن استهداف أجهزة الاستشعار هذه على وجه التحديد إلى مواقع متميزة. GFP الحساسة للأكسدة (roGFP) هو نوع واحد من هذه أجهزة الاستشعار الحيوية ROS. البديل roGFP2-Orp1 يكشف على وجه التحديد H2O2 من خلال مجالها Orp1، وهو بروتين الأسرة بيروكسيريدوكسيني الجلوتاثيون من الخميرة15،16. يتم نقل أكسدة البروتين Orp1 إلى roGFP2 لتغيير تشكيله (الشكل 1A). ويعرض المسبار قمتين للإثارة بالقرب من 405 نانومتر و480 نانومتر، وذروة انبعاث واحدة عند 515 نانومتر. عند الأكسدة ، تتغير كثافة الفلورسينس حول قمم الإثارة: في حين يزيد الإثارة 405 نانومتر ، ينخفض 480 نانومتر من الإثارة. وهكذا، roGFP2-Orp1 هو حساس حيوي نسبة، ويتم الكشف عن H2O2-levels بنسبة كثافة الفلورية متحمس في أطوال موجية مختلفة اثنين(الشكل 1B). عموما، roGFP2-Orp1 هو أداة متعددة الاستخدامات للتصوير ROS التي يمكن استخدامها بكفاءة في الجسم الحي.
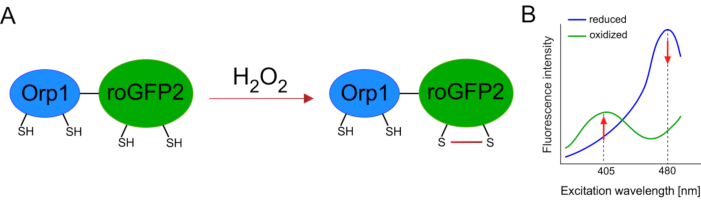
الشكل 1: التمثيل التخطيطي وأطياف الإثارة من roGFP2-Orp1. (A) نقل الأكسدة يحدث بين Orp1 و roGFP2 ردا على H2O2, مما يؤدي إلى تغييرات تشكيلية في roGFP2. (ب) تعرض أطياف الإثارة من roGFP2-Orp1 قمتين للإثارة عند 405 نانومتر و480 نانومتر وذروة انبعاث واحدة عند 515 نانومتر. عند الأكسدة بواسطة H2O2، يزيد الإثارة 405 نانومتر في حين ينخفض 480 نانومتر من الإثارة. ينتج عن ذلك قراءات معدلية لوجود H2O2. تم تعديل الرقم من بيلان وبيلوسوف (2017)16 ومورغان وآخرين (2011)25. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
نظام نموذج دانيو ريو (حمار وحشي) له العديد من المزايا لتطبيق أجهزة الاستشعار البيولوجية المشفرة وراثيا. الشفافية البصرية للأجنة واليرقات تمكن التصوير غير الغازي في الجسم الحي. ويجري تطوير أدوات التصوير الجديدة لتحقيق دقة أعلى وأعمق اختراق17. وعلاوة على ذلك، هناك أدوات راسخة للتلاعب الجيني (التعبير ميرنا خارج الرحم، Tol2 transgenesis، الخ) وتحرير الجينوم (TALENs، CRISPR/Cas9، الخ)، الذي يعزز جيل الحيوانات المعدلةوراثيا 18. كما تتطور أجنة حمار وحشي خارج الأم، وهذا النظام يسمح كذلك سهولة الوصول والتلاعب في الأجنة. على سبيل المثال، يمكن بسهولة حقن المرحلة من خلية واحدة والعلاجات الدوائية.
هنا، استخدمنا حمار وحشي للتعبير عن عابر H2O2-محددة الاستشعار الحيوي roGFP2-Orp1 عن طريق حقن في الحمض النووي الريبي المختبرة المنسوخة. ويمكن استخدام هذه الأجنة في كل من التصوير المختبري للخلايا العصبية المستزرعة والتصوير في الجسم الحي (الشكل 2). نحن نصف بروتوكولا لتشريح وصفيح خلايا العقدة الشبكية (RGCs) من أجنة حمار وحشي يليه تقييم H2O2-levels في الخلايا العصبية المستزرعة. ثم نقدم طريقة للتصوير الحي للأجنة واليرقات المعبرة عن roGFP2-Orp1 باستخدام المجهر البؤري. هذا النهج لا يسمح فقط لتحديد الفسيولوجية H2O2-مستويات ولكن أيضا التغيرات المحتملة التي تحدث في مراحل النمو المختلفة أو الظروف. بشكل عام، يوفر هذا النظام طريقة موثوقة للكشف عن H2O2 في الخلايا الحية والحيوانات لدراسة دور H2O2 في التنمية والصحة والمرض.
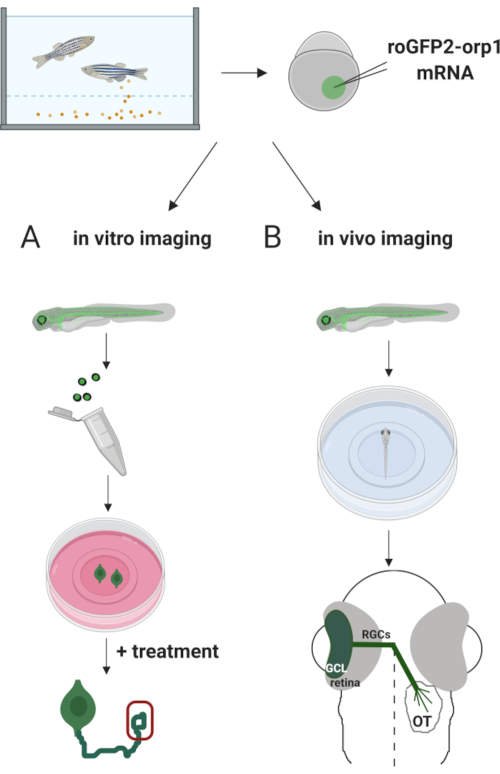
الشكل 2. الخطوط العريضة للنهج التجريبي. لفترة وجيزة، بعد جمع الأجنة، يتم حقن roGFP2-Orp1 مرنا في صفار من خلية واحدة مرحلة أجنة حمار وحشي. يمكن استخدام الأجنة النامية لكل من (أ) في المختبر و (ب) في التصوير الحي. (أ)تستخدم الأجنة الإيجابية GFP لتشريح شبكية العين لجمع RGC في 34 hpf. لوحات RGCs المفككة على أغطية مغلفة ب PDL/laminin في وسائط ZFCM (+). يمكن إجراء تصوير مخروط النمو حيث تقوم RGCs بتوسيع محاورها المحورية بعد 6-24 ساعة من الطلاء. يمكن أن تخضع الخلايا لعلاجات مختلفة لقياس التغيرات المحتملة في H2O2-levels. هنا، قمنا بقياس H2O2-مستويات في المخاريط نمو RGCs (الأحمر). (ب)تستخدم الأجنة الإيجابية GFP للتصوير في الجسم الحي. في العمر المطلوب، يمكن تخدير الأجنة وتركيبها على أطباق قاع زجاجية مقاس 35 ملم للتصوير البؤري. هنا، يتم تركيب الأجنة بطنية لتصوير الشبكية. التخطيطي يظهر تطور الشبكية في حمار وحشي. تشكل RGCs طبقة خلايا العقدة (GCL) ، وهي الطبقة الأعمق في شبكية العين. محاور RGC تتطور إلى العصب البصري لعبور خط الوسط، وتشكيل chiasm البصرية. ثم، محاور RGC تنمو ظهريا لجعل نقاط الاشتباك العصبي في استئصال البصرية في الدماغ المتوسط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تمت مراجعة جميع التجارب على الحيوانات أخلاقيا والموافقة عليها من قبل لجنة بوردو لرعاية الحيوانات واستخدامها (PACUC) ، وفقا للمبادئ التوجيهية للمعهد الوطني للصحة مع البروتوكول 2006002050 الموافقة عليه في 07/24/2020.
1. إعداد الحلول
- E2 وسائل الإعلام (1x)
- إعداد حلول E2A 100x (500 مل) و500x E2B (100 مل) و500x E2C (100 مل) من خلال الجمع بين جميع المكونات الموضحة في الجدول 1. حلول Autoclave E2A و E2B و E2C. يخزن عند درجة حرارة 4 درجات مئوية.
- لوسائط 1x E2: اجمع 5 مل من 100x E2A و1 مل من 500x E2B و1 مل من 500x E2C. رفع حجم إلى 500 مل مع الماء العقيم. ضبط درجة الحموضة إلى 7.0-7.5.
- إعداد 50 مل aliquots من 1x E2 متجر وسائل الإعلام في -20 درجة مئوية للتخزين على المدى الطويل. ومع ذلك، يمكن أن تحدث هطول الأمطار عند ذوبان الجليد. تأكد من ذوبان الأمطار بالكامل قبل استخدام محلول المخزون.
| حل | مكون | مبلغ | تركيز |
| 100X E2A (500 مل) | |||
| ناكل | 43.8 غرام | 1500 متر في اليوم | |
| KCl | 1.88 غرام | 50 مليون متر | |
| مغسو4 | 6 جم | 100 مليون متر | |
| KH2PO4 | 1.03 غرام | 15 مليون متر | |
| Na2HPO4 | 0.34 غرام | 5 مليون متر | |
| 500X E2B (100 مل) | |||
| كاكلين2 | 5.5 غرام | 500 مليون متر | |
| 500X E2C (100 مل) | |||
| ناهكو3 | 3 جم | 350 مليون متر | |
| 1X E2 (500 مل) | |||
| 100X E2A | 5 مل | 1X | |
| 500X E2B | 1 مل | 1X | |
| 500X E2C | 1 مل | 1X |
الجدول 1: مكونات وسائط 1x E2 لثقافة خلايا سمك الحمار الوحشي.
- E3 وسائل الإعلام (1x)
- حل المكونات في الماء العقيم 1 لتر كما هو مبين في الجدول 2 لجعل المخزون 100x. تمييع المخزون في الماء العقيم لجعل وسائل الإعلام 1x E3.
- أضف 0.2٪ الميثيلين الأزرق. ل20 مل من وسائط E3 1x، أضف 40 ميكرولتر من أزرق الميثيلين.
- جعل دفعة أخرى دون الميثيلين الأزرق للتصوير الفلورسنت.
| مكون | المبلغ (ز) | التركيز في مخزون 100X (mM) |
| ناكل | 29.22 | 500 |
| KCl | 1.26 | 17 |
| كاكلين2 2H2O | 4.85 | 33 |
| MgSO4 7H2O | 8.13 | 33 |
الجدول 2: مكونات وسائط E3 100x للحفاظ على أجنة حمار وحشي.
- محلول مخزون ملحي 80x
- اجمع جميع المكونات المعروضة في الجدول 3. إضافة الماء لجعل محلول 100 مل. اخلط حتى يتم حل جميع المكونات. تخزين الحل عند 4 °C.
| مكون | المبلغ (ز) | التركيز في المخزون (mM) |
| الجلوكوز | 1.44 | 80 |
| الصوديوم بيروفات | 0.44 | 40 |
| كاكلين2 2H2O | 0.148 | 10 |
| هيبس | 6.1 | 256 |
الجدول 3: مكونات محلول ملحي 80x لوسائط استزراع خلايا الحمار الوحشي.
- زيبرافيش خلية الثقافة المتوسطة (ZFCM +)
- اجمع جميع المكونات المعروضة في الجدول 4 لإنشاء وسائط سعة 250 مل. ضبط درجة الحموضة إلى 7.5. تصفية الوسائط باستخدام فلتر 0.22 ميكرومتر وتخزينها عند 4 درجات مئوية.
| مكون | المبلغ (مل) | حجم النسبة المئوية |
| L-15 المتوسطة (مع فينول الأحمر) | 212.75 | 85.1 |
| مصل الأبقار الجنيني (FBS) | 5 | 2 |
| البنسلين/ستريبتومايسين | 1 | 0.4 |
| محلول ملحي 80X | 3.125 | 1.25 |
| الماء | 28.125 | 11.25 |
الجدول 4: مكونات خلية حمار وحشي زراعة المتوسطة مع المصل والمضادات الحيوية.
- زيبرافيش خلية ثقافة المتوسطة للتصوير (ZFCM-)
- اجمع جميع المكونات المعروضة في الجدول 5 لإنشاء وسائط سعة 250 مل. ضبط درجة الحموضة إلى 7.5. تصفية الوسائط باستخدام عامل تصفية 0.22 ميكرومتر.
- جعل aliquots استخدام واحد (50 مل دفعات) لمنع التلوث. ابق عند 4 درجة مئوية
| مكون | المبلغ (مل) | حجم النسبة المئوية |
| L-15 المتوسطة (لا الفينول الأحمر) | 212.75 | 85.1 |
| محلول ملحي 80X | 3.125 | 1.25 |
| الماء | 34.125 | 13.65 |
الجدول 5: مكونات خلية حمار وحشي ثقافة المتوسطة دون المصل والمضادات الحيوية للتصوير في المختبر.
- قوالب الحقن
- حل 1.5٪ agarose في وسائل الإعلام E3. صب ~ 25 مل من الآجروز في طبق بيتري 100 × 15 ملم.
- وضع القالب على رأس agarose مع زاوية 45 درجة فيما يتعلق بالسطح، والسماح لها تطفو على agarose مع حركة بطيئة. وهذا سوف يساعد على تجنب الفقاعات. دع الآغاروز يبرد ويترسخ على قمة مقاعد البدلاء.
- مرة واحدة توطدت تماما، وإزالة القالب ببطء لمنع كسر الآغروز. إضافة وسائل الإعلام E3 الطازجة، إضافة فيلم البارافين حول الطبق لمنع الانسكابات، وتخزينها في 4 درجة مئوية ( الشكل 3).
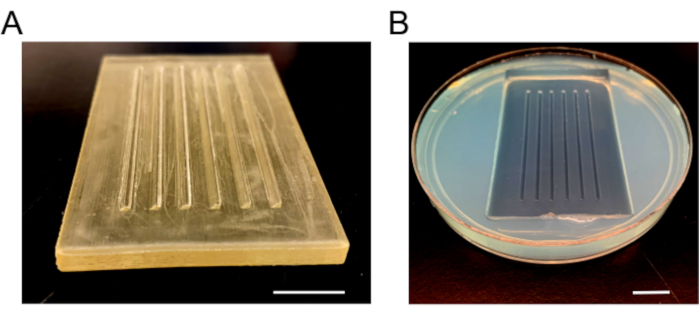
الشكل 3: حقن صور العفن. (أ) القالب البلاستيكي الذي يستخدم لجعل لوحات الحقن. يحتوي القالب على ستة سلالم ، واحد 90 درجة وجانب واحد مشطوف 45 درجة لعقد الأجنة في مكانها. (ب) لوحة الحقن بعد إزالة agarose الصلبة والعفن. أشرطة المقياس = 1 سم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
2. إعداد وحقن roGFP2-Orp1 مرنا
ملاحظة: تم الحصول على بناء roGFP2-Orp1 من الدكتور توبياس ديك، DKFZ، ألمانيا. تم استنساخه من الباطن في ناقلات pCS2 + في مختبر الدكتور تشينغ دينغ ، جامعة بوردو. لمنع تدهور من قبل RNase، يجب اتخاذ العديد من الاحتياطات. يجب استخدام الكواشف والأنابيب الخالية من RNase في جميع الأوقات ، ويجب ارتداء القفازات لجميع الخطوات ، وبدلا من ذلك ، يمكن مسح المواد والأسطح باستخدام عامل تنظيف لإزالة RNase.
- linearize 3-10 ميكروغرام من pCS2 + / roGFP2 - Orp1 المتجه مع نوتي.
- تنقية البلازميد الخطي مع مجموعة تنظيف PCR.
- في المختبر نسخ roGFP2-Orp1 مرنا مع عدة النسخ في المختبر وفقا للتعليمات المقدمة من قبل الشركة المصنعة.
- تجميع رد فعل النسخ المتوج
- وضع البوليميراز الحمض النووي الريبي والحمض النووي الخطي / تنقية على الجليد. دوامة 10x رد فعل العازلة و 2x NTP / CAP حتى تكون تماما في الحل. تخزين NTP / CAP على الجليد ولكن الحفاظ على العازلة في درجة حرارة الغرفة (RT) أثناء تجميع رد الفعل. قم بتدريج جميع الكواشف قبل فتح الأنابيب لمنع التلوث.
- إعداد رد فعل تخليق الحمض النووي الريبي بالترتيب المشار إليه أدناه في RT في أنبوب طرد مركزي خال من RNase سعة 0.5 مل. الحجم النهائي للتفاعل هو 20 ميكرولتر. يظهر إعداد رد الفعل في الجدول 6.
- إضافة 10 ميكرولتر من مزيج ريبونوكليوتيد، 2x NTP/CAP، والمياه الخالية من النيوكليز، إذا لزم الأمر إلى الأنبوب. إضافة 2 ميكرولتر 10X رد فعل العازلة. أضف 1-1.5 ميكروغرام من الحمض النووي الخطي (حتى 6 ميكرولتر). إذا لزم الأمر، إضافة المياه الخالية من النيوكليز لتعويض حجم رد فعل 20 ميكرولتر.
- أغلق الأنبوب، دوامة لفترة وجيزة واللمس تدور microfuge. إضافة 2 ميكرولتر من مزيج إنزيم SP6 10x. أغلق بنقرة إصبع وتدور باللمس في حيلة صغيرة.
- ضعه في 37 درجة مئوية لمدة 2-2.5 ساعة (يمكن أن ترتفع إلى 18 ساعة).
ملاحظة: في التجربة المقدمة بين عشية وضحاها تم تنفيذ الحضانة 16-18 ساعة في 37 درجة مئوية للحصول على أفضل النتائج. - أضف 1 ميكرولتر من DNase لإزالة قالب الحمض النووي، وانقر على الإصبع، والمس الدوران، واحتضانه عند 37 درجة مئوية لمدة 15 دقيقة.
- تجميع رد فعل النسخ المتوج
| الكاشف | حجم الصوت (ميكرولتر) | المبلغ في رد فعل |
| 2X NTP/ CAP | 10 | 1X |
| 10X رد فعل المخزن المؤقت | 2 | 1X |
| قالب الحمض النووي | حتى 6 | 1-1.5 ميكروغرام |
| مياه خالية من النيوكليز | إضافة لجعل 20 ميكرولتر | |
| 10X SP6 مزيج الانزيم | 2 | 1X |
الجدول 6: إعداد رد الفعل لroGFP2-Orp1 مرنا في النسخ المختبري.
- انتعاش الحمض النووي الريبي
- إضافة 25 ميكرولتر من كلوريد الليثيوم (LiCl) المقدمة في عدة النسخ في المختبر. ضعه عند -20 درجة مئوية في ثلاجة غير متجمدة لمدة 30 دقيقة على الأقل.
- تدور لمدة 25 دقيقة بأقصى سرعة في جهاز طرد مركزي الطاولة في 4 °C. إزالة والتخلص من supernatant بعناية، حتى لا يزعج بيليه. إضافة 25 ميكرولتر من الإيثانول البارد 75٪ وتدور لمدة 5 دقائق في 4 درجة مئوية.
- إزالة بعناية وتجاهل supernatant. دع هواء بيليه يجف لمدة 5 دقائق على الأقل في RT. لا تدع أكثر من الجافة. أضف 12 ميكرولتر من النيوكليز الخالي من مخزن Tris-EDTA المؤقت (TE) (درجة الحموضة 7.0) والحفاظ على العينة على الجليد.
- قياس تركيز الحمض النووي الريبي مع مطياف. 0.5- عادة ما يتم الحصول على 1 ميكروغرام / ميكرولتر.
- إعداد 100 نانوغرام / μL مرنا في محلول فينول الأحمر (0.5٪ فينول الأحمر في ملحي الفوسفات المخزنة بالفوسفات دولبيكو -DPBS) وaliquot للاستخدام واحد (3-5 ميكرولتر). تخزين aliquots مرنا في - 80 °C.
- الميكروبيكشن من مرنا
- في يوم الحقن، استخدم أحد المغذيات الرنا واتبع بروتوكول حقن جنين حمار وحشي لحقن 1 nL من مرنا في الأجنة مرحلة خلية واحدة من خلال صفاربهم 19. ويرد أدناه وصف موجز.
- تربية الأسماك الكبار وجمع الأجنة كما وصف سابقا20.
- سحب الإبر microinjection مع سحب ماصة. قطع غيض من الإبر مع ملقط لإنشاء فتحة تلميح 10 ميكرومتر.
- محاذاة الأجنة في قالب الحقن التي وصفت في الخطوة 1.6.
- حقن 1 nL من مرنا في فينول الأحمر مع ماصة microinjection الزجاج.
- جمع الأجنة والاحتفاظ بها في وسائل الإعلام E3.
- احتفظ بالأجنة في حاضنة 27 درجة مئوية في وسائط E3 حتى يتم تحقيق مرحلة النمو المطلوبة. يمكن استخدام الأجنة المحقونة في المختبر (القسم 3 والقسم 4) وفي التصوير الحي (القسم 5). يمكن اختيار الأجنة التي تعبر عن roGFP2-Orp1 مسبقا قبل إجراء التجارب باستخدام مجهر تشريح منتظم مجهز بضوء فلوري ومجموعة فلتر زرقاء /خضراء.
3. الأولية الشبكية خلية العقدة ثقافة المستمدة من أجنة حمار وحشي
ملاحظة: هذا البروتوكول مقتبس من أسلوب منشور مسبقا 21. تنفيذ الخطوات 3.1 و 3.2 في غطاء محرك السيارة تدفق صفح.
- إعداد الأغطية
- إعداد لوحات الثقافة 4-6 في كل تجربة. استخدام الأغطية تنظيفها بالأحماض (22 × 22 ملم مربع؛ 0.16-0.19 مم سمك) التي يتم تخزينها في الإيثانول 100٪.
- إزالة غطاء واحد من حاوية التخزين باستخدام ملقط واللهب لإزالة الإيثانول المتبقية.
- الهواء يجفف الغطاء تماما عن طريق وضعه في زاوية داخل طبق ثقافة 35 ملم.
- إعداد محلول عمل Poly-D-Lysine (PDL) (1x) عن طريق تخفيف مخزون 10x (5 ملغم / مل) في الماء العقيم.
- تطبيق 100 ميكرولتر من 0.5 ملغ / مل PDL إلى مركز كل coverslip وتجنب انتشار الحل إلى حواف.
- احتضان PDL على coverlips لمدة 20-30 دقيقة في درجة حرارة الغرفة (RT). تأكد من أن PDL لا تجف.
- اغسل PDL بماء معقم 0.5 مل ثلاث مرات. دع الأطباق تجف تماما.
- إعداد حل عمل صفمين (1x) عن طريق تخفيف المخزون 50x (1 ملغ / مل) في برنامج تلفزيوني 1x.
- تطبيق 100 ميكرولتر من 20 ميكروغرام / مل صفمين في برنامج تلفزيوني إلى مركز كل coverslip وتجنب انتشار الحل إلى حواف.
- احتضان لوحات في 37 درجة مئوية في حاضنة مرطب لمدة 2-6 ساعة. تجنب تجفيف محلول صفح.
- تشريح الأجنة والطلاء RGCs
- إعداد وتسمية أربعة أطباق زراعة الأنسجة 35 ملم وملء مع 4 مل من: 70٪ الإيثانول، "E2 وسائل الإعلام 1"، "E2 وسائل الإعلام 2"، "E2 وسائل الإعلام 3" في يوم تشريح. احتفظ بالأطباق في الثلاجة حتى تشريحها.
- عندما تكون أجنة حمار وحشي 34 ساعة بعد الإخصاب (hpf)، واتخاذ أطباق الثقافة المغلفة مع صفمين من الحاضنة وغسل coverlips ثلاث مرات مع 0.5 مل من برنامج تلفزيوني 1x.
- بعد الغسيل النهائي، أضف 4 مل من وسائط ZFCM(+) إلى كل طبق ثقافة وتجنب تجفيف الطبق.
- استرجع أطباق الثقافة المعدة من الخطوة 3.2.1. دعهم equilibrate إلى RT.
- املأ أنابيب PCR 4-6 مع 15 ميكرولتر من وسائط ZFCM(+). هناك حاجة إلى أنبوب واحد لإعداد RGCs من 4 عيون لتكون مطلية على غطاء واحد.
- استرجاع أجنة حمار وحشي من الحاضنة وتزج الأجنة في طبق زراعة الأنسجة 35 ملم تحتوي على 70٪ الإيثانول لمدة 5-10 ق لتعقيم.
- باستخدام ماصة نقل، نقل الأجنة إلى E2 Media 1 طبق يحتوي على وسائل الإعلام E2 العقيمة لغسل الإيثانول الزائد.
- نقل الأجنة إلى E2 Media 2 طبق وإزالة chorions مع ملقط حاد.
- نقل الأجنة إلى طبق E2 Media 3 النهائي لإجراء التشريح.
- باستخدام زوج من ملقط غرامة، تشريح شبكية العين كما وصف سابقا 22.
- وضع وعقد الأجنة الأمامية إلى صفار بهم مع واحدة من ملقط وإزالة الذيل الخلفي إلى كيس صفار مع ملقط أخرى.
- الاستيلاء على الرقبة مع ملقط وخلع الرأس لفضح الدماغ والعينين لوسائل الإعلام E2. تجنب قطع كيس الصفار.
- مع غيض من ملقط غرامة، لفة بلطف عيون قبالة من الرأس، في حين عقد الأنسجة الجمجمة إلى أسفل مع ملقط الثاني. إبقاء العينين معزولة عن حطام الأنسجة المجاورة.
- نقل أربع عيون إلى واحد من أنابيب أعدت مسبقا تحتوي على ZFCM(+).
- يتقي بلطف صعودا وهبوطا مع ماصة P20 وطرف أصفر حوالي 45 مرة للخلايا التفكك. تجنب أي فقاعات الهواء.
- نقل ZFCM(+) مع الخلايا المفككة إلى مركز غطاء. كرر الخطوات 10-12 للحصول على أغطية إضافية.
- الحفاظ على الثقافات على مقاعد البدلاء في 22 درجة مئوية على رف رغوة البوليسترين لامتصاص الاهتزازات.
- إجراء التصوير 6-24 ساعة بعد الطلاء.
ملاحظة: استخدام ماصة نقل لنقل الأجنة إلى أطباق ثقافة مختلفة. تغيير ماصة لكل حل لمنع حمل أكثر من الإيثانول (الخطوات 6-8).
4. في المختبر ROS التصوير من الخلايا العصبية RGC المستزرعة
- في يوم التصوير (عادة 6-24 ساعة بعد طلاء الخلايا) ، تحقق من الخلايا تحت المجهر للتحقق من نمو محاور RGC.
- للتصوير بالخلايا الحية، نقل الأغطية من طبق الثقافة إلى غرفة تصوير الخلايا الحية. في هذه الحالة تم استخدام غرفة مفتوحة حسب الطلب ، والتي تم وصفها سابقا23.
- إعداد المجهر للتصوير. استخدم مجهر مقلوب مجهزا بهدف تباين التداخل التفاضلي (DIC) ، ومرشح أحمر طويل التمرير OG590 ، وكاميرا EM-CCD.
- قبل التصوير، استبدل المتوسط ZFCM(+) ب ZFCM(-).
- مرة واحدة يتم وضع الخلايا مع الهدف 10x، والحصول على الصور في التكبير 60x باستخدام هدف الغمر النفط NA عالية. استخدم تكبير إضافي 1.5x.
- أولا، الحصول على صور DIC. ثم، صورة roGFP2-Orp1 باستخدام مجموعة مرشح المناسبة. تثير roGFP2-Orp1 مع مرشحات الإثارة 405/20 و 480/30 نانومتر بالتسلسل والحصول على الصور مع مرشح الانبعاثات 535/30 نانومتر بعد ضوء الانبعاثات قد مرت مرآة ديكهروي 505DCXR.
- بعد التقاط المجموعة الأولى من الصور، تبادل الوسائط مع الوسائط التي تحتوي على حلول علاج مختلفة. يجب تغيير الوسائط كل 30 دقيقة من التصوير لتجنب تغيرات الحموضة والأوسمولارية.
5. في تصوير فيفو روس من الأجنة النامية
- للتصوير في الجسم الحي، احتفظ بالأجنة في وسائط E3 التي تحتوي على 0.003٪ فينيلثيوريوديا (PTU) بدون أزرق الميثيلين من 22-24 حصان. تبادل وسائل الإعلام وإزالة الأجنة الميتة على أساس يومي.
- في العمر المطلوب، تخدير الأجنة في 0.016٪ tricaine. قم بتركيب أجنة مخدرة بنسبة 1٪ من الآغاروز منخفض الذوبان على أطباق ثقافة القاع الزجاجية مقاس 35 مم. يمكن توجيه الأجنة بشكل ظهري أو بطني أو أفقي، اعتمادا على المنطقة ذات الاهتمام للتصوير.
- بعد agarose solidifies، ملء الأطباق مع وسائل الإعلام E3 دون الميثيلين الأزرق /0.016٪ tricaine.
- إعداد المجهر للتصوير. استخدام المجهر المقلوب ليزر المسح confocal. بدلا من ذلك، استخدم مجهرا كونفوجكال مستقيما مجهزا بعدسة غمر بالماء لتصوير الأجنة المثبتة فوق قطرة أغاروز.
- تثير roGFP2-Orp1 مع 405 نانومتر و 488 نانومتر مرشحات الإثارة بالتسلسل والحصول على الصور المقابلة مع مرشحات الانبعاثات في نطاق 515-535 نانومتر.
- الحصول على مداخن z مع سمك مقطع 5 ميكرومتر من خلال الجزء المطلوب من الأجنة. يمكن الاحتفاظ بالأجنة للتصوير في مراحل لاحقة من التطور.
- بعد التصوير، قم بإزالة الأجنة من الآغروز باستخدام ملقط ناعم والحفاظ عليها في الحاضنة حتى العمر المطلوب في الوسائط الخالية من الميثيلين الزرقاء مع وحدة الإرسال الكبرى.
6. تحليل الصور ومعالجتها
- قياس مستويات H2O2 استنادا إلى قيم نسبة 405/480
- استخدام برنامج مناسب لتحليل الصور. تم استخدام برنامج ImageJ هنا لتحليل الصور ومعالجتها.
- فتح DIC، 405/535 و 480/535 الصور في برنامج ImageJ إما عن طريق سحب الملفات أو النقر فوق ملف | فتح. إذا لم يكن قد تم بالفعل، قم بتحويل الصور إلى 32 بت بالنقر فوق صورة | اكتب | 32 بت.
- تحديد منطقة الاهتمام (ROI) باستخدام أداة يدوية حرة من شريط التحكم (جسم الخلية، مخروط النمو، شبكية العين، إلخ). افتح مدير عائد الاستثمار بالنقر فوق تحليل | أدوات | مدير عائد الاستثمار. انقر فوق إضافة في علامة التبويب إدارة عائد الاستثمار لإضافة عائد الاستثمار المعرفة.
- رسم منطقة قريبة من عائد الاستثمار وإضافة عائد استثمار كخلفية. قم بقياس متوسط قيم الخلفية عن طريق تحديد عائد الاستثمار والنقر فوق قياس من علامة التبويب مدير عائد الاستثمار.
- لاحظ متوسط قيم الكثافة من القياس. طرح قيمة الخلفية المتوسطة من الصور الفلورية بالنقر فوق عملية | | الرياضيات طرح. تنفيذ هذه الخطوة لكل من الصور 405/535 و 480/535.
- إضافة قيمة "1" إلى صورة الفلورسنت 480/535 للقضاء على القيم "0" عن طريق النقر فوق عملية | | الرياضيات إضافة دالة قبل حساب النسبة.
- انقر فوق | العملية | حاسبة الصور تقسيم الدالة في ImageJ لتقسيم صورة 405/535 على صورة 480/535 بكسل بكسل. حدد صورة 405/535 ليتم تقسيمها على صورة 480/535. حدد صورة إخراج 32 بت.
- تطبيق عائد الاستثمار إلى صورة النسبة بالنقر أولا على صورة النسبة ثم عائد الاستثمار في علامة التبويب مدير عائد الاستثمار.
- قياس متوسط قيم النسبة من صورة 405/535 إلى صورة 480/535 بالنقر فوق قياس في علامة التبويب مدير عائد الاستثمار.
- قم بالخطوات 6.1.2-6.1.9 للحصول على أكبر عدد ممكن من العينات لإجراء التحليل الإحصائي المناسب.
- عرض صورة النسبة
ملاحظة: هذا الإجراء هو طرح الخلفية خارج العينة وتطبيق جدول بحث عن لون إلى الصورة.- بمجرد إنشاء صورة النسبة في ImageJ في الخطوة 6.1.7.، قم بإنشاء صورة سوداء 32 بت بالنقر فوق ملف | | جديدة صورة.
- تطبيق ROI الذي ترغب في عرض مستويات H2O2 للصورة الجديدة بالنقر أولا فوق الصورة الجديدة ثم عائد الاستثمار من علامة التبويب مدير عائد الاستثمار.
- إنشاء قناع بالنقر فوق تحرير | | التحديد إنشاء قناع.
- تقسيم صورة القناع على 255 لضبط قيمة عائد الاستثمار إلى "1" وستكون قيم الخلفية "0". انقر فوق | العملية | الرياضيات تقسيم واكتب 255.
- ضرب قناع مع صورة النسبة بالنقر فوق عملية | | حاسبة الصور ضرب الدالة. سيؤدي ذلك إلى صورة نسبة مقياس رمادي تظهر عائد الاستثمار فقط.
- تغيير الجدول البحث عن "النار" بالنقر فوق صورة | البحث عن جداول | النار.
ملاحظة: يمكن تطبيق عامل الضرب على كافة الصور للحصول على تصور أفضل للنسبة بالنقر فوق عملية | صورة | ضرب. - تحويل صورة النسبة إلى 8 بت بالنقر فوق صورة | اكتب | 8 بت.
- إضافة شريط المعايرة بالنقر فوق تحليل | أدوات | شريط المعايرة.
النتائج
RGCs حمار وحشي مثقف تمديد محاور في غضون 1D. صورة نسبة 405/480 ممثل H2O2-الاستشعار الحيوي هو مبين في الشكل 4A. جسم الخلية، محور عصبي، ومخاريط النمو مرئية بوضوح في الخلايا العصبية الفردية. يمكن أن تخضع هذه الخلايا العصبية لعلاجات مختلفة مع مرور الوقت لمراقبة H2O2 ...
Discussion
هناك العديد من الخطوات الحاسمة التي تحتاج إلى الاهتمام في جميع أنحاء هذا البروتوكول. ونعتقد أن النظر في هذه النقاط سيحسن التدفق التجريبي. بالنسبة لثقافة RGC الأولية ، فإن عقم ZFCM (-) مهم جدا ، نظرا لأن هذه الوسائط الثقافية لا تحتوي على المضادات الحيوية ويمكن أن يحدث التلوث قبل أو أثناء التصوير...
Disclosures
ويعلن المؤلفون أنه ليس لديهم تضارب في المصالح.
Acknowledgements
وقد دعم هذا العمل المعاهد الوطنية للصحة (المنحة R01NS117701)، والمؤسسة الوطنية للعلوم (المنحة 1146944-IOS)، وصندوق أبحاث الحبل الشوكي وإصابات الدماغ في إنديانا (منحة 20000289)، ومؤسسة أبحاث بوردو (منحة 209911)، ومكتب نائب الرئيس التنفيذي للبحوث والشراكات في جامعة بوردو (منحة 210362). نشكر الدكتور كوري ج. ويفر وهايلي رودر على إنشاء بروتوكول ثقافة سمك الحمار الوحشي RGC. نشكر هالي رودر بالإضافة إلى ذلك على توفير بيانات الشكل 4. نشكر ليا بياسي وكيني نغوين على المساعدة في ثقافة RGC. نشكر جنتري لي لتحرير النص. نشكر الدكتور توبياس ديك لتوفير roGFP2-Orp1 والدكتور تشينغ دينغ لأجهزة الكمبيوتر 2 + ناقلات تحتوي على roGFP2-Orp1. يتم إنشاء الشكل 2 مع Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved