Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nöronal Gelişim Sırasında ROS Canlı Hücre Görüntüleme
Bu Makalede
Özet
Bu protokol, sinir sistemi gelişimi sırasında H 2 O2'ninfizyolojik sinyal rollerini değerlendirmek için kültürlü zebra balığı nöronlarında ve larvalarında genetik olarak kodlanmış bir hidrojen peroksit (H 2 O2)-biyosensör kullanımını açıklar. Farklı hücre tiplerine uygulanabilir ve genel gelişimde reaktif oksijen türlerini (ROS) incelemek için deneysel tedavilerle değiştirilebilir.
Özet
Reaktif oksijen türleri (ROS), normal gelişim, homeostaz ve fizyolojide önemli olan iyi kurulmuş sinyal molekülleridir. Farklı ROS arasında, hidrojen peroksit (H2O2)hücresel sinyalizasyondaki rollerle karakterize edilir. H2O2, çeşitli türlerde gelişim sırasında bulaşmıştır. Örneğin, döllenmeyi takip eden ilk günlerde zebra balığı embriyolarındaH2 O2'de geçici bir artış tespit edilmiştir. Ayrıca, önemli bir hücresel H2O2 kaynağı olan NADPH oksidaz (NOX) tükendi, retinal ganglion hücrelerinin (RGC) hem in vivo hem de in vitrofarklılaşması, aksonal büyümesi ve rehberliği gibi sinir sistemi gelişimini bozar. Burada, genetik olarak kodlanmış H 2 O2 -spesifik biyosensör, roGFP2-Orp1 kullanılarak kültürlü zebra balığı nöronlarında ve tüm larvalarda hücre içi H2O2seviyelerini görüntüleme için bir yöntem açıklıyoruz. Bu prob zebra balığı larvalarında geçici veya stably olarak ifade edilebilir. Ayrıca, oranmetrik okuma, diferansiyel gen ekspresyosu veya hacim etkileri nedeniyle eserleri tespit etme olasılığını azaltır. İlk olarak, geçici olarak roGFP2-Orp1 eksprese eden zebra balığı embriyolarından elde edilen RPC'lerin nasıl izole edildiğini ve kültürlendirılacağını gösteriyoruz. Daha sonra, doku seviyesinde H2O2 seviyelerini izlemek için tüm larvaları kullanırız. Sensör H2O2ilavesi ile doğrulanmıştır. Ek olarak, bu metodoloji dokuya özgü biyosensör ekspresyörü ile transgenik hayvanlar üreterek belirli hücre tiplerinde ve dokulardaH2 O2 seviyelerini ölçmek için kullanılabilir. Zebra balığı genetik ve gelişimsel manipülasyonları kolaylaştırdığı için, burada gösterilen yaklaşım, omurgalılarda nöronal ve genel embriyonik gelişim sırasında H2O2'nin rolünü test etmek için bir boru hattı görevi görebilir.
Giriş
Reaktif oksijen türleri (ROS) sinyali sinir sisteminin gelişimini ve işleyişini düzenler1. Önemli bir hücresel ROS kaynağı, süperoksit ve hidrojen peroksit (H2O 2 )2üreten transmembran proteinleri olan NADPH oksidazlarıdır (NOX). NOX enzimleri merkezi sinir sistemi (CNS) boyunca bulunur ve NOX türevi ROS nöronal gelişime katkıda bulunur3,4,5,6. Sinirsel kök hücrelerin bakımı ve farklılaşması, nöronal polaritenin kurulması, neurit büyümesi ve sinaptik plastisitenin yeterli ROS7, 8,9,10,11seviyelerini gerektirdiği gösterilmiştir. Öte yandan, NOX'ler tarafından kontrolsüz ROS üretimi Alzheimer Hastalığı, multipl skleroz ve travmatik beyin hasarı dahil olmak üzere nörodejeneratif bozukluklara katkıda bulunur12,13,14. Bu nedenle, fizyolojik olarak ilgili ROS üretimi sağlıklı koşulların korunması için kritik öneme sahiptir.
Genetik olarak kodlanmış biyosensörlerin geliştirilmesi hücresel ROS'un tespitini büyük ölçüde kolaylaştırmıştır. Genetik olarak kodlanmış biyosensörlerin önemli bir avantajı, ROS sinyalinin artan zamansal ve mekansal çözünürlüğüdür, çünkü bu sensörler özellikle farklı konumlara hedeflenebilir. Redoks duyarlı GFP (roGFP) bu tür ROS biyosensörlerinin bir türüdür. RoGFP2-Orp1 varyantı özellikle Maya15,16'dan glutatyon peroksitoksin aile proteini olan Orp1 etki alanı aracılığıyla H 2 O2'yi algılar. Orp1 proteininin oksidasyonu, konformasyonunu değiştirmek için roGFP2'ye aktarılır (Şekil 1A). Prob, 405 nm ve 480 nm'ye yakın iki heyecan zirvesi ve 515 nm'de tek bir emisyon zirvesi sergiliyor. Oksidasyon üzerine, heyecan zirvesi etrafındaki floresan yoğunluğu değişir: 405 nm heyecan artarken, 480 nm heyecan azalır. Bu nedenle, roGFP2-Orp1 oranmetrik bir biyosensördür ve H2O2-seviyeleri iki farklı dalga boyunda heyecanlanan floresan yoğunluklarının oranı ile tespit edilir (Şekil 1B). Genel olarak, roGFP2-Orp1, ROS görüntüleme için verimli bir şekilde kullanılabilecek çok yönlü bir araçtır vivo.
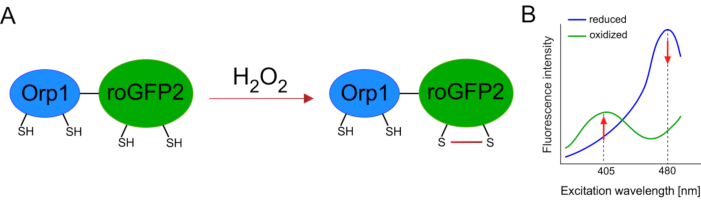
Şekil 1: RoGFP2-Orp1'in şematik gösterimi ve eksitasyon spektrumları. (A) Oksidan transferi, H 2 O 2'ye yanıt olarak Orp1 ve roGFP2 arasındagerçekleşirve roGFP2'de konformasyon değişikliklerine yol meydana gelir. (B) RoGFP2-Orp1'in heyecan spektrumu, 405 nm ve 480 nm'de iki heyecan zirvesi ve 515 nm'de tek emisyon zirvesi sergiler. H 2 O2ileoksidasyonüzerine, 405 nm ekscitasyon artarken 480 nm heyecan azalır. Bu, H2O2 varlığı için oranmetrik bir okuma ile sonuçlanır. Rakam Bilan ve Belousov (2017)16 ve Morgan ve ark. (2011)25'ten değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Danio rerio (zebra balığı) model sistemi, genetik olarak kodlanmış biyosensörleri uygulamak için çeşitli avantajlara sahiptir. Embriyoların ve larvaların optik şeffaflığı invaziv olmayan in vivo görüntülemeyi mümkün hale sağlar. Daha yüksek çözünürlük ve daha derin penetrasyon elde etmek için yeni görüntüleme araçları geliştirilmektedir17. Ayrıca, transgenik hayvanların neslini destekleyen genetik manipülasyon (ektopik mRNA ekspresyözü, Tol2 transgenez, vb.) ve genom düzenleme (TALENler, CRISPR / Cas9, vb.) için yerleşik araçlar vardır18. Zebra balığı embriyoları anne dışında geliştikçe, bu sistem embriyoların daha kolay erişmesini ve manipülasyonuna izin verir. Örneğin, tek hücreli aşama enjeksiyonları ve ilaç tedavileri kolayca yapılabilir.
Burada zebra balığını, H 2 O2'yeözgü biyosensör roGFP2-Orp1'i tüp bebekli mRNA enjekteederekgeçici olarak ifade etmek için kullandık. Bu embriyolar hem kültürlü nöronların in vitro görüntülemesi hem de in vivo görüntüleme için kullanılabilir ( Şekil2). Zebra balığı embriyolarından retinal ganglion hücrelerinin (RGC) parçalanıp kaplatılmasını ve ardından kültürlü nöronlarda H2O2seviyelerinin değerlendirilmesini içeren bir protokol açıklıyoruz. Daha sonra konfokal mikroskopi kullanarak roGFP2-Orp1 ekspresyaklı embriyo ve larvaların in vivo görüntüleme yöntemi sunuyoruz. Bu yaklaşım sadece fizyolojik H2O2seviyelerinin belirlenmesine izin vermekle kalmaz, aynı zamanda farklı gelişim aşamalarında veya koşullarında meydana gelen potansiyel değişiklikleri de belirler. Genel olarak, bu sistem H 2 O2'ningelişim, sağlık ve hastalıktaki rolünü incelemek için canlı hücrelerde ve hayvanlarda H2O2'yi tespit etmek için güvenilir bir yöntem sağlar.
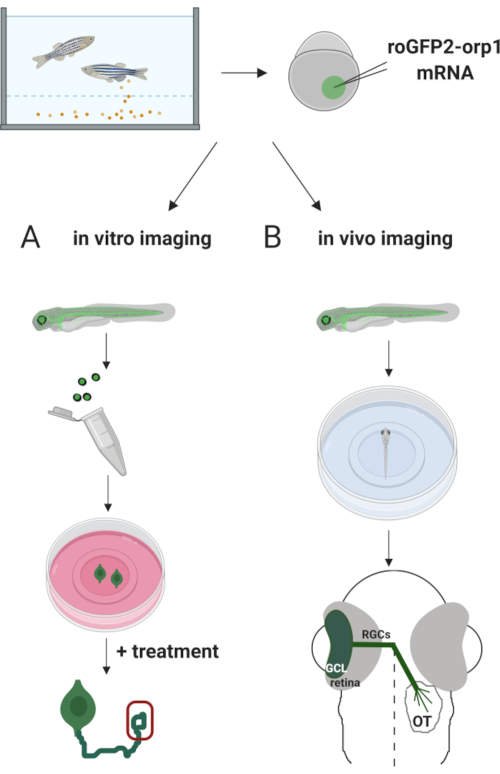
Şekil 2. Deneysel yaklaşımın ana hatları. Kısaca embriyo toplanmasından sonra roGFP2-Orp1 mRNA tek hücreli evre zebra balığı embriyolarının sarısına enjekte edilir. Gelişmekte olan embriyolar hem (A) in vitro hem de (B) in vivo görüntüleme için kullanılabilir. (A) GFP pozitif embriyolar 34 hpf'de RGC koleksiyonu için retinaları parçalamak için kullanılır. Ayrışmış RFC'ler ZFCM (+) ortamlarında PDL/laminin kaplı coverlips üzerine kaplanmıştır. RGC'ler 6-24 saat kaplamadan sonra aksonlarını uzattıkça büyüme konisi görüntülemesi yapılabilir. Hücreler, H2O2seviyelerindeki olası değişiklikleri ölçmek için farklı tedavilere tabi tutulabilir. Burada RGC'lerin (kırmızı) büyüme konilerindeH2 O2seviyelerini ölçtük. (B) In vivo görüntüleme için GFP pozitif embriyolar kullanılır. İstenilen yaşta embriyolar uyuşturulabilir ve konfokal görüntüleme için 35 mm cam dip yemeklerine monte edilebilir. Burada embriyolar retina görüntüleme için ventral olarak monte edilir. Şematik zebra balıklarında retina gelişimini gösterir. RGC'ler retinadaki en iç katman olan ganglion hücre tabakasını (GCL) oluşturur. RGC aksonları orta çizgiyi geçmek için optik sinire dönüşür ve optik chiasm oluşturur. Daha sonra, RGC aksonları, orta beyindeki optik tectum'da sinaps yapmak için dorsally büyür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Tüm hayvan deneyleri, 07/24/2020 tarihinde onaylanan protokol 2006002050 NIH yönergelerine uyularak Purdue Hayvan Bakım ve Kullanım Komitesi (PACUC) tarafından etik olarak gözden geçirilmiş ve onaylanmıştır.
1. Çözümlerin hazırlanması
- E2 ortam (1x)
- Tablo 1'de gösterilen tüm bileşenleri birleştirerek 100x E2A (500 mL), 500x E2B (100 mL) ve 500x E2C (100 mL) çözümleri hazırlayın. Autoclave E2A, E2B ve E2C çözümleri. 4 °C'de saklayın.
- 1x E2 ortam için: 100x E2A'nın 5 mL'si, 500x E2B'nin 1 mL'si ve 500x E2C'nin 1 mL'si birleştirin. Steril su ile hacmi 500 mL'ye getirin. pH'ı 7,0-7,5 olarak ayarlayın.
- Uzun süreli depolama için -20 °C'de 1x E2 medya deposundan 50 mL aliquot hazırlayın. Ancak, çözülme üzerine yağışlar meydana gelebilir. Stok çözeltisini kullanmadan önce yağışın tamamen çözüldüğünden emin olun.
| çözüm | parça | miktar | konsantrasyon |
| 100X E2A (500mL) | |||
| NaCl | 43,8 g | 1500 mM | |
| Kartal | 1,88 g | 50 mM | |
| MgSO4 | 6 g | 100 mM | |
| KH2PO4 | 1,03 g | 15 mM | |
| Na2HPO4 | 0,34 g | 5 mM | |
| 500X E2B (100 mL) | |||
| CaCl2 | 5,5 g | 500 mM | |
| 500X E2C (100 mL) | |||
| NaHCO3 | 3 g | 350 mM | |
| 1X E2 (500 mL) | |||
| 100X E2A | 5 mL | 1 Kat | |
| 500X E2B | 1 mL | 1 Kat | |
| 500X E2C | 1 mL | 1 Kat |
Tablo 1: Zebra balığı hücre kültürü için 1x E2 ortamın bileşenleri.
- E3 Medya (1x)
- 100x stok yapmak için bileşenleri Tablo 2'de gösterildiği gibi 1 L steril suda çözün. 1x E3 ortam yapmak için stoğu steril suda seyreltin.
- % 0.2 metilen mavisi ekleyin. 20 mL 1x E3 ortam için 40 μL metilen mavisi ekleyin.
- Floresan görüntüleme için metilen mavisi olmadan başka bir parti yapın.
| parça | Tutar (g) | 100X stokta konsantrasyon (mM) |
| NaCl | 29.22 | 500 |
| Kartal | 1.26 | 17 |
| CaCl2 2H2O | 4.85 | 33 |
| MgSO4 7H2O | 8.13 | 33 |
Tablo 2: Zebra balığı embriyolarının bakımı için 100x E3 ortamın bileşenleri.
- 80x tuzlu su stok çözeltisi
- Tablo 3'te gösterilen tüm bileşenleri birleştirin. 100 mL çözelti yapmak için su ekleyin. Tüm bileşenler çözülene kadar karıştırın. Çözeltiyi 4 °C'de saklayın.
| parça | Tutar (g) | Stokta konsantrasyon (mM) |
| glikoz | 1.44 | 80 |
| Sodyum Piruvat | 0.44 | 40 |
| CaCl2 2H2O | 0.148 | 10 |
| HEPES | 6.1 | 256 |
Tablo 3: Zebra balığı hücre kültürü ortamı için 80x tuzlu su çözeltisinin bileşenleri.
- Zebra balığı hücre kültürü ortamı (ZFCM+)
- 250 mL ortam oluşturmak için Tablo 4'te gösterilen tüm bileşenleri birleştirin. pH'ı 7,5'e ayarlayın. 0,22 μm filtre kullanarak ortamı filtreleyin ve 4 °C'de saklayın.
| parça | Tutar (mL) | Birim % |
| L-15 orta (fenol kırmızısı ile) | 212.75 | 85.1 |
| Fetal Sığır Serumu (FBS) | 5 | 2 |
| Penisilin/Streptomisiin | 1 | 0.4 |
| 80X Tuzlu su çözeltisi | 3.125 | 1.25 |
| Su | 28.125 | 11.25 |
Tablo 4: Zebra balığı hücre kültürünün bileşenleri serum ve antibiyotiklerle orta.
- Görüntüleme için Zebra balığı hücre kültürü ortamı (ZFCM-)
- 250 mL ortam yapmak için Tablo 5'te gösterilen tüm bileşenleri birleştirin. pH'ı 7,5'e ayarlayın. 0,22 μm filtre kullanarak filtre ortamı.
- Kirlenmeyi önlemek için tek kullanımlık aliquots (50 mL partiler) yapın. 4 °C'de tutun.
| parça | Tutar (mL) | Birim % |
| L-15 orta (fenol kırmızısı yok) | 212.75 | 85.1 |
| 80X Tuzlu su çözeltisi | 3.125 | 1.25 |
| Su | 34.125 | 13.65 |
Tablo 5: Zebra balığı hücre kültürünün bileşenleri in vitro görüntüleme için serum ve antibiyotik içermeyen ortamlar.
- Enjeksiyon kalıpları
- E3 medyasında %1,5 agarose çözün. 100 x 15 mm Petri kabına ~ 25 mL agarose dökün.
- Kalıbı yüzeye göre 45 ° açıyla agarose'un üzerine yerleştirin ve ağır çekimle agarose üzerinde yüzmesine izin verin. Bu kabarcıklardan kaçınmaya yardımcı olacaktır. Agarose soğumaya bırakın ve tezgah üstünde katılanın.
- Tamamen katılaştıktan sonra, agarose kırılmasını önlemek için kalıbı yavaşça çıkarın. Taze E3 ortamı ekleyin, dökülmeleri önlemek için yemeğin etrafına parafin filmi ekleyin ve 4 °C'de saklayın (Şekil 3).
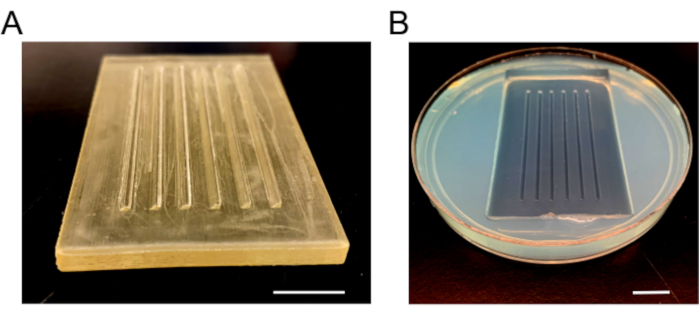
Şekil 3: Enjeksiyon kalıp görüntüleri. (A) Enjeksiyon plakaları yapmak için kullanılan plastik kalıp. Kalıp, embriyoları yerinde tutmak için bir 90 ° ve bir 45 ° eğimli olmak üzere altı rampaya sahiptir. (B) Agarose katılaştıktan ve küf çıkarıldıktan sonra enjeksiyon plakası. Ölçek çubukları = 1 cm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. RoGFP2-Orp1 mRNA hazırlanması ve enjeksiyonu
NOT: roGFP2-Orp1 yapısı Dr. Tobias Dick, DKFZ, Almanya'dan alınmıştır. Purdue Üniversitesi Dr. Qing Deng'in Laboratuvarı'nda pCS2+ vektörüne alt klonlanmış. RNase tarafından bozulmayı önlemek için çeşitli önlemler alınmalıdır. RNase içermeyen reaktifler ve tüpler her zaman kullanılmalı, tüm adımlar için eldiven giyilmelidir ve alternatif olarak, malzemeler ve yüzeyler RNase çıkarılması için bir temizlik maddesi ile silinebilir.
- 3-10 μg pCS2+/roGFP2-Orp1 vektörü NotI ile doğrusallaştırın.
- Doğrusallaştırılmış plazmidi PCR temizleme kiti ile arındırın.
- In vitro, roGFP2-Orp1 mRNA'yı üretici tarafından sağlanan talimatlara göre bir in vitro transkripsiyon kiti ile yazıya dökebilir.
- Kapaklı transkripsiyon reaksiyon tertibatı
- RNA polimeraz ve doğrusallaştırılmış/saflaştırılmış DNA'yı buza yerleştirin. Vortex 10x reaksiyon tamponu ve 2x NTP/CAP tamamen çözüme geçene kadar. NTP/CAP'i buzda saklayın, ancak reaksiyonu monte ederken tamponu oda sıcaklığında (RT) tutun. Kirlenmeyi önlemek için tüpleri açmadan önce tüm reaktiflere dokunarak çevirin.
- RNA sentez reaksiyonlarını RT'de RNase içermeyen 0,5 mL santrifüj tüpünde aşağıda belirtilen sırayla ayarlayın. Reaksiyonun son hacmi 20 μL'dir. Reaksiyon kurulumu Tablo 6'da gösterilmiştir.
- Tüpe gerekirse 10 μL ribonükleotid karışımı, 2x NTP/CAP ve çekirdeksiz su ekleyin. 2 μL 10X reaksiyon tamponu ekleyin. 1-1,5 μg doğrusal DNA (6 μL'ye kadar) ekleyin. Gerekirse, 20 μL reaksiyon hacmini oluşturan çekirdeksiz su ekleyin.
- Tüpü kapatın, kısa bir süre girdap ve dokunmatik dönüş mikrofuge. 2 μL 10x SP6 enzim karışımı ekleyin. Bir parmak tıklaması ile kapatın ve bir mikro yakıtta dokunmatik dönüş.
- 2-2,5 saat boyunca 37 °C'ye yerleştirin (18 saate kadar çıkabilir).
NOT: Sunulan deneyde en iyi sonuçlar için 37 °C'de 16-18 saat inkübasyon yapıldı. - DNA şablonunu kaldırmak, parmak tıklaması, dokunmatik döndürme ve 15 dakika boyunca 37 °C'de kuluçkaya yatmak için 1 μL DNase ekleyin.
- Kapaklı transkripsiyon reaksiyon tertibatı
| reaktif | Hacim (μL) | Reaksiyon miktarı |
| 2X NTP/CAP | 10 | 1 Kat |
| 10X Reaksiyon Tamponu | 2 | 1 Kat |
| Şablon DNA'sı | 6'ya kadar | 1-1,5 μg |
| Nükleaz içermeyen su | 20 μL yapmak için ekleyin | |
| 10X SP6 enzim karışımı | 2 | 1 Kat |
Tablo 6: RoGFP2-Orp1 mRNA in vitro transkripsiyon için reaksiyon kurulumu.
- RNA kurtarma
- In vitro transkripsiyon kitine verilen 25 μL lityum klorür (LiCl) ekleyin. -20 °C'de donmayan bir dondurucuya en az 30 dakika yerleştirin.
- 4 °C'de masa üstü santrifüjde maksimum hızda 25 dakika döndürün. Peletin rahatsız olmaması için üstnatantları dikkatlice çıkarın ve atın. 25 μL soğuk % 75 etanol ekleyin ve 4 °C'de 5 dakika döndürün.
- Dikkatlice çıkarın ve üstnatant atın. Pelet havanın RT'de en az 5 dakika kurumasına izin verin. Kurumaya izin vermeyin. 12 μL çekirdeksiz Tris-EDTA (TE) tamponu (pH 7.0) ekleyin ve numuneyi buzda tutun.
- RNA konsantrasyonunu spektrofotometre ile ölçün. Genellikle 0,5- 1 μg/μL elde edilir.
- Fenol kırmızısı çözeltide (Dulbecco'nun fosfat tamponlu salin -DPBS'sinde %0,5 fenol kırmızısı) 100 ng/μL mRNA ve tek kullanımlık aliquot (3-5 μL) hazırlayın. mRNA aliquots'u - 80 °C'de saklayın.
- mRNA'nın mikroenjeksiyon
- Enjeksiyon gününde, mRNA aliquotlarından birini kullanın ve yumurta sarısı19aracılığıyla tek hücreli evre embriyolara 1 nL mRNA enjekte etmek için zebra balığı embriyo enjeksiyon protokolünü izleyin. Aşağıda kısa bir açıklama verilmiştir.
- Yetişkin balıkları yetiştirin ve daha önce açıklandığı gibi embriyoları toplayın20.
- Pipet çekme ile mikroenjeksiyon iğneleri çekin. 10 μm uç açıklığı oluşturmak için iğnelerin ucunu tokmaklarla kesin.
- Embriyoları Adım 1.6'da açıklanan bir enjeksiyon kalıbına hizalayın.
- MRNA'nın 1 nL'sini bir cam mikroenjeksiyon pipet ile fenol kırmızısı olarak enjekte edin.
- Embriyoları toplayın ve E3 medyasında tutun.
- embriyoları istenen gelişim aşamasına gelene kadar E3 ortamlarında 27 °C inkübatörde tutun. Enjekte edilen embriyolar hem in vitro (bölüm 3 ve bölüm 4) hem de in vivo görüntüleme (bölüm 5) için kullanılabilir. RoGFP2-Orp1'i ifade eden embriyolar, floresan ışık ve mavi/yeşil filtre seti ile donatılmış düzenli bir diseksiyon mikroskobu ile deneylerden önce ön seçim yapılabilir.
3. Zebra balığı embriyolarından elde edilen primer retinal ganglion hücre kültürü
NOT: Bu protokol daha önce yayımlanmış bir yöntem olan 21'denuyarlanmıştır. Laminer akış başlığında 3.1 ve 3.2 adımlarını gerçekleştirin.
- Kapak örtülerinin hazırlanması
- Her deneyde 4-6 kültür plakası hazırlayın. %100 etanolde depolanan asitle temizlenmiş kapak örtüleri (22 x 22 mm kare; 0,16-0,19 mm kalınlık) kullanın.
- Bir kapak kapağını, yedekleri kullanarak depolama kabından çıkarın ve artık etanolleri çıkarmak için alevlendirın.
- Kapak kapağını 35 mm'lik bir kültür çanağının içine bir açıyla yerleştirerek tamamen kurulayın.
- Steril suda 10x stok (5 mg/mL) seyrelterek Poli-D-Lizin (PDL) çalışma çözeltisini (1x) hazırlayın.
- Her kapak ucunun ortasına 100 μL 0,5 mg/mL PDL uygulayın ve çözeltinin kenarlara yayılmasını önleyin.
- PDL'yi kapak örtülerinde oda sıcaklığında (RT) 20-30 dakika kuluçkaya yatırın. PDL'nin kurumadığını unutmayın.
- PDL'yi 0,5 mL steril suyla üç kez yıkayın. Tabakların tamamen kurumasına izin verin.
- 50x stoku (1 mg/mL) 1x PBS'de seyrelterek laminin çalışma çözeltisi (1x) hazırlayın.
- PBS'de 100 μL 20 μg/mL laminin her kapak ucunun ortasına uygulayın ve çözeltinin kenarlara yayılmasını önleyin.
- Plakaları 37 °C'de nemlendirilmiş bir inkübatörde 2-6 saat kuluçkaya yatırın. Laminin çözeltisinin kurumasından kaçının.
- Embriyo diseksiyonu ve kaplama RGC'leri
- Dört adet 35 mm'lik doku kültürü yemeği hazırlayın ve etiketlenin ve 4 mL ile doldurun: %70 etanol, "E2 media 1", "E2 media 2", "E2 media 3" diseksiyon gününde. Bulaşıkları parçalara göre buzdolabında saklayın.
- Zebra balığı embriyoları döllenmeden (hpf) 34 saat sonra olduğunda, laminin ile kaplanmış kültür yemeklerini inkübatörden alın ve kapakları 0,5 mL 1x PBS ile üç kez yıkayın.
- Son yıkamadan sonra, her kültür yemeğine 4 mL ZFCM (+) ortam ekleyin ve plakayı kurutmaktan kaçının.
- Hazırlanan kültür yemeklerini Adım 3.2.1'den alın. Rt'ye eşitlik versinler.
- 4-6 PCR tüpünü 15 μL ZFCM(+) ortamla doldurun. RGC'leri tek bir kapak kapağına kaplanacak şekilde 4 gözden hazırlamak için bir tüp gereklidir.
- Zebra balığı embriyolarını inkübatörden alın ve embriyoları sterilize etmek için 5-10 sn boyunca% 70 etanol içeren 35 mm doku kültürü kabına daldırın.
- Bir transfer pipet kullanarak, fazla etanol yıkamak için steril E2 ortamı içeren E2 Media 1 kabına embriyo transfer edin.
- Embriyoları E2 Media 2 çanağından aktarın ve keskin tokmaklarla korozyonlarını çıkarın.
- Diseksiyon yapmak için embriyoları son E2 Media 3 çanağından transfer edin.
- Bir çift ince asa kullanarak, retinaları daha önce açıklandığı gibi parçalara 22.
- Embriyoları ön taraftaki yumurta sarısını ön tarafa ön olarak ön tarafa yerleştirin ve ön taraflardan biriyle tutun ve kuyruk arkasını diğer önpsüklerle yumurta sarısı kesesine çıkarın.
- Boynunu tokmaklarla tutun ve beyni ve gözleri E2 ortamına maruz bırakmak için başını koparın. Yumurta sarısı kesesini kesmekten kaçının.
- İnce tokmakla, ikinci peripslerle kranial dokuyu aşağı tutarken, gözleri yavaşça kafadan yuvarlayın. Gözleri bitişik doku kalıntılarından izole edin.
- Dört gözü ZFCM(+) içeren önceden hazırlanmış tüplerden birine aktarın.
- Hücreleri ayrıştırmak için P20 pipet ve yaklaşık 45 kez sarı bir uçla hafifçe yukarı ve aşağı titratlayın. Hava kabarcıklarından kaçının.
- ZFCM'yi(+) ayrışmış hücrelerle kapak sapanı merkezine aktarın. Ek kapaklar için 10-12 arası adımları yineleyin.
- Titreşimleri emmek için bir polistiren köpük raf üzerinde 22 °C'de tezgah üstünde kültürleri koruyun.
- Kaplamadan sonra 6-24 saat görüntüleme gerçekleştirin.
NOT: Embriyoları farklı kültür yemeklerine aktarmak için transfer pipeti kullanın. Etanol üzerinde taşımayı önlemek için her çözelti için pipet değiştirin (Adım 6-8).
4. Kültürlü RGC nöronlarının in vitro ROS görüntülemesi
- Görüntüleme gününde (hücre kaplamadan sonra tipik olarak 6-24 saat), RGC aksonlarının büyümesini doğrulamak için mikroskop altında hücreleri kontrol edin.
- Canlı hücre görüntüleme için, kapakları kültür çanaktan canlı hücre görüntüleme odasına aktarın. Bu durumda, daha önce açıklanan özel yapım bir açık oda23.
- Görüntüleme için mikroskop kurun. Diferansiyel girişim kontrastı (DIC) hedefi, OG590 uzun geçişli kırmızı filtre ve EM-CCD kamera ile donatılmış ters bir mikroskop kullanın.
- Görüntülemeden önce, ZFCM(+) ortamını ZFCM(-) ile değiştirin.
- Hücreler 10x hedefiyle konumlandıktan sonra, yüksek NA yağı daldırma hedefi kullanarak 60x büyütmede görüntüler elde edin. Ek bir 1,5x büyütme kullanın.
- İlk olarak, DIC görüntülerini edin. Ardından, uygun bir filtre kümesi kullanarak roGFP2-Orp1 görüntüsünü görüntüleyin. 405/20 ve 480/30 nm eksitasyon filtreleri ile roGFP2-Orp1'i sırayla heyecanlandırın ve emisyon ışığı dikroik ayna 505DCXR'yi geçtikten sonra 535/30 nm emisyon filtresi ile görüntüler elde edin.
- İlk görüntü setini aldıktan sonra, farklı tedavi çözümleri içeren medya ile medya alışverişi. pH ve osmolarite değişikliklerini önlemek için medya her 30 dakikada bir değiştirilmelidir.
5. Gelişmekte olan embriyoların in vivo ROS görüntülemesi
- In vivo görüntüleme için embriyoları 22-24 bgf arasında metilen mavisi olmadan %0.003 Fenilthiourea (PTU) içeren E3 ortamlarında tutun. Medya alışverişi ve ölü embriyoları günlük olarak çıkarın.
- İstenilen yaşta embriyoları %0.016 trikainde uyuşturun. 35 mm'lik cam dip kültürü yemeklerine %1 düşük eriyen agarose ile uyuşturulmuş embriyolar monte edin. Embriyolar, görüntüleme için ilgi alanına bağlı olarak dorsally, ventral veya yanal olarak yönlendirilebilir.
- Agarose katılaştıktan sonra, bulaşıkları metilen mavisi / % 0.016 trikain olmadan E3 ortamı ile doldurun.
- Mikroskobu görüntüleme için ayarlayın. Ters lazer tarama konfokal mikroskobu kullanın. Alternatif olarak, bir agarose damlasının üzerine monte edilmiş embriyoları görüntülemek için su daldırma lensi ile donatılmış dik bir konfokal mikroskop kullanın.
- 405 nm ve 488 nm eksitasyon filtreleri ile roGFP2-Orp1'i sırayla heyecanlandırın ve 515-535 nm aralığında emisyon filtreleri ile ilgili görüntüleri elde edin.
- Embriyoların istenen kısmı boyunca 5 μm kesit kalınlığında z-yığınları elde edin. Embriyolar gelişimin ilerleyen aşamalarında görüntüleme için tutulabilir.
- Görüntülemeden sonra, embriyoları ince forsepslerle agarosedan çıkarın ve PTU ile metilen mavi içermeyen medyada istenen yaşa kadar inkübatörde tutun.
6. Görüntü analizi ve işleme
- H 2O2 seviyelerinin 405/480 oran değerlerine göre ölçümü
- Görüntü analizi için uygun bir yazılım kullanın. ImageJ yazılımı burada görüntü analizi ve işlenmesi için kullanılmıştır.
- Dosyaları sürükleyerek veya Dosya |'na tıklayarak ImageJ yazılımında DIC, 405/535 ve 480/535 görüntülerini açın 'nin adresini açın. Henüz yapılmamışsa, Görüntü |'na tıklayarak görüntüleri 32 bit'e dönüştürün | yazın 32-bit.
- Kontrol çubuğundan (hücre gövdesi, büyüme konisi, retina vb.) serbest el aleti ile ilgi çekici bölgeyi (ROI) tanımlayın. Analiz |'ni tıklatarak yatırım getirisi yöneticisini açma Araçlar | Yatırım Getirisi Yöneticisi. Tanımlanan yatırım getirisini eklemek için Yatırım Getirisi Yöneticisi sekmesinde Ekle'yi tıklatın.
- Yatırım getirisine yakın bir bölge çizin ve arka plan yatırım getirisi olarak ekleyin. Yatırım getirisini seçip yatırım getirisi yöneticisi sekmesinden Ölç'ü tıklatarak ortalama arka plan değerlerini ölçün.
- Ölçümdeki ortalama yoğunluk değerlerine dikkat edin. İşlem |'na tıklayarak floresan görüntülerden ortalama arka planın değerini çıkarın Matematik | öğesini çıkarın. Bu adımı hem 405/535 hem de 480/535 görüntüler için gerçekleştirin.
- İşlem |'na tıklayarak "0" değerlerini ortadan kaldırmak için 480/535 floresan görüntüye "1" değeri ekleyin Matematik | Oran hesaplamadan önce işlev ekleyin.
- İşlem |'i tıklatın Resim Hesaplayıcı | ImageJ'deki işlevi bölerek 405/535 görüntüyü piksel piksel 480/535'e bölün. 480/535 görüntüye bölünecek 405/535 görüntüyü seçin. 32 bit çıkış görüntüsü seçin.
- Önce oran görüntüsünü ve ardından yatırım getirisi yöneticisi sekmesindeki yatırım getirisini tıklatarak oran görüntüsüne yatırım getirisi uygulayın.
- Yatırım getirisi yöneticisi sekmesinde Ölç'e tıklayarak 405/535 görüntünün ortalama oran değerlerini 480/535 görüntüye ölçün.
- Uygun istatistiksel analizi gerçekleştirmek için mümkün olduğunca çok örnek için 6.1.2-6.1.9 adımlarını uygulayın.
- Oran görüntüsünü görüntüleme
NOT: Bu yordam, arka planı numunenin dışına çıkarmak ve görüntüye bir renk arama tablosu uygulamaktır.- 6.1.7. adımda ImageJ'de oran görüntüsü oluşturulduktan sonra, Dosya |'nı tıklatarak 32 bit siyah bir görüntü oluşturun Yeni | Resim.
- H 2O 2seviyelerini görüntülemek istediğiniz yatırım getirisini, önce yeni görüntüye ve ardından yatırım getirisi yöneticisi sekmesinden yatırım getirisine tıklayarak yeni görüntüye uygulayın.
- | Düzenle'yi tıklatarak maske oluşturma Seçim | Maske Oluştur.
- Yatırım getirisi değerini "1" olarak ayarlamak için maske görüntüsünü 255'e bölün ve arka plan değerleri "0" olacaktır. İşlem |'i tıklatın Matematik | Böl ve 255 yaz.
- İşlem |'na tıklayarak maskeyi oran görüntüsüyle çarpın Resim Hesaplayıcı | Çarpma işlevi. Bu, yalnızca yatırım getirisini gösteren gri ölçekli bir oran görüntüsüne neden olur.
- Resim | tıklayarak tabloyu "Ateş" olarak değiştirin Tablolara | Ateş .
NOT: İşlem | tıklatılarak oranın daha iyi görselleştirilmesi için tüm görüntülere çarpma faktörü uygulanabilir Resim | Çarpın. - Görüntü |'na tıklayarak oran görüntüsünü 8 bit'e dönüştürme | yazın 8-bit.
- Analiz |'ne tıklayarak kalibrasyon çubuğu ekleme Araçlar | Kalibrasyon Çubuğu.
Sonuçlar
Kültürlü zebra balığı RGC'leri 1d içinde aksonları genişletir. H 2 O2-biosensor'un temsili405/480oranlı görüntüsü Şekil 4A'dagösterilmiştir. Hücre gövdesi, akson ve büyüme konileri bireysel nöronlarda açıkça görülebilir. Bu nöronlar H2O2 değişikliklerini izlemek için zamanla farklı tedavilere tabi tutulabilir. Daha önce kültür ortamına 100 μM H2O2 eklenmesinin oran değerlerini artırdığ?...
Tartışmalar
Bu protokol boyunca dikkat etmeniz gereken birkaç kritik adım vardır. Bu noktaların göz önünde bulundurulmasının deneysel akışı iyileştireceğine inanıyoruz. Birincil RGC kültürü için, ZFCM'nin (-) sterilitesi çok önemlidir, çünkü bu kültür ortamı antibiyotik içermez ve görüntülemeden önce veya görüntüleme sırasında kontaminasyon oluşabilir. Bundan kaçınmak için, ZFCM'yi (-) yalnızca bir biyogüvenlik kabini içinde hazırlamanızı ve kullanmanızı ve düzenli olarak taze ZFCM (...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri (Grant R01NS117701), Ulusal Bilim Vakfı (Grant 1146944-IOS), Indiana Travmatik Omurilik ve Beyin Hasarı Araştırma Fonu (Grant 20000289), Purdue Araştırma Vakfı (Grant 209911) ve Purdue Üniversitesi Araştırma ve Ortaklıklardan Sorumlu Başkan Yardımcısı Ofisi (Grant 210362) tarafından desteklendi. Dr. Cory J. Weaver ve Haley Roeder'a zebra balığı RGC kültür protokolünü oluşturdukları için teşekkür ederiz. Haley Roeder'a Şekil 4'ün verilerini sağladığı için ayrıca teşekkür ederiz. Leah Biasi ve Kenny Nguyen'e RGC kültürüne yardımları için teşekkür ederiz. Gentry Lee'ye metni düzenlediği için teşekkür ederiz. RoGFP2-Orp1 içeren pCS2+ vektörü için roGFP2-Orp1 ve Dr. Qing Deng sağladığı için Dr. Tobias Dick'e teşekkür ederiz. Şekil 2 Biorender.com ile oluşturulur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
Referanslar
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır