需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
神经元发育过程中的 ROS 活细胞成像
摘要
该协议描述了在培养斑马鱼神经元和幼虫中使用基因编码的过氧化氢(H2O2)生物传感器,以评估H2O2 在神经系统发育过程中的生理信号作用。它可以应用于不同的细胞类型,并修改与实验治疗研究活性氧物种(ROS)在一般发展。
摘要
活性氧物种(ROS)是成熟的信号分子,在正常发育、平衡和生理学中非常重要。在不同的ROS中,过氧化氢(H2O2)在细胞信号中的作用最为突出。H2O2在若干物种的开发过程中被牵连。例如,在受精后的头几天,斑马鱼胚胎中检测到H2O2的瞬时增加。此外,消耗一个重要的细胞H2O2源,NADPH氧化酶(NOX),损害神经系统的发展,如分化,轴向生长,和视网膜结节细胞(RGCs)在体内和体外指导。在这里,我们描述了一种在发育过程中使用基因编码的H 2 O2-特异性生物传感器roGFP2-Orp1在培养斑马鱼神经元和整个幼虫中成像细胞内H 2O2水平的方法。这个探针可以在斑马鱼幼虫中短暂或稳定地表达。此外,由于基因表达或体积效应的差异,比例读数降低了检测伪证的可能性。首先,我们演示如何分离和培养从斑马鱼胚胎中衍生的RGC,这些胚胎暂时表达roGFP2-Orp1。然后,我们使用整个幼虫来监测H2O2水平在组织水平。传感器已通过添加 H2O2进行验证。此外,该方法还可用于通过产生具有组织特异性生物传感器表达的转基因动物来测量特定细胞类型和组织的 H2O2水平。由于斑马鱼促进遗传和发育操作,这里展示的方法可以作为测试H2O2在脊椎动物神经元和一般胚胎发育过程中的作用的管道。
引言
活性氧物种(ROS)信号调节神经系统的发展和功能1。一个重要的细胞ROS来源是NADPH氧化酶(NOX),这是产生超氧化物和过氧化氢(H 2 O2)2的跨膜蛋白。NOX酶存在于整个中枢神经系统(CNS)中,NOX衍生的ROS有助于神经元发育3、4、5、6。神经干细胞的维持和分化,建立神经元极性,中性生长,突触可塑性已被证明需要足够的ROS 7,8,9,10,11水平。另一方面,NOXs不受控制地生产ROS会导致神经退行性疾病,包括阿尔茨海默氏症、多发性硬化症和创伤性脑损伤12、13、14。因此,生产生理相关的ROS对于维持健康状况至关重要。
基因编码生物传感器的开发极大地促进了细胞ROS的检测。基因编码生物传感器的一个重要优点是 ROS 信号的时间和空间分辨率增加,因为这些传感器可以专门针对不同的位置。对氧化物敏感的GFP(roGFP)是一种类型的ROS生物传感器。roGFP2-Orp1变种通过其Orp1域专门检测H2O2,这是一种来自酵母15,16的谷胱甘肽过氧化物类家庭蛋白。Orp1蛋白的氧化被转移到roGFP2,以改变其构象(图1A)。探测器在405纳米和480纳米附近显示两个兴奋峰,在515纳米处显示一个单个发射峰值。氧化后,兴奋峰周围的荧光强度会发生变化:当405 nm兴奋增加时,480纳米激发会减少。因此,roGFP2-Orp1 是一种比值生物传感器,H2O2-水平通过两个不同波长的荧光增量(图 1B)的兴奋度比率检测到。总的来说,roGFP2-Orp1 是 ROS 成像的多功能工具,可在体内高效使用。
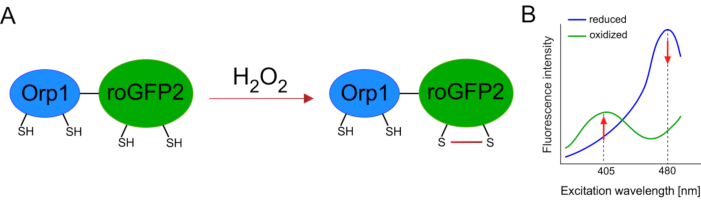
图1:roGFP2-Orp1. (A) 氧化剂转移的示意图表示和激发光谱发生在 Orp1 和 roGFP2 之间,以响应 H2O2,导致 roGFP2 的构象变化。(B) roGFP2-Orp1的激发光谱显示两个兴奋峰值在405 nm和480 nm和单个排放峰值在515 nm。H2O2氧化后,405 nm 激发增加,而 480 nm 激发减少。这会导致 H 2O 2存在的比例读出。该数字已从比兰和贝卢索夫(2017)16和摩根等人(2011)25修改。请单击此处查看此图的较大版本。
达尼奥雷里奥(斑马鱼)模型系统在应用基因编码生物传感器方面有几个优势。胚胎和幼虫的光学透明度使体内成像具有非侵入性。新的成像工具正在开发中,以实现更高的分辨率和更深的渗透17。此外,还有既定的基因操纵工具(异位mRNA表达,托尔2转基因等)和基因组编辑(塔伦斯,CRISPR/Cas9等),促进转基因动物的生成18。随着斑马鱼胚胎在母体之外发育,该系统进一步允许更容易地获取和操作胚胎。例如,单细胞阶段注射和药物治疗很容易做到。
在这里,我们使用斑马鱼通过注射体外转录的mRNA来暂时表达H2O2特异性生物传感器roGFP2-Orp1。这些胚胎可用于培养神经元的 体外 成像和 体内 成像(图2)。我们描述了从斑马鱼胚胎解剖和电镀视网膜结节细胞(RGCs)的协议,然后评估培养神经元的H2O2水平。然后,我们提出了一种利用共聚焦显微镜对罗格FP2-Orp1表达胚胎和幼虫进行 体内 成像的方法。这种方法不仅能够确定生理H2O2水平,而且还可以确定在不同的发育阶段或条件下发生的潜在变化。总的来说,该系统为检测活细胞和动物中的H2O2 提供了可靠的方法,以研究H2O2 在发育、健康和疾病中的作用。
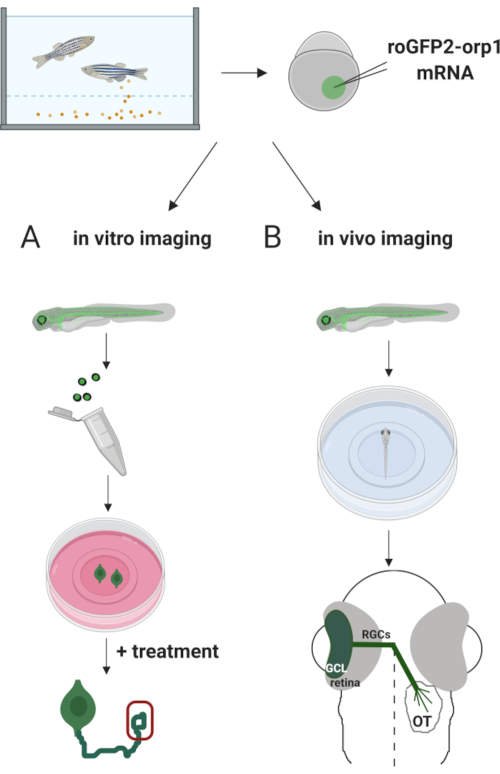
图2。实验方法大纲。简言之,胚胎采集后,roGFP2-Orp1 mRNA被注射到单细胞阶段斑马鱼胚胎的蛋黄中。发育中的胚胎可用于体外和体内成像的(A)和B。(A) GFP阳性胚胎用于解剖视网膜,用于在34马力下采集RGC。分离的 RGC 镀在 ZFCM (+) 介质中的 PDL/层膜盖上。生长锥成像可以进行RGC延长他们的轴突后,6-24小时的电镀。细胞可以接受不同的治疗,以测量H2O2水平的潜在变化。在这里,我们测量了RGC(红色)生长锥中的H 2 O2水平。(B) GFP阳性胚胎用于体内成像。在理想年龄,胚胎可以麻醉并安装在35毫米玻璃底盘上,用于共焦成像。在这里,胚胎被安装在腹膜成像的通风装置上。示意图显示斑马鱼的视网膜发育。RGC 形成结膜细胞层 (GCL),这是网状网膜的最内层。RGC轴突发展成视神经,穿过中线,形成视基亚西姆。然后,RGC轴突生长,在中脑的光学构造中形成突触。请单击此处查看此图的较大版本。
研究方案
所有动物实验均经过普渡动物护理和使用委员会 (PACUC) 的合乎道德的审查和批准,遵循 NIH 指南,协议2006002050 2020 年 7 月 24 日获得批准。
1. 准备解决方案
- E2 介质 (1x)
- 通过将 表1 中显示的所有组件组合在一起,准备 100x E2A (500 mL)、500x E2B (100 mL) 和 500x E2C (100 mL) 解决方案。高压灭菌网、E2B 和 E2C 解决方案。存储在4°C。
- 对于 1x E2 介质:将 5 mL 的 100x E2A、1 mL 的 500x E2B 和 1 mL 的 500x E2C 组合在一起。将无菌水的体积达到 500 mL。将pH口调整为7.0-7.5。
- 在-20°C下准备50 mL的1x E2介质存储的单音节,用于长期存储。但是,解冻后可能会发生降水。使用库存解决方案之前,确保降水完全溶解。
| 溶液 | 元件 | 量 | 浓度 |
| 100X E2A (500mL) | |||
| 纳克 | 43.8 克 | 1500立方米 | |
| 氯化钾 | 1.88 克 | 50米 | |
| MgSO4 | 6 g | 100立方米 | |
| KH2PO4 | 1.03 克 | 15米 | |
| 纳2HPO4 | 0.34 克 | 5米 | |
| 500X E2B (100 mL) | |||
| 卡克莱尔2 | 5.5 克 | 500立方米 | |
| 500X E2C (100 mL) | |||
| 纳赫科3 | 3 g | 350立方米 | |
| 1X E2 (500 mL) | |||
| 100X E2A | 5升 | 1X | |
| 500X E2B | 1升 | 1X | |
| 500X E2C | 1升 | 1X |
表1:斑马鱼细胞培养的1x E2介质组件。
- E3 媒体 (1x)
- 将组件溶解在 1 L 无菌水中,如 表 2 所示,使 100 倍的库存。将库存稀释在无菌水中,使1x E3介质。
- 加入 0.2% 的甲基蓝。对于 20 mL 的 1x E3 介质,添加 40 μL 的甲基蓝。
- 制作另一批无甲基蓝的荧光成像。
| 元件 | 金额(g) | 浓度在 100X 库存 (mM) |
| 纳克 | 29.22 | 500 |
| 氯化钾 | 1.26 | 17 |
| 卡克莱尔2 2H2O | 4.85 | 33 |
| MgSO4 7H2O | 8.13 | 33 |
表2:用于维护斑马鱼胚胎的100x E3介质的组件。
- 80x 盐水库存解决方案
- 将 表 3中显示的所有组件组合在一起。加入水,使100 mL解决方案。混合,直到所有组件溶解。将解决方案存储在 4 °C。
| 元件 | 金额(g) | 库存浓度 (mM) |
| 葡萄糖 | 1.44 | 80 |
| 皮鲁瓦酸钠 | 0.44 | 40 |
| 卡克莱尔2 2H2O | 0.148 | 10 |
| 赫佩斯 | 6.1 | 256 |
表3:斑马鱼细胞培养介质80x盐水溶液的组件。
- 斑马鱼细胞培养介质 (ZFCM+)
- 将 表 4 中显示的所有组件组合在一起,使 250 mL 介质。将pH口调整为7.5。使用 0.22μm 滤镜过滤介质,并将存储在 4 °C。
| 元件 | 金额(mL) | 音量% |
| L-15 介质(含苯酚红色) | 212.75 | 85.1 |
| 胎儿牛血清 (FBS) | 5 | 2 |
| 青霉素/链霉素 | 1 | 0.4 |
| 80X 盐水解决方案 | 3.125 | 1.25 |
| 水 | 28.125 | 11.25 |
表4:斑马鱼细胞培养介质的成分,含血清和抗生素。
- 斑马鱼细胞培养成像介质 (ZFCM-)
- 将 表 5 中显示的所有组件组合在一起,使 250 mL 介质。将pH口调整为7.5。使用 0.22 μm 滤镜过滤介质。
- 单次使用阿利库特(50 mL 批次)以防止污染。保持在4°C。
| 元件 | 金额(mL) | 音量% |
| L-15 中等(无酚红色) | 212.75 | 85.1 |
| 80X 盐水解决方案 | 3.125 | 1.25 |
| 水 | 34.125 | 13.65 |
表5:没有血清和抗生素的斑马鱼细胞培养介质的组件 ,用于体外 成像。
- 注射模具
- 在 E3 介质中溶解 1.5% 的阿加罗斯。将约25毫升的香菜倒入100×15毫米的培养皿中。
- 将模具放在表面角度为 45° 角的浮雕上,并让它以慢动作漂浮在浮雕上。这将有助于避免泡沫。让阿加罗斯冷却下来, 在板凳上凝固。
- 一旦完全凝固,慢慢去除霉菌,以防止碎裂。添加新鲜的 E3 介质,在菜盘周围添加石蜡薄膜以防止溢出,并储存在 4 °C ( 图 3)。
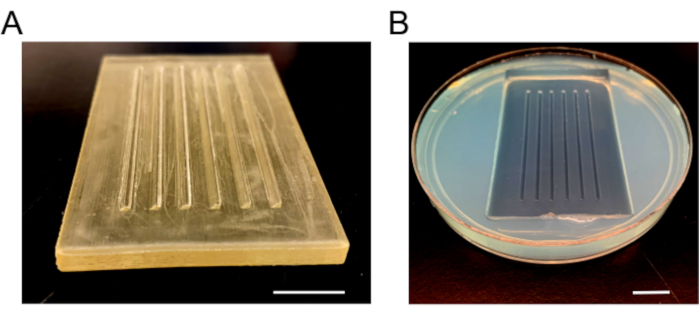
图3:注射模具图像。 (A) 用于制作注射板的塑料模具。模具有六个坡道,一个90°和一个45°斜面,用于将胚胎放在原位。(B) 凝固后,将注射板和霉菌移除。缩放条 = 1 厘米。 请单击此处查看此图的较大版本。
2. 准备和注射罗格夫普2-Orp1 mRNA
注:roGFP2-Orp1结构是从德国DKFZ的托比亚斯·迪克博士那里获得的。它被分克隆到普渡大学邓青博士实验室的PCS2+载体中。为了防止 RNase 的降解,必须采取若干预防措施。必须随时使用无 RNase 试剂和管子,所有步骤都必须佩戴手套,或者,材料和表面可以用清洁剂擦拭,以清除 RNase。
- 将 3-10 μg 的 pCS2+/roGFP2-Orp1 矢量与 NotI 线性化。
- 使用 PCR 清理套件净化线性质粒。
- 体外根据制造商提供的说明,使用体外转录套件转录 roGFP2-Orp1 mRNA。
- 封顶转录反应组件
- 将RNA聚合酶和线性/纯化DNA放在冰上。漩涡 10 倍反应缓冲器和 2 倍 NTP/CAP,直到它们完全处于解决方案中。将 NTP/CAP 存放在冰上,但在组装反应时将缓冲区保持在室温 (RT) 下。在打开管子之前,触摸所有试剂以防止污染。
- 在 RT 中设置 RNA 合成反应,顺序如下:在无 RNase 0.5 mL 离心机管中。反应的最终体积为20μL。反应设置显示在 表6中。
- 如果管子需要,加入 10μL 的核苷酸混合物、2 倍 NTP/CAP 和无核糖水。添加2μL 10X反应缓冲器。添加1-1.5微克线性DNA(最多6微l)。如有必要,加入无核糖水,以弥补20μL反应量。
- 关闭管子,短暂漩涡和触摸旋转微胶。添加 2 μL 的 10 倍 SP6 酶混合物。用手指点击和触摸旋转在微浮子关闭。
- 放置在37°C 2-2.5小时(可以高达18小时)。
注:在介绍的实验中,在37°C的16-18小时潜伏期进行了最佳结果。 - 添加 1μL 的 DNase 以去除 DNA 模板、手指单击、触摸旋转并在 37 °C 下孵育 15 分钟。
- 封顶转录反应组件
| 试剂 | 音量 (μL) | 反应量 |
| 2X NTP/盖 | 10 | 1X |
| 10倍反应缓冲区 | 2 | 1X |
| 模板DNA | 最多 6 个 | 1-1.5微克 |
| 无核糖水 | 添加以制作20μL | |
| 10X SP6酶混合物 | 2 | 1X |
表6:体外转录中对roGFP2-Orp1 mRNA的反应设置。
- RNA 恢复
- 在体外转录套件中添加 25 μL 氯化锂 (LiCl)。在非霜冻冰柜中放置 -20 °C 至少 30 分钟。
- 在 4 °C 的桌面离心机中以最大速度旋转 25 分钟。 小心去除和丢弃超细剂,以免干扰颗粒。加入25微升的冷75%乙醇,在4°C旋转5分钟。
- 小心地取出并丢弃超自然人。让颗粒空气干燥至少 5 分钟在 Rt 。不要让过多干燥。添加 12 μL 的无核糖特瑞斯-EDTA (TE) 缓冲区 (pH 7.0),并将样品放在冰上。
- 用光谱仪测量RNA浓度。通常获得 0.5- 1 微克/微升。
- 用酚红色溶液(杜尔贝科的磷酸盐缓冲盐水-DPBS中0.5%苯酚红色)和aliquot准备100 ng/μL mRNA,供一次性使用(3-5μL)。将 mRNA 单引号存储在 - 80 °C。
- mRNA 的微投射
- 在注射当天,使用其中一个mRNA单引,并遵循斑马鱼胚胎注射协议,通过他们的蛋黄19将1nL的mRNA注射到单细胞阶段胚胎。下面提供了简要说明。
- 繁殖成年鱼和收集胚胎,如先前描述的20。
- 用移液器拉拔针。用钳子切开针尖,创建 10 μm 尖端开口。
- 将胚胎对齐在注射模具中,该模具在第 1.6 步中描述。
- 用玻璃微注射移液器将 mRNA 的 1 nL 注入苯酚红色。
- 收集胚胎并将其保存在E3介质中。
- 将胚胎保存在 E3 介质中的 27 °C 孵化器中,直到达到所需的发育阶段。注射胚胎可用于 体外 (第3节和第4节)和 体内 成像(第5节)。表达roGFP2-Orp1的胚胎可以在实验前预先选择,使用配备荧光灯和蓝/绿滤光片的常规解剖显微镜。
3. 从斑马鱼胚胎中提取的原发性视网膜结扎细胞培养
注:此协议改编自先前公布的方法 21。在层流罩中执行步骤 3.1 和 3.2。
- 盖片的准备
- 在每个实验中准备4-6个培养板。使用储存在 100% 乙醇中的酸洗盖片(22 x 22 mm 平方;0.16-0.19 mm 厚度)。
- 使用钳子从存储容器中取出一个盖片,并点燃它以去除残留的乙醇。
- 空气完全干燥盖片,将其以一个角度放置在35毫米的文化盘内。
- 通过稀释无菌水中的 10 倍库存(5 毫克/mL),准备聚 D-Lysine (PDL) 工作解决方案 (1x)。
- 将 100 微升 0.5 毫克/mL PDL 涂抹到每个盖片的中心,避免溶液扩散到边缘。
- 在室温下将 PDL 在盖片上孵化 20-30 分钟 (RT)。确保 PDL 不会干涸。
- 用 0.5 mL 无菌水清洗 PDL 三次。让盘子完全干燥。
- 通过在 1x PBS 中稀释 50 倍库存(1 毫克/mL),准备层压素工作解决方案 (1x)。
- 在 PBS 中应用 100μL 的 20μg/mL 层蛋白到每个盖片的中心,避免溶液扩散到边缘。
- 在加湿的孵化器中以 37 °C 将板孵化 2-6 小时。避免拉米宁溶液干燥。
- 胚胎解剖和电镀RGC
- 准备和标记四个35毫米组织培养菜肴,并填充4mL的:70%乙醇,"E2介质1","E2介质2","E2介质3"在解剖当天。将盘子放在冰箱里,直到解剖。
- 当斑马鱼胚胎受精后34小时(hpf),将涂有层蛋白的培养皿从孵化器中取出,用0.5 mL的1x PBS洗三次盖片。
- 最后洗涤后,在每个培养皿中加入 4 mL 的 ZFCM (+) 介质,避免烘干盘子。
- 从步骤 3.2.1 中检索准备好的文化菜肴。让他们等于 RT 。
- 用 15 μL 的 ZFCM (+) 介质填充 4-6 个 PCR 管。需要一根管子来准备 4 只眼睛的 Rgcs, 以镀在一个盖片上。
- 从孵化器中取出斑马鱼胚胎,将胚胎浸入35毫米组织培养皿中,其中含有70%乙醇,供5-10s消毒。
- 使用转移移液器,将胚胎转移到含有无菌E2介质的E2介质的E2介质的E2盘中,以清洗多余的乙醇。
- 将胚胎转移到E2介质2盘中,用锋利的钳子去除它们的胆汁。
- 将胚胎转移到最终的E2介质3盘进行解剖。
- 使用一对细钳,解剖视网膜,如先前描述的22。
- 用其中一个钳子将胚胎放在蛋黄前部,用其他钳子将尾部后部移到蛋黄囊上。
- 用钳子抓住脖子,摘下头部,让大脑和眼睛暴露在 E2 介质中。避免切割蛋黄囊。
- 用细钳尖,轻轻地把眼睛从头部滚下来,同时用第二个钳子把颅面组织放下。将眼睛与相邻的组织碎片隔离开来。
- 将四只眼睛转移到一个先前准备的含有 ZFCM (+) 的管子上。
- 用 P20 移液器和黄色尖端轻轻上下滴定约 45 次,以分离细胞。避免任何气泡。
- 将 ZFCM (+) 与分离的细胞转移到盖滑的中心。重复步骤 10-12 以获得额外的盖片。
- 在聚苯乙烯泡沫架上将培养物保持在 22 °C 的台面上,以吸收振动。
- 电镀后执行成像 6-24 h。
注意:使用转移移液器将胚胎转移到不同的培养皿中。更改每个溶液的移液器以防止携带乙醇(步骤 6-8)。
4. 培养的 RGC 神经元的 体外 ROS 成像
- 在成像日(通常在细胞电镀后 6-24 小时),在显微镜下检查细胞以验证 RGC 轴突的生长。
- 对于活细胞成像,将覆盖从培养皿转移到活细胞成像室。在这种情况下,一个定制的开放室,这是以前描述使用23。
- 设置显微镜进行成像。使用配备微分干扰对比 (DIC) 目标的倒置显微镜、OG590 长通红色滤镜和 EM-CCD 摄像机。
- 在成像之前,用 ZFCM (-) 替换 ZFCM (+) 介质。
- 一旦细胞定位为 10 倍目标,使用高 NA 油浸入目标以 60 倍的放大倍数获取图像。使用额外的 1.5 倍放大倍数。
- 首先,获取 DIC 图像。然后,使用适当的滤镜集对 roGFP2-Orp1 进行映像。使用 405/20 和 480/30 nm 激发滤镜按顺序激发 roGFP2-Orp1,并在发射灯通过 dichroic 镜 505DCXR 后以 535/30 nm 发射滤光片获取图像。
- 拍摄完第一组图像后,与包含不同治疗解决方案的媒体交换介质。应每 30 分钟更改一次媒体成像,以避免 pH 和渗透性变化。
5. 发育胚胎的 体内 ROS 成像
- 对于体内成像,保持胚胎在E3介质中含有0.003%苯甲基尿素(PTU)没有甲基苯蓝色从22-24马力。每天交换介质并去除死胚胎。
- 在理想年龄,麻醉胚胎在0.016%三卡因。在35毫米玻璃底培养皿上安装1%低熔化的胚胎。胚胎可以按多面、通风或横向方向,具体取决于成像的兴趣区域。
- 凝固后,用E3介质填充菜肴,不加甲基蓝/0.016%三卡因。
- 设置显微镜进行成像。使用倒置激光扫描对焦显微镜。或者,使用配备水浸透镜的直立共焦显微镜,以图像胚胎安装在糖滴顶部。
- 使用 405 nm 和 488 nm 激发滤波器按顺序激发 roGFP2-Orp1,并获取与发射滤波器在 515-535 nm 范围内的相应图像。
- 通过胚胎所需的部分获得 5 μm 部分厚度的 z 堆栈。胚胎可以在发育的后期保存成像。
- 成像后,用细钳从蔗糖中取出胚胎,并保存在孵化器中,直到与 PTU 一起在无甲基无蓝色介质中达到预期年龄。
6. 图像分析和处理
- 基于405/480比率值对 H 2 O2 级别进行测量
- 使用合适的软件进行图像分析。此处使用 ImageJ 软件进行图像分析和处理。
- 通过拖动文件或单击文件,打开图像J软件中的 DIC、405/535 和 480/535 图像 |打开。如果尚未完成,请单击 "图像|将图像转换为 32 位类型|32 位。
- 使用控制栏(细胞体、生长锥体、网状膜等)的免费手工具定义感兴趣的区域 (ROI)。通过单击分析|打开投资回报率经理工具|投资回报率经理。单击"加入投资回报率经理"选项卡以添加已定义的投资回报率。
- 绘制接近投资回报率的区域,并添加为背景投资回报率。通过从投资回报率经理选项卡中选择投资回报率和单击 "量度" 来衡量平均背景值。
- 注意测量中的平均强度值。通过单击 "过程"|,从荧光图像中减去平均背景值数学|减去。执行此步骤,同时执行 405/535 和 480/535 图像。
- 将"1"值添加到 480/535 荧光图像,通过单击进程|消除"0" 值数学|在 比率计算之前添加功能。
- 单击 "进程|图像计算器|在 图像J中划分功能,将 405/535 图像除以 480/535 图像像素/像素。选择 405/535 图像,除以 480/535 图像。选择 32 位输出图像。
- 首先单击比率图像,然后在投资回报率经理选项卡中应用投资回报率与比率图像。
- 通过单击投资回报率管理器选项卡中的 "测量", 测量 405/535 图像与 480/535 图像的平均比率值。
- 为尽可能多的样本执行步骤 6.1.2-6.1.9 以执行适当的统计分析。
- 显示比率图像
注意:此过程是减去标本外部的背景,并将彩色查找表应用到图像中。- 一旦在图像J中以步骤6.1.7创建比例图像,通过单击文件创建32位黑色图像 |新|图像。
- 首先单击新图像,然后从投资回报率经理选项卡中显示新图像,将您希望显示 H2O2 级别的投资回报率应用于新图像。
- 通过单击 "编辑|创建掩码选择|创建面膜。
- 将面膜图像除以 255,将投资回报率值调整为"1",背景值为"0"。单击 "进程|数学|除以 255型。
- 通过单击 "进程"|,将面膜与比率图像进行乘以图像计算器|倍增 功能。这将导致只显示投资回报率的灰度比率图像。
- 通过单击"图像"更改"火"的查找表 |查找表|火.
注:通过单击 "过程"|,可以将乘法因子应用于所有图像,从而更好地可视化比率图像|乘以 . - 通过单击 "图像"|将比例图像转换为 8 位类型|8 位。
- 通过单击 "分析|添加校准栏工具|校准栏。
结果
养殖斑马鱼RGCs在1d内扩展轴突。图4A显示了H 2 O2-生物传感器的具有代表性的405/480比例图像。细胞体、轴龙和生长锥体在单个神经元中清晰可见。随着时间的推移,这些神经元可以接受不同的治疗,以监测H2O2的变化。我们以前发现,在培养介质中添加 100 μM H2O2可增加比率值,表明可以通过此系统(图 4 )24
讨论
有几个关键步骤需要在整个协议中引起注意。我们相信,考虑到这些点将改善实验流。对于初级 RGC 培养,ZFCM(-) 的不育性非常重要,因为这种培养介质不含抗生素,在成像之前或成像期间可能发生污染。为了避免这种情况,我们建议仅在生物安全柜内准备和使用 ZFCM(-),并定期制作新鲜的 ZFCM(-) 介质(步骤 1.5)。此外,层压素库存应保持在-80°C。 解冻的层蛋白应随时储存在 4 °C。不要?...
披露声明
作者宣称他们没有利益冲突。
致谢
这项工作得到了国家卫生研究院(Grant R01NS1117701)、国家科学基金会(第1146944-IOS格兰特)、印第安纳创伤脊髓和脑损伤研究基金(格兰特20000289)、普渡研究基金会(格兰特·209911)和普渡大学研究与伙伴关系执行副总裁办公室(格兰特·210362)的支持。我们感谢科里·韦弗博士和海莉·罗德博士建立斑马鱼RGC文化协议。我们感谢海莉·罗德提供图4的数据。我们感谢利亚比亚西和肯尼 · 恩古恩对 Rgc 文化的帮助。我们感谢李将军编辑了文本。我们感谢托比亚斯·迪克博士为含有roGFP2-Orp1的PCS2+载体提供roGFP2-Orp1和邓青博士。图 2 是用 Biorender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
参考文献
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。