Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация живых клеток ROS во время развития нейронов
В этой статье
Резюме
Этот протокол описывает использование генетически закодированного перекиси водорода (H2 O2)-биосенсорав культивируемых нейронах рыбок данио и личинках для оценки физиологических сигнальных ролей H2 O2во время развития нервной системы. Он может быть применен к различным типам клеток и модифицирован с помощью экспериментальных методов лечения для изучения активных форм кислорода (АФК) в общем развитии.
Аннотация
Активные формы кислорода (АФК) являются хорошо зарестающимися сигнальными молекулами, которые важны для нормального развития, гомеостаза и физиологии. Среди различных АФК перекись водорода(H2O2)лучше всего характеризуется в отношении ролей в клеточной сигнализации. H2O2 был замешан во время разработки нескольких видов. Например, преходящее увеличениеH2O2 было обнаружено у эмбрионов рыбок данио в течение первых дней после оплодотворения. Кроме того, истощение важного клеточного источникаH2O2, NADPH-оксидазы (NOX), ухудшает развитие нервной системы, такое как дифференцировка, рост аксонов и руководство ганглиозными клетками сетчатки (RGCs) как in vivo, так и in vitro. Здесь мы описываем метод визуализации внутриклеточных уровнейH2O2 в культивируемых нейронах рыбок данио и целых личинках во время развития с использованием генетически закодированногоH2O2-специфическогобиосенсора roGFP2-Orp1. Этот зонд может быть временно или стабильно экспрессирован в личинкам рыбок данио. Кроме того, ратиометрическое считывание уменьшает вероятность обнаружения артефактов из-за дифференциальной экспрессии генов или эффектов объема. Во-первых, мы демонстрируем, как изолировать и культивировать RGC, полученные из эмбрионов рыбок данио, которые временно экспрессируют roGFP2-Orp1. Затем мы используем целые личинки для мониторинга уровня H2O2 на тканевом уровне. Датчик был проверен добавлением H2O2. Кроме того, эта методология может быть использована для измерения уровнейH2O2 в определенных типах клеток и тканей путем генерации трансгенных животных с тканеспецифической экспрессией биосенсора. Поскольку рыбки данио облегчают генетические манипуляции и манипуляции с развитием, продемонстрированный здесь подход может служить конвейером для проверки ролиH2O2 во время нейронного и общего эмбрионального развития у позвоночных.
Введение
Передача сигналов активных форм кислорода (АФК) регулирует развитие и функционирование нервнойсистемы1. Важным клеточным источником АФК являются NADPH оксидазы (NOX), которые представляют собой трансмембранные белки, образующие супероксид и перекись водорода (H2O2)2. Ферменты NOX обнаруживаются по всей центральной нервной системе (ЦНС), а АФК, полученная изNOX,способствует развитию нейронов3,4,5,6. Было показано, что поддержание и дифференцировка нервных стволовых клеток, установление полярности нейронов, роста нейритов и синаптической пластичности требуют адекватных уровней АФК7,8,9,10,11. С другой стороны, неконтролируемое производство АФК ТОКС способствуют нейродегенеративным расстройствам, включая болезнь Альцгеймера, рассеянный склероз и черепно-мозговую травму12,13,14. Следовательно, производство физиологически значимого АФК имеет решающее значение для поддержания здоровых условий.
Разработка генетически закодированных биосенсоров значительно облегчила обнаружение клеточного АФК. Одним из важных преимуществ генетически закодированных биосенсоров является повышенное временное и пространственное разрешение сигнала АФК, поскольку эти датчики могут быть специально нацелены на различные места. Окислительно-чувствительный GFP (roGFP) является одним из типов таких биосенсоров ROS. Вариант roGFP2-Orp1 специфически обнаруживает H2O2 через свой домен Orp1, который представляет собой белок семейства глутатиона пероксиредоксинов из дрожжей15,16. Окисление белка Orp1 переносится в roGFP2 для изменения его конформации(рисунок 1A). Зонд демонстрирует два пика возбуждения около 405 нм и 480 нм и один пик излучения при 515 нм. При окислении интенсивность флуоресценции вокруг пиков возбуждения изменяется: при увеличении возбуждения 405 нм снижается возбуждение на 480 нм. Таким образом, roGFP2-Orp1 является логометрическим биосенсором, а уровниH2O2-определяются соотношением интенсивностей флуоресценции, возбуждаемых на двух разных длинах волн(рисунок 1B). В целом, roGFP2-Orp1 является универсальным инструментом для визуализации АФК, который можно эффективно использовать in vivo.
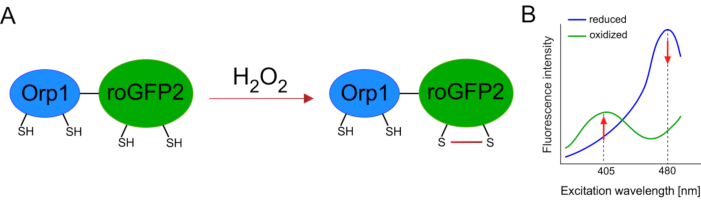
Рисунок 1:Схематическое представление и спектры возбуждения roGFP2-Orp1. (A)Перенос окислителя происходит между Orp1 и roGFP2 в ответ наH2O2,что приводит к конформационным изменениям roGFP2. (B)Спектры возбуждения roGFP2-Orp1 демонстрируют два пика возбуждения при 405 нм и 480 нм и одинарный пик излучения при 515 нм. При окислении наH2O2 возбуждение405 нм увеличивается, а возбуждение 480 нм уменьшается. Это приводит к ратиометрическому считываю для присутствия H2O2. Рисунок был изменен с Bilan and Belousov (2017)16 и Morgan et al. (2011)25. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Модельная система Danio rerio (рыбки данио) имеет ряд преимуществ для применения генетически закодированных биосенсоров. Оптическая прозрачность эмбрионов и личинок позволяет проводить неинвазивную визуализацию in vivo. Разрабатываются новые инструменты визуализации для достижения более высокого разрешения и более глубокого проникновения17. Кроме того, существуют установленные инструменты для генетических манипуляций (эктопическая экспрессия мРНК, трансгенез Tol2 и др.) и редактирования генома (TALENs, CRISPR/Cas9 и др.), что способствует генерации трансгенных животных18. Поскольку эмбрионы рыбок данио развиваются вне матери, эта система дополнительно облегчает доступ и манипулирование эмбрионами. Например, инъекции на одноклеточной стадии и медикаментозное лечение могут быть легко сделаны.
Здесь мы использовали рыбок данио для временной экспрессииH2O2-специфическогобиосенсора roGFP2-Orp1 путем инъекции транскрибированной in vitro мРНК. Эти эмбрионы могут быть использованы как для визуализации культивированных нейронов in vitro, так и для визуализации in vivo (рисунок 2). Мы описываем протокол для рассечения и покрытия ганглиозных клеток сетчатки (RGC) из эмбрионов рыбок данио с последующей оценкой уровнейH2O2в культивированных нейронах. Затем мы представляем метод визуализации in vivo roGFP2-Orp1-экспрессирующих эмбрионов и личинок с использованием конфокальной микроскопии. Такой подход позволяет не только определить физиологические уровниH2O2,но и потенциальные изменения, происходящие на разных стадиях развития или в различных условиях. В целом, эта система обеспечивает надежный метод обнаруженияH2O2 в живых клетках и животных для изучения ролиH2O2 в развитии, здоровье и болезни.
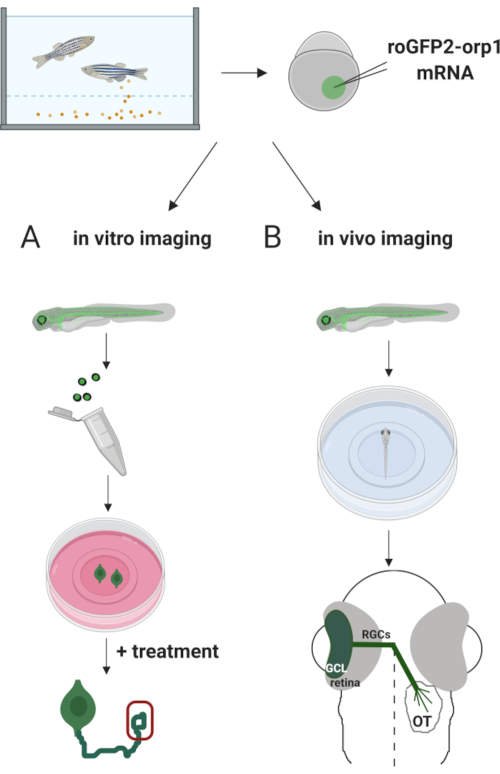
Рисунок 2. Схема экспериментального подхода. Вкратце, после сбора эмбрионов, мРНК roGFP2-Orp1 вводят в желток эмбрионов одноклеточной стадии данио. Развивающиеся эмбрионы могут быть использованы как для(A) in vitro, так и(B) in vivo визуализации. (A) GFP-положительные эмбрионы используются для рассечения сетчатки для сбора RGC при 34 л.с. Диссоциированные RGC покрываются на обшивки с PDL/ламининым покрытием в средах ZFCM (+). Визуализация конуса роста может проводиться по мере того, как RGC расширяют свои аксоны после 6-24 ч покрытия. Клетки могут подвергаться различным методам лечения для измерения потенциальных изменений в уровняхH2O2. Здесь мы измерилиH2O2-уровни в ростовых конусах RGC (красный). (B)GFP-положительные эмбрионы используются для визуализации in vivo. В желаемом возрасте эмбрионы могут быть обезболиваться и устанавливаться на стеклянную посуду со стеклянным дном 35 мм для конфокальной визуализации. Здесь эмбрионы устанавливаются вентрально для визуализации сетчатки. Схема показывает развитие сетчатки у рыбок данио. RGC образуют ганглионный клеточный слой (GCL), который является самым внутренним слоем в сетчатке. Аксоны RGC развиваются в зрительный нерв, пересекая среднюю линию, образуя зрительный хиазм. Затем аксоны RGC растут дорсально, чтобы сделать синапсы в зрительном тектуме в среднем мозге. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Все эксперименты на животных были этически рассмотрены и одобрены Комитетом по уходу и использованию животных Пердью (PACUC), следуя руководящим принципам NIH с протоколом 2006002050 утвержден 24.07.2020.
1. Приготовление растворов
- Носитель E2 (1x)
- Приготовьте 100 растворов E2A (500 мл), 500x E2B (100 мл) и 500x E2C (100 мл), объединив все компоненты, указанные в таблице 1. Автоклавные решения E2A, E2B и E2C. Хранить при 4 °C.
- Для 1 носителя E2: объедините 5 мл 100x E2A, 1 мл 500x E2B и 1 мл 500x E2C. Доведите объем до 500 мл стерильной водой. Отрегулируйте pH до 7,0-7,5.
- Подготовьте 50 мл аликвот 1x E2 медиамагазину при -20 °C для длительного хранения. Однако осадки могут возникать при оттаивании. Убедитесь, что осадки полностью растворились перед использованием запасного раствора.
| решение | компонент | количество | концентрация |
| 100X E2A (500 мл) | |||
| НаКл | 43.8 г | 1500 мМ | |
| ККл | 1,88 г | 50 мМ | |
| МгСО4 | 6 г | 100 мМ | |
| Х2ПО4 | 1,03 г | 15 мМ | |
| На2ХПО4 | 0,34 г | 5 мМ | |
| 500X E2B (100 мл) | |||
| КаCl2 | 5.5 г | 500 мМ | |
| 500X E2C (100 мл) | |||
| НаХКО3 | 3 г | 350 мМ | |
| 1X E2 (500 мл) | |||
| 100X E2A | 5 мл | в 1 раз | |
| 500X E2B | 1 мл | в 1 раз | |
| 500X E2C | 1 мл | в 1 раз |
Таблица 1: Компоненты 1 среды E2 для культуры клеток рыбок данио.
- E3 Медиа (1x)
- Растворите компоненты в 1 л стерильной воды, как показано в таблице 2, чтобы получить 100x запас. Разбавьте бульон в стерильной воде, чтобы получить 1 х E3 среды.
- Добавьте 0,2% метиленового синего. Для 20 мл 1 среды E3 добавьте 40 мкл метиленового синего.
- Сделайте еще одну партию без метиленового синего для флуоресцентной визуализации.
| компонент | Количество (г) | Концентрация в 100X запасе (мММ) |
| НаКл | 29.22 | 500 |
| ККл | 1.26 | 17 |
| CaCl2 2H2O | 4.85 | 33 |
| MgSO4 7H2O | 8.13 | 33 |
Таблица 2: Компоненты среды 100x E3 для поддержания эмбрионов рыбок данио.
- 80x солевой раствор
- Объедините все компоненты, показанные в таблице 3. Добавьте воду, чтобы получить 100 мл раствора. Перемешайте до тех пор, пока все компоненты не растворятся. Хранить раствор при 4 °C.
| компонент | Количество (г) | Концентрация в запасе (мМ) |
| глюкоза | 1.44 | 80 |
| Пируват натрия | 0.44 | 40 |
| CaCl2 2H2O | 0.148 | 10 |
| ХЕПЕС | 6.1 | 256 |
Таблица 3: Компоненты 80x физиологического раствора для культуры клеток рыбок данио.
- Среда для культивной культуры клеток рыбок данио (ZFCM+)
- Объедините все компоненты, показанные в таблице 4, чтобы получить 250 мл среды. Отрегулируйте pH до 7,5. Фильтрующие материалы используют фильтр 0,22 мкм и хранят при 4 °C.
| компонент | Количество (мл) | Объем % |
| L-15 среда (с фенолом красного цвета) | 212.75 | 85.1 |
| Фетальная бытовая сыворотка (FBS) | 5 | 2 |
| Пенициллин/Стрептомицин | 1 | 0.4 |
| 80X Солевой раствор | 3.125 | 1.25 |
| Вода | 28.125 | 11.25 |
Таблица 4: Компоненты культуры клеток рыбок данио с сывороткой и антибиотиками.
- Культурная среда для клеток рыбок данио для визуализации (ZFCM-)
- Объедините все компоненты, показанные в таблице 5, чтобы получить 250 мл среды. Отрегулируйте pH до 7,5. Фильтрующий материал с использованием фильтра 0,22 мкм.
- Делайте одноразовые аликвоты (партии 50 мл) для предотвращения загрязнения. Хранить при 4 °C.
| компонент | Количество (мл) | Объем % |
| L-15 среда (без фенола красного цвета) | 212.75 | 85.1 |
| 80X Солевой раствор | 3.125 | 1.25 |
| Вода | 34.125 | 13.65 |
Таблица 5: Компоненты среды для культивовок рыбок данио без сыворотки и антибиотиков для визуализации in vitro.
- Литьевые формы
- Растворяют 1,5% агарозы в средах Е3. Налейте ~ 25 мл агарозы в чашку Петри 100 х 15 мм.
- Положите форму поверх агарозы под углом 45° по отношению к поверхности и дайте ей плавать на агарозе с замедленным движением. Это поможет избежать пузырей. Дайте агарозе остыть и затвердеть на столешницы.
- После полного затвердевания медленно удаляйте плесень, чтобы предотвратить разрушение агарозы. Добавьте свежие носители E3, добавьте парафиновую пленку вокруг блюда, чтобы предотвратить разливы, и храните при 4 °C (рисунок 3).
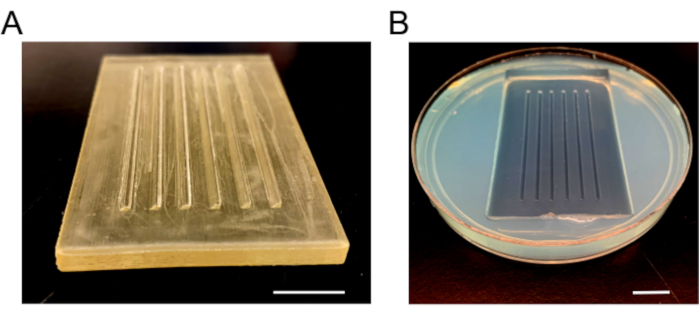
Рисунок 3:Изображения литьевых форм. (A) Пластиковая форма, которая используется для изготовления литьевых пластин. Форма имеет шесть рамп, одну 90° и одну скошенную сторону 45° для удержания эмбрионов на месте. (B) Инъекционная пластина после затвердевания агарозы и удаления формы. Шкала = 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Получение и инъекция мРНК roGFP2-Orp1
ПРИМЕЧАНИЕ: Конструкция roGFP2-Orp1 была получена от доктора Тобиаса Дика, DKFZ, Германия. Он был субклонирован в вектор pCS2+ в лаборатории доктора Цин Дэна, Университет Пердью. Для предотвращения деградации РНКазы необходимо принять ряд мер предосторожности. Реагенты и трубки без РНКазы должны использоваться в любое время, перчатки должны быть надеты на все этапы, и, в качестве альтернативы, материалы и поверхности могут быть протерты чистящим средством для удаления РНКазы.
- Линеаризация 3-10 мкг вектора pCS2+/roGFP2-Orp1 с помощью NotI.
- Очистите линеаризованную плазмиду с помощью набора для очистки ПЦР.
- In vitro транскрибируют мРНК roGFP2-Orp1 с помощью набора транскрипции in vitro в соответствии с инструкциями, предоставленными производителем.
- Закрытая сборка реакции транскрипции
- Поместите РНК-полимеразу и линеаризированную/очищенную ДНК на лед. Вихревой 10-кратный реакционный буфер и 2x NTP/CAP до тех пор, пока они полностью не будут в растворе. Храните NTP/CAP на льду, но держите буфер при комнатной температуре (RT) во время сборки реакции. Перед открытием трубок раскрутите все реагенты, чтобы предотвратить загрязнение.
- Настройте реакцию синтеза РНК в указанном ниже порядке на РТ в безрназной центрифужной трубке 0,5 мл. Конечный объем реакции составляет 20 мкл. Реакционная установка показана в таблице 6.
- Добавьте 10 мкл смеси рибонуклеотидов, 2x NTP/CAP и воду без нуклеазы, если это необходимо, в трубку. Добавьте 2 мкл реакционного буфера 10X. Добавьте 1-1,5 мкг линейной ДНК (до 6 мкл). При необходимости добавьте воду без нуклеазы, чтобы составить 20 мкл реакционного объема.
- Закройте трубку, ненадолго вихрь и коснитесь-спинового микрофуга. Добавьте 2 мкл 10-кратной смеси ферментов SP6. Закройте щелчком пальца и вращайте касанием в микрофуге.
- Поместите при 37 °C на 2-2,5 ч (может доходить до 18 ч).
ПРИМЕЧАНИЕ: В представленном эксперименте в течение ночи 16-18 ч инкубации при 37 °C была выполнена для достижения наилучших результатов. - Добавьте 1 мкл ДНКазы для удаления шаблона ДНК, щелчка пальцем, касания и инкубации при 37 °C в течение 15 мин.
- Закрытая сборка реакции транскрипции
| реагент | Объем (мкл) | Количество в реакции |
| 2X NTP/CAP | 10 | в 1 раз |
| 10X реакционный буфер | 2 | в 1 раз |
| ДНК шаблона | До 6 | 1-1,5 мкг |
| Вода без нуклеаз | Добавить, чтобы получить 20 мкл | |
| 10X SP6 ферментная смесь | 2 | в 1 раз |
Таблица 6: Настройка реакции на транскрипцию мРНК in vitro roGFP2-Orp1.
- Восстановление РНК
- Добавьте 25 мкл хлорида лития (LiCl), поставляемого в комплекте транскрипции in vitro. Поместите при -20 °C в морозильную камеру не менее чем на 30 мин.
- Вращаться в течение 25 мин на максимальной скорости в настольной центрифуге при 4 °C. Удалите и выбросьте супернатант осторожно, чтобы не потревожить гранулы. Добавьте 25 мкл холодного 75% этанола и открутите в течение 5 мин при 4 °C.
- Аккуратно удалите и выбросьте супернатант. Дайте гранулированной воздушной высохнуть не менее 5 мин при RT. Не дайте высохнуть. Добавьте 12 мкл свободного от нуклеазы буфера Tris-EDTA (TE) (pH 7,0) и сохраните образец на льду.
- Измерьте концентрацию РНК с помощью спектрофотометра. Обычно получается 0,5-1 мкг/мкл.
- Готовят 100 нг/мкл мРНК в растворе фенольных красных (0,5% фенол красного в фосфатно-буферном физиологическом растворе Dulbecco -DPBS) и аликвоту для однократного применения (3-5 мкл). Хранить аликвоты мРНК при - 80 °C.
- Микроинъекция мРНК
- В день инъекции используйте одну из аликвот мРНК и следуйте протоколу инъекции эмбриона рыбки данио, чтобы ввести 1 нЛ мРНК в эмбрионы одноклеточной стадии через их желток19. Ниже приводится краткое описание.
- Разводите взрослых рыб и собирайте эмбрионы, как описаноранее 20.
- Вытягиваем микроинъекцию игл с помощью пипетки. Вырежьте кончик игл щипцами, чтобы создать отверстие наконечника 10 мкм.
- Выровнять эмбрионы в литьевую форму, описанную в Шаге 1.6.
- Вводят 1 нЛ мРНК фенол красного цвета стеклянной микроинъекционным пипеткой.
- Собирайте эмбрионы и храните их в среде E3.
- Держите эмбрионы в инкубаторе с 27 °C в среде E3 до достижения желаемой стадии развития. Введенные эмбрионы могут быть использованы как для визуализации in vitro (раздел 3 и раздел 4), так и для визуализации in vivo (раздел 5). Эмбрионы, экспрессирующие roGFP2-Orp1, могут быть предварительно отобраны перед экспериментами с помощью обычного диссекционного микроскопа, оснащенного флуоресцентным светом и набором сине-зеленых фильтров.
3. Первичная культура ганглиозных клеток сетчатки, полученная из эмбрионов рыбок данио
ПРИМЕЧАНИЕ: Данный протокол адаптирован из ранее опубликованного способа 21. Выполните шаги 3.1 и 3.2 в ламинарной вытяжке.
- Подготовка покровов
- Подготовьте 4-6 культурных пластин в каждом эксперименте. Используйте очищенные кислотой покровные прослойки (квадрат 22 х 22 мм; толщина 0,16-0,19 мм), которые хранятся в 100% этаноле.
- Снимите один чехл из контейнера для хранения с помощью щипцов и зажжите его, чтобы удалить остаточный этанол.
- Полностью высушите крышку на воздухе, поместив ее под углом внутрь 35-миллиметровой чашки для культивовки.
- Готовят рабочий раствор поли-D-лизина (PDL) (1x), разбавляя 10x бульона (5 мг/мл) в стерильной воде.
- Нанесите 100 мкл 0,5 мг/мл PDL к центру каждого покровного листа и избегайте растекания раствора по краям.
- Инкубировать PDL на крышках в течение 20-30 мин при комнатной температуре (RT). Убедитесь, что PDL не высыхает.
- Промыть PDL стерильной водой 0,5 мл три раза. Дайте тарелкам полностью высохнуть.
- Готовят рабочий раствор ламинина (1x), разбавляя 50x бульона (1 мг/мл) в 1x PBS.
- Нанесите 100 мкл 20 мкг/мл ламинина в PBS к центру каждого обложек и избегайте растекания раствора по краям.
- Инкубировать пластины при 37 °C в увлажненный инкубатор в течение 2-6 ч. Избегайте высыхания раствора ламинина.
- Вскрытие эмбрионов и покрытие RGC
- Подготовьте и маркируете четыре 35-мм блюда для посева тканей и наполните 4 мл: 70% этанола, «Е2 среды 1», «Е2 среды 2», «Е2 среды 3» в день вскрытия. Храните посуду в холодильнике до рассечения.
- Когда эмбрионы рыбок данио находятся в 34 часах после оплодотворения (HPF), выньте из инкубатора посуду для культивации, покрытую ламинином, и трижды вымойте покровы 0,5 мл 1x PBS.
- После окончательной стирки добавьте 4 мл среды ZFCM(+) в каждое блюдо для культивирования и избегайте сушки тарелки.
- Извлеките приготовленные блюда из области культуры из Шага 3.2.1. Пусть они уравновешиваются RT.
- Заполните 4-6 пробирок ПЦР 15 мкл среды ZFCM(+). Одна трубка необходима для подготовки RGC из 4 глаз, которые будут покрыты на одном крышке.
- Извлеките эмбрионы рыбок данио из инкубатора и погрузите эмбрионы в 35-миллиметровую чашку для культивации тканей, содержащую 70% этанола, на 5-10 с для стерилизации.
- Используя переносную пипетку, перенесите эмбрионы в чашку E2 Media 1, содержащую стерильные среды E2, для промывки избытка этанола.
- Перенесите эмбрионы в тарелку E2 Media 2 и удалите их хорионы острыми щипцами.
- Перенесите эмбрионы в конечную посуду E2 Media 3 для выполнения вскрытия.
- Используя пару тонких щипцов, рассекните сетчатку, как описано ранее 22.
- Расположите и удерживайте эмбрионы перед желтком одним из щипцов и удалите хвост с задней части желтого мешка с другими щипцами.
- Возьмите шею щипцами и снимайте голову, чтобы подвергнуть мозг и глаза воздействию среды E2. Избегайте разрезания желтокового мешка.
- Кончиком тонких щипцов аккуратно закатываем глаза от головы, при этом удерживая черепную ткань вниз вторыми щипцами. Держите глаза изолированными от остатков соседних тканей.
- Переложите четыре глаза на одну из предварительно приготовленных пробирок, содержащих ZFCM(+).
- Осторожно титруйте вверх и вниз пипеткой P20 и желтым наконечником около 45 раз, чтобы диссоциировать клетки. Избегайте пузырьков воздуха.
- Перенесите ZFCM(+) с диссоциированными ячейками в центр покровного листа. Повторите шаги 10–12 для дополнительных обложек.
- Поддерживайте культуры на столешнице при 22 °C на стойке из пенополистирола для поглощения вибраций.
- Выполняют визуализацию через 6-24 ч после нанесения покрытия.
ПРИМЕЧАНИЕ: Используйте переносную пипетку для перемещения эмбрионов в различные культуральные блюда. Замените пипетку для каждого раствора, чтобы предотвратить перенос этанола (шаги 6-8).
4. Визуализация IN vitro ROS культивированных нейронов RGC
- В день визуализации (обычно через 6-24 ч после покрытия клеток) проверьте клетки под микроскопом, чтобы подтвердить рост аксонов RGC.
- Для визуализации живых клеток перенесите обтекания из чашки для культивовки в камеру визуализации живых клеток. В этом случае использовалась изготовленная на заказ открытая камера, которая была ранее описана23.
- Настройте микроскоп для визуализации. Используйте инвертированный микроскоп, оснащенный объективом дифференциального интерференционного контраста (DIC), длинным красным фильтром OG590 и камерой EM-CCD.
- Перед созданием изображения замените носитель ZFCM(+) на ZFCM(-).
- После того, как ячейки расположены с 10-кратным объективом, получите изображения с 60-кратным увеличением, используя цель погружения масла с высоким NA. Используйте дополнительное увеличение в 1,5 раза.
- Во-первых, получите изображения DIC. Затем изобразите roGFP2-Orp1 с помощью соответствующего набора фильтров. Возбуждайте roGFP2-Orp1 с фильтрами возбуждения 405/20 и 480/30 нм последовательно и получайте изображения с эмиссионной фильтрой 535/30 нм после того, как эмиссионные свет прошли через дихроичное зеркало 505DCXR.
- После получения первого набора изображений обменяйте носители со средами, содержащими различные лечебные растворы. Носители следует менять каждые 30 минут визуализации, чтобы избежать изменений рН и осмолярности.
5. In vivo ROS визуализация развивающихся эмбрионов
- Для визуализации in vivo храните эмбрионы в среде E3, содержащей 0,003% фенилтиомерины (PTU) без метиленового синего от 22-24 л.с. Ежедневно обменивайтеся средами и удаляйте мертвые эмбрионы.
- В желаемом возрасте обезболивают эмбрионы в 0,016% трикаина. Накладываем обезболенные эмбрионы в 1% низкоплавкой агарозе на 35-миллиметровую стеклянную посуду для культуры. Эмбрионы могут быть ориентированы дорсально, вентрально или латерально, в зависимости от области, интересующей для визуализации.
- После затвердения агарозы наполните посуду средой Е3 без метиленового синего/0,016% трикаина.
- Настройте микроскоп для визуализации. Используйте инвертированный лазерный сканирующий конфокальный микроскоп. В качестве альтернативы, используйте вертикальный конфокальный микроскоп, оснащенный водоиммерной линзой для изображения эмбрионов, установленных поверх капли агарозы.
- Возбуждайте roGFP2-Orp1 с фильтрами возбуждения 405 нм и 488 нм последовательно и получайте соответствующие изображения с эмиссионные фильтры в диапазоне 515-535 нм.
- Приобретайте z-стеки с толщиной сечения 5 мкм через нужную часть эмбрионов. Эмбрионы могут быть сохранены для визуализации на более поздних стадиях развития.
- После визуализации удалите эмбрионы из агарозы тонкими щипцами и держите в инкубаторе до желаемого возраста в метиленовых синих средах с ПТУ.
6. Анализ и обработка изображений
- Измерение уровней H2O2 на основе значений соотношения 405/480
- Используйте подходящее программное обеспечение для анализа изображений. Программное обеспечение ImageJ использовалось здесь для анализа и обработки изображений.
- Откройте изображения DIC, 405/535 и 480/535 в программном обеспечении ImageJ, перетащив файлы или щелкнув Файл | Открыть. Если это еще не сделано, преобразуйте изображения в 32-разрядные, щелкнув Image | Тип | 32-разряднаяверсия .
- Определите интересуемую область (ROI) с помощью инструмента свободной руки от панели управления (тело клетки, конус роста, сетчатка и т. Д.). Откройте менеджер окупаемокрой инвестиций, щелкнув Анализ | Инструменты | Менеджер по окупаемоемо мусям. Нажмите кнопку Добавить на вкладке Диспетчер окупаеморожить инвестиции, чтобы добавить определенную окупаемо емку.
- Нарисуйте регион, близкий к ROI, и добавьте в качестве фонового ROI. Измерьте средние фоновые значения, выбрав рентабельность инвестиций и щелкнув Измерить на вкладке Диспетчер окупаеморования инвестиций.
- Обратите внимание на средние значения интенсивности измерения. Вычтите значение среднего фона из флуоресцентных изображений, щелкнув Обработать | Математические | Вычесть. Выполните этот шаг для изображений 405/535 и 480/535.
- Добавьте значение "1" к флуоресцентному изображению 480/535, чтобы исключить значения "0", щелкнув Обработать | Математические | Добавить функцию перед вычислением соотношения.
- Нажмите | обработки Калькулятор изображений | Функция деления в ImageJ для деления изображения 405/535 на 480/535 попиксельное изображение. Выберите изображение 405/535, которое будет разделено на изображение 480/535. Выберите 32-разрядное выходное изображение.
- Примените ROI к изображению соотношения, сначала щелкнув изображение соотношения, а затем ROI на вкладке диспетчера ROI.
- Измерьте средние значения соотношения изображения 405/535 к изображению 480/535, щелкнув Измерить на вкладке Менеджер ROI.
- Выполните шаги 6.1.2-6.1.9 для как можно большего количества выборок для выполнения соответствующего статистического анализа.
- Отображение изображения соотношения
ПРИМЕЧАНИЕ: Эта процедура заключается в вычитание фона за пределами образца и применении таблицы цветового поиска к изображению.- После создания изображения соотношения сторон в ImageJ на шаге 6.1.7., создайте 32-битное черное изображение, щелкнув Файл | Новые | Изображение.
- Примените к новому изображению уровни ROI, для которого выхотитеотобразить уровни H 2 O2, сначала щелкнув новое изображение, а затем ROI на вкладке менеджера ROI.
- Создайте маску, нажав кнопку Изменить | | выбора Создать маску.
- Разделите изображение маски на 255, чтобы настроить значение ROI на «1», а фоновые значения будут «0». Нажмите | обработки Математические | Разделите и введите 255.
- Умножьте маску с изображением соотношения, щелкнув Обработать | Калькулятор изображений | Функция умножения. Это приведет к тому, что изображение с соотношением оттенков серого покажет только рентабельность инвестиций.
- Измените таблицу поиска на "Fire", нажав на Image | Поиск таблиц | Огонь.
ПРИМЕЧАНИЕ: Коэффициент умножения можно применить ко всем изображениям для лучшей визуализации соотношения, щелкнув Процесс | | изображений Умножьте. - Преобразуйте изображение с соотношением сторон в 8 бит, щелкнув Изображение | Тип | 8-бит.
- Добавьте калибровочную панель, щелкнув Анализ | Инструменты | Калибровочный стерженок.
Access restricted. Please log in or start a trial to view this content.
Результаты
Культивированная рыбка данио RGC расширяет аксоны в пределах 1d. Репрезентативное изображение с соотношением 405/480 биосенсора H2O2показано на фиг.4A. Тело клетки, аксон и колбки роста хорошо видны в отдельных нейронах. Эти нейроны могут подвергаться различным мет?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Существует несколько критических шагов, которые требуют внимания в этом протоколе. Мы считаем, что рассмотрение этих моментов улучшит экспериментальный поток. Для первичной культуры RGC стерильность ZFCM(-) очень важна, поскольку эта культуральная среда не содержит антибиотиков, и загряз?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Эта работа была поддержана Национальными институтами здравоохранения (грант R01NS117701), Национальным научным фондом (грант 1146944-IOS), Фондом исследований черепно-мозгового мозга и черепно-мозговой травмы штата Индиана (грант 20000289), Исследовательским фондом Пердью (грант 209911) и Офисом исполнительного вице-президента по исследованиям и партнерствам в Университете Пердью (грант 210362). Мы благодарим д-ра Кори Уивера и Хейли Редер за создание протокола культивирования рыбок данио RGC. Мы также благодарим Хейли Редер за предоставление данных рисунка 4. Мы благодарим Лию Биази и Кенни Нгуена за помощь в культуре RGC. Мы благодарим Джентри Ли за редактирование текста. Мы благодарим д-ра Тобиаса Дика за предоставление roGFP2-Orp1 и д-ра Цин Дэна за вектор pCS2+, содержащий roGFP2-Orp1. Рисунок 2 создан с помощью Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
Ссылки
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752(2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12(2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115(2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539(2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028(2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132(2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222(2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены