A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في تصوير الكالسيوم في الجسم الحي من الماوس Geniculate استجابات الخلايا العصبية العقدية لتذوق المحفزات
In This Article
Summary
هنا نقدم كيفية فضح العقدة geniculate من حية، مخدر الماوس المختبر وكيفية استخدام التصوير الكالسيوم لقياس استجابات مجموعات من هذه الخلايا العصبية لتذوق المحفزات، مما يسمح لتجارب متعددة مع المنشطات المختلفة. وهذا يسمح لمقارنات متعمقة من الخلايا العصبية التي تستجيب التي التي tastants.
Abstract
خلال السنوات العشر الماضية، عززت التطورات في مؤشرات الكالسيوم المشفرة وراثيا (GECIs) ثورة في التصوير الوظيفي في الجسم الحي. باستخدام الكالسيوم كوكيل لنشاط الخلايا العصبية، توفر هذه التقنيات وسيلة لرصد استجابات الخلايا الفردية داخل مجموعات الخلايا العصبية الكبيرة لمجموعة متنوعة من المحفزات في الوقت الحقيقي. نحن، وآخرون، قد طبقت هذه التقنيات لتصوير استجابات الخلايا العصبية العقدة geniculate الفردية لتذوق المحفزات المطبقة على ألسنة الفئران مخدر الحية. تتكون العقدة الجينية من أجسام الخلايا العصبية gustatory الداخلية اللسان الأمامي والحنك، فضلا عن بعض الخلايا العصبية الحسية سوماتوسوسي ت الداخلي بينا الأذن. وقد قدم تصوير الاستجابات التي أثارها الذوق من الخلايا العصبية العقدة geniculate الفردية مع GCaMP معلومات هامة حول ملامح ضبط هذه الخلايا العصبية في الفئران البرية من نوع فضلا عن وسيلة للكشف عن الأنماط الظاهرية الذوق المحيطي miswiring في الفئران التلاعب وراثيا. هنا نعرض الإجراء الجراحي لكشف العقدة الجينية ، واكتساب صورة GCaMP الفلورية ، والخطوات الأولية لتحليل البيانات ، واستكشاف الأخطاء وإصلاحها. يمكن استخدام هذه التقنية مع GCaMP المشفرة وراثيا ، أو مع تعبير GCaMP بوساطة AAV ، ويمكن تعديلها لتصوير مجموعات فرعية وراثية معينة ذات أهمية (أي تعبير GCaMP بوساطة Cre). عموما، في تصوير الكالسيوم في الجسم الحي من الخلايا العصبية العقدة geniculate هو تقنية قوية لرصد نشاط الخلايا العصبية gustatory الطرفية ويوفر معلومات تكميلية لتسجيلات أكثر تقليدية وتر العصب كله tympani أو المقايسات سلوك الذوق.
Introduction
أحد المكونات الرئيسية لنظام الذوق المحيطي للثدييات هو العقدة الجينية. بالإضافة إلى بعض الخلايا العصبية الحسية التي ت الداخلي بينا الأذن، ويتكون geniculate من أجسام الخلايا العصبية gustatory الداخلية اللسان الأمامي والحنك. على غرار الخلايا العصبية الحسية الطرفية الأخرى ، فإن الخلايا العصبية العقدية الجينية هي أحادية القطب الزائفة مع محور عصبي طويل إسقاط هامشيا لبراعم الذوق ، ومركزية إلى نواة جذع الدماغ في الجهاز الانفرادي1. يتم تنشيط هذه الخلايا العصبية في المقام الأول عن طريق الافراج عن ATP من قبل خلايا مستقبلات الذوق الاستجابة لمحفزات الذوق في تجويف الفم2,3. ATP هو ناقل عصبي أساسي للإشارات الذوق, ومستقبلات P2rx التي أعرب عنها الخلايا العصبية العقدة gustatory ضروريةلتفعيلها 4. وبالنظر إلى أن خلايا مستقبلات الذوق تعبر عن مستقبلات طعم محددة لصيغة طعم معين (الحلو، المر، المالحة، أومامي، أو الحامض)، فقد افترض أن استجابات الخلايا العصبية العقدية gustatory لمحفزات الذوق سيكون أيضا ضبطها بشقالأنفس 5.
وقد أظهرت تسجيلات الأعصاب كلها على حد سواء و chorda tympani والأعصاب بتروسال متفوقة أكبر إجراء إشارات gustatory تمثل جميع طرائق الذوق الخمسة إلى العقدة geniculate6،7. ومع ذلك، هذا لا يزال يترك أسئلة حول خصوصية الاستجابات العصبية لتسانت معين: إذا كان هناك طريقة الذوق الخلايا العصبية محددة، والخلايا العصبية متعددة الوسائط، أو خليط من كليهما. تسجيلات الألياف واحدة تعطي المزيد من المعلومات حول نشاط الألياف الفردية والحساسيات الكيميائية8،9،10، ولكن هذه المنهجية تقتصر على جمع البيانات من أعداد صغيرة من الألياف. وبالمثل، في التسجيلات الكهربية في الجسم الحي من الخلايا العصبية العقدة geniculate الفئران الفردية تعطي معلومات حول استجابات الخلايا العصبية الفردية11،12،13، ولكن لا يزال يفقد نشاط السكان وتسفر عن تسجيلات الخلايا العصبية قليلة نسبيا لكل. من أجل تحليل أنماط الاستجابة للفرق العصبية دون إغفال نشاط الخلايا العصبية الفردية، وتقنيات جديدة تحتاج إلى استخدامها.
وقد وفرت التصوير الكالسيوم، وخاصة باستخدام مؤشرات الكالسيوم المشفرة وراثيا مثل GCaMP، هذا الاختراق التقني14،15،16،17،18. يستخدم GCaMP الكالسيوم كوكيل لنشاط الخلايا العصبية ، مما يزيد من الفلورة الخضراء مع ارتفاع مستويات الكالسيوم داخل الخلية. أشكال جديدة من GCaMP لا تزال تتطور لتحسين نسبة الإشارة إلى الضوضاء، وضبط الحركية ملزمة، والتكيف مع التجارب المتخصصة19. يوفر GCaMP دقة خلية عصبية واحدة ، على عكس التسجيل العصبي بأكمله ، ويمكنه في وقت واحد قياس استجابات مجموعات الخلايا العصبية ، على عكس الألياف الفردية أو تسجيل الخلايا الواحدة. وقد قدم تصوير الكالسيوم من العقدة geniculate بالفعل معلومات هامة حول ملامح ضبط هذه الخلايا العصبية في الفئران البرية من النوع16،20، وحددت الذوق المحيطي miswiring الأنماط الظاهرية في الفئران التلاعب وراثيا18.
إحدى الصعوبات الرئيسية لتطبيق تقنيات تصوير الكالسيوم في الجسم الحي على العقدة الجينية هي أنه مغلف داخل الثور التكتل العظمي. من أجل الحصول على الوصول البصري إلى geniculate ، مطلوب جراحة دقيقة لإزالة طبقات العظام ، مع الحفاظ على العقدة سليمة. لهذا الغرض، أنشأنا هذا الدليل لمساعدة الباحثين الآخرين على الوصول إلى العقدة الجينية وصورة استجابات GCaMP الفلورية بوساطة هذه الخلايا العصبية لتذوق المحفزات في الجسم الحي.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم مراجعة البروتوكولات الحيوانية والموافقة عليها من قبل اللجان المؤسسية لرعاية الحيوانات واستخدامها في جامعة تكساس سان أنطونيو.
1. الإعداد قبل العملية
ملاحظة: يرجى ملاحظة أن الإعداد الأولي للمعدات لا يتم تناوله هنا، حيث سيختلف استنادا إلى نظام المضخة والمجهر والكاميرا وبرامج التصوير المستخدمة. للحصول على تعليمات الإعداد يرجى الرجوع إلى المواد التعليمية المقدمة من قبل بائع المعدات. للاطلاع على المعدات التي يستخدمها المؤلفون، يرجى الاطلاع على جدول المواد.
- ضمان تدفق السوائل من خلال جميع المركبات (المياه) وخطوط التسائب. إذا تم حظر الخط، افصله واتدفق بالماء. إذا كان الخط مكمن الخلل، والتدليك حتى يتدفق السائل. تأكد من أن يبدأ السائل ويتوقف على جديلة.
- بمجرد التأكد من إلغاء حظر جميع الخطوط ، قم بتشغيل السيارة لمدة 10 ثانية ثم أغلق جميع الصمامات.
- تأكد من أن برنامج التصوير جاهز لجميع المتغيرات المطلوبة (على سبيل المثال، طول الإصدار التجريبي، أسماء الملفات، معدل الإطار، إلخ). باستخدام μManager ، وهي حزمة برامج الحصول على صورة مفتوحة المصدر ، وإدخال 200 مللي ثانية في الحقل المسمى وقت التعرض لإطارات في الثانية من 5Hz ، حدد x2 تحت binning، واضغط على الزر المسمى لايف. عند بدء تشغيل الفيديو، اضغط على الزر الموجود على الجانب الأيسر المسمى ROI. سيؤدي هذا إلى حقل عرض 512x512.
2. تخدير وشل حركة الحيوان
ملاحظة: البروتوكول التالي هو إجراء المحطة الطرفية الأمثل للفئران من أي من الجنسين وزنها 18-35 غرام. ينصح باستخدامه مع الحيوانات التي تتراوح أعمارهم بين 10 و 12 أسبوعا. ويمكن استخدامه مع الحيوانات المعدلة وراثيا التعبير عن مؤشرات الكالسيوم المشفرة وراثيا (GECIs) مثل Snap25-GCaMP6s، أو الحيوانات حقن ستيريوتاكاكسيكالي مع GECIs الفيروسية. يجب ارتداء القفازات ومعطف المختبر وقناع الوجه لكامل البروتوكول.
- Scruff الحيوان وإجراء حقن داخل الصفاق من الكيتامين (100 ملغ / كغ) وXylazine (10 ملغ / كغ). تقييم عمق التخدير عن طريق قرصة إصبع القدم قبل المتابعة.
- حلق الجزء العلوي من الرأس amd المنطقة الجراحية في الجزء الأمامي من الرقبة.
- بدوره على وسادة التدفئة ووضع الحيوان عرضة على لوحة.
- ضعي مرهم على عيون الحيوان لتجنب تجفيف العينين.
- إجراء شق (~ 1 سم) في خط الوسط من الرأس لفضح جمجمة الحيوان. إزالة النسيج الضام باستخدام مسحة معقمة بحيث يمكن الوصول إلى العظام العارية. استخدام القطن يميل قضيب لضمان الجمجمة جافة.
- تطبيق السندات البيطرية إلى الجمجمة. تأكد من تغطية الجمجمة المكشوفة. انتظر حتى يجف الغراء.
- في غطاء طبق بيتري، اخلطي وطبقي طبقة من أسمنت الأسنان على الجمجمة. النهاية الخلفية للقطن يميل قضيب المستخدمة في الخطوة 2.5 ستعمل بشكل جيد لهذه العملية. ضع عمود الرأس فوق أسمنت الأسنان وطبق طبقة ثانية من أسمنت الأسنان لوضع عمود الرأس في مكانه على الجمجمة.
- دعه يجلس حتى يجف أسمنت الأسنان وتماسكه. كسر القطن يميل قضيب في النصف واستخدام نهايات مدببة لكزة أسمنت الأسنان لاختبار. إذا كان الاسمنت الأسنان لا تستسلم لكونها مطعون الحيوان قد تتحول إلى موقف سوبين.
3. القصبة الهوائية
- تطبيق فرك ما قبل الجراحة على المنطقة الجراحية. بعد فرك، وجعل شق خط الوسط ~ 2 سم في الجلد من الحلق من القص إلى الذقن.
- تراجع الجلد والغدد شبه الفكية، والتأكد من أن تكشف تماما العضلات digastric.
- العثور على التماس في العضلات paratracheal، فصله مع تشريح حادة، وتراجع مفتوحة.
- قطع بعناية فتحة في الجزء العلوي من القصبة الهوائية كبيرة بما يكفي لتناسب أنابيب البولي ايثيلين (I.D. 0.86 ملم، O.D. 1.27 ملم). لا تقطع أكثر من منتصف الطريق من خلال قطر القصبة الهوائية. أدخل أنابيب في القصبة الهوائية نحو الرئتين.
- إعادة وضع الرافضات لإطلاق العضلات paratracheal والتراجع عن الغدد تحت الفكية.
- الغراء العضلات paratracheal معا على أنابيب مع الحد الأدنى من الغراء البيطري (انظر الشكل 1A).
4. كسر فتح بولا التيمبية
- ندف بلطف العضلات digastric المطلوب (اليسار أو اليمين) حتى وسحب بعيدا النسيج الضام. قطع في الطرف الأمامي من العضلات، وتجنب الأوعية الدموية، وسحب الخلفي حتى واضحة من بولا التيمبية.
- إمالة الرأس إلى الوراء قليلا لرفع بولا التيمبية. حدد موقع فرع الشريان السباتي الأمامي إلى نقطة الإدراج الخلفية للعضلات الديجاستية. يشعر فقط الخلفي لهذا الأوعية الدموية لهيكل محدب من بولا التيمبية.
- ابحث عن التماس في العضلات في هذا الموقع (انظر الشكل 1B). باستخدام مجموعتين من ملقط غرامة، تشريح حادة في التماس حتى عظم بولا التيمبية مرئية. استخدام الجرافات للحفاظ على رؤية واضحة للبالا التيمبية.
- العثور على التماس تشغيل الأمامي إلى الخلفي على بولا (انظر الشكل 1C). باستخدام مسبار جراحي، كزة ثقب في العظام في وسط هذا التماس. استخدام مجموعة من مقص نهاية غرامة لقطع منطقة دائرية في العظام، مع الحرص على عدم قطع الأوعية الدموية الأمامي والخلفي، وعميقة تحت الثور.
5. تعريض geniculate
- داخل هذه الحفرة هو جزء محدب من العظام، وهذا هو القوقعة. الأمامي إلى القوقعة هو العضلات، وتيماني الشد (انظر الشكل 1D). باستخدام مقص الربيع، وقطع التيمباني الشد وإزالتها.
- تنفيذ قرصة إصبع القدم. إذا كان الحيوان يستجيب، وإعطاء خليط الكيتامين / xylazine ata 1/3 جرعة لإعادة السوسينج.
- إعداد سائل الري وخط الشفط. باستخدام المسبار الجراحي، كزة حفرة في الرعن قوقعة. ري السائل الذي يتدفق على الفور وإزالتها مع الشفط. هذا السائل سوف تتدفق بشكل مستمر أكثر أو أقل من هذه النقطة، وسوف تحتاج إلى معالجة دوريا.
- تكبير الثقب في القوقعة. العناية مع الأوعية الدموية التي تحيط القوقعة إلى الحافة الخلفية والظريلية.
- إمالة رأس الماوس إلى الأمام. حدد موقع الثقب في العظم الصدغي تحت ما كان القوقعة (انظر الشكل 1E). يحيط علما من التلال الأمامية لهذه الحفرة، هذه الحافة يجلس مباشرة على العصب السابع.
- أدخل مسبار جراحي في الحفرة وارفع العظم الزمني بعناية لكشف العصب السابع (انظر الشكل 1F). قم بتقييم مقدار العصب السابع المرئي وإذا لم يتم تعريض geniculate بالكامل ، قم بإمالة رأس الحيوان إلى الخلف ومحاولة سحب العظام من الأمامي إلى العصب.
- إذا كان العقدة لا تزال غير مرئية تماما، سحب المزيد من العظام من تحت. كن حذرا جدا عدم وضع المسبار العميق تحت العظام كما أن القيام بذلك قد يضر geniculate.
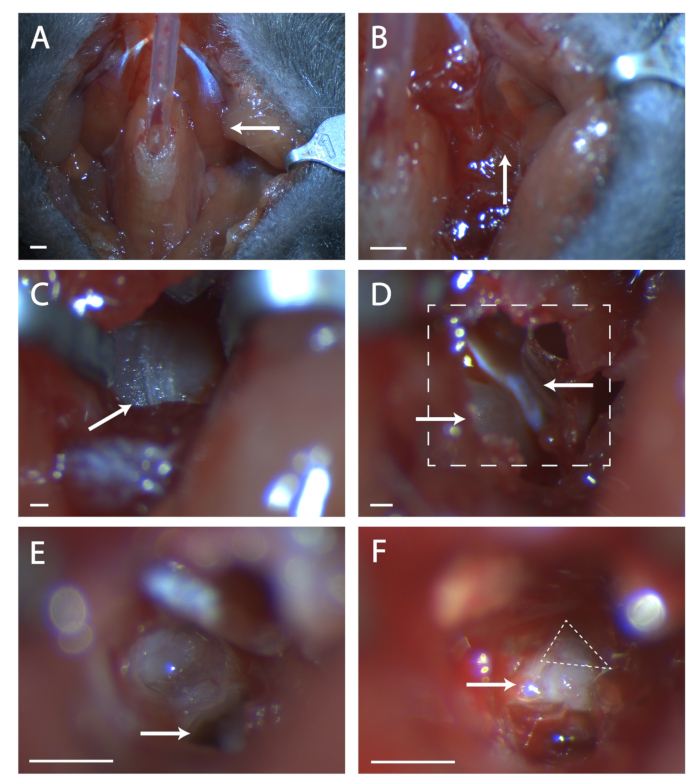
الشكل 1: التعرض الجراحي للغرغرينا geniculate. (أ) صورة لتجويف الرقبة الماوس بعد القصبة الهوائية. السهم يشير إلى العضلات digastric الكذب على المنطقة الجراحية استكشافها في بقية الشكل. (ب) صورة للمنطقة تحت العضلات digastric المشار إليها سابقا. السهم يشير إلى التماس في العضلات لتشريح حادة. (ج) صورة لبالا التيمبية. السهم يشير التماس في العظام لكسر مع التحقيق الجراحي. (د) صورة للمنطقة الجراحية بعد فتح بولا. السهم الأيسر السفلي يشير إلى القوقعة، يشير السهم العلوي إلى tympani الشد. يشير الخط المربع إلى المنطقة في (E) و (F). (ه) صورة للمنطقة الجراحية بعد كسر القوقعة وإزالة محتوياتها. يشير السهم الأبيض إلى مكان وضع المسبار الجراحي المشار إليه في الخطوة البروتوكولية 5.6. (F) صورة من العقدة geniculate المكشوفة. السهم يشير إلى جسم العصب السابع، مثلث متقطع يحيط العقدة geniculate. لوحات A-B، مقياس = 5 مم لوحات C-F، مقياس = 1 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. تشغيل لوحة تذوق
- استخدام الشفط لإزالة السائل من فوق geniculate. ضع نقطة ماصة اختياريا للمساعدة في تخفيف التسرب والمساعدة في الملاحة بالمجهر.
- ضع الحيوان على وسادة ماصة تحت المجهر. تحديد موقع العقدة geniculate: تشمل المعالم المفيدة الثقب المتبقي في الثيران، والثقب في العظام الصدغية، والعصب السابع. باستخدام فلتر FITC / GFP على نطاق epifluorescence ، تحقق من الخلايا العصبية الفردية GCaMP التعبير عن العقدة. وهناك هدف 10x (مسافة 10mm workind) توفير دقة كافية لتتبع نشاط الخلايا الفردية ، ولكن يمكن أيضا استخدام هدف 20x (مسافة العمل 12 ملم).
- وضع إبرة الاستغناء عن خط تذوق بقوة في فم الحيوان. ضع طبق بيتري أسفل فم الحيوان للقبض على السوائل.
- تأكد من أن الكاميرا تعرض مجال الرؤية للمجهر. مزامنة بداية تسجيل الفيديو مع بداية العرض التقديمي tastant.
- أثناء التسجيل، شاهد البث المباشر للاستجابات والانجراف والتسرب.
- إذا حدث تسرب، شفط السائل حتى عرض geniculate واضحة وتكرار. إذا حدث الانجراف، تحقق من أن جميع أجزاء من منصب رئيس يتم تشديد بحزم. إذا لم تحدث استجابات تحقق من أن السائل يتدفق وأن المجهر والكاميرا تركز على الموقع المناسب دون أي شيء يحجب مجال الرؤية.
- كرر حتى يتم الحصول على العدد المطلوب من مقاطع الفيديو. تخفيف بلطف الحفارات، ثم كرر الخطوات 3-6 على الجانب الآخر.
- بعد أن تم الحصول على أشرطة الفيديو المطلوبة لجميع ganglia المطلوبة، والقتل الرحيم الحيوان عن طريق خلع عنق الرحم.
Access restricted. Please log in or start a trial to view this content.
النتائج
بعد البروتوكول ، تم تخدير Snap25-GCaMP6s المعدل وراثيا ، وتم الكشف عن العقدة الجينية ، وتم تطبيق التذيل على اللسان أثناء تسجيل الفيديو. وكان الهدف من التجربة هو تحديد التيستات التي أثارت ردودا من كل خلية. تم إذابة التستانتس (30 mM AceK، 5 mM كوينين، 60 mM NaCl، 50 mM IMP + 1 mM MPG، 50 mM Citric Acid)18 في ماء DI و?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يصف هذا العمل بروتوكول خطوة بخطوة لفضح العقدة الجينية جراحيا وتسجيل نشاط خلاياها العصبية بصريا باستخدام GCaMP6s. هذا الإجراء مشابه جدا لتلك التي وصفت سابقا17، مع استثناءات ملحوظة قليلة. أولا ، استخدام منصب رئيس يسمح لتعديل سهل لتحديد المواقع في الرأس أثناء الجراحة. ثانيا، فيما ي?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ولا يوجد لدى أصحاب البلاغ أي تضارب في المصالح لتقديم التقارير.
Acknowledgements
يشكر المؤلفون س. همايون على تربية الفئران. وقد تم توفير التمويل لهذا العمل جزئيا من قبل اتحاد صحة الدماغ UTSA خريج ومنحة بذور ما بعد الدكتوراه (B.E.F.) والمعاهد الوطنية للصحة-SC2-GM130411 إلى L.J.M.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
References
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved