È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging in vivo del calcio delle risposte del neurone ganglio genicolato di topo agli stimoli del gusto
In questo articolo
Riepilogo
Qui presentiamo come esporre il ganglio genicolato di un topo da laboratorio vivo e anestetizzato e come utilizzare l'imaging del calcio per misurare le risposte degli insiemi di questi neuroni agli stimoli del gusto, consentendo prove multiple con diversi stimolanti. Ciò consente confronti approfonditi di quali neuroni rispondono a quali tastants.
Abstract
Negli ultimi dieci anni, i progressi negli indicatori di calcio geneticamente codificati (GECI) hanno promosso una rivoluzione nell'imaging funzionale in vivo. Utilizzando il calcio come proxy per l'attività neuronale, queste tecniche forniscono un modo per monitorare le risposte delle singole cellule all'interno di grandi insiemi neuronali a una varietà di stimoli in tempo reale. Noi, e altri, abbiamo applicato queste tecniche per immaginare le risposte dei singoli neuroni gangliali genicolati agli stimoli gustavi applicati alle lingue di topi vivi anestetizzati. Il ganglio genicolato è composto dai corpi cellulari dei neuroni gustativi che innervano la lingua e il palato anteriori e da alcuni neuroni somatosensoriali che innervano la pinna dell'orecchio. L'imaging delle risposte evocate dal gusto dei singoli neuroni gangliosi genicolati con GCaMP ha fornito importanti informazioni sui profili di sintonizzazione di questi neuroni nei topi wild-type e un modo per rilevare i fenotipi di errore di gusto periferico nei topi geneticamente manipolati. Qui dimostriamo la procedura chirurgica per esporre il ganglio genicolato, l'acquisizione dell'immagine di fluorescenza GCaMP, i passaggi iniziali per l'analisi dei dati e la risoluzione dei problemi. Questa tecnica può essere utilizzata con GCaMP codificato transgenicamente o con espressione GCaMP mediata da AAV e può essere modificata per l'immagine di particolari sottoinsiemi genetici di interesse (ad esempio, espressione GCaMP mediata da Cre). Nel complesso, l'imaging del calcio in vivo dei neuroni gangliari genicolati è una tecnica potente per monitorare l'attività dei neuroni gustativi periferici e fornisce informazioni complementari alle registrazioni più tradizionali della corda timpani a nervi interi o ai saggi del comportamento del gusto.
Introduzione
Un componente chiave del sistema gustatico periferico dei mammiferi è il ganglio genicolato. Oltre ad alcuni neuroni somatosensoriali che innervano la pinna dell'orecchio, il genicolato è costituito dai corpi cellulari dei neuroni gustativi che innervano la lingua e il palato anteriori. Simile ad altri neuroni sensoriali periferici, i neuroni gangliogenici sono pseudo-unipolari con un lungo assone che si proietta perifericamente verso le papille gustative e centralmente verso il nucleo del tronco cerebrale del tratto solitario1. Questi neuroni sono attivati principalmente dal rilascio di ATP da parte delle cellule del recettore del gusto che rispondono agli stimoli del gusto nella cavità orale2,3. L'ATP è un neurotrasmettitore essenziale per la segnalazione del gusto e i recettori P2rx espressi dai neuroni gangliari gustativi sono necessari per la loro attivazione4. Dato che le cellule recettrici del gusto esprimono specifici recettori del gusto per una particolare modalità di gusto (dolce, amaro, salato, umami o acido), è stato ipotizzato che le risposte dei neuroni gangliari gustativi agli stimoli del gusto sarebbero anche strettamente sintonizzate5.
Intere registrazioni nervose hanno mostrato che sia la chorda timone che i nervi petrosali superiori maggiori conducono segnali gustativi che rappresentano tutte e cinque le modalità di gusto al ganglio genicolato6,7. Tuttavia, questo ha ancora lasciato domande sulla specificità delle risposte neuronali a un dato tastant: se ci sono neuroni specifici della modalità di gusto, neuroni polimodali o una miscela di entrambi. Le registrazioni a fibra singola forniscono maggiori informazioni sull'attività delle singole fibre e sulle loro sensibilità chimiche8,9,10,ma questa metodologia è limitata alla raccolta di dati da un piccolo numero di fibre. Allo stesso modo, le registrazioni elettrofisiologiche in vivo di singoli neuroni gangliali genicolati di ratto forniscono informazioni sulle risposte dei singoli neuroni11,12,13, ma perde ancora l'attività della popolazione e produce relativamente poche registrazioni neuronali per animale. Al fine di analizzare i modelli di risposta degli insiemi neuronali senza perdere di vista l'attività dei singoli neuroni, è stato necessario impiegare nuove tecniche.
L'imaging del calcio, in particolare utilizzando indicatori di calcio geneticamente codificati come GCaMP, ha fornito questa svolta tecnica14,15,16,17,18. GCaMP utilizza il calcio come proxy per l'attività neuronale, aumentando la fluorescenza verde all'aumentare dei livelli di calcio all'interno della cellula. Nuove forme di GCaMP continuano ad essere sviluppate per migliorare il rapporto segnale/rumore, regolare la cinetica di legame e adattarsi per esperimenti specializzati19. GCaMP fornisce una risoluzione a singolo neurone, a differenza della registrazione dell'intero nervo, e può misurare contemporaneamente le risposte di insiemi di neuroni, a differenza della registrazione a fibra singola o singola cellula. L'imaging del calcio dei gangli genicolati ha già fornito importanti informazioni sui profili di sintonizzazione di questi neuroni nei topi wild-type16,20e ha identificato fenotipi di miswiring del gusto periferico nei topi geneticamente manipolati18.
Una delle maggiori difficoltà nell'applicare tecniche di imaging del calcio in vivo al ganglio genicolato è che è incapsulato all'interno della bolla timpanica ossea. Per ottenere l'accesso ottico al genicolato, è necessario un delicato intervento chirurgico per rimuovere gli strati di ossa, mantenendo intatto il ganglio. A tal fine, abbiamo creato questa guida per aiutare altri ricercatori ad accedere al ganglio genicolato e immaginare le risposte fluorescenti mediate da GCaMP di questi neuroni per gustare gli stimoli in vivo.
Access restricted. Please log in or start a trial to view this content.
Protocollo
I protocolli sugli animali sono stati esaminati e approvati dai comitati istituzionali per la cura e l'uso degli animali dell'Università del Texas a San Antonio.
1. Configurazione pre-operatoria
NOTA: Si prega di notare che la configurazione iniziale dell'apparecchiatura non è affrontata qui, in quanto varierà in base al sistema di pompaggio, al microscopio, alla fotocamera e al software di imaging utilizzato. Per le istruzioni di configurazione, fare riferimento ai materiali didattici forniti dal fornitore dell'apparecchiatura. Per le attrezzature utilizzate dagli autori, si prega di consultare la Tabella dei materiali.
- Garantire che il liquido scorra attraverso tutte le linee del veicolo (acqua) e del tastant. Se la linea è bloccata, scollegare e lavare con acqua. Se la linea è attorcigliata, massaggiare fino a quando il liquido scorre. Assicurarsi che il liquido si inizi e si fermi su spunto.
- Una volta confermate tutte le linee sbloccate, far funzionare il veicolo per 10 s quindi chiudere tutte le valvole.
- Assicurarsi che il software di imaging sia pronto con tutte le variabili richieste (ad esempio, lunghezza della prova, nomi dei file, frame rate, ecc.). Utilizzando μManager, un pacchetto software di acquisizione di immagini open source, immettere 200 ms nel campo etichettato Tempo di esposizione per un fotogramma al secondo di 5Hz, selezionare x2 sotto binninge premere il pulsante con l'etichetta Live. All'avvio del video, premi il pulsante sul lato sinistro con l'etichetta ROI. Ciò si tradurrà in un campo visivo di 512x512.
2. Anestetizzare e immobilizzare l'animale
NOTA: Il seguente protocollo è una procedura terminale ottimizzata per topi di entrambi i sessi di peso 18-35 g. Si raccomanda l'uso con animali di età compresa tra 10 e 12 settimane. Può essere utilizzato con animali transgenici che esprimono indicatori di calcio geneticamente codificati (GECI) come gli Snap25-GCaMP6s o animali iniettati stereotassicamente con GECI virali. Guanti, camice da laboratorio e mascherina devono essere indossati per l'intero protocollo.
- Scruff animale ed eseguire un'iniezione intraperitoneale di ketamina (100 mg/kg) e xilazina (10 mg/kg). Valutare la profondità dell'anestesia tramite pizzicamento della dita del dito prima di continuare.
- Rasare la parte superiore della testa e l'area chirurgica nella parte anteriore del collo.
- Accendere la piastra riscaldante e posizionare l'animale prono sul pad.
- Applicare un unguento sugli occhi dell'animale per evitare l'asciugatura degli occhi.
- Fai un'incisione (~ 1 cm) sulla linea mediana della testa per esporre il cranio dell'animale. Rimuovere il tessuto connettivo utilizzando un tampone sterile in modo che l'osso nudo sia accessibile. Utilizzare un applicatore con punta in cotone per assicurarsi che il cranio sia asciutto.
- Applicare il legame veterinario sul cranio. Assicurati di coprire il cranio esposto. Attendere che la colla si asciughi.
- In un coperchio della capsula di Petri, mescolare e applicare uno strato di cemento dentale sul cranio. La parte posteriore dell'applicatore con punta in cotone utilizzata nel passaggio 2.5 funzionerà bene per questo processo. Posizionare il paletto sopra il cemento dentale e applicare un secondo strato di cemento dentale per inserire il paletto in posizione sul cranio.
- Lasciare riposare fino a quando il cemento dentale è asciutto e solido. Rompere l'applicatore con punta di cotone a metà e utilizzare le estremità appuntite per colpire il cemento dentale per testare. Se il cemento dentale non cede all'essere colpito, l'animale può essere trasformato in posizione supina.
3. Tracheotomia
- Applicare lo scrub pre-chirurgico all'area chirurgica. Post-scrub, fare un'incisione della linea mediana ~ 2 cm nella pelle della gola dallo sterno al mento.
- Ritrarre la pelle e le ghiandole sub-mascellari, assicurandosi di esporre completamente i muscoli digastrici.
- Trova la cucitura nella muscolatura paratracheale, separala con una dissezione smussata e retratti aperta.
- Tagliare con cura un'apertura nella parte superiore della trachea abbastanza grande da adattarsi a tubi in polietilene (I.D. 0,86 mm, O.D. 1,27 mm). Non tagliare più di metà del diametro della trachea. Inserire tubi nella trachea verso i polmoni.
- Riposizionatori per rilasciare la muscolatura paratracheale e ritrarre le ghiandole sottomascellari.
- Incollare insieme la muscolatura paratracheale su tubi con una quantità minima di colla veterinaria (vedere Figura 1A).
4. Rompere la bulla timpanica
- Stuzzicare delicatamente il muscolo digastrico desiderato (sinistro o destro) e separare il tessuto connettivo. Tagliare all'estremità anteriore del muscolo, evitando i vasi sanguigni, e tirare indietro posteriormente fino a quando non si libera della bolla timpanica.
- Inclina leggermente la testa all'indietro per sollevare la bulla timpanica. Individuare il ramo dell'arteria carotide anteriore al punto di inserzione posteriore del muscolo digastrico. Senti solo posteriore a questo vaso sanguigno per la struttura convessa della bolla timpanica.
- Cercare una cucitura nella muscolatura in questa posizione (vedere Figura 1B). Usando due serie di pinci fini, smussare la cucitura fino a quando l'osso della bolla timpanica è visibile. Usa i divaricatori per mantenere una visione chiara della bolla timpanica.
- Trova la cucitura che corre da anteriore a posteriore sulla bulla (vedi Figura 1C). Usando una sonda chirurgica, fai un buco nell'osso al centro di questa cucitura. Utilizzare un set di forbici sottili per tagliare un'area circolare nell'osso, facendo attenzione a non tagliare i vasi sanguigni anteriori, posteriori e profondi sotto la bolla.
5. Esposizione del genicolato
- All'interno di questo buco c'è un pezzo convesso di osso, questa è la coclea. Anteriormente alla coclea c'è un muscolo, il tensore timpanico (vedi Figura 1D). Usando le forbici a molla, tagliare i timonti tensoriali e rimuoverlo.
- Esegui un pizzico di dita. Se l'animale risponde, ingamina/xilazina miscela ata 1/3 dose per il ridosso.
- Preparare il fluido di irrigazione e una linea di aspirazione. Usando la sonda chirurgica, fai un buco nel promontorio cocleare. Irrigare immediatamente il liquido che fuoriesci e rimuoverlo con l'aspirazione. Questo liquido fluirà più o meno continuamente da questo punto e dovrà essere affrontato periodicamente.
- Allargare il buco nella coclea. Fare attenzione con il vaso sanguigno che circonda la coclea fino al bordo posteriore e laterale.
- Inclinare la testa del mouse in avanti. Individuare il foro nell'osso temporale sotto quella che era la coclea (vedere Figura 1E). Prendi nota della cresta anteriore a questo buco, questa cresta si trova direttamente sopra il settimo nervo.
- Inserire una sonda chirurgica nel foro e sollevare con attenzione l'osso temporale per esporre il settimo nervo (vedere Figura 1F). Fai il punto su quanto del settimo nervo è visibile e se il genicolato non è completamente esposto, inclina la testa dell'animale all'indietro e tenta di tirare su l'osso dall'anteriore al nervo.
- Se il ganglio non è ancora completamente visibile, tirare su più osso da sotto. Fare molta attenzione a non posizionare la sonda in profondità sotto l'osso in quanto ciò potrebbe danneggiare il genicolato.
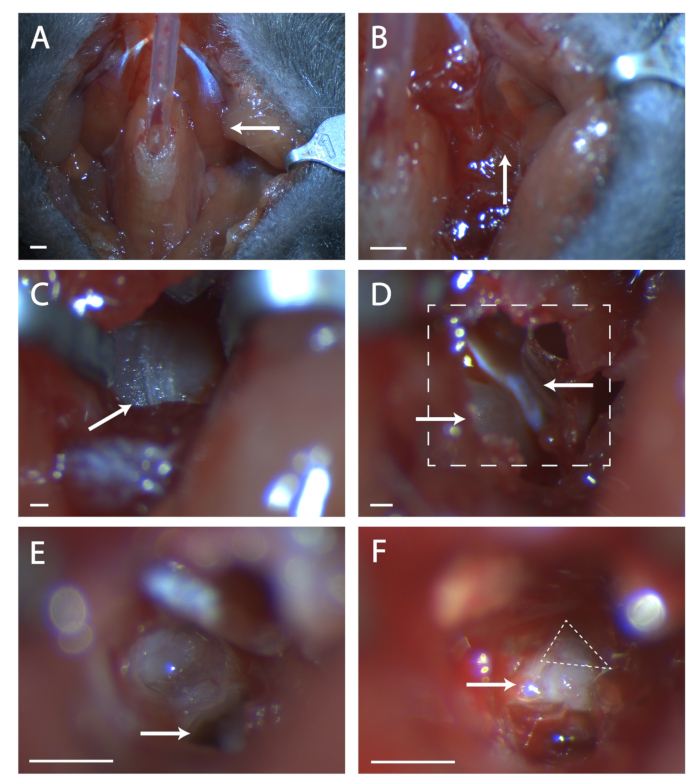
Figura 1: Esposizione chirurgica del ganglio genicolato. (A) Immagine della cavità del collo del topo dopo la tracheotomia. Arrow sta indicando il muscolo digastrico che si trova sopra l'area chirurgica esplorata nel resto della figura. (B) Immagine della regione sotto il muscolo digastrico precedentemente indicato. La freccia indica la cucitura nella muscolatura per la dissezione smussata. (C) Immagine della Bolla Timpanica. Freccia indica cucitura nell'osso per rompere con una sonda chirurgica. (D) Immagine dell'area chirurgica dopo l'apertura della bulla. La freccia in basso a sinistra indica la coclea, la freccia superiore punta al tensore timpanico. La linea in scatola indica l'area in (E) e (F). (E) Immagine dell'area chirurgica dopo che la coclea è stata rotta e il contenuto rimosso. La freccia bianca indica dove posizionare la sonda chirurgica a cui si fa riferimento nel passaggio di protocollo 5.6. (F) Un'immagine del ganglio genicolato esposto. La freccia indica il corpo del settimo nervo, il triangolo tratteggiato circonda il ganglio genicolato. Pannelli A-B, Scala = 5 mm. Pannelli C-F, Scala = 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
6. Esegui il pannello tastant
- Utilizzare l'aspirazione per rimuovere il liquido da sopra il genicolato. Facoltativamente posizionare un punto assorbente per aiutare a mitigare le infiltrazioni e aiutare nella navigazione al microscopio.
- Posizionare l'animale su un tampone assorbente al microscopio. Individua il ganglio genicolato: punti di riferimento utili includono il buco lasciato nella bulla, il buco nell'osso temporale e il settimo nervo. Utilizzando il filtro FITC/GFP sull'ambito dell'epifluorescenza, verificare la ricerca di singoli neuroni gangliari genicolati che esprimono GCaMP. Un obiettivo 10x (distanza di lavoro 10mm) fornirà una risoluzione sufficiente per tracciare l'attività delle singole celle, ma è possibile utilizzare anche un obiettivo 20x (distanza di lavoro 12 mm).
- Posizionare l'ago di erogazione per la linea tastant saldamente nella bocca dell'animale. Metti una capsula di Petri sotto la bocca dell'animale per catturare il liquido.
- Assicurarsi che la fotocamera stia visualizzando il campo visivo del microscopio. Sincronizza l'inizio della registrazione video con l'inizio della presentazione tastant.
- Durante la registrazione, guarda il feed live per le risposte, la deriva e le infiltrazioni.
- Se si verificano infiltrazioni, aspirare il liquido fino a quando la vista del genicolato è chiara e ripetere. Se si verifica una deriva, controllare che tutte le parti del palo della testa siano saldamente serrate. Se non si verificano risposte, controllare che il liquido scorra e che il microscopio e la fotocamera siano focalizzati sulla posizione corretta senza che nulla oscuri il campo visivo.
- Ripeti fino a ottenere il numero desiderato di video. Allentare delicatamente i riavvolgitori, quindi ripetere i passaggi 3-6 sul lato opposto.
- Dopo aver ottenuto i video desiderati per tutti i gangli desiderati, eutanasizzare l'animale tramite lussazione cervicale.
Access restricted. Please log in or start a trial to view this content.
Risultati
Seguendo il protocollo, un animale transgenico Snap25-GCaMP6s è stato sedato, i gangli genicolati sono stati esposti e il tastant è stato applicato alla lingua durante la registrazione del video. Lo scopo dell'esperimento era quello di definire quali tastants hanno suscitato risposte da ciascuna cellula. I tanci (30 mM AceK, 5 mM chinino, 60 mM NaCl, 50 mM IMP + 1 mM MPG, 50 mM acido citrico)18 sono stati disciolti in acqua DI e sono stati applicati alla lingua per 2 s separati da 13 s di acqua ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo lavoro descrive un protocollo passo-passo per esporre chirurgicamente il ganglio genicolato e registrare visivamente l'attività dei suoi neuroni con GCaMP6s. Questa procedura è molto simile a quella descritta in precedenza17, con alcune eccezioni degne di nota. In primo luogo, l'uso di un palo della testa consente una facile regolazione del posizionamento della testa durante l'intervento chirurgico. In secondo luogo, per quanto riguarda la consegna dello stimolo, l'approccio di Wu e Dvory...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi da segnalare.
Riconoscimenti
Gli autori ringraziano S. Humayun per l'allevamento dei topi. Il finanziamento per questo lavoro è stato fornito in parte dal Brain Health Consortium Graduate and Postdoctoral Seed Grant (B.E.F.) dell'UTSA e dal NIH-SC2-GM130411 a L.J.M.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
Riferimenti
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon