É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
In vivo Imagem de cálcio do rato Geniculado Gânglio Respostas ao Sabor Estímulo
Neste Artigo
Resumo
Aqui apresentamos como expor o gânglio geniculado de um rato de laboratório vivo, anestesiado e como usar imagens de cálcio para medir as respostas desses conjuntos desses neurônios a estímulos de sabor, permitindo múltiplos ensaios com diferentes estimulantes. Isso permite comparações profundas das quais os neurônios respondem a quais tastantes.
Resumo
Nos últimos dez anos, os avanços nos indicadores de cálcio geneticamente codificados (GECIs) promoveram uma revolução na imagem funcional in vivo. Usando o cálcio como proxy para a atividade neuronal, essas técnicas fornecem uma maneira de monitorar as respostas de células individuais dentro de grandes conjuntos neuronais para uma variedade de estímulos em tempo real. Nós, e outros, aplicamos essas técnicas para visualizar as respostas dos neurônios de gânglios gênicos individuais para provar estímulos aplicados às línguas de camundongos anesthetizados vivos. O gânglio geniculado é composto pelos corpos celulares de neurônios gustativos que inervam a língua e o paladar anteriores, bem como alguns neurônios somatosensoriais que inervam o pinna da orelha. A imagem das respostas evocadas pelo sabor de neurônios de gânglios gênicos individuais com GCaMP forneceu informações importantes sobre os perfis de ajuste desses neurônios em camundongos do tipo selvagem, bem como uma maneira de detectar fenótipos de desocupação de gosto periférico em camundongos geneticamente manipulados. Aqui demonstramos o procedimento cirúrgico para expor o gânglio geniculado, aquisição de imagem de fluorescência GCaMP, etapas iniciais para análise de dados e solução de problemas. Esta técnica pode ser usada com GCaMP codificado transgenicamente, ou com expressão GCaMP mediada por AAV, e pode ser modificada para imagem de subconjuntos genéticos particulares de interesse (ou seja, expressão GCaMP mediada por Cre). No geral, a imagem in vivo de cálcio de neurônios de gânglios geniculados é uma técnica poderosa para monitorar a atividade de neurônios gustativos periféricos e fornece informações complementares para gravações mais tradicionais de chorda tympani de nervo inteiro ou ensaios de comportamento de paladar.
Introdução
Um componente-chave do sistema de gosto periférico dos mamíferos é o gânglio geniculado. Além de alguns neurônios somatossensoriais que inervam o pinna do ouvido, o geniculado é composto pelos corpos celulares de neurônios gustativos que inervam a língua anterior e o paladar. Semelhante a outros neurônios sensoriais periféricos, os neurônios de gânglios geniculados são pseudo-unipolares com um longo axônio projetando periféricamente para as papilas gustativas, e centralmente para o núcleo do tronco cerebral do trato solitário1. Esses neurônios são ativados principalmente pela liberação de ATP por células receptoras de paladar que respondem a estímulos de paladar na cavidade oral2,3. ATP é um neurotransmissor essencial para sinalização de paladar, e receptores P2rx expressos pelos neurônios de gânglio gustativo são necessários para sua ativação4. Dado que as células receptoras de sabor expressam receptores de sabor específicos para uma modalidade de sabor particular (doce, amargo, salgado, umami ou azedo), tem sido hipótese que as respostas do neurônio gânglio gustativo a estímulos de sabor também seriam estreitamente ajustadas5.
Gravações nervosas inteiras mostraram que tanto o chorda tympani quanto os nervos petrosais superiores maiores conduzem sinais gustativos representando todas as cinco modalidades de gosto ao gânglio geniculado6,7. No entanto, isso ainda deixou dúvidas sobre a especificidade das respostas neuronais a um determinado tastant: se houver a modalidade de sabor neurônios específicos, neurônios polimodais ou uma mistura de ambos. Registros únicos de fibras dão mais informações sobre a atividade de fibras individuais e suas sensibilidades químicas8,9,10, mas essa metodologia limita-se à coleta de dados de pequenos números de fibras. Da mesma forma, gravações eletrofisiológicas in vivo de neurônios gânglios gênicos individuais de ratos dão informações sobre as respostas dos neurônios individuais11,12,13, mas ainda perdem a atividade da população e produzem relativamente poucos registros de neurônios por animal. Para analisar os padrões de resposta dos conjuntos neuronais sem perder de vista a atividade dos neurônios individuais, novas técnicas precisavam ser empregadas.
A imagem de cálcio, especialmente utilizando indicadores de cálcio geneticamente codificados como o GCaMP, proporcionou esse avanço técnico14,15,16,17,18. GCaMP usa cálcio como proxy para atividade neuronal, aumentando a fluorescência verde à medida que os níveis de cálcio dentro da célula aumentam. Novas formas de GCaMP continuam a ser desenvolvidas para melhorar a relação sinal/ruído, ajustar cinética de ligação e adaptar-se para experimentos especializados19. O GCaMP fornece resolução de neurônios únicos, ao contrário de todo o registro nervoso, e pode medir simultaneamente respostas de conjuntos de neurônios, ao contrário de uma única fibra ou gravação de célula única. A imagem de cálcio do gânglio geniculado já forneceu informações importantes sobre os perfis de ajuste desses neurônios em camundongos do tipo selvagem16,20, e identificou fenótipos de pericular de erro de giro em camundongos geneticamente manipulados18.
Uma grande dificuldade para aplicar técnicas de imagem de cálcio in vivo ao gânglio geniculado é que ele é encapsulado dentro da bula tympanica óssea. Para obter acesso óptico ao geniculado, uma cirurgia delicada é necessária para remover as camadas dos ossos, mantendo o gânglio intacto. Para isso, criamos este guia para ajudar outros pesquisadores a acessar o gânglio geniculado e a imagem que o GCaMP mediava respostas fluorescentes desses neurônios para provar estímulos in vivo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Os protocolos animais foram revisados e aprovados pelos Comitês Institucionais de Cuidados e Uso de Animais da Universidade do Texas San Antonio.
1. Configuração pré-operatória
NOTA: Observe que a configuração inicial do equipamento não é tratada aqui, pois ela irá variar de acordo com o sistema de bomba, microscópio, câmera e software de imagem usados. Para obter instruções de configuração, consulte os materiais instrucionais fornecidos pelo fornecedor do equipamento. Para os equipamentos utilizados pelos autores, consulte a Tabela de Materiais.
- Certifique-se de que o líquido flua através de todos os veículos (água) e linhas tastant. Se a linha estiver bloqueada, desconecte e lave com água. Se a linha estiver dobrada, massageie até que o líquido flua. Certifique-se de que o líquido começa e pára na deixa.
- Uma vez que todas as linhas são confirmadas desbloqueadas, execute o veículo por 10 s e feche todas as válvulas.
- Certifique-se de que o software de imagem esteja pronto com todas as variáveis necessárias (por exemplo, comprimento de teste, nomes de arquivos, taxa de quadros, etc). Usando o μManager, um pacote de software de aquisição de imagens de código aberto, insira 200 ms no campo rotulado tempo de exposição para um quadro por segundo de 5Hz, selecione x2 sob binninge pressione o botão rotulado Live. Quando o vídeo começar, pressione o botão no lado esquerdo rotulado roi. Isso resultará em um campo de visão 512x512.
2. Anestesiar e imobilizar o animal
NOTA: O protocolo a seguir é um procedimento terminal otimizado para camundongos de ambos os sexos pesando 18-35 g. Recomenda-se para uso com animais entre 10 e 12 semanas de idade. Pode ser usado com animais transgênicos expressando Indicadores de Cálcio Geneticamente Codificados (GECIs), como o Snap25-GCaMP6s, ou animais estereotaxicamente injetados com GECIs virais. Luvas, jaleco e máscara facial devem ser usados para o protocolo.
- Scruff animal e realizar uma injeção intraperitoneal de Cetamina (100 mg/kg) e Xylazine (10 mg/kg). Avalie a profundidade da anestesia através de beliscão do dedo do dedo do sol antes de continuar.
- Raspe a parte superior da cabeça amd a área cirúrgica na frente do pescoço.
- Ligue a almofada de aquecimento e coloque o animal propenso na almofada.
- Aplique pomada nos olhos do animal para evitar a secagem dos olhos.
- Faça uma incisão (~1 cm) na linha média da cabeça para expor o crânio do animal. Remova o tecido conjuntivo usando um cotonete estéril para que o osso nu seja acessível. Use um aplicador de ponta de algodão para garantir que o crânio esteja seco.
- Aplique ligação veterinária no crânio. Certifique-se de cobrir o crânio exposto. Espere a cola secar.
- Em uma tampa de placa de Petri, misture e aplique uma camada de cimento dental no crânio. A parte traseira do aplicador de ponta de algodão usado na etapa 2.5 funcionará bem para este processo. Coloque o poste em cima do cimento dental e aplique uma segunda camada de cimento dental para sanduíche no poste no lugar do crânio.
- Deixe descansar até que o cimento dental esteja seco e sólido. Quebre o aplicador de ponta de algodão ao meio e use as pontas pontiagudas para cutucar o cimento dental para testar. Se o cimento dental não ceder a ser cutucado, o animal pode ser transformado em uma posição supina.
3. Traqueotomia
- Aplique esfoliação pré-cirúrgica na área cirúrgica. Pós-esfregar, faça uma incisão midline ~ 2 cm na pele da garganta do esterno para o queixo.
- Retraia a pele e as glândulas sub-maxilais, com certeza expõem totalmente os músculos digastricos.
- Encontre a costura na musculatura paratracheal, separe-a com dissecção sem cortes e retrate-se aberta.
- Corte cuidadosamente uma abertura na parte superior da traqueia grande o suficiente para caber tubos de polietileno (I.D. 0,86 mm, O.D. 1,27 mm). Não corte mais do que a metade do diâmetro da traqueia. Insira tubos na traqueia em direção aos pulmões.
- Reposicione os repositores para liberar a musculatura paratracheal e retrair as glândulas submaxilares.
- Cola musculatura paratracheal junto sobre tubos com uma quantidade mínima de cola veterinária (ver Figura 1A).
4. Quebrar a bulla timpânica
- Provoque suavemente o músculo digastric desejado (esquerda ou direita) para cima e retire o tecido conjuntivo. Corte na extremidade anterior do músculo, evitando vasos sanguíneos, e puxe para trás posteriormente até se livrar da bíprica.
- Incline a cabeça para trás ligeiramente para levantar a bíprica. Localize o ramo da artéria carótida anterior ao ponto de inserção posterior do músculo digastric. Sinta-se apenas posterior a este vaso sanguíneo para a estrutura convexa da bímpana.
- Procure uma costura na musculatura neste local (ver Figura 1B). Usando dois conjuntos de fórceps finos, dissecar sem cortes na costura até que o osso da bípria tympanic seja visível. Use retráteis para manter uma visão clara da bula timpânica.
- Encontre a costura correndo de anterior para posterior na bula (ver Figura 1C). Usando uma sonda cirúrgica, faça um buraco no osso no centro desta costura. Use um conjunto de tesouras finas para cortar uma área circular no osso, tomando cuidado para não cortar os vasos sanguíneos anterior, posterior e profundo sob a bula.
5. Expondo o geniculado
- Dentro deste buraco há um pedaço convexo de osso, esta é a cóclea. Anterior à cóclea é um músculo, o tensor tympani (ver Figura 1D). Usando a tesoura de mola, corte o tensor tympani e remova-o.
- Faça uma pitada de dedo do dedo. Se o animal responder, dê uma mistura de cetamina/xilazina a uma dose de 1/3 para redosagem.
- Prepare o fluido de irrigação e uma linha de sucção. Usando a sonda cirúrgica, faça um buraco no promontório coclear. Irrigar imediatamente o líquido que flui para fora e removê-lo com sucção. Este líquido fluirá mais ou menos continuamente a partir deste ponto e precisará ser tratado periodicamente.
- Amplie o buraco na cóclea. Tome cuidado com o vaso sanguíneo que circunda a cóclea até a borda posterior e lateral.
- Incline a cabeça do rato para a frente. Localize o buraco no osso temporal abaixo do que era a cóclea (ver Figura 1E). Tome nota do cume anterior a este buraco, este cume fica diretamente sobre o sétimo nervo.
- Insira uma sonda cirúrgica no orifício e levante cuidadosamente o osso temporal para expor o sétimo nervo (ver Figura 1F). Faça um balanço de quanto do sétimo nervo é visível e se o geniculado não estiver totalmente exposto, incline a cabeça do animal para trás e tente puxar o osso do anterior para o nervo.
- Se o gânglio ainda não é totalmente visível, puxe mais osso por baixo. Tenha muito cuidado para não colocar a sonda bem abaixo do osso, pois isso pode danificar o geniculado.
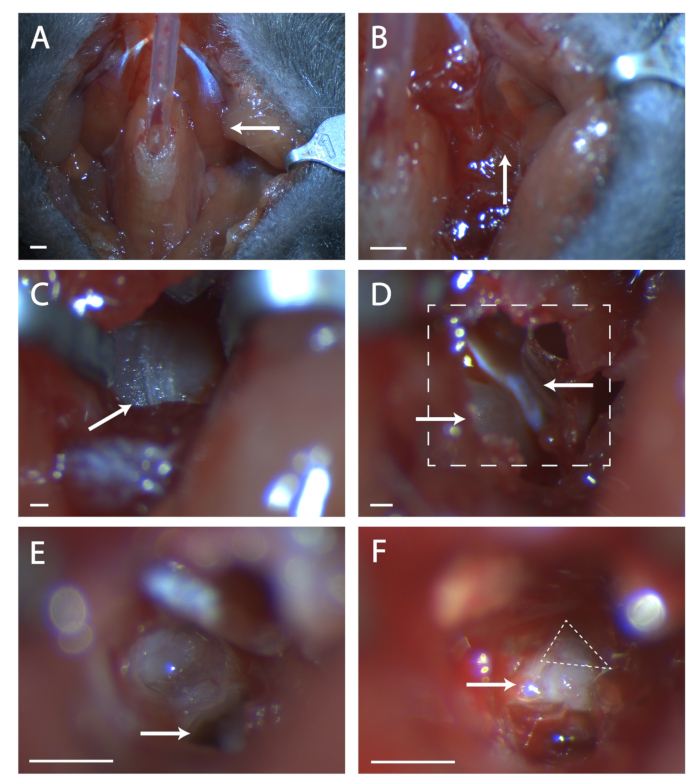
Figura 1: Exposição cirúrgica do gânglio geniculado. (A) Imagem da cavidade do pescoço do rato pós traqueotomia. A seta está apontando para o músculo digastrico deitado sobre a área cirúrgica explorada no resto da figura. (B) Imagem da região sob o músculo digastric previamente indicado. A seta indica a costura em musculatura para dissecção contundente. (C) Imagem do Tympanic Bulla. A seta indica costura no osso para quebrar com uma sonda cirúrgica. (D) Imagem da área cirúrgica após a abertura da bula. A seta inferior esquerda indica a cóclea, a seta superior aponta para o tensor tympani. Linha encaixotada indica área em (E) e (F). (E) Imagem da área cirúrgica após a fratura da cóclea e o conteúdo removido. A seta branca indica onde colocar a sonda cirúrgica referenciada na etapa 5.6 do protocolo. (F) Uma imagem do gânglio geniculado exposto. Seta indica corpo do sétimo nervo, triângulo tracejado envolve o gânglio geniculado. Painéis A-B, Escala = 5 mm. Painéis C-F, Escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
6. Executar painel tastant
- Use sucção para remover o líquido do geniculado. Opcionalmente coloque um ponto absorvente para ajudar a mitigar a infiltração e ajudar na navegação de microscópio.
- Coloque o animal na almofada absorvente sob o microscópio. Localize o gânglio geniculado: marcos úteis incluem o buraco deixado na bula, o buraco no osso temporal e o sétimo nervo. Usando o filtro FITC/GFP no escopo da epifluorescência, verifique se há neurônios de glulato gênicoulatados expressados por GCaMP. Um objetivo de 10x (distância trabalhada 10mm) fornecerá resolução suficiente para acompanhar a atividade de células individuais, mas um objetivo de 20x (distância de trabalho de 12 mm) também pode ser usado.
- Coloque a agulha dispensando a linha tastant firmemente na boca do animal. Coloque uma placa de Petri abaixo da boca do animal para pegar fluido.
- Certifique-se de que a câmera está visualizando o campo de visão do microscópio. Sincronizar o início da gravação de vídeo com o início da apresentação tastant.
- Durante a gravação, assista ao feed ao vivo para respostas, drift e seepage.
- Se ocorrer a infiltração, sucede o líquido até que a visão do geniculado esteja clara e repita. Se ocorrer deriva, verifique se todas as partes do poste da cabeça estão firmemente apertadas. Se não ocorrermos respostas verifique se o líquido está fluindo e que o microscópio e a câmera estão focados no local adequado sem que nada obscurece o campo de visão.
- Repita até que o número desejado de vídeos tenha sido obtido. Facilite suavemente os retráteis e repita os passos 3-6 do lado oposto.
- Após os vídeos desejados terem sido obtidos para todos os gânglios desejados, eutanize o animal através de deslocamento cervical.
Access restricted. Please log in or start a trial to view this content.
Resultados
Seguindo o protocolo, um animal Snap25-GCaMP6s transgênico foi sedado, gânglios geniculados foram expostos, e tastant foi aplicado na língua enquanto o vídeo era gravado. O objetivo do experimento era definir quais tastantes provocavam respostas de cada célula. Tastants (AceK de 30 mM, 5 mM Quinine, 60 mM NaCl, 50 mM IMP + 1 mM MPG, 50 mM Ácido Cítrico)18 foram dissolvidos em água DI e foram aplicados na língua por 2 s separados por 13 s de água DI.
Access restricted. Please log in or start a trial to view this content.
Discussão
Este trabalho descreve um protocolo passo-a-passo para expor cirurgicamente o gânglio geniculado e registrar visualmente a atividade de seus neurônios com GCaMP6s. Este procedimento é muito semelhante ao descrito anteriormente17, com algumas exceções notáveis. Primeiro, o uso de um poste na cabeça permite um ajuste fácil do posicionamento da cabeça durante a cirurgia. Em segundo lugar, em relação à entrega de estímulos, a abordagem de Wu e Dvoryanchikov flui estímulos de sabor atrav?...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm conflito de interesses para relatar.
Agradecimentos
Os autores agradecem a S. Humayun pela criação de ratos. O financiamento para este trabalho foi fornecido em parte pelo Brain Health Consortium Graduate and Postdoctoral Seed Grant (B.E.F.) e nih-SC2-GM130411 para L.J.M.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
Referências
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados