このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスの神経節神経節ニューロン反応のインビボカルシウムイメージングが味覚刺激に反応する
要約
ここでは、生きた麻酔薬用マウスのジェニュー酸神経節を暴露する方法と、カルシウムイメージングを使用してこれらのニューロンのアンサンブルの応答を測定して刺激を味わう方法を紹介し、異なる覚醒剤を用いた複数の試験を可能にする。これにより、どのニューロンがどのタスタントに反応するかを深く比較することができます。
要約
過去10年以内に、遺伝子組み換えカルシウム指標(GEC)の進歩は、生体内機能イメージングにおける革命を促進しました。これらの技術は、神経活動の代理としてカルシウムを使用して、大規模なニューロンアンサンブル内の個々の細胞の反応をリアルタイムで様々な刺激に対して監視する方法を提供する。我々や他の人々は、これらの技術を適用して、個々の原発性神経節ニューロンの応答を画像化し、生きた麻酔マウスの舌に加わる刺激を味わってきた。原発性神経節は、舌前舌と口蓋を内在させる気味ニューロンの細胞体と、耳のピナを内在させる体性感覚ニューロンで構成される。GCaMPを用いた個々の原発性神経節ニューロンの味覚誘発応答をイメージングすることは、野生型マウスにおけるこれらのニューロンの調整プロファイルに関する重要な情報と、遺伝的に操作されたマウスにおける末梢の味の誤配線表現型を検出する方法を提供した。ここでは、原発性神経節、GCaMP蛍光画像取得、データ分析の初期ステップ、およびトラブルシューティングを行うための外科的手順を示す。この技術は、トランスジェニックにコード化されたGCaMP、またはAAV媒介GCaMP発現で使用することができ、また、対象となる特定の遺伝的サブセット(すなわち、クレ媒介GCaMP発現)を画像に変更することができる。全体的に、神経節ニューロンのインビボカルシウムイメージングは、末梢の気味ニューロンの活性を監視するための強力な技術であり、より伝統的な全神経脊索のティンパニの記録または味覚行動アッセイに補完的な情報を提供する。
概要
哺乳類末梢味システムの重要な成分は、神経節の起源である。耳のピンナを内在させるいくつかの体性感覚ニューロンに加えて、原発は前舌と口蓋を内在させる味覚ニューロンの細胞体で構成される。他の末梢感覚ニューロンと同様に、原発性神経節ニューロンは、長い軸索が味覚芽に末梢に突き出て、そして一元的に孤独な管1の脳幹核に対して擬似ユニポーラである。これらのニューロンは主に口腔内の味覚刺激に反応する味覚受容体細胞によるATPの放出によって活性化される2、3。ATPは、味覚シグナル伝達に不可欠な神経伝達物質であり、そして、その活性化のために、味覚神経節ニューロンによって発現されるP2rx受容体が必要である。味覚受容体細胞が特定の味覚モダリティ(甘味、苦味、塩味、うま味、または酸っぱい)に対する特定の味覚受容体を発現することを考えると、味覚刺激に対する味覚神経節ニューロン応答も狭く調整されるであろうと仮定されている5。
全体の神経録音は、コルダ・タンパニと優れたペトロサル神経の両方が、5つの味覚モダリティすべてを表す射薬信号を、起源の神経節6,7に伝導することを示している。しかし、これはまだ与えられたタスタントに対する神経応答の特異性に関する疑問を残した:味モダリティ特異的ニューロン、ポリモーダルニューロン、またはその両方の混合物がある場合。単繊維の記録は、個々の繊維の活性に関するより多くの情報を与え、その化学的感受性8、9、10を与えるが、この方法論は、少数の繊維からのデータ収集に限定される。同様に、個々のラットの神経節ニューロンのインビボ電気生理学的記録は、個々のニューロン11、12、13の応答に関する情報を与えるが、それでも集団の活性を失い、動物1人あたりのニューロン記録が比較的少ない。個々のニューロンの活動を見失うことなく、ニューロンアンサンブルの応答パターンを分析するためには、新しい技術を採用する必要がありました。
カルシウムイメージングは、特にGCaMPのような遺伝的にコード化されたカルシウム指標を使用して、この技術的なブレークスルー14、15、16、17、18を提供してきました。GCaMPは、神経活動の代理としてカルシウムを使用し、細胞内のカルシウムレベルが上昇するにつれて緑色蛍光を増加させる。GCaMPの新しい形態は、信号対雑音比を改善し、結合性運動を調整し、特殊実験19に適応するために開発され続けている。GCaMPは、神経全体の記録とは異なり、単一のニューロンの解像度を提供し、同時に単一の繊維または単一細胞の記録とは異なり、ニューロンのアンサンブルの応答を測定することができます。原発性神経節のカルシウムイメージングは、野生型マウス16,20におけるこれらのニューロンのチューニングプロファイルに関する重要な情報を既に提供しており、遺伝的に操作されたマウス18における末梢の味の誤配線表現型を同定している。
インビボカルシウムイメージング技術を原発性神経節に適用する際の大きな難点の1つは、骨の鼓膜発作の中にカプセル化されるということです。ジェクレートへの光学的アクセスを得るためには、ガングリオンをそのまま維持しながら、骨の層を除去するために繊細な手術が必要です。そのために、他の研究者が原発性神経節にアクセスし、GCaMPがこれらのニューロンの蛍光応答を媒介して生体内で刺激を味わう画像を画像化するのを助けるために、このガイドを作成しました。
Access restricted. Please log in or start a trial to view this content.
プロトコル
動物のプロトコルは、テキサス大学サンアントニオ校の施設動物ケアと使用委員会によって見直され、承認されました。
1. 事前操作のセットアップ
注:機器の初期設定は、使用するポンプシステム、顕微鏡、カメラ、イメージングソフトウェアによって異なるため、ここでは取り扱いません。設定手順については、機器ベンダーから提供される説明資料を参照してください。著者が使用する機器については、 資料表を参照してください。
- 液体がすべての車両(水)とタスタントラインを通って流れるようにします。回線がブロックされている場合は、水で切断し、フラッシュします。ラインがキンクしている場合は、液体が流れるまでマッサージします。液体がキューで開始および停止することを確認します。
- すべてのラインがブロック解除されたことを確認したら、10 sの車両を実行し、すべてのバルブを閉じます。
- イメージングソフトウェアが必要なすべての変数(例えば、試行時間、ファイル名、フレームレートなど)で準備ができていることを確認してください。μManagerを使用して、オープンソースの画像取得ソフトウェアパッケージを使用して、5Hzの1秒当たりのフレームに対して 「露出時間 」というラベルのフィールドに200 msを入力し、 ビニングの下でx2を選択し、Liveというボタンを押します。ビデオが開始したら 、ROIというラベルの付いた左側のボタンを押します。これにより、512x512 の視野が表示されます。
2. 動物の麻酔と固定化
注:次のプロトコルは、18-35 gの体重を量るいずれかの性別のマウスに最適化された端末手順です。10~12週の動物と一緒に使用することをお勧めします。これは、遺伝的にコード化されたカルシウム指標(GEC)を発現するトランスジェニック動物(Snap25-GCaMP6sなど)、またはウイルス性GECを立体的に注入した動物と一緒に使用することができる。手袋、ラボコート、フェイスマスクは、プロトコル全体を着用する必要があります。
- スクラフ動物とケタミンの腹腔内注射を行います (100 mg/kg) とキシラジン (10 mg/kg).続ける前につま先ピンチを介して麻酔の深さを評価します。
- 首の前部の外科的領域を、頭の上を剃る。
- 加熱パッドをオンにし、パッドの上に動物を置く傾向があります。
- 目の乾燥を避けるために、動物の目に軟膏を塗布します。
- 頭の中線で切開(約1cm)を行い、動物の頭蓋骨を露出させる。裸骨がアクセス可能になるように、滅菌綿棒を使用して結合組織を除去します。綿製のチップアプリケーターを使用して、頭蓋骨が乾燥していることを確認します。
- 頭蓋骨に獣医の結合を適用します。露出した頭蓋骨を覆うことを確認してください。接着剤が乾くのを待ちます。
- ペトリ皿の蓋に、混合し、頭蓋骨に歯科用セメントの層を適用します。ステップ2.5で使用される綿の先端の適用器のバックエンドはこのプロセスのためにうまく働く。歯科用セメントの上にヘッドポストを置き、歯科用セメントの第2層を適用して、頭蓋骨の上にヘッドポストを挟みます。
- 歯科用セメントが乾燥して固くなるまで座らせます。綿の先端の適用器を半分に割り、テストするために歯科用セメントを突くために尖った端を使用する。歯科用セメントが突かれることに屈しない場合、動物は、supineの位置に回され得る。
3. 気管切開術
- 手術前のスクラブを手術領域に適用する。スクラブ後、胸骨から顎まで喉の皮膚に中線切開~2cmを作る。
- 皮膚と上顎下腺を引き込み、必ず筋痛を完全に露出させます。
- パラトラチャー筋肉の縫い目を見つけ、鈍い解剖で分離し、開いたままにします。
- ポリエチレンチューブに合うほどの大きさの気管の上部に開口部を慎重にカットします(I.D. 0.86 mm,O.D. 1.27 mm)。気管の直径の途中で切らないでください。肺に向かって気管にチューブを挿入します。
- 再配置リトラクターを再配置して、パラトラクヒールの筋肉を放出し、顎下腺を引き込む。
- 最小限の量の動物用接着剤でチューブの上にパラトラチャー筋肉を一緒に接着します( 図1Aを参照)。
4. 鼓膜を開く
- 望ましい筋(左または右)を軽くいじめ、結合組織を引き離します。筋肉の前端で切断, 血管を避ける, 鼓膜ブラのクリアまで後に引き戻します。.
- 頭を少し後ろに傾けて、鼓膜発作を持ち上げます。頸動脈前部の枝を、筋膜筋の後部挿入点に位置付ける。鼓膜の凸構造のために、この血管の後部を感じる。
- この場所で筋の縫い目を探します( 図 1Bを参照)。2組の細かい鉗子を使用して、鼓膜発作の骨が見えるまで縫い目で鈍い解剖をする。鼓膜ブラの明確なビューを維持するためにレトラクターを使用してください。
- ブラの後部に前部を走る縫い目を見つける( 図1Cを参照)。外科用プローブを使用して、この縫い目の中心にある骨に穴を開けます。細かい端のはさみのセットを使用して骨の円形領域を切断し、前、後部、およびブラの下の深い血管を切断しないように注意してください。
5. ジェラ化を暴露する
- この穴の中には骨の凸ビット、これが内痛です。内痛の前走は筋肉、テンソル・タンパニである( 図1Dを参照)。スプリングハサミを使ってテンソルのテンパニを切って取り外します。
- つま先ピンチを実行します。動物が反応する場合は、ケタミン/キシラジン混合物を与える ata 1/3 投与量のやり取り.
- 灌漑液と吸引ラインを準備します。外科用プローブを使用して、人工内口のプロモントリーに穴を開けます。すぐに流出する液体を灌漑し、吸引でそれを取り除きます。この液体は、この時点から多かれ少なかれ連続的に流れ、定期的に対処する必要があります。
- 内の穴を拡大します。後部および横端に内気を囲む血管に注意してください。
- マウスの頭を前方に傾けます。頭骨の中の、内骨の下の穴を見つけます( 図1Eを参照)。この穴に尾根の前部に注意してください、この尾根は第七神経の上に直接座っています。
- 外科用プローブを穴に挿入し、側頭骨を慎重に持ち上げて第7神経を露出させる( 図1Fを参照)。7番目の神経のどのくらいが見えるかをストックし、原発が完全に露出していない場合は、動物の頭を後ろに傾け、前から神経に骨を引き上げようとします。
- ガングリオンがまだ完全に見えない場合は、下からより多くの骨を引き上げ。これを行うと、原発性を損傷する可能性があるため、プローブを骨の下に深く置かないように注意してください。
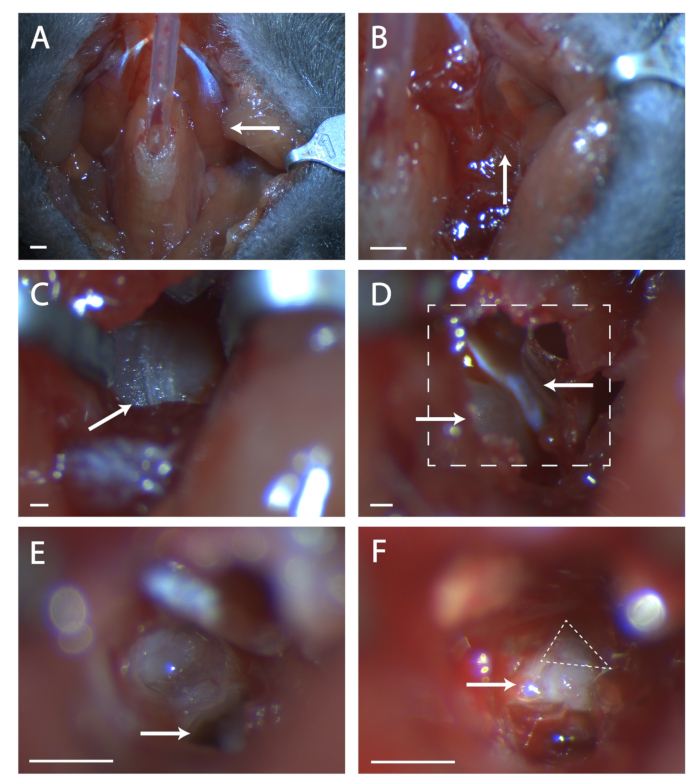
図1:神経節の原発性神経節の外科的暴露(A)気管切開後マウス首腔の画像。矢印は、図の残りの部分で探索された外科領域の上に横たわっているディダス筋肉を指しています。(B)以前に示された筋の下の領域の画像。矢印は、鈍い解剖のための筋肉の縫い目を示しています。(C)鼓動ブラのイメージ。矢印は、外科用プローブで壊れる骨の縫い目を示す。(D) ブラを開いた後の手術領域の画像。左下矢印は、内痛を示し、上矢印はテンソル・テンパニを指す。ボックス線は、 (E) および (F) の領域を示します。(E)内痛が壊れ、内容物が取り除かれた後の手術領域の画像。白い矢印は、プロトコルステップ5.6で参照される外科プローブを配置する場所を示す。(F)露出したジェグレートガングリオンの画像。矢印は第7神経の体を示し、破線三角形は、原発性神経節を囲む。パネルA-B、スケール= 5 mm.パネルC-F、スケール= 1 mm。この図のより大きなバージョンを表示するには、ここをクリックしてください。
6. タスタントパネルを実行する
- 吸引を使用して、上から液体を除去します。必要に応じて、顕微鏡ナビゲーションの浸透を軽減し、補助するために吸収点を配置します。
- 動物を顕微鏡下の吸収パッドに置きます。原発性神経節を見つける:有用なランドマークには、ブラに残された穴、側頭骨の穴、および第7の神経が含まれる。FITC/GFPフィルターを使用して、蛍光スコープで、個々のGCaMP発現型神経節ニューロンを確認します。10倍の目標(作業距離10mm)は、個々の細胞の活性を追跡するのに十分な解像度を提供しますが、20倍の目標(作業距離12mm)も使用できます。
- 動物の口の中にしっかりとタスタンラインのための分配針を置きます。動物の口の下にペトリ皿を置き、液体を捕まえます。
- カメラが顕微鏡の視野を見ているか確認します。ビデオ録画の開始を、tastant プレゼンテーションの開始と同期します。
- 録音中は、応答、ドリフト、および浸透のためのライブフィードを見ます。
- もし浸透が生じたら、原発の視野が明確かつ繰り返されるまで液体を吸引する。ドリフトが発生した場合は、ヘッドポストのすべての部分がしっかりと締め付けされていることを確認します。応答が発生しない場合は、液体が流れていること、顕微鏡とカメラが視野を隠すことなく適切な位置に焦点を当てているかどうかを確認してください。
- 必要な数のビデオが得られるまで繰り返します。レトラクタを軽く緩め、反対側のステップ3~6を繰り返します。
- 望ましいすべての神経節に対して所望のビデオが得られた後、子宮頸部脱臼を介して動物を安楽死させる。
Access restricted. Please log in or start a trial to view this content.
結果
プロトコルに従って、トランスジェニックSnap25-GCaMP6s動物が鎮静され、ジェニューレ酸神経節が暴露され、ビデオが記録されている間に舌にタスタントが適用された。実験の目的は、各細胞から応答を引き出すタスタントを定義することであった。乳化剤(30mM AceK、5 mMキニーネ、60mM NaCl、50mM IMP+1mM MPG、50mMクエン酸)18 をDI水中に溶解し、13sのDI水で分離した2sの舌に塗布した。...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この研究は、ジェニュー酸神経節を外科的に暴露し、GCaMP6sでそのニューロンの活動を視覚的に記録するためのステップバイステッププロトコルを記述する。この手順は、前述の17と非常によく似ていますが、いくつかの顕著な例外があります。まず、ヘッドポストを使用することで、手術中の頭部の位置調整が容易になります。第二に、刺激送達に関して、呉とドボヤンチ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は報告する利害の対立はありません。
謝辞
著者らは、マウスの夫のためにS.フマユンに感謝します。この研究のための資金は、UTSAの脳健康コンソーシアムの卒業生とポスドクシードグラント(B.E.F.)とNIH-SC2-GM130411によってL.J.Mに提供されています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
参考文献
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved