Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In vivo Calcium Imaging of Mouse Geniculate Ganglion Neuron Reaktionen auf Geschmacksreize
In diesem Artikel
Zusammenfassung
Hier präsentieren wir, wie man das genikulierte Ganglion einer lebenden, betäubten Labormaus freilegt und wie man Kalziumbildgebung verwendet, um die Reaktionen von Ensembles dieser Neuronen auf Geschmacksreize zu messen, was mehrere Versuche mit verschiedenen Stimulanzien ermöglicht. Dies ermöglicht detaillierte Vergleiche, welche Neuronen auf welche Tastants reagieren.
Zusammenfassung
In den letzten zehn Jahren haben Fortschritte bei genetisch kodierten Kalziumindikatoren (GECIs) eine Revolution in der funktionellen In-vivo-Bildgebung gefördert. Mit Kalzium als Proxy für neuronale Aktivität bieten diese Techniken eine Möglichkeit, die Reaktionen einzelner Zellen innerhalb großer neuronaler Ensembles auf eine Vielzahl von Reizen in Echtzeit zu überwachen. Wir und andere haben diese Techniken angewendet, um die Reaktionen einzelner genikulater Ganglienneuronen auf Geschmacksreize abbilden, die auf die Zungen lebender anästhesierierter Mäuse angewendet werden. Das geniculate Ganglion besteht aus den Zellkörpern von Gustatorneuronen, die die vordere Zunge und den Gaumen innervieren, sowie einigen somatosensorischen Neuronen, die die Pinna des Ohres innervieren. Die Abbildung der geschmacksbedingten Reaktionen einzelner genikulater Ganglienneuronen mit GCaMP hat wichtige Informationen über die Tuning-Profile dieser Neuronen bei Wildtyp-Mäusen sowie eine Möglichkeit zum Nachweis peripherer Geschmacksfehlverdrahtungsphänotypen bei genetisch manipulierten Mäusen geliefert. Hier demonstrieren wir den chirurgischen Eingriff zur Freilegen des geniculaten Ganglions, die GCaMP-Fluoreszenzbildaufnahme, erste Schritte zur Datenanalyse und die Fehlerbehebung. Diese Technik kann mit transgen kodiertem GCaMP oder mit AAV-vermittelter GCaMP-Expression verwendet und modifiziert werden, um bestimmte genetische Untergruppen von Interesse abbilden (d. H. Cre-vermittelte GCaMP-Expression). Insgesamt ist die In-vivo-Calcium-Bildgebung von geniculaten Ganglien-Neuronen eine leistungsstarke Technik zur Überwachung der Aktivität peripherer Gustator-Neuronen und liefert ergänzende Informationen zu traditionelleren Ganznerven-Chorda-Tympani-Aufnahmen oder Geschmacksverhaltenstests.
Einleitung
Eine Schlüsselkomponente des peripheren Geschmackssystems von Säugetieren ist das geniculate Ganglion. Zusätzlich zu einigen somatosensorischen Neuronen, die die Pinna des Ohres innervieren, besteht das Genikulat aus den Zellkörpern von Gustatorneuronen, die die vordere Zunge und den Gaumen innervieren. Ähnlich wie andere periphere sensorische Neuronen sind die geniculaten Ganglienneuronen pseudo-unipolar mit einem langen Axon, das peripher auf die Geschmacksknospen und zentral auf den Hirnstammkern des Solitärtraktsprojiziert 1. Diese Neuronen werden in erster Linie durch die Freisetzung von ATP durch Geschmacksrezeptorzellen aktiviert, die auf Geschmacksreize in der Mundhöhle reagieren2,3. ATP ist ein essentieller Neurotransmitter für die Geschmackssignalisierung, und P2rx-Rezeptoren, die von den gustatorischen Ganglienneuronen exprimiert werden, sind für ihre Aktivierung notwendig4. Angesichts der Tatsache, dass Geschmacksrezeptorzellen spezifische Geschmacksrezeptoren für eine bestimmte Geschmacksmodalität (süß, bitter, salzig, Umami oder sauer) exprimieren, wurde die Hypothese aufgestellt, dass gustatorische Ganglienneuronreaktionen auf Geschmacksreize ebenfalls eng abgestimmt wären5.
Ganze Nervenaufnahmen haben gezeigt, dass sowohl die Chorda-Tympani als auch die größeren oberen Petrosalnerven Gustatoriken leiten, die alle fünf Geschmacksmodalitäten zum geniculaten Ganglion6,7darstellen. Dies ließ jedoch immer noch Fragen über die Spezifität neuronaler Reaktionen auf ein bestimmtes Tastant offen: wenn es geschmacksmodalitätsspezifische Neuronen, polymodale Neuronen oder eine Mischung aus beidem gibt. Einzelfaseraufzeichnungen geben mehr Informationen über die Aktivität einzelner Fasern und ihre chemischenEmpfindlichkeiten 8,9,10, aber diese Methodik beschränkt sich auf die Erfassung von Daten aus einer kleinen Anzahl von Fasern. In ähnlicher Weise geben elektrophysiologische In-vivo-Aufzeichnungen einzelner Genikulat-Ganglienneuronen von Ratten Aufschluss über die Reaktionen einzelner Neuronen11,12,13, verlieren aber immer noch die Aktivität der Population und liefern relativ wenige Neuronenaufnahmen pro Tier. Um die Reaktionsmuster neuronaler Ensembles zu analysieren, ohne die Aktivität einzelner Neuronen aus den Augen zu verlieren, mussten neue Techniken eingesetzt werden.
Die Calcium-Bildgebung, insbesondere unter Verwendung genetisch kodierter Kalziumindikatoren wie GCaMP, hat diesen technischen Durchbruch gebracht14,15,16,17,18. GCaMP verwendet Kalzium als Proxy für neuronale Aktivität und erhöht die grüne Fluoreszenz, wenn der Kalziumspiegel in der Zelle ansteigt. Neue Formen von GCaMP werden weiterhin entwickelt, um das Signal-Rausch-Verhältnis zu verbessern, die Bindungskinetik anzupassen und sich für spezialisierte Experimente anzupassen19. GCaMP bietet im Gegensatz zur Aufzeichnung ganzer Nerven eine Auflösung einzelner Neuronen und kann im Gegensatz zur Einzelfaser- oder Einzelzellaufzeichnung gleichzeitig die Reaktionen von Ensembles von Neuronen messen. Die Calcium-Bildgebung der Genikulatganglien hat bereits wichtige Informationen über die Tuning-Profile dieser Neuronen bei Wildtyp-Mäusen16,20geliefert und periphere Geschmacksfehlverdrahtungsphänotypen bei genetisch manipulierten Mäusen identifiziert18.
Eine große Schwierigkeit bei der Anwendung von In-vivo-Calcium-Bildgebungstechniken auf das geniculate Ganglion besteht darin, dass es in der knöchernen Paukenbulle eingekapselt ist. Um einen optischen Zugang zum Genikulat zu erhalten, ist eine heikle Operation erforderlich, um die Knochenschichten zu entfernen und gleichzeitig das Ganglion intakt zu halten. Zu diesem Zweck haben wir diesen Leitfaden erstellt, um anderen Forschern den Zugang zum geniculaten Ganglion zu helfen und die GCaMP-vermittelten fluoreszierenden Reaktionen dieser Neuronen abbilden, um Reize in vivo zu schmecken.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Tierprotokolle wurden von den Institutional Animal Care and Use Committees der University of Texas San Antonio überprüft und genehmigt.
1. Präoperative Einrichtung
HINWEIS: Bitte beachten Sie, dass die Ersteinrichtung der Ausrüstung hier nicht behandelt wird, da sie je nach Verwendeten Pumpensystem, Mikroskop, Kamera und Bildgebungssoftware variiert. Anweisungen zur Einrichtung finden Sie in den Anleitungsmaterialien des Geräteherstellers. Für die von den Autoren verwendeten Geräte siehe Materialtabelle.
- Stellen Sie sicher, dass Flüssigkeit durch alle Fahrzeug- (Wasser-) und Tastantleitungen fließt. Wenn die Leitung blockiert ist, trennen Sie die Verbindung und spülen Sie sie mit Wasser. Wenn die Linie geknickt ist, massieren Sie, bis Flüssigkeit fließt. Stellen Sie sicher, dass Flüssigkeit auf Anhieb startet und stoppt.
- Sobald alle Leitungen entsperrt bestätigt sind, fahren Sie das Fahrzeug für 10 s und schließen Sie dann alle Ventile.
- Stellen Sie sicher, dass die Imaging-Software mit allen erforderlichen Variablen (z. B. Testlänge, Dateinamen, Bildrate usw.) bereit ist. Geben Sie mit μManager, einem Open-Source-Bilderfassungssoftwarepaket, 200 ms in das Feld mit der Bezeichnung Belichtungszeit für ein Bild pro Sekunde von 5 Hz ein, wählen Sie x2 unter Binningaus und drücken Sie die Taste Live. Wenn das Video gestartet wird, drücken Sie die Taste auf der linken Seite mit der Bezeichnung ROI. Dies führt zu einem Sichtfeld von 512 x 512.
2. Betäubung und Immobilisierung des Tieres
HINWEIS: Das folgende Protokoll ist ein terminales Verfahren, das für Mäuse beiderlei Geschlechts mit einem Gewicht von 18-35 g optimiert ist. Es wird für die Anwendung bei Tieren zwischen 10 und 12 Wochen empfohlen. Es kann bei transgenen Tieren verwendet werden, die genetisch kodierte Kalziumindikatoren (GECIs) wie die Snap25-GCaMP6s exprimieren, oder bei Tieren, die stereotaxisch mit viralen GECIs injiziert werden. Handschuhe, Laborkittel und Gesichtsmaske sollten für das gesamte Protokoll getragen werden.
- Scruff Tier und führen eine intraperitoneale Injektion von Ketamin (100 mg/kg) und Xylazin (10 mg/kg) durch. Beurteilen Sie die Tiefe der Anästhesie über Zehenklemmen, bevor Sie fortfahren.
- Rasieren Sie die Oberseite des Kopfes und den Operationsbereich an der Vorderseite des Halses.
- Schalten Sie das Heizkissen ein und legen Sie das Tier anfällig auf das Pad.
- Tragen Sie Salbe auf die Augen des Tieres auf, um ein Austrocknen der Augen zu vermeiden.
- Machen Sie einen Schnitt (~ 1 cm) in der Mittellinie des Kopfes, um den Schädel des Tieres freizulegen. Entfernen Sie das Bindegewebe mit einem sterilen Tupfer, damit der nackte Knochen zugänglich ist. Verwenden Sie einen Applikator mit Baumwollspitze, um sicherzustellen, dass der Schädel trocken ist.
- Tragen Sie die Tierarztbindung auf den Schädel auf. Achten Sie darauf, den freiliegenden Schädel zu bedecken. Warten Sie, bis der Kleber getrocknet ist.
- In einem Petrischalendeckel mischen und eine Schicht Zahnzement auf den Schädel auftragen. Das hintere Ende des in Schritt 2.5 verwendeten Applikators mit Baumwollspitze funktioniert gut für diesen Prozess. Legen Sie den Kopfpfosten auf den Zahnzement und tragen Sie eine zweite Schicht Zahnzement auf, um den Kopfpfosten auf dem Schädel zu platzieren.
- Lassen Sie es sitzen, bis der Zahnzement trocken und fest ist. Brechen Sie den Applikator mit Baumwollspitze in zwei Hälften und verwenden Sie die spitzen Enden, um den Zahnzement zum Testen zu stochern. Wenn der Zahnzement dem Stochern nicht nachgibt, kann das Tier in Rückenlage gedreht werden.
3. Tracheotomie
- Tragen Sie das präoperative Peeling auf den Operationsbereich auf. Nach dem Peeling einen Mittellinienschnitt ~ 2 cm in der Haut des Halses vom Brustbein bis zum Kinn machen.
- Ziehen Sie die Haut und die Unterkieferdrüsen zurück und achten Sie darauf, die digastrischen Muskeln vollständig freizulegen.
- Finden Sie die Naht in der Paratrachealmuskulatur, trennen Sie sie mit stumpfer Dissektion und ziehen Sie sie offen zurück.
- Schneiden Sie vorsichtig eine Öffnung in der Oberseite der Luftröhre ab, die groß genug ist, um Polyethylenschläuche (I.D. 0,86 mm, O.D. 1,27 mm) zu montieren. Schneiden Sie nicht mehr als die Hälfte des Durchmessers der Luftröhre. Führen Sie einen Schlauch in die Luftröhre in Richtung Lunge ein.
- Repositionieren Sie Retraktoren, um die paratracheale Muskulatur freizusetzen und die submaxillären Drüsen zurückzuziehen.
- Paratrachealmuskulatur mit einer minimalen Menge Veterinärkleber über Schläuche kleben (siehe Abbildung 1A).
4. Aufbrechen der Paukenbulle
- Den gewünschten Digastrinnenmuskel (links oder rechts) sanft nach oben necken und das Bindegewebe auseinanderziehen. Schneiden Sie am vorderen Ende des Muskels, vermeiden Sie Blutgefäße und ziehen Sie sich nach hinten zurück, bis die Paukenbulle frei ist.
- Neigen Sie den Kopf leicht nach hinten, um die Paukenbulle anzuheben. Lokalisieren Sie den Ast der Halsschlagader vor der hinteren Einstichstelle des Digastrinnenmuskels. Fühlen Sie sich nur hinter diesem Blutgefäß für die konvexe Struktur der Paukenbulle.
- Suchen Sie an dieser Stelle nach einer Naht in der Muskulatur (siehe Abbildung 1B). Mit zwei Sätzen feiner Zangen stumpf an der Naht sezieren, bis der Knochen der Paukenbulle sichtbar ist. Verwenden Sie Retraktoren, um eine klare Sicht auf die Paukenbulla zu haben.
- Finden Sie die Naht, die anterior bis posterior auf der Bulla verläuft (siehe Abbildung 1C). Stechen Sie mit einer chirurgischen Sonde ein Loch in den Knochen in der Mitte dieser Naht. Verwenden Sie eine feine Endschere, um einen kreisförmigen Bereich im Knochen zu schneiden, und achten Sie darauf, die Blutgefäße nicht vor, hinter und tief unter der Bulle zu schneiden.
5. Freilegen des Genikulats
- In diesem Loch befindet sich ein konvexes Stück Knochen, das ist die Cochlea. Anterior zur Cochlea befindet sich ein Muskel, der Tensor Tympani (siehe Abbildung 1D). Schneiden Sie mit der Federschere die Tensor-Pauken ab und entfernen Sie sie.
- Führen Sie eine Zehenklemme durch. Wenn das Tier reagiert, geben Sie eine Ketamin / Xylazin-Mischung in einer Dosis von 1/3 zur Umdosierung.
- Bereiten Sie Bewässerungsflüssigkeit und eine Saugleitung vor. Stechen Sie mit der chirurgischen Sonde ein Loch in das Cochlea-Vorgebirge. Bewässern Sie sofort die flüssigkeit, die ausströmt, und entfernen Sie sie mit Absaugung. Diese Flüssigkeit fließt von diesem Punkt an mehr oder weniger kontinuierlich und muss regelmäßig behandelt werden.
- Vergrößern Sie das Loch in der Cochlea. Achten Sie darauf, dass das Blutgefäß die Cochlea bis zum hinteren und seitlichen Rand umgibt.
- Neigen Sie den Mauskopf nach vorne. Suchen Sie das Loch im Schläfenbein unter der Cochlea (siehe Abbildung 1E). Beachten Sie den Grat vor diesem Loch, dieser Grat sitzt direkt über dem siebten Nerv.
- Führen Sie eine chirurgische Sonde in das Loch ein und heben Sie vorsichtig den Schläfenbein an, um den siebten Nerv freizulegen (siehe Abbildung 1F). Machen Sie eine Bestandsaufnahme, wie viel des siebten Nervs sichtbar ist, und wenn das Genikulat nicht vollständig freigelegt ist, neigen Sie den Kopf des Tieres nach hinten und versuchen Sie, Knochen von vorne zum Nerv zu ziehen.
- Wenn das Ganglion immer noch nicht vollständig sichtbar ist, ziehen Sie mehr Knochen von unten nach oben. Achten Sie sehr darauf, die Sonde nicht tief unter dem Knochen zu platzieren, da dies das Genikulat schädigen kann.
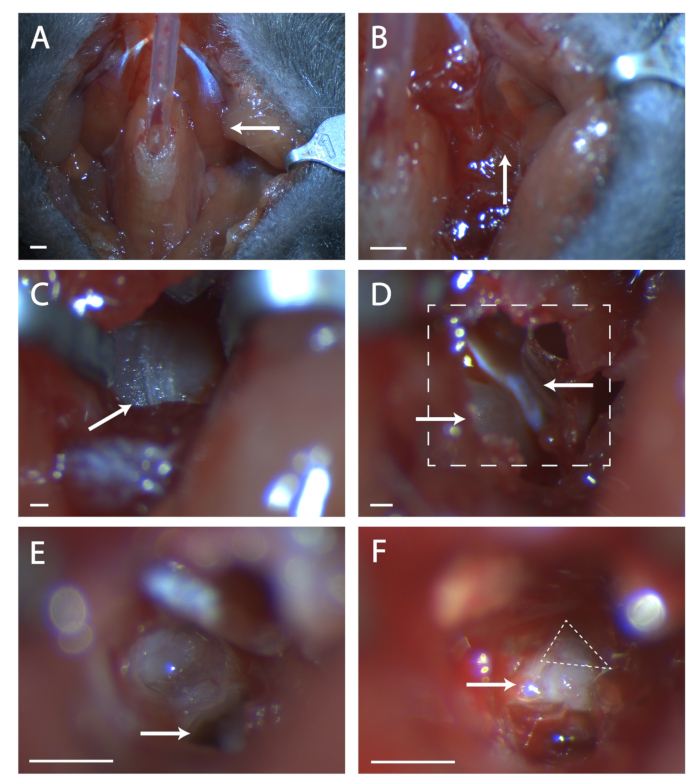
Abbildung 1: Chirurgische Exposition des Ganglionsgeniculat. (A) Bild der Halshöhle der Maus nach der Tracheotomie. Arrow zeigt auf den Digastrischen Muskel, der über dem Operationsbereich liegt, der im Rest der Figur erforscht wurde. (B) Bild der Region unter dem zuvor angegebenen Digastriummuskel. Pfeil zeigt die Naht in der Muskulatur für stumpfe Dissektion an. (C) Bild der Paukenbulla. Pfeil zeigt Naht im Knochen an, um mit einer chirurgischen Sonde zu brechen. (D) Bild des Operationsbereichs nach dem Öffnen der Bulla. Der untere linke Pfeil zeigt die Cochlea, der obere Pfeil zeigt auf den Tensor-Pauken. Boxed Line zeigt den Bereich in (E) und (F) an. (E) Bild des Operationsbereichs, nachdem Cochlea gebrochen und der Inhalt entfernt wurde. Der weiße Pfeil zeigt an, wo die chirurgische Sonde zu platzieren ist, auf die in Protokollschritt 5.6 verwiesen wird. (F) Ein Bild des freigelegten Genikulatganglions. Pfeil zeigt Körper des siebten Nervs an, gestricheltes Dreieck umgibt das geniculate Ganglion. Tafeln A-B, Maßstab = 5 mm. Paneele C-F, Maßstab = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Führen Sie das Tastant-Panel aus
- Verwenden Sie Absaugen, um Flüssigkeit über dem Genikulat zu entfernen. Platzieren Sie optional einen absorbierenden Punkt, um das Versickern zu verringern und die Mikroskopnavigation zu unterstützen.
- Legen Sie das Tier auf ein saugfähiges Pad unter dem Mikroskop. Lokalisieren Sie das geniculate Ganglion: Nützliche Orientierungspunkte sind das Loch in der Bulla, das Loch im Schläfenbein und der siebte Nerv. Überprüfen Sie mit dem FITC/GFP-Filter auf dem Epifluoreszenz-Scope auf einzelne GCaMP-exprimierende geniculate Ganglien-Neuronen. Ein 10-faches Objektiv (Arbeitsabstand 10 mm) bietet eine ausreichende Auflösung, um die Aktivität einzelner Zellen zu verfolgen, aber auch ein 20-faches Objektiv (Arbeitsabstand 12 mm) kann verwendet werden.
- Legen Sie die Dosiernadel für die Tastant-Linie fest in den Mund des Tieres. Legen Sie eine Petrischale unter den Mund des Tieres, um Flüssigkeit aufzufangen.
- Stellen Sie sicher, dass die Kamera das Sichtfeld des Mikroskops betrachtet. Synchronisieren Sie den Start der Videoaufzeichnung mit dem Beginn der tasstanten Präsentation.
- Beobachten Sie während der Aufnahme den Live-Feed auf Antworten, Drift und Versickerung.
- Wenn Versickerung auftritt, saugen Sie die Flüssigkeit ab, bis die Sicht auf das Genikulat klar ist und wiederholen Sie sich. Wenn Drift auftritt, überprüfen Sie, ob alle Teile des Kopfpfostens fest angezogen sind. Wenn keine Reaktionen auftreten, überprüfen Sie, ob Flüssigkeit fließt und dass Mikroskop und Kamera an der richtigen Stelle fokussiert sind, ohne dass etwas das Sichtfeld verdeckt.
- Wiederholen Sie diesen Vorgang, bis die gewünschte Anzahl von Videos erhalten wurde. Erleichtern Sie die Retraktoren vorsichtig und wiederholen Sie dann die Schritte 3-6 auf der gegenüberliegenden Seite.
- Nachdem die gewünschten Videos für alle gewünschten Ganglien erhalten wurden, euthanasieren Sie das Tier durch zervikale Dislokation.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Nach dem Protokoll wurde ein transgenes Snap25-GCaMP6s-Tier sediert, genulierte Ganglien wurden freigelegt und Tastant wurde während der Videoaufnahme auf die Zunge aufgetragen. Ziel des Experiments war es zu definieren, welche Tastants Reaktionen aus jeder Zelle hervorrief. Tastantien (30 mM AceK, 5 mM Chinin, 60 mM NaCl, 50 mM IMP + 1 mM MPG, 50 mM Zitronensäure)18 wurden in DI-Wasser gelöst und 2 s getrennt durch 13 s DI-Wasser auf die Zunge aufgetragen.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Diese Arbeit beschreibt ein Schritt-für-Schritt-Protokoll, um das geniculate Ganglion chirurgisch freizulegen und die Aktivität seiner Neuronen mit GCaMP6s visuell aufzuzeichnen. Dieses Verfahren ist dem zuvor beschriebenen17sehr ähnlich, mit einigen bemerkenswerten Ausnahmen. Erstens ermöglicht die Verwendung eines Kopfpfostens eine einfache Anpassung der Kopfpositionierung während der Operation. Zweitens, in Bezug auf die Stimulusabgabe, fließt der Ansatz von Wu und Dvoryanchikov Geschmack...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt zu melden.
Danksagungen
Die Autoren danken S. Humayun für die Maushaltung. Die Finanzierung dieser Arbeit wurde teilweise durch den Brain Health Consortium Graduate and Postdoctoral Seed Grant (B.E.F.) und NIH-SC2-GM130411 der UTSA an L.J.M bereitgestellt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
Referenzen
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten