A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
In vivo סידן הדמיה של עכבר גניציה גנגליון נוירון תגובות לגירויים טעם
In This Article
Summary
כאן אנו מציגים כיצד לחשוף את גנגליון geniculate של עכבר מעבדה חי, מרדים וכיצד להשתמש הדמיית סידן כדי למדוד את התגובות של הרכבים של נוירונים אלה לטעום גירויים, המאפשר ניסויים מרובים עם ממריצים שונים. זה מאפשר השוואות מעמיקות של אילו נוירונים מגיבים לאו תיוהמים.
Abstract
בעשר השנים האחרונות, ההתקדמות במדדי סידן (GECIs) המקודדים גנטית קידמה מהפכה בהדמיה תפקודית של vivo. באמצעות סידן כבא כוח לפעילות עצבית, טכניקות אלה מספקות דרך לפקח על התגובות של תאים בודדים בתוך הרכבים עצביים גדולים למגוון גירויים בזמן אמת. אנחנו, ואחרים, יישמנו טכניקות אלה כדי לדמיין את התגובות של נוירונים גנגליון geniculate בודדים לטעום גירויים להחיל על הלשונות של עכברים מרדים חיים. הגנגליון הגנולט מורכב מגופי התא של נוירונים גוסטטוריים המחדירים את הלשון והחך העורפיים, כמו גם כמה נוירונים סומטוסנסוריים המחדירים את הפינה של האוזן. הדמיית התגובות מעוררות הטעם של נוירוני גנגליון geniculate בודדים עם GCaMP סיפק מידע חשוב על פרופילי כוונון של נוירונים אלה בעכברים מסוג בר, כמו גם דרך לזהות פנוטיפים טעם היקפי miswiing בעכברים מניפולציה גנטית. כאן אנו מדגימים את ההליך הכירורגי כדי לחשוף את גנגליון geniculate, רכישת תמונה פלואורסצנטית GCaMP, צעדים ראשוניים לניתוח נתונים, ופתרון בעיות. טכניקה זו יכולה לשמש עם GCaMP מקודד מהונדס, או עם ביטוי GCaMP בתיווך AAV, וניתן לשנות אותה לתמונה תת-קבוצות גנטיות מסוימות של עניין (כלומר, ביטוי GCaMP בתיווך Cre). בסך הכל, בהדמיית סידן ויו של נוירוני גנגליון geniculate היא טכניקה רבת עוצמה לניטור הפעילות של נוירונים גוסטטוריים היקפיים ומספקת מידע משלים להקלטות מסורתיות יותר של chorda tympani עצב שלם או טעם התנהגות ישבן.
Introduction
מרכיב מרכזי במערכת הטעם ההיקפית של היונקים הוא גנגליון geniculate. בנוסף לכמה נוירונים סומטוסנסוריים המ innervate את הפינה של האוזן, geniculate מורכב מגופי התא של נוירונים gustatory innervating הלשון והחך הצפוניים. בדומה לנוירונים חושיים היקפיים אחרים, נוירוני הגנגליון הגנולטים הם פסאודו-חד קוטביים עם אקסון ארוך המקרין באופן היקפי לבלוטות הטעם, ובמרכז לגרעין גזע המוח של מערכת הבודדת1. נוירונים אלה מופעלים בעיקר על ידי שחרור של ATP על ידי תאי קולטן טעם המגיבים לגירויים טעם בחלל הפה2,3. ATP הוא נוירוטרנסמיטר חיוני עבור איתות טעם, קולטני P2rx לידי ביטוי על ידי נוירונים גנגליון gustatory נחוצים להפעלתם4. בהתחשב בכך שתאי קולטן הטעם מבטאים קולטני טעם ספציפיים עבור מודאליות טעם מסוימת (מתוק, מריר, מלוח, אומאמי, או חמוץ), ההשערה היא כי תגובות נוירון גנגליון gustatory טעם גירויים יהיה גם מכוון בקושי5.
הקלטות עצבים שלמות הראו הן את chorda tympani ואת העצבים פטרוסאלי מעולה גדול יותר לבצע אותות gustatory המייצגים את כל חמש שיטות הטעם כדי גנגליון geniculate6,7. עם זאת, זה עדיין השאיר שאלות על הספציפיות של תגובות עצביות לטעם נתון: אם יש מודאליות טעם נוירונים ספציפיים, נוירונים פולימודליים, או תערובת של שניהם. הקלטות סיבים בודדים לתת מידע נוסף על הפעילות של סיבים בודדים רגישויות כימיות שלהם8,9,10, אבל מתודולוגיה זו מוגבלת לאיסוף נתונים ממספר קטן של סיבים. באופן דומה, בהקלטות אלקטרופיזיולוגיות vivo של נוירוני גנגליון geniculate חולדה בודדים לתת מידע על התגובות של נוירונים בודדים11,12,13, אבל עדיין מאבד את הפעילות של האוכלוסייה ומניב הקלטות נוירון מעט יחסית לכל חיה. על מנת לנתח את דפוסי התגובה של הרכבים עצביים מבלי לאבד את הפעילות של נוירונים בודדים, טכניקות חדשות צריך להיות מועסק.
הדמיית סידן, במיוחד באמצעות אינדיקטורים סידן מקודד גנטית כמו GCaMP, סיפק פריצת דרך טכנית זו14,15,16,17,18. GCaMP משתמש בסידן כבא כוח לפעילות עצבית, הגדלת פלואורסצנטיות ירוקה ככל שרמות הסידן בתוך התא עולות. צורות חדשות של GCaMP ממשיכות להיות מפותחות כדי לשפר את יחס האות לרעש, להתאים קינטיקה מחייבת, ולהתאים לניסויים מיוחדים19. GCaMP מספק רזולוציית נוירון יחיד, שלא כמו הקלטת עצב שלמה, והוא יכול בו זמנית למדוד תגובות של הרכבים של נוירונים, שלא כמו סיב יחיד או הקלטת תא יחיד. הדמיית סידן של הגרעינים geniculate כבר סיפק מידע חשוב על פרופילי כוונון של נוירונים אלה בעכברים מסוג בר16,20, וזיהה טעם היקפי חיווט פנוטיפים במניפולציה גנטית עכברים18.
אחד הקושיים העיקריים ליישם בטכניקות הדמיית סידן ויוו על גנגליון geniculate הוא שזה עטוף בתוך בולה טימפנית גרמית. על מנת לקבל גישה אופטית geniculate, ניתוח עדין נדרש כדי להסיר את שכבות העצמות, תוך שמירה על הגנגליון שלם. לשם כך, יצרנו מדריך זה כדי לעזור לחוקרים אחרים לגשת לגנגליון geniculate ולדמות את GCaMP מתווך תגובות פלואורסצנטיות של נוירונים אלה לטעום גירויים ב vivo.
Access restricted. Please log in or start a trial to view this content.
Protocol
פרוטוקולים של בעלי חיים נבדקו ואושרו על ידי ועדות הטיפול והשימוש בבעלי חיים המוסדיים של אוניברסיטת טקסס סן אנטוניו.
1. התקנה טרום ניתוחית
הערה: שים לב כי ההתקנה הראשונית של הציוד אינה מטופלת כאן, שכן היא תשתנה בהתאם למערכת המשאבה, המיקרוסקופ, המצלמה ותוכנת ההדמיה שבה נעשה שימוש. לקבלת הוראות התקנה, עיין בחומרי הדרכה המסופקים על-ידי ספק הציוד. עבור ציוד המשמש את המחברים, עיין בטבלת החומרים.
- ודא נוזל זורם דרך כל הרכב (מים) וקווים טעימים. אם הקו חסום, התנתק ושטוף במים. אם הקו הוא סטיה, לעסות עד נוזל זורם. ודא שהנוזל מתחיל ונעצר לפי סימן.
- לאחר כל הקווים מאושרים ללא חסימה, להפעיל רכב עבור 10 s ואז לסגור את כל השסתומים.
- ודא שתוכנת ההדמיה מוכנה עם כל המשתנים הנדרשים (למשל, אורך ניסיון, שמות קבצים, קצב פריימים וכו '). באמצעות μManager, חבילת תוכנה לרכישת תמונות בקוד פתוח, הזן 200 אלפיות השנייה בשדה שכותרתו זמן חשיפה עבור מסגרות לשנייה של 5Hz, בחר x2 תחת binningולחץ על הלחצן שכותרתו Live. כאשר הווידאו מתחיל, לחץ על הלחצן בצד שמאל שכותרתו ROI. התוצאה תהיה שדה ראייה של 512x512.
2. מרדים ומשתק את החיה
הערה: הפרוטוקול הבא הוא הליך סופני ממוטב לעכברים מכל מין במשקל 18-35 גרם. מומלץ לשימוש עם בעלי חיים בין הגילאים 10 ל -12 שבועות. זה עשוי לשמש עם בעלי חיים מהונדסים המבטאים אינדיקטורים סידן מקודד גנטית (GECIs) כגון Snap25-GCaMP6s, או בעלי חיים מוזרק סטריאוטקסית עם GECIs ויראלי. כפפות, חלוק מעבדה ומסכת פנים צריכים להיות משוחקים במשך כל הפרוטוקול.
- לגרד את החיה ולבצע הזרקה תוך-גופית של קטמין (100 מ"ג/ק"ג) ו Xylazine (10 מ"ג/ק"ג). להעריך את עומק ההרדמה באמצעות צביטת הבוהן לפני שתמשיך.
- גילוח החלק העליון של הראש amd האזור הכירורגי בחלק הקדמי של הצוואר.
- הפעל את כרית החימום והניח את החיה נוטה על הכרית.
- יש למרוח משחה על עיני החיה כדי למנוע ייבוש העיניים.
- בצע תרסיס (~ 1 ס"מ) בקו האמצע של הראש כדי לחשוף את הגולגולת של החיה. הסר רקמת חיבור באמצעות ספוגית סטרילית כך העצם החשופה נגישה. השתמש אפליקטור כותנה קצה כדי להבטיח את הגולגולת יבשה.
- החל קשר וטרינר על הגולגולת. הקפד לכסות את הגולגולת החשופה. חכה שהדבק יתייבש.
- במכסה צלחת פטרי, מערבבים ומחילים שכבה של מלט דנטלי על הגולגולת. הקצה האחורי של אפליקטור הכותנה המשמש בשלב 2.5 יעבוד היטב עבור תהליך זה. מניחים כיסוי ראש על גבי המלט הדנטלי ומניחים שכבה שנייה של מלט דנטלי כדי לכריך את כיסוי הראש במקום על הגולגולת.
- תן לו לשבת עד הבטון הדנטלי יבש ומוצק. לשבור את אפליקטור הכותנה הטה לשניים ולהשתמש בקצוות מחודדים לתקוע את מלט השיניים כדי לבדוק. אם המלט הדנטלי אינו נכנע לדחיפה החיה עשוי להפוך לתנוחה על-ביתית.
3. קנה הנשימה
- יש למרוח קרצוף טרום ניתוחי על אזור כירורגי. לאחר קרצוף, לעשות חבטה בקו האמצע ~ 2 ס"מ בעור הגרון מ ועצם החזה לסנטר.
- לסגת העור ואת בלוטות תת maxillary, להיות בטוח לחשוף באופן מלא את השרירים digastric.
- מצא את התפר בשריר הצנחן, להפריד אותו עם ניתוח קהה, ולבטל פתוח.
- חותכים בזהירות פתח בחלק העליון של קנה הנשימה גדול מספיק כדי להתאים צינורות פוליאתילן (I.D. 0.86 מ"מ, O.D. 1.27 מ"מ). אין לחתוך יותר מחצי דרך קוטר קנה הנשימה. הכנס צינורות לתוך קנה הנשימה לכיוון הריאות.
- מקם מחדש מפסקים כדי לשחרר שרירים paratracheal ולבטל את בלוטות תת-מהילארי.
- דבק שרירים paratracheal יחד על צינורות עם כמות מינימלית של דבק וטרינרי (ראה איור 1A).
4. לשבור את הבוולה הסימפנית
- הקנירו בעדינות את שריר הדיגסטרו הרצוי (משמאל או מימין) למעלה ופרקו את רקמת החיבור. חותכים בקצה הקדמי של השריר, הימנעות מכלי הדם, ולמשוך לאחור לאחור עד נקי של bulla tympanic.
- הטה את הראש מעט לאחור כדי להרים את הבולה הטימפנית. אתר את הענף של העורק הראשי הקדמי לנקודת הכניסה האחורית של השריר digastric. תרגישו רק אחוריים לכלי הדם הזה למבנה הקמור של הבורה הטימפנית.
- חפשו תפר בשרירים במיקום זה (ראו איור 1B). באמצעות שני סטים של מלקחיים עדינים, לנתח בוטה בתפר עד העצם של bulla tympanic גלוי. השתמש במפסקים כדי לשמור על תצוגה ברורה של הבוולה הסימפנית.
- מצאו את התפר שרץ הקדמי אל אחורי הבולה (ראו איור 1C). באמצעות בדיקה כירורגית, לתקוע חור בעצם במרכז התפר הזה. השתמש קבוצה של מספריים קצה דק לחתוך אזור מעגלי בעצם, דואג לא לחתוך כלי דם הקדמי, אחורי, ועמוק מתחת bulla.
5. חשיפת ההיגיינה
- בתוך החור הזה יש חתיכת עצם קעורה, זו השבלול. החלק האחורי של השבלול הוא שריר, טימפני הטנסור (ראו איור 1D). בעזרת מספריים קפיץ, לחתוך את טימפני טנסור ולהסיר אותו.
- בצע צביטת בוהן. אם בעלי חיים מגיבים, לתת תערובת קטמין / קסילסין ata 1/3 מנה עבור redosing.
- הכן נוזל השקיה וקו יניקה. באמצעות הגשוש הכירורגי, לנקב חור בצוק שבלול. מיד להשקות את הנוזל שזורם החוצה ולהסיר אותו עם יניקה. נוזל זה יזרום פחות או יותר ברציפות מנקודה זו ויהיה צורך לטפל בו מעת לעת.
- להגדיל את החור שבלול. יש להקפיד על כלי הדם האופפת את השבלול לקצה האחורי והלבי.
- הטה את ראש העכבר קדימה. אתר את החור בעצם הטמפורלית מתחת למה שהיה השבלול (ראו איור 1E). שימו לב לרכס החם לחור הזה, הרכס הזה יושב ישירות מעל העצב השביעי.
- הכנס בדיקה כירורגית לתוך החור והרם בזהירות את עצם הזמן כדי לחשוף את העצב השביעי (ראו איור 1F). קח מלאי של כמה של העצב השביעי נראה ואם geniculate אינו חשוף לחלוטין, להטות את ראשו של החיה בחזרה ולנסות למשוך את העצם מן העצבים אל העצב.
- אם הגנגליון עדיין לא נראה במלואו, משוך יותר עצם מלמטה. היזהר מאוד לא למקם את הגשוש עמוק מתחת לעצם כמו עושה את זה עלול לפגוע geniculate.
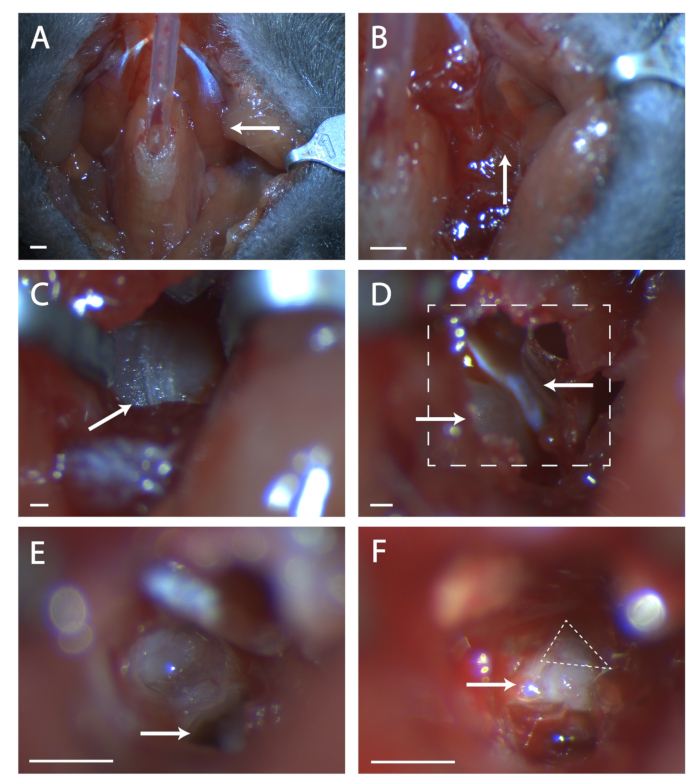
איור 1: חשיפה כירורגית של גנגליון geniculate. (A)תמונה של חלל צוואר העכבר לאחר קנה הנשימה. החץ מצביע על שריר הדיגסטרי השוכב מעל האזור הכירורגי שנחקר בשאר הדמות. (B)תמונה של אזור תחת שריר digastric שצוין בעבר. החץ מציין את התפר בשרירים עבור ניתוח בוטה. (ג)תמונה של בולה טימפנית. החץ מציין תפר בעצם כדי לשבור עם בדיקה כירורגית. (ד)תמונה של אזור כירורגי לאחר פתיחת הבוולה. החץ השמאלי התחתון מציין את השבלול, החץ העליון מצביע על טימפני הטנסור. קו בקופסה מציין אזור ב- (E) ו -F. (ה)תמונה של אזור כירורגי לאחר השבלול נשבר והתוכן הוסר. החץ הלבן מציין היכן למקם בדיקה כירורגית המוזכרת בפרוטוקול שלב 5.6. (ו)תמונה של גנגליון geniculate חשוף. החץ מציין את גופו של העצב השביעי, משולש מקווקו מקיף את גנגליון geniculate. לוחות A-B, Scale = 5 מ"מ. לוחות C-F, Scale = 1 מ"מ. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
6. הפעל פאנל טעים
- השתמש שאיבה כדי להסיר נוזל מעל geniculate. לחלופיות, מקם נקודת ספיגה כדי לסייע בצמצם את החלחול ולסייע בניווט במיקרוסקופ.
- מניחים את החיה על כרית סופגת מתחת למיקרוסקופ. אתר את גנגליון geniculate: ציוני דרך שימושיים כוללים את החור שנותר בולה, החור בעצם הטמפורלית, ואת העצב השביעי. באמצעות מסנן FITC /GFP על טווח האפיפלואורסצנטיות, בדוק אם יש נוירוני גנגליון geniculate בודדים המביעים GCaMP. מטרה של 10x (מרחק עבודה 10 מ"מ) תספק רזולוציה מספקת כדי לעקוב אחר הפעילות של תאים בודדים, אך ניתן להשתמש גם במטרה של 20x (מרחק עבודה 12 מ"מ).
- מניחים מחט חלוקה לקו טעים בחוזקה בפה של בעלי חיים. מניחים צלחת פטרי מתחת לפה של החיה כדי לתפוס נוזל.
- ודא שהמצלמה מציגה את שדה הראייה של המיקרוסקופ. סנכרן את תחילת הקלטת הווידאו עם תחילת המצגת הטעים.
- במהלך ההקלטה, צפה בשידור חי כדי לצפות בתגובות, להיסחף ולחלחל.
- אם חלחול מתרחשת, שאיבה הנוזל עד התצוגה של geniculate ברור וחוזר על עצמו. אם מתרחשת סחף, ודא שכל חלקי עמוד הראש מתהדקים היטב. אם לא מתרחשות תגובות, בדוק שהנוזל זורם ושהמיקרוסקופ והמצלמה מתמקדים במיקום הנכון מבלי שמשהו יטשטש את שדה הראייה.
- חזור על הפעולה עד לקבלת מספר הסרטונים הרצוי. הקל בעדינות על המפסקים ולאחר מכן חזור על שלבים 3-6 בצד הנגדי.
- לאחר שהסרטונים הרצויים הושגו עבור כל הגרעינים הרצויים, המת חסד את החיה באמצעות נקע צוואר הרחם.
Access restricted. Please log in or start a trial to view this content.
תוצאות
בעקבות הפרוטוקול, חיה מהונדסת Snap25-GCaMP6s היה מסומם, גרעינים geniculate נחשפו, ו tastant הוחל על הלשון בזמן וידאו הוקלט. מטרת הניסוי הייתה להגדיר אילו תיחומות עוררו תגובות מכל תא. תמציתים (30 מ"מ AceK, 5 mM כינין, 60 mM NaCl, 50 mM IMP + 1 mM MPG, 50 מ"מ חומצת לימון)18 היו מומסים במי DI והוחלו על הלשון עבור 2 s מופרדי...
Access restricted. Please log in or start a trial to view this content.
Discussion
עבודה זו מתארת פרוטוקול שלב אחר שלב כדי לחשוף בניתוח את גנגליון geniculate ולתעד חזותית את הפעילות של הנוירונים שלה עם GCaMP6s. הליך זה דומה מאוד לזה שתואר קודם לכן17, עם כמה יוצאים מן הכלל בולטים. ראשית, השימוש בתנוחת ראש מאפשר התאמה קלה של מיצוב הראש במהלך הניתוח. שנית, לגבי משלוח גירוי...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגוד אינטרסים לדווח.
Acknowledgements
המחברים מודים לס. הומאיון על גידול העכברים. מימון עבור עבודה זו ניתן בחלקו על ידי בוגר הקונסורציום לבריאות המוח של UTSA ומענק זרע פוסט-דוקטורט (B.E.F.) ו- NIH-SC2-GM130411 ל- L.J.M.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
References
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved