JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 의 생체 칼슘 이미징에서 맛 자극에 신경절 신경 반응
요약
여기에서 우리는 살아있는, 마취 실험실 마우스의 조야성 신경절 신경절을 드러내는 방법과 각성제를 맛보기 위하여 이 뉴런의 앙상블의 반응을 측정하기 위하여 칼슘 화상 진찰을 사용하는 방법을 제시합니다, 다른 각성제를 가진 다중 예심을 허용하. 이것은 어떤 신경 세포가 어떤 tastants에 반응하는지의 깊이 비교를 허용합니다.
초록
지난 10 년 이내에, 유전자 로 코딩 된 칼슘 지표 (GECIs)의 발전은 생체 기능 적 이미징의 혁명을 촉진했습니다. 신경 활동에 대 한 프록시로 칼슘을 사용 하 여, 이러한 기술은 실시간으로 자극의 다양 한 큰 신경 앙상블 내에서 개별 세포의 응답을 모니터링 하는 방법을 제공. 우리 등은 이러한 기술을 적용하여 개별 조니컬트 신경절 뉴런의 반응을 이미지화하여 살아있는 마취 마우스의 혀에 적용되는 자극을 맛볼 수 있습니다. 조닐레이트 신경절은 전방 혀와 입맛을 내면에 가두는 구형 뉴런의 세포 체와 귀의 정강을 가두는 일부 세포 감각 뉴런으로 구성됩니다. GCaMP를 사용하여 개별 조개 신경절 신경전 뉴런의 맛에 자극된 반응을 이미징하는 것은 야생 형 마우스에서 이러한 뉴런의 튜닝 프로파일뿐만 아니라 유전적으로 조작 된 마우스의 표현형을 잘못 배선하는 말초 맛을 감지하는 방법에 대한 중요한 정보를 제공했습니다. 여기서 는 조폐성 신경절, GCaMP 형광 이미지 수집, 데이터 분석을 위한 초기 단계 및 문제 해결을 노출시키는 외과 적 절차를 시연합니다. 이 기술은 형질적으로 인코딩된 GCaMP 또는 AAV 매개 GCaMP 발현과 함께 사용될 수 있으며, 특정 유전 적 관심 하위 집합(즉, Cre-mediated GCaMP 발현)을 이미지하도록 수정할 수 있다. 전반적으로, 조폐성 신경절 신경의 생체 내 칼슘 이미징은 말초 구형 뉴런의 활동을 모니터링하기위한 강력한 기술이며 전통적인 전신경 코르다 tympani 녹음 또는 맛 행동 분석에 보완 적인 정보를 제공합니다.
서문
포유류 말초 맛 시스템의 핵심 성분은 조질성 신경절입니다. 귀의 정점을 내면으로 만드는 일부 소마토 감각 뉴런 외에도, 조닐은 전방 혀와 입맛을 내면에 가두는 구형 뉴런의 세포 체로 구성됩니다. 다른 말초 감각 뉴런과 유사하게, 조폐성 신경절 뉴런은 미각에 말초로 투사되는 긴 축삭을 가진 의사 단극성이며, 고독한1의뇌줄기 핵에 중앙으로 투사된다. 이러한 뉴런은 주로 구강2,3에서맛 자극에 반응하는 맛 수용체 세포에 의해 ATP의 방출에 의해 활성화된다. ATP는 맛 신호에 필수적인 신경 전달 물질이며, 구술 신경절 뉴런에 의해 발현된P2rx 수용체는 활성화4에 필요하다. 맛 수용체 세포가 특정 맛 양식 (달콤한, 쓴 맛, 짠, 감칠맛 또는 신맛)에 대한 특정 맛 수용체를 표현하는 것을 감안할 때, 맛 자극에 대한 구술 신경절 뉴런 반응도 좁게 조정 될 것이라고 가설되었습니다5.
전체 신경 기록은 코다 티파니와 더 큰 우수한 석유 신경이 조랑말 신경절6,7에모든 다섯 맛 양식체를 나타내는 돌풍 신호를 실시 모두 보여 주었다. 그러나, 이것은 여전히 주어진 술에 신경 응답의 특이성에 대 한 질문을 왼쪽: 맛 양식 특정 뉴런이 있는 경우, polymodal 뉴런, 또는 둘 다의 혼합물. 단일 섬유 레코딩은 개별 섬유의 활성과 화학적 민감도8,9,10에대한 자세한 정보를 제공하지만, 이 방법론은 소수의 섬유로부터 데이터를 수집하는 것으로 제한됩니다. 유사하게, 개별 쥐 의 생체 내 전기생리학적 기록에서 신경절 뉴런은 개별 뉴런11,12,13의반응에 대한 정보를 제공하지만, 여전히 인구의 활성을 잃고 동물당 상대적으로 적은 뉴런 기록을 산출한다. 개별 뉴런의 활성의 시력을 잃지 않고 신경 앙상블의 반응 패턴을 분석하기 위해 새로운 기술을 사용할 필요가 있습니다.
칼슘 이미징, 특히 GCaMP와 같은 유전자 로 인코딩 된 칼슘 지표를 사용하여이 기술적 돌파구를 제공했습니다14,15,16,17,18. GCaMP는 칼슘을 신경 활동의 대리자로 사용하여 세포 내의 칼슘 수준으로 녹색 형광을 증가시킵니다. 새로운 형태의 GCaMP는 신호 대 노이즈 비율을 개선하고, 결합 운동학을 조정하며, 특수실험(19)에적응하기 위해 지속적으로 개발되고 있다. GCaMP는 전체 신경 기록과 달리 단일 신경 해상도를 제공하며 단일 섬유 또는 단일 세포 기록과 달리 뉴런 앙상블의 반응을 동시에 측정할 수 있습니다. 조닐칼갱리아의 칼슘 이미징은 이미 야생형 마우스16,20에서이들 뉴런의 튜닝 프로파일에 대한 중요한 정보를 제공하고 있으며, 유전자 조작마우스(18)에서표현형을 잘못 배선하는 말초 맛을 확인하였다.
비보 칼슘 이미징 기술을 조닐레이트 신경절에 적용하는 한 가지 주요 어려움은 뼈 성 막판 불라 내에 캡슐화된다는 것입니다. 조폐제에 대한 광학 적 접근을 얻으려면 신경절을 그대로 유지하면서 뼈층을 제거하기 위해 섬세한 수술이 필요합니다. 그 목적을 위해, 우리는 그밖 연구원이 조닐레이트 신경절에 접근하고 생체 내 자극을 맛하기 위하여 이 뉴런의 GCaMP 중재형 반응을 심상에 접근하는 것을 돕기 위하여 이 가이드를 만들었습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
동물 프로토콜은 텍사스 샌 안토니오 대학의 기관 동물 관리 및 사용 위원회에 의해 검토및 승인되었습니다.
1. 수술 전 설정
참고: 장비의 초기 설정은 펌프 시스템, 현미경, 카메라 및 사용되는 이미징 소프트웨어에 따라 다르므로 여기에서 다루지 않습니다. 설치 지침은 장비 공급업체에서 제공하는 교육 자료를 참조하십시오. 저자가 사용하는 장비의 경우 재료 표를참조하십시오.
- 액체가 모든 차량(물)과 맛줄을 통해 흐르는지 확인합니다. 선이 막힌 경우 분리하고 물로 플러시합니다. 라인이 꼬인 경우 액체가 흐를 때까지 마사지하십시오. 액체가 큐에서 시작하고 멈추는지 확인합니다.
- 모든 라인이 차단해제된 것으로 확인되면 10s의 차량을 달리다가 모든 밸브를 닫습니다.
- 이미징 소프트웨어가 필요한 모든 변수(예: 평가판 길이, 파일 이름, 프레임 속도 등)로 준비되었는지 확인합니다. 오픈 소스 이미지 수집 소프트웨어 패키지인 μManager를 사용하여 초당 프레임에 대해 노출 시간라벨이 표시된 필드에 200ms를 입력하고, binning에서 x2를 선택하고 라이브로 표시된 버튼을 누릅니다. 동영상이 시작되면 왼쪽의 단추를 ROI라고표시합니다. 그러면 512x512 의 시야필드가 생성됩니다.
2. 동물을 마취하고 고정
참고: 다음 프로토콜은 18-35g의 성용 마우스에 최적화된 말단 절차입니다. 10주에서 12주 사이의 동물과 함께 사용하는 것이 좋습니다. Snap25-GCaMP6s와 같은 유전자 인코딩된 칼슘 지표(GECIs) 또는 바이러스 성 GECI로 고정증주입된 동물과 함께 사용될 수 있다. 장갑, 실험실 코트 및 얼굴 마스크는 프로토콜 전체를 착용해야합니다.
- 스크러프 동물과 케타민 (100 mg/kg) 및 자일라진 (10 mg/kg)의 관면 주사를 수행합니다. 계속하기 전에 발가락 핀치를 통해 마취의 깊이를 평가합니다.
- 머리 의 상단을 면도 목의 전면에 수술 영역을 amd.
- 가열 패드를 켜고 패드에 경향이 동물을 배치합니다.
- 눈의 건조를 피하기 위해 동물의 눈에 연고를 적용합니다.
- 동물의 두개골을 드러내기 위해 머리 의 중간에 절개 (~1cm)를 만듭니다. 맨뼈에 접근할 수 있도록 멸균 면봉을 사용하여 결합 조직을 제거합니다. 면 팁 어플리케이터를 사용하여 두개골이 건조하도록 합니다.
- 두개골에 수의사 유대를 적용합니다. 노출된 두개골을 덮으십시오. 접착제가 마르기를 기다립니다.
- 페트리 접시 뚜껑에 치과 시멘트 층을 혼합하고 두개골에 바이드시면 섞어 바에 발라주세요. 2.5 단계에서 사용되는 면 팁 어플리케이터의 백 엔드는이 과정에 잘 작동합니다. 치과 시멘트 위에 헤드 포스트를 놓고 두개골에 헤드 포스트를 끼우기 위해 두 번째 치과 시멘트 층을 적용하십시오.
- 치과 시멘트가 건조하고 단단할 때까지 앉게 하십시오. 면 팁 어플리케이터를 반으로 부수고 뾰족한 끝을 사용하여 치과 시멘트를 찌르고 테스트합니다. 치과 시멘트가 찌르지 않도록 굴복하지 않으면 동물이 척추 위치로 전환될 수 있다.
3. 기관 절제술
- 수술 전 스크럽을 수술 부위에 바르습니다. 스크럽 후, 흉골에서 턱까지 목구멍의 피부에 중간 개절 ~ 2cm를 만듭니다.
- 피부와 상악선 이하의 땀샘을 완전히 드러내십시오.
- 분리 근막에서 솔기를 찾아 무딘 해부로 분리하고, 열린 철회.
- 폴리에틸렌 튜브(I.D.0.86 mm, O.D. 1.27 mm)에 들어갈 수 있을 만큼 큰 기관 상단의 개구부를 조심스럽게 잘라냅니다. 기관지의 직경을 통해 절반 이상을 자르지 마십시오. 폐쪽으로 기관체에 튜브를 삽입합니다.
- 재배치 리트랙터는 paratracheal 근육을 방출하고 하위 땀샘을 철회합니다.
- 접착제 는 수의학 접착제의 최소한의 욕조위에 함께 근육 (그림 1A참조).
4. 타일파닉 불라를 열어
- 원하는 디거스트 근육(왼쪽 또는 오른쪽)을 부드럽게 애타게 하고 결합 조직을 분리합니다. 근육의 앞쪽 끝에서 잘라 혈관을 피하고, 타공 황소가 지울 때까지 후방으로 다시 당깁니다.
- 고리 투박 불라를 들어 올리기 위해 머리를 약간 기울입니다. 경동맥 전방의 가지를 디거스트릭 근육의 후방 삽입 지점으로 찾습니다. 정토닉 불라의 볼록한 구조에 대한이 혈관에 단지 후방을 느낀다.
- 이 위치에서 근육의 솔기를 찾습니다(그림 1B참조). 미세 한 집게의 두 세트를 사용 하 여, 정강이 황소의 뼈가 볼 때까지 솔기에 무딘 해부. 리트랙터를 사용하여 타막 불라의 선명한 시야를 유지하십시오.
- 불라에서 후방으로 앞쪽으로 달리는 솔기를 찾습니다(그림 1C참조). 외과 프로브를 사용하여이 솔기의 중앙에 뼈에 구멍을 찌르습니다. 미세 한 끝 가위 세트를 사용하여 뼈의 원형 영역을 자르고 혈관 앞쪽, 후방 및 황소 아래 깊은 혈관을 자르지 않도록주의하십시오.
5. 천재성 노출
- 이 구멍 안에는 뼈의 볼록한 비트가 있으며, 이것은 달팽이관입니다. 달팽이관에 전방은 근육, 텐서 티파니 (그림 1D참조)입니다. 스프링 가위를 사용하여 텐서 티파니를 자르고 제거합니다.
- 발가락 핀치를 수행합니다. 동물이 반응하는 경우, 케타민 / 자일라진 혼합물 아타1/3 주사위를 배설하십시오.
- 관개 액과 흡입 선을 준비합니다. 외과 프로브를 사용하여 달팽이관 추진에 구멍을 뚫습니다. 즉시 흘러 나오는 액체를 관개하고 흡입으로 제거합니다. 이 액체는 이 시점부터 다소 연속적으로 흐르며 주기적으로 해결해야 합니다.
- 달팽이관의 구멍을 확대합니다. 달팽이관을 후면과 측면 가장자리로 둘러싸고 있는 혈관을 돌봐.
- 마우스의 머리를 앞으로 기울이세요. 달팽이관 아래에 현세적 뼈의 구멍을 찾습니다(그림 1E참조). 이 구멍에 능선 전방의 주의, 이 능선은 일곱 번째 신경 위에 직접 앉아.
- 수술 프로브를 구멍에 삽입하고 세일한 뼈를 조심스럽게 들어 올려 일곱 번째 신경을 노출시다(그림 1F참조). 일곱 번째 신경의 얼마나 많은 것이 보이는지, 그리고 조니큐레이트가 완전히 드러지지 않는 경우에, 동물의 머리를 뒤로 기울이고 신경에 전방에서 뼈를 당기려고 시도하십시오.
- 신경절이 아직 완전히 보이지 않으면 아래에서 더 많은 뼈를 끌어당깁니다. 이렇게 하면 뼈 아래에 프로브를 두지 않도록 주의하십시오.
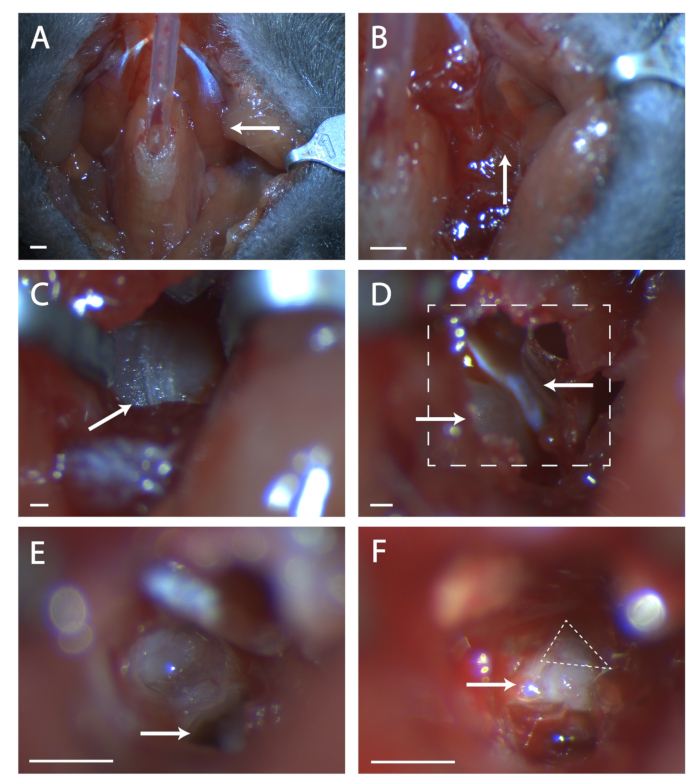
도 1: 조랑말 신경절의 외과 적 노출. (A)마우스 목 구멍의 이미지 사후 기관 절제술. 화살표는 그림의 나머지 부분에서 탐구 수술 영역에 누워 디거스 근육을 가리키고있다. (B)이전에 표시된 디거스강 근육 하에서 영역의 이미지. 화살표는 무딘 해부에 대한 근육의 솔기를 나타냅니다. (C)정폭성 불라의 이미지. 화살표는 수술 프로브와 함께 부서뼈의 솔기를 나타냅니다. (D)황소를 연 후 수술 부위의 이미지. 왼쪽 아래 화살표는 달팽이관, 상부 화살표가 텐서 티파니를 가리킵니다. 박스 라인(E)및(F)의영역을 나타냅니다. (E)달팽이관 후 수술 부위의 이미지가 끊어지고 내용물제거. 백색 화살표는 프로토콜 단계 5.6에서 참조된 수술 프로브를 배치할 위치를 나타냅니다. (F)노출된 조개 신경절의 이미지. 화살표는 일곱 번째 신경의 몸을 나타내고, 돌진삼각형은 조랑말 신경절을 둘러싸고 있다. 패널 A-B, 배율 = 5mm. 패널 C-F, 배율 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 태스탄 패널 실행
- 흡입을 사용하여 조니쿨레이트 위로 액체를 제거하십시오. 선택적으로 흡수점을 배치하여 현미경 탐색을 통해 침투를 완화하고 도움을 줍니다.
- 동물을 현미경 아래에 흡수 패드에 놓습니다. 조랑말 신경절을 찾습니다: 유용한 랜드마크에는 불라에 남아 있는 구멍, 현세골의 구멍 및 일곱 번째 신경이 포함됩니다. EPIfluorescence 범위에 FITC/GFP 필터를 사용하여 개별 GCaMP 표현 geniculate 신경절 신경절 뉴런을 확인하십시오. 10x 목표(작업 거리 10mm)는 개별 셀의 활성을 추적하기에 충분한 해상도를 제공하지만 20배 목표(작업 거리 12mm)도 사용할 수 있습니다.
- 동물의 입에 태액 라인을 위해 분주 바늘을 단단히 놓습니다. 페트리 접시를 동물의 입 아래에 놓고 액체를 잡습니다.
- 카메라가 현미경의 시야를 보고 있는지 확인합니다. 비디오 녹화의 시작을 맛있는 프레젠테이션의 시작과 동기화합니다.
- 녹화 하는 동안 응답, 드리프트 및 seepage에 대 한 라이브 피드를 시청 합니다.
- 투명도가 생기면, 조니큐레이트의 시야가 명확하고 반복될 때까지 액체를 흡입한다. 드리프트가 발생하면 헤드 포스트의 모든 부분이 단단히 조여있는지 확인합니다. 응답이 발생하지 않으면 액체가 흐르고 현미경과 카메라가 시야를 가리는 것이 없는 적절한 위치에 초점을 맞추고 있는지 확인합니다.
- 원하는 비디오 수가 얻을 때까지 반복합니다. 리트랙터를 부드럽게 완화한 다음 반대편에서 3-6단계를 반복합니다.
- 원하는 모든 간질에 대해 원하는 비디오를 얻은 후 자궁 경부 탈구를 통해 동물을 안락사시하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
프로토콜에 따라, 형질전환 Snap25-GCaMP6s 동물은 진정되고, 조네이큐레이트 간리아가 노출되고, 비디오가 녹화되는 동안 태액을 혀에 적용했다. 실험의 목적은 각 세포에서 어떤 술관이 반응을 유도하는지 정의하는 것이었습니다. 태스트(30mM AceK, 5m키닌, 60mM NaCl, 50mM IMP + 1mM MPG, 50mM 양연산)18은 DI 수에 용해되어 DI 수의 13s로 분리된 2s에 혀에 적용되었다.
Access restricted. Please log in or start a trial to view this content.
토론
이 작품은 조폐성 신경절을 외과적으로 노출하고 GCaMP6s로 뉴런의 활동을 시각적으로 기록하는 단계별 프로토콜을 설명합니다. 이 절차는 몇 가지 주목할 만한 예외를 제외하고 이전에 설명된17과매우 유사합니다. 첫째, 헤드 포스트를 사용하면 수술 중 헤드 포지셔닝을 쉽게 조정할 수 있습니다. 둘째, 자극 전달에 관해서는, 우와 드보리안치코프의 접근법은 식도?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 보고할 이해 상충이 없습니다.
감사의 말
저자는 마우스 축산에 대한 S. 후마윤에게 감사드립니다. 이 작업에 대한 자금은 UTSA의 뇌 건강 컨소시엄 대학원 및 박사 후 종자 보조금 (B.E.F.) 및 NIH-SC2-GM130411에서 L.J.M부분적으로 제공되었습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
참고문헌
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유