Method Article
المجهر أحادي الجسيمات كريو إلكترون: من عينة إلى هيكل
In This Article
Summary
أصبح تحديد هيكل المجمعات الجزيئية الكبيرة باستخدام cryoEM روتينيا لفئات معينة من البروتينات والمجمعات. هنا، يتم تلخيص هذا الخط (إعداد العينات، والفحص، والحصول على البيانات ومعالجتها) ويتم توجيه القراء نحو المزيد من الموارد التفصيلية والمتغيرات التي يمكن تغييرها في حالة العينات الأكثر تحديا.
Abstract
المجهر الإلكترونى (cryoEM) هو تقنية قوية لتحديد هيكل المجمعات الجزيئية الكلية، عن طريق تحليل الجسيمات واحد (SPA). وتنطوي العملية الشاملة على 1) تزجيج العينة في فيلم رقيق مدعوم على شبكة cryoEM؛ '2' فحص العينة لتقييم توزيع الجسيمات وجودة الجليد؛ 3) إذا كانت الشبكة مناسبة، وجمع مجموعة بيانات جسيم واحد للتحليل؛ و4) معالجة الصور لتسفر عن خريطة الكثافة EM. في هذا البروتوكول، يتم توفير نظرة عامة لكل خطوة من هذه الخطوات، مع التركيز على المتغيرات التي يمكن للمستخدم تعديلها أثناء سير العمل واستكشاف الأخطاء وإصلاحها للقضايا الشائعة. مع تشغيل المجهر عن بعد تصبح قياسية في العديد من المرافق، سيتم وصف الاختلافات على بروتوكولات التصوير لمساعدة المستخدمين في التشغيل الفعال والتصوير عندما يكون الوصول المادي إلى المجهر محدودة.
Introduction
جسيم واحد كريويم
للتحقيق في الحياة على المستوى الجزيئي يجب أن نفهم الهيكل. تتوفر العديد من التقنيات للتحقيق في بنية البروتين، مثل NMR، والتصوير البلوري بالأشعة السينية، وقياس الطيف الكتلي، والمجهر الإلكتروني (EM). حتى الآن، تم حل معظم الهياكل المودعة في بنك بيانات البروتين (PDB) باستخدام التصوير البلوري بالأشعة السينية. ومع ذلك ، من ~ 2012 فصاعدا ، أصبح المجهر الإلكتروني المبرد (cryoEM) تقنية سائدة لتحديد بنية البروتين وزاد استخدامه بشكل كبير. بلغ إجمالي عدد خرائط EM المودعة في بنك بيانات المجهر الإلكتروني (EMDB) (حتى ديسمبر 2020) 13,421 مقارنة ب 1,566 في عام 2012 (الشكل 1، www.ebi.co.uk). وفي عام 2012، كان عدد الإحداثيات الذرية على غرار خرائط كثافة التبريد، المودعة في مصرف التنمية للبلدان الأمريكية 67 فقط، ولكن حتى كانون الأول/ديسمبر 2020، تم إيداع 309 2 هياكل حتى الآن، بزيادة قدرها 35 ضعفا. وكان سبب هذا النمو الأساسي في نوعية وكمية خرائط كثافة التبريد المنتجة، والتي يشار إليها أحيانا باسم "ثورة القرار"1، هو تجمع التقدم في مجالات متعددة: تطوير كاميرات جديدة للتصوير تعرف باسم كاشفات الإلكترونات المباشرة؛ وسرعة استخدام الأجهزة في مجال التصوير؛ وسرعة استخدام الأجهزة ذات الأجهزة التي يمكن استخدامها في استخدام الأجهزة الكشفية المباشرة؛ وسرعة استخدام الأجهزة التي تستخدم في استخدام الأجهزة؛ وسرعة استخدام الأجهزة التي تستخدم في استخدام الأجهزة التي تستخدم في استخدام الإلكترونات؛ وسرعة استخدام الأجهزة التي تستخدم في استخدام الأجهزة الإلكترونية؛ وسرعة استخدام ال برنامج جديد؛ والمجاهر أكثر استقرارا2،3،4.
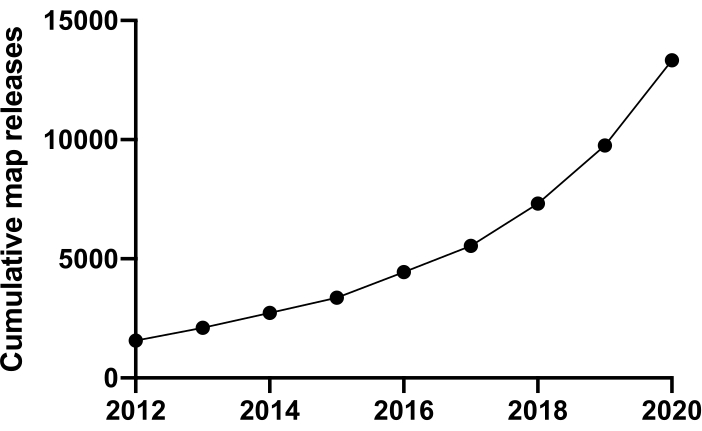
الشكل 1: الطلبات التراكمية إلى EMDB من عام 2012 إلى ديسمبر 2020. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحليل الجسيمات واحد (SPA) هو أداة قوية لتوليد البصيرة البيولوجية في مجموعة واسعة من أنواع العينات من خلال توضيح هياكل عالية الدقة من complexes5،6 معزولة بما في ذلك viruses7،8، membrane proteins9،10، التجميعات حلية11 وغيرها من المجمعات الجزيئية الكلية الديناميكية وغير المتجانسة12،13، أحجامها تختلف حسب أوامر الحجم (من 39 kDa 14,15 إلى عشرات من الميغادالتونات). هنا، يتم وصف بروتوكول لخط أنابيب قياسية للحصول على CRYOEM SPA من عينة إلى بنية.
قبل الشروع في خط الأنابيب هذا، ينبغي إخضاع عينة منقى للتحليل الكيميائي الحيوي لتقييم فرص نجاح المصب. يمكن القول إن إعداد عينة مناسبة هو أكبر عائق أمام SPA ، خاصة بالنسبة للمجمعات العابرة وغير المتجانسة (التركيبية والتكوينية). وينبغي أن يحتوي الإعداد المعقد الجزيئي الكلي على أقل عدد ممكن من الملوثات، بتركيز كاف ليسفر عن العديد من الجسيمات في كل ميكروجراف بالتبريد، وفي تركيبة عازلة مناسبة تماما لتحليل التبريد. بعض المكونات العازلة، بما في ذلك السكروز والجلسرين وعالية (~ > تركيزات 350 mM من الأملاح، اعتمادا على حجم العينة والخصائص وغيرها من المكونات العازلة) يمكن أن تتداخل مع عملية التزجيج أو تقليل نسبة الإشارة إلى الضوضاء في الصور، مما يعوق تحديد الهيكل16.
عادة ، كحد أدنى ، يجب استخدام تحليل الكروماتوغرافيا استبعاد الحجم (SEC) و SDS- PAGE gel لتقييم نقاء العينة17،18 ، ولكن dichroism دائرية ، المقايسات الوظيفية ، SEC مقرونة بتشتت الضوء متعدد الزوايا ، ومقايسات الاستقرار الحراري كلها أدوات مفيدة للتحليل النوعي للاستعدادات المعقدة الجزيئية الكلية قبل تحليل cryoEM. ومع ذلك، فإن نتائج هذه التحليلات الكيميائية الحيوية قد تسفر عن القليل من البصيرة في التغاير الهيكلي للعينة وسلوكها على شبكة cryoEM. لهذا السبب، يتم استخدام وصمة عار سلبية EM بشكل روتيني كأداة سريعة ورخيصة وقوية لتقييم التغايرية التركيبية والتكوينية، وبالتالي طريقة جيدة للتأكد من أي جزء elution من تنقية واعدة للغاية، أو فحص التراكيب العازلة المختلفة19،20. بمجرد تحديد عينة واعدة ، يمكننا المضي قدما في خط أنابيب CRYOEM SPA. وصمة عار سلبية لا تتماشى دائما مع النتائج اللاحقة ينظر في cryoEM; في بعض الأحيان عينة تبدو فقيرة من قبل وصمة عار سلبية ولكن يتحسن عندما ينظر إليها في الجليد الزجاجي في cryoEM. في المقابل ، تبدو العينات في بعض الأحيان ممتازة أثناء خطوات البقع السلبية ولكنها تتطلب المزيد من التحسين عند التقدم إلى cryoEM. ومع ذلك، في معظم الحالات بقعة سلبية يوفر خطوة مفيدة لمراقبة الجودة.
التزجيج
البيئة القاسية داخل نظام فراغ المجهر الإلكتروني يسبب كل من الجفاف والأضرار الإشعاعية للعينات البيولوجية غير المثبتة21. لذلك ، لتصوير العينة في حالة تشبه الأم ، يجب الحفاظ على العينة البيولوجية قبل التصوير. بالنسبة للاستعدادات المنقى للمجمعات الجزيئية الكلية ، فإن التزجيج هو الطريقة المفضلة لتمكين تصورها عن طريق cryoEM مع الحفاظ على التفاصيل الذرية للمجمع. كان اكتشاف التزجيج كطريقة لإعداد العينات تقدما أساسيا في المجهر الإلكتروني للعينات البيولوجية ، والذي تم الاعتراف به في جائزة نوبل للكيمياء لعام 2017. عينة التزجيج ينطوي على خلق طبقة رقيقة من الحل الذي يحتوي على عينة من الفائدة، وعادة ما تكون عشرات نانومتر سميكة، علقت على دعم شبكة cryoEM. ثم يتم تجميد الفيلم رقيقة بسرعة كبيرة في cryogen مثل الإيثان السائل في ~ -175 درجة مئوية. معدل التجمد هو ~ 106 درجة مئوية / ثانية ، بسرعة كافية أن أشكال الجليد غير متبلور ، أو الزجاجية ، وتعليق العينة في رقيقة ، film22 الصلبة.
المتغير الأولي للنظر هو دعم شبكة cryoEM المختار23. شبكة EM يتكون عادة من فيلم الكربون غير متبلور مع ثقوب (إما العادية أو غير النظامية)، على هيكل الدعم. هيكل الدعم هو عادة شبكة معدنية دائرية قطرها 3.05 ملم ، وعادة ما تكون مصنوعة من النحاس ، ولكن يمكن استخدام معادن أخرى مثل الذهب ، أو الموليبدينوم (الذي يفضل خصائص التوسع الحراري24). في بعض الأحيان ، يتم تطبيق دعم إضافي رقيق ومستمر عبر الشبكة ، مثل الجرافين أو أكسيد الجرافين أو طبقة كربون رقيقة (~ 1-2 نانومتر) غير متبلورة. في حين أن شبكات cryoEM القياسية (الأكثر شيوعا 400-200 شبكة النحاس مع ثقب (1.2 ميكرومتر ثقوب مستديرة مفصولة 1.3 ميكرومتر (r1.2/2 1.3) ، أو 2 ميكرومتر مفصولة 2 ميكرومتر من الكربون (r2/2)) دعم الكربون ، على الرغم من وجود العديد من الأنماط المختلفة المتاحة) وقد استخدمت في الغالبية العظمى من الهياكل المبلغ عنها حتى الآن ، وقد تم الإبلاغ عن تقنيات الشبكة الجديدة مع تحسين الموصلية وانخفاض حركة العينة25 . تتعرض شبكات مختارة لعلاج تنظيف توهج التفريغ / البلازما لجعلها هيدروفيلي وقابلة لعينة application26.
بعد توهج التفريغ، والمرحلة التالية هي تشكيل فيلم رقيقة. يتم تشكيل هذا الفيلم رقيقة الأكثر شيوعا باستخدام ورقة تصفية لإزالة السائل الزائد من الشبكة. في حين أن هذا يمكن القيام به يدويا، وعدد من أجهزة تجميد يغرق متاحة تجاريا، بما في ذلك Vitrobot Mk IV (الحرارية فيشر العلمية)، EM GP الثاني (لايكا) وCP3 (جاتان). مع هذه الأجهزة ، يتم تطبيق ~ 3-5 ميكرولتر من العينة في الحل على شبكة EM ، تليها النشاف بعيدا الحل الزائد باستخدام ورق التصفية. الشبكة، مع فيلم رقيقة علقت عبرها، ثم سقطت في الإيثان السائل تبريدها بالنيتروجين السائل (LN2) إلى ~-175 درجة مئوية. بمجرد تجميد الشبكة، يتم الحفاظ عليها عند درجة حرارة أقل من نقطة الإزالة (-137 درجة مئوية) قبل وأثناء التصوير.
فحص العينات وجمع البيانات
بعد تزجيج شبكة cryoEM ، فإن المرحلة التالية هي فحص الشبكة لتقييم جودتها وتحديد ما إذا كانت الشبكة مناسبة للشروع في جمع البيانات عالية الدقة. شبكة التبريد المثالية لديها الجليد الزجاجي (على عكس الجليد البلوري) مع سمك الجليد كافية فقط لاستيعاب أطول بعد للعينة، وضمان الجليد المحيطة يساهم أقل قدر ممكن من الضوضاء إلى الصورة الناتجة. يجب أن يكون للجسيمات داخل الجليد حجم وشكل (إذا كان معروفا) بما يتفق مع الكيمياء الحيوية ، ومن الناحية المثالية يجب أن تكون أحادية التشتت مع توزيع عشوائي لاتجاهات الجسيمات. وأخيرا، ينبغي أن يكون للشبكة ما يكفي من المجالات ذات الجودة الكافية لتلبية طول جمع البيانات المطلوب. اعتمادا على العينة، وهذا قد يستغرق العديد من التكرار من التزجيج والفحص حتى يتم إنتاج الشبكات المثلى. لحسن الحظ ولسوء الحظ ، هناك مجموعة كبيرة من المتغيرات التي يمكن اختبارها تجريبيا لتغيير توزيع الجسيمات على شبكات cryoEM (تمت مراجعتها في 16،27). في هذه المخطوطة، تظهر النتائج التمثيلية لمشروع بروتين الغشاء10 .
وبمجرد تحديد شبكة مناسبة، يمكن المضي قدما في جمع البيانات. تم تحسين العديد من نماذج المجاهر الإلكترونية لنقل التبريد للعينات البيولوجية لجمع بيانات عالية الدقة بطريقة آلية. عادة، يتم جمع البيانات على 300 كيلو فولت أو 200 كيلو فولت. يمكن تحقيق جمع البيانات الآلي باستخدام البرمجيات بما في ذلك EPU (الحرارية فيشر العلمية)28، Leginon29، JADAS30 و SerialEM31،32. وعادة ما ينتج عن جمع البيانات الآلي باستخدام أجهزة الكشف الحديثة تيرابايت من البيانات الأولية في فترة 24 ساعة (يبلغ متوسط حجم مجموعات البيانات ~ 4 تيرابايت).
بسبب القيود المفروضة على COVID-19 في معظم أنحاء العالم (وقت كتابة ديسمبر 2020) ، انتقلت العديد من مرافق الفحص المجهري إلى توفير الوصول عن بعد. بمجرد تحميل الشبكات في التحميل التلقائي للمجهر ، يمكن إجراء الحصول على البيانات عن بعد.
معالجة الصور وبناء النموذج
عندما تكون جلسة جمع البيانات عادة 0.5-4 أيام، قد تستغرق معالجة الصور اللاحقة عدة أسابيع وأشهر، اعتمادا على توفر موارد الحوسبة. ومن المعايير الأولية لمعالجة الصور الخطوات ، وهي تصحيح الحركة ونقل التباين وظيفة (CTF) تقدير أن تجري 'على الطاير' 33344. للمعالجة المصب، وهناك عدد كبير من مجموعات البرمجيات المتاحة. يتم "انتقاؤها" الجسيمات واستخراجها من micrographs35,36. وبمجرد استخراج الجسيمات، سيكون البروتوكول القياسي هو معالجة الجسيمات من خلال عدة جولات من التصنيف (في كلا البعدين (ثنائي الأبعاد) وثلاثة أبعاد (ثلاثية الأبعاد) و/أو التركيز على مناطق محددة ذات أهمية) للوصول إلى مجموعة فرعية متجانسة من الجسيمات. ثم يتم متوسط هذه المجموعة الفرعية المتجانسة من الجسيمات معا لإنتاج إعادة بناء ثلاثية الأبعاد. عند هذه النقطة غالبا ما يتم تصحيح البيانات أكثر لإنتاج خريطة أعلى جودة ممكنة، على سبيل المثال من خلال صقل CTF، وتصحيحات التشويه37 وتلميع بايزي38 . نتيجة معالجة هذه الصورة هي خريطة cryoEM ثلاثية الأبعاد للعينة البيولوجية ذات الاهتمام. نطاق القرار التي تم التوصل إليها في تجربة "قياسية" الجسيمات الفردية الآلي من شبكة ذات جودة كافية، مع البيانات التي تم جمعها على نظام المجهر 300 كيلو فولت عادة ما يكون بين 10 Å و 2 Å اعتمادا على حجم ومرونة مجمع البروتين. مع عينة مثالية، تم الآن التوصل إلى قرارات ~1.2 Å باستخدام سير العمل SPA5. في حين أن هذا البروتوكول تفاصيل الخطوات نحو الحصول على خريطة كثافة EM، مرة واحدة وهذا هو في متناول اليد يمكن تفسيرها من خلال تركيب وصقل نموذج البروتين (إذا كان القرار هو < 3.5 Å) أو بناء دي novo39. يمكن إيداع البيانات المرتبطة بتجارب تحديد الهيكل في المستودعات العامة عبر الإنترنت، بما في ذلك خرائط الكثافة EM (بنك بيانات المجهر الإلكتروني)40، والإحداثيات الذرية الناتجة (بنك بيانات البروتين)41 ومجموعات البيانات الخام (أرشيف الصور العامة المجهر الإلكتروني)42.
في هذا البروتوكول، يتم استخدام مجمع البروتين الخارجي RagAB (~ 340 كيلودا) من بورفيروموناس جينجيفاليس كمثال مجمع الجزيئات الكلية10 (EMPIAR-10543). بالنسبة لأولئك الجدد ل cryoEM ، يتوفر دعم للعينات من خلال خط الأنابيب هذا من عينة إلى بنية ، رهنا بمراجعة الأقران ، من خلال مخططات الوصول الممولة مثل iNEXT Discovery و Instruct.
Protocol
1. شبكة التزجيج
ملاحظة: لجميع الخطوات في الخطوتين 1 و2، تأكد من أن جميع الأدوات نظيفة وجافة وفي درجة حرارة الغرفة قبل تبريدها إلى درجة حرارة LN2 ، وذلك باستخدام LN2 الطازج للحد من تلوث الجليد. العمل في بيئة تسيطر عليها الرطوبة، حيثما أمكن، مع رطوبة نسبية < 20٪. ضمان توفير معدات الحماية الشخصية المناسبة ووثائق H&.S قبل بدء العمل.
- تأكد من أن عينة الاهتمام جاهزة لإعداد العينة.
- اختيار شبكات التبريد المناسبة وضمان هذه قد أصبحت هيدروفيلي باستخدام توهج التفريغ أو العلاج البلازما. تتوفر مجموعة واسعة من الأنظمة والاختلافات في البروتوكول ولكنها تنطوي جميعها على وضع الشبكات في نظام تنظيف تفريغ / البلازما توهج وتشغيل برنامج من شأنه أن يضخ الغرفة إلى مستوى الفراغ المطلوب ، قبل إدخال خليط غاز محدد / بخار كيميائي أو هواء في النظام. يتم تمرير تيار كهربائي من خلال النظام ، وتأيين جزيئات الغاز وتحفيز سطح الشبكات لجعلها أكثر هيدروفيلية.
- بدء تشغيل جهاز تجميد الهبوط لتزجيج الشبكة عن طريق تشغيل النظام باستخدام مفتاح الطاقة على ظهره، وانتظر الشاشة التي تعمل باللمس لتحميل.
- باستخدام القلم أو الأصابع المقدمة، في وحدة التحكم، تعيين درجة حرارة العمل المطلوب من الغرفة (النطاق المتاح هو 4-60 درجة مئوية، وأوصت لمعظم الجزيئات الكلية 4-6 درجة مئوية).
- ملء مرطب مع 50 مل من نوع الثاني مختبر المياه باستخدام حقنة، عن طريق أنابيب المطاط في الجزء السفلي من مرطب. التأكد من إزالة أي هواء محصور في المحقنة قبل التعبئة. يجب الحرص على عدم ملء مرطب أو الماء سوف تنضح في الغرفة. بمجرد تعبئة المرطب ، اسحب المكبس المحاقن بمقدار 5-10 مل لإنشاء ختم فراغ.
- في وحدة التحكم، تعيين الرطوبة النسبية المطلوبة للغرفة (النطاق المتاح هو 0-100٪، وعادة ما تستخدم الرطوبة من 95-100٪). ترك الرطوبة تعيين إلى 'إيقاف' حتى مباشرة قبل صنع الشبكة بحيث الغرفة لا تحصل على الرطب جدا.
- الحصول على ملاقط جهاز تجميد يغرق وورق تصفية قطع إلى الحجم الصحيح لتناسب على منصات، إما شراؤها أو باستخدام ختم لقطع فتحة من الحجم المناسب.
- إعداد cryogen لإغراق تجميد.
- ضع حامل صندوق الشبكة المبردة المعدنية وكأس cryogen وساقي العنكبوت المعدني في حاوية المبرد.
- تبريد الحاوية عن طريق ملء الغرفة الخارجية مع LN2. حافظ على الغرفة الخارجية مغطاة لتغطية الجزء العلوي من حامل صندوق شبكة التبريد. إضافة ~ 1 سم من LN2 إضافية إلى كأس cryogen للمساعدة في توازن النظام إلى درجة حرارة LN2 .
ملاحظة: يمكن استخدام حلقة مكافحة التلوث للحد من تكثيف الهواء الرطب حول كوب cryogen ويؤدي إلى تلوث المبرد / الإيثان. وهذا غير مطلوب بشكل عام في بيئة يتم التحكم فيها بالرطوبة. إذا كنت تستخدم حلقة مكافحة التلوث، يجب الحرص على عدم ملء الحاوية مع LN2 أو أنه قد تسرب عندما يتم الضغط على حلقة في الحاوية في وقت لاحق في هذه العملية. - انتظر 3-5 دقائق لمراقبة غليان الساقين العنكبوت، ومن ثم الانتظار لمدة 3 دقائق أخرى لضمان كوب cryogen الباردة بما فيه الكفاية لتكثيف المتوسطة التزجيج.
- تسييل cryogen (الإيثان السائل) في كوب cryogen.
- خذ أنبوب اسطوانة الإيثان مع أنابيب رقيقة وفوهة للاستغناء عن الغاز. تلميح ماصة P200 مع الفتحة التي فتحت عن طريق قطع طرف جدا باستخدام شفرة حلاقة مثالية هنا. هناك حاجة إلى فتحة أوسع لمنع ترسيخ الإيثان عند الطرف ومنع تدفق الغاز.
- ضمان كأس cryogen لا يحتوي على أي LN2 المتبقية، واتخاذ فوهة غاز الإيثان ووضعه داخل كأس cryogen. باستخدام منظم اسطوانة الغاز، بدء تدفق منخفض والاستغناء عن غاز cryogen في كوب cryogen لتكثيف الغاز. الحفاظ على الطرف الذي يتدفق الغاز ضغط مباشرة ضد جدار الكأس cryogen ولكن تحريكه بلطف ذهابا وإيابا في حركة التنصت ضد السطح. تنظيم تدفق الغاز للسماح لتدفق منخفض وثابت للبدء في تكثيف / تسييل بطريقة تسيطر عليها داخل كأس cryogen.
- ملء الكأس إلى ما دون حافة العنكبوت الفضي ووقف تدفق الغاز، ثم إزالة خط الغاز بعناية لتجنب تلويث LN2 المحيطة بها مع الإيثان.
- قم بأعلى حاوية التبريد مع LN2 ، مع الحرص الشديد على عدم سكب أي منها في الإيثان السائل.
- اترك أرجل العناكب في موضعها لمدة 3-5 دقائق لضمان توازن الإيثان السائل إلى درجة حرارة باردة بما فيه الكفاية. سوف تبدأ cryogen لتبدو غائمة / مبهمة قليلا. وهذا يشير إلى أنه قريب من نقطة التجمد. في هذه المرحلة، استخدم الملاقط لإزالة العنكبوت. طالما يتم الاحتفاظ LN2 داخل الحاوية المحيطة كأس cryogen، والإيثان سوف تبقى الآن المسال ومناسبة للتزجيج لمدة 1-2 ساعة. ومع ذلك، تهدف إلى إكمال الإجراء في أسرع وقت ممكن، وخاصة في الغرف غير التي تسيطر عليها الرطوبة، للحد من تلوث الجليد.
ملاحظة: إذا كان العنكبوت يبدو أن 'عالقة على'، استخدم كائن معدني مثل الجوز وعقد ضد ساقي العنكبوت لتسخينها قليلا، ومن ثم إزالة الساقين.
- إعداد جهاز تجميد يغرق والملحقات للتزجيج عينة.
- إضافة صناديق تخزين الشبكة إلى حامل مربع الشبكة المبردة المعدنية وطوال الإجراء ضمان يتم الاحتفاظ LN2 تصدرت ما يصل الى أعلى بقليل من مستوى صناديق الشبكة (عادة كل ~ 5 دقيقة).
- على شاشة جهاز تجميد يغرق، في مربع معلمات العملية إدخال المعلمات المختارة بما في ذلك: وقت لطخة (الوقت الذي يغرق منصات الجهاز تجميد سوف تأتي معا)، والقوة (المسافة من منصات النشاف من الشبكة، والذي يغير التدرج من تشكيل الجليد) والمجموع (عدد المرات التي سوف تأتي منصات النشاف في لتلبية). اختر هذه المعلمات استنادا إلى جهاز تجميد الهبوط الفردي وسلوك الجزيئات الكلية. القيم النموذجية هي قوة لطخة بين 0 و 5 ، وقت لطخة من 1-6 ق ومجموع لطخة من 1. وقت الانتظار النموذجي (الوقت بين بدء لطخة، وبداية لطخة) واستنزاف الوقت (الوقت بعد النشاف قبل الغطس) هو 0-2 ق.
ملاحظة: اعتمادا على تفضيلات المستخدم، خيارات إضافية في الخيارات، يمكن تحديد المقطع المتنوعة، بما في ذلك استخدام دواسة القدم للانتقال إلى الخطوة التالية على كل الصحافة، تخطي نقل الشبكة (يتخطى الخطوة النهائية حيث يتم رفع ذراع ملاقط قليلا)، بدوره الرطوبة إيقاف أثناء العملية (في حين يتم تطبيق العينة، وتوقف الترطيب النشط للغرفة التي يمكن أن تجعل من الصعب رؤية الشبكة) وAutraise Ethanelift (يجمع بين خطوة من ملاقط التي أثيرت في الغرفة ورفع حاوية المبرد- يتخطى رفع خطوة حاوية الإيثان ). هنا، يتم تشغيل كل هذه الخيارات. - ضع حاوية المبرد بأمان على ذراع المنصة المتحركة تحت الغرفة
- أدخل ورق النشاف الطازج على كل ذراع لطخة للتأكد من تأمين مقاطع الحلقة البلاستيكية. كل ورقة تصفية تسمح 16 البقع (الأسلحة تدوير ورقة النشاف). اضغط على الزر إعادة تعيين ورقة لطخة في قسم عناصر التحكم .
- تشغيل 1 دورة كاملة من عملية تجميد جهاز الهبوط التزجيج لضمان أن كل جزء يتحرك يتصرف كما هو متوقع.
- اضغط (أو استخدم دواسة القدم) إلى وضع شبكة جديدة، ثم ابدأ العملية، ثم قم بمعالجة ثم متابعة. في هذه المرحلة، ومشاهدة لضمان الأسلحة النشاف هي الاتصال ببعضها البعض كما هو متوقع.
- تشغيل 'على' مرطب. وسيتم إنتاج بخار الماء (طالما أن الرطوبة مجموعة أعلى مما هو عليه حاليا في الغرفة).
- ويمكن الآن أن تهتز عينة من الاهتمام. استخدام دواسة القدم أو مكان الشبكة الجديدة وقضيب يغرق سوف ينزل من الغرفة السماح للملاقط أن تعلق في جبل.
- باستخدام ملاقط جهاز تجميد يغرق، والتقاط توهج المطلوب تفريغها / البلازما تنظيف شبكة cryoEM، مع الحرص على ملاحظة الجانب الذي هو الجانب الصحيح لاستخدامها لتطبيق عينة وفقا للشركة المصنعة للشبكة. التقاط الشبكة من الحافة، مع الحرص على تجنب الاتصال المفرط / غير الضرورية مع ملاقط لأن هذا سوف يضر الدعم. تأمين الشبكة في ملاقط عن طريق تحريك مقطع أسود وصولا الى الجزء متطاولة من ملاقط. الشبكة يحتاج إلى عقد بشكل آمن، ولكن مقطع لا ينبغي أن تكون بعيدة جدا إلى أسفل لأنها سوف تتصل منصات النشاف، مما يؤدي إلى النشاف لا يمكن دحضها، وبعد ذلك، سوف تحتاج إلى عقد ملاقط تحت هذه النقطة عند الإفراج عن مقطع.
- ضع ملاقط جهاز التجميد المغرقة التي تحمل شبكة cryoEM على الذراع الهوائية مع الجانب الصحيح الذي يواجه يدك المهيمنة. تصميم ملاقط جهاز تجميد يغرق وغرفة من هذا القبيل بحيث يمكن تطبيق العينة من خلال الجانب الأيمن أو الأيسر من الغرفة، وفقا تسليمه من المستخدم.
ملاحظة: تطبيق العينة على جوانب مختلفة مع معلمات النشاف نفسه نادرا ما يؤدي إلى نتائج مماثلة، لذلك قد يحتاج الباحثون الأعسر لضبط المعلمات النشاف بشكل مستقل عن زملائهم اليد اليمنى. - سيتم أخذ عملية بدء الضغط والشبكة الموجودة في الملاقط إلى الغرفة وسيتم رفع حاوية المبرد.
- اضغط على العملية والملاقط سوف تتحرك الشبكة إلى الموقف حيث يمكن استخدام ماصة لتطبيق العينة على الشبكة. افتح المنفذ الجانبي المواجه للجانب الصحيح من الشبكة وطبق العينة عن طريق الأنابيب ، مع التأكد من أن طرف ماصة لا يلمس الشبكة لأنه قد يؤدي إلى تلف دعم الشبكة / ثني الشبكة ، ولكن الاستغناء عن السائل قريبة بما فيه الكفاية بحيث يوزع قطرة على الشبكة. عادة، يتم تطبيق 3-5 ميكرولتر.
- اضغط على متابعة والمعلمات المحددة مسبقا للمستخدم سوف لطخة الشبكة ومن ثم يغرق ملاقط مع الشبكة التي شنت في كوب المبرد للتزجيج عينة. سوف تنزل الملاقط بالتزامن مع الذراع التي تحمل حاوية المبرد والمبرد ، مما يحافظ على الشبكة مغمورة في cryogen.
- نقل الشبكة من كأس cryogen إلى مربع تخزين الشبكة المغمورة في LN2.
- فصل ملاقط من الذراع ملاقط، مع الحرص الشديد على عدم الاتصال الشبكة vitrified مع الجانبين من كأس cryogen. ضبط قبضة بحيث يتم عقد ملاقط مريح. في أسرع وقت ممكن وبعناية، نقل الشبكة من cryogen إلى LN2. بيد واحدة، عقد ملاقط مغلقة باستخدام أصابعك ومع اليد الأخرى، الشريحة مقطع أسود صعودا للخروج من الطريق، وعقد ملاقط مغلقة. إعادة ضبط قبضة والتلاعب الشبكة في مربع تخزين الشبكة.
- كرر الخطوات 1.10-1.19 حتى يتم إجراء كافة الشبكات (جلسة عمل نموذجية سوف تتضمن إنشاء شبكات 4-12). تخزين كافة صناديق تخزين الشبكة التي تحتوي على شبكات في ديوار LN2 حتى المراحل التالية.
2. قص شبكات للتحميل في المجهر autoloader
- قص الشبكات في تجميع شبكة تلقائية وفقا للبروتوكول الموضح سابقا 28.
3. تأمين تسجيل الدخول عن بعد إلى المجاهر
ملاحظة: مع ضوابط COVID-19 في وقت كتابة هذا التقرير، ولكن أيضا مع المخاوف البيئية المرتبطة بالسفر الدولي، تم تقديم المزيد من مرافق المجهر الخدمات حيث يعمل المستخدم عن بعد. وستختلف طريقة تنفيذ هذا النظام وفقا لتكوين تكنولوجيا المعلومات المحلي لكل مرفق، واحتياجات مجتمع المستخدمين الداخلي والخارجي. هنا يتم وصف عملية الوصول عن بعد cryoEMs في eBIC والسيطرة على المجهر من خلال برامج وحدة معالجة الرسومات.
- تسجيل الدخول عن بعد إلى cryoEM. يتم التوسط تسجيل الدخول عن بعد عبر برنامج NoMachine للوصول إلى جهاز دعم المجهر ويتم تكوينه للسماح فقط بالوصول إلى المستخدمين المسجلين في زيارة عبر بيانات اعتماد تسجيل الدخول FedID للمستخدمين. يبقى الوصول نشطا فقط طوال مدة الجلسة.
- افتح NoMachine وابدأ اتصال NX جديد nx-cloud.diamond.ac.uk باستخدام مصادقة كلمة المرور.
- افتح الاتصال وسجل الدخول باستخدام اسم المستخدم fedid@fed.cclrc.ac.uk وكلمة مرور FedID. انقر نقرا مزدوجا فوق الرمز المطابق للمجهر ذي الصلة من الخيارات المتاحة لفتح اتصال بجهاز الدعم ذي الصلة.
- أدخل اسم المستخدم clrc\FedID وكلمة المرور في شاشة تسجيل دخول Windows.
- افتح برنامج TeamViewer من رمز سطح المكتب ثم اتصل ب PartnerID: TEM باستخدام كلمة المرور المتوفرة. هذا يؤسس الاتصال من دعم الكمبيوتر إلى جهاز الكمبيوتر TEM. يمكن استخدام زر "الشاشة التالية" في شريط TeamViewer للتبديل بين واجهة مستخدم المجهر ونافذة وحدة معالجة الرسومات.
- ويمكن بعد ذلك التحكم في وظائف المجهر من قبل المستخدمين مباشرة من خلال واجهة وحدة معالجة الرسومات.
4. تحميل العينات في المجهر autoloader وفحص الجليد ونوعية العينة
ملاحظة: في هذا القسم يتم استخدام المجهر مع برنامج التحميل التلقائي وEPU لفحص العينة، ولكن هذا يمكن تحقيقه باستخدام برامج أخرى ونظام دخول الجانب و cryoEMs من الشركات المصنعة الأخرى.
- تحميل الشبكات المقطوعة في محمل المجهر التلقائي كما هو موضح سابقا28.
- في علامة التبويب التحميل التلقائي لواجهة مستخدم المجهر، قم بعلامة التبويب حوار الخيارات باستخدام السهم واضغط على زر المخزون . سيؤدي ذلك إلى التحقق من كل موضع في الكاسيت بشكل تسلسلي لتحديد ما إذا كانت خرطوشة موجودة. سيتم وضع علامة على الفتحات المحتلة باللون الأزرق. إذا تم تعيين كافة الفتحات المحتلة، اضغط على زر المخزون مرة أخرى للتوقف بعد الموضع الحالي، وإلا اترك التشغيل حتى يتم تعيين كافة الفتحات المشغولة. تسمية كافة الفتحات المحتلة مع تفاصيل العينة في المربعات المقدمة.
- قم بتمييز الشبكة التي سيتم نقلها إلى عمود المجهر وانقر فوق تحميل. ستتحول تسمية الفتحة من اللون الأزرق إلى الأصفر بمجرد تحميل الشبكة بنجاح على المسرح. تابع لفحص الشبكات.
- افتح برنامج EPU. في صفحة التحضير ، حدد بصريات وإعدادات Acquisition ثم حدد الإعداد المسبق ل Atlas من القائمة المنسدلة. اختر إعدادات إعداد الحزمة المناسبة (على سبيل المثال، 64x mag الاسمية، حجم البقعة 5، Microprobe، مع منطقة مضيئة في النطاق الموازي للكشف عن فالكون - لمزيد من المعلومات اختيار الإعدادات المسبقة إعداد شعاع see28). اضغط على تعيين لدفع المعلمات إلى المجهر.
- اضغط على صمامات العمود المفتوحة وأدخل FluScreen. تأكد من أن شعاع مرئية وتنتشر بما فيه الكفاية وتركزت لتغطية الكاشف. إذا لزم الأمر، انتقل إلى منطقة أرق من الشبكة باستخدام عصا التحكم أو قائمة المرحلة للتحكم في حركات المرحلة في X و Y.
- ارفع FluScreen و التقاط صورة باستخدام زر المعاينة في وحدة معالجة الرسومات. استنادا إلى الصورة المكتسبة، يمكن زيادة الجرعة عن طريق الانتقال إلى حجم بقعة أقل، والعكس بالعكس.
- في وحدة معالجة الرسومات، انتقل إلى صفحة أطلس واضغط على جلسة جديدة. حدد تنسيق صورة MRC وأدخل اسم مجلد وموقع مناسب لحفظ جلسة الفحص، ثم انقر فوق تطبيق.
- حدد الفحص من القائمة على اليسار. ضع علامة على مربعات الاختيار بجوار كل شبكة للحصول على مونتاج أطلس. ابدأ جلسة الفحص في وحدة معالجة الرسومات EPU. وسيتم الحصول على أطلس لكل شبكة تم فحصها، مع إدراج عدد من مربعات الشبكة المتاحة عند الانتهاء. يمكن مشاهدة كل أطلس من خلال تسليط الضوء عليه على صفحة الفحص ، مع استكمال علامة المتابعة تظهر مربعات الشبكة مع سمك الجليد المتوقع مماثلة مجمعة حسب اللون.
- وعند الانتهاء من ذلك، استعرض الأطالس التي تم جمعها وحدد الشبكات المناسبة لتقييم جودة العينة في التكبيرات الأعلى (أي تلك التي بها عدد مناسب من مربعات الشبكة التي لا تجف ولا تحجبها جليد سميك). قم بتمييز الشبكة المختارة في قائمة فحص وحدة معالجة الرسومات وانقر فوق نموذج التحميل.
- استخدم إعدادات إعداد الحزم المسبقة (انظر 28 للحصول على شرح لإعداد الحزم المسبقة المطلوبة لكل مرحلة) ووظيفة المعاينة لفحص مربعات الشبكة المطلوبة بمزيد من التفصيل.
- من قائمة فحص أطلس، حدد الشبكة المحملة حاليا ونقل المرحلة إلى مربع شبكة تحتوي على ثقوب مملوءة عن طريق النقر بزر الماوس الأيمن فوق الموقع المطلوب على صورة الشبكة واختيار الانتقال إلى مربع الشبكة.
- العودة إلى وحدة معالجة الرسومات، إعداد الصفحة وحدد الإعداد المسبق GridSquare .
- افتح صفحة EPU و Auto Functions واركض Auto-eucentric حسب إمالة المرحلة باستخدام إعداد GridSquare المسبق لنقل العينة إلى الارتفاع متحد المركز.
ملاحظة: السيارات- eucentric بواسطة شعاع إمالة يتوفر أيضا، وهو أسرع ولكن عادة أقل دقة من السيارات eucentric بواسطة مرحلة الميل. - في وحدة معالجة الرسومات ، وإعداد ، واتخاذ GridSquare معاينة صورة جديدة. لاحظ القيم الرمادية المختلفة عبر ثقوب مختلفة تشير إلى اختلاف سماكة الجليد. نقل المرحلة فوق حفرة باستخدام انقر بزر الماوس الأيمن > مرحلة التحرك هنا. حدد الإعداد المسبق لثقب/ارتفاع مركز اليون المركزي والمعاينة.
ملاحظة: اعتمادا على الوزن الجزيئي وشكل جسيم الفائدة، قد يكون من الممكن التعرف عليه في التكبير ارتفاع حفرة / Eucentric. - حدد إعداد الحصول على البيانات مسبقا وتعيين تكبير يسمح بسهولة تحديد الجسيمات (المقابلة لأخذ عينات من الكائن بشكل عام <2 Å/pixel). تعيين إزاحة defocus إلى ~ -3 إلى -5 ميكرومتر مع جرعة إلكترون التعرض ~ 40-80 الإلكترونية / Å2.
- يكرر من خلال خطوات في 4.4 لتقييم مجموعة من سمك الجليد لتوزيع الجسيمات، والتوجه والتلوث عبر الشبكة. قد يختلف توزيع الجسيمات بالقرب من الحواف مقابل مركز الثقب ، وبالتالي من المهم مسح مواقع مختلفة مع الثقب.
- فحص جميع الشبكات التي تظهر الوعد من الأطالس وجود مربعات الشبكة كافية. إما الاحتفاظ بها في المجهر والمضي قدما في الحصول على البيانات باستخدام وحدة معالجة الرسومات، أو تفريغ العينات من المجهر وتخزينها تحت LN2 حتى يتم جدولة جمع البيانات.
5. جمع بيانات cryoEM جسيم واحد (مع التركيز على التشغيل عن بعد)
ملاحظة: يتم وصف بروتوكول مفصل للحصول على البيانات مع EPU في دليل الشركات المصنعة وwherewhere28. هنا يتم تسليط الضوء على تعديلات هذا البروتوكول للتشغيل عن بعد (أي الحد من استخدام لوحات اليد لإجراء المهام واستخدام البدائل القائمة على البرمجيات).
- ما لم يكن قد تم جمعها بالفعل خلال الدورة، وجمع أطلس للشبكة.
- تحديد كل من الإعدادات المسبقة إعداد شعاع وفقا للاحتياجات التجريبية للمشروع.
- إجراء معايرة إزاحة الصورة28.
- إعداد جلسة عمل وحدة معالجة الرسومات.
- في وحدة معالجة الرسومات، حدد صفحة EPU ثم إعداد الجلسة، وحدد جلسة عمل جديدة ثم جديدة من التفضيلات.
- حدد جلسة عمل جديدة ستظهر نافذة منبثقة توفر خيارا لاستخدام الإعدادات السابقة. نعم سيتم تلقائيا تحميل الإعدادات من EPU السابقة (أي، الناقل عينة، مجموعة defocus، إعدادات التركيز البؤري التلقائي، نوع الشبكة) في الدورة الحالية وحدة معالجة الرسومات. يتيح تحديد جديد من التفضيلات للمستخدم اختيار ملف مع التفضيلات المحفوظة (أي نطاق defocus وإعدادات التركيز البؤري التلقائي ونوع الشبكة) وسيتم تحميل هذه المعلومات مسبقا في وحدة معالجة الرسومات.
- ملء اسم الجلسة مع شيء مفيد. قد يقترح المرفق المحلي اصطلاح تسمية.
- في النوع، حدد يدوي.
- بالنسبة لوضع الامتلاك، حدد توسيط ثقب دقيق أو اكتساب أسرع.
- في تنسيق الصورة، حدد التنسيق المطلوب.
- حدد مجلد تخزين مناسب وستنشئ وحدة معالجة الرسومات دليلا باسم جلسة العمل.
- حدد حامل العينة المناسب وفقا لنوع الشبكة وتباعد الفتحات المستخدمة (على سبيل المثال، Quantifoil 1.2/1.3) واضغط على تطبيق. يصف هذا البروتوكول عملية إنشاء قالب لمجموعة منتظمة من الثقوب
- حدد مربع شبكة أولية ثم قم بتعيين قالب اكتساب.
- اختيار مربع الذهاب، إذا كانت جميع المربعات خضراء، انقر فوق إلغاء تحديد الكل في أعلى اليسار.
- فتح البلاط (انقر بزر الماوس الأيمن > فتح البلاط). حدد مربع (انقر بزر الماوس الأيمن > إضافة، انقر بزر الماوس الأيمن > نقل المرحلة إلى مربع الشبكة).
- انتقل إلى اختيار هول واضغط على السيارات Eucentric. انتظر حتى يكتمل هذا الأمر وتم التقاط صورة مربع الشبكة. إذا فشل الوظيفة التلقائية قد يكون هذا بسبب ارتفاع بشكل ملحوظ إيقاف; إذا كان الأمر كذلك يمكن تعديلها يدويا باستخدام FluScreen في ساحة الشبكة التكبير.
- قياس حجم الثقب. نقل وضبط الدوائر الصفراء بحيث تكون أكثر من الثقوب مع الحجم الصحيح والتباعد.
- اضغط على البحث عن ثقوب. تأكد من أن الثقوب قد تم العثور عليها بشكل صحيح. إن لم يكن تغيير حجم الثقب والعثور على ثقوب مرة أخرى. كرر هذا حتى يجد الثقب بشكل صحيح. إذا فشل باستمرار، فكر في الانتقال إلى حجم بقعة أقل (أكثر سطوعا) عند تكبير مربع الشبكة.
- استخدم مخطط تخطيطي جودة الثلج تصفية على اليمين لضبط تحديد ثقب. وهذا يمكن أن يكون مفيدا لاستبعاد المناطق ذات الجليد السميك والجليد الرقيق. سيتم تذكر هذا المربعات الشبكة المستقبلية المحددة أثناء هذه الجلسة.
- تحسين تحديد الفتحة باستخدام الأدوات الموجودة في قائمة تحديد في الأعلى. على سبيل المثال، انقر فوق إزالة الثقوب القريبة من شريط الشبكة.
- انتقل إلى تعريف القالب واضغط على اكتساب.
- انقر فوق البحث عن ثقب في الوسط. سيكون هناك الآن صورة لثقب مع دائرة صفراء حول الحفرة.
ملاحظة: إذا كان يكافح للعثور على ثقب، إدراج الفتحة الهدف. إذا كان لا يزال لا يمكن العثور على ثقب، حاول زيادة وقت التعرض لارتفاع حفرة / eucentric مسبقا أو زيادة defocus لهذا مسبقا أو بن الصورة. قد يغير تغيير كبير في defocus محاذاة إزاحة الصورة. - تغيير التأخير بعد مرحلة التحول والتأخير بعد أوقات نقل الصورة إلى 1-5 ق.
- تحقق من قيمة الحد الأقصى لإزاحة الصورة (إذا كان الخيار متاحا) كما هو مطلوب. إذا تم استخدام مجموعة shift صورة خالية انحراف يتم تعريف هذه القيمة في ملف تكوين EPU وإلا 5 ميكرومتر قيمة قياسية.
- انقر على إضافة منطقة اكتساب، ثم انقر فوق أي مكان على الصورة. نقل منطقة الاستحواذ إلى الموقع المطلوب (أي على حافة حفرة) بحيث لا تتعرض مناطق الاستحواذ بشكل مضاعف مع الشعاع (يمثل المربع في الدائرة الخضراء منطقة الكاشف ، والدائرة الخضراء هي قطر الحزمة).
- في أعلى اليمين، أضف نطاق defocus. ثم أضف مناطق الاستحواذ الأخرى. قائمة ديفوكوس نموذجية لمشروع بروتين الغشاء هو -0.8 إلى -3 ميكرومتر ديفوكوس.
- انقر فوق إضافة منطقة التركيز البؤري التلقائي وانقر فوق أي مكان على الصورة. حرك منطقة التركيز البؤري التلقائي إلى الكربون المحيط بالحفرة. الممارسة القياسية هي التركيز البؤري التلقائي بعد التركيز عند استخدام AFIS ، أو كل 5-15 ميكرومتر ، اعتمادا على تباين ارتفاع z عبر المربع.
- انقر فوق إضافة منطقة قياس الانجراف، قياس الانجراف التي أجريت مرة واحدة في مربع الشبكة، مع عتبة مجموعة من 0.05 نانومتر / ثانية هو إعداد قياسي. يمكن لمنطقة قياس الانجراف (وهي فكرة جيدة) التداخل مباشرة مع منطقة التركيز البؤري التلقائي. تأكد من عدم تداخل منطقة الانجراف أو التركيز البؤري التلقائي مع منطقة الامتلاك.
ملاحظة: يمكن التحقق من القالب باستخدام دالة تنفيذ القالب. هذه فكرة جيدة لمعرفة ما إذا كانت مناطق الاستحواذ تحتاج إلى التحرك (على سبيل المثال ، الكثير / ليس ما يكفي من الكربون في الصور) ، ولكنها ليست ضرورية. - العودة إلى مربع التحديد، وعلى الشبكة حدد المربعات لاكتساب. استخدام عدد مناطق الاستحواذ ومعدل الحصول المتوقع على البيانات (من المرفق القائم على أجهزة الكشف والتجريبية) للتنبؤ بعدد مناطق الاستحواذ المطلوبة.
- عند تحديد كافة المربعات المطلوبة، اضغط على إعداد كافة المربعات.
- بمجرد جمع كل مربع، انتقل بين مربعات الشبكة وصقل الثقوب باستخدام فرشاة التحديد.
- الانتقال إلى موقع مرحلة على عينة واستخدام وظائف السيارات لتعيين ارتفاع eucentric. قم بإجراء محاذاة المجهر كما هو موضح سابقا28، ولكن بدلا من إجراء محاذاة خالية من الغيبوبة وتصحيح الاستجماتيزم الموضوعي يدويا، استخدم أدوات المحاذاة داخل البرنامج. باختصار، تعيين شروط شعاع اقتناء، وضمان إزالة الفتحة الهدف (OA) ويتم وضع المرحلة على مساحة شعاع مستقرة من العينة في ارتفاع eucentric. قم بإجراء محاذاة خالية من الغيبوبة داخل الوظائف التلقائية قبل إعادة إدراج الزراعة العضوية وتوسيطها وتصحيح الاستجماتيزم الموضوعي للعدسة باستخدام وحدة معالجة الرسومات. تأكد من أن كلا التحالفات تتلاقى على القيم المناسبة (<150 نانومتر من الغيبوبة وقريبة من الاستجماتيزم صفر.
- قبل بدء تشغيل الاستحواذ التلقائي، تأكد من إيقاف تشغيل مضخة توربو التحميل التلقائي، ويتم إدراج الفتحة الهدف.
- في عملية الاستحواذ التلقائي، اضغط على تشغيل البدء لبدء الحصول الآلي على البيانات.
6. معالجة الصور لتسفر عن خريطة الكثافة EM
ملاحظة: توفر غالبية مرافق cryoEM المعالجة المسبقة لأفلام micrograph "على الطاير". هناك مجموعة واسعة من حزم البرامج والنهج المتاحة لهذا بما في ذلك خطوط أنابيب RELION28,33، cryoSPARC43، Scipion34 و WarpEM44. يتم وصف خط أنابيب RELION القائم هنا ويفترض أن المستخدم قد نقل أفلام micrograph إلى موقع تخزين مناسب مع الوصول إلى موارد الحوسبة. يتم توفير نظرة عامة على العملية والنتائج التمثيلية لمشروع بروتين الغشاء ، ويمكن الاطلاع على وصف مفصل والبرنامج التعليمي خطوة بخطوة على الصفحة الرئيسية RELION: https://www3.mrc-lmb.cam.ac.uk/relion.
- إجراء تحليل "على الطاير" لتصحيح حركة ميكروجراف وتقدير CTF. بدء RELION ضمن دليل المشروع. جدولة استيراد وتصحيح الحركة والمهام تقدير CTF حلقة بحيث تكون متزامنة مع جمع البيانات ونقلها. يوفر برنامج نصي لتحليل micrograph28 ملاحظات مرئية في الوقت الفعلي حول الاستجماتيزم وقيم defocus المقدرة (انظر النتائج التمثيلية).
- اختر جزيئات من مجهرات المعالجة مسبقا. هناك عدد من حزم برامج انتقاء الجسيمات الآلي للاختيار من بينها. تتوفر خيارات الانتقاء المرجعية المجانية والمستندة إلى القالب ضمن علامة التبويب الانتقاء التلقائي في RELION37. ويمكن استخدام برامج أخرى لخطوات مختلفة، على سبيل المثال باستخدام crYOLO لالتقاط الجسيمات35.
- استخراج الجسيمات من ميكروجرافات CTF تصحيحها.
ملاحظة: لتقليل الوقت الحسابي المطلوب لأوائل " تنظيف " خطوات المعالجة أو مقياس لأسفل/ بن الجسيمات عند الاستخراج. تفاصيل حول كيفية تشغيل استخراج المهمة يمكن العثور عليها في البرنامج التعليمي RELION 3.1. لهذا المشروع، تم في البداية جسيمات binned بعامل 2. - تنفيذ متوسط الفئة 2D. يعمل التصنيف عبر 100-200 فئة بشكل جيد بالنسبة لمعظم مجموعات البيانات التي تحتوي على 100,000 جسيم ≥. لا ينصح باستخدام أكثر من 200 فئة أو أقل من 50 فئة ، حتى عندما تكون مجموعات البيانات صغيرة ما لم تكن العينة ذات تماثل عال (أي فيروس icosahedral) وفي هذه الحالة قد لا يزال أقل من 50 فئة تعطي نتيجة جيدة. تعيين قطر القناع كبيرة بما يكفي لاستيعاب أطول بعد من الجسيمات، ولكن ضيق بما يكفي لاستبعاد أي جزيئات المجاورة (وهذا قد يتطلب بعض التجربة والخطأ).
- حدد الفئات الجيدة (أي تلك التي لها تفاصيل هيكلية) باستخدام وظيفة اختيار المجموعة الفرعية. يمكن العثور على أمثلة لمتوسطات الفئة 2D الجيدة والسيئة في قسم النتائج التمثيلية.
- إنشاء نموذج أولي من البيانات باستخدام وظيفة النموذج الأولي ثلاثي الأبعاد في RELION.
ملاحظة: قد تستفيد مداخن الجسيمات الأقل نظافة من صقل ab initio SGD متعدد المراجع (هبوط التدرج العشوائي) لأن هذا يوفر فرصة إضافية لغربلة الجسيمات غير المرغوب فيها / دون المستوى الأمثل. حدد قطر قناع يمكن أن يستوعب جسيم الاهتمام، واترك القيم الافتراضية للحقول في علامة التبويب "SGD" لأن هذه تؤدي بشكل روتيني بشكل جيد. تأكد من أن النموذج الأولي يبدو معقولا في Chimera (أو برنامج تصور مناسب آخر) (انظر النتائج التمثيلية). - إجراء تصنيف ثلاثي الأبعاد لمعالجة التغايرية في البيانات باستخدام الإخراج من الخطوة 6.6 كنموذج مرجعي. تقييم الخرائط الناتجة في كيميرا. معالجة مداخن الجسيمات المقابلة للدول تشكيلية فريدة من نوعها بشكل مستقل. استخدم مهمة تحديد المجموعة الفرعية لتحديد فئة/فئات ذات أهمية وإنشاء ملفات particles.star لمداخن الجسيمات المقترنة.
- تشغيل 3D لصناعة السيارات في الصقل. استخدم متوسطات الفئة ثلاثية الأبعاد التي تم الحصول عليها في الخطوة السابقة كمراجع لصقل أكوام الجسيمات المقابلة لها. إذا كان قرار الصقل يقترب من الحد Nyquist من البيانات ، وإعادة استخراج الجسيمات دون خفض التحجيم. بعد إعادة الاستخراج، كرر مهمة التحسين التلقائي ثلاثي الأبعاد مع مكدس الجسيمات غير الملزم. في هذه الحالة، يجب إعادة قياس النماذج المرجعية ثلاثية الأبعاد بحيث يكون حجم البكسل والمربع متسقين مع أحجام صور الجسيمات التي أعيد استخراجها. استخدم أداة سطر الأوامر relion_image_handler لتنفيذ هذه العملية.
- الاستفادة من التماثل في صقل إذا كان ذلك مناسبا. إذا كانت الخريطة المعاد بناؤها تمتلك تماثلا، قم بمحاذاة الخريطة على محور التناظر المناسب باستخدام أداة سطر الأوامر relion_align_symmetry. استخدم الخريطة المتوائمة الناتجة كمرجع في مهمة تحسين تلقائي ثلاثي الأبعاد جديدة مع عامل تشغيل التماثل المناسب المحدد في علامة التبويب المرجع.
- شحذ الخرائط من التحسين التلقائي ثلاثي الأبعاد. ويتم ذلك باستخدام وظيفة ما بعد المعالجة في RELION، ولكن أولا يجب إنشاء قناع مناسب من الخريطة المكررة. يتم تفصيل خطوات إنشاء القناع ومعالجة ما بعده في البرنامج التعليمي RELION (انظر أيضا النتائج التمثيلية).
ملاحظة: يمكن تحسين دقة العديد من عمليات إعادة الإعمار باستخدام وظائف التلميع البايزية وتحسين CTF في RELION. استخدم نوع وظيفة تحسين CTF لتقدير وتصحيح الانحرافات ذات الترتيب الأعلى (إمالة الحزمة وانحرافات التربة التريفية وانحرافات الترتيب الرابع ) وكوظائف منفصلة ، التكبير النظائري وdefocus لكل جسيم. بعد ذلك، استخدم مهمة التلميع بايزي (المدربين أو مع القيم الافتراضية) لمعالجة الحركة الناجمة عن شعاع على أساس كل جسيم. كما هو موجه في البرنامج التعليمي RELION 3.1 ، من المرجح أن تستفيد هذه الوظائف من نهج متكرر (CTF-refinement → تلميع بايزي → صقل تلقائي ثلاثي الأبعاد → → ما بعد المعالجة ... حلقة) منذ كل الاستفادة من نماذج أعلى دقة. - تصحيح تسليم خرائط الكثافة EM إذا لزم الأمر. فحص الخرائط لتحديد ما إذا كان تسليم صحيحة إما عن طريق محاولة لتناسب نموذج الذرية القائمة، أو تقييم تسليم المناطق ألفا حلية. عند الحاجة، قم بقلب الخريطة على طول المحور z في UCSF Chimera45 باستخدام الأمر "vop zflip".
النتائج
وعند الفحص، يمكن التخلص من الشبكات في مرحلة الأطلس، حيث تشير الميزات التي يتم حلها عند التكبير المنخفض إلى أن الشبكة غير مناسبة للحصول على البيانات. على سبيل المثال، إذا تعرضت الشبكة لأضرار ميكانيكية كبيرة مع كسر معظم مربعات الشبكة (الشكل 2A)، أو حيث تبدو الشبكة "جافة"، بدون جليد حيوي (الشكل 2B). يمكن تعريف هذه الشبكات عادة حيث تظهر حواف مربعات الشبكة حادة ومتميزة. عبر معظم الشبكات المصنوعة باستخدام جهاز تجميد الهبوط ، لوحظ تدرج من الجليد (الشكل 2C ، D). توزيع الجسيمات، اعتمادا على عينة من الفائدة، يمكن أن تختلف بشكل كبير مع سمك الجليد، وبالتالي يوصى بفحص مجموعة من المربعات الشبكة لتقييم توزيع الجسيمات. وقد نفذت أدوات في إطار برنامج الاتحاد البرلماني الدولي خلال خطوة فحص أطلس لمساعدة المستخدم على تحديد مربعات الشبكة ذات سمك الجليد المماثل أو المختلف، والتي يمكن أن تكون مفيدة بشكل خاص للمستخدمين الجدد في فحص شبكات cryoEM (الشكل 2E، F).

الشكل 2: مثال على المونتاج "أطلس" التكبير المنخفض من جلسات الفحص. أ) الشبكة التي عانت من أضرار كبيرة مع معظم المربعات الشبكة مكسورة - غير مناسبة لجمع. ب) شبكة جافة مع عدم وجود الجليد الزجاجي - غير مناسب لجمع. ج) شبكة تظهر تدرج الجليد مع ~ 50٪ من الشبكة صالحة للاستخدام. د) تدرج الجليد مع ~ 33٪ من الشبكة صالحة للاستعمال. كل من C و D، هي مناسبة لجمع البيانات إذا كانت مربعات الشبكة قابلة للاستخدام لديها سمك الجليد المناسبة لجمع، وهناك ما يكفي من مناطق الاستحواذ لتلبية الحد الأدنى لمدة جمع (على سبيل المثال، 24 ح) E) أطلس مثال مع مجموعة من سمك الجليد. F) نفس الأطلس المقدم في E ولكن مع، المربعات الشبكة تصنيفها والملونة من قبل برنامج EPU وفقا لسمك الجليد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
عند فحص توزيع الجسيمات، تأكد من أن معلمات التصوير، مثل التكبير والجرعة الإلكترون الكلية، مماثلة لتلك المتوقع استخدامها أثناء الحصول على البيانات من أجل تقديم صورة دقيقة عن النتائج المتوقعة. أثناء الفحص ، يكون توزيع الجسيمات المثالي أحادي التشتت مع مجموعة من اتجاهات الجسيمات المرئية (اعتمادا على العينة والمعرفة الحالية مورفولوجيا الجسيمات ، قد يكون من الصعب التأكد من ذلك) (الشكل 3A). يجب أن يكون الجليد رقيقا قدر الإمكان مع استيعاب الجسيمات أكبر بعد ، إذا كان الجليد رقيقا جدا ، فيمكن أن يذوب عندما يضيء بشعاع الإلكترون. وهذا يسبب الحركة المفرطة في ميكروجراف، وينبغي تجنب المناطق التي تعرض هذه الخاصية (الشكل 3B). من التجربة الجماعية ، لوحظ هذا التأثير الأكثر شيوعا عندما يكون هناك المنظفات في المخزن المؤقت. وهذا يمكن أن يؤدي إلى الجليد رقيقة جدا في وسط الحفرة وحتى الجسيمات يمكن استبعادها جسديا وإجبارها نحو الحافة. ويلاحظ هذا التأثير في الشكل 3C، ولكنه في هذه الحالة ليس مثالا متطرفا، وستظل هذه الصور تسهم بشكل مفيد في مجموعة البيانات. وأخيرا، يجب أن يكون الجليد زكيا؛ استبعاد أي مناطق من الشبكة (أو الشبكات) حيث تظهر معظم أو كل الصور الملتقطة الجليد البلوري (الشكل 3D) من الحصول على البيانات. في كثير من الأحيان ، لوحظ الجليد غير الزجاجي على حافة مربعات الشبكة. تتم إحالة القراء إلى مراجعات مفصلة للمتغيرات التي يمكن تغييرها أثناء تزجيج الشبكة16 وأوصاف سلوك الجسيمات في بيئة الفيلم الرقيق4647 لمزيد من المعلومات.

الشكل 3: صور دقيقة تمثيلية تبين توزيعات مختلفة للجسيمات. أ) توزيع "مثالي" للجسيمات أحادية التشتت التي تعتمد مجموعة من التوجهات. ب) الجليد رقيقة بشكل مفرط في منتصف الحفرة التي تشوه عند التعرض لشعاع الإلكترون مما تسبب في الحركة المفرطة في المجهر. ويلاحظ هذا التأثير في معظم الأحيان عندما المنظفات موجودة في العازلة C) حيث الجليد هو أرق في وسط الحفرة، وهذا يستبعد جسديا الجسيمات من المركز، مما تسبب في ازدحام الجسيمات نحو حافة الثقب. في هذه الحالة ، ليس متطرفا بما يكفي لمنع هذه الصور من أن تكون مفيدة ، ولكنها تشير إلى أنه يستحق الفحص مناطق أكثر سمكا قليلا. د) الجليد ليس الزجاجية، لا ينبغي جمع البيانات على المناطق التي تبدو مثل هذا المثال ميكروجراف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن أن تساعد معالجة الصور على الفور في التقاط الأخطاء والمشاكل المتعلقة بالحصول على البيانات ، لذا يوصى دائما حيثما أمكن ذلك. على سبيل المثال، قد تشير الحركة المفرطة داخل الصور الدقيقة إلى أن مضخة توربو التحميل التلقائي نشطة، أو يتم جمع البيانات على مربع شبكة متصدع حيث يتحرك الجليد بشكل كبير في شعاع الإلكترون، مما يشير إلى أنه يجب تخطي مربع الشبكة. على الطاير يمكن تقدير CTF تكشف عن الظروف التي يتم فيها تطبيق نقطة تركيز إيجابية (بدلا من defocus) (حيث يتم استخدام برامج تقدير CTF والمعلمات للعثور على هذه النقاط)، وتحديد التحول المرحلة حيث يتم استخدام لوحة مرحلة فولتا48. على خطوط أنابيب معالجة الصور تطير غالبا ما تشمل ملخص رسومية للبيانات (الشكل 4A) لتسهيل على المستخدمين لتقييم جودة micrograph بسرعة وتقرر ما إذا كانت هناك حاجة إلى تعديلات جمع البيانات.
اختيار الجسيمات من micrographs، في حين تجنب "إيجابيات كاذبة" مثل التلوث أو فيلم دعم الشبكة يمكن أن تتطلب التحسين. ومع ذلك ، فإن جامعي الجسيمات مثل crYOLO غالبا ما يعملون بشكل جيد بما فيه الكفاية باستخدام المعلمات الافتراضية ل "أول تمريرة" من البيانات (الشكل 4B) ، مما يتيح التقدم إلى متوسط الفئة 2D حيث يمكن أن يكون من الأسهل تقييم جودة البيانات واحتمال نجاح المصب. بالنسبة لمعظم المشاريع ، يجب أن يبدأ التصنيف 2D لجسيمات 10k > ~ في الكشف عن الفئات التي تحتوي على تفاصيل البنية الثانوية. للشروع في 3D، ينبغي أن تكشف مرحلة التصنيف 2D عادة الطبقات التي تمثل مجموعة من التوجهات الجسيمات. إذا تم الكشف عن اتجاه مفضل، قد يلزم إجراء المزيد من التكرارات لإعداد العينة16 أو الحصول على مزيد من البيانات مع إمالة العينة49. يجب اختيار جميع الفئات التي تظهر تفاصيل البنية الثانوية للمضي قدما في التحليل ثلاثي الأبعاد ، في حين يتم التخلص من الجسيمات "غير المرغوب فيها" (الشكل 4C).
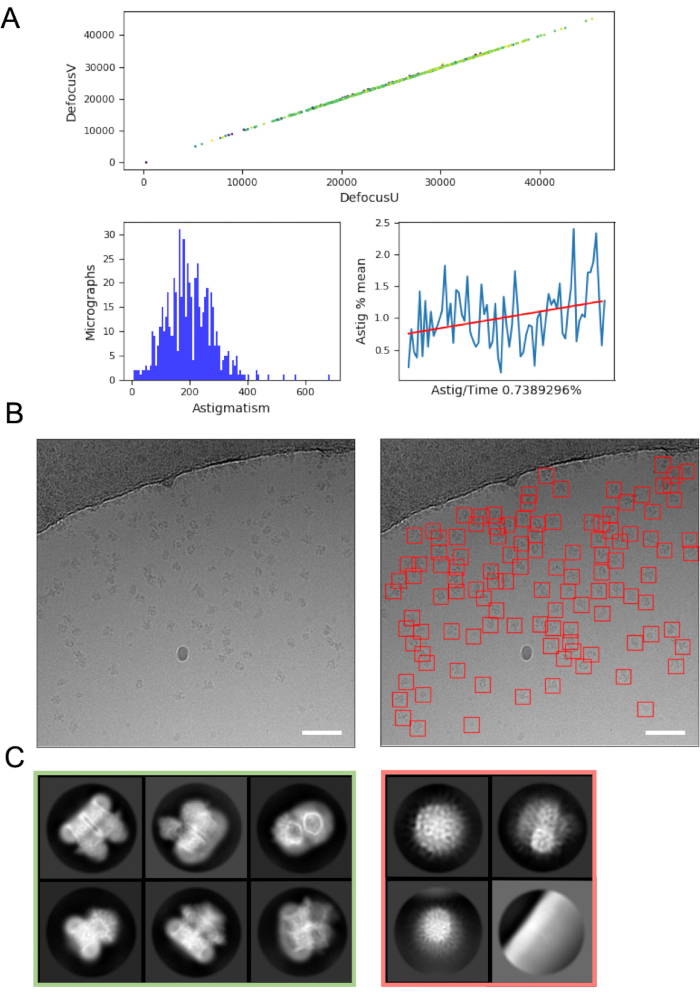
الشكل 4: خطوات معالجة الصور الأولية. أ) الإخراج من 'على الطاير' صورة معالجة السيناريو. ب) مثال ميكروجراف (يسار) مع الجسيمات التي تم انتقاؤها تلقائيا بشكل مناسب التي تم تحديدها باستخدام نموذج crYOLO العام (يمين، مع الجسيمات التي تحدها المربعات الحمراء) قضبان المقياس (أبيض) هي 50 نانومتر. ج) نتائج التصنيف 2D تبين الطبقات التي تم التخلص منها في المربع الأحمر، والفئات التي تم اختيار الجسيمات لمزيد من المعالجة باللون الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ويمكن استخدام مجموعة فرعية صغيرة من الجسيمات لتوليد نموذج أولي (الشكل 5A). ويمكن بعد ذلك استخدام هذا النموذج الأولي كنموذج بداية في التصنيف 3D والصقل. وفي حالة RagAB، تضمنت مجموعة البيانات ثلاثة مطابقين متميزين يمكن فصلهم أثناء التصنيف ثلاثي الأبعاد (الشكل 5B). ويمكن بعد ذلك معالجة الجسيمات المساهمة في كل فئة من هذه الفئات بشكل مستقل واستخدامها لصقل خريطة كثافة EM التي يمكن أن تخضع بعد ذلك لمزيد من التفسير وبناء النموذج.
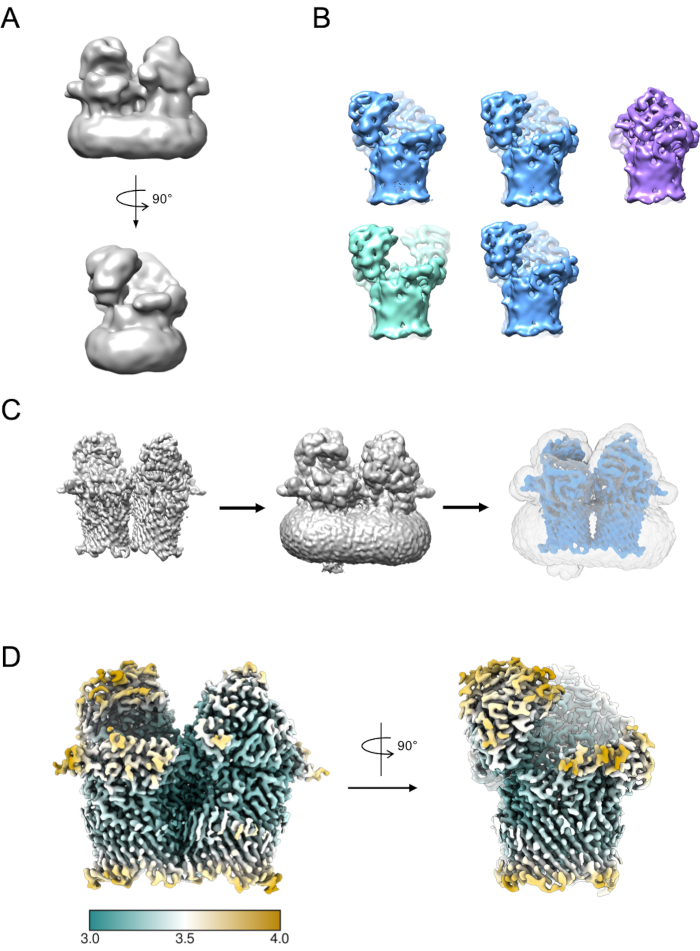
الشكل 5: إنشاء خريطة كثافة 3D EM. أ) نموذج نموذجي الأولية التي تم إنشاؤها باستخدام RELION. ب) تصنيف ثلاثي الأبعاد على 5 فئات تظهر فصل الجسيمات إلى ثلاث حالات تشكيلية متميزة: مفتوحة مفتوحة (خضراء)، مفتوحة مغلقة (زرقاء)، مغلقة مغلقة (أرجواني). ج) عملية إنشاء قناع. الخريطة من الصقل 3D (يسار) ينبغي تصور في الوهم. يمكن استخدام عارض الصوت بعد ذلك لتحديد الحد الأدنى الذي تكون الخريطة فيه خالية من الكثافة المفككة الصاخبة (في الوسط). يتم إدخال قيمة العتبة هذه ك عتبة ثنائية أولية في وظيفة إنشاء قناع RELION. يظهر إخراج قناع مثال باللون الرمادي (يمين). D) خريطة الكثافة EM عالية الدقة لحالة RagAB المفتوحة الإغلاق (EMD-10245)، التي تمت تصفيتها وتلوينها بالدقة المحلية (Å). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذا البروتوكول وصفنا خط أنابيب الأساسية المطبقة على العينات قابلة للروتين SPA. في حين أن هذه الطريقة ورقة تصفية النشاف من تشكيل فيلم رقيقة وتزجيج هو بلا شك ناجحة نظرا لاستخدامه في الغالبية العظمى من مشاريع SPA حتى الآن، فإنه يأتي مع عدد من العيوب. وتشمل هذه الهدر عينة، والجداول الزمنية بطيئة (ثانية) المطلوبة لتشكيل فيلم رقيقة وتجميد العينة، وذكرت عدم الحماية27 والآثار السلبية المبلغ عنها من استخدام ورقة تصفية لمسح بعيدا liquid50 الزائدة. وقد تم مؤخرا تطوير تكنولوجيات جديدة لتحسين إمكانية استنساخ إنتاج الأفلام الرقيقة51,52. وقد تم تطوير تكنولوجيات أخرى تقلل من الوقت بين تطبيق العينة والتزجيج53,54,55. في حين أن الأساليب الورقية المرشحة لتشكيل الأفلام الرقيقة لا تزال أكثر الطرق انتشارا لإعداد عينة CRYOEM SPA وقت كتابة هذا التقرير ، فإن هذه التقنيات الجديدة قد تجلب مجموعة من الفوائد من حيث الكفاءة وقابلية استنساخ تزجيج الشبكة ، بالإضافة إلى خلق فرص جديدة لجلب أبعاد تجريبية إضافية ، مثل حل الوقت والاختلاط السريع قبل التزجيج.
وعملية فحص الشبكة بالنسبة لمعظم المستعملين هي في الوقت الحاضر عملية نوعية تنطوي على اقتناء أطالس منخفضة التكبير يعقبها التقاط صور عالية التكبير عبر الشبكة لتقييم توزيع الجسيمات. في حين أن هذا هو نهج قوي بما فيه الكفاية لبعض أنواع العينة، يمكن أن يكون من الصعب تقييم بالعين إذا كانت العينة هي في الواقع ما يأمل الباحث في تصوير أو لديه اتجاه مفضل، على سبيل المثال مع عينات صغيرة (<200 kDa) أو حيث مورفولوجيا منخفضة الدقة يجعل من الصعب تحديد بالعين إذا كانت هناك مجموعة من توزيعات الجسيمات. وفيما يتعلق ببعض المشاريع، يستحيل تحديد ما إذا كانت العينة على النحو المطلوب، مثلا عندما يكون الرباط ملزما أو المكان الذي يجري فيه فحص العينة لتقييم ما إذا كانت وحدة فرعية صغيرة (مثل 10 كيلودا) لا تزال موجودة بالاقتران مع مجمع. بالنسبة لهذه المشاريع ، فإن خطوط الأنابيب المؤتمتة بالكامل لتحليل البيانات إلى جانب مجموعات "قصيرة" 0.5 - 1 ساعة ، يمكن أن تمضي قدما من خلال خطوات معالجة الصور إلى تصنيف 2D أو حتى التصنيف 3D والصقل من شأنه أن يساعد على تحديد ما إذا كان هناك ما يبرر جمع أطول. ولا تزال خطوط الأنابيب هذه قيد التطوير ولا تنفذ على نطاق واسع في الوقت الحاضر، ولكن لديها القدرة على تحسين كفاءة فحص شبكة التبريد، ولا سيما بالنسبة للعينات الصعبة.
وقد أدت التحسينات في أجهزة الكشف المباشر عن الإلكترونات، فضلا عن التعديلات في المجهر إلى جانب التقدم في معالجة الصور مثل جمع بيانات تحول الصور، إلى زيادة إنتاجية وجودة الصور التي يتم إنتاجها أثناء الحصول على البيانات. وهذه الزيادة في معدل البيانات التي يجري جمعها تسلط الضوء على الحاجة إلى إجراء فحص شامل لشبكات التبريد قبل الحصول على العديد من السل من البيانات.
أصبح CryoEM SPA تقنية بيولوجية هيكلية سائدة حقا ، وفي كثير من الحالات نهج "الذهاب إلى" لبعض فئات العينات ، مثل المجمعات الجزيئية الكلية غير المتجانسة والكبرية. في حين أن البروتوكول هنا يصف نظرة عامة أساسية على خط أنابيب SPA ، فإن كل قسم مغطى هنا (تزجيج الشبكة وفحصها ، cryoEM ومعالجة الصور) هو موضوع في حد ذاته ويستحق الاستكشاف أثناء تطوير مشروع SPA. ومع تقدم تقنيات إعداد العينات والفحص المجهري، وحداثة خوارزميات ونهج جديدة لمعالجة الصور، ستواصل وكالة الأنباء السعودية تطويرها كخطوط أنابيب، مما يساعد الباحثين في اكتساب نظرة ثاقبة على النظم البيولوجية المعقدة.
Disclosures
ولا يبلغ عن أي تضارب في المصالح.
Acknowledgements
وقد تم دعم هذا العمل من قبل iNEXT-Discovery (منحة 871037) الممولة من برنامج أفق 2020 للمفوضية الأوروبية. يتم تمويل J B. R. White من قبل صندوق ويلكوم الاستئماني (215064/Z/18/Z). تم تمويل مجاهر FEI Titan Krios من قبل جامعة ليدز (جائزة UoL ABSL) و Wellcome Trust (108466/Z/15/Z). نشكر M Iadanza على استخدام نص تحليله ميكروجراف. نحن نعترف بمصدر ضوء الماس للوصول إلى مرافق cryo-EM ودعمها في مركز التصوير الحيوي الإلكتروني الوطني في المملكة المتحدة (eBIC) الممول من صندوق ويلكوم الاستئماني وMRC وBBRSC.
Materials
| Name | Company | Catalog Number | Comments |
| Blunt tweezers | Agar Scientific | AGT5022 | |
| Cryo EM round storage box | Agar Scientific | AGG3736 | |
| CryoEM autogrid boxes | ThermoFisher Scientific | 1084591 | |
| CryoEM grids | Quantifoil | N1-C14nCu30-01 | |
| Ethane gas | Boc | 270595-F | |
| LN2 foam dewar | Agar Scientific | AG81760-500 | |
| LN2 storage dewar | Worthington industries | HC 34 | |
| Pipette | Gilson | 10082012 | |
| Pipette tips | Star labs | s1111-1706 | |
| Syringe | BD | BD 300869 | |
| Type II lab water | Suez | select fusion | |
| Vitrobot | ThermoFisher Scientific | 1086439 | |
| Vitrobot filter paper | Whatman | 1001-055 | |
| Vitrobot styrophome container assembly | ThermoFisher Scientific | 1086439 | |
| Vitrobot tweesers | ThermoFisher Scientific | 72882-D | |
| Software | |||
| EPU | ThermoFisher Scientific | 2.8.1.10REL | |
| TEM server | ThermoFisher Scientific | 6.15.3.22415REL | |
| Tia | ThermoFisher Scientific | 5.0.0.2896REL | |
| Titan krios microscope | ThermoFisher Scientific | Titan Krios G2 |
References
- Kuehlbrandt, W. The Resolution Revolution. Science. 343 (6178), 1443-1444 (2014).
- McMullan, G., Faruqi, A. R., Henderson, R. Direct Electron Detectors. Methods in Enzymology. , (2016).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: the nuts and bolts. Current Opinion in Structural Biology. , (2017).
- Lyumkis, D. Challenges and opportunities in cryo-EM single-particle analysis. Journal of Biological Chemistry. , (2019).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. , (2020).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. , (2020).
- Conley, M. J., et al. Calicivirus VP2 forms a portal-like assembly following receptor engagement. Nature. 565 (7739), 377-381 (2019).
- Hesketh, E. L., et al. The 3.3 Å structure of a plant geminivirus using cryo-EM. Nature communications. 9 (1), 2369 (2018).
- Malone, L. A., et al. Cryo-EM structure of the spinach cytochrome b6 f complex at 3.6 A resolution. Nature. 575 (7783), 535-539 (2019).
- Madej, M., et al. Structural and functional insights into oligopeptide acquisition by the RagAB transporter from Porphyromonas gingivalis. Nature Microbiology. , (2020).
- Gallardo, R., et al. Fibril structures of diabetes-related amylin variants reveal a basis for surface-templated assembly. Nature Structural and Molecular Biology. , (2020).
- Scarff, C., et al. Structure of the shutdown state of myosin-2. Nature. , (2020).
- Scarff, C. A., et al. Structure of the protective nematode protease complex H-gal-GP and its conservation across roundworm parasites. PLoS Pathogens. 16 (4), 1008465 (2020).
- Wu, M., Lander, G. C. How low can we go? Structure determination of small biological complexes using single-particle cryo-EM. Current Opinion in Structural Biology. , (2020).
- Khoshouei, M., Radjainia, M., Baumeister, W., Danev, R. Cryo-EM structure of haemoglobin at 3.2 Å determined with the Volta phase plate. Nature Communications. , (2017).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta crystallographica. Section D, Structural biology. 74, 560-571 (2018).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadanza, M. G. Variations on negative stain electron microscopy methods: tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biological procedures online. 6, 23-34 (2004).
- Baker, L. A., Rubinstein, J. L. Radiation Damage in Electron Cryomicroscopy. Methods in enzymology. 481, 371-388 (2010).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (02), 129-228 (1988).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in enzymology. 579, 51-86 (2016).
- Carragher, B., et al. Current outcomes when optimizing ‘standard’ sample preparation for single-particle cryo-EM. Journal of Microscopy. , (2019).
- Naydenova, K., Jia, P., Russo, C. J. Cryo-EM with sub-1 Å specimen movement. Science. , (2020).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in Enzymology. , (2016).
- Thompson, R. F., Iadanza, M. G., Hesketh, E. L., Rawson, S., Ranson, N. A. Collection, pre-processing and on-the-fly analysis of data for high-resolution, single-particle cryo-electron microscopy. Nature protocols. 14 (1), 100-118 (2019).
- Suloway, C., et al. Automated molecular microscopy: the new Leginon system. Journal of Structural Biology. 151 (1), 41-60 (2005).
- Zhang, J., et al. JADAS: A customizable automated data acquisition system and its application to ice-embedded single particles. Journal of Structural Biology. , (2009).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. , (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. , (2019).
- Fernandez-Leiro, R., Scheres, S. H. W. A pipeline approach to single-particle processing in RELION. Acta crystallographica. Section D, Structural biology. 73, 496-502 (2017).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. , (2018).
- Wagner, T., et al. SPHIRE-crYOLO is a fast and accurate fully automated particle picker for cryo-EM. Communications biology. 2 (1), 213-218 (2019).
- Bepler, T., et al. TOPAZ: A Positive-Unlabeled Convolutional Neural Network CryoEM Particle Picker that can Pick Any Size and Shape Particle. Microscopy and Microanalysis. , (2019).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 163 (2018).
- Zivanov, J., Nakane, T., Scheres, S. H. W. A Bayesian approach to beam-induced motion correction in cryo-EM single-particle analysis. IUCrJ. , (2019).
- Cianfrocco, M. A., Kellogg, E. H. What Could Go Wrong? A Practical Guide to Single-Particle Cryo-EM: From Biochemistry to Atomic Models. Journal of Chemical Information and Modeling. , (2020).
- Tagari, M., Newman, R., Chagoyen, M., Carazo, J. M., Henrick, K. New electron microscopy database and deposition system. Trends in Biochemical Sciences. , (2002).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: A public archive for raw electron microscopy image data. Nature Methods. , (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. , (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. , (2019).
- Goddard, T. D., et al. UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Protein Science. 27 (1), 14-25 (2018).
- Klebl, D. P., et al. Need for Speed: Examining Protein Behavior during CryoEM Grid Preparation at Different Timescales. Structure. , (2020).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 32 (2018).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proceedings of the National Academy of Sciences. , (2014).
- Zi Tan, Y., et al. Addressing preferred specimen orientation in single-particle cryo-EMthrough tilting. Nature Methods. , (2017).
- Armstrong, M., Han, B. -. G., Gomez, S., Turner, J., Fletcher, D. A., Glaeser, R. M. Microscale Fluid Behavior during Cryo-EM Sample Blotting. Biophysical Journal. 118 (3), 708-719 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. , (2017).
- Dandey, V. P., et al. Spotiton: New Features and Applications. Journal of Structural Biology. , (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta crystallographica. Section D, Structural biology. 75, 1063-1070 (2019).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. bioRxiv. , (2020).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: From sprays to jets and back. Acta Crystallographica Section D: Structural Biology. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved