Method Article
单颗粒冷冻电子显微镜:从样品到结构
摘要
使用冷冻电镜测定大分子复合物的结构已成为某些类别的蛋白质和复合物的常规。在这里,总结了该管道(样品制备,筛选,数据采集和处理),并将读者引导到更多详细的资源和变量,这些资源和变量在更具挑战性的标本的情况下可能会被改变。
摘要
冷冻电子显微镜(cryoEM)是一种通过单颗粒分析(SPA)测定大分子复合物结构的强大技术。整个过程包括i)在冷冻EM网格上支撑的薄膜中对标本进行玻璃化;ii)筛选标本以评估颗粒分布和冰质;iii)如果网格合适,收集单个粒子数据集进行分析;和iv)图像处理以产生EM密度图。在此协议中,提供了每个步骤的概述,重点介绍了用户可以在工作流期间修改的变量以及常见问题的故障排除。随着远程显微镜操作成为许多设施的标准,将描述成像方案的变化,以帮助用户在物理访问显微镜受到限制时进行高效操作和成像。
引言
单颗粒冷冻机电镜
为了在分子水平上研究生命,我们必须了解结构。有许多技术可用于探测蛋白质结构,例如NMR,X射线晶体学,质谱法和电子显微镜(EM)。迄今为止,沉积到蛋白质数据库(PDB)的大多数结构已经使用X射线晶体学进行了解析。然而,从2012年左右开始,冷冻电子显微镜(cryoEM)成为蛋白质结构测定的主流技术,其使用量急剧增加。存入电子显微镜数据库(EMDB)的EM图谱总数(截至2020年12月)为13,421张,而2012年为1,566张(图1,www.ebi.co.uk)。2012年,沉积到PDB的冷冻EM密度图中建模的原子坐标数量仅为67个,但截至2020年12月,到目前为止,已经沉积了2,309个结构,增加了35倍。所生产的冷冻EM密度图的质量和数量的潜在增长,有时被称为"分辨率革命"1,是由多个领域的进步共同引起的:开发称为直接电子探测器的新型成像相机;新软件;和更稳定的显微镜2,3,4。
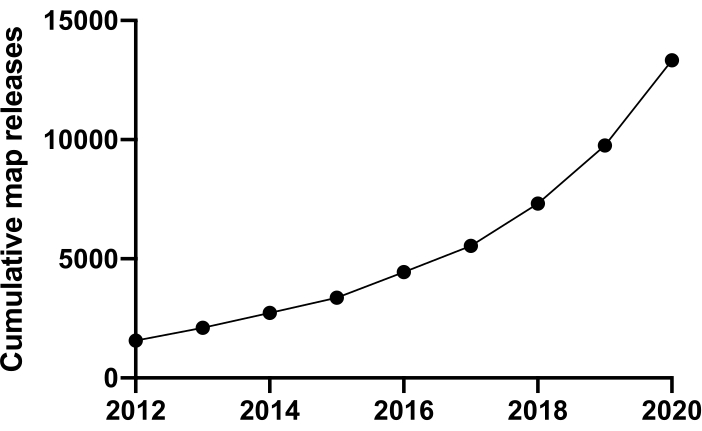
图 1:从 2012 年到 2020 年 12 月向 EMDB 提交的累计申请。请单击此处查看此图的大图。
单颗粒分析(SPA)是一种强大的工具,通过阐明分离复合物的高分辨率结构5,6(包括病毒7,8,膜蛋白9,10,螺旋组装体11和其他动态和异质大分子复合物12,13)来生成各种样品类型的生物学见解,其大小因数量级而异(从39 kDa开始)14,15到数十兆达尔顿)。这里描述了从样品到结构的冷冻EM SPA标准管道的协议。
在开始使用该管道之前,应对纯化的样品进行生化分析,以评估其下游成功的机会。制备合适的样品可以说是SPA的最大障碍,特别是对于瞬态和非均质(组合和构象)复合物。大分子复合物制备应包含尽可能少的污染物,浓度足以在每个冷冻EM显微照片中产生许多颗粒,并且非常适合冷冻EM分析的缓冲液成分。某些缓冲液成分,包括蔗糖、甘油和高(~>350 mM浓度的盐,取决于样品大小、性质和其他缓冲液成分)会干扰玻璃化过程或降低图像中的信噪比,阻碍结构测定16。
通常,作为最小尺寸排阻色谱(SEC)和SDS-PAGE凝胶分析,应用于评估样品纯度17,18,但圆二色性,功能测定,SEC结合多角度光散射和热稳定性测定都是在冷冻EM分析之前对大分子复合物制剂进行定性分析的有用工具。然而,这些生化分析的结果可能无法深入了解样品的结构异质性及其在冷冻电磁网格上的行为。因此,阴性染色剂EM通常被用作评估成分和构象异质性的快速,廉价和强大的工具,因此是确定纯化中哪种洗脱部分最有希望或筛选不同缓冲液成分的好方法19,20。一旦确定了有希望的样品,我们就可以进入SPA冷冻EM管道。阴性染色并不总是与冷冻EM中看到的后续结果一致;有时样品的阴性染色看起来很差,但在冷冻EM的玻璃体冰中看到时会有所改善。相比之下,有时样品在阴性染色步骤中看起来非常出色,但在进入冷冻EM时需要进一步优化。然而,在大多数情况下,阴性染色提供了一个有用的质量控制步骤。
玻璃化
电子显微镜真空系统内的恶劣环境会对未固定的生物标本造成脱水和辐射损伤21。因此,要以类似天然的状态对样品进行成像,必须在成像之前保存生物标本。对于大分子复合物的纯化制备,玻璃化是首选的方法,可以通过冷冻电镜进行可视化,同时保留复合物的原子细节。玻璃化作为样品制备方法的发现是生物标本电子显微镜的根本进步,Dubochet因此获得了2017年诺贝尔化学奖。样品玻璃化涉及创建一层薄薄的溶液,其中包含目标样品,通常为数十nm厚,悬浮在冷冻EM网格支撑上。然后将薄膜在~-175°C的冷冻剂(如液体乙烷)中极快地冷冻。 冷冻速率约为106 °C / s,足够快,形成无定形或玻璃体冰,将试样悬浮在薄的固体薄膜中22。
要考虑的初始变量是选择的 cryoEM 网格支持23。EM网格通常由支撑结构上带有穿孔(规则或不规则)的无定形碳膜组成。支撑结构通常是直径为3.05 mm的圆形金属网格,通常由铜制成,但可以使用其他金属,例如金或钼(具有优选的热膨胀性能24)。有时,在网格上施加额外的薄,连续支撑,例如石墨烯,氧化石墨烯或薄(~1-2nm)无定形碳层。虽然标准冷冻EM网格(最常见的是400-200目铜,穿孔(1.2μm圆孔,间隔1.3μm(r1.2 / 1.3),或2μm,由2μm碳(r2 / 2))碳载体隔开 - 尽管迄今为止有许多不同的模式可用)已被用于绝大多数结构中,但据报道,具有改进的导电性和减少试样运动的新型网格技术25.选定的网格经过辉光放电/等离子体清洗处理,使其具有亲水性并适合样品应用26。
在辉光放电之后,下一阶段是薄膜形成。这种薄膜通常使用滤纸从网格中去除多余的液体而形成。虽然这可以手动进行,但市面上有许多小型冷冻设备,包括Vitrobot Mk IV(赛默飞世尔科技),EM GP II(徕卡)和CP3(Gatan)。使用这些设备,将约3-5μL溶液中的样品施加到EM网格上,然后使用滤纸吸走多余的溶液。网格上悬挂着一层薄膜,然后插入液态乙烷中,由液氮(LN2)冷却至~-175°C。 一旦冻结,网格在成像之前和成像期间保持在低于失活点(-137°C)的温度。
标本筛选和数据收集
在冷冻EM网格的玻璃化之后,下一阶段是筛选网格以评估其质量并确定网格是否适合进行高分辨率数据收集。理想的冷冻EM网格具有玻璃体冰(与结晶冰相反),其冰厚度刚好足以容纳样品的最长尺寸,确保周围的冰对生成的图像产生尽可能少的噪声。冰中的颗粒应具有与生物化学一致的大小和(如果已知)形状,理想情况下是单分散的,具有随机分布的颗粒取向。最后,网格应具有足够质量的面积,以满足所需的数据收集长度。根据样品的不同,这可能需要多次玻璃化和筛选,直到产生最佳网格。幸运的是,不幸的是,有一大范围的变量可以通过经验测试来改变冷冻EM网格上的粒子分布(在16,27中回顾)。在这份手稿中,显示了膜蛋白项目10 的代表性结果。
一旦确定了合适的网格,就可以继续进行数据收集。用于生物标本的几种型号的低温透射电子显微镜经过优化,可以自动收集高分辨率数据。通常,数据在 300 kV 或 200 kV 系统上收集。使用包括EPU(赛默飞世尔科技)28、Leginon29、JADAS30和SerialEM31,32在内的软件可以实现自动数据收集。使用现代探测器自动收集数据通常会在 24 小时内产生 TB 的原始数据(平均数据集大小约为 4 TB)。
由于世界大部分地区(撰写本文的时间为2020年12月)实施了COVID-19限制,许多显微镜设施已转向提供远程访问。一旦网格被加载到显微镜的自动加载器中,就可以远程进行数据采集。
图像处理和模型构建
如果数据收集会话通常为 0.5-4 天,则后续图像处理可能需要数周和数月,具体取决于计算资源的可用性。它是初始图像处理步骤的标准,即运动校正和对比度传递函数(CTF)估计"动态"进行33,34。对于下游处理,有大量的软件套件可用。颗粒被"拾取"并从显微照片中提取35,36。一旦颗粒被提取,标准协议将是通过几轮分类(在二维(2D)和三维(3D)和/或专注于感兴趣的特定区域)来处理颗粒,以达到均匀的颗粒子集。然后将这些均匀的粒子子集平均在一起以产生3D重建。此时,通常会进一步校正数据以生成最高质量的地图,例如通过CTF细化,失真校正37和贝叶斯抛光38。该图像处理的结果是感兴趣生物标本的3D冷冻EM图。在"标准"自动单颗粒实验中,从足够质量的网格中达到的分辨率范围,在300 kV显微镜系统上收集的数据通常在10 Å和2 Å之间,具体取决于蛋白质复合物的大小和灵活性。对于理想的试样,使用SPA工作流程,现在已经达到了~1.2 Å的分辨率5。虽然该协议详细介绍了获得EM密度图的步骤,但一旦掌握了这些步骤,就可以通过拟合和优化蛋白质模型(如果分辨率为<3.5 Å)或构建de novo39来进一步解释。与结构测定实验相关的数据可以存入在线公共存储库,包括EM密度图(电子显微镜数据库)40,由此产生的原子坐标(蛋白质数据库)41和原始数据集(电子显微镜公共图像档案)42。
在该协议中,来自牙 龈卟啉单胞菌的 外膜蛋白复合物RagAB(~340 kDa)被用作大分子复合物10 (EMPIAR-10543)的示例。对于那些刚接触 cryoEM 的人来说,可以通过 iNEXT Discovery 和 Instruct 等资助访问计划,通过这种管道从样品到结构来支持样品,但需经过同行评审。
研究方案
1. 网格玻化
注意:对于步骤 1 和 2 中的所有步骤,请确保所有工具在冷却到 LN2 温度之前都处于清洁、干燥和室温下,使用新鲜醒注的 LN2 来减少冰污染。在可能的情况下,在相对湿度<20%的湿度控制环境中工作。在开始工作之前,请确保适当的个人防护装备和H&S文件到位。
- 确保感兴趣的样品已准备好进行样品制备。
- 选择合适的冷冻EM网格,并确保这些网格使用辉光放电或等离子体处理使其具有亲水性。有各种各样的系统和协议的变体,但都涉及将网格放入辉光放电/等离子体清洁系统,并运行一个程序,将腔室泵送到所需的真空水平,然后将特定的气体混合物/化学蒸气或空气引入系统。电流通过系统,电离气体颗粒并诱导电网表面变得更亲水。
- 使用背面的电源开关打开系统,启动用于电网玻璃化的骤降冷冻装置,然后等待触摸屏加载。
- 使用提供的手写笔或手指,在 控制台中设置腔室的所需工作温度(可用范围为4-60°C,建议大多数大分子4-6°C)。
- 使用注射器,通过加湿器底部的橡胶管,用 50 mL II 型实验室水填充加湿器。确保在填充前清除注射器中的任何滞留空气。注意不要加湿器溢出,否则水会渗入腔室。加湿器装满后,将注射器柱塞拉回5-10 mL以形成真空密封。
- 在 控制台中,设置腔室所需的相对湿度(可用范围为 0-100%,通常使用 95-100% 的湿度)。将湿度设置为"关闭",直到在网格形成之前立即,以便腔室不会变得太湿。
- 将切成正确尺寸的切入式冷冻装置镊子和滤纸,以适合垫子,无论是购买还是使用邮票切割适当尺寸的孔径。
- 准备冷冻剂以进行骤降冷冻。
- 将金属冷冻格栅盒支架、冷冻剂杯和金属蜘蛛腿放入冷却液容器中。
- 通过用LN2填充外腔来冷却容器。保持外腔顶部覆盖冷冻网格盒支架的顶部。向冷冻剂杯中加入约1厘米的额外LN2 ,以帮助系统平衡至LN2 温度。
注:防污染环可用于限制低温剂杯周围的潮湿空气冷凝,并导致冷冻冷却液/乙烷污染。在湿度受控的环境中,通常不需要这样做。如果使用防污染环,请注意不要用LN2 过度填充容器,否则在该过程的后期将环压入容器中时可能会溢出。 - 等待3-5分钟观察蜘蛛腿的沸腾,然后再等待3分钟,以确保冷冻剂杯足够冷以冷凝玻璃化介质。
- 将冷冻剂(液体乙烷)液化到冷冻剂杯中。
- 取带有细管和喷嘴的乙烷气缸管来分配气体。P200移液器吸头,其孔径通过使用剃须刀片切掉尖端而打开,是理想的选择。需要更宽的孔径来防止乙烷在尖端固化并阻塞气体流动。
- 确保低温剂杯不含任何残留的LN2,取乙烷气体喷嘴并将其放入冷冻剂杯中。使用气瓶调节器,启动低流量并将冷冻剂气体分配到冷冻剂杯中以冷凝气体。保持气体流动的尖端直接压在冷冻剂杯壁上,但轻轻地来回移动,以对表面的敲击运动。调节气体的流量,使低而稳定的流量开始在低温剂杯内以受控的方式冷凝/液化。
- 将杯子填充到银蜘蛛边缘的正下方并停止气体流动,然后小心地取出气体管路,以避免乙烷污染周围的LN2 。
- 用LN2填充冷却剂容器,非常小心不要将任何液体乙烷溅入液体乙烷中。
- 将蜘蛛腿保持在适当的位置约3-5分钟,以确保液体乙烷平衡到足够冷的温度。冷冻剂将开始看起来浑浊/略微不透明。这表明它已接近其冰点。在此阶段,使用镊子去除蜘蛛。只要将LN2 保存在冷冻剂杯周围的容器内,乙烷现在将保持液化状态,适合玻璃化1-2小时。但是,要尽快完成该过程,特别是在非湿度控制的房间中,以减少冰污染。
注意:如果蜘蛛看起来"卡住了",请使用金属物体(如螺母)并固定在蜘蛛的腿上以稍微加热它们,然后取下腿。
- 准备用于样品玻璃化的小型冷冻装置和附件。
- 将网格存储盒添加到金属冷冻网格盒支架中,并在整个过程中确保将LN2 保持在网格盒的正上方(通常每〜5分钟一次)。
- 在陷入式冷冻装置屏幕上,在 "工艺参数 "框中输入所选参数,包括:印迹时间(熔断冻结装置垫将聚集在一起的时间)、力(印迹垫与网格的距离,这会改变结冰的梯度)和总计(印迹垫进入以满足的次数)。根据单个沉降冷冻装置和大分子的行为选择这些参数。典型值为 0 到 5 之间的印迹力、1-6 秒的印迹时间和总印迹 1。典型的等待时间(起始印迹和印迹开始之间的时间)和排水时间(印迹后插入前的时间)为 0-2 秒。
注意:根据用户偏好,可以选择 "选项,杂项" 部分中的其他选项,包括 使用脚踏板 在每次按下时移动到下一步, 跳过网格传输 (跳过镊子臂略微升高的最后一步), 在过程中关闭湿度 (在施加样品时,停止腔室的主动加湿,这可能使看到网格变得更加困难)和 自动提升乙烷提升 (结合镊子升入腔室和提升冷却液容器的步骤 - 跳过 提高乙烷容器 步骤)。在这里,所有这些选项都处于打开状态。 - 将冷却液容器牢固地放在腔室下方的移动平台臂上
- 将新鲜的吸墨纸插入每个吸墨臂上,确保塑料环夹固定。每张滤纸允许16个印迹(手臂旋转转印纸)。按"控制"部分中的"重置印迹纸张"按钮。
- 运行 1 个完整周期的小型冷冻装置玻璃化过程,以确保每个活动部件的行为符合预期。
- 按(或使用脚踏板)放置新网格,然后开始处理,然后处理,然后继续。在此阶段,请注意确保印迹臂按预期相互接触。
- 打开"打开"加湿器。将产生水蒸气(只要设定的湿度高于当前腔室中的湿度)。
- 感兴趣的标本现在可以被玻璃化。使用脚踏板或 放置新网格 ,插入杆将下降出腔室,允许镊子连接到支架中。
- 使用陷入式冷冻装置镊子,拾取所需的辉光放电/等离子体清洁的冷冻EM网格,注意根据网格制造商,哪一侧是用于样品应用的正确一侧。通过轮辋拾取网格,注意避免与镊子过度/不必要的接触,因为这会损坏支撑。通过将黑色夹子向下移动到镊子的脊状部分,将网格固定在镊子中。网格需要牢固地固定,但夹子不应太低,因为它会接触到吸墨垫,导致不可重复的印迹,并且以后,在释放夹子时,镊子需要保持在该点以下。
- 将保持冷冻EM网格的小型冷冻装置镊子放在气动臂上,其正确的一侧朝向惯用手。切入式冷冻装置镊子和腔室的设计使得样品可以根据用户的手性通过腔室的右侧或左侧施加。
注意:将样品应用于具有相同印迹参数的不同侧面很少会产生可比的结果,因此左撇子研究人员可能需要独立于右撇子同事调整其印迹参数。 - 按 启动过程 ,镊子中的网格将被带入腔室,冷却液容器将被抬起。
- 按 工艺 和镊子将网格移动到可以使用移液器将试样施加到网格的位置。打开面向网格正确一侧的侧端口,并通过移液来施加样品,确保移液器吸头不会接触网格,因为它可能导致网格支撑损坏/弯曲网格,但要将液体分配得足够近,以便液滴分配到网格上。通常,应用3-5μL。
- 按 "继续" ,用户预定义的参数将擦拭网格,然后将安装有网格的镊子插入冷却液杯中进行样品玻璃化。镊子将与容纳冷却剂容器和冷却剂的臂一起下降,使网格浸没在冷冻剂中。
- 将网格从冷冻剂杯转移到浸没在LN2中的网格存储盒。
- 将镊子从镊子臂上拆下,非常小心不要将玻璃化的网格与冷冻剂杯的侧面接触。调整手柄,使镊子握持舒适。尽可能快速和小心地将网格从低温剂移动到LN2。 用一只手用手指握住镊子,另一只手向上滑动黑色夹子,保持镊子关闭。重新调整手柄并将网格操纵到网格存储盒中。
- 重复步骤 1.10-1.19,直到创建完所有网格(典型的会话将涉及创建 4-12 个网格)。将所有包含网格的网格存储箱存储在LN2 杜瓦瓶中,直到下一阶段。
2. 削片网格,用于加载到自动加载仪显微镜中
- 将网格根据先前描述的协议 28剪辑成自动网格组件。
3. 安全远程登录显微镜
注意:在撰写本文时,由于COVID-19的控制措施,以及与国际旅行相关的环境问题,越来越多的显微镜设施一直在为用户提供远程操作的服务。实现方法将根据每个设施的本地IT配置及其内部和外部用户社区的需求而有所不同。这里描述了在eBIC远程访问冷冻EM并通过EPU软件控制显微镜的过程。
- 远程登录到 cryoEM。远程登录通过NoMachine软件进行调解,以访问显微镜支持PC,并配置为仅允许通过用户FedID登录凭据访问时注册的用户访问。访问仅在会话期间保持活动状态。
- 打开 NoMachine 并使用密码身份验证启动与 nx-cloud.diamond.ac.uk 的新 NX 连接。
- 打开连接并使用用户名 feedid@fed.cclrc.ac.uk 和FedID密码登录。从可用选项中双击与相关显微镜对应的图标,以打开与相关支持PC的连接。
- 在 Windows 登录屏幕上输入用户名 clrc\FedID 和密码。
- 从桌面图标打开 TeamViewer 软件,并使用提供的密码连接到合作伙伴 ID:TEM。这将建立从支持 PC 到 TEM PC 的连接。TeamViewer 功能区中的" 下一个监视器 "按钮可用于在显微镜用户界面和 EPU 窗口之间切换。
- 然后,用户可以通过EPU接口直接控制显微镜功能。
4. 将样品装入自动上样显微镜,筛选冰和样品质量
注:在本节中,带有自动进样机和EPU软件的显微镜用于样品筛选,但这可以使用其他软件和侧面进入系统以及其他制造商的冷冻EM来实现。
- 如前所述,将夹片网格加载到显微镜自动加载仪中28。
- 在显微镜用户界面的自动加载器选项卡中,使用箭头勾选 出"选项" 对话框,然后按 "库存 "按钮。这将依次检查磁带中的每个位置,以确定是否存在墨盒。已占用的插槽将标记为蓝色。如果所有已占用的插槽都已映射,请再次按 "物品栏 "按钮以在当前位置之后停止,否则请保持运行状态,直到映射完所有已占用的插槽。在提供的框中使用样品详细信息标记所有已占用的插槽。
- 突出显示要传输到显微镜柱的网格,然后单击 加载。一旦网格成功加载到舞台上,插槽标签将从蓝色变为黄色。继续筛选网格。
- 打开 EPU 软件。在 "准备" 页面上,选择" 采集光学元件和设置 ",然后从下拉菜单中选择 Atlas 预设。选择适当的光束设置预设(例如,64x标称磁模,光斑尺寸5,微探针,在Falcon探测器的平行范围内具有照明区域 - 有关更多信息,请选择光束设置预设见28)。按 Set 将参数推送到显微镜。
- 按 打开柱阀 并插入 FluScreen。检查光束是否可见,并且是否充分扩散和居中以覆盖探测器。如有必要,请使用操纵杆或舞台菜单导航到网格的较薄区域,以控制 X 和 Y 中的舞台移动。
- 抬起FluScreen并使用EPU中的 "预览 "按钮拍摄图像。根据获得的图像,可以通过移动到较小的数字光斑大小来增加剂量,反之亦然。
- 在 EPU 中,转到 Atlas 页面,然后按 "新建会话"。选择 MRC 图像格式并输入合适的文件夹名称和位置以保存筛选会话,然后单击 应用。
- 从左侧菜单中选择 筛选 。勾选每个网格旁边的复选框以获取地图集蒙太奇。在EPU中 开始 筛选会话。将为每个已检查的网格获取一个地图集,并在完成后列出一些可用的网格方块。每个地图集都可以通过在筛选页面上突出显示来查看,并带有一个标记,显示具有类似预测冰厚的网格正方形,并按颜色分组。
- 完成后,查看收集的地图集并确定适合在较高放大倍率下评估样品质量的网格(即具有适当数量的网格正方形的网格,这些网格正方形既不干燥也不被厚冰遮挡)。在 EPU 筛选菜单上突出显示所选网格,然后单击 加载样本。
- 使用光束设置预设(有关每个阶段所需的光束设置预设的说明,请参见 28)和预览功能更详细地检查所需的网格正方形。
- 从 Atlas 筛选菜单中,选择当前加载的网格,然后通过右键单击网格图像上的所需位置并选择移动到网格正方形,将舞台移动到包含填充孔的网格正方形。
- 返回到 EPU 的"准备" 页,然后选择" 网格方形" 预设。
- 打开"EPU,自动功能"页面,然后使用GridSquare预设运行"按阶段倾斜自动偏心",将样品移动到真心高度。
注意:还提供了通过光束倾斜自动真心,它更快,但通常不如通过载物台倾斜自动真心。 - 在 EPU 的"准备"中,获取新的 GridSquare 预览 图像。请注意,不同孔洞中的灰色值不同,表示冰的厚度不同。使用右键单击将舞台移动到孔上 ,>在此处移动舞台。选择" 孔/真心高度" 预设和 "预览"。
注意:根据目标颗粒的分子量和形状,可以在孔/真心高度放大镜下识别它。 - 选择 "数据采集 "预设并设置放大倍率,以便轻松识别颗粒(对应于通常为<2 Å/像素的物体采样)。将散焦偏移设置为~-3至-5μm,曝光电子剂量为~40-80 e-/Å2。
- 迭代 4.4 中的步骤,以评估整个网格中颗粒分布、定向和污染的冰厚度范围。粒子分布可能在靠近边缘和孔中心的位置附近变化,因此使用孔测量不同位置非常重要。
- 筛选所有显示地图集承诺的网格,这些网格具有足够的网格正方形。要么将它们保存在显微镜中并使用EPU进行数据采集,要么从显微镜中卸下样品并储存在LN2 下,直到计划数据收集。
5.单颗粒冷冻EM数据收集(重点是远程操作)
注:制造商手册和其他地方介绍了使用EPU进行数据采集的详细协议28。这里强调了对该协议的修改,以进行远程操作(即减少使用手板执行任务和使用基于软件的替代方案)。
- 除非在会话期间已经收集了地图集,否则请为网格收集 Atlas。
- 根据项目的实验需求定义每个光束设置预设。
- 执行图像偏移校准28.
- 设置 EPU 会话。
- 在 EPU 中,依次选择"EPU 页面"和"会话设置",然后从首选项中选择"新建会话"和"新建"。
- 选择 新建会话 ,将出现一个弹出窗口,提供使用以前设置的选项。 "是" 会自动将先前EPU中的设置(即样本载体、散焦范围、自动对焦设置、网格类型)加载到当前EPU会话中。 从首选项中选择"新建"使用户能够选择具有已保存首选项(即散焦范围、自动对焦设置、网格类型)的文件,并且此信息将预加载到 EPU 中。
- 在会话名称中填写信息丰富的内容。当地设施可能会建议命名约定。
- 在 "类型"中,选择" 手动"。
- 对于 采集模式,请选择 精确的孔居中 或 更快的采集。
- 在 "图像格式 "中,选择所需的格式。
- 选择适当的 存储文件夹 ,EPU 将创建一个具有会话名称的目录。
- 根据所使用的栅格类型和孔间距(例如,Quantifoil 1.2/1.3)选择合适的 试样载体,然后按 Apply。此协议描述了为常规孔阵列生成模板的过程
- 选择初始网格方块并设置采集模板。
- 转到 正方形选择,如果所有方块都为绿色,请单击左上角的"全部取消选择"。
- 打开磁贴(右键单击>打开磁贴)。选择一个正方形(右键单击>添加,右键单击>将舞台移动到网格正方形)。
- 转到 孔选择, 然后按 自动真心。等到完成此操作并拍摄出网格方块图像。如果自动功能失败,这可能是因为高度明显偏低;如果是这样,可以使用网格方形放大倍率的FluScreen手动调整。
- 测量孔尺寸。移动并调整黄色圆圈,使它们以正确的大小和间距覆盖孔。
- 按 查找孔。检查是否正确找到孔。如果没有,请更改孔的大小并再次找到孔。重复此操作,直到正确找到孔。如果它持续失败,请考虑在网格方形放大倍率下移动到较小数量(更亮)的光斑尺寸。
- 使用右侧的 过滤器冰质量 直方图来调整孔选择。这可用于排除厚冰和薄冰的区域。对于本届会议期间选择的未来网格方块,将记住这一点。
- 使用顶部 "选择" 菜单中的工具优化孔选择。例如,单击" 移除靠近栅格栏的孔"。
- 转到 "模板定义" ,然后按 "获取"。
- 单击" 查找并居中孔"。现在将有一个孔的图像,孔周围有一个黄色圆圈。
注:如果难以找到孔,请插入物镜光圈。如果仍然找不到孔,请尝试增加预设孔/真心高度的曝光时间,或增加此预设的散焦或对图像进行分档。较大的散焦变化可能会改变图像偏移对齐方式。 - 将 阶段移位后的延迟 和 图像移位后的延迟 时间更改为 1-5 s。
- 检查 最大图像偏移 值(如果选项可用)是否根据需要。如果使用无像差图像偏移集合,则在 EPU 配置文件中定义此值,否则 5 μm 为标准值。
- 单击" 添加采集区域",然后单击图像上的任意位置。将采集区域移动到所需位置(即,在孔的边缘),以便采集区域不会与光束一起双重暴露(绿色圆圈中的正方形代表探测器区域,绿色圆圈是光束直径)。
- 在右上角,添加散焦范围。然后添加其他获取区域。膜蛋白项目的典型散焦列表为-0.8至-3μm散焦。
- 单击 添加自动对焦区域 ,然后单击图像上的任意位置。将自动对焦区域移动到孔周围的碳纤维上。标准做法是在使用AFIS时或每隔5-15μm对准后自动对焦,具体取决于整个正方形的z高度变化。
- 单击 添加漂移测量区域,每个网格方块执行一次漂移测量,设置阈值为0.05 nm/s是标准设置。漂移测量区域可以(最好)与自动对焦区域直接重叠。确保漂移和自动对焦区域均不与采集区域重叠。
注意:可以使用模板执行函数检查模板。这是一个好主意,看看采集区域是否需要移动(例如,图像中的碳过多/不够),但不是必需的。 - 返回" 正方形选择",然后在网格上选择要获取的正方形。使用采集区域的数量和预期的数据采集速率(来自基于探测器和实验设置的设施)来预测需要多少个采集区域。
- 选择所有需要的方块后,按 "准备所有方块"。
- 收集每个方块后,在网格正方形之间导航,并使用 选择画笔微调孔。
- 移动到试样上方的载物台位置,并使用自动功能设置真心高度。如前所述执行显微镜对准28,但不是手动执行无昏迷对准和校正物镜散光,而是使用软件中的对准工具。简而言之,设置采集光束条件,确保移除物镜孔径(OA),并将载物台定位在真心高度的试样的光束稳定区域上。在重新插入OA并将其居中并用EPU校正物镜散光之前,在自动功能内执行无昏迷对齐。确保两种对齐都收敛于合适的昏迷值(<150 nm,散光接近于零。
- 在开始自动采集运行之前,请确保关闭自动装载机涡轮泵,并插入物镜孔径。
- 在 "自动采集"中,按 "开始运行" 以开始自动数据采集。
6. 图像处理以生成EM密度图
注:大多数冷冻机电设备都提供"即时"显微胶片的预处理。有各种各样的软件包和方法可用于此,包括RELINE管道28,33,cryoSPARC43,Scipion34和WarpEM44。这里描述了一个基于RELINE的流水线,假设用户已经将显微胶片移动到适当的存储位置,并可以访问计算资源。提供了膜蛋白项目的过程和代表性结果的概述,详细说明和分步教程可以在RELINE主页上找到:https://www3.mrc-lmb.cam.ac.uk/relion。
- 对显微照片运动校正和 CTF 估计执行"动态"分析。在项目目录中启动 RELION。将导入、运动校正和 CTF 估计作业安排为循环,以便它们与数据收集和传输同时进行。显微照片分析脚本28提供有关散光和估计散焦值的实时视觉反馈(参见代表性结果)。
- 从预处理的显微照片中挑选颗粒。有许多自动颗粒拾取软件包可供选择。无需参考和基于模板的拣选选项在 RELION37 的自动拣选选项卡中可用。其他程序可用于各种步骤,例如使用crYOLO进行颗粒拾取35。
- 从CTF校正的显微照片中提取颗粒。
注:为了减少早期、"清理"、处理步骤、提取时对颗粒进行下尺度/装箱所需的计算时间。有关如何运行提取作业的详细信息,请参阅 RELION 3.1 教程。对于这个项目,粒子最初被装箱为2倍。 - 执行 2D 类平均。对 100-200 个类进行分类适用于大多数包含 ≥100,000 个粒子的数据集。不建议使用超过200个类或少于50个类,即使数据集很小,除非样本具有高对称性(即二十面体病毒),在这种情况下,少于50个类可能仍然会给出良好的结果。将掩模直径设置为足够大以容纳粒子的最长尺寸,但又要足够紧密以排除任何相邻粒子(这可能需要一些试验和错误)。
- 使用子集选择作业选择好的类(即具有结构细节的类)。2D类平均值的好和坏示例可以在代表性结果部分找到。
- 使用 RELION 中的 3D 初始模型作业从数据 从头开始 生成初始模型。
注意:不太干净的颗粒堆叠可能受益于多参考 从头开始 SGD(随机梯度下降)细化,因为这提供了筛选出垃圾/次优颗粒的额外机会。选择可以容纳感兴趣粒子的掩模直径,并在"SGD"选项卡中保留字段的默认值,因为这些字段通常表现良好。确保初始模型在Chimera(或其他适当的可视化程序)中看起来合理(参见代表性结果)。 - 使用步骤 6.6 的输出作为参考模型,执行 3D 分类以解决数据中的异质性问题。在奇美拉中评估生成的地图。独立处理对应于唯一构象状态的粒子堆叠。使用子集选择作业选择感兴趣的类,并为关联的粒子堆栈生成 particles.star 文件。
- 运行 3D 自动优化。使用在上一步中获得的 3D 类平均值作为参考,以细化其相应的粒子堆栈。如果细化的分辨率接近数据的奈奎斯特极限,则在不缩小比例的情况下重新提取粒子。重新提取后,使用未绑定的粒子堆栈重复 3D 自动优化作业。在这种情况下,必须重新缩放 3D 参考模型,以使像素和框大小与重新提取的粒子图像的像素和框大小一致。使用relion_image_handler命令行工具执行此操作。
- 如果合适,在细化中利用对称性。如果重建的地图具有对称性,请使用relion_align_symmetry命令行工具将地图对齐在相应的对称轴上。使用生成的对齐贴图作为新 3D 自动细化作业中的参考,并在参考选项卡中指定相应的对称运算符。
- 通过 3D 自动细化来锐化地图。这是使用 RELION 中的后处理作业完成的,但首先必须从优化的地图中创建合适的蒙版。RELION 教程详细介绍了掩码创建和后处理的步骤(另请参阅代表性结果)。
注意:使用 RELION 中的贝叶斯抛光和 CTF 优化功能,可以进一步提高许多重建的分辨率。使用 CTF 细化作业类型来估计和校正高阶像差(光束倾斜、三叶畸变和 4 阶 像差),以及作为单独的作业,各向异性放大倍率和每粒子散焦。在此之后,使用贝叶斯抛光作业(经过训练或使用默认值)来解决每个粒子的光束诱导运动。如 RELION 3.1 教程中所述,这些作业可能会受益于迭代方法(CTF 细化→贝叶斯抛光→ 3D 自动细化→后处理→...loop),因为两者都受益于更高分辨率的模型。 - 如有必要,请校正 EM 密度图的偏手性。检查映射以确定偏手性是否正确,方法是尝试拟合现有原子模型或评估α螺旋区域的偏手性。如果需要,使用"vop zflip"命令在 UCSF Chimera45 中沿 z 轴翻转地图。
结果
在筛选时,可以在图集阶段丢弃网格,其中以低放大倍率解析的特征将网格标记为不适合数据采集。例如,如果网格受到重大机械损坏,大多数网格方块被破坏(图2A),或者网格看起来是"干燥的",没有玻璃体冰(图2B)。此类网格通常可识别,因为网格正方形的边缘看起来清晰而清晰。在使用沉降冷冻装置制作的大多数网格中,观察到冰的梯度(图2C,D)。根据感兴趣的标本,颗粒分布可能会随冰层厚度而有很大差异,因此建议筛选一系列网格正方形以评估颗粒分布。在图集筛选步骤期间,EPU软件中已经实施了工具,以帮助用户识别相似或不同冰厚的网格正方形,这对于刚接触检查冷冻EM网格的用户特别有用(图2E,F)。

图2:放映过程中的低倍率"图谱"蒙太奇示例。A)遭受严重损坏的网格,大多数网格方块损坏 - 不适合收集。B)没有玻璃体冰的干燥网格 - 不适合收集。C)显示冰梯度的网格,其中约50%的网格可用。D) 具有~33%的网格的冰梯度可用。如果可用网格正方形具有适合收集的冰厚度,并且有足够的采集区域来满足收集的最短持续时间(例如,24 小时)E,则 C 和 D 都适合于数据收集 具有冰厚度范围的示例图集。F)与E中呈现的地图集相同,但具有由EPU软件根据冰层厚度分类和着色的网格正方形。请点击此处查看此图的放大版本。
在筛选颗粒分布时,请确保成像参数(如放大倍率和总电子剂量)与数据采集期间预期使用的参数相似,以便提供预期结果的准确图像。在筛选过程中,理想的颗粒分布是单分散的,可以看到一系列颗粒取向(取决于标本和颗粒形态的现有知识,这可能很难确定)(图3A)。冰应尽可能薄,同时容纳粒子的最大尺寸,如果冰太薄,当用电子束照射时会融化。这会导致显微照片过度运动,应避免显示此特性的区域(图3B)。从集体经验来看,当缓冲液中有洗涤剂时,这种效应最常被观察到。这可能导致在孔的中心产生非常薄的冰,因此颗粒可以被物理排除并被迫朝向边缘。这种效应在 图3C中观察到,但在这种情况下,它不是一个极端的例子,这些图像仍然有助于数据集。最后,冰需要是玻璃体的;排除网格(或多个网格)的任何区域,其中拍摄的大部分或全部图像显示数据采集中的结晶冰(图3D)。通常,在网格正方形的边缘观察到非玻璃体冰。读者可以参考网格玻璃化过程中可以改变的变量的详细评论16 ,以及薄膜环境中颗粒行为的描述46,47以获取更多信息。

图3:显示不同颗粒分布的代表性显微照片。A)采用一系列取向的单分散颗粒的"理想"分布。 B)空穴中间的冰层过薄,暴露在电子束中时变形,导致显微照片过度运动。当缓冲液中存在洗涤剂时,最常观察到这种效应 C)当孔中心冰较薄时,这在物理上将颗粒从中心排除,导致颗粒向孔边缘拥挤。在这种情况下,它不足以阻止这些图像有用,但它表明值得筛选稍微厚的区域。 D)冰不是玻璃体,不应收集看起来像本例显微照片的区域的数据。 请点击此处查看此图的放大版本。
动态图像处理可以帮助发现数据采集的错误和问题,因此在可能的情况下始终建议使用。例如,显微照片中的过度运动可能表明自动加载器涡轮泵处于活动状态,或者正在破裂的网格方块上收集数据,其中冰在电子束中显着移动,表明应跳过网格方块。动态 CTF 估计可以揭示应用正焦点(而不是散焦)的情况(使用 CTF 估计程序和参数来查找这些点),并确定使用 Volta 相板48 的相移。动态图像处理管道通常包括数据的图形摘要(图4A),使用户更容易快速评估显微照片质量并决定是否需要对数据收集进行修改。
从显微照片中选择颗粒,同时避免"假阳性",如污染或网格支撑膜,可能需要优化。然而,诸如crYOLO之类的粒子拾取器通常使用默认参数进行数据的"首次传递"(图4B),可以很好地工作,从而可以进展到2D类平均,从而更容易评估数据的质量和下游成功的可能性。对于大多数项目,约>10k粒子的2D分类应该开始显示具有二级结构细节的类。要继续进行3D,2D分类阶段通常应显示表示一系列粒子方向的类。如果揭示了首选方向,则可能需要对样品制备进行更多次迭代16 或在样品倾斜的情况下进行进一步的数据采集49。应选择所有显示二级结构细节的类以进行3D分析,同时丢弃"垃圾"颗粒(图4C)。
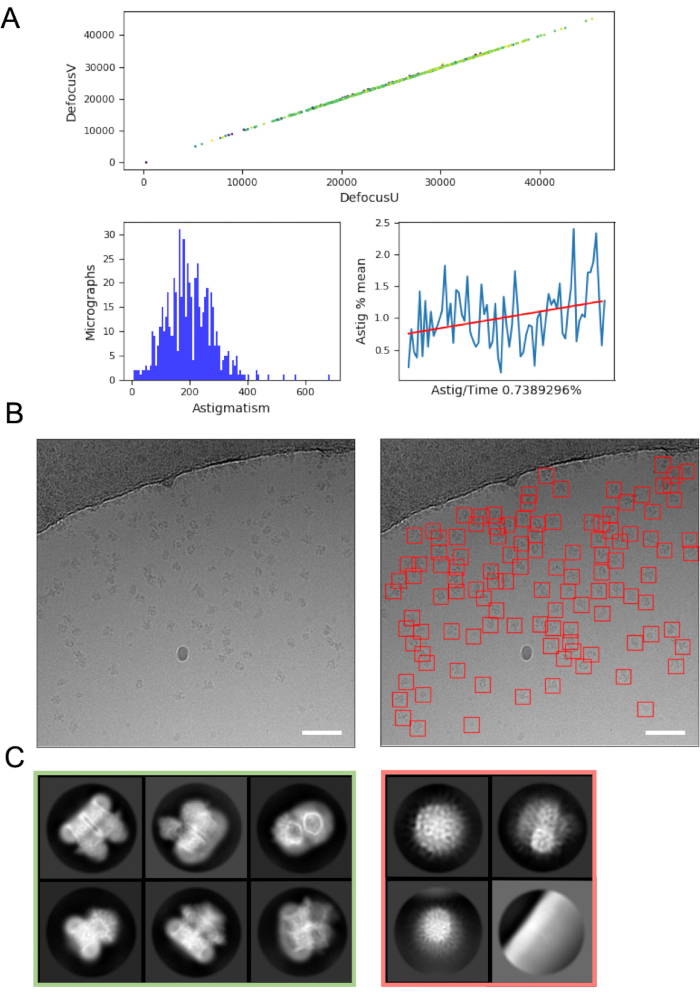
图 4:初始图像处理步骤。A) 从"动态"图像处理脚本输出。 B)使用crYOLO通用模型识别适当自动拾取的颗粒的示例显微照片(左图)比例尺(白色)为50nm。 C)2D分类的结果显示红色方块中丢弃的类,以及从中选择粒子以绿色进一步处理的类。 请点击此处查看此图的放大版本。
一小部分粒子可用于生成初始模型(图5A)。然后,此初始模型可用作 3D 分类和细化中的起始模型。在RagAB的情况下,数据集包含三个不同的符合性,可以在3D分类过程中分离(图5B)。然后,可以独立处理对每个类做出贡献的粒子,并用于优化EM密度图,然后可以对其进行进一步的解释和模型构建。
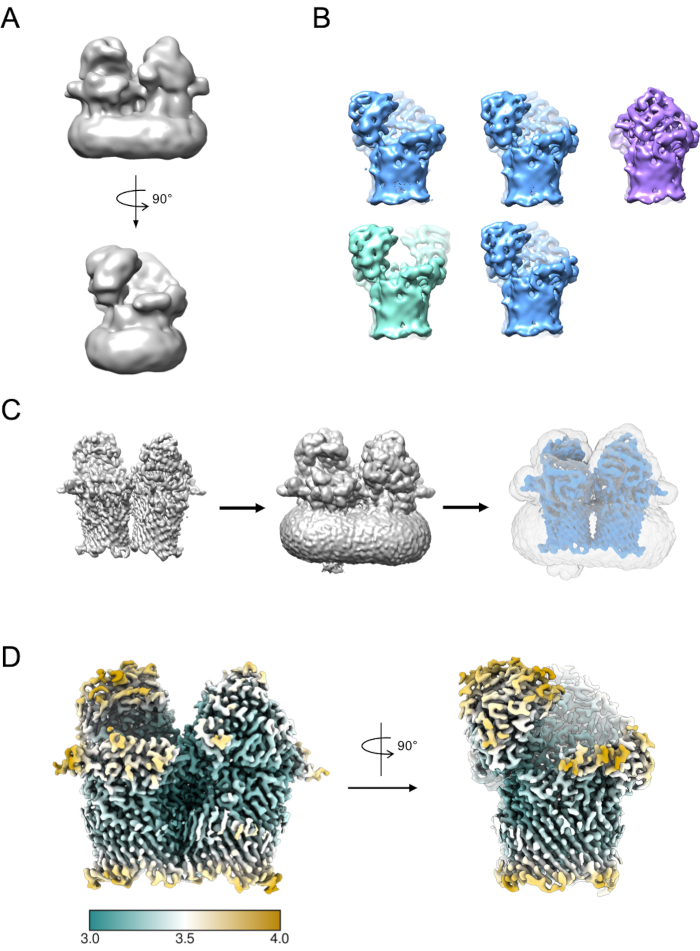
图 5:生成 3D EM 密度图。A) 使用 RELION 生成的典型初始模型。 B)5类3D分类显示颗粒分离成三种不同的构象状态:开-开(绿色),开-闭(蓝色),闭合-闭合(紫色)。 C)面具创建过程。3D细化(左)的地图应以嵌合体形式可视化。然后,可以使用体积查看器来识别地图没有脱节噪声密度(中间)的最低阈值。此阈值作为 RELION 掩码创建作业中的初始二值化阈值输入。示例掩码输出以灰色显示(右)。 D) RagAB (EMD-10245) 开闭状态的高分辨率 EM 密度图,通过局部分辨率 (Å) 进行过滤和着色。请点击此处查看此图的放大版本。
讨论
在该协议中,我们描述了一种适用于常规SPA的标本的基本管道。虽然这种薄膜形成和玻璃化的滤纸印迹方法无疑是成功的,因为它在迄今为止的绝大多数SPA项目中都有使用,但它有许多缺点。这些因素包括样品浪费、形成薄膜和冷冻样品所需的慢速时间尺度(秒)、报告的不可重复性27 以及使用滤纸吸走多余液体的负面影响50。最近,已经开发了新技术来提高薄膜生产的再现性51,52。已经开发了其他技术,可以减少样品应用和玻璃化之间的时间53,54,55。虽然在撰写本文时,基于滤纸的薄膜形成方法仍然是SPA冷冻EM样品制备中最普遍的方法,但这些新技术可能会在网格玻璃化的效率和再现性方面带来一系列好处,并创造新的机会,带来额外的实验维度,如时间分辨率和玻璃化前的快速混合。
对于大多数用户来说,网格筛选过程目前是一个定性过程,涉及获取低倍率图集,然后在整个网格中拍摄高倍率图像以评估颗粒分布。虽然对于某些类型的标本来说,这是一种足够强大的方法,但很难用眼睛来评估标本是否确实是研究人员希望成像的东西,或者具有首选的方向,例如对于小(<200 kDa)样品,或者低分辨率形态使得如果存在一系列颗粒分布,则很难用眼睛识别。对于某些项目,无法确定标本是否如预期的那样,例如配体结合的地方或正在筛选样品以评估小(例如,10 kDa)亚基是否仍然与复合物相关。对于这些项目,用于数据分析的全自动管道与"短"的0.5 - 1小时集合相结合,可以通过图像处理步骤进行2D分类甚至3D分类和细化,这将有助于有效地确定是否需要更长的集合。这些管道仍在开发中,目前尚未广泛实施,但它们有可能提高cryoEM网格筛选的效率,特别是对于具有挑战性的标本。
直接电子探测器的改进,以及显微镜的修改,加上图像处理的进步,如图像偏移数据收集,提高了数据采集过程中产生的图像的吞吐量和质量。数据收集速率的这种增加凸显了在获取许多TB数据之前对冷冻电镜网格进行彻底筛选的必要性。
CryoEM SPA已成为一种真正主流的结构生物学技术,在许多情况下,这是某些类别标本的"去"方法,例如异质性和不稳定的大分子复合物。虽然这里的协议描述了SPA管道的基本概述,但这里涵盖的每个部分(网格玻璃化和筛选,cryoEM和图像处理)本身就是一个主题,值得在SPA项目的开发过程中进行探索。随着样品制备和显微镜技术的进步,以及新的图像处理算法和方法的上线,SPA将继续作为管道开发,帮助研究人员深入了解复杂的生物系统。
披露声明
没有报告任何利益冲突。
致谢
这项工作得到了欧盟委员会地平线2020计划资助的iNEXT-Discovery(赠款871037)的支持。J B. R. White由Wellcome Trust(215064/ Z / 18 / Z)资助。FEI Titan Krios显微镜由利兹大学(UoL ABSL奖)和Wellcome Trust(108466 / Z / 15 / Z)资助。我们感谢M Iadanza使用他的显微照片分析脚本。我们感谢Diamond Light Source访问和支持由Wellcome Trust,MRC和BBRSC资助的英国国家电子生物成像中心(eBIC)的冷冻电镜设施。
材料
| Name | Company | Catalog Number | Comments |
| Blunt tweezers | Agar Scientific | AGT5022 | |
| Cryo EM round storage box | Agar Scientific | AGG3736 | |
| CryoEM autogrid boxes | ThermoFisher Scientific | 1084591 | |
| CryoEM grids | Quantifoil | N1-C14nCu30-01 | |
| Ethane gas | Boc | 270595-F | |
| LN2 foam dewar | Agar Scientific | AG81760-500 | |
| LN2 storage dewar | Worthington industries | HC 34 | |
| Pipette | Gilson | 10082012 | |
| Pipette tips | Star labs | s1111-1706 | |
| Syringe | BD | BD 300869 | |
| Type II lab water | Suez | select fusion | |
| Vitrobot | ThermoFisher Scientific | 1086439 | |
| Vitrobot filter paper | Whatman | 1001-055 | |
| Vitrobot styrophome container assembly | ThermoFisher Scientific | 1086439 | |
| Vitrobot tweesers | ThermoFisher Scientific | 72882-D | |
| Software | |||
| EPU | ThermoFisher Scientific | 2.8.1.10REL | |
| TEM server | ThermoFisher Scientific | 6.15.3.22415REL | |
| Tia | ThermoFisher Scientific | 5.0.0.2896REL | |
| Titan krios microscope | ThermoFisher Scientific | Titan Krios G2 |
参考文献
- Kuehlbrandt, W. The Resolution Revolution. Science. 343 (6178), 1443-1444 (2014).
- McMullan, G., Faruqi, A. R., Henderson, R. Direct Electron Detectors. Methods in Enzymology. , (2016).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: the nuts and bolts. Current Opinion in Structural Biology. , (2017).
- Lyumkis, D. Challenges and opportunities in cryo-EM single-particle analysis. Journal of Biological Chemistry. , (2019).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. , (2020).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. , (2020).
- Conley, M. J., et al. Calicivirus VP2 forms a portal-like assembly following receptor engagement. Nature. 565 (7739), 377-381 (2019).
- Hesketh, E. L., et al. The 3.3 Å structure of a plant geminivirus using cryo-EM. Nature communications. 9 (1), 2369 (2018).
- Malone, L. A., et al. Cryo-EM structure of the spinach cytochrome b6 f complex at 3.6 A resolution. Nature. 575 (7783), 535-539 (2019).
- Madej, M., et al. Structural and functional insights into oligopeptide acquisition by the RagAB transporter from Porphyromonas gingivalis. Nature Microbiology. , (2020).
- Gallardo, R., et al. Fibril structures of diabetes-related amylin variants reveal a basis for surface-templated assembly. Nature Structural and Molecular Biology. , (2020).
- Scarff, C., et al. Structure of the shutdown state of myosin-2. Nature. , (2020).
- Scarff, C. A., et al. Structure of the protective nematode protease complex H-gal-GP and its conservation across roundworm parasites. PLoS Pathogens. 16 (4), 1008465 (2020).
- Wu, M., Lander, G. C. How low can we go? Structure determination of small biological complexes using single-particle cryo-EM. Current Opinion in Structural Biology. , (2020).
- Khoshouei, M., Radjainia, M., Baumeister, W., Danev, R. Cryo-EM structure of haemoglobin at 3.2 Å determined with the Volta phase plate. Nature Communications. , (2017).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta crystallographica. Section D, Structural biology. 74, 560-571 (2018).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadanza, M. G. Variations on negative stain electron microscopy methods: tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biological procedures online. 6, 23-34 (2004).
- Baker, L. A., Rubinstein, J. L. Radiation Damage in Electron Cryomicroscopy. Methods in enzymology. 481, 371-388 (2010).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (02), 129-228 (1988).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in enzymology. 579, 51-86 (2016).
- Carragher, B., et al. Current outcomes when optimizing ‘standard’ sample preparation for single-particle cryo-EM. Journal of Microscopy. , (2019).
- Naydenova, K., Jia, P., Russo, C. J. Cryo-EM with sub-1 Å specimen movement. Science. , (2020).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in Enzymology. , (2016).
- Thompson, R. F., Iadanza, M. G., Hesketh, E. L., Rawson, S., Ranson, N. A. Collection, pre-processing and on-the-fly analysis of data for high-resolution, single-particle cryo-electron microscopy. Nature protocols. 14 (1), 100-118 (2019).
- Suloway, C., et al. Automated molecular microscopy: the new Leginon system. Journal of Structural Biology. 151 (1), 41-60 (2005).
- Zhang, J., et al. JADAS: A customizable automated data acquisition system and its application to ice-embedded single particles. Journal of Structural Biology. , (2009).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. , (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. , (2019).
- Fernandez-Leiro, R., Scheres, S. H. W. A pipeline approach to single-particle processing in RELION. Acta crystallographica. Section D, Structural biology. 73, 496-502 (2017).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. , (2018).
- Wagner, T., et al. SPHIRE-crYOLO is a fast and accurate fully automated particle picker for cryo-EM. Communications biology. 2 (1), 213-218 (2019).
- Bepler, T., et al. TOPAZ: A Positive-Unlabeled Convolutional Neural Network CryoEM Particle Picker that can Pick Any Size and Shape Particle. Microscopy and Microanalysis. , (2019).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 163 (2018).
- Zivanov, J., Nakane, T., Scheres, S. H. W. A Bayesian approach to beam-induced motion correction in cryo-EM single-particle analysis. IUCrJ. , (2019).
- Cianfrocco, M. A., Kellogg, E. H. What Could Go Wrong? A Practical Guide to Single-Particle Cryo-EM: From Biochemistry to Atomic Models. Journal of Chemical Information and Modeling. , (2020).
- Tagari, M., Newman, R., Chagoyen, M., Carazo, J. M., Henrick, K. New electron microscopy database and deposition system. Trends in Biochemical Sciences. , (2002).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: A public archive for raw electron microscopy image data. Nature Methods. , (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. , (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. , (2019).
- Goddard, T. D., et al. UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Protein Science. 27 (1), 14-25 (2018).
- Klebl, D. P., et al. Need for Speed: Examining Protein Behavior during CryoEM Grid Preparation at Different Timescales. Structure. , (2020).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 32 (2018).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proceedings of the National Academy of Sciences. , (2014).
- Zi Tan, Y., et al. Addressing preferred specimen orientation in single-particle cryo-EMthrough tilting. Nature Methods. , (2017).
- Armstrong, M., Han, B. -. G., Gomez, S., Turner, J., Fletcher, D. A., Glaeser, R. M. Microscale Fluid Behavior during Cryo-EM Sample Blotting. Biophysical Journal. 118 (3), 708-719 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. , (2017).
- Dandey, V. P., et al. Spotiton: New Features and Applications. Journal of Structural Biology. , (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta crystallographica. Section D, Structural biology. 75, 1063-1070 (2019).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. bioRxiv. , (2020).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: From sprays to jets and back. Acta Crystallographica Section D: Structural Biology. , (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。