Method Article
מיקרוסקופיה קריו-אלקטרונית חלקיקית בודדת: מדגם למבנה
In This Article
Summary
קביעת מבנה של מתחמים מקרומולקולריים באמצעות cryoEM הפכה לשגרה עבור סוגים מסוימים של חלבונים ומתחמים. כאן, צינור זה מסוכם (הכנה לדוגמה, סינון, רכישת נתונים ועיבוד) והקוראים מופנים למשאבים ומשתנים מפורטים נוספים שעשויים להשתנות במקרה של דגימות מאתגרות יותר.
Abstract
מיקרוסקופיה קריו-אלקטרונית (cryoEM) היא טכניקה רבת עוצמה לקביעת מבנה של מתחמים מקרומולקולריים, באמצעות ניתוח חלקיקים יחיד (SPA). התהליך הכולל כרוך i) vitrifying הדגימה בסרט דק נתמך על רשת cryoEM; ii) סינון הדגימה להערכת התפלגות החלקיקים ואיכות הקרח; iii) אם הרשת מתאימה, איסוף ערכת נתונים חלקיקית אחת לניתוח; ו-iv) עיבוד תמונה כדי להניב מפת צפיפות EM. בפרוטוקול זה, מסופקת מבט כולל עבור כל אחד מהצעדים הללו, תוך התמקדות במשתנים שהמשתמש יכול לשנות במהלך זרימת העבודה ובפתרון בעיות נפוצות. עם פעולת מיקרוסקופ מרחוק הופכת לסטנדרט במתקנים רבים, יתואר וריאציות על פרוטוקולי הדמיה כדי לסייע למשתמשים בתפעול והדמיה יעילים כאשר הגישה הפיזית למיקרוסקופ מוגבלת.
Introduction
קריום חלקיק יחיד
כדי לחקור את החיים ברמה המולקולרית עלינו להבין את המבנה. טכניקות רבות לבדיקת מבנה החלבון זמינות, כגון NMR, קריסטלוגרפיה של קרני רנטגן, ספקטרומטריית מסה ומיקרוסקופיית אלקטרונים (EM). עד כה, רוב המבנים שהופקדו במאגר נתוני החלבון (PDB) נפתרו באמצעות קריסטלוגרפיה של קרני רנטגן. עם זאת, משנת 2012 ואילך, מיקרוסקופיה קריו-אלקטרונית (cryoEM) הפכה לטכניקה מיינסטרים לקביעת מבנה החלבון והשימוש בה גדל באופן דרמטי. המספר הכולל של מפות EM שהופקדו במאגר הנתונים אלקטרון מיקרוסקופיה (EMDB) (נכון לדצמבר 2020) היה 13,421 לעומת 1,566 בשנת 2012 (איור 1, www.ebi.co.uk). בשנת 2012 מספר הקואורדינטות האטומיות שעוצבו במפות צפיפות cryoEM, שהופקדו ל- PDB היה רק 67 אך נכון לדצמבר 2020 הופקדו עד כה 2,309 מבנים, גידול של פי 35. צמיחה זו באיכות ובכמות מפות צפיפות cryoEM המיוצרות, המכונות לעתים "מהפכת הרזולוציה"1, נגרמה על ידי התמזגות של התקדמות בתחומים מרובים: פיתוח מצלמות חדשות להדמיה המכונות גלאי אלקטרונים ישירים; תוכנה חדשה; ומיקרוסקופים יציבים יותר2,3,4.
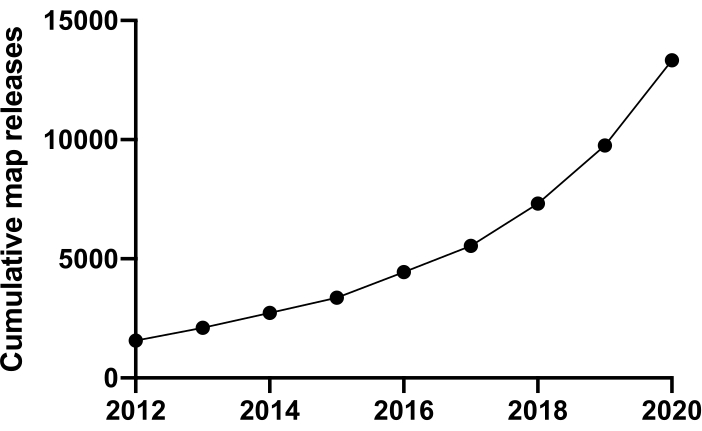
איור 1: הגשות מצטברות ל- EMDB מ- 2012 עד דצמבר 2020. אנא לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
ניתוח חלקיקים יחיד (SPA) הוא כלי רב עוצמה ליצירת תובנה ביולוגית במגוון רחב של סוגי מדגמים על ידי ביסוס מבנים ברזולוציה גבוהה של מתחמים מבודדים5,6 כולל וירוסים7,8, חלבונים ממברנה9,10, מכלולים סלילים11 ומתחמים מאקרומולקולריים דינמיים והטרוגניים אחרים12,13, שגודלם משתנה לפי סדרי גודל (מ- 39 kDa 14,15 עד עשרות מגדונים). כאן, פרוטוקול עבור צינור סטנדרטי עבור spa cryoEM מדגם למבנה מתואר.
לפני ההחלמה על צינור זה, מדגם מטוהר צריך להיות נתון לניתוח ביוכימי כדי להעריך את סיכוייה להצלחה במורד הזרם. הכנת מדגם מתאים היא ללא ספק המחסום הגדול ביותר לספא, במיוחד עבור מתחמים ארעיים והטרוגניים (קומפוזיציה וקונפורמיים כאחד). ההכנה המורכבת המקרומולקולרית צריכה להכיל כמה שפחות מזהמים, בריכוז מספיק כדי להניב חלקיקים רבים בכל מיקרוגרף cryoEM, ובהרכב חיץ מתאים היטב לניתוח cryoEM. מרכיבי חיץ מסוימים, כולל סוכרוז, גליצול וגבוה (~ > 350 mM ריכוזים של מלחים, בהתאם לגודל המדגם, תכונות ומרכיבי חוצץ אחרים) יכול להפריע לתהליך של vitrification או להפחית את יחס אות לרעש בתמונות, לעכב את קביעת המבנה16.
בדרך כלל, ככרומטוגרפיה מינימלית של אי-הכללת גודל (SEC) וניתוח ג'ל SDS- PAGE יש להשתמש כדי להעריך טוהר מדגם17,18, אך דיכרויזם מעגלי, בדיקות תפקודיות, SEC בשילוב עם פיזור אור רב-זוויתי, ובוחות יציבות תרמית הם כלים שימושיים לניתוח איכותי של הכנות מורכבות מקרומולקולריות לפני ניתוח cryoEM. עם זאת, התוצאות של ניתוחים ביוכימיים אלה עשויות להניב תובנה מועטה על ההטרוגניות המבנית של המדגם והתנהגותה ברשת cryoEM. מסיבה זו, כתם שלילי EM משמש באופן שגרתי ככלי מהיר, זול ורב עוצמה להערכת הטרוגניות קומפוזיציה וקונפורמציה, ולכן דרך טובה לברר איזה שבר חמקן מטיהור הוא המבטיח ביותר, או הקרנת קומפוזיציות חיץ שונות19,20. ברגע שזוהתה דגימה מבטיחה, נוכל להמשיך לצינור ההקפאה של הספא. כתם שלילי לא תמיד ליישר עם התוצאות הבאות לראות cryoEM; לפעמים מדגם נראה עני על ידי כתם שלילי אבל משתפר כאשר נראה בקרח הזגוגות cryoEM. לעומת זאת, לפעמים דגימות נראות מצוינות במהלך שלבי כתם שליליים אך דורשות מיטוב משמעותי נוסף כאשר מתקדמים ל- cryoEM. עם זאת, ברוב המקרים כתם שלילי מספק שלב בקרת איכות שימושי.
ויטריפיקציה
הסביבה הקשה בתוך מערכת הוואקום של מיקרוסקופ האלקטרונים גורמת הן להתייבשות והן לנזק לקרינה לדגימות ביולוגיות שלא פתורות21. לכן, כדי לדמיין את המדגם במצב דמוי יליד, הדגימה הביולוגית חייבת להישמר לפני ההדמיה. עבור הכנות מטוהרות של מתחמים מקרומולקולריים, vitrification היא שיטת הבחירה כדי לאפשר הדמיה שלה על ידי cryoEM תוך שמירה על הפרטים האטומיים של המתחם. גילוי ה-vitrification כשיטה להכנת מדגם היה התקדמות בסיסית במיקרוסקופיה אלקטרונית של דגימות ביולוגיות, אשר דובוצ'ה הוכר בפרס נובל לכימיה לשנת 2017. vitrification לדוגמה כרוך ביצירת שכבה דקה של פתרון המכיל את הדגימה של עניין, בדרך כלל עשרות ננומטר עובי, מושעה על תמיכה ברשת cryoEM. הסרט הדק קפוא במהירות רבה בקריוגן כגון אתאן נוזלי ב ~ -175 °C (70 °F). קצב ההקפאה הוא ~ 106 °C/s, מהיר מספיק כדי אמורפי, או קרח זוועתי צורות, השעיית הדגימה בסרט דק, מוצק22.
המשתנה ההתחלתי שיש לקחת בחשבון הוא התמיכה ברשת cryoEM שנבחרה23. רשת EM מורכבת בדרך כלל מסרט פחמן אמורפי עם ניקובים (רגילים או לא סדירים), על מבנה תמיכה. מבנה התמיכה הוא בדרך כלל רשת מתכת עגולה בקוטר 3.05 מ"מ, בדרך כלל עשוי נחושת, אבל מתכות אחרות כגון זהב, או מוליבדן (אשר העדיף תכונות התפשטות תרמית24) ניתן להשתמש. לעיתים, תמיכה דקה ורציפה נוספת מוחלת על פני הרשת, כגון גרפן, תחמוצת גרפן או שכבת פחמן אמורפית דקה (~1-2 ננומטר). בעוד רשתות cryoEM סטנדרטיות (הנפוצות ביותר 400-200 נחושת רשת עם מחורר (1.2 מיקרומטר חורים עגולים מופרדים על ידי 1.3 מיקרומטר (r1.2/1.3), או 2 מיקרומטר מופרד על ידי 2 מיקרומטר של פחמן (r2/2)) תמיכה בפחמן - למרות דפוסים רבים ושונים זמינים) שימשו ברוב המכריע של מבנים שדווחו עד כה, טכנולוגיות רשת חדשניות עם מוליכות משופרת ותנועה מופחתת דגימה דווחו25 . רשתות נבחרות כפופות לטיפול ניקוי זוהר-פריקה/פלזמה כדי להפוך אותם הידרופיליים ומקובל לדגום application26.
לאחר פריקת זוהר, השלב הבא הוא היווצרות סרט דק. סרט דק זה נוצר בדרך כלל באמצעות נייר סינון כדי להסיר נוזל עודף מהרשת. בעוד זה יכול להתבצע באופן ידני, מספר מכשירי הקפאת צלילה זמינים מסחרית, כולל Vitrobot Mk IV (תרמו פישר מדעי), EM GP II (לייקה) ו CP3 (גטן). עם התקנים אלה, ~ 3-5 μL של מדגם בפתרון מוחל על רשת EM, ואחריו סופג את פתרון עודף באמצעות נייר מסנן. הרשת, עם סרט דק תלוי על פני זה, הוא צלל לתוך אתאן נוזלי מקורר על ידי חנקן נוזלי (LN2) כדי ~ -175 °C (70 °F). לאחר הקפאת, הרשת נשמרת בטמפרטורה מתחת לנקודת הפיחות (-137 °C)-C לפני, ובמהלך ההדמיה.
סינון דגימה ואיסוף נתונים
לאחר vitrification של רשת cryoEM, השלב הבא הוא לסנן את הרשת כדי להעריך את איכותה ולקבוע אם הרשת מתאימה להמשיך לאיסוף נתונים ברזולוציה גבוהה. רשת cryoEM אידיאלית כוללת קרח זגוכי (בניגוד לקרח גבישי) עם עובי הקרח מספיק כדי להכיל את הממד הארוך ביותר של הדגימה, מה שמבטיח שהקרח שמסביב תורם כמה שפחות רעש לתמונה המתקבלת. החלקיקים בתוך הקרח צריכים להיות בגודל (אם ידוע) צורה עולה בקנה אחד עם ביוכימיה, באופן אידיאלי להיות monodisperse עם התפלגות אקראית של כיווני חלקיקים. לבסוף, הרשת צריכה להיות מספיק אזורים באיכות מספקת כדי לספק את אורך איסוף הנתונים הרצוי. בהתאם לדגימה, זה עשוי לקחת איטרציות רבות של vitrification והקרנה עד רשתות אופטימליות מיוצרים. למרבה המזל ולמרבה הצער, יש מגוון עצום של משתנים שניתן לבדוק אמפירית כדי לשנות את התפלגות החלקיקים ברשתות cryoEM (נבדק ב-16,27). בכתב יד זה, תוצאות מייצגות עבור פרויקט חלבון ממברנה10 מוצגים.
לאחר זיהוי רשת מתאימה, איסוף הנתונים יכול להמשיך. מספר מודלים של מיקרוסקופ אלקטרונים בהעברת קריו עבור דגימות ביולוגיות מותאמים לאיסוף נתונים ברזולוציה גבוהה באופן אוטומטי. בדרך כלל, נתונים נאספים במערכות 300 kV או 200 kV. איסוף נתונים אוטומטי ניתן להשיג באמצעות תוכנה כולל EPU (תרמו פישר מדעי)28, Leginon29, JADAS30 ו SerialEM31,32. איסוף נתונים אוטומטי עם גלאים מודרניים בדרך כלל גורם לטרה-בתים (TB) של נתונים גולמיים בפרק זמן של 24 שעות (ערכות נתונים ממוצעות הן ~ 4 TB בגודל).
בשל מגבלות COVID-19 במקום על רוב העולם (זמן כתיבת דצמבר 2020), מתקני מיקרוסקופיה רבים עברו להציע גישה מרחוק. לאחר שהרשתות נטענו לתוך המטען האוטומטי של מיקרוסקופ, ניתן לבצע רכישת נתונים מרחוק.
עיבוד תמונה ובניית מודל
כאשר הפעלת איסוף נתונים עשויה להיות בדרך כלל 0.5-4 ימים, עיבוד תמונה עוקב עשוי להימשך שבועות וחודשים רבים, בהתאם לזמינות משאבי המחשוב. זה סטנדרטי עבור שלבים ראשוניים עיבוד תמונה, כלומר תיקון תנועה והערכת פונקציית העברת ניגודיות (CTF) להתקיים 'תוך כדי תנועה' 33,34. עבור עיבוד במורד הזרם, יש שפע של חבילות תוכנה זמינות. חלקיקים 'נקטפים' ומופקים ממיקרוגרפים35,36. לאחר חילוץ החלקיקים, פרוטוקול סטנדרטי יהיה לעבד את החלקיקים באמצעות מספר סבבי סיווג (בשני הממדים (2D) ושלושה ממדים (3D) ו / או התמקד באזורים ספציפיים של עניין) כדי להגיע תת קבוצה הומוגנית של חלקיקים. תת-קבוצה הומוגנית זו של חלקיקים היא אז ממוצע יחד כדי לייצר שחזור 3D. בשלב זה נתונים מתוקנים לעתים קרובות עוד יותר כדי לייצר את המפה באיכות הגבוהה ביותר האפשרית, למשל באמצעות עידון CTF, תיקוני עיוות37 ו ליטוש בייסיאן38 . התוצאה של עיבוד תמונה זה היא מפת cryoEM תלת-ממדית של הדגימה הביולוגית של עניין. טווח הרזולוציה אליו הגיע בניסוי חלקיקים יחידים אוטומטי 'סטנדרטי' מרשת באיכות מספקת, כאשר הנתונים הנאספים במערכת מיקרוסקופ של 300 קילוואט הוא בדרך כלל בין 10 Å ל- 2 Å בהתאם לגודל ולגמישות של קומפלקס החלבון. עם דגימה אידיאלית, רזולוציות של ~ 1.2 Å הגיעו כעת באמצעות זרימות עבודה של SPA5. בעוד פרוטוקול זה מפרט צעדים לקראת קבלת מפת צפיפות EM, ברגע זה ביד זה יכול להתפרש עוד יותר באמצעות התאמה ועידון מודל חלבון (אם הרזולוציה היא < 3.5 Å) או בניית דה novo39. נתונים הקשורים לניסויי קביעת מבנים יכולים להיות מופקדים במאגרים ציבוריים מקוונים, כולל מפות צפיפות EM (אלקטרון מיקרוסקופיה Data Bank)40, וכתוצאה מכך קואורדינטות אטומיות (Protein Data Bank)41 וערכת נתונים גולמית (ארכיון התמונות הציבוריות של אלקטרון מיקרוסקופיה)42.
בפרוטוקול זה, קומפלקס חלבון הממברנה החיצונית RagAB (~ 340 kDa) מ Porphyromonas gingivalis משמש קומפלקס מקרומולקולרי דוגמה10 (EMPIAR-10543). עבור אלה חדשים cryoEM, תמיכה עבור דגימות דרך צינור זה מדגם למבנה זמין, בכפוף לביקורת עמיתים, באמצעות תוכניות גישה ממומנות כגון גילוי iNEXT והוראה.
Protocol
1. ויטריפיקציה ברשת
הערה: עבור כל השלבים בשלבים 1 ו-2, ודא שכל הכלים נקיים, יבשים בטמפרטורת החדר לפני קירורם לטמפרטורת LN2 , תוך שימוש ב- LN2 שנקבע זה עתה כדי להפחית את זיהום הקרח. במידת האפשר, עבוד בסביבה מבוקרת לחות עם < 20% לחות יחסית. ודא שציוד מגן אישי מתאים ותיעוד H&S קיימים לפני תחילת העבודה.
- ודא את הדגימה של עניין מוכן להכנת מדגם.
- בחר רשתות cryoEM מתאימות ולהבטיח אלה כבר שניתנו הידרופילי באמצעות פריקה זוהרת או טיפול פלזמה. מגוון רחב של מערכות וריאציות לפרוטוקול זמינות אך כולן כרוכות בהצבת הרשתות במערכת ניקוי פריקה/פלזמה זוהרת והפעלת תוכנית שתשאוב את התא לרמת ואקום רצויה, לפני הכנסת תערובת גזים ספציפית / אדים כימיים או אוויר למערכת. זרם חשמלי מועבר דרך המערכת, מייסר את חלקיקי הגז ומעורר את פני השטח של הרשתות להיות מעובד הידרופילי יותר.
- הפעל את התקן הקפאת הצלילה להתחדשות רשת על-ידי הפעלת המערכת באמצעות מתג ההפעלה מאחור, והמתן לטעינת מסך המגע.
- באמצעות העט האלקטרוני או האצבעות שסופקו, בקונסולה, הגדר את טמפרטורת העבודה הרצויה של התא (הטווח הזמין הוא 4-60 °C (4°F), מומלץ עבור רוב מקרומולקולים 4-6 °C (6 °F).
- מלא את מכשיר הלחות עם 50 מ"ל של מי מעבדה מסוג II באמצעות מזרק, באמצעות צינורות גומי בתחתית מכשיר הלחות. הקפד להסיר כל אוויר לכוד במזרק לפני המילוי. היזהר לא למלא את מכשיר הלחות או מים יתפרץ לתוך החדר. לאחר שספינת הלחות מתמלאת, משכו לאחור את בוכנה המזרק ב-5-10 מ"ל כדי ליצור אטם ואקום.
- בקונסולה, הגדר את הלחות היחסית הרצויה עבור התא (הטווח הזמין הוא 0-100%, לחות של 95-100% משמשת בדרך כלל). השאר לחות מוגדרת 'כבויה' עד מיד לפני יצירת הרשת, כך התא לא מקבל רטוב מדי.
- להשיג את פינצטה מכשיר הקפאת לצלול ונייר מסנן לחתוך לגודל הנכון כדי להתאים על הרפידות, או שנרכש או באמצעות חותמת כדי לחתוך צמצם בגודל המתאים.
- הכן את הקריוגן להקפאת צלילה.
- מניחים את מחזיק תיבת קריו מתכת, קריוגן ורגלי עכביש מתכת לתוך מיכל נוזל הקירור.
- מצננים את המיכל על ידי מילוי התא החיצוני ב- LN2. שמור את התא החיצוני למעלה כדי לכסות את החלק העליון של מחזיק תיבת רשת ההקפאה. הוסף ~ 1 ס"מ של LN2 נוסף לכוס קריוגן כדי לסייע שיווי משקל של המערכת לטמפרטורת LN2 .
הערה: הטבעת נגד זיהום יכולה לשמש כדי להגביל את התעבויות האוויר לח סביב קריוגן ומוביל זיהום קריו-נוזל/אתאן. זה לא נדרש בדרך כלל בסביבה מבוקרת לחות. אם משתמשים בטבעת למניעת זיהום, היזהרו שלא למלא את המיכל ב-LN2 או שהוא עלול להישפך כאשר הטבעת נלחצת לתוך המיכל בהמשך התהליך. - המתן 3-5 דקות כדי לראות את הרתיחה של רגלי העכביש, ולאחר מכן המתן 3 דקות נוספות כדי להבטיח את הקריוגן קר מספיק כדי לדחוס את מדיום ה- vitrification.
- מנוזל את הקריוגן (אתאן נוזלי) לתוך קריוגן.
- קח את צינור צילינדר האתאן עם צינורות דקים וזרבובית כדי לחלק את הגז. קצה פיפטה P200 עם הצמצם שנפתח על ידי חיתוך הקצה באמצעות סכין גילוח הוא אידיאלי כאן. יש צורך בצמצם רחב יותר כדי למנוע אתאן מתגבש בקצה וחוסם את זרימת הגז.
- הבטחת קריוגן אינו מכיל כל LN2 הנותרים, לקחת את זרבובית גז אתאן ומניחים אותו בתוך קריוגן. באמצעות וסת צילינדר הגז, להתחיל זרימה נמוכה ולחלק גז קריוגן לתוך קריוגן כדי לדחוס את הגז. שמור את הקצה שממנו הגז זורם ישירות על הקיר של קריוגן אבל להזיז אותו בעדינות קדימה ואחורה בתנועת הקשה על פני השטח. לווסת את זרימת הגז כדי לאפשר זרימה נמוכה ויציבה להתחיל לדחוס / נזיל בצורה מבוקרת בתוך קריוגן.
- מלאו את הכוס ממש מתחת לשפת העכביש הכסוף ועסקו את זרימת הגז, ואז הסירו את קו הגז בזהירות כדי למנוע זיהום LN2 שמסביב עם אתאן.
- למעלה את מיכל נוזל הקירור עם LN2, נזהר מאוד לא לשפוך כל לתוך האתאן הנוזלי.
- השאירו את רגלי העכבישים בעמדה למשך ~ 3-5 דקות כדי להבטיח את האתאן הנוזלי הוא שיווי משקל לטמפרטורה קרה מספיק. הקריוגן יתחיל להיראות מעונן/מעט אטום. זה מצביע על כך שהוא קרוב לנקודת ההקפאה שלו. בשלב זה, השתמש פינצטה כדי להסיר את העכביש. כל עוד LN2 נשמר בתוך המיכל המקיף את קריוגן, האתאן יישאר עכשיו נוזלי ומתאים vitrification עבור 1-2 שעה. עם זאת, לשאוף להשלים את ההליך מהר ככל האפשר, במיוחד בחדרים שאינם מבוקרי לחות, כדי להפחית את זיהום הקרח.
הערה: אם העכביש נראה 'תקוע על', להשתמש בעצם מתכת כגון אגוז ולהחזיק נגד הרגליים של העכביש כדי לחמם אותם מעט, ולאחר מכן להסיר את הרגליים.
- הכן את מכשיר הקפאת הצלילה ואביזרים עבור vitrification מדגם.
- הוסף תיבות אחסון רשת למחזיק תיבת רשת ההקפאה המתכתית ולאורך כל ההליך להבטיח את LN2 נשמר עד קצת מעל הרמה של תיבות הרשת (בדרך כלל כל ~ 5 דקות).
- במסך התקן הקפאת הצלילה, בתיבה פרמטרי תהליך מזינים את הפרמטרים שנבחרו כולל: זמן כתם (הזמן שבו רפידות התקן ההקפאה של הצלילה יתאחדו), כוח (המרחק של רפידות הכתמים מהרשת, המשנה את השיפוע של היווצרות הקרח) וסך הכל (מספר הפעמים שרפידות הכתמים יגיעו להיפגש). בחר פרמטרים אלה בהתבסס על התקן הקפאת הצלילה הבודד והתנהגות המאקרומולקול. ערכים אופייניים הם כוח כתם בין 0 ל- 5, זמן כתם מ- 1-6 s וסך הכל כתם של 1. זמן המתנה טיפוסי (זמן בין ייזום הכתם, לבין תחילת הכתם) וזמן הניקוז (זמן לאחר הצלילה) הוא 0-2 s.
הערה: בהתאם להעדפות המשתמש, ניתן לבחור אפשרויות נוספות במקטע אפשרויות, שונות , כולל השתמש בדוושת רגל כדי לעבור לשלב הבא בכל לחיצה, דלג על העברת רשת (מדלג על השלב האחרון שבו זרוע הפינצטה מורמת מעט), לכבות את הלחות במהלך התהליך (בזמן שהדגימה מוחלת, מפסיק לחות פעילה של התא שיכול להקשות על הצגת הרשת) ו - Autoraise Ethanelift (משלב את שלב פינצטה שגדלים לתוך התא ומעלה את מיכל הקירור - מדלג על שלב מיכל האתאן ). כאן, כל האפשרויות האלה מופעלות. - מניחים את מיכל הקירור בבטחה על זרוע הפלטפורמה הנעה מתחת לתא
- הכנס נייר סופג טרי על כל זרוע סופגת כדי לוודא שמהדקי טבעת פלסטיק מאובטחים. כל נייר סינון יאפשר 16 כתמים (זרועות לסובב נייר סופג). לחץ על לחצן אפס נייר כתם במקטע פקדים .
- הפעל מחזור מלא אחד של תהליך vitrification התקן הקפאת צלילה כדי להבטיח כי כל חלק נע מתנהג כצפוי.
- הקש (או השתמש בדוושת רגל) כדי למקם רשת חדשה ולאחר מכן התחל תהליך ולאחר מכן עבד ולאחר מכן המשך. בשלב זה, צפו כדי להבטיח שזרועות הכתמים יוצרות קשר כצפוי.
- תדליק את מכשיר הלחות. אדי מים יופקו (כל עוד הלחות שנקבעה גבוהה יותר מאשר כיום בתא).
- דגימת העניין יכולה כעת להתחדש. השתמש בדוושת כף הרגל או Place New Grid ומוט הצלילה יירד מהתא ויאפשר לחבר את הפינצטה להר.
- באמצעות פינצטה התקן הקפאת לצלול, להרים את זוהר הרצוי משוחרר / פלזמה ניקה רשת cryoEM, תוך כדי שימת לב איזה צד הוא הצד הנכון לשמש ליישום מדגם על פי יצרן הרשת. הרם את הרשת על ידי שפת, דואג למנוע מגע מוגזם / מיותר עם פינצטה כמו זה יפגע בתמיכה. אבטחו את הרשת בפינצטה על ידי הזזת הסרטון השחור לחלק הסגור של פינצטה. הרשת צריכה להיות מוחזקת בבטחה, אבל קליפ לא צריך להיות רחוק מדי למטה כפי שהוא יפנה את רפידות blotting, מה שמוביל סופג בלתי יעבור, מאוחר יותר, פינצטה תצטרך להיות מוחזקת מתחת לנקודה זו בעת שחרור קליפ.
- הנח את פינצטה ההקפאה לצלול מחזיק את רשת cryoEM על הזרוע הפנאומטית עם הצד הנכון מול היד הדומיננטית שלך. העיצוב של פינצטה מכשיר הקפאת צלילה ותא הם כאלה כי המדגם ניתן ליישם דרך הצד הימני או השמאלי של התא, על פי היד של המשתמש.
הערה: החלת המדגם בצדדים שונים עם אותם פרמטרים סופגים לעתים רחוקות מביא לתוצאות דומות, כך חוקרים שמאליים ייתכן שיהיה צורך לכוונן את הפרמטרים שלהם סופגת ללא תלות של עמיתיהם הימניים. - לחץ על תהליך התחל והרשת המוחזקת בפינצטה תוכנס לתא ומיכל נוזל הקירור יועלה.
- לחץ על תהליך ופינצטה יעבירו את הרשת למיקום שבו ניתן להשתמש בצינור כדי להחיל את הדגימה על הרשת. פתח את היציאה הצדדית הפונה לצד הנכון של הרשת והחל דגימה על ידי צנרת, ודא כי קצה pipette אינו נוגע ברשת כפי שהוא עלול להוביל לנזק של תמיכה ברשת / כיפוף הרשת, אבל לחלק את הנוזל קרוב מספיק, כך טיפה מוותר על הרשת. בדרך כלל, 3-5 μL מוחל.
- לחץ על המשך ופרמטרים מוגדרים מראש של המשתמש יכתימו את הרשת ולאחר מכן יצללו את הפינצטה עם רשת המותקנת לתוך נוזל הקירור להתחדשות מדגם. פינצטה תרד בשילוב עם הזרוע מחזיקה את מיכל נוזל הקירור ואת נוזל הקירור, שמירה על הרשת שקועה בקריוגן.
- העבר את הרשת מכוס הקריוגן לתיבת אחסון הרשת השקועה ב- LN2.
- לנתק את פינצטה מזרוע פינצטה, תוך דאגה רבה לא ליצור קשר עם הרשת vitrified עם הצדדים של קריוגן. כוונן את האחיזה כך שהפנצטה תוחזק בנוחות. במהירות ובזהירות ככל האפשר, להעביר את הרשת מן הקריוגן ל LN2. ביד אחת, החזק את פינצטה סגורה באמצעות האצבעות שלך וביד השנייה, להחליק את הקליפ השחור כלפי מעלה מהדרך, מחזיק את פינצטה סגורה. התאם מחדש את האחיזה וטפל ברשת לתוך תיבת האחסון של הרשת.
- חזור על שלבים 1.10-1.19 עד שכל הרשתות נוצרות (הפעלה טיפוסית תכלול יצירת רשתות 4-12). אחסן את כל תיבות אחסון הרשת המכילות רשתות ב- LN2 dewar עד לשלבים הבאים.
2. רשתות חיתוך לטעינה למיקרוסקופ של טעינה אוטומטית
- קליפ רשתות לתוך הרכבה autogrid על פי הפרוטוקול שתואר בעבר 28.
3. התחברות מרחוק מאובטחת למיקרוסקופים
הערה: עם פקדי COVID-19 בזמן הכתיבה, אך גם עם חששות סביבתיים הקשורים לנסיעות בינלאומיות, מתקני מיקרוסקופיה נוספים מציעים שירותים שבהם המשתמש פועל מרחוק. שיטת היישום לכך תשתנה בהתאם לתצורת ה- IT המקומית של כל מתקן, ולצרכים של קהילת המשתמשים הפנימית והחיצונית שלו. כאן מתואר התהליך לגישה מרחוק ל- cryoEMs ב- eBIC ושליטה במיקרוסקופ באמצעות תוכנת EPU.
- היכנס מרחוק ל- cryoEM. כניסה מרחוק מתווכת באמצעות תוכנת NoMachine כדי לגשת למחשב התמיכה במיקרוסקופ ותצורתה נקבעה לאפשר גישה רק למשתמשים הרשומים בביקור באמצעות אישורי הכניסה של FedID למשתמשים. Access נשאר פעיל רק למשך ההפעלה.
- פתח את NoMachine והתחל חיבור NX חדש כדי nx-cloud.diamond.ac.uk עם אימות סיסמה.
- פתח את החיבור והיכנס באמצעות שם המשתמש fedid@fed.cclrc.ac.uk וסיסמה של FedID. לחץ פעמיים על הסמל המתאים למיקרוסקופ הרלוונטי מהאפשרויות הזמינות כדי לפתוח חיבור למחשב התמיכה הרלוונטי.
- הזן שם משתמש clrc\FedID וסיסמה במסך הכניסה של Windows.
- פתח את תוכנת TeamViewer מסמל שולחן העבודה והתחבר ל- PartnerID: TEM עם הסיסמה שסופקה. פעולה זו קובעת את החיבור ממחשב התמיכה למחשב TEM. ניתן להשתמש בלחצן הצג הבא ברצועת הכלים TeamViewer כדי לעבור בין ממשק המשתמש של המיקרוסקופ לבין חלון ה- EPU.
- לאחר מכן ניתן לשלוט בפונקציות מיקרוסקופ על ידי משתמשים ישירות דרך ממשק EPU.
4. טעינת דגימות למיקרוסקופ של טעינה אוטומטית והקרנה לקרח ולאיכות המדגם
הערה: בסעיף זה מיקרוסקופ עם טוען אוטומטי ותוכנת EPU משמש להקרנה לדוגמה, אך ניתן להשיג זאת באמצעות תוכנה אחרת ומערכת הזנה צדדית ו- cryoEMs מיצרני אחרים.
- טען רשתות חתוכה לתוך המיקרוסקופ autoloader כפי שתואר בעבר28.
- בכרטיסיה טעינה אוטומטית של ממשק המשתמש של המיקרוסקופ, עבור את תיבת הדו-שיח אפשרויות באמצעות החץ ולחץ על לחצן מלאי . פעולה זו תבדוק ברצף כל מיקום בקלטת כדי לקבוע אם קיימת מחסנית. חריצים תפוסים יסומנו בכחול. אם כל החריצים הכבושים מופו, לחץ שוב על לחצן המלאי כדי להפסיק לאחר המיקום הנוכחי, אחרת השאר את הפעלה עד למיפוי כל החריצים הכבושים. סמן את כל החריצים הכבושים עם הפרטים לדוגמה בתיבות שסופקו.
- סמן את הרשת שיש להעביר לעמודת המיקרוסקופ ולחץ על טען. תווית החריץ תהפוך מכחול לצהוב לאחר שרשת הטעינה בהצלחה על הבמה. המשך לסנן את הרשתות.
- פתח תוכנת EPU. בדף הכנה , בחר רכישה אופטית והגדרות ולאחר מכן בחר את הקביעה המוגדרת מראש אטלס מהתפריט הנפתח. בחרו קביעות קרן מוגדרות מראש מתאימות (למשל, 64x mag נומינלי, ספוט בגודל 5, Microprobe, עם אזור מואר בטווח המקביל לגלאי פלקון - למידע נוסף לבחירת קביעות קרן מוגדרות מראש see28). הקש Set כדי לדחוף את הפרמטרים למיקרוסקופ.
- לחץ על פתח שסתומי עמודה והכנס את מסך הפלומה. בדוק כי קרן גלויה ומופצת מספיק ומרוכזת כדי לכסות את הגלאי. במידת הצורך, נווטו לאזור דק יותר ברשת באמצעות הג'ויסטיק או תפריט הבמה כדי לשלוט בתנועות הבמה ב- X וב- Y.
- הרימו את מסך ה-Flu ולכו תמונה באמצעות לחצן 'תצוגה מקדימה ' ב-EPU. בהתבסס על התמונה שנרכשה, ניתן להגדיל את המינון על ידי מעבר לגודל ספוט מספר נמוך יותר, ולהיפך.
- ב - EPU, עבור אל הדף אטלס והקש על הפעלה חדשה. בחר תבנית תמונת MRC והזן שם תיקיה ומיקום מתאימים לשמירת הפעלת ההקרנה ולאחר מכן לחץ על החל.
- בחר הקרנה מהתפריט מימין. סמן את תיבות הסימון לצד כל רשת כדי לרכוש מונטאז' אטלס. התחל את הפעלת ההקרנה ב- EPU. אטלס יירכש עבור כל רשת מסומנת, עם מספר ריבועי רשת זמינים המפורטים עם השלמתם. ניתן לצפות בכל אטלס על-ידי הדגשתו בעמוד ההקרנה, עם סימון המציג ריבועי רשת עם עובי קרח צפוי דומה המקובצים לפי צבע.
- בסיום, סקור את האטלסים שנאספו וזיהה את הרשתות המתאימות להערכת איכות המדגם בהגדלות גבוהות יותר (כלומר, אלה עם מספר מתאים של ריבועי רשת שאינם יבשים ואינם מוסתרים על ידי קרח עבה). סמן את הרשת שנבחרה בתפריט ההקרנה EPU ולחץ על טען דוגמה.
- השתמשו בקביעות הגדרת הקרן המוגדרות מראש (ראו 28 להסבר על קביעות הקרן המוגדרות מראש הרצויות לכל שלב) ובפונקציות התצוגה המקדימה כדי לבחון את ריבועי הרשת הרצויים ביתר פירוט.
- מתפריט ההקרנה אטלס, בחר את הרשת שנטענה כעת והזז את הבמה לריבוע רשת המכיל חורים מלאים על-ידי לחיצה באמצעות לחצן העכבר הימני על המיקום הרצוי בתמונת הרשת ובחירה עבור עבור לריבוע רשת.
- חזרו ל-EPU, לדף ההכנה ובחרו בקביעות המוגדרות מראש של GridSquare .
- פתחו את הדף EPU, פונקציות אוטומטיות והפעלו את ההטיה האוטומטית-אוצנטרית לפי שלב עם הקביעה המוגדרת מראש GridSquare כדי להעביר את הדגימה לגובה האוצנטרי.
הערה: ניתן גם להטות אוטומטית של eucentric על ידי קרן, שהיא מהירה יותר אך בדרך כלל פחות מדויקת מאשר הטיה אוטומטית של אוצנטרית לפי שלב. - ב- EPU, Preparation, צלם תמונת תצוגה מקדימה חדשה של GridSquare. שים לב לערכים האפורים השונים על פני חורים שונים המציינים עובי קרח שונה. הזז את הבמה מעל חור באמצעות לחיצה ימנית > להזיז את השלב כאן. בחרו את הקביעה המוגדרת מראש של גובה חור/אוצנטרי ותצוגה מקדימה.
הערה: בהתאם למשקל המולקולרי ולצורה של חלקיק העניין, ייתכן שניתן יהיה לזהות אותו בהגדלת גובה חור / Eucentric. - בחר קביעה מוגדרת מראש של רכישת נתונים והגדר הגדלה המאפשרת זיהוי קל של החלקיקים (המתאים לדגימה של אובייקט של בדרך כלל <2 Å/פיקסל). הגדר את היסט ההיסט ל- ~-3 עד -5 מיקרומטר עם מינון אלקטרונים חשיפה של ~ 40-80 e-/ Å2.
- יש לחזור על שלבים ב-4.4 כדי להעריך טווח של עובי קרח להתפלגות חלקיקים, כיוון וזיהום על פני הרשת. התפלגות החלקיקים עשויה להשתנות קרוב לקצוות לעומת מרכז החור ולכן חשוב לסקור מיקומים שונים עם החור.
- מסך את כל הרשתות המציגות הבטחה מאטלסים כבעלי ריבועי רשת מספיקים. שמור אותם במיקרוסקופ והמשיך לרכישת נתונים באמצעות EPU, או פרק את הדגימות מהמיקרוסקופ ואחסן תחת LN2 עד לתוזמנת איסוף הנתונים.
5. איסוף נתונים של קריום חלקיקים יחידים (עם דגש על פעולה מרחוק)
הערה: פרוטוקול מפורט לרכישת נתונים עם EPU מתואר במדריך היצרנים ובמקומות אחרים28. כאן מודגשים שינויים בפרוטוקול זה לפעולה מרחוק (כלומר צמצום השימוש בלוחות היד לביצוע משימות ושימוש בחלופות מבוססות תוכנה).
- אלא אם כן אחד כבר נאסף במהלך הפגישה, לאסוף אטלס עבור הרשת.
- הגדר כל אחת מההגדרות המוגדרות מראש של הקרן בהתאם לצרכים הניסיוניים של הפרויקט.
- בצע כיול הזזת תמונה28.
- הגדר את הפעלת ה- EPU.
- ב-EPU, בחרו דף EPU ולאחר מכן 'הגדרת הפעלה', בחרו 'הפעלה חדשה' ולאחר מכן 'חדש' מהעדפות.
- בחר הפעלה חדשה תופיע תופיע הפעלה מוקפצת המספקת אפשרות להשתמש בהגדרות קודמות. Yes תטען באופן אוטומטי את ההגדרות מה- EPU הקודם (כלומר, ספק הדגימה, טווח ההשבתה, הגדרות מיקוד אוטומטי, סוג רשת) להפעלת EPU הנוכחית. בחירה באפשרות חדש מהעדפות מאפשרת למשתמש לבחור קובץ עם העדפות שמורות (כלומר, טווח נטרול, הגדרות מיקוד אוטומטי, סוג רשת) ומידע זה ייטען מראש ל- EPU.
- מלא את שם ההפעלה במשהו אינפורמטיבי. המתקן המקומי עשוי להציע מוסכמה למתן שמות.
- בסוג, בחר ידני.
- עבור מצב רכישה, בחר מיקוד חורים מדויק או רכישה מהירה יותר.
- בתבנית תמונה, בחר תבנית רצויה.
- בחר תיקיית אחסון מתאימה ו- EPU ייצור ספריה בשם ההפעלה.
- בחר את מנשא הדגימה המתאים לפיו נעשה שימוש בסוג הרשת ובמרווח בין חורים (למשל, Quantifoil 1.2/1.3) והקש על החל. פרוטוקול זה מתאר את התהליך ליצירת תבנית עבור מערך קבוע של חורים
- בחר ריבוע רשת התחלתי והגדר תבנית רכישה.
- עבור בחירה מרובעת, אם כל הריבועים ירוקים, לחץ על בטל את הבחירה בכל הימני העליון.
- פתח אריחים (לחץ באמצעות לחצן העכבר הימני > אריח פתוח). בחר ריבוע (לחץ באמצעות לחצן העכבר הימני > להוסיף, לחץ באמצעות לחצן העכבר הימני > העבר את השלב לריבוע הרשת).
- עבור אל בחירת חור ולחץ על אוטומטי Eucentric. המתן עד להשלמת פעולה זו ותמונה של ריבוע רשת צולמה. אם ההפעלה האוטומטית נכשלת זה יכול להיות בגלל הגובה כבוי באופן משמעותי; אם כן, ניתן לכוונן אותו באופן ידני באמצעות FluScreen בהגדלה מרובעת רשת.
- מדוד גודל חור. הזז ולהתאים את העיגולים הצהובים כך שהם מעל החורים עם גודל ומרווח נכונים.
- לחץ על מצא חורים. בדוק כי החורים נמצאו כראוי. אם לא לשנות את גודל החור ולמצוא חורים שוב. חזור על כך עד שהוא מוצא את החור כראוי. אם הוא נכשל בעקביות, שקול לעבור לגודל ספוט נמוך יותר (בהיר יותר) בהגדלה מרובעת של רשת.
- השתמש בהיסטוגרמה של איכות הקרח Filter בצד ימין כדי להתאים את בחירת החורים. זה יכול להיות שימושי כדי לא לכלול אזורים עם קרח עבה וקרח דק. אפשרות זו תיזכר עבור ריבועי רשת עתידיים שנבחרו במהלך הפעלה זו.
- מטב את בחירת החורים בעזרת הכלים בתפריט בחירה בחלק העליון. לדוגמה, לחץ על הסר חורים קרוב לסרגל הרשת.
- עבור אל הגדרת תבנית והקש על רכוש.
- לחץ על חיפוש וחור מרכזי. עכשיו תהיה תמונה של חור עם עיגול צהוב סביב החור.
הערה: אם הוא מתקשה למצוא את החור, הכנס את הצמצם האובייקטיבי. אם הוא עדיין לא מוצא את החור, נסה להגדיל את זמן החשיפה עבור קביעת הגובה החור/אוצנטרית מראש או להגדיל את ההשבתה עבור קביעה מוגדרת מראש זו או bin התמונה. שינוי נטרול גדול עשוי לשנות את יישור הסטת התמונה. - שנה את זמני ההשהיה לאחר הסטת השלב ואת זמני ההשהיה לאחר הזזת התמונה ל- 1-5 שניות.
- בדוק שערך הסטת התמונה המרבי (אם האפשרות זמינה) הוא לפי הרצון. אם נעשה שימוש באוסף הסטייה חופשי של תמונה, ערך זה מוגדר בקובץ התצורה של EPU, אחרת 5 מיקרומטר הוא ערך סטנדרטי.
- לחץ על הוסף אזור רכישה ולאחר מכן לחץ במקום כלשהו בתמונה. הזז את אזור הרכישה למיקום הרצוי (כלומר, בקצה חור) כך שאזורי הרכישה לא ייחשפו כפליים עם הקרן (הריבוע בעיגול הירוק מייצג את שטח הגלאי, העיגול הירוק הוא קוטר הקרן).
- בצד ימין למעלה, הוסף את טווח ההשבתה. לאחר מכן הוסף אזורי רכישה אחרים. רשימת נטרול טיפוסית לפרויקט חלבון ממברנה היא -0.8 עד -3 מיקרומטר נטרול.
- לחץ על הוסף אזור מיקוד אוטומטי ולחץ במקום כלשהו בתמונה. העבר את אזור ההתמקדות האוטומטית לפחמן המקיף חור. הנוהג המקובל הוא למקד אוטומטית לאחר מרכוז בעת שימוש ב- AFIS, או כל 5-15 מיקרומטר, בהתאם לשינוי בגובה z על פני הריבוע.
- לחץ על הוסף אזור מדידת סחף, מדידת סחף המבוצעת פעם אחת בכל ריבוע רשת, כאשר סף מוגדר של 0.05 ננומטר/s הוא הגדרה סטנדרטית. אזור מדידת הסחף יכול (וזה רעיון טוב) לחפוף ישירות עם אזור המיקוד האוטומטי. ודא שאף אזור לא להיסחף ולא אזור מיקוד אוטומטי חופפים לאזור רכישה.
הערה: ניתן לבדוק את התבנית באמצעות פונקציית ביצוע התבנית. זהו רעיון טוב כדי לראות אם אזורי רכישה צריכים לזוז (למשל, יותר מדי / לא מספיק פחמן בתמונות), אבל אין צורך. - חזור לבחירה מרובעת, וברשת בחר את הריבועים לרכישה. השתמש במספר אזורי הרכישה ובקצב רכישת הנתונים הצפוי (ממתקן המבוסס על גלאים והגדרת ניסוי) כדי לחזות כמה אזורי רכישה נדרשים.
- כאשר כל הריבועים הרצויים נבחרים, הקש על הכן את כל הריבועים.
- לאחר איסוף כל ריבוע, נווטו בין ריבועי הרשת והתכוונן היטב את החורים באמצעות מברשת הבחירה.
- עבור למיקום שלב מעל דגימה והשתמש בפונקציות אוטומטיות כדי להגדיר גובה אוצנטרי. בצע יישור מיקרוסקופ כפי שתואר בעבר28, אך במקום לבצע יישור ללא תרדמת ותיקון לאסטיגמציה אובייקטיבית באופן ידני, השתמש בכלי יישור בתוך התוכנה. בקצרה, הגדר תנאי קרן רכישה, להבטיח את הצמצם האובייקטיבי (OA) מוסר ואת השלב ממוקם מעל אזור יציב קרן של דגימה בגובה eucentric. בצע יישור ללא תרדמת בתוך הפונקציות האוטומטיות לפני כניסה מחדש וריכוז של OA ותיקון אסטיגמציה העדשה האובייקטיבית עם EPU. ודא כי שני היישורים מתכנסים על ערכים מתאימים (<150 ננומטר של תרדמת וקרוב לאפס אסטיגמציה.
- לפני תחילת הרכש האוטומטי, ודאו כי משאבת הטורבו האוטומטית כבויה, והצמצם האובייקטיבי מוכנס.
- ברכישה אוטומטית, הקש התחל לפעול כדי להתחיל ברכישת נתונים אוטומטית.
6. עיבוד תמונה כדי להניב מפת צפיפות EM
הערה: רוב מתקני cryoEM מציעים עיבוד מקדים של סרטי מיקרוגרף 'תוך כדי תנועה'. יש מגוון רחב של חבילות תוכנה וגישות זמינות עבור זה כולל צינורות RELION28,33, cryoSPARC43, Scipion34 ו- WarpEM44. צינור מבוסס RELION מתואר כאן וההנחה היא שהמשתמש העביר את סרטי המיקרוגרף למיקום אחסון מתאים עם גישה למשאבי מחשוב. סקירה של התהליך ותוצאות מייצגות עבור פרויקט חלבון ממברנה מסופקים, תיאור מפורט וצעד אחר צעד הדרכה ניתן למצוא בדף הבית RELION: https://www3.mrc-lmb.cam.ac.uk/relion.
- בצע ניתוח 'תוך כדי תנועה' של תיקון תנועה מיקרוגרף והערכה CTF. התחל RELION בתוך ספריית הפרוייקט. תזמן משימות ייבוא, תיקון תנועה והערכת CTF כדי לבצע לולאה כך שהן יעברו במקביל לאיסוף נתונים והעברה. סקריפט ניתוח מיקרוגרף28 מספק משוב חזותי בזמן אמת על אסטיגמציה וערכי נטרול משוערים (ראה תוצאות מייצגות).
- בחר חלקיקים ממיקרוגרפים מעובדים מראש. ישנן מספר חבילות תוכנה אוטומטיות לקטיף חלקיקים לבחירה. אפשרויות איסוף ללא הפניה ומבוססות תבנית זמינות בכרטיסיה איסוף אוטומטי של RELION37. תוכניות אחרות עשויות לשמש עבור שלבים שונים, למשל באמצעות crYOLO עבור קטיף חלקיקים35.
- לחלץ חלקיקים מהמיקרוגרפים המתוקנים של CTF.
הערה: כדי לקצר את הזמן החישובי הנדרש עבור מוקדם, "ניקוי", שלבים עיבוד, בקנה מידה למטה / סל החלקיקים בעת החילוץ. פרטים על אופן ההפעלה של משימת החילוץ ניתן למצוא בערכת הלימוד RELION 3.1. עבור פרויקט זה, חלקיקים היו בתחילה binned על ידי גורם של 2. - בצע ממוצע של מחלקה 2D. סיווג על פני 100-200 מחלקות עובד היטב עבור רוב ערכות הנתונים המכילות ≥100,000 חלקיקים. לא מומלץ להשתמש בהרבה יותר מ-200 כיתות או פחות מ-50 כיתות, גם כאשר ערכות הנתונים קטנות אלא אם כן המדגם בעל סימטריה גבוהה (כלומר, וירוס icosahedral) ובמקרה זה פחות מ-50 שיעורים עדיין עשויים לתת תוצאה טובה. הגדר את קוטר המסכה גדול מספיק כדי להתאים את הממד הארוך ביותר של החלקיק, אבל חזק מספיק כדי לא לכלול חלקיקים שכנים (זה עשוי לדרוש קצת ניסוי וטעייה).
- בחר מחלקות טובות (כלומר, מחלקות עם פרטים מבניים) באמצעות משימת הבחירה של קבוצת המשנה. דוגמאות לממוצעים טובים ורעים של כיתה 2D ניתן למצוא בסעיף תוצאות מייצגות.
- צור מודל ראשוני של דה נובו מהנתונים באמצעות משימת הדגם ההתחלתית בתלת-ממד ב- RELION.
הערה: ערימות חלקיקים פחות נקיות עשויות להפיק תועלת מ- ab initio SGD מרובה ייחוס (ירידה הדרגתית סטוכאסטית) שכן זה מספק הזדמנות נוספת לנפות חלקיקים זבל / תת אופטימלי. בחר קוטר מסיכה שיכול להכיל את חלקיק העניין, ולהשאיר את ערכי ברירת המחדל עבור שדות בכרטיסיה 'SGD' מאז אלה ביצועים שגרתיים היטב. ודא שהמודל הראשוני נראה סביר ב- Chimera (או בתוכנית ויזואליזציה מתאימה אחרת) (ראה תוצאות מייצגות). - בצע סיווג תלת-ממדי כדי לטפל בהטרוגניות בנתונים באמצעות הפלט מהשלב 6.6 כמודל ייחוס. להעריך את המפות המתקבלות כימרה. תהליך ערימות חלקיקים המתאימות למדיונים קונפורמיים ייחודיים באופן עצמאי. השתמש במשימת בחירת קבוצת המשנה כדי לבחור מחלקה/מחלקות של עניין וליצור קבצי particles.star עבור ערימות החלקיקים המשויכות.
- הפעל עידון אוטומטי תלת-ממדי. השתמש בממוצעי המחלקות בתלת-ממד שהושגו בשלב הקודם כהפניות לעידון ערימות החלקיקים המתאימות להן. אם הרזולוציה של עידון מתקרבת לגבול Nyquist של הנתונים, לחלץ מחדש את החלקיקים ללא שינוי קנה מידה למטה. לאחר החילוץ מחדש, חזרו על משימת הזיקוק האוטומטי של תלת-ממד עם מחסנית החלקיקים הלא מאוגדת. במקרה זה, יש לשנות את קנה המידה של מודלי ההתייחסות לתלת-ממד כך שגודל הפיקסל והקופסה יתאים לאלה של תמונות החלקיקים שחולצו מחדש. השתמש בכלי שורת הפקודה relion_image_handler כדי לבצע פעולה זו.
- השתמש בסימטריה בעידון במידת הצורך. אם מפה משוחזרת בעלת סימטריה, יישר את המפה על ציר הסימטריה המתאים באמצעות כלי שורת הפקודה relion_align_symmetry. השתמש במפה המיושרת המתקבלת כהפניה במשימת עידון אוטומטי תלת-ממדית חדשה עם אופרטור הסימטריה המתאים שצוין בכרטיסיית ההפניה.
- חידדו מפות משיפור אוטומטי תלת-ממדי. פעולה זו נעשית באמצעות משימת לאחר העיבוד ב- RELION, אך תחילה יש ליצור מסיכה מתאימה מהמפה המעודנת. השלבים של יצירת מסיכה ועיבוד מפורטים בערכת הלימוד RELION (ראה גם תוצאות מייצגות).
הערה: ניתן לשפר עוד יותר את הרזולוציה של שחזורים רבים באמצעות פונקציות ליטוש בייזי ותיקון CTF ב- RELION. השתמש בסוג העבודה של עידון CTF כדי להעריך ולתקן סטיות בסדר גבוה יותר (הטיית קרן, סטיות רפוי וסטיות בסדר הרביעי ) וכעבודות נפרדות, הגדלה אניזוטרופית ונטרול לכל חלקיק. לאחר מכן, השתמש במשימת הליטוש של בייסיאן (מאומנת או עם ערכי ברירת מחדל) כדי לטפל בתנועה הנגרמת על-ידי קרן על בסיס חלקיק. כפי שנוזכר במדריך RELION 3.1, עבודות אלה ייהנו ככל הנראה מגישה איטרטיבית (CTF-עידון → ליטוש בייסיאנית → עידון אוטומטי → → לאחר העיבוד... לולאה) מכיוון ששניהם נהנים ממודלים ברזולוציה גבוהה יותר. - תקן את מסירות של מפות צפיפות EM במידת הצורך. בדוק את המפות כדי לקבוע אם מסירות נכונות או על ידי ניסיון להתאים מודל אטומי קיים, או הערכת מידות של האזורים האלליים אלפא. במידת הצורך, הפוך את המפה לאורך ציר z ב- UCSF Chimera45 באמצעות הפקודה 'vop zflip'.
תוצאות
בעת ההקרנה, ניתן למחוק רשתות בשלב האטלס, שבו תכונות שנפתרו בהגדלה נמוכה מסמנות את הרשת כמי שאינה מתאימה לרכישת נתונים. לדוגמה, אם רשת הייתה נתונה לנזק מכני משמעותי כאשר רוב ריבועי הרשת נשברו (איור 2A), או כאשר הרשת נראית 'יבשה', ללא קרח זגג (איור 2B). רשתות כאלה ניתנות לזיהוי בדרך כלל מכיוון שקצוות ריבועי הרשת נראים חדים ומובחנים. ברוב הרשתות המיוצרות באמצעות מכשיר ההקפאה של הצלילה, נצפה שיפוע קרח (איור 2C, D). התפלגות החלקיקים, בהתאם לדגימה של עניין, יכול להשתנות באופן דרמטי עם עובי הקרח ולכן הקרנת מגוון של ריבועי רשת כדי להעריך את התפלגות החלקיקים מומלץ. כלים יושמו בתוכנת EPU במהלך שלב סינון האטלס כדי לסייע למשתמש לזהות ריבועי רשת של עובי קרח דומה או שונה, אשר יכול להיות שימושי במיוחד למשתמשים חדשים לבדיקת רשתות cryoEM (איור 2E, F).

איור 2: מונטאז'ים 'אטלס' בהגדלה נמוכה לדוגמה מהפעלות הקרנה. A) רשת שספגה נזק משמעותי כאשר רוב ריבועי הרשת נשברו - לא מתאימים לאיסוף. ב) רשת יבשה ללא קרח עליז - לא מתאימה לאיסוף. C) רשת המדגים שיפוע קרח עם ~ 50% מהרשת שמיש. D) שיפוע קרח עם ~ 33% מהרשת שמיש. הן C והן D, מתאימים לאיסוף נתונים אם לריבועי הרשת השימושיים יש עובי קרח המתאים לאיסוף, ויש מספיק אזורי רכישה כדי לספק את משך הזמן המינימלי של אוסף (למשל, 24 שעות) E) אטלס לדוגמה עם טווח של עובי קרח. ו) אותו אטלס המוצג ב- E אך עם ריבועי רשת מסווגים וצבעוניים על ידי תוכנת EPU לפי עובי הקרח. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בעת סינון התפלגות חלקיקים, ודא כי פרמטרי הדמיה, כגון הגדלה ומינון אלקטרונים כולל, דומים לאלה הצפויים לשמש במהלך רכישת נתונים על מנת לספק תמונה מדויקת של התוצאות הצפויות. במהלך ההקרנה, התפלגות חלקיקים אידיאלית היא חד-ממדית עם מגוון של כיווני חלקיקים הנראים לעין (בהתאם לדגימה ולידע הקיים של המורפולוגיה של החלקיק, זה עשוי להיות מאתגר לברר) (איור 3A). הקרח צריך להיות דק ככל האפשר תוך כדי אירוח הממד הגדול ביותר של החלקיקים, אם הקרח דק מדי הוא יכול להינמס כאשר הוא מואר בקרן האלקטרונים. הדבר גורם לתנועה מוגזמת במיקרוגרף, ויש להימנע מאזורים המציגים מאפיין זה (איור 3B). מניסיון קולקטיבי, אפקט זה הוא הנפוץ ביותר כאשר יש חומר ניקוי במאגר. זה יכול לגרום קרח דק מאוד במרכז החור ולכן חלקיקים ניתן לשלול פיזית נאלץ לכיוון הקצה. אפקט זה נצפה באיור 3C, אך במקרה זה הוא אינו דוגמה קיצונית ותמונות אלה עדיין יתרמו באופן מועיל ערכת נתונים. לבסוף, הקרח צריך להיות שרץ; אל תכלול אזורים ברשת (או ברשתות) שבהם רוב התמונות שצולמו או כולן מציגות קרח גבישי (איור 3D) מרכישת נתונים. לעתים קרובות, קרח לא מרץ נצפה בקצה ריבועי רשת. הקוראים מופנים ביקורות מפורטות של המשתנים שניתן לשנות במהלך vitrification רשת16 ותיאורים של התנהגות חלקיקים בסביבת הסרט הדק46,47 לקבלת מידע נוסף.

איור 3: מיקרוגרפים מייצגים המציגים התפלגות חלקיקים שונה. A) התפלגות 'אידיאלית' של חלקיקים חד-ממדיים המאמצים מגוון אוריינטציות. B) קרח דק מדי באמצע החור שהוא מעוות עם החשיפה לקרן האלקטרונים וגורם לתנועה מוגזמת במיקרוגרף. אפקט זה נצפה לרוב כאשר חומר ניקוי קיים במאגר C) כאשר קרח הוא דק יותר במרכז החור, זה פיזית מוציא חלקיקים מהמרכז, גרימת צפיפות של חלקיקים לכיוון קצה החור. במקרה זה זה לא קיצוני מספיק כדי למנוע תמונות אלה להיות שימושי, אבל זה מרמז שזה שווה הקרנה אזורים מעט עבים יותר. ד) קרח אינו שרץ, אין לאסוף נתונים על אזורים שנראים כמו מיקרוגרף לדוגמה זו. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
עיבוד תמונה תוך כדי תנועה יכול לעזור לאסוף שגיאות ובעיות ברכישת נתונים ולכן מומלץ תמיד במידת האפשר. לדוגמה, תנועה מופרזת בתוך מיקרוגרפים עשויה להצביע על כך שמשאבת הטורבו האוטומטית פעילה, או שנאספים נתונים בריבוע רשת סדוק שבו הקרח נע באופן משמעותי בקרן האלקטרונים, מה שמצביע על כך שיש לדלג על ריבוע הרשת. על זבוב הערכת CTF יכול לחשוף נסיבות שבהן נקודת מיקוד חיובית (ולא defocus) מוחל (שבו תוכניות הערכת CTF ופרמטרים כדי למצוא נקודות אלה משמשים), ולקבוע את שינוי הפאזה שבו צלחת שלב וולטה48 משמש. בצינורות עיבוד התמונות של Fly יש לעתים קרובות סיכום גרפי של הנתונים (איור 4A) כדי להקל על המשתמשים להעריך את איכות המיקרוגרף במהירות ולהחליט אם נדרשים תיקוני איסוף נתונים.
בחירת חלקיקים ממיקרוגרפים, תוך הימנעות מ"תוצאות חיוביות שגויות" כגון זיהום או סרט התמיכה ברשת יכולה לדרוש מיטוב. עם זאת, בוררי חלקיקים כגון crYOLO פועלים לעתים קרובות מספיק טוב באמצעות פרמטרי ברירת המחדל עבור 'מעבר ראשון' של הנתונים (איור 4B), המאפשר התקדמות למחלקה דו-יומית בממוצע שבה ניתן להעריך את איכות הנתונים ואת הסבירות להצלחה במורד הזרם. עבור רוב הפרויקטים, סיווג 2D של ~ > חלקיקי 10k צריך להתחיל לחשוף מחלקות שיש להם פירוט מבנה משני. כדי להמשיך לתל-ממד, שלב הסיווג הדו-ממדי אמור בדרך כלל לחשוף מחלקות המייצגות טווח של כיווני חלקיקים. אם מתגלה כיוון מועדף, ייתכן שיידרשו איטרציות נוספות של הכנת מדגם16 או רכישת נתונים נוספת כאשר המדגם מוטה עשוי להידרש49. יש לבחור את כל המחלקות המציגות פרטי מבנה משניים כדי לעבור לניתוח תלת-ממדי, בעוד חלקיקי 'זבל' מושלכים (איור 4C).
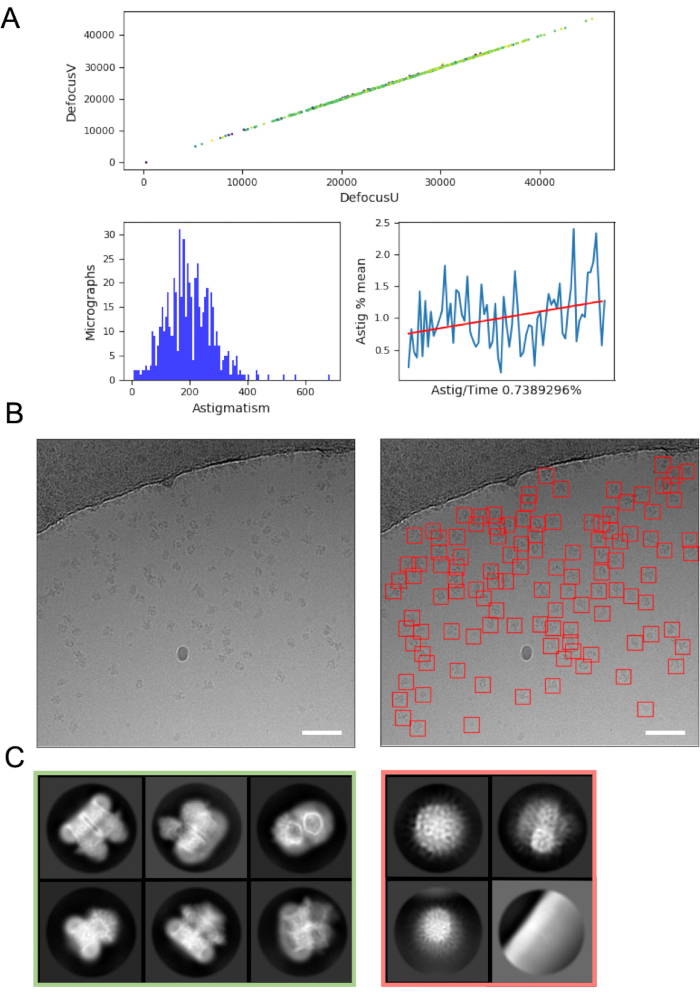
איור 4: שלבים ראשוניים של עיבוד תמונה. A) פלט מקובץ Script של עיבוד תמונה 'תוך כדי תנועה'. ב) מיקרוגרף לדוגמה (משמאל) עם חלקיקים שנבחרו אוטומטית כראוי שזוהו באמצעות המודל הכללי של crYOLO (מימין, עם חלקיקים תחובים בריבועים אדומים) מוטות קנה מידה (לבן) הם 50 ננומטר. ג) תוצאות מסיווג 2D המציגות מחלקות שהושלכו בריבוע האדום, וכיתות שמהן נבחרו חלקיקים לעיבוד נוסף בירוק. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ניתן להשתמש בתת-קבוצה קטנה של חלקיקים ליצירת דגם ראשוני (איור 5A). לאחר מכן ניתן להשתמש במודל התחלתי זה כמודל התחלתי בסיווג ושיפור תלת-ממדיים. במקרה של RagAB, ערכת הנתונים הכילה שלושה קונפורמרים נפרדים שניתן להפרידם במהלך סיווג תלת-ממדי (איור 5B). חלקיקים התורמים לכל אחד משיעורים אלה יכולים להיות מטופלים באופן עצמאי ולהשתמש בהם כדי לחדד מפת צפיפות EM אשר לאחר מכן יכול להיות כפוף לפרשנות נוספת ובניית מודל.
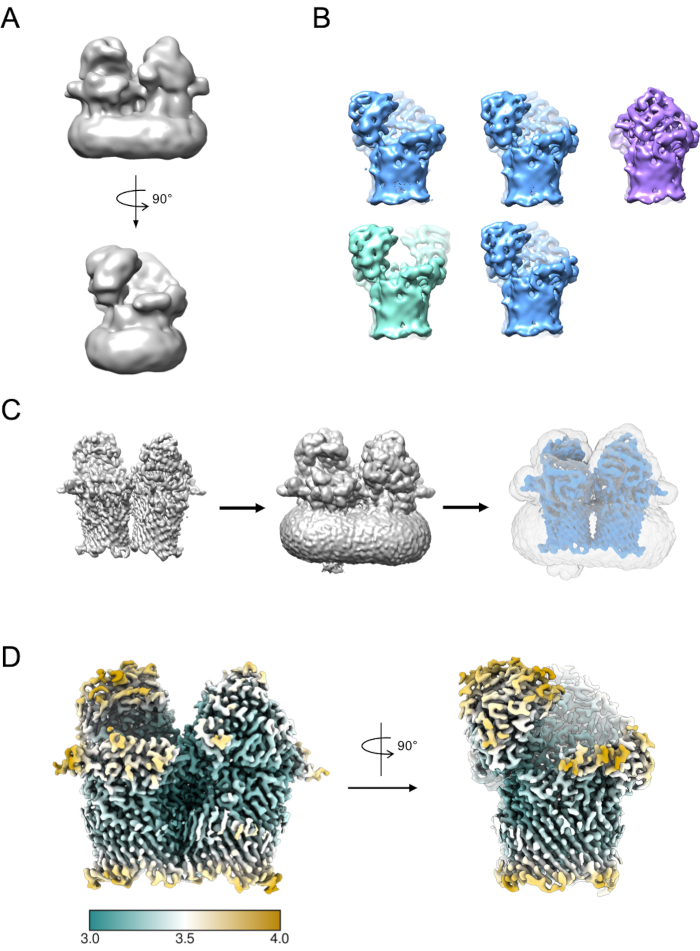
איור 5: יצירת מפת צפיפות EM תלת-ממדית. A) דגם התחלתי אופייני שנוצר באמצעות RELION. ב) סיווג תלת-ממדי על פני 5 מחלקות המציגות הפרדת חלקיקים לשלושה מצבים קונפורמיים נפרדים: פתוח (ירוק), סגור פתוח (כחול), סגור (סגול). ג) תהליך יצירת מסיכה. יש לדמיין את המפה מעידון תלת-ממדי (משמאל) ב כימרה. לאחר מכן ניתן להשתמש במציג עוצמת הקול כדי לזהות את הסף הנמוך ביותר שבו המפה נקייה מצפיפות מתפוררת ורועשת (אמצע). ערך סף זה הוא קלט כסף הבינאריזציה ההתחלתי ב משימת יצירת מסיכת RELION. פלט מסיכה לדוגמה מוצג באפור (מימין). D) מפת צפיפות EM ברזולוציה גבוהה של המצב הפתוח הסגור של RagAB (EMD-10245), מסוננת וצבעונית לפי רזולוציה מקומית (Å). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
בפרוטוקול זה תיארנו צינור בסיסי החל על דגימות המקובלות על ספא שגרתי. בעוד ששיטת כתמי נייר מסנן זו של היווצרות סרט דק ו- vitrification היא ללא ספק מוצלחת בהתחשב בשימוש ברוב המכריע של פרויקטי ספא עד כה, היא מגיעה עם מספר חסרונות. אלה כוללים בזבוז מדגם, צירי הזמן האיטיים (שניות) הנדרשים כדי ליצור את הסרט הדק ולהקפיא את הדגימה, דיווח על חוסר תפוקה27 ודיווח על השפעות שליליות של שימוש בנייר מסנן כדי למחוק עודף נוזל50. לאחרונה פותחו טכנולוגיות חדשות לשיפור יכולת הרבייה של הפקת סרטים דקים51,52. טכנולוגיות אחרות פותחו אשר לקצר את הזמן בין יישום מדגם ו vitrification53,54,55. בעוד ששיטות מבוססות נייר סינון להיווצרות סרט דק נשארות השיטה הנפוצה ביותר להכנת מדגם SPA CryoEM בזמן הכתיבה, טכנולוגיות חדשות אלה עשויות להביא מגוון יתרונות מבחינת יעילות ושחזור של vitrification רשת, כמו גם יצירת הזדמנויות חדשות להביא ממדים ניסיוניים נוספים, כגון רזולוציית זמן וערבוב מהיר לפני vitrification.
תהליך סינון הרשת עבור רוב המשתמשים הוא כיום תהליך איכותי הכולל רכישת אטלסים הגדלה נמוכה ואחריו צילום תמונות הגדלה גבוהה על פני הרשת כדי להעריך את התפלגות החלקיקים. אמנם זוהי גישה חזקה מספיק עבור סוגים מסוימים של דגימה, זה יכול להיות קשה להעריך על ידי העין אם הדגימה היא אכן מה החוקר מקווה לדמיין או יש אוריינטציה מועדפת, למשל עם דגימות קטנות (<200 kDa) או שבו מורפולוגיה ברזולוציה נמוכה מקשה לזהות על ידי העין אם מגוון של התפלגות חלקיקים קיימים. עבור פרויקטים מסוימים, לא ניתן לקבוע אם הדגימה היא כרצונה, לדוגמה, כאשר ליגנד מאוגד או היכן המדגם נבדק כדי להעריך אם ארון משנה קטן (לדוגמה, 10 kDa) עדיין קיים בשיתוף עם קומפלקס. עבור פרוייקטים אלה, צינורות אוטומטיים לחלוטין לניתוח נתונים בשילוב עם אוספים 'קצרים' של 0.5 - 1 שעות, שיכולים להמשיך בשלבי עיבוד תמונה לסיווג 2D או אפילו סיווג ושיפור תלת-ממדי יסייעו לקבוע ביעילות אם יש צורך באיסוף ארוך יותר. צינורות אלה עדיין נמצאים בפיתוח ואינם מיושמים באופן נרחב כיום, אך יש להם פוטנציאל לשפר את היעילות של הקרנת רשת CryoEM, במיוחד עבור דגימות מאתגרות.
שיפורים בגלאי אלקטרונים ישירים, כמו גם שינויים במיקרוסקופיה בשילוב עם התקדמות בעיבוד תמונה כגון איסוף נתוני העברת תמונה, הגבירו את התפוקה והאיכות של תמונות שהופקו במהלך רכישת נתונים. עלייה זו בשיעור איסוף הנתונים מדגישה את הצורך בסינון יסודי של רשתות cryoEM לפני ש-TB רבים של נתונים נרכשים.
CryoEM SPA הפך לטכניקה ביולוגית מבנית מיינסטרים באמת, ובמקרים רבים הגישה 'ללכת אל' עבור סוגים מסוימים של דגימות, כגון קומפלקסים מקרומולקולריים הטרוגניים ושפתיים. בעוד הפרוטוקול כאן מתאר סקירה בסיסית של צינור הספא, כל סעיף מכוסה כאן (vitrification רשת וסינון, cryoEM ועיבוד תמונה) הוא נושא בפני עצמו וראוי לחקירה במהלך פיתוח פרויקט SPA. ככל שמתקדמות טכנולוגיות הכנת הדגימה והמיקרוסקופיה, ואלגוריתמים וגישות חדשות לעיבוד תמונה עולים לרשת, SPA תמשיך להתפתח כצינור, ותסייע לחוקרים להשיג תובנות על מערכות ביולוגיות מורכבות.
Disclosures
לא מדווחים על ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי iNEXT-Discovery (מענק 871037) במימון תוכנית Horizon 2020 של הנציבות האירופית. J. B. R. White ממומן על ידי קרן Wellcome (215064/ Z / 18 /Z). המיקרוסקופים של FEI Titan Krios מומנו על ידי אוניברסיטת לידס (פרס ABSL UoL) וקרן Wellcome (108466/Z/15/Z). אנו מודים לאם איאדנזה על השימוש בתסריט ניתוח המיקרוגרף שלו. אנו מכירים במקור אור יהלום לגישה ותמיכה במתקני cryo-EM במרכז הלאומי להדמיה ביולוגית אלקטרונים (eBIC) בבריטניה הממומן על ידי קרן Wellcome, MRC ו- BBRSC.
Materials
| Name | Company | Catalog Number | Comments |
| Blunt tweezers | Agar Scientific | AGT5022 | |
| Cryo EM round storage box | Agar Scientific | AGG3736 | |
| CryoEM autogrid boxes | ThermoFisher Scientific | 1084591 | |
| CryoEM grids | Quantifoil | N1-C14nCu30-01 | |
| Ethane gas | Boc | 270595-F | |
| LN2 foam dewar | Agar Scientific | AG81760-500 | |
| LN2 storage dewar | Worthington industries | HC 34 | |
| Pipette | Gilson | 10082012 | |
| Pipette tips | Star labs | s1111-1706 | |
| Syringe | BD | BD 300869 | |
| Type II lab water | Suez | select fusion | |
| Vitrobot | ThermoFisher Scientific | 1086439 | |
| Vitrobot filter paper | Whatman | 1001-055 | |
| Vitrobot styrophome container assembly | ThermoFisher Scientific | 1086439 | |
| Vitrobot tweesers | ThermoFisher Scientific | 72882-D | |
| Software | |||
| EPU | ThermoFisher Scientific | 2.8.1.10REL | |
| TEM server | ThermoFisher Scientific | 6.15.3.22415REL | |
| Tia | ThermoFisher Scientific | 5.0.0.2896REL | |
| Titan krios microscope | ThermoFisher Scientific | Titan Krios G2 |
References
- Kuehlbrandt, W. The Resolution Revolution. Science. 343 (6178), 1443-1444 (2014).
- McMullan, G., Faruqi, A. R., Henderson, R. Direct Electron Detectors. Methods in Enzymology. , (2016).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: the nuts and bolts. Current Opinion in Structural Biology. , (2017).
- Lyumkis, D. Challenges and opportunities in cryo-EM single-particle analysis. Journal of Biological Chemistry. , (2019).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. , (2020).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. , (2020).
- Conley, M. J., et al. Calicivirus VP2 forms a portal-like assembly following receptor engagement. Nature. 565 (7739), 377-381 (2019).
- Hesketh, E. L., et al. The 3.3 Å structure of a plant geminivirus using cryo-EM. Nature communications. 9 (1), 2369 (2018).
- Malone, L. A., et al. Cryo-EM structure of the spinach cytochrome b6 f complex at 3.6 A resolution. Nature. 575 (7783), 535-539 (2019).
- Madej, M., et al. Structural and functional insights into oligopeptide acquisition by the RagAB transporter from Porphyromonas gingivalis. Nature Microbiology. , (2020).
- Gallardo, R., et al. Fibril structures of diabetes-related amylin variants reveal a basis for surface-templated assembly. Nature Structural and Molecular Biology. , (2020).
- Scarff, C., et al. Structure of the shutdown state of myosin-2. Nature. , (2020).
- Scarff, C. A., et al. Structure of the protective nematode protease complex H-gal-GP and its conservation across roundworm parasites. PLoS Pathogens. 16 (4), 1008465 (2020).
- Wu, M., Lander, G. C. How low can we go? Structure determination of small biological complexes using single-particle cryo-EM. Current Opinion in Structural Biology. , (2020).
- Khoshouei, M., Radjainia, M., Baumeister, W., Danev, R. Cryo-EM structure of haemoglobin at 3.2 Å determined with the Volta phase plate. Nature Communications. , (2017).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta crystallographica. Section D, Structural biology. 74, 560-571 (2018).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadanza, M. G. Variations on negative stain electron microscopy methods: tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biological procedures online. 6, 23-34 (2004).
- Baker, L. A., Rubinstein, J. L. Radiation Damage in Electron Cryomicroscopy. Methods in enzymology. 481, 371-388 (2010).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (02), 129-228 (1988).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in enzymology. 579, 51-86 (2016).
- Carragher, B., et al. Current outcomes when optimizing ‘standard’ sample preparation for single-particle cryo-EM. Journal of Microscopy. , (2019).
- Naydenova, K., Jia, P., Russo, C. J. Cryo-EM with sub-1 Å specimen movement. Science. , (2020).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in Enzymology. , (2016).
- Thompson, R. F., Iadanza, M. G., Hesketh, E. L., Rawson, S., Ranson, N. A. Collection, pre-processing and on-the-fly analysis of data for high-resolution, single-particle cryo-electron microscopy. Nature protocols. 14 (1), 100-118 (2019).
- Suloway, C., et al. Automated molecular microscopy: the new Leginon system. Journal of Structural Biology. 151 (1), 41-60 (2005).
- Zhang, J., et al. JADAS: A customizable automated data acquisition system and its application to ice-embedded single particles. Journal of Structural Biology. , (2009).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. , (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. , (2019).
- Fernandez-Leiro, R., Scheres, S. H. W. A pipeline approach to single-particle processing in RELION. Acta crystallographica. Section D, Structural biology. 73, 496-502 (2017).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. , (2018).
- Wagner, T., et al. SPHIRE-crYOLO is a fast and accurate fully automated particle picker for cryo-EM. Communications biology. 2 (1), 213-218 (2019).
- Bepler, T., et al. TOPAZ: A Positive-Unlabeled Convolutional Neural Network CryoEM Particle Picker that can Pick Any Size and Shape Particle. Microscopy and Microanalysis. , (2019).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 163 (2018).
- Zivanov, J., Nakane, T., Scheres, S. H. W. A Bayesian approach to beam-induced motion correction in cryo-EM single-particle analysis. IUCrJ. , (2019).
- Cianfrocco, M. A., Kellogg, E. H. What Could Go Wrong? A Practical Guide to Single-Particle Cryo-EM: From Biochemistry to Atomic Models. Journal of Chemical Information and Modeling. , (2020).
- Tagari, M., Newman, R., Chagoyen, M., Carazo, J. M., Henrick, K. New electron microscopy database and deposition system. Trends in Biochemical Sciences. , (2002).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: A public archive for raw electron microscopy image data. Nature Methods. , (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. , (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. , (2019).
- Goddard, T. D., et al. UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Protein Science. 27 (1), 14-25 (2018).
- Klebl, D. P., et al. Need for Speed: Examining Protein Behavior during CryoEM Grid Preparation at Different Timescales. Structure. , (2020).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 32 (2018).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proceedings of the National Academy of Sciences. , (2014).
- Zi Tan, Y., et al. Addressing preferred specimen orientation in single-particle cryo-EMthrough tilting. Nature Methods. , (2017).
- Armstrong, M., Han, B. -. G., Gomez, S., Turner, J., Fletcher, D. A., Glaeser, R. M. Microscale Fluid Behavior during Cryo-EM Sample Blotting. Biophysical Journal. 118 (3), 708-719 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. , (2017).
- Dandey, V. P., et al. Spotiton: New Features and Applications. Journal of Structural Biology. , (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta crystallographica. Section D, Structural biology. 75, 1063-1070 (2019).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. bioRxiv. , (2020).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: From sprays to jets and back. Acta Crystallographica Section D: Structural Biology. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved