Method Article
Криоэлектронная микроскопия с одной частицей: от образца к структуре
В этой статье
Резюме
Определение структуры высокомолекулярных комплексов с помощью криоЭМ стало рутиной для определенных классов белков и комплексов. Здесь этот конвейер обобщается (подготовка образцов, скрининг, сбор и обработка данных), и считыватели направляются к более подробным ресурсам и переменным, которые могут быть изменены в случае более сложных образцов.
Аннотация
Криоэлектронная микроскопия (криоЭМ) является мощным методом определения структуры высокомолекулярных комплексов с помощью анализа одиночных частиц (SPA). Общий процесс включает в себя i) остеклование образца в тонкой пленке, поддерживаемой на криоЭМ-сетке; ii) скрининг образца для оценки распределения частиц и качества льда; iii) если сетка подходит, сбор одного набора данных о частицах для анализа; и iv) обработка изображений для получения карты плотности ЭМ. В этом протоколе представлен обзор для каждого из этих шагов с акцентом на переменные, которые пользователь может изменить во время рабочего процесса, и устранение общих проблем. Поскольку удаленная работа микроскопа становится стандартом во многих учреждениях, будут описаны вариации протоколов визуализации, помогающие пользователям в эффективной работе и визуализации, когда физический доступ к микроскопу ограничен.
Введение
Одиночные частицы КриоЭМ
Чтобы исследовать жизнь на молекулярном уровне, мы должны понимать структуру. Доступны многие методы исследования структуры белка, такие как ЯМР, рентгеновская кристаллография, масс-спектрометрия и электронная микроскопия (ЭМ). На сегодняшний день большинство структур, депонированных в банке данных белка (PDB), были решены с помощью рентгеновской кристаллографии. Однако с 2012 года криоэлектронная микроскопия (криоЭМ) стала основным методом определения структуры белка, и ее использование резко возросло. Общее количество ЭМ-карт, депонированных в банке данных электронной микроскопии (EMDB) (по состоянию на декабрь 2020 года), составило 13 421 по сравнению с 1 566 в 2012 году (рисунок 1, www.ebi.co.uk). В 2012 году количество атомных координат, смоделированных на картах плотности криоЭМ, депонированных в PDB, составляло всего 67, но по состоянию на декабрь 2020 года до сих пор было отложено 2 309 структур, что в 35 раз больше. Этот базовый рост качества и количества создаваемых карт плотности криоЭМ, иногда называемый «революцией разрешения»1, был вызван объединением достижений в нескольких областях: разработкой новых камер для визуализации, известных как прямые электронные детекторы; новое программное обеспечение; и более стабильные микроскопы2,3,4.
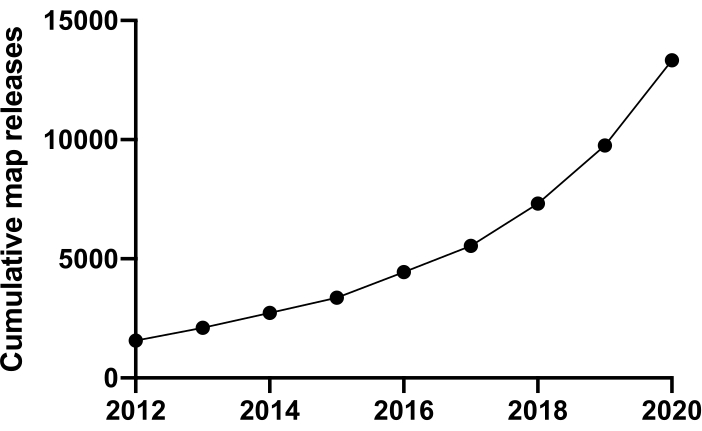
Рисунок 1: Совокупные представления в EMDB с 2012 по декабрь 2020 года. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Анализ одиночных частиц (SPA) является мощным инструментом для получения биологического понимания в широком спектре типов образцов путем выяснения структур высокого разрешения изолированных комплексов5,6, включая вирусы7,8, мембранные белки9,10, спиральные сборки11 и другие динамические и гетерогенные макромолекулярные комплексы12,13, размеры которых варьируются на порядки (от 39 кДа) от 14,15 до десятков мегадальтонн). Здесь описан протокол для стандартного конвейера для cryoEM SPA от образца до структуры.
Прежде чем приступить к работе по этому трубопроводу, очищенный образец должен быть подвергнут биохимическому анализу для оценки его шансов на успех в дальнейшем. Подготовка подходящего образца, возможно, является самым большим препятствием для SPA, особенно для переходных и гетерогенных (как композиционных, так и конформационных) комплексов. Препарат высокомолекулярного комплекса должен содержать как можно меньше загрязняющих веществ, при достаточной концентрации для получения большого количества частиц на каждой микрофотографии криоЭМ и в буферной композиции, хорошо подходящей для криоЭМ-анализа. Некоторые буферные компоненты, включая сахарозу, глицерин и высокие (~> концентрации солей 350 мМ, в зависимости от размера образца, свойств и других буферных составляющих), могут препятствовать процессу витрификации или уменьшать отношение сигнал/шум на изображениях, препятствуя определению структуры16.
Как правило, как минимум, для оценки чистоты образца следует использовать эксклюзионную хроматографию (SEC) и анализ геля SDS-PAGE17,18, но круговой дихроизм, функциональные анализы, SEC в сочетании с многоугольным рассеянием света и анализы термической стабильности являются полезными инструментами для качественного анализа макромолекулярных комплексных препаратов перед анализом криоЭМ. Однако результаты этих биохимических анализов могут дать слабое представление о структурной неоднородности образца и его поведении в криоЭМ-сетке. По этой причине отрицательное окрашивание ЭМ обычно используется в качестве быстрого, дешевого и мощного инструмента для оценки композиционной и конформационной гетерогенности и, следовательно, хорошего способа определения того, какая фракция элюирования из очистки является наиболее перспективной, или скрининга различных буферных композиций19,20. После того, как перспективный образец был идентифицирован, мы можем перейти к конвейеру SPA cryoEM. Отрицательное пятно не всегда совпадает с последующими результатами, наблюдаемыми в криоЭМ; иногда образец выглядит бедным из-за отрицательного пятна, но улучшается, когда его видят в стекловидном льде в криоЭМ. Напротив, иногда образцы выглядят превосходно во время этапов отрицательного окрашивания, но требуют значительной дальнейшей оптимизации при переходе к криоЭМ. Однако в большинстве случаев отрицательное окрашивание обеспечивает полезный этап контроля качества.
Стеклование
Суровая среда в вакуумной системе электронного микроскопа вызывает как обезвоживание, так и радиационное повреждение нефиксированных биологических образцов21. Поэтому, чтобы получить образец в нативном состоянии, биологический образец должен быть сохранен до визуализации. Для очищенных препаратов высокомолекулярных комплексов витрификация является методом выбора, позволяющим его визуализацию с помощью криоЭМ при сохранении атомных деталей комплекса. Открытие витрификации как метода пробоподготовки стало фундаментальным достижением в электронной микроскопии биологических образцов, за что Дубочет был признан в Нобелевской премии по химии 2017 года. Витрификация образца включает в себя создание тонкого слоя раствора, содержащего интересующий образец, обычно толщиной в десятки нм, подвешенного на опоре сетки криоЭМ. Затем тонкая пленка очень быстро замораживается в криогене, таком как жидкий этан, при ~-175 °C. Скорость замерзания составляет ~ 106 ° C / с, достаточно быстро, чтобы образовался аморфный или стекловидный лед, подвешивающий образец в тонкой твердой пленке22.
Начальной переменной, которую следует учитывать, является поддержка сетки криоЭМ selected23. Эм-сетка обычно состоит из аморфной углеродной пленки с перфорациями (регулярными или нерегулярными) над опорной структурой. Опорная конструкция обычно представляет собой круглую металлическую сетку диаметром 3,05 мм, обычно изготовленную из меди, но могут использоваться и другие металлы, такие как золото или молибден (который имеет предпочтительные свойства теплового расширения24). Иногда по всей сетке наносится дополнительная тонкая, непрерывная опора, такая как графен, оксид графена или тонкий (~1-2 нм) аморфный углеродный слой. В то время как стандартные криоЭМ-сетки (чаще всего 400-200-сетчатая медь с перфорированной (круглые отверстия 1,2 мкм, разделенные 1,3 мкм (r1,2/1.3) или 2 мкм, разделенные 2 мкм углерода (r2/2)) углеродной поддержкой - хотя доступно много различных моделей) использовались в подавляющем большинстве структур, о которых сообщалось на сегодняшний день, сообщалось о новых сетевых технологиях с улучшенной проводимостью и уменьшенным перемещением образцов25 . Выбранные сетки подвергаются обработке тлеющим разрядом/плазменной очисткой, чтобы сделать их гидрофильными и поддающимися применению образца26.
После тлеющего разряда следующим этапом является образование тонких пленок. Эта тонкая пленка чаще всего формируется с использованием фильтровальной бумаги для удаления лишней жидкости из сетки. Хотя это может быть выполнено вручную, коммерчески доступен ряд устройств для погружной заморозки, включая Vitrobot Mk IV (Thermo Fisher Scientific), EM GP II (Leica) и CP3 (Gatan). С помощью этих устройств ~3-5 мкл образца в растворе наносят на эм-сетку с последующим смыванием излишков раствора с помощью фильтровальной бумаги. Сетка с тонкой пленкой, подвешенной поперек нее, затем погружается в жидкий этан, охлаждаемый жидким азотом (LN2) до ~-175 °C. После замораживания сетка поддерживается при температуре ниже точки девитрификации (-137 °C) до и во время визуализации.
Скрининг образцов и сбор данных
После витрификации сетки криоЭМ следующим этапом является скрининг сетки для оценки ее качества и определения того, подходит ли сетка для сбора данных с высоким разрешением. Идеальная сетка криоЭМ имеет стекловидный лед (в отличие от кристаллического льда) с толщиной льда, достаточной для размещения самого длинного размера образца, гарантируя, что окружающий лед вносит как можно меньше шума в полученное изображение. Частицы во льду должны иметь размер и (если известно) форму, соответствующую биохимии, и в идеале быть монодисперсными со случайным распределением ориентаций частиц. Наконец, сетка должна иметь достаточно площадей достаточного качества для удовлетворения желаемой длины сбора данных. В зависимости от образца, это может занять много итераций витрификации и скрининга, пока не будут созданы оптимальные сетки. Как к счастью, так и к сожалению, существует огромный диапазон переменных, которые могут быть эмпирически проверены для изменения распределения частиц на криоЭМ-сетках (рассмотрено в 16,27). В этой рукописи показаны репрезентативные результаты для проекта мембранного белка10.
После того, как подходящая сетка была определена, сбор данных может быть продолжен. Несколько моделей криопропускающих электронных микроскопов для биологических образцов оптимизированы для автоматизированного сбора данных с высоким разрешением. Как правило, данные собираются на системах 300 кВ или 200 кВ. Автоматизированный сбор данных может быть достигнут с помощью программного обеспечения, включая EPU (Thermo Fisher Scientific)28, Leginon29, JADAS30 и SerialEM31,32. Автоматизированный сбор данных с помощью современных детекторов обычно приводит к терабайтам (ТБ) необработанных данных в течение 24 часов (средние наборы данных составляют ~ 4 ТБ в размере).
Из-за ограничений COVID-19, действующих в большей части мира (время написания в декабре 2020 года), многие микроскопические учреждения перешли на предоставление удаленного доступа. После того, как сетки были загружены в автозагрузчик микроскопа, сбор данных может проводиться удаленно.
Обработка изображений и построение моделей
Если сеанс сбора данных обычно может составлять 0,5-4 дня, последующая обработка изображений может занять много недель и месяцев, в зависимости от доступности вычислительных ресурсов. Он является стандартным для начальных этапов обработки изображений, а именно для оценки функции коррекции движения и передачи контраста (CTF), которая должна происходить «на лету» 33,34. Для последующей обработки существует множество пакетов программного обеспечения. Частицы «отбираются» и извлекаются из микроснимков35,36. Как только частицы извлечены, стандартный протокол будет состоять в том, чтобы обработать частицы через несколько раундов классификации (как в двух измерениях (2D), так и в трех измерениях (3D) и / или сосредоточиться на конкретных областях, представляющих интерес), чтобы достичь однородного подмножества частиц. Это однородное подмножество частиц затем усредняется вместе, чтобы получить 3D-реконструкцию. На этом этапе данные часто корректируются дополнительно для получения карты максимально возможного качества, например, путем уточнения CTF, коррекции искажений37 и байесовской полировки38. Результатом этой обработки изображения является 3D-криоЭМ-карта интересующего биологического образца. Диапазон разрешения, достигнутый в «стандартном» автоматизированном эксперименте с одной частицей из сетки достаточного качества, с данными, собранными на системе микроскопа 300 кВ, обычно составляет от 10 Å до 2 Å в зависимости от размера и гибкости белкового комплекса. С идеальным образцом разрешения ~1,2 Å теперь достигнуты с помощью рабочих процессов SPA5. Хотя этот протокол подробно описывает шаги по получению карты плотности ЭМ, как только она будет в руках, она может быть дополнительно интерпретирована путем установки и уточнения модели белка (если разрешение < 3,5 Å) или построения de novo39. Данные, связанные с экспериментами по определению структуры, могут быть депонированы в общедоступные онлайн-репозитории, включая карты плотности ЭМ (Банк данных электронной микроскопии)40, результирующие атомные координаты (Банк данных белка)41 и необработанные наборы данных (Архив открытых изображений электронной микроскопии)42.
В этом протоколе в качестве примера макромолекулярного комплекса используется внешнем мембранный белковый комплекс RagAB (~340 кДа) из Porphyromonas gingivalis10 (EMPIAR-10543). Для тех, кто новичок в криоЭМ, поддержка образцов через этот конвейер от образца до структуры доступна, при условии экспертной оценки, через финансируемые схемы доступа, такие как iNEXT Discovery и Instruct.
протокол
1. Витрификация сетки
ПРИМЕЧАНИЕ: Для всех этапов шагов 1 и 2 убедитесь, что все инструменты чистые, сухие и при комнатной температуре, прежде чем охлаждать их до температуры LN2 , используя свежедекатированный LN2 для уменьшения загрязнения льдом. Там, где это возможно, работайте в среде с контролируемой влажностью с < относительной влажностью 20%. Убедитесь, что перед началом работ имеются соответствующие средства индивидуальной защиты и документация H&S.
- Убедитесь, что интересующий образец готов к пробоподготовке.
- Выберите подходящие криоЭМ-сетки и убедитесь, что они стали гидрофильными с помощью тлеющего разряда или плазменной обработки. Доступно большое разнообразие систем и вариаций протокола, но все они включают в себя размещение сеток в системе очистки тлеющего разряда / плазмы и запуск программы, которая будет накачивать камеру до желаемого уровня вакуума, прежде чем вводить в систему конкретную газовую смесь / химический пар или воздух. Электрический ток пропускается через систему, ионизируя частицы газа и заставляя поверхность сеток становиться более гидрофильной.
- Запустите устройство заморозки погружения для витрификации сети, включив систему с помощью выключателя питания на задней панели, и дождитесь загрузки сенсорного экрана.
- С помощью прилагаемого стилуса или пальцев, в консоли установите нужную рабочую температуру камеры (диапазон доступен 4-60 °C, рекомендуется для большинства макромолекул 4-6 °C).
- Наполните увлажнитель 50 мл лабораторной воды типа II с помощью шприца через резиновую трубку на дне увлажнителя. Обязательно удалите весь захваченный воздух в шприце перед заполнением. Будьте осторожны, чтобы не переполнить увлажнитель, иначе вода будет выделяться в камеру. После того, как увлажнитель заполнен, оттяните плунжер шприца на 5-10 мл, чтобы создать вакуумное уплотнение.
- В консоли установите желаемую относительную влажность для камеры (диапазон доступен 0-100%, обычно используется влажность 95-100%). Оставьте влажность «выключенной» до непосредственного изготовления сетки, чтобы камера не стала слишком влажной.
- Получите пинцет и фильтровальную бумагу, вырезанную до нужного размера, чтобы поместиться на прокладках, либо купленные, либо с помощью штампа для резки отверстия соответствующего размера.
- Подготовьте криоген к погружной заморозке.
- Поместите металлический держатель криотрешетки, криогенную чашку и металлические ножки паука в контейнер охлаждающей жидкости.
- Охладите контейнер, заполнив внешнюю камеру LN2. Держите внешнюю камеру заправленной, чтобы покрыть верхнюю часть держателя криотетчатого ящика. Добавьте ~ 1 см дополнительного LN2 в криогенную чашку, чтобы помочь уравновешиванию системы до температуры LN2 .
ПРИМЕЧАНИЕ: Антизагрязняющее кольцо может быть использовано для ограничения конденсации влажного воздуха вокруг криогенной чашки и приведения к загрязнению криохладагеном / этаном. Обычно это не требуется в среде с контролируемой влажностью. При использовании кольца защиты от загрязнения будьте осторожны, чтобы не переполнить контейнер LN2 , иначе он может пролиться, когда кольцо вдавливается в контейнер позже в процессе. - Подождите 3-5 минут, чтобы наблюдать за кипением ног паука, а затем подождите еще 3 минуты, чтобы убедиться, что чашка криогена достаточно холодная, чтобы конденсировать среду витрификации.
- Разжижайте криоген (жидкий этан) в чашку криогена.
- Возьмите трубу этанового цилиндра с тонкой трубкой и соплом для дозирования газа. Наконечник пипетки P200 с отверстием, открытым путем отсечения самого наконечника с помощью лезвия бритвы, здесь идеален. Более широкое отверстие необходимо для предотвращения затвердевания этана на кончике и блокирования потока газа.
- Убедившись, что криогенная чашка не содержит оставшегося LN2, возьмите газовое сопло этана и поместите его в криогенную чашку. Используя регулятор газового баллона, запустите низкий поток и дозируйте криогенный газ в криогенную чашку для конденсации газа. Держите наконечник, из которого течет газ, непосредственно прижатым к стенке криогенной чашки, но осторожно перемещайте его вперед и назад постукивающим движением по поверхности. Регулируйте поток газа, чтобы позволить низкому, устойчивому потоку начать конденсироваться / сжижаться контролируемым образом в криогенной чашке.
- Заполните чашку чуть ниже серебряного края паука и остановите поток газа, затем осторожно удалите газовую магистраль, чтобы избежать загрязнения окружающего LN2 этаном.
- Доливайте контейнер охлаждающей жидкости LN2, стараясь не пролить его в жидкий этан.
- Оставьте ноги пауков в положении на ~ 3-5 мин, чтобы убедиться, что жидкий этан уравновешен до достаточно холодной температуры. Криоген начнет выглядеть мутным/слегка непрозрачным. Это указывает на то, что он близок к своей точке замерзания. На этом этапе используйте пинцет для удаления паука. Пока LN2 хранится в контейнере, окружающем криогенную чашку, этан теперь будет оставаться сжиженным и пригодным для витрификации в течение 1-2 ч. Тем не менее, стремитесь завершить процедуру как можно быстрее, особенно в помещениях без контроля влажности, чтобы уменьшить загрязнение льдом.
ПРИМЕЧАНИЕ: Если паук кажется «застрявшим», используйте металлический предмет, такой как гайка, и прижмитесь к ногам паука, чтобы слегка согреть их, а затем удалите ноги.
- Подготовьте устройство для замораживания погружения и аксессуары для витрификации образцов.
- Добавьте коробки для хранения сетки к металлическому держателю криотеточного ящика и на протяжении всей процедуры убедитесь, что LN2 поддерживается до уровня чуть выше уровня коробок сетки (обычно каждые ~ 5 минут).
- На экране устройства заморозки погружения в поле Параметры процесса введите выбранные параметры, в том числе: время промокания (время, когда площадки устройства замораживания погружения соберутся вместе), усилие (расстояние от сетки, которое изменяет градиент образования льда) и общее (количество раз, когда пятнистые площадки будут встречаться). Выберите эти параметры на основе индивидуального устройства замораживания погружения и поведения макромолекулы. Типичными значениями являются сила пятна между 0 и 5, время блоттинга от 1-6 с и общее количество пятен 1. Типичное время ожидания (время между началом блоттинга и началом блоттинга) и время слива (время после блоттинга перед погружением) составляет 0-2 с.
ПРИМЕЧАНИЕ: В зависимости от предпочтений пользователя могут быть выбраны дополнительные опции в разделе «Параметры», «Разное », в том числе «Использовать ножную педаль » для перехода к следующему шагу при каждом нажатии, «Пропустить передачу сетки » (пропускает последний шаг, где рука пинцета слегка приподнята), «Отключить влажность во время процесса» (пока применяется образец, останавливает активное увлажнение камеры, что может затруднить просмотр сетки) и Autoraise Ethanelift (сочетает в себе ступень поднятия пинцета в камеру и подъема контейнера охлаждающей жидкости - пропускает ступень подъема этанового контейнера ). Здесь все эти параметры включены. - Надежно поместите контейнер охлаждающей жидкости на рычаг движущейся платформы под камерой
- Вставьте свежую промокательную бумагу на каждую руку блоттера, убедившись, что пластиковые кольцевые зажимы закреплены. Каждая фильтровальная бумага допускает 16 пятен (руки вращают промокательную бумагу). Нажмите кнопку Сбросить блок-бумагу в разделе Элементы управления .
- Запустите 1 полный цикл процесса витрификации погружного морозильного устройства, чтобы убедиться, что каждая движущаяся часть ведет себя так, как ожидалось.
- Нажмите (или используйте ножную педаль), чтобы поместить новую сетку, затем Запустить процесс, затем Обработать , затем Продолжить. На этом этапе следите за тем, чтобы пятна рук контактировали друг с другом, как и ожидалось.
- Включите увлажнитель воздуха. Будет вырабатываться водяной пар (при условии, что установленная влажность выше, чем в настоящее время в камере).
- Интересующий образец теперь может быть остеклован. Используйте ножную педаль или Поместите новую сетку , и погружной стержень спустится из камеры, позволяя пинцету быть прикрепленным к креплению.
- Используя пинцет устройства погружной заморозки, подберите желаемую сетку криоЭМ с разряженным тлеющим разрядом / плазменной очисткой, позаботившись о том, чтобы отметить, какая сторона является правильной стороной для использования для применения образца в соответствии с производителем сетки. Подберите сетку за обод, позаботившись о том, чтобы избежать чрезмерного / ненужного контакта с пинцетом, так как это повредит опору. Закрепите сетку в пинцете, переместив черный зажим вниз к ребристой части пинцета. Сетка должна быть надежно закреплена, но зажим не должен быть слишком далеко внизу, так как он будет контактировать с блоттинговыми подушечками, что приведет к невоспроизводимому пятну, и, позже, пинцет нужно будет удерживать ниже этой точки при отпускании клипа.
- Поместите пинцет с устройством замораживания погружения, удерживающий сетку cryoEM, на пневматический рычаг правильной стороной, обращенной к вашей доминирующей руке. Конструкция погружного морозильного устройства пинцета и камеры такова, что образец может быть нанесен либо через правую, либо через левую сторону камеры, в зависимости от руки пользователя.
ПРИМЕЧАНИЕ: Применение образца на разных сторонах с одинаковыми параметрами блоттинга редко приводит к сопоставимым результатам, поэтому исследователям-левшам может потребоваться настроить свои параметры блоттинга независимо от своих коллег-правшей. - Процесс запуска нажатия и сетка, удерживаемая в пинцете, будут приняты в камеру, и контейнер охлаждающей жидкости будет поднят.
- Нажмите Process , и пинцет переместит сетку в положение, где пипетка может быть использована для нанесения образца на сетку. Откройте боковой порт, обращенный к правильной стороне сетки, и нанесите образец путем пипетки, убедившись, что наконечник пипетки не касается сетки, так как это может привести к повреждению опоры сетки / изгибу сетки, но распределите жидкость достаточно близко, чтобы капля дозировала на сетку. Обычно применяется 3-5 мкл.
- Нажмите Продолжить , и заданные пользователем параметры промокнут сетку, а затем погружают пинцет с сеткой, установленной в чашке охлаждающей жидкости для витрификации образца. Пинцет будет опускаться вместе с рычагом, удерживающим контейнер охлаждающей жидкости и охлаждающую жидкость, удерживая сетку погруженной в криоген.
- Перенесите сетку из криогенной чашки в ячейку для хранения сетки, погруженную в LN2.
- Отсоедините пинцет от руки пинцета, уделяя большое внимание тому, чтобы не соприкасаться остекленной сеткой с боками криогенной чашки. Отрегулируйте рукоятку так, чтобы пинцет держался удобно. Как можно быстрее и тщательнее переместите сетку с криогена на LN2. Одной рукой держите пинцет закрытым пальцами, а другой рукой сдвиньте черный зажим вверх с дороги, держа пинцет закрытым. Отрегулируйте захват и манипулируйте сеткой в ящик для хранения сетки.
- Повторяйте шаги 1.10-1.19 до тех пор, пока не будут сделаны все сетки (типичный сеанс будет включать в себя создание 4-12 сеток). Храните все ячейки для хранения сетки в LN2 dewar до следующих этапов.
2. Обрезка сетки для загрузки в микроскоп автозагрузчика
- Зажимайте сетки в сборку автосетки в соответствии с протоколом, описанным ранее 28.
3. Безопасный удаленный вход в микроскопы
ПРИМЕЧАНИЕ: С контролем COVID-19 на момент написания статьи, а также с экологическими проблемами, связанными с международными поездками, все больше учреждений микроскопии предлагают услуги, где пользователь работает удаленно. Метод реализации для этого будет варьироваться в зависимости от локальной ИТ-конфигурации каждого объекта и потребностей его внутреннего и внешнего сообщества пользователей. Здесь описан процесс удаленного доступа к криоЭМ в eBIC и управления микроскопом через программное обеспечение EPU.
- Удаленно войдите в криоЭМ. Удаленный вход в систему опосредован с помощью программного обеспечения NoMachine для доступа к ПК поддержки микроскопа и настроен на разрешение доступа только пользователям, зарегистрированным при посещении через учетные данные входа пользователей FedID. Доступ остается активным только в течение всего сеанса.
- Откройте NoMachine и запустите новое подключение NX, чтобы nx-cloud.diamond.ac.uk с аутентификацией по паролю.
- Откройте подключение и войдите в систему, используя имя пользователя fedid@fed.cclrc.ac.uk и пароль FedID. Дважды щелкните значок, соответствующий соответствующему микроскопу, из доступных опций, чтобы открыть подключение к соответствующему вспомогательному ПК.
- Введите имя пользователя clrc\FedID и пароль на экране входа в Windows.
- Откройте программное обеспечение TeamViewer со значка рабочего стола и подключитесь к PartnerID: TEM с предоставленным паролем. При этом устанавливается подключение вспомогательного ПК к ПК ТЕА. Кнопка Next Monitor на ленте TeamViewer может использоваться для переключения между пользовательским интерфейсом микроскопа и окном EPU.
- Затем функции микроскопа могут контролироваться пользователями непосредственно через интерфейс EPU.
4. Загрузка образцов в микроскоп автозарядчика и скрининг на лед и качество образцов
ПРИМЕЧАНИЕ: В этом разделе микроскоп с автозагрузчиком и программным обеспечением EPU используется для скрининга образцов, но это может быть достигнуто с помощью другого программного обеспечения и системы бокового входа и криоЭМ других производителей.
- Загрузите обрезанные сетки в автозагрузчик микроскопа, как описано ранее28.
- На вкладке автозагрузчика пользовательского интерфейса микроскопа с помощью стрелки откройте диалоговое окно Параметры и нажмите кнопку Инвентарь . Это будет последовательно проверять каждую позицию в кассете, чтобы определить, присутствует ли картридж. Занятые слоты будут помечены синим цветом. Если все занятые слоты были сопоставлены, нажмите кнопку Inventory еще раз, чтобы остановиться после текущего положения, в противном случае оставьте работу до тех пор, пока все занятые слоты не будут сопоставлены. Пометьте все занятые слоты с деталями образца в прилагаемых коробках.
- Выделите сетку для переноса в столбец микроскопа и нажмите кнопку Загрузить. Метка слота превратится из синего в желтый после успешной загрузки сетки на сцену. Перейдите к экранированию сеток.
- Откройте программное обеспечение EPU. На странице Подготовка выберите Оптика и параметры сбора , а затем выберите в раскрывающемся меню стиль Atlas . Выберите соответствующие предустановки настройки луча (например, 64x номинальный магнит, размер пятна 5, Микрозонд, с освещенной областью в параллельном диапазоне для детектора Falcon - для получения дополнительной информации о выборе предустановок настройки луча см. 28). Нажмите Set (Установить ), чтобы отправить параметры в микроскоп.
- Нажмите Открыть клапаны колонки и вставьте FluScreen. Убедитесь, что луч виден и достаточно распространен и центрирован, чтобы покрыть детектор. При необходимости перейдите в более тонкую область сетки с помощью джойстика или меню стадии для управления движениями стадий в X и Y.
- Поднимите экран FluScreen и сделайте снимок с помощью кнопки «Предварительный просмотр» в EPU. Исходя из полученного изображения, дозу можно увеличить, перейдя на меньший размер пятнистого пятна, и наоборот.
- В EPU перейдите на страницу Atlas и нажмите New Session (Новая сессия). Выберите формат изображения MRC и введите подходящее имя папки и расположение для сохранения сеанса скрининга, затем нажмите « Применить».
- Выберите Скрининг в меню слева. Установите флажки рядом с каждой сеткой, чтобы получить атласный монтаж. Начните сеанс скрининга в EPU. Для каждой проверенной сетки будет получен атлас с указанием ряда доступных квадратов сетки по завершении. Каждый атлас можно просмотреть, выделив его на странице скрининга, в комплекте с разметкой, показывающей квадраты сетки с аналогичной прогнозируемой толщиной льда, сгруппированной по цвету.
- По завершении просмотрите собранные атласы и определите сетки, пригодные для оценки качества проб при более высоком увеличении (т.е. сетки с соответствующим количеством квадратов сетки, которые не являются ни сухими, ни скрытыми толстым льдом). Выделите выбранную сетку в экранном меню EPU и нажмите кнопку Загрузить образец.
- Используйте предустановки настройки луча (см. 28 для объяснения предустановок настройки луча, необходимых для каждого этапа) и функцию предварительного просмотра, чтобы более подробно изучить желаемые квадраты сетки.
- В экранном меню «Атлас» выберите загруженную в данный момент сетку и переместите сцену в квадрат сетки, содержащий заполненные отверстия, щелкнув правой кнопкой мыши нужное место на изображении сетки и выбрав «Переместить в квадрат сетки».
- Вернитесь на страницу EPU, Подготовка и выберите предустановку GridSquare .
- Откройте страницу EPU, Auto Functions и запустите Auto-eucentric by stage tilt с предустановленной настройкой GridSquare , чтобы переместить образец на эйцентрическую высоту.
ПРИМЕЧАНИЕ: Также доступен автоматический эйцентрический наклон луча, который быстрее, но, как правило, менее точен, чем автоматический эйцентрический наклон по шагу. - В EPU, Подготовка, возьмите новое изображение предварительного просмотра GridSquare. Обратите внимание на различные значения серого цвета в разных отверстиях, указывающие на различную толщину льда. Переместите рабочую область через отверстие, щелкнув правой кнопкой мыши > переместите сцену здесь. Выберите предустановленную высоту отверстия/эйцентрика и предварительный просмотр.
ПРИМЕЧАНИЕ: В зависимости от молекулярной массы и формы интересующей частицы, ее можно идентифицировать при увеличении hole/Eucentric Height. - Выберите Предустановленный параметр «Сбор данных» и установите увеличение, которое позволяет легко идентифицировать частицы (соответствующие выборке объектов обычно <2 Å/пиксель). Установите смещение дефокуса на ~-3-5 мкм с экспозиционной электронной дозой ~40-80 e-/ Å2.
- Итерация шагов в 4.4 для оценки диапазона толщины льда для распределения, ориентации и загрязнения частиц по всей сетке. Распределение частиц может варьироваться близко к краям по отношению к центру отверстия, и, следовательно, важно исследовать различные места с отверстием.
- Экранируйте все сетки, которые показывают перспективы из атласов как имеющие достаточные квадраты сетки. Либо храните их в микроскопе и приступайте к сбору данных с помощью EPU, либо выгружайте образцы из микроскопа и храните под LN2 до тех пор, пока не будет запланирован сбор данных.
5. Сбор данных криоЭМ по отдельным частицам (с акцентом на дистанционное управление)
ПРИМЕЧАНИЕ: Подробный протокол сбора данных с помощью EPU описан в руководстве по изготовлению и в других местах28. Здесь выделены модификации этого протокола для удаленной работы (а именно сокращение использования ручных панелей для выполнения задач и использование программных альтернатив).
- Если он еще не был собран во время сессии, соберите атлас для сетки.
- Определите каждый из предустановок настройки луча в соответствии с экспериментальными потребностями проекта.
- Выполните калибровку сдвига изображения28.
- Настройте сеанс EPU.
- В EPU выберите страницу EPU , затем Настройка сеанса, выберите Новый сеанс, затем Создать из настроек.
- Выберите Новый сеанс появится всплывающее окно с возможностью использования предыдущих настроек. Yes автоматически загрузит настройки из предыдущего EPU (т.е. носитель образца, диапазон расфокусировки, настройки автофокусировки, тип сетки) в текущий сеанс EPU. Выбор «Создать» из настроек позволяет пользователю выбрать файл с сохраненными настройками (например, диапазон дефокусировки, настройки автофокусировки, тип сетки), и эта информация будет предварительно загружена в EPU.
- Заполните название сеанса чем-нибудь информативным. Местный объект может предложить соглашение об именовании.
- В поле Тип выберите Вручную.
- В режиме «Захват» выберите точное центрирование отверстий или более быстрое получение.
- В поле Формат изображения выберите нужный формат.
- Выберите соответствующую папку хранилища, и EPU создаст каталог с именем сеанса.
- Выберите соответствующий носитель образца, в соответствии с которым используется тип сетки и расстояние между отверстиями (например, Quantifoil 1.2/1.3) и нажмите кнопку Применить. Этот протокол описывает процесс генерации шаблона для обычного массива отверстий
- Выберите начальный квадрат сетки и задайте шаблон сбора.
- Перейти к выделению квадратов, если все квадраты зеленые, нажмите «Отменить выделение всех» в левом верхнем углу.
- Открыть плитки (щелкните правой кнопкой мыши > открыть плитку). Выберите квадрат (щелкните правой кнопкой мыши > добавить, щелкните правой кнопкой мыши > Переместить этап в квадрат сетки).
- Перейдите в раздел Выбор отверстий и нажмите Auto Eucentric. Подождите, пока это не будет завершено и не будет получено изображение квадрата сетки. Если автофункция не работает, это может быть связано с тем, что высота значительно снижена; если это так, его можно настроить вручную с помощью FluScreen при увеличении Grid Square.
- Измерьте размер отверстия. Перемещайте и корректируйте желтые круги так, чтобы они располагались над отверстиями с правильным размером и расстоянием.
- Нажмите Найти отверстия. Проверьте, правильно ли найдены отверстия. Если нет, измените размер отверстия и найдите отверстия снова. Повторяйте это до тех пор, пока не найдете отверстие правильно. Если он постоянно терпит неудачу, рассмотрите возможность перехода к меньшему размеру (более яркого) пятна при увеличении квадрата сетки.
- Используйте гистограмму качества льда Фильтр справа, чтобы настроить выбор отверстий. Это может быть полезно для исключения участков с толстым льдом и тонким льдом. Это запомнится будущим квадратам сетки, выбранным в ходе этой сессии.
- Оптимизируйте выделение отверстий с помощью инструментов в меню «Выбор» вверху. Например, щелкните Удалить отверстия рядом с панелью сетки.
- Перейдите в определение шаблона и нажмите Приобрести.
- Нажмите Найти и центрировать отверстие. Теперь будет изображение отверстия с желтым кругом вокруг отверстия.
ПРИМЕЧАНИЕ: Если он изо всех сил пытается найти отверстие, вставьте объективную диафрагму. Если он по-прежнему не может найти отверстие, попробуйте увеличить время экспозиции для предустановленной высоты отверстия / эйцентрической высоты или увеличить расфокусировку для этого предустановки или сжать изображение. Значительное изменение расфокусировки может изменить выравнивание смещения изображения. - Измените время задержки после сдвига этапа и задержки после сдвига изображения на 1-5 с.
- Установите флажок Максимальное значение сдвига изображения (если опция доступна) по желанию. Если используется коллекция сдвигов изображений без аберрации, это значение определяется в конфигурационном файле EPU, в противном случае 5 мкм является стандартным значением.
- Нажмите Добавить область сбора, затем щелкните в любом месте изображения. Переместите область захвата в нужное место (т.е. на краю отверстия) таким образом, чтобы области захвата не подвергались двойному воздействию луча (квадрат в зеленом круге представляет область детектора, зеленый круг - диаметр луча).
- В правом верхнем углу добавьте диапазон расфокусировки. Затем добавьте другие области приобретения. Типичный список расфокусировки для проекта мембранного белка составляет от -0,8 до -3 мкм расфокусировки.
- Нажмите Добавить область автофокусировки и щелкните в любом месте изображения. Переместите область автофокусировки в углерод, окружающий отверстие. Стандартной практикой является автофокусировка после центрирования при использовании AFIS или каждые 5-15 мкм, в зависимости от изменения высоты z по квадрату.
- Нажмите Добавить область измерения дрейфа, измерение дрейфа выполняется один раз на квадрат сетки, с установленным порогом 0,05 нм / с является стандартной настройкой. Область измерения дрейфа может (и это хорошая идея) перекрывать непосредственно с областью автофокусировки. Убедитесь, что ни область дрейфа, ни область автофокусировки не перекрывают область приобретения.
ПРИМЕЧАНИЕ: Шаблон можно проверить с помощью функции выполнения шаблона. Это хорошая идея, чтобы увидеть, нуждаются ли области приобретения в перемещении (например, слишком много / недостаточно углерода на изображениях), но это не обязательно. - Вернитесь к выделению квадратов и на сетке выберите квадраты для получения. Используйте количество областей сбора и ожидаемую скорость сбора данных (с объекта на основе детекторов и экспериментальной установки), чтобы предсказать, сколько областей сбора требуется.
- Когда все нужные квадраты выбраны, нажмите Подготовить все квадраты.
- После сбора каждого квадрата перемещайтесь между квадратами сетки и точно настраивайте отверстия с помощью кисти выделения.
- Переместитесь на сцену над образцом и используйте автоматические функции для установки эйцентрической высоты. Выполняйте выравнивание микроскопа, как описано ранее28, но вместо того, чтобы выполнять выравнивание без комы и коррекцию объективного астигматизма вручную, используйте инструменты выравнивания в программном обеспечении. Вкратце, установите условия захвата луча, убедитесь, что объективная апертура (OA) удалена, а ступень расположена над устойчивой областью луча образца на эйцентрической высоте. Выполните выравнивание без комы в рамках автофункций перед повторной вставкой и центрированием ОА и коррекцией астигматизма объектива с помощью EPU. Убедитесь, что оба выравнивания сходятся на подходящих значениях (<150 нм комы и близкого к нулю астигматизма.
- Перед началом автоматического запуска сбора убедитесь, что турбонасос автозагрузчика выключен и вставлена объективная апертура.
- В разделе Автоматическое получение нажмите кнопку Начать запуск , чтобы начать автоматический сбор данных.
6. Обработка изображений для получения карты плотности EM
ПРИМЕЧАНИЕ: Большинство криоЭМ-объектов предлагают предварительную обработку микроснимков «на лету». Для этого существует широкий спектр программных пакетов и подходов, включая конвейеры RELION28,33, cryoSPARC43, Scipion34 и WarpEM44. Здесь описан конвейер на основе RELION, и предполагается, что пользователь переместил фильмы на микрофотографии в соответствующее место хранения с доступом к вычислительным ресурсам. Представлен обзор процесса и репрезентативные результаты для проекта мембранного белка, подробное описание и пошаговое руководство можно найти на домашней странице RELION: https://www3.mrc-lmb.cam.ac.uk/relion.
- Выполняйте «на лету» анализ коррекции движения микрофотографии и оценки CTF. Запустите RELION в каталоге проекта. Запланируйте задания импорта, коррекции движения и оценки CTF таким образом, чтобы они совпадали со сбором и передачей данных. Сценарий анализа микрофотографии28 обеспечивает визуальную обратную связь в режиме реального времени об астигматизме и предполагаемых значениях расфокусировки (см. репрезентативные результаты).
- Собирайте частицы из предварительно обработанных микроснимков. Существует ряд автоматизированных пакетов программного обеспечения для сбора частиц на выбор. Параметры выбора без ссылок и на основе шаблонов доступны на вкладке Автоподбор RELION37. Другие программы могут использоваться для различных этапов, например, с использованием crYOLO для сбора частиц35.
- Извлекайте частицы из микроснимков с коррекцией CTF.
ПРИМЕЧАНИЕ: Сократить вычислительное время, необходимое для ранней «очистки», этапов обработки, уменьшения масштаба / бункера частиц при извлечении. Подробную информацию о том, как запустить задание извлечения, можно найти в учебнике RELION 3.1. Для этого проекта частицы были первоначально скреплены в 2 раза. - Выполните усреднение 2D-классов. Классификация по 100-200 классам хорошо работает для большинства наборов данных, содержащих ≥ 100 000 частиц. Не рекомендуется использовать более 200 классов или менее 50 классов, даже если наборы данных невелики, если выборка не имеет высокой симметрии (т. Е. Икосаэдрический вирус), и в этом случае менее 50 классов все еще могут дать хороший результат. Установите диаметр маски, достаточно большой, чтобы вместить самый длинный размер частицы, но достаточно плотный, чтобы исключить любые соседние частицы (это может потребовать некоторых проб и ошибок).
- Выберите хорошие классы (т.е. классы со структурными деталями) с помощью задания выбора подмножества. Примеры хороших и плохих средних значений 2D-классов можно найти в разделе репрезентативных результатов.
- Создайте начальную модель de novo из данных с помощью задания начальной 3D-модели в RELION.
ПРИМЕЧАНИЕ: Менее чистые стеки частиц могут извлечь выгоду из уточнения мульти-эталонного ab initio SGD (стохастический градиентный спуск), поскольку это дает дополнительную возможность отсеивать мусорные /неоптимальные частицы. Выберите диаметр маски, который может вместить интересующую частицу, и оставьте значения по умолчанию для полей на вкладке «SGD», поскольку они обычно работают хорошо. Убедитесь, что исходная модель выглядит разумно в Chimera (или другой подходящей программе визуализации) (см. репрезентативные результаты). - Выполните 3D-классификацию для устранения неоднородности данных, используя выходные данные шага 6.6 в качестве эталонной модели. Оцените полученные карты в Химере. Технологические стеки частиц, соответствующие уникальным конформационным состояниям, независимо друг от друга. Используйте задание выбора подмножества для выбора интересующего класса/классов и создания файлов particles.star для связанных стеков частиц.
- Запустите 3D-автофинировку. Используйте средние значения 3D-классов, полученные на предыдущем шаге, в качестве ссылок для уточнения соответствующих им стеков частиц. Если разрешение уточнения приближается к пределу данных Найквиста, повторно извлеките частицы без уменьшения масштаба. После повторной экстракции повторите задание 3D-автоочистки с несвязанным стеком частиц. В этом случае эталонные 3D-модели должны быть перемасштабированы таким образом, чтобы размеры пикселей и коробок соответствовали размерам повторно извлеченных изображений частиц. Для выполнения этой операции используйте средство командной строки relion_image_handler.
- При необходимости используйте симметрию при уточнении. Если реконструированная карта обладает симметрией, выровняйте карту по соответствующей оси симметрии с помощью инструмента командной строки relion_align_symmetry. Используйте результирующую выровненную карту в качестве ссылки в новом 3D-задании автоочистки с соответствующим оператором симметрии, указанным на вкладке ссылки.
- Заточка карт из 3D-автофинировки. Это делается с помощью задания постобработки в RELION, но сначала из уточненной карты должна быть создана подходящая маска. Этапы создания и постобработки маски подробно описаны в учебнике RELION (см. также репрезентативные результаты).
ПРИМЕЧАНИЕ: Разрешение многих реконструкций может быть дополнительно улучшено с использованием функций байесовской полировки и уточнения CTF в RELION. Используйте тип задания уточнения CTF для оценки и корректировки аберраций более высокого порядка (наклон луча, аберрации трилистника и аберрации 4-го порядка) и, в качестве отдельных заданий, анизотропного увеличения и расфокусировки на частицу. После этого используйте байесовское задание полировки (обученное или со значениями по умолчанию) для решения проблемы движения, вызванного пучком, на основе частицы. Как указано в учебнике RELION 3.1, эти задания, вероятно, выиграют от итеративного подхода (CTF-уточнение → байесовской полировки → 3D-автоочистки → постобработки → ... loop), поскольку оба выигрывают от моделей с более высоким разрешением. - При необходимости исправьте вручение карт плотности ЭМ. Изучите карты, чтобы определить, является ли рука правильной, либо пытаясь соответствовать существующей атомной модели, либо оценивая управляемость альфа-спиральных областей. При необходимости переверните карту вдоль оси Z в UCSF Chimera45 с помощью команды 'vop zflip'.
Результаты
При скрининге сетки могут быть отброшены на этапе атласа, где объекты, разрешенные при низком увеличении, отмечают сетку как непригодную для сбора данных. Например, если сетка подверглась значительным механическим повреждениям, при этом большинство квадратов сетки было сломано (рисунок 2A), или когда сетка кажется «сухой», без стекловидного льда (рисунок 2B). Такие сетки обычно идентифицируются, поскольку края квадратов сетки кажутся четкими и отчетливыми. На большинстве решеток, выполненных с помощью погружного морозильного устройства, наблюдается градиент льда (рисунок 2C, D). Распределение частиц, в зависимости от интересующего образца, может резко варьироваться в зависимости от толщины льда, и поэтому рекомендуется скрининг ряда квадратов сетки для оценки распределения частиц. На этапе скрининга атласа в программном обеспечении EPU были внедрены инструменты, помогающие пользователю идентифицировать квадраты сетки аналогичной или различной толщины льда, что может быть особенно полезно для пользователей, которые являются новичками в изучении криоЭМ-сетей (рисунок 2E, F).

Рисунок 2: Пример монтажей «атласа» с низким увеличением из сеансов скрининга. А) Сетка, которая получила значительный ущерб, при этом большинство квадратов сетки сломано - непригодна для сбора. Б) Сухая сетка без стекловидного льда - непригодна для сбора. C) Сетка, демонстрирующая градиент льда с ~ 50% используемой сетки. D) Градиент льда с ~ 33% используемой сетки. Как C , так и D подходят для сбора данных, если пригодные для использования квадраты сетки имеют толщину льда, подходящую для сбора, и имеется достаточно областей сбора для удовлетворения минимальной продолжительности сбора (например, 24 ч) E) Пример атласа с диапазоном толщин льда. F) Тот же атлас, представленный в E, но с квадратами сетки, классифицированными и окрашенными программным обеспечением EPU в соответствии с толщиной льда. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
При скрининге распределения частиц убедитесь, что параметры визуализации, такие как увеличение и общая доза электронов, аналогичны тем, которые, как ожидается, будут использоваться при сборе данных, чтобы обеспечить точную картину ожидаемых результатов. Во время скрининга идеальное распределение частиц является монодисперсным с видимым диапазоном ориентаций частиц (в зависимости от образца и существующих знаний о морфологии частицы, это может быть трудно установить) (рисунок 3A). Лед должен быть как можно более тонким, вмещая частицы наибольшего размера, если лед слишком тонкий, он может растаять при освещении электронным пучком. Это вызывает чрезмерное движение на микрофотографии, и следует избегать областей, которые отображают эту характеристику (рисунок 3B). Исходя из коллективного опыта, этот эффект чаще всего наблюдается, когда в буфере есть моющее средство. Это может привести к очень тонкому льду в центре отверстия, и поэтому частицы могут быть физически исключены и вытеснены к краю. Этот эффект наблюдается на рисунке 3C, но в данном случае это не экстремальный пример, и эти изображения все равно будут полезно вносить свой вклад в набор данных. Наконец, лед должен быть стекловидным; исключить любые области сетки (или сетки), где большинство или все сделанные изображения показывают кристаллический лед (рисунок 3D) из сбора данных. Часто нестеклевидный лед наблюдается на краю квадратов сетки. Для получения дополнительной информации читателям предлагается ознакомиться с подробными обзорами переменных, которые могут быть изменены во время витрификации сетки16, и описаниями поведения частиц в тонкопленочной среде46,47.

Рисунок 3: Репрезентативные микроснимки, показывающие различные распределения частиц. А) «Идеальное» распределение монодисперсных частиц, принимающих диапазон ориентаций. Б) Чрезмерно тонкий лед в середине отверстия, который деформируется при воздействии электронного пучка, вызывающего чрезмерное движение на микрофотографии. Этот эффект чаще всего наблюдается, когда моющее средство присутствует в буфере C) Там, где лед тоньше в центре отверстия, это физически исключает частицы из центра, вызывая скопление частиц к краю отверстия. В этом случае это не достаточно экстремально, чтобы предотвратить эти изображения, но это говорит о том, что стоит отсеивать немного более толстые области. Г) Лед не стекловидный, данные не должны собираться по областям, которые выглядят как этот пример микрофотографии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обработка изображений на лету может помочь выявить ошибки и проблемы с получением данных, и поэтому всегда рекомендуется, где это возможно. Например, чрезмерное движение в пределах микроснимков может указывать на то, что турбонасос автозагрузчика активен, или данные собираются на трещиноватом квадрате сетки, где лед значительно перемещается в электронном пучке, что указывает на то, что квадрат сетки должен быть пропущен. На лету оценка CTF может выявить обстоятельства, при которых применяется положительная точка фокусировки (а не расфокусировка) (где используются программы и параметры оценки CTF для поиска этих точек), и определить сдвиг фазы, где используется фазовая пластина Volta48. Конвейеры обработки изображений «на лету» часто включают графическое резюме данных (рисунок 4A), чтобы облегчить пользователям быструю оценку качества микрофотографии и решить, требуются ли поправки к сбору данных.
Отбор частиц из микроснимков, избегая при этом «ложных срабатываний», таких как загрязнение или пленка поддержки сетки, может потребовать оптимизации. Тем не менее, средства выбора частиц, такие как crYOLO, часто работают достаточно хорошо, используя параметры по умолчанию для «первого прохода» данных (рисунок 4B), что позволяет перейти к усреднению 2D-классов, где может быть легче оценить качество данных и вероятность последующего успеха. Для большинства проектов 2D-классификация ~> 10k частиц должна начать выявлять классы, которые имеют вторичную структуру деталей. Чтобы перейти к 3D, этап 2D-классификации обычно должен раскрывать классы, представляющие диапазон ориентаций частиц. Если выявлена предпочтительная ориентация, может потребоваться больше итераций подготовки образца16 или дальнейшего сбора данных с наклоном образца49. Все классы, которые показывают детали вторичной структуры, должны быть выбраны для перехода к 3D-анализу, в то время как «мусорные» частицы отбрасываются (рисунок 4C).
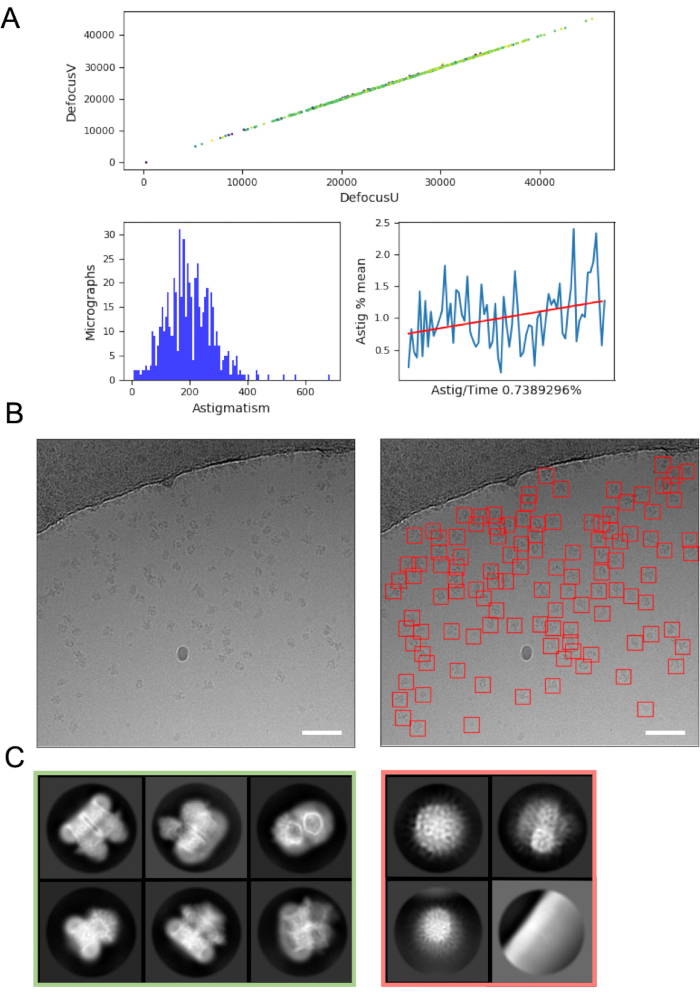
Рисунок 4: Начальные этапы обработки изображений. A) Вывод из скрипта обработки изображений «на лету». B) Пример микрофотографии (слева) с соответствующим образом автоматически подобранными частицами, идентифицированными с использованием общей модели crYOLO (справа, с частицами, ограниченными красными квадратами) Шкала (белая) составляет 50 нм. C) Результаты 2D-классификации, показывающие классы, которые были отброшены в красный квадрат, и классы, из которых были выбраны частицы для дальнейшей обработки зеленым цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Небольшое подмножество частиц может быть использовано для создания исходной модели (рисунок 5A). Эта начальная модель затем может быть использована в качестве исходной модели в 3D-классификации и уточнении. В случае RagAB набор данных содержал три различных конформера, которые могут быть разделены во время 3D-классификации (рисунок 5B). Частицы, вносящие вклад в каждый из этих классов, затем могут быть обработаны независимо и использованы для уточнения карты плотности ЭМ, которая затем может быть подвергнута дальнейшей интерпретации и построению модели.
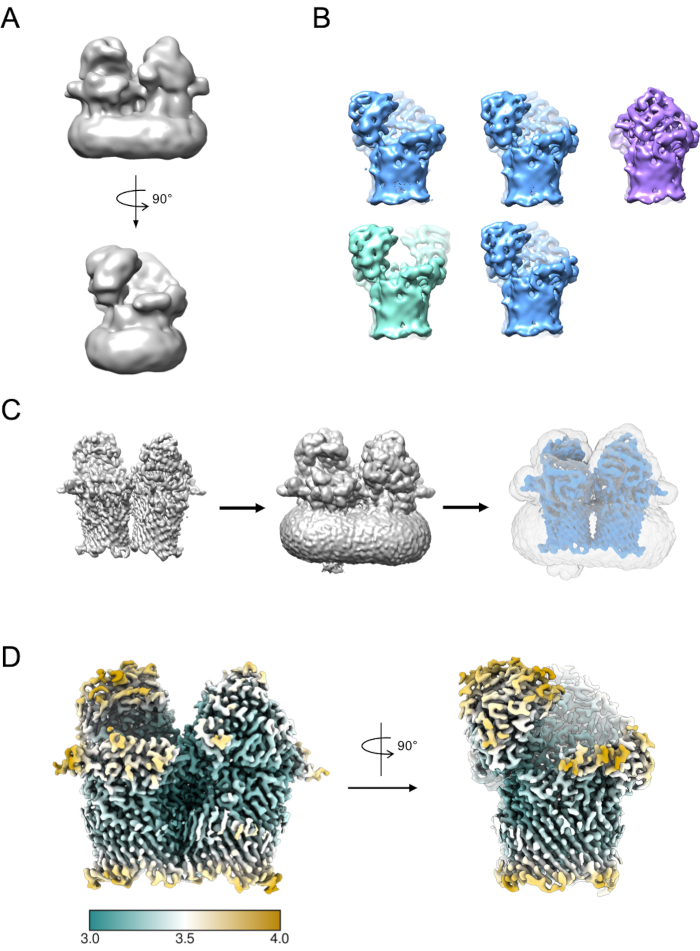
Рисунок 5: Создание карты плотности 3D EM. A) Типичная исходная модель, сгенерированная с помощью RELION. B) 3D-классификация по 5 классам, показывающая разделение частиц на три различных конформационных состояния: открыто-открытое (зеленое), открытое-закрытое (синий), закрытое-закрытое (фиолетовое). В) Процесс создания маски. Карта из 3D уточнения (слева) должна быть визуализирована в химере. Затем вьюер томов может быть использован для определения самого низкого порога, при котором карта свободна от разрозненной, шумной плотности (средняя). Это пороговое значение вводится в качестве начального порога бинаризации в задании создания маски RELION. Пример вывода маски показан серым цветом (справа). D) Карта плотности ЭМ высокого разрешения открытого-закрытого состояния RagAB (EMD-10245), отфильтрованная и окрашенная локальным разрешением (Å). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этом протоколе мы описали базовый конвейер, применимый к образцам, поддающимся рутинному SPA. Хотя этот метод промокания тонкой пленки и витрификации фильтровальной бумаги, несомненно, является успешным, учитывая его использование в подавляющем большинстве проектов SPA на сегодняшний день, он имеет ряд недостатков. К ним относятся потери образца, медленные временные рамки (секунды), необходимые для формирования тонкой пленки и замораживания образца, сообщения о невоспроизводимости27 и сообщения о негативных последствиях использования фильтровальной бумаги для смывания лишней жидкости50. В последнее время были разработаны новые технологии для улучшения воспроизводимости тонкопленочного производства51,52. Были разработаны и другие технологии, которые сокращают время между нанесением образца и витрификацией53,54,55. В то время как методы тонкопленочного образования на основе фильтровальной бумаги остаются наиболее распространенным методом пробоподготовки SPA cryoEM на момент написания статьи, эти новые технологии могут принести ряд преимуществ с точки зрения эффективности и воспроизводимости витрификации сетки, а также создать новые возможности для привнесения дополнительных экспериментальных измерений, таких как временное разрешение и быстрое смешивание до витрификации.
Процесс скрининга сетки для большинства пользователей в настоящее время является качественным процессом, который включает в себя получение атласов с низким увеличением с последующим получением изображений с высоким увеличением по всей сетке для оценки распределения частиц. Хотя это достаточно надежный подход для некоторых типов образцов, может быть трудно оценить на глаз, действительно ли образец является тем, что исследователь надеется изобразить, или имеет предпочтительную ориентацию, например, с небольшими (<200 кДа) образцами или там, где морфология с низким разрешением затрудняет идентификацию на глаз, если присутствует диапазон распределений частиц. Для некоторых проектов невозможно определить, является ли образец желаемым, например, где лиганд связан или где образец проверяется для оценки того, присутствует ли небольшая (например, 10 кДа) субъединица в связи с комплексом. Для этих проектов полностью автоматизированные конвейеры для анализа данных в сочетании с «короткими» 0,5 - 1-часовыми коллекциями, которые могут проходить через этапы обработки изображений до 2D-классификации или даже 3D-классификации и уточнения, помогут эффективно определить, оправдана ли более длинная коллекция. Эти трубопроводы все еще находятся в стадии разработки и в настоящее время не получили широкого распространения, но они могут повысить эффективность скрининга сетки криоЭМ, особенно для сложных образцов.
Усовершенствования в прямых электронных детекторах, а также модификации в микроскопии в сочетании с достижениями в области обработки изображений, такими как сбор данных о сдвиге изображения, увеличили пропускную способность и качество изображений, полученных во время сбора данных. Это увеличение скорости собираемых данных подчеркивает необходимость тщательного скрининга криоЭМ-сетей перед получением многих ТБ данных.
CryoEM SPA стал по-настоящему распространенным методом структурной биологии, и во многих случаях подходом «перейти к» для некоторых классов образцов, таких как гетерогенные и лабильные макромолекулярные комплексы. В то время как протокол здесь описывает базовый обзор конвейера SPA, каждый раздел, рассматриваемый здесь (витрификация и скрининг сетки, криоЭМ и обработка изображений), является отдельной темой и заслуживает изучения во время разработки проекта SPA. По мере развития технологий подготовки образцов и микроскопии, а также появления новых алгоритмов и подходов к обработке изображений SPA будет продолжать развиваться как конвейер, помогая исследователям в получении понимания сложных биологических систем.
Раскрытие информации
О конфликте интересов не сообщается.
Благодарности
Эта работа была поддержана программой iNEXT-Discovery (Grant 871037), финансируемой программой Horizon 2020 Европейской комиссии. J B. R. White финансируется Wellcome Trust (215064/Z/18/Z). Микроскопы FEI Titan Krios финансировались Университетом Лидса (премия UoL ABSL) и Wellcome Trust (108466/Z/15/Z). Мы благодарим М. Иаданзу за использование его сценария анализа микрофотографии. Мы благодарим Diamond Light Source за доступ и поддержку крио-ЭМ-установок в Национальном центре электронной биовизуализации Великобритании (eBIC), финансируемом Wellcome Trust, MRC и BBRSC.
Материалы
| Name | Company | Catalog Number | Comments |
| Blunt tweezers | Agar Scientific | AGT5022 | |
| Cryo EM round storage box | Agar Scientific | AGG3736 | |
| CryoEM autogrid boxes | ThermoFisher Scientific | 1084591 | |
| CryoEM grids | Quantifoil | N1-C14nCu30-01 | |
| Ethane gas | Boc | 270595-F | |
| LN2 foam dewar | Agar Scientific | AG81760-500 | |
| LN2 storage dewar | Worthington industries | HC 34 | |
| Pipette | Gilson | 10082012 | |
| Pipette tips | Star labs | s1111-1706 | |
| Syringe | BD | BD 300869 | |
| Type II lab water | Suez | select fusion | |
| Vitrobot | ThermoFisher Scientific | 1086439 | |
| Vitrobot filter paper | Whatman | 1001-055 | |
| Vitrobot styrophome container assembly | ThermoFisher Scientific | 1086439 | |
| Vitrobot tweesers | ThermoFisher Scientific | 72882-D | |
| Software | |||
| EPU | ThermoFisher Scientific | 2.8.1.10REL | |
| TEM server | ThermoFisher Scientific | 6.15.3.22415REL | |
| Tia | ThermoFisher Scientific | 5.0.0.2896REL | |
| Titan krios microscope | ThermoFisher Scientific | Titan Krios G2 |
Ссылки
- Kuehlbrandt, W. The Resolution Revolution. Science. 343 (6178), 1443-1444 (2014).
- McMullan, G., Faruqi, A. R., Henderson, R. Direct Electron Detectors. Methods in Enzymology. , (2016).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: the nuts and bolts. Current Opinion in Structural Biology. , (2017).
- Lyumkis, D. Challenges and opportunities in cryo-EM single-particle analysis. Journal of Biological Chemistry. , (2019).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. , (2020).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. , (2020).
- Conley, M. J., et al. Calicivirus VP2 forms a portal-like assembly following receptor engagement. Nature. 565 (7739), 377-381 (2019).
- Hesketh, E. L., et al. The 3.3 Å structure of a plant geminivirus using cryo-EM. Nature communications. 9 (1), 2369 (2018).
- Malone, L. A., et al. Cryo-EM structure of the spinach cytochrome b6 f complex at 3.6 A resolution. Nature. 575 (7783), 535-539 (2019).
- Madej, M., et al. Structural and functional insights into oligopeptide acquisition by the RagAB transporter from Porphyromonas gingivalis. Nature Microbiology. , (2020).
- Gallardo, R., et al. Fibril structures of diabetes-related amylin variants reveal a basis for surface-templated assembly. Nature Structural and Molecular Biology. , (2020).
- Scarff, C., et al. Structure of the shutdown state of myosin-2. Nature. , (2020).
- Scarff, C. A., et al. Structure of the protective nematode protease complex H-gal-GP and its conservation across roundworm parasites. PLoS Pathogens. 16 (4), 1008465 (2020).
- Wu, M., Lander, G. C. How low can we go? Structure determination of small biological complexes using single-particle cryo-EM. Current Opinion in Structural Biology. , (2020).
- Khoshouei, M., Radjainia, M., Baumeister, W., Danev, R. Cryo-EM structure of haemoglobin at 3.2 Å determined with the Volta phase plate. Nature Communications. , (2017).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta crystallographica. Section D, Structural biology. 74, 560-571 (2018).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadanza, M. G. Variations on negative stain electron microscopy methods: tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biological procedures online. 6, 23-34 (2004).
- Baker, L. A., Rubinstein, J. L. Radiation Damage in Electron Cryomicroscopy. Methods in enzymology. 481, 371-388 (2010).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (02), 129-228 (1988).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in enzymology. 579, 51-86 (2016).
- Carragher, B., et al. Current outcomes when optimizing ‘standard’ sample preparation for single-particle cryo-EM. Journal of Microscopy. , (2019).
- Naydenova, K., Jia, P., Russo, C. J. Cryo-EM with sub-1 Å specimen movement. Science. , (2020).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in Enzymology. , (2016).
- Thompson, R. F., Iadanza, M. G., Hesketh, E. L., Rawson, S., Ranson, N. A. Collection, pre-processing and on-the-fly analysis of data for high-resolution, single-particle cryo-electron microscopy. Nature protocols. 14 (1), 100-118 (2019).
- Suloway, C., et al. Automated molecular microscopy: the new Leginon system. Journal of Structural Biology. 151 (1), 41-60 (2005).
- Zhang, J., et al. JADAS: A customizable automated data acquisition system and its application to ice-embedded single particles. Journal of Structural Biology. , (2009).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. , (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. , (2019).
- Fernandez-Leiro, R., Scheres, S. H. W. A pipeline approach to single-particle processing in RELION. Acta crystallographica. Section D, Structural biology. 73, 496-502 (2017).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. , (2018).
- Wagner, T., et al. SPHIRE-crYOLO is a fast and accurate fully automated particle picker for cryo-EM. Communications biology. 2 (1), 213-218 (2019).
- Bepler, T., et al. TOPAZ: A Positive-Unlabeled Convolutional Neural Network CryoEM Particle Picker that can Pick Any Size and Shape Particle. Microscopy and Microanalysis. , (2019).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 163 (2018).
- Zivanov, J., Nakane, T., Scheres, S. H. W. A Bayesian approach to beam-induced motion correction in cryo-EM single-particle analysis. IUCrJ. , (2019).
- Cianfrocco, M. A., Kellogg, E. H. What Could Go Wrong? A Practical Guide to Single-Particle Cryo-EM: From Biochemistry to Atomic Models. Journal of Chemical Information and Modeling. , (2020).
- Tagari, M., Newman, R., Chagoyen, M., Carazo, J. M., Henrick, K. New electron microscopy database and deposition system. Trends in Biochemical Sciences. , (2002).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: A public archive for raw electron microscopy image data. Nature Methods. , (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. , (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. , (2019).
- Goddard, T. D., et al. UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Protein Science. 27 (1), 14-25 (2018).
- Klebl, D. P., et al. Need for Speed: Examining Protein Behavior during CryoEM Grid Preparation at Different Timescales. Structure. , (2020).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 32 (2018).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proceedings of the National Academy of Sciences. , (2014).
- Zi Tan, Y., et al. Addressing preferred specimen orientation in single-particle cryo-EMthrough tilting. Nature Methods. , (2017).
- Armstrong, M., Han, B. -. G., Gomez, S., Turner, J., Fletcher, D. A., Glaeser, R. M. Microscale Fluid Behavior during Cryo-EM Sample Blotting. Biophysical Journal. 118 (3), 708-719 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. , (2017).
- Dandey, V. P., et al. Spotiton: New Features and Applications. Journal of Structural Biology. , (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta crystallographica. Section D, Structural biology. 75, 1063-1070 (2019).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. bioRxiv. , (2020).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: From sprays to jets and back. Acta Crystallographica Section D: Structural Biology. , (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены