Method Article
Microscopia crio-elétron de partículas únicas: da amostra à estrutura
Neste Artigo
Resumo
A determinação da estrutura dos complexos macromoleculares utilizando o crioEM tornou-se rotina para certas classes de proteínas e complexos. Aqui, este pipeline é resumido (preparação de amostras, triagem, aquisição e processamento de dados) e os leitores são direcionados para recursos e variáveis mais detalhados que podem ser alterados no caso de espécimes mais desafiadores.
Resumo
A microscopia crio-elétron (crioEM) é uma técnica poderosa para a determinação estrutural de complexos macromoleculares, através da análise de partículas únicas (SPA). O processo geral envolve i) vitrificar o espécime em um filme fino apoiado em uma grade crioem; ii) triagem da amostra para avaliar a distribuição de partículas e a qualidade do gelo; iii) se a grade for adequada, coletando um único conjunto de dados de partículas para análise; e iv) processamento de imagem para produzir um mapa de densidade EM. Neste protocolo, é fornecida uma visão geral para cada uma dessas etapas, com foco nas variáveis que um usuário pode modificar durante o fluxo de trabalho e na solução de problemas de questões comuns. Com a operação de microscópio remoto se tornando padrão em muitas instalações, serão descritas variações nos protocolos de imagem para auxiliar os usuários em operação eficiente e imagem quando o acesso físico ao microscópio for limitado.
Introdução
CrioEM de partícula única
Para investigar a vida em um nível molecular devemos entender a estrutura. Muitas técnicas para sondar a estrutura proteica estão disponíveis, como NMR, cristalografia de raios-X, espectrometria de massa e microscopia eletrônica (EM). Até o momento, a maioria das estruturas depositadas no Protein Databank (PDB) foram resolvidas com cristalografia de raios-X. No entanto, a partir de ~2012, a microscopia crio-elétron (crioEM) tornou-se uma técnica mainstream para determinação da estrutura proteica e seu uso aumentou drasticamente. O número total de mapas EM depositados no Electron Microscopy Databank (EMDB) (a partir de dezembro de 2020) foi de 13.421 contra 1.566 em 2012 (Figura 1, www.ebi.co.uk). Em 2012, o número de coordenadas atômicas modeladas em mapas de densidade criodento, depositados no PDB era de apenas 67, mas a partir de dezembro de 2020, 2.309 estruturas foram depositadas até agora, um aumento de 35 vezes. Esse crescimento subjacente na qualidade e quantidade de mapas de densidade crioem produzidos, às vezes chamados de "revolução da resolução" 1, foi causado por uma coalescência de avanços em múltiplas áreas: o desenvolvimento de novas câmeras para imagens conhecidas como detectores de elétrons diretos; novo software; e microscópios mais estáveis2,3,4.
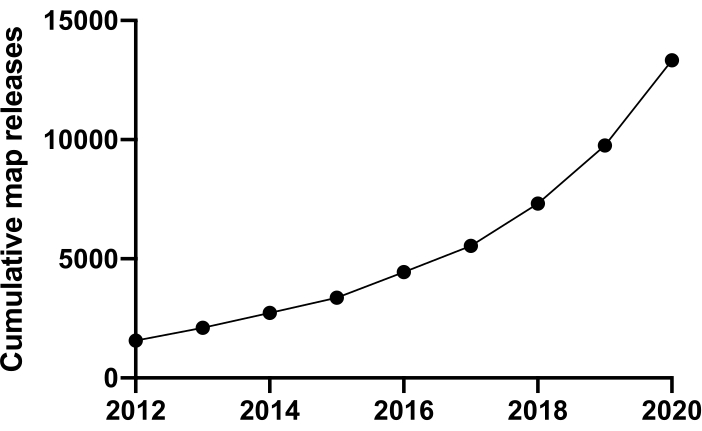
Figura 1: Submissões cumulativas ao EMDB de 2012 a dezembro de 2020. Clique aqui para ver uma versão maior deste número.
A análise de partículas simples (SPA) é uma poderosa ferramenta para gerar insights biológicos em uma ampla variedade de tipos de amostras, elucidando estruturas de alta resolução de complexos isolados5,6 incluindo vírus7,8, proteínas de membrana9,10, conjuntos helicoidais11 e outros complexos macromoleculares dinâmicos e heterogêneos12,13, os tamanhos dos quais variam por ordens de magnitude (a partir de 39 kDa 14,15 a dezenas de megadaltons). Aqui, é descrito um protocolo para um pipeline padrão para o CRIOEM SPA da amostra para a estrutura.
Antes de embarcar neste gasoduto, uma amostra purificada deve ser submetida à análise bioquímica para avaliar suas chances de sucesso a jusante. A preparação de uma amostra adequada é, sem dúvida, a maior barreira para o SPA, particularmente para complexos transitórios e heterogêneos (tanto composicionais quanto conformais). A preparação do complexo macromolecular deve conter o menor número possível de contaminantes, em concentração suficiente para produzir muitas partículas em cada micrografo crioEM, e em uma composição tampão bem adequada à análise crioEM. Certos componentes tampão, incluindo sacarose, glicerol e alto (~> concentrações de 350 mM de sais, dependendo do tamanho da amostra, propriedades e outros componentes tampão) podem interferir no processo de vitrificação ou reduzir a relação sinal-ruído nas imagens, dificultando a determinação da estrutura16.
Normalmente, como mínimo, a cromatografia de exclusão de tamanho (SEC) e a análise do gel de PÁGINA SDS-PAGE devem ser usadas para avaliar a pureza da amostra17,18, mas o dichroismo circular, os ensaios funcionais, sec juntamente com dispersão de luz multi angle e ensaios de estabilidade térmica são ferramentas úteis para análise qualitativa de preparações complexas macromoleculares antes da análise crioEM. No entanto, os resultados dessas análises bioquímicas podem produzir pouca percepção sobre a heterogeneidade estrutural da amostra e seu comportamento em uma grade crioem. Por essa razão, a mancha negativa EM é rotineiramente usada como uma ferramenta rápida, barata e poderosa para avaliar a heterogeneidade composicional e conformacional e, portanto, uma boa maneira de verificar qual fração de eluição de uma purificação é mais promissora, ou selecionar diferentes composições tampão19,20. Uma vez identificada uma amostra promissora, podemos prosseguir para o oleoduto crioem SPA. A mancha negativa nem sempre se alinha com os resultados subsequentes observados no crioEM; às vezes uma amostra parece pobre por mancha negativa, mas melhora quando visto em gelo vítreo no crioEM. Em contraste, às vezes as amostras parecem excelentes durante as etapas de manchas negativas, mas requerem uma otimização significativa ao progredir para crioEM. No entanto, na maioria dos casos, a mancha negativa fornece uma etapa útil de controle de qualidade.
Vitrificação
O ambiente severo dentro do sistema de vácuo do microscópio eletrônico causa tanto desidratação quanto danos à radiação em espécimes biológicos nãofixados21. Portanto, para a imagem da amostra em um estado nativo, o espécime biológico deve ser preservado antes da imagem. Para preparações purificadas de complexos macromoleculares, a vitrificação é o método de escolha para permitir sua visualização por crioEM, preservando os detalhes atômicos do complexo. A descoberta da vitrificação como método de preparação de amostras foi um avanço fundamental na microscopia eletrônica de espécimes biológicos, para a qual Dubochet foi reconhecido no Prêmio Nobel de Química de 2017. A vitrificação da amostra envolve a criação de uma fina camada de solução contendo o espécime de interesse, tipicamente dezenas de nm de espessura, suspensos em um suporte de grade crioEM. O filme fino é então congelado extremamente rapidamente em um criogen, como o etano líquido a ~-175 °C. A taxa de congelamento é de ~106 °C/s, rápido o suficiente para que formas de gelo amorfa, ou vítreos, suspendendo o espécime em uma película fina e sólida22.
A variável inicial a considerar é o suporte à grade crioEM escolhido23. Uma grade EM normalmente consiste em uma película de carbono amorfa com perfurações (regulares ou irregulares), sobre uma estrutura de suporte. A estrutura de suporte é tipicamente uma grade metálica circular de 3,05 mm de diâmetro, geralmente feita de cobre, mas outros metais como ouro, ou molbênio (que tem propriedades de expansão térmica preferidas24) podem ser usados. Às vezes, um suporte fino e contínuo adicional é aplicado em toda a grade, como grafeno, óxido de grafeno ou uma fina (~1-2 nm) camada de carbono amorfa. Enquanto as grades crioEM padrão (mais comumente 400-200 cobre de malha com perfurado (1,2 μm de orifícios redondos separados por 1,3 μm (r1.2//1.3), ou 2 μm separados por 2 μm de carbono (r2/2)) suporte a carbono- embora muitos padrões diferentes estejam disponíveis) têm sido usados na grande maioria das estruturas relatadas até o momento, novas tecnologias de grade com condutividade aprimorada e movimento reduzido de espécimes foram relatados25 . As grades selecionadas são submetidas a um tratamento de limpeza de descarga de brilho/plasma para torná-las hidrofílicas e favoráveis à aplicação da amostra26.
Após a descarga de brilho, a próxima etapa é a formação de filmes finos. Esta película fina é mais comumente formada usando papel filtro para remover o excesso de líquido da grade. Embora isso possa ser realizado manualmente, uma série de dispositivos de congelamento de mergulho estão disponíveis comercialmente, incluindo o Vitrobot Mk IV (Thermo Fisher Scientific), EM GP II (Leica) e CP3 (Gatan). Com esses dispositivos, ~3-5 μL de amostra na solução é aplicada à grade EM, seguido por blotting solução de excesso de manchas usando papel filtro. A grade, com uma película fina suspensa através dela, é então mergulhada em etano líquido resfriado por nitrogênio líquido (LN2) a ~-175 °C. Uma vez congelada, a rede é mantida a uma temperatura abaixo do ponto de desvitarificação (-137 °C) antes e durante a imagem.
Triagem de espécimes e coleta de dados
Após a vitrificação de uma grade crioEM, o próximo estágio é telar a grade para avaliar sua qualidade e determinar se a grade é adequada para prosseguir para a coleta de dados de alta resolução. Uma grade crioEM ideal tem gelo vítreo (oposto ao gelo cristalino) com a espessura do gelo apenas suficiente para acomodar a maior dimensão do espécime, garantindo que o gelo circundante contribua com o mínimo de ruído para a imagem resultante possível. As partículas dentro do gelo devem ter uma forma de tamanho e (se conhecida) consistente com a bioquímica, e idealmente ser monodisperse com uma distribuição aleatória de orientações de partículas. Finalmente, a rede deve ter áreas suficientes de qualidade suficiente para satisfazer o comprimento desejado de coleta de dados. Dependendo do espécime, isso pode levar muitas iterações de vitrificação e triagem até que as grades ideais sejam produzidas. Felizmente e infelizmente, há uma enorme gama de variáveis que podem ser testadas empiricamente para alterar a distribuição de partículas em grades crioEM (revisadas em 16,27). Neste manuscrito, são mostrados resultados representativos para um projeto de proteína de membrana10.
Uma vez identificada uma grade adequada, a coleta de dados pode prosseguir. Vários modelos de microscópios eletrônicos de transmissão criotransiência para espécimes biológicos são otimizados para coletar dados de alta resolução de forma automatizada. Normalmente, os dados são coletados em sistemas de 300 kV ou 200 kV. A coleta automatizada de dados pode ser obtida utilizando softwares como EPU (Thermo Fisher Scientific)28, Leginon29, JADAS30 e SerialEM31,32. Uma coleta automatizada de dados com detectores modernos normalmente resulta em terabytes (TB) de dados brutos em um período de 24 horas (conjuntos de dados médios são ~ 4 TB em tamanho).
Devido às restrições COVID-19 em vigor em grande parte do mundo (tempo de escrita dezembro de 2020), muitas instalações de microscopia mudaram-se para oferecer acesso remoto. Uma vez que as grades tenham sido carregadas no carregador automático de um microscópio, a aquisição de dados pode ser conduzida remotamente.
Processamento de imagens e construção de modelos
Quando uma sessão de coleta de dados pode ser tipicamente de 0,5-4 dias, o processamento subsequente de imagens pode levar muitas semanas e meses, dependendo da disponibilidade de recursos de computação. É padrão para etapas iniciais de processamento de imagem, ou seja, correção de movimento e estimativa de função de transferência de contraste (CTF) a ser realizada 'na hora' 33,34. Para o processamento a jusante, há uma infinidade de suítes de software disponíveis. As partículas são 'colhidas' e extraídas de micrografos35,36. Uma vez que as partículas são extraídas, um protocolo padrão seria processar as partículas através de várias rodadas de classificação (em ambas as dimensões (2D) e três dimensões (3D) e/ou focadas em regiões específicas de interesse) para alcançar um subconjunto homogêneo de partículas. Este subconjunto homogêneo de partículas é então mediado para produzir uma reconstrução 3D. Neste ponto, os dados são frequentemente corrigidos para produzir o mapa de maior qualidade possível, por exemplo através do refinamento CTF, correções de distorção37 e polimento bayesiano38 . O resultado deste processamento de imagem é um mapa crioEM 3D do espécime biológico de interesse. A faixa de resolução alcançada em um experimento automatizado de partículas únicas "padrão" a partir de uma grade de qualidade suficiente, com dados coletados em um sistema de microscópio de 300 kV é tipicamente entre 10 Å e 2 Å, dependendo do tamanho e flexibilidade do complexo proteico. Com um espécime ideal, resoluções de ~1.2 Å foram agora alcançadas usando fluxos de trabalho SPA5. Embora este protocolo detalhe os passos para obter um mapa de densidade EM, uma vez que isso esteja em mãos, ele pode ser interpretado ainda mais através do encaixe e refinamento de um modelo de proteína (se a resolução for < 3,5 Å) ou de construção de novo39. Os dados associados aos experimentos de determinação da estrutura podem ser depositados em repositórios públicos on-line, incluindo mapas de densidade EM (Electron Microscopy Data Bank)40, resultando em coordenadas atômicas (Protein Data Bank)41 e conjuntos de dados brutos (Electron Microscopy Public Image Archive)42.
Neste protocolo, o complexo proteico de membrana externa RagAB (~340 kDa) de Porphyromonas gingivalis é usado como exemplo complexo macromolecular10 (EMPIAR-10543). Para aqueles novos para crioEM, o suporte para amostras através deste pipeline de amostra para estrutura está disponível, sujeito a revisão por pares, através de esquemas de acesso financiados como iNEXT Discovery e Instruct.
Protocolo
1. Vitrificação de grade
NOTA: Para todas as etapas 1 e 2, certifique-se de que todas as ferramentas estejam limpas, secas e à temperatura ambiente antes de esfriá-las à temperatura LN2 , usando LN2 recém-decantada para reduzir a contaminação do gelo. Sempre que possível, trabalhe dentro de um ambiente controlado pela umidade com < 20% de umidade relativa. Certifique-se de que os equipamentos de proteção individual adequados e a documentação da H&S estão em vigor antes de iniciar o trabalho.
- Certifique-se de que a amostra de interesse está pronta para a preparação da amostra.
- Escolha grades crioEM apropriadas e certifique-se de que estas tenham sido tornadas hidrofílicas usando descarga de brilho ou tratamento plasmático. Uma grande variedade de sistemas e variações ao protocolo estão disponíveis, mas todos envolvem colocar as grades em um sistema de limpeza de descarga de brilho/plasma e executar um programa que bombeará a câmara para um nível de vácuo desejado, antes de introduzir uma mistura de gás específica/vapor químico ou ar no sistema. Uma corrente elétrica é passada através do sistema, ionizando as partículas de gás e induzindo a superfície das redes a ser mais hidrofílica.
- Inicie o dispositivo de congelamento de mergulho para vitrificação da grade ligando o sistema usando o interruptor de alimentação na parte traseira e aguarde a carga da tela de toque.
- Usando a caneta ou dedos fornecidos, no Console, defina a temperatura de trabalho desejada da câmara (a faixa disponível é de 4-60 °C, recomendada para a maioria das macromoléculas 4-6 °C).
- Encha o umidificador com 50 mL de água de laboratório tipo II usando uma seringa, através do tubo de borracha no fundo do umidificador. Certifique-se de remover qualquer ar preso na seringa antes de encher. Tenha cuidado para não encher demais o umidificador ou a água vai exalar na câmara. Uma vez que o umidificador esteja cheio, recue o êmbolo da seringa em 5-10 mL para criar uma vedação a vácuo.
- No Console, defina a umidade relativa desejada para a câmara (alcance disponível é de 0-100%, umidade de 95-100% é tipicamente utilizada). Deixe a umidade definida para 'desligar' até imediatamente antes da grade fazer para que a câmara não fique muito molhada.
- Obtenha a pinça do dispositivo de congelamento de mergulho e o papel filtro cortado para o tamanho correto para caber nas almofadas, compradas ou usando um selo para cortar uma abertura do tamanho apropriado.
- Prepare o criogen para mergulhar congelando.
- Coloque o suporte da caixa crio-grid de metal, o copo de criogen e as pernas da aranha metálica no recipiente de refrescação.
- Esfrie o recipiente enchendo a câmara externa com LN2. Mantenha a câmara externa coberta para cobrir o topo do suporte da caixa crio-grade. Adicione ~ 1 cm de LN2 adicional ao copo criogênico para ajudar o equilíbrio do sistema à temperatura LN2 .
NOTA: O anel anti-contaminação pode ser usado para limitar a condensação de ar úmido ao redor do copo criogênico e levando à contaminação crio-refrigerante/etano. Isso não é geralmente necessário em um ambiente controlado pela umidade. Se usar o anel anti-contaminação, tenha cuidado para não encher demais o recipiente com LN2 ou pode derramar quando o anel é pressionado no recipiente mais tarde no processo. - Espere 3-5 min para observar a ebulição das pernas de aranha e, em seguida, espere mais 3 minutos para garantir que o copo de criogen esteja suficientemente frio para condensar o meio de vitrificação.
- Liquefate o criogen (etano líquido) no copo de criogen.
- Pegue o tubo do cilindro de etano com tubos finos e um bocal para distribuir o gás. Uma ponta de pipeta P200 com a abertura aberta cortando a ponta usando uma lâmina de barbear é ideal aqui. Uma abertura mais ampla é necessária para evitar que o etano se solidifique na ponta e bloqueie o fluxo de gás.
- Garantir que o copo de criogen não contenha nenhum LN2 restante, pegue o bocal de gás de etano e coloque-o dentro do copo criogen. Usando o regulador do cilindro de gás, inicie um baixo fluxo e dispense gás criogen no copo criogênico para condensar o gás. Mantenha a ponta da qual o gás flui diretamente pressionado contra a parede do copo criogênico, mas mova-o suavemente para frente e para trás em um movimento de toque contra a superfície. Regular o fluxo do gás para permitir que um fluxo baixo e constante comece a condensar/liquify de forma controlada dentro do copo criogen.
- Encha o copo logo abaixo da borda da aranha prateada e pare o fluxo de gás, em seguida, remova a linha de gás cuidadosamente para evitar contaminar o LN2 circundante com etano.
- Cubra o recipiente de refreso com LN2, tendo muito cuidado para não derramar nenhum no etano líquido.
- Deixe as pernas das aranhas em posição por ~ 3-5 min para garantir que o etano líquido seja equilibrado a uma temperatura suficientemente fria. O criogênico começará a parecer nublado/ligeiramente opaco. Isso indica que ele está perto de seu ponto de congelamento. Nesta fase, use pinças para remover a aranha. Enquanto o LN2 for mantido dentro do recipiente ao redor do copo de criogen, o etano permanecerá liquefeito e adequado para vitrificação por 1-2 h. No entanto, visam concluir o procedimento o mais rápido possível, especialmente em salas não controladas pela umidade, para reduzir a contaminação do gelo.
NOTA: Se a aranha parece estar "presa", use um objeto de metal, como uma porca e segure-se contra as pernas da aranha para aquecê-las ligeiramente e, em seguida, remova as pernas.
- Prepare o dispositivo de congelamento de mergulho e os acessórios para vitrificação de amostras.
- Adicione caixas de armazenamento de grade ao suporte da caixa crio-grade metálica e durante todo o procedimento garanta que o LN2 seja mantido coberto até um pouco acima do nível das caixas de grade (geralmente a cada ~ 5 min).
- Na tela do dispositivo de congelamento de mergulho, na caixa de parâmetros de processo insira os parâmetros escolhidos, incluindo: tempo de mancha (a hora em que as almofadas do dispositivo de congelamento de mergulho se juntarão), força (a distância das almofadas de manchas da grade, que altera o gradiente da formação de gelo) e total (número de vezes que as almofadas de manchas entrarão para atender). Escolha esses parâmetros com base no dispositivo de congelamento de mergulho individual e no comportamento da macromolécula. Valores típicos são uma força de mancha entre 0 e 5, tempo de mancha de 1-6 s e um total de manchas de 1. O tempo típico de espera (tempo entre iniciar a mancha e o início da mancha) e o tempo de drenagem (tempo após a mancha antes de mergulhar) é de 0-2 s.
NOTA: Dependendo das preferências do usuário, opções adicionais nas Opções, seção Diversas podem ser selecionadas , incluindo Use Foot Pedal para passar para o próximo passo em cada prensa, transferência skip grid (pula a etapa final onde o braço da pinça é levantada ligeiramente), desligar a umidade durante o processo (enquanto a amostra está sendo aplicada, pára a umidificação ativa da câmara que pode dificultar a ver a grade ) e (combina o passo da pinça sendo levantada na câmara e levantando o recipiente de refranão- pula passo de recipiente de etano ). Aqui, todas essas opções estão ligadas. - Coloque o recipiente de refrão com segurança no braço da plataforma em movimento sob a câmara
- Insira papel de mancha fresco em cada braço de mancha, certificando-se de que os clipes de anel de plástico estejam fixados. Cada papel filtro permitirá 16 manchas (braços giram papel de mancha). Pressione o botão de papel de mancha reset na seção Controles .
- Execute 1 ciclo completo do processo de vitrificação do dispositivo de congelamento de mergulho para garantir que cada parte móvel esteja se comportando como esperado.
- Pressione (ou use o pedal do pé) para colocar nova grade, depois inicie o processo e, em seguida, processe e continue. Nesta fase, observe para garantir que os braços manchados estejam entrando em contato uns com os outros como esperado.
- Ligue o umidificador. Vapor de água será produzido (desde que a umidade definida seja maior do que atualmente na câmara).
- O espécime de interesse pode agora ser vitrificado. Use o pedal do pé ou coloque a nova grade e a haste de mergulho descerá da câmara permitindo que as pinças sejam presas ao suporte.
- Usando a pinça do dispositivo de congelamento de mergulho, pegue a grade crioEM limpa de brilho/plasma desejada, tomando cuidado para notar qual lado é o lado correto a ser usado para aplicação de amostra de acordo com o fabricante da grade. Pegue a grade pela borda, tomando cuidado para evitar contato excessivo/desnecessário com a pinça, pois isso danificará o suporte. Fixar a grade nas pinças movendo o clipe preto para baixo para a parte do cume da pinça. A grade precisa ser segura, mas o clipe não deve ser muito para baixo, pois entrará em contato com as almofadas de manchas, levando a manchas irreprodutíveis e, mais tarde, a pinça precisará ser mantida abaixo deste ponto ao liberar o clipe.
- Coloque as pinças do dispositivo de congelamento de mergulho segurando a grade crioEM sobre o braço pneumático com o lado correto voltado para sua mão dominante. O desenho das pinças e câmara do dispositivo de congelamento de mergulho são tais que a amostra pode ser aplicada através do lado direito ou esquerdo da câmara, de acordo com a desdezidade do usuário.
NOTA: Aplicar a amostra em lados diferentes com os mesmos parâmetros de mancha raramente resulta em resultados comparáveis, de modo que os pesquisadores canhotos podem precisar ajustar seus parâmetros de mancha independentemente de seus colegas destros. - Pressione o Processo de Partida e a grade mantida na pinça serão levadas para a câmara e o recipiente de refranhante será levantado.
- Pressione o processo e as pinças moverão a grade para a posição onde uma pipeta pode ser usada para aplicar o espécime na grade. Abra a porta lateral voltada para o lado correto da grade e aplique a amostra por pipetação, certificando-se de que a ponta da pipeta não toque na grade, pois pode levar a danos do suporte da grade/dobra da grade, mas dispense o líquido perto o suficiente para que a gota dispense a grade. Normalmente, é aplicado 3-5 μL.
- Pressione Continue e os parâmetros predefinidos do usuário vão borrar a grade e, em seguida, mergulhar as pinças com grade montada no copo de refrigerante para vitrificação amostral. A pinça descerá em conjunto com o braço segurando o recipiente de refreso e o refrigerante, mantendo a grade submersa no criogen.
- Transfira a grade do copo criogênico para a caixa de armazenamento da grade submersa em LN2.
- Retire as pinças do braço da pinça, tomando muito cuidado para não entrar em contato com a grade vitrificada com as laterais do copo criogênico. Ajuste a aderência para que as pinças sejam mantidas confortavelmente. O mais rápido e cuidadosamente possível, mova a grade do criogen para o LN2. Com uma mão, segure as pinças fechadas usando os dedos e, com a outra mão, deslize o clipe preto para cima do caminho, segurando a pinça fechada. Reajuste a aderência e manipule a grade na caixa de armazenamento da rede.
- Repetir as etapas 1.10-1.19 até que todas as grades sejam feitas (uma sessão típica envolverá a fabricação de grades 4-12). Armazene todas as caixas de armazenamento de grade contendo grades em LN2 dewar até os próximos estágios.
2. Recorte de grades para carregamento em um microscópio de carregador automático
- Clipe grades em conjunto autogrid de acordo com o protocolo descrito anteriormente 28.
3. Proteja o login remoto nos microscópios
NOTA: Com os controles COVID-19 no momento da redação, mas também com preocupações ambientais associadas a viagens internacionais, mais instalações de microscopia vêm oferecendo serviços onde o usuário opera remotamente. O método de implementação para isso vai variar de acordo com a configuração local de TI de cada instalação e as necessidades de sua comunidade de usuários internos e externos. Aqui é descrito o processo para acessar remotamente crioemes no eBIC e controlar o microscópio através do software EPU.
- Faça login remotamente no crioEM's. O logon remoto é mediado através do software NoMachine para acessar o PC de suporte ao microscópio e é configurado apenas para permitir o acesso aos usuários que estão registrados em uma visita através das credenciais de logon FedID dos usuários. O acesso permanece ativo apenas durante a sessão.
- Abra o NoMachine e inicie uma nova conexão NX para nx-cloud.diamond.ac.uk com autenticação de senha.
- Abra a conexão e faça login com o nome de usuário fedid@fed.cclrc.ac.uk e senha FedID. Clique duas vezes no ícone correspondente ao microscópio relevante das opções disponíveis para abrir uma conexão ao PC de suporte relevante.
- Digite nome de usuário clrc\FedID e senha na tela de logon do Windows.
- Abra o software TeamViewer a partir do ícone da área de trabalho e conecte-se ao PartnerID: TEM com a senha fornecida. Isso estabelece a conexão do PC de suporte ao TEM PC. O botão Next Monitor na fita TeamViewer pode ser usado para alternar entre a interface do usuário do microscópio e a janela EPU.
- As funções do microscópio podem então ser controladas pelos usuários diretamente através da interface EPU.
4. Carregar amostras em um microscópio de carregador automático e triagem para qualidade de gelo e amostra
NOTA: Nesta seção, um microscópio com um software de carregador automático e EPU é usado para triagem de amostras, mas isso pode ser alcançado usando outro software e um sistema de entrada lateral e crioEMs de outros fabricantes.
- Carregue grades cortadas no carregador automático do microscópio como descrito anteriormente28.
- Na guia autocarregador da interface do usuário do microscópio, tabe o diálogo Opções usando a seta e pressione o botão Inventário . Isso verificará sequencialmente cada posição do para determinar se um cartucho está presente. As ranhuras ocupadas serão rotuladas em azul. Se todos os slots ocupados tiverem sido mapeados, pressione o botão Inventário novamente para parar após a posição atual, caso contrário, deixe em funcionamento até que todos os slots ocupados tenham sido mapeados. Rotule todos os slots ocupados com os detalhes da amostra nas caixas fornecidas.
- Destaque a grade a ser transferida para a coluna do microscópio e clique em Carregar. A etiqueta do slot passará de azul para amarelo assim que a grade tiver sido carregada com sucesso no palco. Prossiga para a tela das grades.
- Abra o software EPU. Na página Preparação , selecione A óptica de aquisição e as configurações e selecione a predefinição do Atlas no menu suspenso. Escolha predefinições de configuração de feixe apropriadas (por exemplo, 64x nominais mag, tamanho do ponto 5, Microprobe, com uma área iluminada na faixa paralela para detector Falcão - para obter mais informações escolhendo predefinições de configuração de feixes ver28). Pressione o Conjunto para empurrar os parâmetros para o microscópio.
- Pressione as válvulas da coluna Abertas e insira o FluScreen. Verifique se um feixe está visível e suficientemente espalhado e centrado para cobrir o detector. Se necessário, navegue até uma região mais fina da grade usando o joystick ou menu de palco para controlar os movimentos do palco em X e Y.
- Levante o FluScreen e tire uma imagem usando o botão Visualização em EPU. Com base na imagem adquirida, a dose pode ser aumentada movendo-se para um tamanho spot menor, e vice-versa.
- Em EPU, vá para a página atlas e pressione New Session. Selecione o formato de imagem MRC e digite um nome e local de pasta adequados para salvar a sessão de triagem e clique em Aplicar.
- Selecione Triagem no menu à esquerda. Marque as caixas de seleção ao lado de cada grade para ter uma montagem atlas adquirida. Inicie a sessão de triagem em EPU. Um atlas será adquirido para cada grade verificada, com uma série de quadrados de grade disponíveis listados após a conclusão. Cada atlas pode ser visto destacando-o na página de projeção, completa com um mark-up mostrando quadrados de grade com uma espessura de gelo prevista semelhante agrupada por cor.
- Após a conclusão, revise os atlas coletados e identifique as grades adequadas para avaliar a qualidade da amostra em ampliações mais elevadas (ou seja, aquelas com um número adequado de quadrados de grade que não são secos nem obscurecidos por gelo espesso). Destaque a grade escolhida no menu de triagem EPU e clique em Coletar amostras.
- Use as predefinições de configuração do feixe (Consulte 28 para explicar as predefinições de configuração do feixe desejadas para cada estágio) e a função de visualização para examinar os quadrados de grade desejados com mais detalhes.
- No menu de triagem do Atlas, selecione a grade atualmente carregada e mova o palco para um quadrado de grade contendo orifícios preenchidos clicando com o botão direito do mouse sobre o local desejado na imagem da grade e selecionando mover-se para o quadrado da grade.
- Retorne ao EPU, página de preparação e selecione a predefinição gridSquare .
- Abra a página EPU, Funções Automáticas e execute auto-eucentric por inclinação de palco com a predefinição gridSquare para mover a amostra para a altura eucêntrica.
NOTA: Auto-eucentric por inclinação de feixe também está disponível, que é mais rápido, mas tipicamente menos preciso do que auto-eucentric por inclinação de palco. - Em EPU, Preparação, faça uma nova imagem do GridSquare Preview. Observe os diferentes valores cinzentos em diferentes orifícios indicando diferentes espessuras de gelo. Mova o palco sobre um buraco usando o clique direito > mover o palco aqui. Selecione a predefinição de altura e visualização de orifício/eucentric.
NOTA: Dependendo do peso molecular e forma da partícula de interesse, pode ser possível identificá-la na ampliação da altura hole/eucêntrica. - Selecione a predefinição de aquisição de dados e defina uma ampliação que permita fácil identificação das partículas (correspondente a uma amostragem de objetos geralmente <2 Å/pixel). Defina o deslocamento de desfoco para ~-3 a -5 μm com uma dose eletrônica de exposição de ~40-80 e-/ Å2.
- Iterar através de etapas em 4.4 para avaliar uma gama de espessuras de gelo para distribuição de partículas, orientação e contaminação em toda a rede. A distribuição de partículas pode variar perto das bordas em relação ao centro do buraco e, portanto, é importante fazer o levantamento de diferentes locais com o orifício.
- Tela todas as grades que mostram promessa de atlases como tendo quadrados de grade suficientes. Mantenha-os no microscópio e prossiga para a aquisição de dados usando EPU, ou descarregue as amostras do microscópio e armazene sob LN2 até que a coleta de dados seja agendada.
5. Coleta de dados crioEM de partículas únicas (com foco em operação remota)
NOTA: Um protocolo detalhado para aquisição de dados com EPU é descrito no manual do fabricante e em outros lugares28. Aqui são destacadas modificações deste protocolo para operação remota (ou seja, reduzir o uso dos painéis manuais para realizar tarefas e usar alternativas baseadas em software).
- A menos que um já tenha sido coletado durante a sessão, colete um Atlas para a grade.
- Defina cada uma das predefinições de ajuste do feixe de acordo com as necessidades experimentais do projeto.
- Execute calibrações de mudança de imagem28.
- Configure a sessão EPU.
- Em EPU, selecione A página EPU e a configuração de sessão, selecione Nova sessão e outra das preferências.
- Selecione Nova sessão um pop-up aparecerá fornecendo uma opção para usar configurações anteriores. Sim , carregará automaticamente as configurações do EPU anterior (ou seja, portador de amostras, intervalo de desfoco, configurações de foco automático, tipo de grade) na sessão EPU atual. A seleção do Novo entre as preferências permite que o usuário escolha um arquivo com preferências salvas (ou seja, intervalo de desfoco, configurações de foco automático, tipo de grade) e essas informações serão pré-carregadas em EPU.
- Preencha o nome da sessão com algo informativo. A instalação local pode sugerir uma convenção de nomeação.
- Em Tipo, selecione Manual.
- Para o modo Aquisição, selecione o centro de furos preciso ou a aquisição mais rápida.
- No formato Imagem, selecione o formato desejado.
- Selecione uma pasta de armazenamento apropriada e o EPU criará um diretório com o nome da sessão.
- Selecione o portador de amostra apropriado de acordo com o qual o tipo de grade e o espaçamento do orifício estão sendo usados (por exemplo, Quantifoil 1.2/1.3) e pressione Aplicar. Este protocolo descreve o processo de geração de um modelo para uma matriz regular de buracos
- Selecione um quadrado de grade inicial e defina um modelo de aquisição.
- Seleção Go Square, se todos os quadrados são verdes, clique em desmarcar tudo no canto superior esquerdo.
- Abra as telhas (clique com o botão direito > azulejo aberto). Selecione um quadrado (clique com o botão direito do mouse > adicionar, clique com o botão direito do mouse > Mover o estágio para o quadrado da grade).
- Vá para a seleção hole e pressione Auto Eucentric. Espere até que isso esteja completo e uma imagem da Praça da Grade foi tirada. Se a função automática falhar, isso pode ser porque a altura está significativamente desligada; se assim for, pode ser ajustado manualmente usando o FluScreen na ampliação grid square.
- Meça o tamanho do buraco. Mova-se e ajuste os círculos amarelos para que eles estejam sobre os orifícios com tamanho correto e espaçamento.
- Pressione Encontrar buracos. Verifique se os buracos foram encontrados corretamente. Se não mudar o tamanho do buraco e encontrar buracos novamente. Repita isso até encontrar o buraco corretamente. Se falhar consistentemente, considere mover-se para um número menor (mais brilhante) tamanho da mancha na ampliação quadrada da grade.
- Use o histograma de qualidade de gelo do filtro à direita para ajustar a seleção do orifício. Isso pode ser útil para excluir áreas com gelo espesso e gelo fino. Isso será lembrado para futuros quadrados de grade selecionados durante esta sessão.
- Otimize a seleção de furos com as ferramentas no menu Selecionar na parte superior. Por exemplo, clique em Remover orifícios próximos à barra de grade.
- Vá para A definição de Modelo e pressione Acquire.
- Clique em Encontrar e centralar o buraco. Agora haverá uma imagem de um buraco com um círculo amarelo ao redor do buraco.
NOTA: Se ele se esforça para encontrar o orifício, insira a abertura objetiva. Se ele ainda não conseguir encontrar o orifício, tente aumentar o tempo de exposição para o furo/pré-conjunto de altura eucêntrica ou aumentar o desfoco para esta predefinição ou bin a imagem. Uma grande mudança de desfocus pode alterar o alinhamento da mudança de imagem. - Altere o atraso após o shift de etapa e o atraso após o tempo de mudança de imagem para 1-5 s.
- Verifique o valor máximo de mudança da imagem (se a opção estiver disponível) está conforme desejado. Se a coleta de mudança de imagem livre de aberração estiver sendo usada, esse valor será definido no arquivo de configuração EPU, caso contrário, 5 μm é um valor padrão.
- Clique em Adicionar área de aquisição e clique em qualquer lugar da imagem. Mova a área de aquisição para a localização desejada (ou seja, na borda de um buraco) para que as áreas de aquisição não sejam duplamente expostas com o feixe (o quadrado no círculo verde representa a área do detector, o círculo verde é o diâmetro do feixe).
- No canto superior direito, adicione o alcance do defoco. Em seguida, adicione outras áreas de aquisição. Uma lista típica de desfocus para um projeto de proteína de membrana é de -0,8 a -3 μm defoco.
- Clique em Adicionar área de foco automático e clique em qualquer lugar da imagem. Mova a área de foco automático para o carbono ao redor de um buraco. A prática padrão é focar automaticamente após a centragem ao usar AFIS, ou a cada 5-15 μm, dependendo da variação de altura z em todo o quadrado.
- Clique em Adicionar área de medição de deriva, a medição de deriva realizada uma vez por quadrado de grade, com um limiar definido de 0,05 nm/s é uma configuração padrão. A área de medição de deriva pode (e é uma boa ideia) se sobrepor diretamente com a área de foco automático. Certifique-se de que nem a área de deriva nem de foco automático se sobreponham a uma área de aquisição.
NOTA: O modelo pode ser verificado usando a função de execução do modelo. Esta é uma boa ideia para ver se as áreas de aquisição precisam ser movidas (por exemplo, carbono demais/não suficiente em imagens), mas não é necessário. - Volte para a seleção da Square, e na grade selecione os quadrados para aquisição. Use o número de áreas de aquisição e a taxa esperada de aquisição de dados (a partir de instalações baseadas em detectores e configuração experimental) para prever quantas áreas de aquisição são necessárias.
- Quando todos os quadrados desejados forem selecionados, pressione Prepare todas as Praças.
- Uma vez que cada quadrado é coletado, navegue entre os quadrados da grade e ajuste os orifícios usando a escova de seleção.
- Mova-se para um local de estágio sobre a amostra e use funções automáticas para definir a altura eucêntrica. Realize alinhamentos de microscópio como descrito anteriormente28, mas em vez de realizar o alinhamento sem coma e corrigir para astigmatismo objetivo manualmente, faça uso de ferramentas de alinhamento dentro do software. Brevemente, defina as condições do feixe de aquisição, certifique-se de que a abertura objetiva (OA) seja removida e o estágio esteja posicionado sobre uma área estável de feixe de espécimes em altura eucêntrica. Realize o alinhamento sem coma dentro das funções automáticas antes de reinserir e centralizar o OA e corrigir o astigmatismo da lente objetiva com EPU. Certifique-se de que ambos os alinhamentos convergem em valores adequados (< 150 nm de coma e quase zero astigmatismo.
- Antes de iniciar a execução automatizada de aquisição, certifique-se de que a bomba turbo do autocarregador esteja desligada e a abertura objetiva seja inserida.
- Na aquisição automatizada, pressione Start run para iniciar a aquisição automatizada de dados.
6. Processamento de imagem para produzir mapa de densidade EM
NOTA: A maioria das instalações crioEM oferecem pré-processamento de filmes de micrografia 'em tempo real'. Há uma grande variedade de pacotes de software e abordagens disponíveis para isso, incluindo os pipelines RELION28,33, crioSPARC43, Scipion34 e WarpEM44. Um pipeline baseado em RELION é descrito aqui e presume-se que o usuário tenha movido os filmes de micrografo para um local de armazenamento apropriado com acesso a recursos de computação. Uma visão geral do processo e resultados representativos para um projeto de proteína de membrana são fornecidos, uma descrição detalhada e um tutorial passo a passo podem ser encontrados na página inicial do RELION: https://www3.mrc-lmb.cam.ac.uk/relion.
- Realize a análise 'on the fly' da correção de movimento de micrografo e estimativa de CTF. Inicie o RELION dentro do diretório do projeto. Cronograma De importação, correção de movimento e trabalhos de estimativa de CTF para loop de tal forma que eles são concomitantes com a coleta e transferência de dados. Um script de análise de micrografo28 fornece feedback visual em tempo real sobre astigmatismo e valores estimados de desfocus (ver resultados representativos).
- Escolha partículas de micrografias pré-processadas. Há uma série de pacotes de software automatizados de coleta de partículas para escolher. Opções de escolha livre de referência e baseadas em modelos estão disponíveis na guia de escolha automática do RELION37. Outros programas podem ser usados para várias etapas, por exemplo, usando crYOLO para colheita de partículas35.
- Extrair partículas dos micrografos corrigidos pela CTF.
NOTA: Para reduzir o tempo computacional necessário para a "limpeza" precoce, etapas de processamento, escala/lixeira das partículas após a extração. Detalhes sobre como executar o trabalho de extrato podem ser encontrados no tutorial RELION 3.1. Para este projeto, as partículas foram inicialmente binadas por um fator de 2. - Realize a média da classe 2D. Classificar entre 100 e 200 classes funciona bem para a maioria dos conjuntos de dados contendo ≥ 100.000 partículas. Não é recomendável usar muito mais de 200 classes ou menos de 50 classes, mesmo onde os conjuntos de dados são pequenos, a menos que a amostra tenha alta simetria (ou seja, vírus icosaedral) nesse caso menos de 50 classes ainda podem dar um bom resultado. Defina o diâmetro da máscara grande o suficiente para acomodar a maior dimensão da partícula, mas apertado o suficiente para excluir quaisquer partículas vizinhas (isso pode exigir alguma tentativa e erro).
- Selecione boas classes (ou seja, aquelas com detalhes estruturais) usando o trabalho de seleção de subconjuntos. Exemplos de boas e ruins médias de classes 2D podem ser encontrados na seção de resultados representativos.
- Gerar um modelo inicial de novo a partir dos dados usando o trabalho do modelo inicial 3D no RELION.
NOTA: Pilhas de partículas menos limpas podem se beneficiar do refinamento ab initio SGD (descida de gradiente estocástico) uma vez que isso fornece uma oportunidade adicional para peneirar partículas de lixo/sub-ideal. Selecione um diâmetro de máscara que possa acomodar a partícula de interesse e deixe os valores padrão para campos na guia 'SGD', uma vez que estes têm um bom desempenho rotineiro. Certifique-se de que o modelo inicial pareça razoável em Quimera (ou outro programa de visualização apropriado) (veja resultados representativos). - Realize a classificação 3D para abordar a heterogeneidade nos dados usando a saída da etapa 6.6 como modelo de referência. Avalie os mapas resultantes na Quimera. Pilhas de partículas de processo correspondentes a estados conformacionais únicos de forma independente. Use o trabalho de seleção de subconjuntos para selecionar uma classe/classes de interesse e gerar arquivos particles.star para as pilhas de partículas associadas.
- Execute o refinamento automático 3D. Use as médias de classe 3D obtidas na etapa anterior como referências para refinamento de suas pilhas de partículas correspondentes. Se a resolução do refinamento estiver se aproximando do limite nyquist dos dados, re-extraia as partículas sem diminuir o dimensionamento. Após a re extração, reesque o trabalho de refino automático 3D com a pilha de partículas desvinculadas. Neste caso, os modelos de referência 3D devem ser redimensionados de modo que os tamanhos de pixel e caixa sejam consistentes com os das imagens de partículas re-extraídas. Use a ferramenta de linha de comando relion_image_handler para realizar esta operação.
- Utilize simetria no refinamento, se for o caso. Se um mapa reconstruído possuir simetria, alinhe o mapa no eixo de simetria apropriado usando a ferramenta de linha de comando relion_align_symmetry. Use o mapa alinhado resultante como referência em um novo trabalho de refinamento automático 3D com o operador de simetria apropriado especificado na guia de referência.
- Afiar mapas do refinamento automático 3D. Isso é feito usando o trabalho pós-processamento no RELION, mas primeiro uma máscara adequada deve ser criada a partir do mapa refinado. As etapas de criação de máscaras e pós-processamento são detalhadas no tutorial RELION (veja também resultados representativos).
NOTA: A resolução de muitas reconstruções pode ser melhorada usando as funcionalidades de polimento bayesiano e refinamento CTF no RELION. Use o tipo de trabalho de refinamento CTF para estimar e corrigir para aberrações de ordem mais alta (inclinação do feixe, aberrações de trefoil e aberrações de 4ª ordem) e, como trabalhos separados, ampliação anisotrópica e desfoco de partículas. Depois disso, use o trabalho de polimento bayesiano (treinado ou com valores padrão) para abordar o movimento induzido pelo feixe em uma base de partícula. Conforme abordado no tutorial RELION 3.1, esses trabalhos provavelmente se beneficiarão de uma abordagem iterativa (→ polimento bayesiano → refinamento automático 3D → → pós-processamento... loop) uma vez que ambos se beneficiam de modelos de maior resolução. - Corrija a entrega dos mapas de densidade EM, se necessário. Examine os mapas para determinar se a mão está correta, seja tentando se encaixar em um modelo atômico existente, ou avaliando a desdezidade das regiões alfa helical. Quando necessário, gire o mapa ao longo do eixo z na UCSF Chimera45 usando o comando 'vop zflip'.
Resultados
Ao serem rastreadas, as grades podem ser descartadas na fase atlas, onde recursos resolvidos em baixa ampliação marcam a grade como inadequada para aquisição de dados. Por exemplo, se uma grade foi sujeita a danos mecânicos significativos com a maioria dos quadrados de grade quebrados (Figura 2A), ou onde a grade parece estar 'seca', sem gelo vítreo (Figura 2B). Tais grades são tipicamente identificáveis à medida que as bordas dos quadrados da grade parecem afiadas e distintas. Na maioria das grades feitas usando o dispositivo de congelamento de mergulho, observa-se um gradiente de gelo (Figura 2C,D). A distribuição de partículas, dependendo da amostra de interesse, pode variar drasticamente com a espessura do gelo e, portanto, recomenda-se a triagem de uma variedade de quadrados de grade para avaliar a distribuição de partículas. Ferramentas foram implementadas dentro do software EPU durante a etapa de triagem do Atlas para ajudar o usuário a identificar quadrados de grade de espessura de gelo semelhante ou diferente, o que pode ser particularmente útil para usuários que são novos para examinar grades crioEM (Figura 2E, F).

Figura 2: Exemplo de montagens de "atlas" de baixa ampliação das sessões de triagem. A) Uma grade que sofreu danos significativos com a maioria dos quadrados de grade quebrados - inadequados para coleta. B) Uma rede seca sem gelo vitreous - inadequada para coleta. C) Uma grade demonstrando um gradiente de gelo com ~ 50% da grade útil. D) Um gradiente de gelo com ~ 33% da rede útil. Ambos C e D, são adequados para coleta de dados se os quadrados de grade utilizáveis tiverem uma espessura de gelo adequada para coleta, e há áreas de aquisição suficientes para satisfazer a duração mínima de uma coleta (por exemplo, 24 h) E) Um atlas de exemplo com faixa de espessuras de gelo. F) O mesmo atlas apresentado em E, mas com quadrados de grade categorizados e coloridos pelo software EPU de acordo com a espessura do gelo. Clique aqui para ver uma versão maior desta figura.
Ao triagem da distribuição de partículas, certifique-se de que os parâmetros de imagem, como ampliação e dose total de elétrons, são semelhantes aos esperados para serem usados durante a aquisição de dados, a fim de fornecer uma imagem precisa dos resultados esperados. Durante a triagem, uma distribuição ideal de partículas é monodisperse com uma gama de orientações de partículas visíveis (dependendo do espécime e do conhecimento existente da morfologia da partícula, isso pode ser desafiador de determinar) (Figura 3A). O gelo deve ser o mais fino possível enquanto acomoda as partículas maior dimensão, se o gelo é muito fino ele pode derreter quando iluminado com o feixe de elétrons. Isso causa movimento excessivo no micrografo, e áreas que exibem essa característica devem ser evitadas (Figura 3B). A partir da experiência coletiva, esse efeito é mais comumente observado quando há detergente no buffer. Isso pode resultar em gelo muito fino no centro do buraco e, portanto, as partículas podem ser fisicamente excluídas e forçadas para a borda. Este efeito é observado na Figura 3C, mas neste caso não é um exemplo extremo e essas imagens ainda contribuiriam de forma útil para um conjunto de dados. Finalmente, o gelo precisa ser vítreo; exclua quaisquer áreas da grade (ou grades) onde a maioria ou todas as imagens tiradas mostram gelo cristalino (Figura 3D) da aquisição de dados. Muitas vezes, o gelo não vitreous é observado na borda dos quadrados de grade. Os leitores são encaminhados para revisões detalhadas das variáveis que podem ser alteradas durante a vitrificação da grade16 e descrições do comportamento de partículas no ambiente de filme fino46,47 para obter mais informações.

Figura 3: Micrografias representativas mostrando diferentes distribuições de partículas. A) Uma distribuição 'ideal' de partículas monodispersas adotando uma gama de orientações. B) Gelo excessivamente fino no meio do buraco que ele deforma após a exposição ao feixe de elétrons causando movimento excessivo no micrografo. Este efeito é mais frequentemente observado quando o detergente está presente no buffer C) Onde o gelo é mais fino no centro do buraco, isso exclui fisicamente partículas do centro, causando aglomeração de partículas em direção à borda do buraco. Neste caso, não é extremo o suficiente para evitar que essas imagens sejam úteis, mas sugere que vale a pena selecionar áreas ligeiramente mais espessas. D) O gelo não é vitreous, os dados não devem ser coletados em áreas que se parecem com este micrografo de exemplo. Clique aqui para ver uma versão maior desta figura.
O processamento de imagens on-the-fly pode ajudar a detectar erros e problemas com a aquisição de dados e, portanto, é sempre recomendado sempre que possível. Por exemplo, o movimento excessivo dentro dos micrografos pode indicar que a bomba turbo do carregador automático está ativa, ou os dados estão sendo coletados em um quadrado de grade rachado onde o gelo está se movendo significativamente no feixe de elétrons, indicando que o quadrado da grade deve ser ignorado. Na mosca, a estimativa do CTF pode revelar circunstâncias em que um ponto de foco positivo (em vez de desfocus) é aplicado (onde programas de estimativa de CTF e parâmetros para encontrar esses pontos são usados) e determinar o turno de fase onde uma placa de fase Volta48 é usada. Nos pipelines de processamento de imagens em tempo real geralmente incluem um resumo gráfico dos dados (Figura 4A) para facilitar que os usuários avaliem rapidamente a qualidade do micrográfico e decidam se são necessárias alterações de coleta de dados.
A seleção de partículas de micrografias, evitando "falsos positivos", como contaminação ou a película de suporte à rede, pode exigir otimização. No entanto, catadores de partículas como o crYOLO muitas vezes funcionam suficientemente bem usando parâmetros padrão para um 'primeiro passe' dos dados (Figura 4B), permitindo a progressão para a classe 2D em média onde pode ser mais fácil avaliar a qualidade dos dados e a probabilidade de sucesso a jusante. Para a maioria dos projetos, a classificação 2D de partículas de ~> 10k deve começar a revelar classes que têm detalhes de estrutura secundária. Para seguir para 3D, a fase de classificação 2D deve normalmente revelar classes que representam uma gama de orientações de partículas. Se for revelada uma orientação preferencial, mais iterações de preparação amostral16 ou aquisição de dados adicionais com a amostra inclinada podem ser necessárias49. Todas as classes que mostram detalhes da estrutura secundária devem ser escolhidas para levar adiante para análise 3D, enquanto partículas de "lixo" são descartadas (Figura 4C).
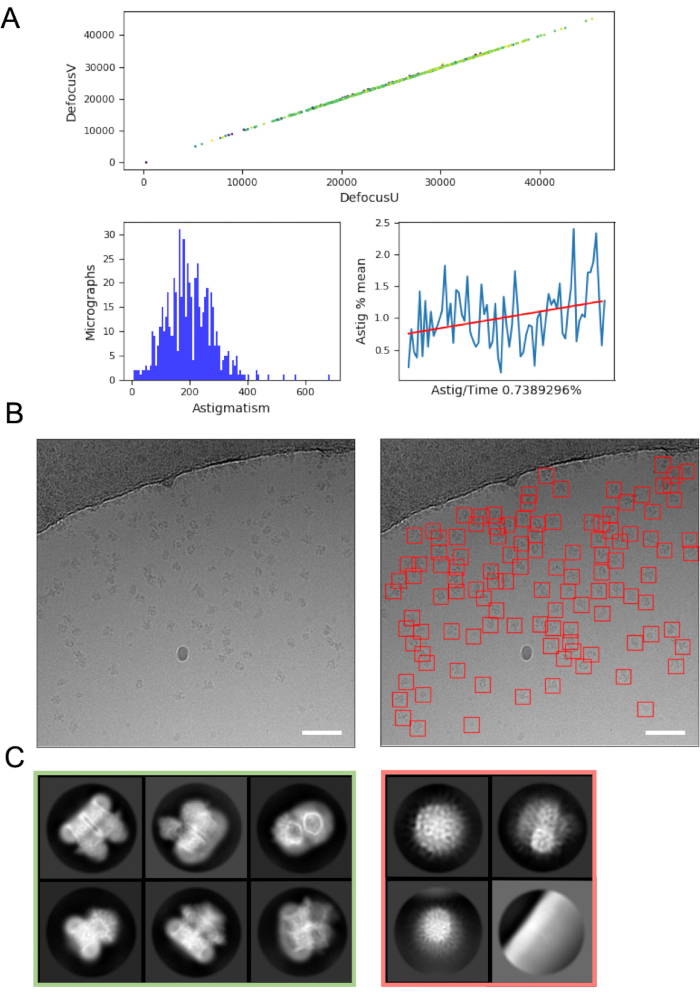
Figura 4: Etapas iniciais de processamento de imagem. A) Saída de um script de processamento de imagem 'on the fly'. B) Exemplo de micrografo (à esquerda) com partículas adequadamente escolhidas automaticamente identificadas usando o modelo geral crYOLO (à direita, com partículas delimitadas por quadrados vermelhos) As barras de escala (brancas) são de 50 nm. C) Resultados da classificação 2D mostrando classes que foram descartadas no quadrado vermelho, e classes das quais as partículas foram selecionadas para posterior processamento em verde. Clique aqui para ver uma versão maior desta figura.
Um pequeno subconjunto de partículas pode ser usado para gerar um modelo inicial (Figura 5A). Este modelo inicial pode então ser usado como um modelo inicial em classificação 3D e refinamento. No caso do RagAB, o conjunto de dados continha três conformadores distintos que podem ser separados durante a classificação 3D (Figura 5B). As partículas que contribuem para cada uma dessas classes podem então ser tratadas de forma independente e usadas para refinar um mapa de densidade EM que pode então estar sujeito a mais interpretação e construção de modelos.
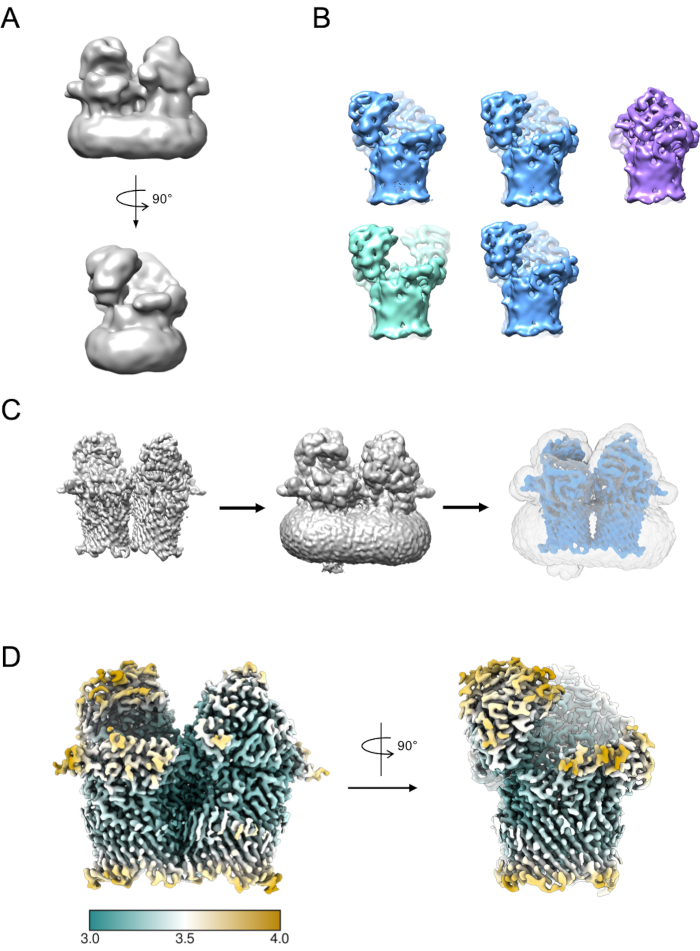
Figura 5: Gerando mapa de densidade 3D EM. A) Modelo inicial típico gerado usando RELION. B) Classificação 3D sobre 5 classes mostrando separação de partículas em três estados conformais distintos: aberto (verde), aberto (azul), fechado (roxo). C) Processo de criação de máscaras. O mapa do refinamento 3D (à esquerda) deve ser visualizado na quimera. O visualizador de volume pode então ser usado para identificar o limiar mais baixo no qual o mapa está livre de densidade desarticulada e noisy (meio). Esse valor limiar é insumo como limiar inicial de binarização no trabalho de criação da Máscara RELION. Uma saída de máscara de exemplo é mostrada em cinza (à direita). D) Mapa de densidade EM de alta resolução do estado aberto de RagAB (EMD-10245), filtrado e colorido pela resolução local (Å). Clique aqui para ver uma versão maior desta figura.
Discussão
Neste protocolo, descrevemos um pipeline básico aplicável aos espécimes favoráveis à SPA de rotina. Embora este método de mancha de papel filtro de formação e vitrificação de filme fino seja sem dúvida bem sucedido dado o seu uso na grande maioria dos projetos spa até o momento, ele vem com uma série de desvantagens. Estes incluem desperdício de amostra, as escalas de tempo lentas (segundos) necessárias para formar o filme fino e congelar a amostra, relataram irreproducibilidade27 e relataram efeitos negativos do uso de papel filtro para apagar o excesso de líquido50. Recentemente, novas tecnologias foram desenvolvidas para melhorar a reprodutibilidade da produção de filmes finos51,52. Outras tecnologias foram desenvolvidas que reduzem o tempo entre aplicação amostral e vitrificação53,54,55. Embora os métodos baseados em papel filtro para formação de filmes finos permaneçam o método mais onipresente de preparação de amostras de SPA crioEM no momento da escrita, essas novas tecnologias podem trazer uma série de benefícios em termos de eficiência e reprodutibilidade da vitrificação da grade, bem como criar novas oportunidades para trazer dimensões experimentais adicionais, como resolução de tempo e mistura rápida antes da vitrificação.
O processo de triagem de grade para a maioria dos usuários é atualmente um processo qualitativo que envolve a aquisição de atlas de baixa ampliação seguido de tirar imagens de alta ampliação em toda a rede para avaliar a distribuição de partículas. Embora esta seja uma abordagem suficientemente robusta para alguns tipos de espécimes, pode ser difícil avaliar olho se o espécime é realmente o que o pesquisador está esperando para imagem ou tem uma orientação preferida, por exemplo, com pequenas (<200 kDa) ou onde a morfologia de baixa resolução torna difícil identificar pelo olho se uma gama de distribuições de partículas estão presentes. Para alguns projetos, é impossível determinar se a amostra está como desejada, por exemplo, onde um ligante está vinculado ou onde a amostra está sendo rastreada para avaliar se uma pequena subunidade (por exemplo, 10 kDa) ainda está presente em associação com um complexo. Para esses projetos, pipelines totalmente automatizados para análise de dados combinados com uma coleta 'curta' de 0,5 - 1 h, que podem prosseguir através de etapas de processamento de imagem para classificação 2D ou mesmo classificação e refinamento 3D ajudariam a determinar eficientemente se uma coleta mais longa é justificada. Esses gasodutos ainda estão em desenvolvimento e não são amplamente implementados no momento, mas têm o potencial de melhorar a eficiência da triagem da grade crioEM, especialmente para espécimes desafiadores.
Melhorias nos detectores de elétrons diretos, bem como modificações na microscopia combinadas com avanços no processamento de imagens, como a coleta de dados de mudança de imagem, aumentaram o rendimento e a qualidade das imagens produzidas durante a aquisição de dados. Esse aumento na taxa de dados coletados destaca a necessidade de uma triagem minuciosa das redes crioEM antes de muitos dados de TB serem adquiridos.
O CrioEM SPA tornou-se uma técnica de biologia estrutural verdadeiramente convencional e, em muitos casos, a abordagem "ir para" para algumas classes de espécimes, como complexos macromoleculares heterogêneos e labile. Embora o protocolo aqui descreva uma visão geral básica do pipeline SPA, cada seção aqui coberta (vitrificação e triagem de grade, crioEM e processamento de imagem) é um tópico por si só e digno de exploração durante o desenvolvimento de um projeto SPA. À medida que as tecnologias de preparação de amostras e microscopia avançam, e novos algoritmos e abordagens de processamento de imagens entram em operação, o SPA continuará a se desenvolver como um pipeline, auxiliando os pesquisadores a obter informações sobre sistemas biológicos complexos.
Divulgações
Nenhum conflito de interesses é relatado.
Agradecimentos
Este trabalho foi apoiado pelo programa iNEXT-Discovery (Grant 871037) financiado pelo programa Horizon 2020 da Comissão Europeia. J B. R. White é financiado pelo Wellcome Trust (215064/Z/18/Z). Os microscópios FEI Titan Krios foram financiados pela Universidade de Leeds (prêmio UoL ABSL) e Wellcome Trust (108466/Z/15/Z). Agradecemos a M Iadanza pelo uso de seu roteiro de análise de micrografo. Reconhecemos a Diamond Light Source para acesso e suporte às instalações crio-EM no Centro Nacional de Bioimagem eletrônica (eBIC) do Reino Unido financiado pelo Wellcome Trust, MRC e BBRSC.
Materiais
| Name | Company | Catalog Number | Comments |
| Blunt tweezers | Agar Scientific | AGT5022 | |
| Cryo EM round storage box | Agar Scientific | AGG3736 | |
| CryoEM autogrid boxes | ThermoFisher Scientific | 1084591 | |
| CryoEM grids | Quantifoil | N1-C14nCu30-01 | |
| Ethane gas | Boc | 270595-F | |
| LN2 foam dewar | Agar Scientific | AG81760-500 | |
| LN2 storage dewar | Worthington industries | HC 34 | |
| Pipette | Gilson | 10082012 | |
| Pipette tips | Star labs | s1111-1706 | |
| Syringe | BD | BD 300869 | |
| Type II lab water | Suez | select fusion | |
| Vitrobot | ThermoFisher Scientific | 1086439 | |
| Vitrobot filter paper | Whatman | 1001-055 | |
| Vitrobot styrophome container assembly | ThermoFisher Scientific | 1086439 | |
| Vitrobot tweesers | ThermoFisher Scientific | 72882-D | |
| Software | |||
| EPU | ThermoFisher Scientific | 2.8.1.10REL | |
| TEM server | ThermoFisher Scientific | 6.15.3.22415REL | |
| Tia | ThermoFisher Scientific | 5.0.0.2896REL | |
| Titan krios microscope | ThermoFisher Scientific | Titan Krios G2 |
Referências
- Kuehlbrandt, W. The Resolution Revolution. Science. 343 (6178), 1443-1444 (2014).
- McMullan, G., Faruqi, A. R., Henderson, R. Direct Electron Detectors. Methods in Enzymology. , (2016).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: the nuts and bolts. Current Opinion in Structural Biology. , (2017).
- Lyumkis, D. Challenges and opportunities in cryo-EM single-particle analysis. Journal of Biological Chemistry. , (2019).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. , (2020).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. , (2020).
- Conley, M. J., et al. Calicivirus VP2 forms a portal-like assembly following receptor engagement. Nature. 565 (7739), 377-381 (2019).
- Hesketh, E. L., et al. The 3.3 Å structure of a plant geminivirus using cryo-EM. Nature communications. 9 (1), 2369 (2018).
- Malone, L. A., et al. Cryo-EM structure of the spinach cytochrome b6 f complex at 3.6 A resolution. Nature. 575 (7783), 535-539 (2019).
- Madej, M., et al. Structural and functional insights into oligopeptide acquisition by the RagAB transporter from Porphyromonas gingivalis. Nature Microbiology. , (2020).
- Gallardo, R., et al. Fibril structures of diabetes-related amylin variants reveal a basis for surface-templated assembly. Nature Structural and Molecular Biology. , (2020).
- Scarff, C., et al. Structure of the shutdown state of myosin-2. Nature. , (2020).
- Scarff, C. A., et al. Structure of the protective nematode protease complex H-gal-GP and its conservation across roundworm parasites. PLoS Pathogens. 16 (4), 1008465 (2020).
- Wu, M., Lander, G. C. How low can we go? Structure determination of small biological complexes using single-particle cryo-EM. Current Opinion in Structural Biology. , (2020).
- Khoshouei, M., Radjainia, M., Baumeister, W., Danev, R. Cryo-EM structure of haemoglobin at 3.2 Å determined with the Volta phase plate. Nature Communications. , (2017).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta crystallographica. Section D, Structural biology. 74, 560-571 (2018).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadanza, M. G. Variations on negative stain electron microscopy methods: tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biological procedures online. 6, 23-34 (2004).
- Baker, L. A., Rubinstein, J. L. Radiation Damage in Electron Cryomicroscopy. Methods in enzymology. 481, 371-388 (2010).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (02), 129-228 (1988).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in enzymology. 579, 51-86 (2016).
- Carragher, B., et al. Current outcomes when optimizing ‘standard’ sample preparation for single-particle cryo-EM. Journal of Microscopy. , (2019).
- Naydenova, K., Jia, P., Russo, C. J. Cryo-EM with sub-1 Å specimen movement. Science. , (2020).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in Enzymology. , (2016).
- Thompson, R. F., Iadanza, M. G., Hesketh, E. L., Rawson, S., Ranson, N. A. Collection, pre-processing and on-the-fly analysis of data for high-resolution, single-particle cryo-electron microscopy. Nature protocols. 14 (1), 100-118 (2019).
- Suloway, C., et al. Automated molecular microscopy: the new Leginon system. Journal of Structural Biology. 151 (1), 41-60 (2005).
- Zhang, J., et al. JADAS: A customizable automated data acquisition system and its application to ice-embedded single particles. Journal of Structural Biology. , (2009).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. , (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. , (2019).
- Fernandez-Leiro, R., Scheres, S. H. W. A pipeline approach to single-particle processing in RELION. Acta crystallographica. Section D, Structural biology. 73, 496-502 (2017).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. , (2018).
- Wagner, T., et al. SPHIRE-crYOLO is a fast and accurate fully automated particle picker for cryo-EM. Communications biology. 2 (1), 213-218 (2019).
- Bepler, T., et al. TOPAZ: A Positive-Unlabeled Convolutional Neural Network CryoEM Particle Picker that can Pick Any Size and Shape Particle. Microscopy and Microanalysis. , (2019).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 163 (2018).
- Zivanov, J., Nakane, T., Scheres, S. H. W. A Bayesian approach to beam-induced motion correction in cryo-EM single-particle analysis. IUCrJ. , (2019).
- Cianfrocco, M. A., Kellogg, E. H. What Could Go Wrong? A Practical Guide to Single-Particle Cryo-EM: From Biochemistry to Atomic Models. Journal of Chemical Information and Modeling. , (2020).
- Tagari, M., Newman, R., Chagoyen, M., Carazo, J. M., Henrick, K. New electron microscopy database and deposition system. Trends in Biochemical Sciences. , (2002).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: A public archive for raw electron microscopy image data. Nature Methods. , (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. , (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. , (2019).
- Goddard, T. D., et al. UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Protein Science. 27 (1), 14-25 (2018).
- Klebl, D. P., et al. Need for Speed: Examining Protein Behavior during CryoEM Grid Preparation at Different Timescales. Structure. , (2020).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 32 (2018).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proceedings of the National Academy of Sciences. , (2014).
- Zi Tan, Y., et al. Addressing preferred specimen orientation in single-particle cryo-EMthrough tilting. Nature Methods. , (2017).
- Armstrong, M., Han, B. -. G., Gomez, S., Turner, J., Fletcher, D. A., Glaeser, R. M. Microscale Fluid Behavior during Cryo-EM Sample Blotting. Biophysical Journal. 118 (3), 708-719 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. , (2017).
- Dandey, V. P., et al. Spotiton: New Features and Applications. Journal of Structural Biology. , (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta crystallographica. Section D, Structural biology. 75, 1063-1070 (2019).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. bioRxiv. , (2020).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: From sprays to jets and back. Acta Crystallographica Section D: Structural Biology. , (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados