Method Article
Tek Parçacıklı Kriyo-Elektron Mikroskopisi: Numuneden Yapıya
Bu Makalede
Özet
CryoEM kullanılarak makromoleküler komplekslerin yapı tespiti, belirli protein ve kompleks sınıfları için rutin hale gelmiştir. Burada, bu işlem hattı özetlenmiştir (numune hazırlama, tarama, veri toplama ve işleme) ve okuyucular daha zorlu numuneler durumunda değiştirilebilecek daha ayrıntılı kaynaklara ve değişkenlere yönlendirilir.
Özet
Kriyo-elektron mikroskopisi (cryoEM), tek parçacık analizi (SPA) ile makromoleküler komplekslerin yapı tespiti için güçlü bir tekniktir. Genel süreç, i) numunenin kriyoEM ızgarasında desteklenen ince bir filmde vitrifiye edilmesini içerir; ii) parçacık dağılımını ve buz kalitesini değerlendirmek için numunenin taranmasını; iii) ızgara uygunsa, analiz için tek bir parçacık veri kümesi toplamak; ve iv) EM yoğunluk haritası elde etmek için görüntü işleme. Bu protokolde, bir kullanıcının iş akışı sırasında değiştirebileceği değişkenlere ve sık karşılaşılan sorunların giderilmesine odaklanarak, bu adımların her biri için bir genel bakış sağlanır. Uzaktan mikroskop çalışmasının birçok tesiste standart hale gelmesiyle, mikroskoplara fiziksel erişim sınırlı olduğunda kullanıcıların verimli çalışma ve görüntülemede yardımcı olacak görüntüleme protokollerindeki varyasyonlar açıklanacaktır.
Giriş
Tek parçacıklı CryoEM
Yaşamı moleküler düzeyde araştırmak için yapıyı anlamalıyız. Protein yapısını araştırmak için NMR, X-ışını kristalografisi, kütle spektrometresi ve elektron mikroskopisi (EM) gibi birçok teknik mevcuttur. Bugüne kadar Protein Databank'a (PDB) yatırılan yapıların büyük çoğunluğu X-ışını kristalografisi kullanılarak çözülmüştür. Bununla birlikte, ~2012'den itibaren kriyo-elektron mikroskopisi (cryoEM) protein yapısının belirlenmesi için yaygın bir teknik haline geldi ve kullanımı önemli ölçüde arttı. Elektron Mikroskopi Veri Bankası'na (EMDB) yatırılan toplam EM haritası sayısı (Aralık 2020 itibarıyla) 2012 yılında 1.566 iken 13.421'dir (Şekil 1, www.ebi.co.uk). 2012 yılında cryoEM yoğunluk haritalarında modellenen atomik koordinatların sayısı sadece 67 idi, ancak Aralık 2020 itibarıyla 2.309 yapı birikti, 35 kat artış. Üretilen cryoEM yoğunluk haritalarının kalitesi ve miktarındaki bu temel büyüme, bazen 'çözünürlük devrimi' 1 olarak da adlandırılır, birden fazla alandaki ilerlemelerin bir birleşmesine neden oldu: doğrudan elektron dedektörleri olarak bilinen görüntüleme için yeni kameraların geliştirilmesi; yeni yazılım; ve daha kararlı mikroskoplar2,3,4.
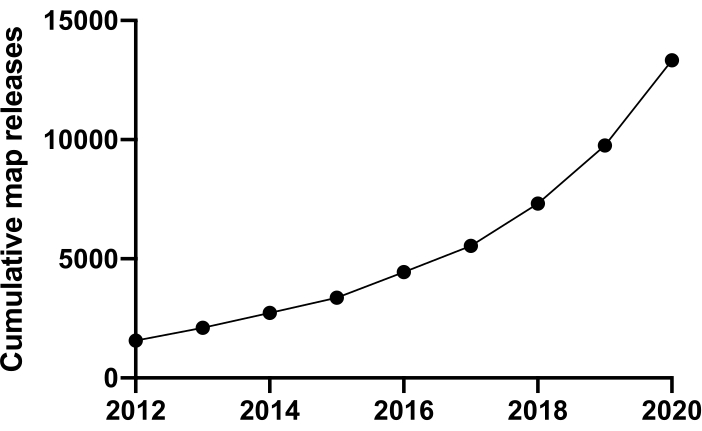
Şekil 1: 2012'den Aralık 2020'ye kadar EMDB'ye toplu gönderimler.
Tek parçacık analizi (SPA), virüsler7,8, membran proteinleri9,10, sarmal derlemeler11 ve boyutları büyüklük sıralarına göre değişen diğer dinamik ve heterojen makromoleküler kompleksler12,13 dahil olmak üzere izole komplekslerin5,6 yüksek çözünürlüklü yapılarını aydınlatarak çok çeşitli örnek türlerinde biyolojik içgörü oluşturmak için güçlü bir araçtır (39 kDa'dan itibaren 14,15 ila onlarca megadalton). Burada, örnekten yapıya cryoEM SPA için standart bir işlem hattı protokolü açıklanmıştır.
Bu boru hattına başlamadan önce, arıtılmış bir numune, aşağı akış başarısı şansını değerlendirmek için biyokimyasal analize tabi tutulmalıdır. Uygun bir numunenin hazırlanması, özellikle geçici ve heterojen (hem bileşimsel hem de konformasyonsal) kompleksler için SPA'nın önündeki en büyük engeldir. Makromoleküler karmaşık preparat, her kriyoEM mikrografında birçok parçacık elde etmek için yeterli konsantrasyonda ve cryoEM analizine çok uygun bir tampon bileşiminde mümkün olduğunca az kirletici içermelidir. Sakkaroz, gliserol ve yüksek (~> numune boyutuna, özelliklerine ve diğer tampon bileşenlerine bağlı olarak 350 mM tuz konsantrasyonları) dahil olmak üzere bazı tampon bileşenleri vitrifikasyon sürecine müdahale edebilir veya görüntülerdeki sinyal-gürültü oranını azaltabilir, yapı belirlemesini engelleyebilir16.
Tipik olarak, örnek saflığı değerlendirmek için minimum boyut dışlama kromatografisi (SEC) ve SDS- PAGE jel analizi kullanılmalıdır17,18, ancak dairesel dikroizm, fonksiyonel tahliller, SEC çok açılı ışık saçılımı ve termal stabilite testleri kriyoEM analizinden önce makromoleküler karmaşık preparatların nitel analizi için yararlı araçlardır. Bununla birlikte, bu biyokimyasal analizlerden elde edilen sonuçlar, numunenin yapısal heterojenliği ve kriyoEM ızgarası üzerindeki davranışı hakkında çok az fikir verebilir. Bu nedenle, negatif leke EM rutin olarak kompozisyonel ve konformasyonel heterojenliği değerlendirmek için hızlı, ucuz ve güçlü bir araç olarak kullanılır ve bu nedenle bir arıtmadan hangi elution fraksiyonunun en umut verici olduğunu veya farklı tampon bileşimlerini taramanın iyi bir yoludur19,20. Umut verici bir örnek belirlendikten sonra SPA cryoEM boru hattına geçebiliriz. Negatif leke her zaman cryoEM'de görülen sonraki sonuçlarla hizalamaz; bazen bir örnek negatif leke ile zayıf görünür, ancak cryoEM'de vitreus buzda görüldüğünde iyileşir. Buna karşılık, bazen numuneler negatif leke adımları sırasında mükemmel görünür, ancak cryoEM'e ilerlerken önemli ölçüde daha fazla optimizasyon gerektirir. Bununla birlikte, vakaların çoğunda negatif leke yararlı bir kalite kontrol adımı sağlar.
Vitrifikasyon
Elektron mikroskopunun vakum sistemi içindeki zorlu ortam, düzeltilmemiş biyolojik numunelerde hem dehidrasyona hem de radyasyon hasarına neden olur21. Bu nedenle, numuneyi doğal bir durumda görüntülemek için, biyolojik numune görüntülemeden önce korunmalıdır. Makromoleküler komplekslerin saf preparatları için vitrifikasyon, kompleksin atomik ayrıntılarını korurken cryoEM ile görselleştirilmesini sağlamak için tercih edilen yöntemdir. Vitrifikasyonun bir örnek hazırlama yöntemi olarak keşfedilmesi, Dubochet'in 2017 Nobel Kimya Ödülü'nde tanındığı biyolojik örneklerin elektron mikroskopisinde temel bir ilerlemeydi. Örnek vitrifikasyon, kriyoEM ızgara desteğinde askıya alınmış, genellikle onlarca nm kalınlığında, ilgi çekici örneği içeren ince bir çözelti tabakası oluşturmayı içerir. İnce film daha sonra ~-175 °C'de sıvı etan gibi bir kriyojende son derece hızlı bir şekilde dondurulur. Donma oranı ~106 °C/s'dir, amorf veya vitreus buz formları kadar hızlıdır ve numuneyi ince, sağlam bir filmle askıya alır22.
Dikkate alınması gereken ilk değişken, seçilen cryoEM ızgara desteğidir23. EM ızgarası genellikle bir destek yapısı üzerinde perforasyonlu (normal veya düzensiz) amorf bir karbon filmden oluşur. Destek yapısı tipik olarak genellikle bakırdan yapılmış 3,05 mm çapında dairesel bir metal ızgaradır, ancak altın veya molibden (tercih edilen termal genleşme özelliklerine sahip24) gibi diğer metaller kullanılabilir. Bazen, grafen, grafen oksit veya ince (~1-2 nm) amorf karbon tabakası gibi ızgara boyunca ek bir ince, sürekli destek uygulanır. Standart kriyoEM ızgaraları (en yaygın olarak delikli 400-200 örgü bakır (1,3 μm ile ayrılmış 1,2 μm yuvarlak delikler (r1,2 /1.3) veya 2 μm ile ayrılmış 2 μm karbon desteği - birçok farklı desen mevcut olmasına rağmen) bugüne kadar bildirilen yapıların büyük çoğunluğunda kullanılmıştır, gelişmiş iletkenliğe ve azaltılmış numune hareketine sahip yeni ızgara teknolojileri bildirilmiştir25 . Seçilen ızgaralar hidrofilik ve numune uygulamasına uygun hale getirmek için bir kızdırma deşarjı / plazma temizleme tedavisine tabi tutulur26.
Işıltı deşarjını takiben, bir sonraki aşama ince film oluşumudur. Bu ince film en yaygın olarak ızgaradaki fazla sıvıyı çıkarmak için filtre kağıdı kullanılarak oluşturulur. Bu manuel olarak gerçekleştirilebilirken, Vitrobot Mk IV (Thermo Fisher Scientific), EM GP II (Leica) ve CP3 (Gatan) dahil olmak üzere bir dizi dalma dondurma cihazı ticari olarak mevcuttur. Bu cihazlarla, çözeltideki ~3-5 μL numune EM ızgarasına uygulanır ve ardından filtre kağıdı kullanılarak fazla çözelti şişirilir. Üzerinde ince bir film asılı olan ızgara, daha sonra sıvı nitrojen (LN2) ile ~-175 °C'ye soğutulan sıvı etan içine daldırilir. Dondurulduktan sonra, ızgara görüntülemeden önce ve görüntüleme sırasında sapma noktasının (-137 °C) altında bir sıcaklıkta tutulur.
Numune taraması ve veri toplama
Bir cryoEM ızgarasının vitrifikasyonunu takiben, bir sonraki aşama, ızgaranın kalitesini değerlendirmek ve ızgaranın yüksek çözünürlüklü veri toplamaya devam etmek için uygun olup olmadığını belirlemek için ızgarayı taramaktır. İdeal bir cryoEM ızgarası, numunenin en uzun boyutunu barındırmak için yeterli olan buz kalınlığına sahip vitreus buza (kristal buzun aksine) sahiptir ve çevredeki buzun ortaya çıkan görüntüye mümkün olduğunca az gürültü katmasını sağlar. Buz içindeki parçacıklar biyokimya ile tutarlı bir boyuta ve (biliniyorsa) şekle sahip olmalı ve ideal olarak parçacık yönelimlerinin rastgele dağılımı ile monodisperz olmalıdır. Son olarak, ızgara istenen veri toplama uzunluğunu karşılamak için yeterli kalitede alanlara sahip olmalıdır. Numuneye bağlı olarak, bu, optimum ızgaralar üretilene kadar birçok vitrifikasyon ve tarama yinelemesi alabilir. Hem neyse ki hem de ne yazık ki, cryoEM ızgaralarındaki parçacık dağılımını değiştirmek için ampirik olarak test edilebilen çok çeşitli değişkenler vardır (16,27'de incelenmiştir). Bu yazıda membran protein projesi10 için temsili sonuçlar gösterilmiştir.
Uygun bir kılavuz belirlendikten sonra veri toplama işlemine devam edilebilir. Biyolojik numuneler için kriyo-iletimli elektron mikroskoplarının çeşitli modelleri, yüksek çözünürlüklü verileri otomatik bir şekilde toplamak için optimize edilmiştir. Genellikle, veriler 300 kV veya 200 kV sistemlerinde toplanır. EPU (Thermo Fisher Scientific)28, Leginon29, JADAS30 ve SerialEM31,32 gibi yazılımlar kullanılarak otomatik veri toplama elde edilebilir. Modern dedektörlerle otomatik veri toplama genellikle 24 saat içinde terabayt (TB) ham veri ile sonuçlanır (ortalama veri kümeleri ~ 4 TB boyutundadır).
Dünyanın büyük bir kısmında uygulanan COVID-19 kısıtlamaları nedeniyle (Aralık 2020'de yazma zamanı), birçok mikroskopi tesisi uzaktan erişim sunmaya geçti. Izgaralar bir mikroskobun otomatik yükleyicisine yüklendikten sonra, veri toplama uzaktan gerçekleştirilebilir.
Görüntü işleme ve model oluşturma
Veri toplama oturumunun genellikle 0,5-4 gün olabileceği durumlarda, sonraki görüntü işleme, bilgi işlem kaynaklarının kullanılabilirliğine bağlı olarak haftalar ve aylar sürebilir. İlk görüntü işleme adımları için standarttır, yani hareket düzeltme ve kontrast aktarma işlevi (CTF) tahmini 'anında' 33,34 gerçekleşir. Aşağı akış işleme için, çok sayıda yazılım paketi vardır. Parçacıklar 'toplanır' ve mikrografilerden çıkarılır35,36. Parçacıklar çıkarıldıktan sonra, standart bir protokol, parçacıkların homojen bir alt grubuna ulaşmak için birkaç sınıflandırma turu (hem iki boyutlu (2B) hem de üç boyutlu (3D) ve / veya belirli ilgi alanlarına odaklanmış) işlemek olacaktır. Parçacıkların bu homojen alt kümesi daha sonra 3D rekonstrüksiyon üretmek için birlikte ortalamalanır. Bu noktada veriler, örneğin CTF arıtma, bozulma düzeltmeleri37 ve Bayes parlatma38 aracılığıyla mümkün olan en yüksek kalite haritasını üretmek için genellikle daha fazla düzeltilir. Bu görüntü işlemenin sonucu, ilgi çekici biyolojik örneğin 3D cryoEM haritasıdır. 300 kV mikroskop sisteminde toplanan verilerle yeterli kalitede bir ızgaradan 'standart' otomatik tek parçacık deneyinde ulaşılan çözünürlük aralığı, protein kompleksinin boyutuna ve esnekliğine bağlı olarak tipik olarak 10 şile 2 şarasındadır. İdeal bir örnekle, SPA iş akışları kullanılarak ~1,2 şçözünürlüklerine ulaşıldı5. Bu protokol bir EM yoğunluk haritası elde etme adımlarını detaylandırırken, bu elde olduğunda, bir protein modelinin takılması ve rafine edilmesi (çözünürlük 3,5 Å'<) veya de novo39 inşa edilmesi yoluyla daha fazla yorumlanabilir. Yapı belirleme deneyleri ile ilişkili veriler, EM yoğunluk haritaları (Elektron Mikroskopi Veri Bankası)40, elde edilen atom koordinatları (Protein Veri Bankası)41 ve ham veri kümeleri (Elektron MikroskopiSi Kamu İmaj Arşivi)42 dahil olmak üzere çevrimiçi kamu depolarına yatırılabilir.
Bu protokolde , Porphyromonas gingivalis'ten dış zar protein kompleksi RagAB (~340 kDa) örnek bir makromoleküler kompleks10 (EMPIAR-10543) olarak kullanılır. CryoEM'e yeni gelenler için, iNEXT Discovery ve Instruct gibi finanse edilen erişim şemaları aracılığıyla eş incelemesine tabi olarak, örnekten yapıya bu işlem hattı aracılığıyla örnekler için destek mevcuttur.
Protokol
1. Izgara Vitrifikasyonu
NOT: 1. ve 2. adımlardaki tüm adımlar için, buz kirlenmesini azaltmak için yeni dekante edilmiş LN2 kullanarak LN2 sıcaklığına soğutmadan önce tüm aletlerin temiz , kuru ve oda sıcaklığında olduğundan emin olun. Mümkün olduğunda, %20 bağıl nem oranına < nem kontrollü bir ortamda çalışın. Çalışmaya başlamadan önce uygun kişisel koruyucu ekipman ve H&S belgelerinin yerinde olduğundan emin olun.
- İlgi çekici numunenin numune hazırlamaya hazır olduğundan emin olun.
- Uygun cryoEM ızgaralarını seçin ve bunların kızdırma deşarjı veya plazma tedavisi kullanılarak hidrofilik hale getirildiğine emin olun. Protokole çok çeşitli sistemler ve varyasyonlar mevcuttur, ancak hepsi ızgaraları bir kızdırma deşarjı / plazma temizleme sistemine yerleştirmeyi ve odaya belirli bir gaz karışımı / kimyasal buhar veya hava sokmadan önce odayı istenen vakum seviyesine pompalayacak bir program çalıştırmayı içerir. Sistemden bir elektrik akımı geçirilir, gaz parçacıklarını iyonize eder ve şebekelerin yüzeyinin daha hidrofilik hale getirilmesi için teşvik edilir.
- Arkadaki güç anahtarını kullanarak sistemi açarak ızgara vitrifikasyonu için dalma dondurma cihazını başlatın ve dokunmatik ekranın yüklenmesini bekleyin.
- Sağlanan kalemi veya parmakları kullanarak , Konsol'da odanın istenen çalışma sıcaklığını ayarlayın (mevcut aralık 4-60 ° C'dir, çoğu makromolekül için önerilir 4-6 °C).
- Nemlendiricinin dibindeki kauçuk borudan bir şırıng kullanarak nemlendiriciyi 50 mL tip II laboratuvar suyu ile doldurun. Doldurmadan önce şırınnadaki sıkışmış havayı çıkardığınızdan emin olun. Nemlendiriciyi aşırı doldurmamaya dikkat edin, aksi veya su odaya sıyırır. Nemlendirici dolduğunda, bir vakum contası oluşturmak için şırınna pistonunu 5-10 mL geri çekin.
- Konsolda, oda için istenen bağıl nemi ayarlayın (mevcut aralık% 0-100'dür, genellikle% 95-100 nem kullanılır). Haznenin çok ıslanmaması için ızgara yapımından hemen öncesine kadar nemi 'kapalı' olarak ayarlayın.
- Dalma dondurma cihazı cımbızlarını elde edin ve uygun boyutta bir diyaframı kesmek için satın alınan veya bir damga kullanarak pedlere sığacak şekilde doğru boyutta kesilmiş kağıdı filtreleyin.
- Kriyojeni dalma donması için hazırlayın.
- Metal kriyo ızgara kutu tutucusunu, kriyojen kabını ve metal örümceğin bacaklarını soğutucu kabına yerleştirin.
- Dış hazneyi LN2 ile doldurarak kabı soğutun. Kriyo ızgara kutusu tutucusunun üstünü örtmek için dış bölmeyi yukarıda tutun. Sistemin LN2 sıcaklığına dengelanmasına yardımcı olmak için kriyojen kabına ~ 1 cm ek LN2 ekleyin.
NOT: Kontaminasyon önleyici halka, kriyojen kabın etrafındaki nemli hava yoğunlaşmasını sınırlamak ve kriyo-soğutucu/etan kontaminasyonuna yol açan için kullanılabilir. Bu genellikle nem kontrollü bir ortamda gerekli değildir. Kirlenme önleyici halkayı kullanıyorsanız, kabı LN2 ile aşırı doldurmamaya dikkat edin, aksi takdirde halka işlemin ilerleyen bölümlerinde kabın içine bastırıldığında dökülebilir. - Örümcek bacaklarının kaynamasını gözlemlemek için 3-5 dakika bekleyin ve ardından kriyojen kabın vitrifikasyon ortamını yoğunlaştırmak için yeterince soğuk olduğundan emin olmak için 3 dakika daha bekleyin.
- Kriyojeni (sıvı etan) kriyojen kabına sıvılaştır.
- Gazı dağıtmak için ince borulu ve nozüllü etan silindir borusunu alın. Jilet kullanarak ucu kesilerek açılan diyafram açıklığına sahip bir P200 pipet ucu burada idealdir. Etanların uçta katılaşmasını ve gaz akışını engellemesini önlemek için daha geniş bir diyaframa ihtiyaç vardır.
- Kriyojen kabının kalan LN2 içermemesini sağlamak için etan gazı nozülini alın ve kriyojen kabının içine yerleştirin. Gaz silindiri regülatörünü kullanarak, düşük bir akış başlatın ve gazı yoğunlamak için kriyojen kabına kriyojen gazı dağıtın. Gazın doğrudan kriyojen kabının duvarına bastırılmış olarak aktığı ucu tutun, ancak yüzeye doğru bir dokunma hareketiyle hafifçe ileri geri hareket ettirin. Kriyojen kabı içinde kontrollü bir şekilde yoğunlaşmaya/sıvılaşmaya başlamak için düşük, sabit bir akış sağlamak için gazın akışını düzenleyin.
- Bardağı gümüş örümcek kenarın hemen altına doldurun ve gaz akışını durdurun, ardından çevredeki LN2'yi etan ile kirletmeyi önlemek için gaz hattını dikkatlice çıkarın.
- Sıvı etan içine herhangi bir dökmemek için çok dikkatli olarak LN2 ile soğutma kabını toplayın.
- Sıvı etanların yeterince soğuk bir sıcaklığa dengelendirilmesini sağlamak için örümcek bacaklarını ~ 3-5 dakika bekletin. Kriyojen bulutlu / hafif opak görünmeye başlayacaktır. Bu, donma noktasına yakın olduğunu gösterir. Bu aşamada, örümceği çıkarmak için cımbız kullanın. LN2 kriyojen kabı çevreleyen kap içinde tutulduğu sürece, etan artık sıvılaştırılmış ve 1-2 saat vitrifikasyon için uygun kalacaktır. Bununla birlikte, buz kirlenmesini azaltmak için özellikle nem kontrollü olmayan odalarda prosedürü mümkün olduğunca hızlı bir şekilde tamamlamayı hedefleyin.
NOT: Örümcek 'sıkışmış' gibi görünüyorsa, fındık gibi metal bir nesne kullanın ve hafifçe ısıtmak için örümceğin bacaklarına tutun ve ardından bacakları çıkarın.
- Dalma dondurma cihazını ve aksesuarlarını örnek vitrifikasyon için hazırlayın.
- Metal kriyo ızgara kutusu tutucusuna ızgara depolama kutuları ekleyin ve prosedür boyunca LN2'nin ızgara kutularının seviyesinin hemen üzerine kadar (genellikle her ~ 5 dakikada bir) yukarıda tutulmasını sağlayın.
- Dalma dondurma cihazı ekranında, İşlem Parametreleri kutusuna seçilen parametreleri girin: blot süresi (dalma dondurma cihazı pedlerinin bir araya geleceği zaman), kuvvet (leke pedlerinin ızgaradan uzaklığı, buz oluşumunun gradyanını değiştirir) ve toplam (şişkin pedlerin karşılamak için kaç kez geleceği). Bu parametreleri, bireysel dalma dondurma cihazına ve makromolekülün davranışına göre seçin. Tipik değerler 0 ile 5 arasında bir blot kuvveti, 1-6 sn arasında blot süresi ve toplam 1 blot kuvvetidir. Tipik bekleme süresi (lekeyi başlatma ile leke başlangıcı arasındaki süre) ve boşaltma süresi (dalmadan önce şişkinlik sonrası süre) 0-2 s'dir.
NOT: Kullanıcı tercihlerine bağlı olarak, Seçenekler, Çeşitli bölümünde, her baskıda bir sonraki adıma geçmek için Ayak Pedalı Kullan , Izgara aktarımını atla (cımbız kolunun hafifçe yükseltildiği son adımı atlar), İşlem Sırasında Nem'i kapatma (örnek uygulanırken, ızgarayı görmeyi zorlaştırabilecek odanın aktif nemlendirilmesini durdurur) ve Etanelift'i Otomatikleştir dahil olmak üzere ek seçenekler seçilebilir. (Cımbızın odaya yükseltilmesi ve soğutucu kabın yükseltilmesi adımını birleştirir- etan kabı adımını yükseltir ). Burada, tüm bu seçenekler açık. - Soğutma kabını odanın altındaki hareketli platform koluna güvenli bir şekilde yerleştirin
- Plastik halka klipslerinin sabitlendiğinden emin olmak için her bir leke koluna taze şişkinlik kağıdı yerleştirin. Her filtre kağıdı 16 blot 'a izin verir (kollar blotting kağıdını döndürür). Denetimler bölümündeki Leke kağıdını sıfırla düğmesine basın.
- Her hareketli parçanın beklendiği gibi çalıştığından emin olmak için dalma dondurma cihazı vitrifikasyon işleminin 1 tam döngüsünü çalıştırın.
- Yeni ızgara yerleştirmek için (veya ayak pedalını kullanın) tuşuna basın, sonra İşlemi başlatın, sonra İşleyin ve devam edin. Bu aşamada, şişkinlik kollarının beklendiği gibi birbirleriyle temas etmesini sağlayın.
- Nemlendiriciyi 'açın'. Su buharı üretilecektir (ayarlanan nem şu anda haznede olduğundan daha yüksek olduğu sürece).
- İlgi çekici örnek artık vitrifiye edilebilir. Ayak pedalını kullanın veya Yeni Izgara yerleştirin , dalma çubuğu odanın dışına inerek cımbızın montaja takılmasını sağlar.
- Dalma dondurma cihazı cımbızlarını kullanarak, ızgara üreticisine göre numune uygulaması için hangi tarafın doğru taraf olduğunu not etmeye dikkat ederek, istenen ışıma deşarjı / plazma temizlenmiş cryoEM ızgarasını alın. Cımbızla aşırı /gereksiz temastan kaçınmaya özen göstererek ızgarayı kenardan alın, çünkü bu desteke zarar verecektir. Siyah klibi cımbızın sırtlı kısmına doğru hareket ettirerek ızgarayı cımbızda sabitleyin. Izgaranın güvenli bir şekilde tutulması gerekir, ancak klips şişkin pedlerle temas edeceği için çok aşağıda olmamalıdır, bu da verimsiz şişkinliğe yol açacaktır ve daha sonra, cımbızın klibi serbest bırakırken bu noktanın altında tutulması gerekir.
- CryoEM ızgarasını tutan dalma dondurma cihazı cımbızlarını, baskın elinize doğru tarafı bakacak şekilde pnömatik kola yerleştirin. Dalma dondurma cihazı cımbızının ve haznesinin tasarımı, numunenin kullanıcının eline göre odanın sağ veya sol tarafından uygulanabileceği şekildedir.
NOT: Örneğin aynı şişkinlik parametreleriyle farklı taraflara uygulanması nadiren karşılaştırılabilir sonuçlarla sonuçlanır, bu nedenle solak araştırmacıların şişkinlik parametrelerini sağ elini kullanan meslektaşlarından bağımsız olarak ayarlamaları gerekebilir. - PresLeme İşlemi ve cımbızda tutulan ızgara odaya alınacak ve soğutucu kap yükseltilecektir.
- İşleme ve cımbıza basmak, ızgarayı, numuneyi ızgaraya uygulamak için bir pipet kullanılabileceği konuma taşıyacaktır. Izgaranın doğru tarafına bakan yan bağlantı noktasını açın ve pipet ucunun ızgaraya temas etmediğinden emin olun, çünkü ızgara desteğinin zarar görmesine / ızgaranın bükülmesine neden olabilir, ancak sıvıyı damlacık ızgaraya dağıtacak kadar yakın dağıtın. Tipik olarak, 3-5 μL uygulanır.
- Devam'a basın ve kullanıcı önceden tanımlanmış parametreler ızgarayı lekeler ve daha sonra örnek vitrifikasyon için soğutucu kabına monte edilmiş ızgara ile cımbızları daldırır. Cımbız, soğutucu kabını ve soğutucuyu tutan kolla birlikte inecek ve ızgarayı kriyojene batıracak.
- Izgarayı kriyojen kabından LN2'ye batırılmış ızgara depolama kutusuna aktarın.
- Cımbızı cımbız kolundan ayırın, vitrifiye ızgarayı kriyojen kabının kenarlarıyla temas etmemeye büyük özen göstererek. Cımbızın rahatça tutulabilmesi için kavramayı ayarlayın. Mümkün olduğunca hızlı ve dikkatli bir şekilde ızgarayı kriyojenden LN2'ye taşıyın. Bir elinizle, parmaklarınızı kullanarak cımbızı kapalı tutun ve diğer elinizle siyah klibi cımbızı kapalı tutarak yoldan yukarı doğru kaydırın. Kavramayı yeniden canlandırın ve ızgarayı ızgara depolama kutusuna işleyin.
- Tüm ızgaralar yapılana kadar 1.10-1.19 adımlarını yineleyin (tipik bir oturum 4-12 ızgara yapmayı içerir). Izgara içeren tüm ızgara depolama kutularını sonraki aşamalara kadar LN2 dewar'da saklayın.
2. Otomatik doldurucu mikroskobuna yüklemek için kırpma ızgaraları
- Daha önce açıklanan protokole göre ızgaraları autogrid derlemesine kırpın 28.
3. Mikroskoplara güvenli uzaktan giriş
NOT: Yazarken COVID-19 kontrolleri ile, aynı zamanda uluslararası seyahatle ilgili çevresel endişelerle, kullanıcının uzaktan çalıştığı yerlerde daha fazla mikroskopi olanağı sunulmaktadır. Bunun için uygulama yöntemi, her tesisin yerel BT yapılandırmasına ve iç ve dış kullanıcı topluluğunun ihtiyaçlarına göre değişecektir. Burada eBIC'deki cryoEM'lere uzaktan erişme ve mikroskobu EPU yazılımı aracılığıyla kontrol etme süreci açıklanmıştır.
- CryoEM'lere uzaktan giriş yapın. Uzaktan oturum açma, mikroskop destek bilgisayarına erişmek için NoMachine yazılımı aracılığıyla aracılık eder ve yalnızca FedID oturum açma kimlik bilgileri aracılığıyla bir ziyarette kayıtlı olan kullanıcılara erişime izin vermek üzere yapılandırılmıştır. Erişim yalnızca oturum süresince etkin kalır.
- NoMachine'i açın ve parola kimlik doğrulamasıyla nx-cloud.diamond.ac.uk için yeni bir NX bağlantısı başlatın.
- Bağlantıyı açın ve fedid@fed.cclrc.ac.uk kullanıcı adı ve FedID şifresi ile giriş yapın. İlgili destek bilgisayarına bağlantı açmak için kullanılabilir seçeneklerden ilgili mikroskoplara karşılık gelen simgeyi çift tıklatın.
- Windows oturum açma ekranına clrc\FedID kullanıcı adını ve parolasını girin.
- TeamViewer yazılımını masaüstü simgesinden açın ve sağlanan parolayla PartnerID: TEM'e bağlanın. Bu, destek bilgisayarından TEM PC'ye bağlantıyı kurar. TeamViewer şeridindeki Sonraki monitör düğmesi, mikroskop kullanıcı arabirimi ile EPU penceresi arasında geçiş yapmak için kullanılabilir.
- Mikroskop fonksiyonları daha sonra kullanıcılar tarafından doğrudan EPU arayüzü üzerinden kontrol edilebilir.
4. Numunelerin otomatik doldurucu mikroskobuna yüklenmesi ve buz ve numune kalitesi taraması
NOT: Bu bölümde, örnek tarama için otomatik yükleyici ve EPU yazılımı içeren bir mikroskop kullanılır, ancak bu, diğer yazılımlar ve diğer üreticilerin yan giriş sistemi ve kriyoEM'leri kullanılarak elde edilebilir.
- Kırpılmış ızgaraları daha önce açıklandığı gibi mikroskop otomatik yükleyicisine yükleyin28.
- Mikroskop kullanıcı arabiriminin otomatik yükleyici sekmesinde, oku kullanarak Seçenekler diyaloğu'nda sekme yapın ve Envanter düğmesine basın. Bu, bir kartuş olup olmadığını belirlemek için kasetteki her konumu sırayla kontrol eder. Dolu yuvalar mavi ile etiketlenecektir. Tüm dolu yuvalar eşlenmişse, geçerli konumdan sonra durdurmak için Envanter düğmesine tekrar basın, aksi takdirde tüm dolu yuvalar eşlenene kadar çalışır durumda bırakın. Tüm dolu yuvaları, sağlanan kutulardaki örnek ayrıntılarla etiketle.
- Mikroskop sütununa aktarılacak ızgarayı vurgulayın ve Yükle'yi tıklatın. Yuva etiketi, ızgara sahne alanına başarıyla yüklendikten sonra maviden sarıya döner. Izgaraları taramaya devam edin.
- EPU yazılımını açın. Hazırlık sayfasında Edinme optikleri ve ayarları'nı seçin ve ardından açılır menüden Atlas hazır ayarını seçin. Uygun ışın ayarı hazır ayarlarını seçin (örneğin, 64x nominal mag, spot boyut 5, Microprobe, Falcon dedektörü için paralel aralıkta aydınlatılmış bir alana sahip- daha fazla bilgi için ışın ayarı hazır ayarlarını seçerek bkz. Parametreleri mikroskopa itmek için Set tuşuna basın.
- Sütun vanalarını aç tuşuna basın ve FluScreen'i takın. Bir ışının görünür ve yeterince yayılmış ve dedektörü kaplayacak şekilde ortalanmış olup olmadığını kontrol edin. Gerekirse, X ve Y'deki sahne alanı hareketlerini kontrol etmek için joystick veya sahne alanı menüsünü kullanarak ızgaranın daha ince bir bölgesine gidin.
- EPU'daki Önizleme düğmesini kullanarak FluScreen'i kaldırın ve görüntü alın. Elde edilen görüntüye dayanarak, doz daha düşük bir sayı spot boyutuna taşınarak artırılabilir ve bunun tersi de olabilir.
- EPU'da Atlas sayfasına gidin ve Yeni Oturum'a basın. MRC görüntü biçimini seçin ve tarama oturumunu kaydetmek için uygun bir klasör adı ve konumu girin, ardından Uygula'yı tıklatın.
- Soldaki menüden Tarama'yı seçin. Atlas montajının alınması için her ızgaranın yanındaki onay kutularını işaretleyin. EPU'da tarama oturumuna başlayın . Kontrol edilen her ızgara için bir atlas elde edilecek ve tamamlandığında bir dizi kullanılabilir ızgara karesi listelenecektir. Her atlas, tarama sayfasında vurgulanarak görüntülenebilir ve benzer tahmin edilen buz kalınlığına sahip ızgara karelerini renklere göre gruplandırarak bir işaretleme ile tamamlanabilir.
- Tamamlandığında, toplanan atlasları gözden geçirin ve numune kalitesini daha yüksek büyütmelerde değerlendirmek için uygun ızgaraları tanımlayın (örneğin, kuru olmayan veya kalın buz tarafından gizlenen uygun sayıda ızgara karesi olanlar). EPU tarama menüsünde seçilen kılavuzu vurgulayın ve Örneği yükle'yi tıklatın.
- İstenen ızgara karelerini daha ayrıntılı incelemek için ışın ayarı hazır ayarlarını (her aşama için istenen ışın ayarı hazır ayarlarının açıklaması için bkz. 28) ve önizleme işlevini kullanın.
- Atlas tarama menüsünden, şu anda yüklü olan ızgarayı seçin ve ızgara görüntüsünde istenen konumun üzerine sağ tıklayarak ve ızgara karesine taşı'yı seçerek sahneyi doldurulmuş delikler içeren bir ızgara karesine taşıyın.
- EPU, Hazırlık sayfasına dönün ve GridSquare hazır ayarını seçin.
- EPU, Otomatik İşlevler sayfasını açın ve örneği ötenatrik yüksekliğe taşımak için GridSquare hazır ayarıyla sahne eğimine göre Otomatik-ötenek çalıştırın.
NOT: Kiriş eğimi ile otomatik ötenarik de mevcuttur, bu da sahne eğimi ile otomatik ösantrikten daha hızlı ancak genellikle daha az doğrudur. - EPU, Preparation'de yeni bir GridSquare Preview görüntüsü alın. Farklı buz kalınlıklarını gösteren farklı deliklerdeki farklı gri değerlere dikkat edin. Sahneyi buraya taşımak > sağ tıklatarak sahneyi bir deliğin üzerine taşıyın. Delik/Ötemerkez Yüksekliği hazır ayarını ve Önizleme'yi seçin.
NOT: İlgi parçacığının moleküler ağırlığına ve şekline bağlı olarak, Delik / Ösantrik Yükseklik büyütmesinde tanımlamak mümkün olabilir. - Veri Toplama hazır ayarını seçin ve parçacıkların kolay tanımlanmasını sağlayan bir büyütme ayarlayın (genellikle <2 Å/piksellik bir nesne örneklemesine karşılık gelen). Odaklama uzaklığını ~40-80 e-/ Å2 maruziyet elektron dozu ile ~-3 ila -5 μm olarak ayarlayın.
- Izgara boyunca parçacık dağılımı, yönelimi ve kirlenmesi için bir dizi buz kalınlığını değerlendirmek için 4,4'teki adımlarla yineleyin. Parçacık dağılımı, deliğin merkezine karşı kenarlara yakın değişebilir ve bu nedenle delik ile farklı konumları incelemek önemlidir.
- Atlaslardan yeterli ızgara karelerine sahip olarak vaat gösteren tüm ızgaraları tarayın. Bunları mikroskopta tutun ve EPU kullanarak veri toplamaya devam edin veya örnekleri mikroskoptan kaldırın ve veri toplama zamanlanana kadar LN2 altında depolayın.
5. Tek parçacıklı cryoEM veri toplama (uzaktan çalışmaya odaklanarak)
NOT: EPU ile veri toplama için ayrıntılı bir protokol, üreticiler kılavuzunda ve başka bir yerde açıklanmıştır28. Burada uzaktan çalışma için bu protokolün modifikasyonları (yani görevleri yürütmek için el panellerinin kullanımını azaltmak ve yazılım tabanlı alternatifler kullanmak) vurgulanmıştır.
- Oturum sırasında zaten bir atlas toplanmadıysa, ızgara için bir Atlas toplayın.
- Projenin deneysel ihtiyaçlarına göre ışın ayarı ön ayarlarının her birini tanımlayın.
- Görüntü kaydırma kalibrasyonları28 gerçekleştirin.
- EPU oturumunu ayarlayın.
- EPU'da, EPU sayfasını ve ardından Oturum Kurulumu'nu seçin, Yeni oturum'u ve tercihlerden Yeni'yi seçin.
- Yeni oturum'u seçin Önceki ayarları kullanma seçeneği sunan bir açılır pencere görünecektir. Evet, ayarları önceki EPU'dan (ör. numune taşıyıcı, defokus aralığı, otomatik netleme ayarları, ızgara türü) geçerli EPU oturumuna otomatik olarak yükler. Tercihlerden Yeni'yi seçmek, kullanıcının kaydedilmiş tercihleri (örneğin, netleme aralığı, otomatik netleme ayarları, ızgara türü) olan bir dosya seçmesini sağlar ve bu bilgiler EPU'ya önceden yüklenir.
- Oturum adını bilgilendirici bir şeyle doldurun. Yerel tesis bir adlandırma kuralı önerebilir.
- Tür'de El İle'yi seçin.
- Edinme modu için doğru delik merkezi veya daha hızlı alım seçin.
- Görüntü biçiminde, istediğiniz biçimi seçin.
- Uygun bir Depolama Klasörü seçin ve EPU oturum adına sahip bir dizin oluşturacaktır.
- Kullanılan ızgara tipine ve delik aralığına göre uygun Numune Taşıyıcısını seçin (örneğin, Quantifoil 1.2/1.3) ve Uygula'ya basın. Bu protokol, normal bir delik dizisi için şablon oluşturma işlemini açıklar
- İlk kılavuz karesini seçin ve bir edinme şablonu ayarlayın.
- Kareye Git seçimi, tüm kareler yeşilse, sol üstteki tümünün seçimini kaldır'ı tıklatın.
- Kutucukları açın (kutucuğu açmak > sağ tıklatın). Bir kare seçin (eklemek > sağ tıklatın, > Aşamayı kılavuz karesine taşı'yı sağ tıklatın).
- Delik seçimine gidin ve Otomatik Eucentric'e basın. Bu tamamlanana ve bir Izgara Meydanı görüntüsü alınana kadar bekleyin. Otomatik işlev başarısız olursa, bunun nedeni yüksekliğin önemli ölçüde kapalı olması olabilir; bu durumda, Grid Square büyütmedeki FluScreen kullanılarak manuel olarak ayarlanabilir.
- Delik boyutunu ölçün. Sarı daireleri hareket ettirip, doğru boyut ve aralıkla deliklerin üzerinde olacak şekilde ayarlayın.
- Delik bul tuşuna basın. Deliklerin doğru bulunarak bulunanın. Delik boyutunu değiştirmezseniz ve tekrar delikler bulamazsanız. Deliği doğru bulana kadar bunu tekrarlayın. Sürekli olarak başarısız olursa, ızgara kare büyütmede daha düşük bir sayı (daha parlak) nokta boyutuna geçmeyi düşünün.
- Delik seçimini ayarlamak için sağdaki Filtre buz kalitesi histogramını kullanın. Bu, kalın buz ve ince buz içeren alanları dışlamak için yararlı olabilir. Bu, bu oturum sırasında seçilen gelecekteki ızgara kareleri için hatırlanacaktır.
- Üstteki Seç menüsündeki araçlarla delik seçimini optimize edin. Örneğin, Kılavuz çubuğuna yakın delikleri kaldır'ı tıklatın.
- Şablon tanımına gidin ve Acquire tuşuna basın.
- Bul'u tıklatın ve orta delik. Şimdi deliğin etrafında sarı bir daire olan bir deliğin görüntüsü olacak.
NOT: Deliği bulmakta zorlanırsa, objektif diyaframı takın. Hala deliği bulamıyorsa, delik/ösantrik yükseklik hazır ayarı için pozlama süresini artırmayı veya bu hazır ayar veya görüntü kutusu için netlemeyi artırmayı deneyin. Büyük bir defocus değişikliği görüntü kaydırma hizalamasını değiştirebilir. - Sahne Alanı Kaymasından Sonraki Gecikmeyi ve Görüntü Kaydırmadan Sonraki Gecikme sürelerini 1-5 s olarak değiştirin.
- Maksimum Görüntü kaydırma değerinin (seçenek varsa) iseildiği gibi olduğunu işaretleyin. Sapma içermeyen görüntü kaydırma koleksiyonu kullanılıyorsa, bu değer EPU yapılandırma dosyasında tanımlanır, aksi takdirde 5 μm standart bir değerdir.
- Edinme alanı ekle'ye tıklayın ve sonra görüntünün herhangi bir yerine tıklayın. Alım alanını istediğiniz yere (yani bir deliğin kenarında) taşıyın, böylece alım alanları kirişle iki kat açığa çıkmasın (yeşil dairedeki kare dedektör alanını temsil eder, yeşil daire kiriş çapıdır).
- Sağ üstte, defocus aralığını ekleyin. Ardından diğer alım alanlarını ekleyin. Bir membran protein projesi için tipik bir defokus listesi -0,8 ila -3 μm defocus'dur.
- Otomatik netleme alanı ekle'yi tıklatın ve görüntünün herhangi bir yerine tıklayın. Otomatik odaklama alanını bir deliği çevreleyen karbona taşıyın. Standart uygulama, AFIS kullanırken merkezlemeden sonra veya karedeki z yüksekliği varyasyonuna bağlı olarak her 5-15 μm'de bir otomatik odaklama yapmaktır.
- Sürüklenme ölçüm alanı ekle'yi tıklatın, ızgara karesi başına bir kez gerçekleştirilen sürüklenme ölçümü, 0,05 nm/s olarak ayarlanmış bir eşik standart bir ayardır. Sürüklenme ölçüm alanı doğrudan otomatik odaklama alanıyla çakıçlanabilir (ve bu iyi bir fikirdir). Ne sürüklenme ne de otomatik odaklama alanının bir alım alanıyla çakışmamasını sağlama.
NOT: Şablon yürütme işlevi kullanılarak şablon denetlenebilir. Bu, satın alma alanlarının taşınmaya ihtiyaç olup olmadığını (örneğin, görüntülerde çok fazla / yeterli karbon yok) görmek için iyi bir fikirdir, ancak gerekli değildir. - Kare seçimine geri dönün ve ızgarada edinme için kareleri seçin. Kaç toplama alanı gerektiğini tahmin etmek için toplama alanlarının sayısını ve beklenen veri toplama oranını (dedektörlere ve deneysel kurulumaya dayalı tesisten) kullanın.
- İstenen tüm kareler seçildiğinde Tüm Kareleri hazırla'ya basın.
- Her kare toplandıktan sonra ızgara kareleri arasında gezinin ve seçim fırçasını kullanarak deliklere ince ayar yapın.
- Numune üzerinde bir sahne yerine geçin ve ötenatrik yüksekliği ayarlamak için otomatik işlevleri kullanın. Daha önce açıklandığı gibi mikroskop hizalamaları gerçekleştirin28, ancak Coma-free hizalama ve nesnel astigmatizma için manuel düzeltme yapmak yerine, yazılım içindeki hizalama araçlarından yararlanın. Kısaca, alım ışını koşullarını ayarlayın, objektif diyaframın (OA) çıkarıldığından ve aşamanın ösantrik yükseklikte bir ışın sabit numune alanı üzerine yer olduğundan emin olun. OA'yı yeniden takıp ortalamadan ve objektif lens astigmatizmasını EPU ile düzeltmeden önce otomatik işlevler içinde komasız hizalama gerçekleştirin. Her iki hizalamanın da uygun değerlere (<150 nm koma ve sıfır astigmatizmaya yakınsamasını sağlayın.
- Otomatik alım çalıştırmasına başlamadan önce, otomatik doldurucu turbo pompanın kapalı olduğundan ve objektif diyaframın takıldığından emin olun.
- Otomatik edinmede, otomatik veri alımını başlatmak için Çalıştırmayı başlat'a basın.
6. EM yoğunluk haritası elde etmek için görüntü işleme
NOT: CryoEM tesislerinin çoğu mikrografi filmlerinin 'anında' ön işlemesini sunar. ReliON işlem hatları28,33, cryoSPARC43, Scipion34 ve WarpEM44 dahil olmak üzere çok çeşitli yazılım paketleri ve yaklaşımları mevcuttur. RELION tabanlı bir işlem hattı burada açıklanmıştır ve kullanıcının mikrografi filmlerini bilgi işlem kaynaklarına erişimi olan uygun bir depolama konumuna taşıdığı varsayılır. Bir membran protein projesi için sürece genel bir bakış ve temsili sonuçlar sağlanmaktadır, ayrıntılı bir açıklama ve adım adım öğretici RELION ana sayfasında bulunabilir: https://www3.mrc-lmb.cam.ac.uk/relion.
- Mikrografi hareket düzeltme ve CTF tahmininin 'anında' analizini yapın. RELION'ı proje dizininde başlatın. İçe Aktarma, Hareket düzeltme ve CTF tahmin işlerini, veri toplama ve aktarımla eşzamanlı olacak şekilde döngüye alacak şekilde zamanlayın. Bir mikrografi analiz betiği28, astigmatizma ve tahmini defokus değerleri hakkında gerçek zamanlı görsel geri bildirim sağlar (bkz. temsili sonuçlar).
- Önceden işlenmiş mikrograflardan parçacıklar alın. Aralarından seçim yapabileceğiniz bir dizi otomatik parçacık toplama yazılımı paketi vardır. Referans ücretsiz ve şablon tabanlı malzeme çekme seçenekleri RELION37'nin Otomatik çekme sekmesinde kullanılabilir. Diğer programlar, örneğin parçacık toplama35 için crYOLO kullanılarak çeşitli adımlar için kullanılabilir.
- CTF tarafından düzeltilmiş mikrografilerden parçacıklar çıkarın.
NOT: Erken, 'temizleme', işleme adımları, çıkarma sırasında parçacıkları aşağı ölçekleme /bin için gereken hesaplama süresini azaltmak için. Ayıklama işinin nasıl çalıştırılacağına ilişkin ayrıntılar RELION 3.1 öğreticisinde bulunabilir. Bu proje için, parçacıklar başlangıçta 2 faktörü ile binned edildi. - 2D sınıf ortalaması gerçekleştirin. 100-200 sınıf arasında sınıflandırma, 100.000 ≥ parçacık içeren çoğu veri kümesi için iyi çalışır. Örnek yüksek simetriye (yani icosahedral virüs) sahip olmadığı sürece veri kümelerinin küçük olduğu durumlarda bile 200'den fazla sınıfın veya 50'den az sınıfın kullanılması önerilmez, bu durumda 50'den az sınıf hala iyi bir sonuç verebilir. Maske çapını parçacığın en uzun boyutuna uyum sağlayacak kadar büyük, ancak komşu parçacıkları dışlayacak kadar sıkı ayarlayın (bu biraz deneme yanılma gerektirebilir).
- Alt küme seçim işini kullanarak iyi sınıflar (örneğin, yapısal ayrıntılara sahip olanlar) seçin. İyi ve kötü 2D sınıf ortalamalarına örnekler temsili sonuçlar bölümünde bulunabilir.
- RELION'daki 3B ilk model işini kullanarak verilerden bir başlangıç modeli de novo oluşturun.
NOT: Daha az temiz parçacık yığınları çok referanslı ab initio SGD (stokastik gradyan iniş) arıtmadan yararlanabilir, çünkü bu, önemsiz / alt-optimal parçacıkları elemek için ek bir fırsat sağlar. İlgi parçacığına uyum sağlayabilen bir maske çapı seçin ve bunlar düzenli olarak iyi performans gösterdiğinden alanlar için varsayılan değerleri 'SGD' sekmesinde bırakın. İlk modelin Chimera'da (veya başka bir uygun görselleştirme programında) makul göründüğünden emin olun (bkz. temsili sonuçlar). - Başvuru modeli olarak adım 6.6'dan çıktıyı kullanarak verilerdeki heterojenliği gidermek için 3B sınıflandırma gerçekleştirin. Elde eden haritaları Chimera'da değerlendirin. Benzersiz konformasyon durumlarına karşılık gelen parçacık yığınlarını bağımsız olarak işleyin. İlgi çekici bir sınıf/sınıf seçmek ve ilişkili parçacık yığınları için particles.star dosyaları oluşturmak için alt küme seçim işini kullanın.
- 3D otomatik iyileştirmeyi çalıştırın. Önceki adımda elde edilen 3D sınıf ortalamalarını, karşılık gelen parçacık yığınlarının iyileştirilmesi için referans olarak kullanın. Arıtmanın çözünürlüğü verilerin Nyquist sınırına yaklaşıyorsa, aşağı ölçekleme yapmadan parçacıkları yeniden ayıklayın. Yeniden çıkarma işleminden sonra, 3D otomatik iyileştirme işini, birleştirilmiş parçacık yığınıyla tekrarlayın. Bu durumda, 3D başvuru modelleri, piksel ve kutu boyutları yeniden ayıklanan parçacık görüntülerinin boyutlarıyla tutarlı olacak şekilde yeniden ölçeklendirilmelidir. Bu işlemi gerçekleştirmek için relion_image_handler komut satırı aracını kullanın.
- Uygunsa inceltmede simetriyi kullanın. Yeniden yapılandırılmış bir harita simetriye sahipse, relion_align_symmetry komut satırı aracını kullanarak haritayı uygun simetri ekseninde hizalayın. Elde edilen hizalanmış eşlemeyi, başvuru sekmesinde belirtilen uygun simetri işleciyle yeni bir 3D otomatik iyileştirme işinde başvuru olarak kullanın.
- Haritaları 3D otomatik iyileştirmeden keskinleştirin. Bu, RELION'daki işlem sonrası iş kullanılarak yapılır, ancak önce rafine haritadan uygun bir maske oluşturulmalıdır. Maske oluşturma ve işlem sonrası adımlar RELION öğreticisinde ayrıntılı olarak yer alıp bulabilirsiniz (ayrıca bkz.
NOT: RELION'daki Bayes parlatma ve CTF arıtma işlevleri kullanılarak birçok yeniden yapılandırmanın çözümü daha da geliştirilebilir. Ctf arıtma iş türünü, daha yüksek sıralı sapmaları (ışın eğimi, trefoil sapmaları ve 4. sıra sapmalar) tahmin etmek ve düzeltmek için kullanın ve ayrı işler olarak, anizotropik büyütme ve parçacık başına defokus. Bunu takiben, parçacık başına ışın kaynaklı hareketi ele almak için Bayes parlatma işini (eğitimli veya varsayılan değerlerle) kullanın. RELION 3.1 öğreticisinde ele edildiği gibi, bu işler büyük olasılıkla yinelemeli bir yaklaşımdan (CTF-arıtma → Bayes parlatma → 3D otomatik arıtma → işlem sonrası → yararlanacaktır... döngü) her ikisi de daha yüksek çözünürlüklü modellerden yararlandığı için. - Gerekirse EM yoğunluk haritalarının elini düzeltin. Mevcut bir atomik modele uymaya çalışarak veya alfa sarmal bölgelerinin elliğini değerlendirerek elin doğru olup olmadığını belirlemek için eşlemeleri inceleyin. Gerektiğinde, 'vop zflip' komutunu kullanarak UCSF Chimera45'teki z ekseni boyunca haritayı çevirin.
Sonuçlar
Tarama yaparken, ızgaralar atlas aşamasında atılabilir, burada düşük büyütmede çözümlenen özellikler ızgarayı veri toplama için uygun değil olarak işaretler. Örneğin, bir ızgara, ızgara karelerinin çoğunluğu kırılmış olarak önemli mekanik hasara maruz kalmışsa (Şekil 2A) veya ızgaranın vitreus buzsuz 'kuru' göründüğü yerlerde (Şekil 2B). Bu tür ızgaralar genellikle ızgara karelerinin kenarları keskin ve farklı göründüğü için tanımlanabilir. Dalma dondurma cihazı kullanılarak yapılan ızgaraların çoğunda bir buz gradyanı gözlenir (Şekil 2C, D). Parçacık dağılımı, ilgi örneğine bağlı olarak, buz kalınlığına göre önemli ölçüde değişebilir ve bu nedenle parçacık dağılımını değerlendirmek için bir dizi ızgara karesinin taranması önerilir. Araçlar, kullanıcının cryoEM ızgaralarını incelemeye yeni başlayan kullanıcılar için özellikle yararlı olabilecek benzer veya farklı buz kalınlığındaki ızgara karelerini tanımlamasına yardımcı olmak için atlas tarama adımı sırasında EPU yazılımı içinde uygulanmıştır (Şekil 2E, F).

Şekil 2: Tarama oturumlarından örnek düşük büyütme 'atlas' montajları. A) Izgara karelerinin çoğunluğu kırılarak önemli hasar görmüş bir ızgara - toplama için uygun değil. B) Vitreus buzsuz kuru bir ızgara - toplanmaya uygun değil. C) Izgaranın ~ % 50'si ile bir buz gradyanı gösteren bir ızgara kullanılır. D) Izgaranın ~ % 33'üne sahip bir buz gradyanı kullanılır. Kullanılabilir ızgara kareleri toplama için uygun bir buz kalınlığına sahipse ve bir koleksiyonun minimum süresini karşılamak için yeterli toplama alanı varsa (örneğin, 24 saat) E) Buz kalınlıkları aralığına sahip örnek bir atlas varsa, hem C hem de D veri toplama için uygundur. F) Aynı atlas E'de sunulur, ancak ızgara kareleri buz kalınlığına göre EPU yazılımı tarafından kategorize edilir ve renklendirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Parçacık dağılımını tadırken, beklenen sonuçların doğru bir resmini sağlamak için büyütme ve toplam elektron dozu gibi görüntüleme parametrelerinin veri toplama sırasında kullanılması beklenenlere benzer olduğundan emin olun. Tarama sırasında, ideal bir parçacık dağılımı, bir dizi parçacık yönelimi görülebilen monodispersedir (numuneye ve parçacığın morfolojisinin mevcut bilgisine bağlı olarak, bu tespit edilmesi zor olabilir) (Şekil 3A). Buz, parçacıkların en büyük boyutunu karşılarken mümkün olduğunca ince olmalıdır, eğer buz çok inceyse, elektron ışını ile aydınlatıldığında eriyebilir. Bu, mikrografta aşırı harekete neden olur ve bu özelliği gösteren alanlardan kaçınılmalıdır (Şekil 3B). Kolektif deneyimden, bu etki en sık tamponda deterjan olduğunda gözlenir. Bu, deliğin merkezinde çok ince buzla sonuçlanabilir ve böylece parçacıklar fiziksel olarak dışlanabilir ve kenara doğru zorlanabilir. Bu efekt Şekil 3C'de gözlenir, ancak bu durumda aşırı bir örnek değildir ve bu görüntüler yine de bir veri kümesine yararlı bir şekilde katkıda bulunur. Son olarak, buzun vitreus olması gerekir; gridin (veya ızgaraların) çoğu veya tüm görüntülerin kristal buz (Şekil 3D) gösterdiği alanları veri toplamadan hariç tutun. Genellikle, ızgara karelerinin kenarında vitreus olmayan buz görülür. Okuyucular, daha fazla bilgi için ızgara vitrifikasyonu16 sırasında değiştirilebilen değişkenlerin ayrıntılı incelemelerine ve ince film ortamındaki parçacık davranışının açıklamalarına atıfta bulunulmaktadır46,47.

Şekil 3: Farklı parçacık dağılımlarını gösteren temsili mikrograflar. A) Bir dizi yönelimi benimseyen monodisperse parçacıklarının 'ideal' dağılımı. B) Mikrografiste aşırı harekete neden olan elektron ışınlarına maruz kalınca deforme olduğu deliğin ortasında aşırı ince buz. Bu etki en sık tamponda deterjan bulunduğunda gözlenir C) Buzun deliğin merkezinde daha ince olduğu durumlarda, bu fiziksel olarak parçacıkları merkezden dışlar ve parçacıkların delik kenarına doğru kalabalık olmasına neden olur. Bu durumda, bu görüntülerin yararlı olmasını önlemek için yeterince aşırı değildir, ancak biraz daha kalın alanları taramaya değer olduğunu önerir. D) Buz vitreus değildir, bu örnek mikrografa benzeyen alanlarda veri toplanmamalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Anında görüntü işleme, hataları ve veri toplama ile ilgili sorunları almaya yardımcı olabilir ve bu nedenle mümkün olduğunda her zaman önerilir. Örneğin, mikrografilerdeki aşırı hareket, otomatik doldurucu turbo pompanın aktif olduğunu veya elektron ışını içinde buzun önemli ölçüde hareket ettiği çatlak bir ızgara karesinde veri toplandığını ve ızgara karesinin atlanması gerektiğini gösterebilir. Anında CTF tahmini, pozitif bir odak noktasının (odaklama yerine) uygulandığı durumları (CTF tahmin programlarının ve bu noktaları bulmak için parametrelerin kullanıldığı) ve Volta faz plakasının kullanıldığı faz değişimini belirleyebilir48. Anında görüntü işleme işlem hatları, kullanıcıların mikrografi kalitesini hızlı bir şekilde değerlendirmelerini ve veri toplama değişikliklerinin gerekip gerek olmadığına karar vermelerini kolaylaştırmak için genellikle verilerin grafiksel bir özetini (Şekil 4A) içerir.
Mikrografilerden partikül seçimi, kontaminasyon veya ızgara destek filmi gibi 'yanlış pozitiflerden' kaçınmak optimizasyon gerektirebilir. Bununla birlikte, crYOLO gibi parçacık seçiciler genellikle verilerin 'ilk geçişi' için varsayılan parametreleri kullanarak yeterince iyi çalışır (Şekil 4B), verilerin kalitesini ve aşağı akış başarı olasılığını değerlendirmenin daha kolay olabileceği 2B sınıf ortalamasına ilerlemeyi sağlar. Çoğu proje için, ~> 10k parçacıklarının 2D sınıflandırılması ikincil yapı ayrıntısına sahip sınıfları ortaya çıkarmaya başlamalıdır. 3D'ye ilerlemek için, 2D sınıflandırma aşaması genellikle bir parçacık yönelim aralığını temsil eden sınıfları göstermelidir. Tercih edilen bir yönlendirme ortaya çıkarsa, örnek hazırlama16 veya örnek eğik olarak daha fazla veri toplama işlemi gerekebilir49. İkincil yapı detayını gösteren tüm sınıflar 3D analize ileriye doğru seçilmelidir, 'önemsiz' parçacıklar atılırken (Şekil 4C).
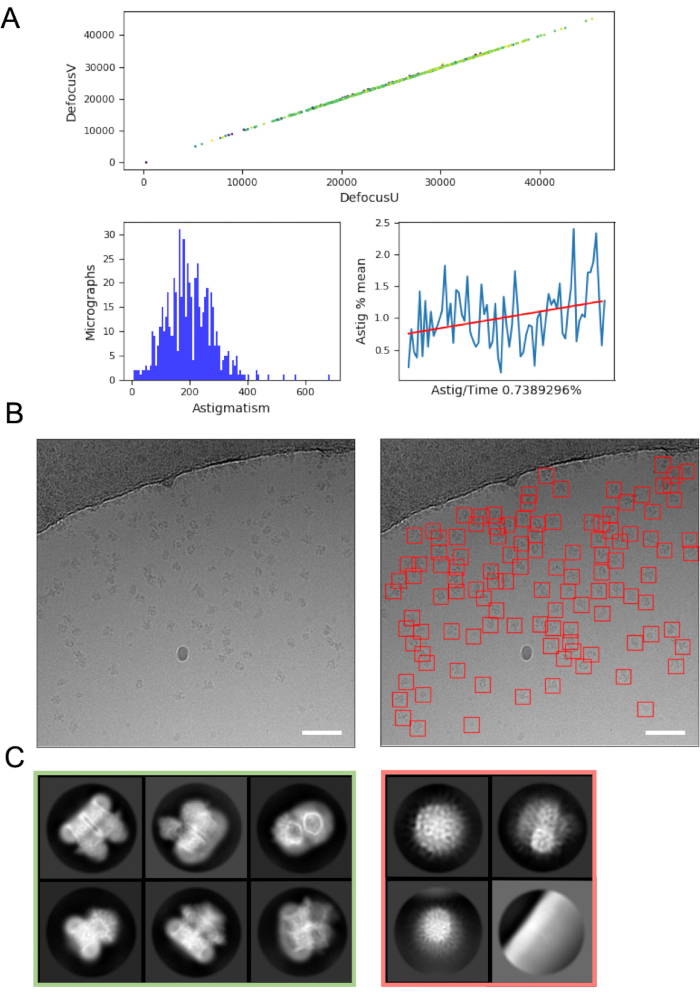
Şekil 4: İlk görüntü işleme adımları. A) 'Anında' görüntü işleme komut dosyasından çıktı. B) CrYOLO genel modeli kullanılarak tanımlanan uygun şekilde otomatik olarak seçilmiş parçacıklara sahip örnek mikrografi (solda) (sağda, kırmızı karelerle sınırlanmış parçacıklarla) Ölçek çubukları (beyaz) 50 nm'dir. C) Kırmızı karede atılan sınıfları ve yeşilde daha fazla işlem için parçacıkların seçildiği sınıfları gösteren 2D sınıflandırmadan elde edilen sonuçlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
İlk modeli oluşturmak için küçük bir parçacık alt kümesi kullanılabilir (Şekil 5A). Bu başlangıç modeli daha sonra 3B sınıflandırma ve iyileştirmede başlangıç modeli olarak kullanılabilir. RagAB durumunda, veri kümesi 3D sınıflandırma sırasında ayrılabilen üç ayrı konformatör içeriyordu (Şekil 5B). Bu sınıfların her birine katkıda bulunan parçacıklar daha sonra bağımsız olarak tedavi edilebilir ve daha sonra daha fazla yorum ve model oluşturmaya tabi olabilecek bir EM yoğunluk haritasını iyileştirmek için kullanılabilir.
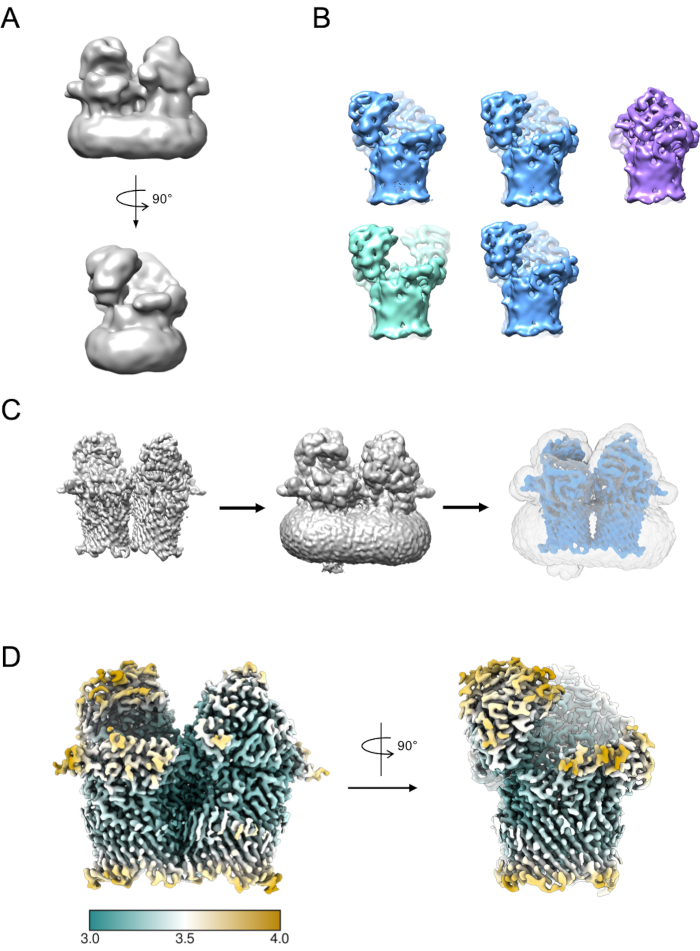
Şekil 5: 3D EM yoğunluk haritası oluşturma. A) RELION kullanılarak oluşturulan tipik başlangıç modeli. B) Parçacıkların üç ayrı konformasyon durumlarına ayrıldığını gösteren 5 sınıf üzerinde 3D sınıflandırma: açık-açık (yeşil), açık-kapalı (mavi), kapalı-kapalı (mor). C) Maske oluşturma işlemi. 3D arıtmadan (solda) harita kimera ile görselleştirilmelidir. Birim görüntüleyici daha sonra haritanın ayrık, gürültülü yoğunluktan (ortada) arındırılmış olduğu en düşük eşiği tanımlamak için kullanılabilir. Bu eşik değeri, RELION Maske oluşturma işinde ilk ikilileştirme eşiği olarak girilir. Örnek bir maske çıkışı gri (sağda) olarak gösterilir. D) RagAB'ın açık-kapalı durumunun (EMD-10245) yüksek çözünürlüklü EM yoğunluk haritası, yerel çözünürlük (Å) ile filtrelenmiş ve renklendirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde, rutin SPA'ya uygun numuneler için geçerli temel bir boru hattı tanımladık. İnce film oluşumu ve vitrifikasyonunun bu filtre kağıdı şişirme yöntemi, bugüne kadar SPA projelerinin büyük çoğunluğunda kullanımı göz önüne alındığında şüphesiz başarılı olsa da, bir dizi dezavantajla birlikte gelir. Bunlar arasında numune wastage, ince filmi oluşturmak ve numuneyi dondurmak için gereken yavaş zaman ölçekleri (saniye), geri alınamazlık27 ve fazla sıvıyı lekelendirmek için filtre kağıdı kullanmanın olumsuz etkileri bildirilmiştir50. Son zamanlarda, ince film üretiminin tekrarlanabilirliğini artırmak için yeni teknolojiler geliştirildi51,52. Örnek uygulama ve vitrifikasyon arasındaki süreyi azaltan başka teknolojiler geliştirilmiştir53,54,55. İnce film oluşumu için filtre kağıdı tabanlı yöntemler, yazma sırasında SPA cryoEM numune hazırlamanın en yaygın yöntemi olmaya devam ederken, bu yeni teknolojiler ızgara vitrifikasyonunun verimliliği ve tekrarlanabilirliği açısından bir dizi fayda sağlamanın yanı sıra, vitrifikasyondan önce zaman çözünürlüğü ve hızlı karıştırma gibi ek deneysel boyutlar getirmek için yeni fırsatlar yaratabilir.
Çoğu kullanıcı için ızgara tarama süreci şu anda, parçacık dağılımını değerlendirmek için ızgara boyunca yüksek büyütme görüntülerinin alınmasıyla düşük büyütme atlaslarının edinilmesini içeren nitel bir süreçtir. Bu, bazı numune türleri için yeterince sağlam bir yaklaşım olsa da, örneğin küçük (<200 kDa) örneklerle veya düşük çözünürlüklü morfolojinin bir dizi parçacık dağılımı olup olmadığını gözle tanımlamayı zorlaştırdığı durumlarda, örneğin araştırmacının görüntülemeyi umduğu şey olup olmadığını veya tercih edilen bir yönelime sahip olup olmadığını göz göre göre değerlendirmek zor olabilir. Bazı projeler için, örneğin bir ligand'ın nereye bağlı olduğu veya örneğin küçük (örneğin, 10 kDa) bir kompleksle ilişkili olarak hala mevcut olup olmadığını değerlendirmek için numunenin nerede tarandığını belirlemek imkansızdır. Bu projeler için, veri analizi için tam otomatik işlem hatları, görüntü işleme adımlarından 2D sınıflandırmaya veya hatta 3D sınıflandırmaya ve iyileştirmeye kadar ilerleyebilen 'kısa' 0,5 - 1-h koleksiyonlarıyla birleştiğinde, daha uzun bir koleksiyonun garanti edilip edilmeyeceğini verimli bir şekilde belirlemeye yardımcı olacaktır. Bu boru hatları hala geliştirilmektedir ve şu anda yaygın olarak uygulanmamaktadır, ancak özellikle zorlu numuneler için cryoEM ızgara taramasının verimliliğini artırma potansiyeline sahiptir.
Doğrudan elektron dedektörlerindeki iyileştirmelerin yanı sıra mikroskopideki değişiklikler, görüntü kaydırma veri toplama gibi görüntü işlemedeki gelişmelerle birlikte, veri toplama sırasında üretilen görüntülerin verimini ve kalitesini artırmıştır. Toplanan veri oranındaki bu artış, elde edilen birçok TB veri öncesinde cryoEM ızgaralarının kapsamlı bir şekilde taranmesi gereğini vurgulamaktadır.
CryoEM SPA gerçekten yaygın bir yapısal biyoloji tekniği haline gelmiştir ve çoğu durumda heterojen ve labile makromoleküler kompleksler gibi bazı örnek sınıfları için 'git' yaklaşımıdır. Buradaki protokol SPA boru hattına temel bir genel bakış açıklarken, burada kapsanan her bölüm (ızgara vitrifikasyonu ve taraması, kriyoEM ve görüntü işleme) bir SPA projesinin geliştirilmesi sırasında kendi başına ve keşfedilmeye değer bir konudur. Örnek hazırlama ve mikroskopi teknolojileri ilerledikçe ve yeni görüntü işleme algoritmaları ve yaklaşımları çevrimiçi oldukça, SPA bir boru hattı olarak gelişmeye devam edecek ve araştırmacıların karmaşık biyolojik sistemler hakkında fikir edinmelerine yardımcı olacaktır.
Açıklamalar
Çıkar çatışması bildirilmiyor.
Teşekkürler
Bu çalışma, Avrupa Komisyonu'nun Horizon 2020 programı tarafından finanse edilen iNEXT-Discovery (Grant 871037) tarafından desteklendi. J B. R. White, Wellcome Trust (215064/Z/18/Z) tarafından finanse edilir. FEI Titan Krios mikroskopları Leeds Üniversitesi (UoL ABSL ödülü) ve Wellcome Trust (108466/Z/15/Z) tarafından finanse edildi. M Iadanza'ya mikrografi analiz senaryosunu kullandığı için teşekkür ederiz. Wellcome Trust, MRC ve BBRSC tarafından finanse edilen İngiltere'nin ulusal Elektron Biyo görüntüleme Merkezi'ndeki (eBIC) kriyo-EM tesislerine erişim ve destek için Diamond Light Source'u kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Blunt tweezers | Agar Scientific | AGT5022 | |
| Cryo EM round storage box | Agar Scientific | AGG3736 | |
| CryoEM autogrid boxes | ThermoFisher Scientific | 1084591 | |
| CryoEM grids | Quantifoil | N1-C14nCu30-01 | |
| Ethane gas | Boc | 270595-F | |
| LN2 foam dewar | Agar Scientific | AG81760-500 | |
| LN2 storage dewar | Worthington industries | HC 34 | |
| Pipette | Gilson | 10082012 | |
| Pipette tips | Star labs | s1111-1706 | |
| Syringe | BD | BD 300869 | |
| Type II lab water | Suez | select fusion | |
| Vitrobot | ThermoFisher Scientific | 1086439 | |
| Vitrobot filter paper | Whatman | 1001-055 | |
| Vitrobot styrophome container assembly | ThermoFisher Scientific | 1086439 | |
| Vitrobot tweesers | ThermoFisher Scientific | 72882-D | |
| Software | |||
| EPU | ThermoFisher Scientific | 2.8.1.10REL | |
| TEM server | ThermoFisher Scientific | 6.15.3.22415REL | |
| Tia | ThermoFisher Scientific | 5.0.0.2896REL | |
| Titan krios microscope | ThermoFisher Scientific | Titan Krios G2 |
Referanslar
- Kuehlbrandt, W. The Resolution Revolution. Science. 343 (6178), 1443-1444 (2014).
- McMullan, G., Faruqi, A. R., Henderson, R. Direct Electron Detectors. Methods in Enzymology. , (2016).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: the nuts and bolts. Current Opinion in Structural Biology. , (2017).
- Lyumkis, D. Challenges and opportunities in cryo-EM single-particle analysis. Journal of Biological Chemistry. , (2019).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. , (2020).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. , (2020).
- Conley, M. J., et al. Calicivirus VP2 forms a portal-like assembly following receptor engagement. Nature. 565 (7739), 377-381 (2019).
- Hesketh, E. L., et al. The 3.3 Å structure of a plant geminivirus using cryo-EM. Nature communications. 9 (1), 2369 (2018).
- Malone, L. A., et al. Cryo-EM structure of the spinach cytochrome b6 f complex at 3.6 A resolution. Nature. 575 (7783), 535-539 (2019).
- Madej, M., et al. Structural and functional insights into oligopeptide acquisition by the RagAB transporter from Porphyromonas gingivalis. Nature Microbiology. , (2020).
- Gallardo, R., et al. Fibril structures of diabetes-related amylin variants reveal a basis for surface-templated assembly. Nature Structural and Molecular Biology. , (2020).
- Scarff, C., et al. Structure of the shutdown state of myosin-2. Nature. , (2020).
- Scarff, C. A., et al. Structure of the protective nematode protease complex H-gal-GP and its conservation across roundworm parasites. PLoS Pathogens. 16 (4), 1008465 (2020).
- Wu, M., Lander, G. C. How low can we go? Structure determination of small biological complexes using single-particle cryo-EM. Current Opinion in Structural Biology. , (2020).
- Khoshouei, M., Radjainia, M., Baumeister, W., Danev, R. Cryo-EM structure of haemoglobin at 3.2 Å determined with the Volta phase plate. Nature Communications. , (2017).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta crystallographica. Section D, Structural biology. 74, 560-571 (2018).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Scarff, C. A., Fuller, M. J. G., Thompson, R. F., Iadanza, M. G. Variations on negative stain electron microscopy methods: tools for tackling challenging systems. Journal of Visualized Experiments. (132), e57199 (2018).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biological procedures online. 6, 23-34 (2004).
- Baker, L. A., Rubinstein, J. L. Radiation Damage in Electron Cryomicroscopy. Methods in enzymology. 481, 371-388 (2010).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (02), 129-228 (1988).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in enzymology. 579, 51-86 (2016).
- Carragher, B., et al. Current outcomes when optimizing ‘standard’ sample preparation for single-particle cryo-EM. Journal of Microscopy. , (2019).
- Naydenova, K., Jia, P., Russo, C. J. Cryo-EM with sub-1 Å specimen movement. Science. , (2020).
- Passmore, L. A., Russo, C. J. Specimen Preparation for High-Resolution Cryo-EM. Methods in Enzymology. , (2016).
- Thompson, R. F., Iadanza, M. G., Hesketh, E. L., Rawson, S., Ranson, N. A. Collection, pre-processing and on-the-fly analysis of data for high-resolution, single-particle cryo-electron microscopy. Nature protocols. 14 (1), 100-118 (2019).
- Suloway, C., et al. Automated molecular microscopy: the new Leginon system. Journal of Structural Biology. 151 (1), 41-60 (2005).
- Zhang, J., et al. JADAS: A customizable automated data acquisition system and its application to ice-embedded single particles. Journal of Structural Biology. , (2009).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. , (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. , (2019).
- Fernandez-Leiro, R., Scheres, S. H. W. A pipeline approach to single-particle processing in RELION. Acta crystallographica. Section D, Structural biology. 73, 496-502 (2017).
- Gómez-Blanco, J., et al. Using Scipion for stream image processing at Cryo-EM facilities. Journal of Structural Biology. , (2018).
- Wagner, T., et al. SPHIRE-crYOLO is a fast and accurate fully automated particle picker for cryo-EM. Communications biology. 2 (1), 213-218 (2019).
- Bepler, T., et al. TOPAZ: A Positive-Unlabeled Convolutional Neural Network CryoEM Particle Picker that can Pick Any Size and Shape Particle. Microscopy and Microanalysis. , (2019).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 163 (2018).
- Zivanov, J., Nakane, T., Scheres, S. H. W. A Bayesian approach to beam-induced motion correction in cryo-EM single-particle analysis. IUCrJ. , (2019).
- Cianfrocco, M. A., Kellogg, E. H. What Could Go Wrong? A Practical Guide to Single-Particle Cryo-EM: From Biochemistry to Atomic Models. Journal of Chemical Information and Modeling. , (2020).
- Tagari, M., Newman, R., Chagoyen, M., Carazo, J. M., Henrick, K. New electron microscopy database and deposition system. Trends in Biochemical Sciences. , (2002).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: A public archive for raw electron microscopy image data. Nature Methods. , (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. , (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nature Methods. , (2019).
- Goddard, T. D., et al. UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Protein Science. 27 (1), 14-25 (2018).
- Klebl, D. P., et al. Need for Speed: Examining Protein Behavior during CryoEM Grid Preparation at Different Timescales. Structure. , (2020).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 32 (2018).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proceedings of the National Academy of Sciences. , (2014).
- Zi Tan, Y., et al. Addressing preferred specimen orientation in single-particle cryo-EMthrough tilting. Nature Methods. , (2017).
- Armstrong, M., Han, B. -. G., Gomez, S., Turner, J., Fletcher, D. A., Glaeser, R. M. Microscale Fluid Behavior during Cryo-EM Sample Blotting. Biophysical Journal. 118 (3), 708-719 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. , (2017).
- Dandey, V. P., et al. Spotiton: New Features and Applications. Journal of Structural Biology. , (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta crystallographica. Section D, Structural biology. 75, 1063-1070 (2019).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. bioRxiv. , (2020).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: From sprays to jets and back. Acta Crystallographica Section D: Structural Biology. , (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır