A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الحصول على بيانات موحدة للتصوير بالرنين المغناطيسي الحساس للميلانين العصبي للمادة السوداء
* These authors contributed equally
In This Article
Summary
يوضح هذا البروتوكول كيفية الحصول على بيانات التصوير بالرنين المغناطيسي الحساسة للميلانين العصبي للمادة السوداء.
Abstract
يلعب نظام الدوبامين دورا حاسما في الإدراك الصحي (على سبيل المثال ، مكافأة التعلم وعدم اليقين) والاضطرابات العصبية والنفسية (مثل مرض باركنسون والفصام). الميلانين العصبي هو منتج ثانوي لتخليق الدوبامين الذي يتراكم في الخلايا العصبية الدوبامينية في المادة السوداء. التصوير بالرنين المغناطيسي الحساس للميلانين العصبي (NM-MRI) هو طريقة غير جراحية لقياس الميلانين العصبي في تلك الخلايا العصبية الدوبامينية ، مما يوفر مقياسا مباشرا لفقدان خلايا الدوبامين في المادة السوداء ومقياسا بديلا لوظيفة الدوبامين. على الرغم من أن التصوير بالرنين المغناطيسي NM-MRI قد ثبت أنه مفيد لدراسة الاضطرابات العصبية والنفسية المختلفة ، إلا أنه يواجه تحديا من خلال مجال رؤية محدود في الاتجاه الأدنى والأعلى مما يؤدي إلى فقدان محتمل للبيانات من الاستبعاد العرضي لجزء من المادة السوداء. بالإضافة إلى ذلك ، يفتقر المجال إلى بروتوكول موحد للحصول على بيانات NM-MRI ، وهي خطوة حاسمة في تسهيل الدراسات متعددة المواقع على نطاق واسع والترجمة إلى العيادة. يصف هذا البروتوكول إجراء وضع حجم NM-MRI خطوة بخطوة وفحوصات مراقبة الجودة عبر الإنترنت لضمان الحصول على بيانات عالية الجودة تغطي المادة السوداء بأكملها.
Introduction
Neuromelanin (NM) هو صبغة داكنة موجودة في الخلايا العصبية الدوبامينية في المادة السوداء (SN) والخلايا العصبية النورادرينالية في الموضع الأزرق (LC) 1،2. يتم تصنيع NM عن طريق الأكسدة المعتمدة على الحديد من الدوبامين الخلوي والنورادرينالين ويتم تخزينها في فجوات الالتهام الذاتي في سوما3. يظهر لأول مرة في البشر حوالي 2-3 سنوات من العمر ويتراكم مع سن1،4،5.
داخل الفجوات المحتوية على NM للخلايا العصبية SN و LC ، تشكل NM مجمعات بالحديد. هذه المعقدات NM-iron هي مغناطيسية ، مما يسمح بالتصور غير الجراحي ل NM باستخدام التصوير بالرنين المغناطيسي (MRI)6,7. تعرف فحوصات التصوير بالرنين المغناطيسي التي يمكنها تصور NM باسم التصوير بالرنين المغناطيسي الحساس ل NM (NM-MRI) وتستخدم إما تأثيرات نقل المغنطة المباشرة أو غير المباشرة لتوفير تباين بين المناطق ذات التركيز العالي ل NM (على سبيل المثال ، SN) والمادة البيضاء المحيطة 8,9.
تباين نقل المغنطة هو نتيجة التفاعل بين بروتونات الماء المرتبطة بالجزيئات الكبيرة (المشبعة بنبضات نقل المغنطة) وبروتونات الماء الحرة المحيطة. في NM-MRI ، يعتقد أن الطبيعة المغناطيسية لمجمعات NM-iron تقصر T1 من بروتونات الماء الحرة المحيطة ، مما يؤدي إلى تقليل تأثيرات نقل المغنطة بحيث تظهر المناطق ذات التركيز العالي NM شديدة الكثافة في فحوصات NM-MRI10. على العكس من ذلك ، تحتوي المادة البيضاء المحيطة ب SN على نسبة عالية من الجزيئات الكبيرة ، مما يؤدي إلى تأثيرات نقل مغنطة كبيرة بحيث تظهر هذه المناطق منخفضة الكثافة في فحوصات NM-MRI ، مما يوفر تباينا عاليا بين SN والمادة البيضاء المحيطة.
في SN ، يمكن أن يوفر التصوير بالرنين المغناطيسي NM-MRI علامة على فقدان خلايا الدوبامين11 ووظيفة نظام الدوبامين12. هاتان العمليتان مناسبتان للعديد من الاضطرابات العصبية والنفسية وتدعمهما مجموعة واسعة من الأعمال السريرية وما قبل السريرية. على سبيل المثال ، لوحظت تشوهات في وظيفة الدوبامين على نطاق واسع في مرض انفصام الشخصية. أظهرت الدراسات التي أجريت في الجسم الحي باستخدام التصوير المقطعي بالإصدار البوزيتروني (PET) زيادة في إطلاق الدوبامين المخطط13،14،15،16 وزيادة قدرة تخليق الدوبامين17،18،19،20،21،22 . علاوة على ذلك ، أظهرت دراسات ما بعد الوفاة أن مرضى الفصام لديهم مستويات متزايدة من هيدروكسيلاز التيروزين - الإنزيم المحدد للمعدل المتورط في تخليق الدوبامين - في العقد القاعدية23 و SN24,25.
بحثت العديد من الدراسات في أنماط فقدان خلايا الدوبامين ، خاصة في مرض باركنسون. كشفت دراسات ما بعد الوفاة أن الخلايا العصبية الدوبامينية المصطبغة في SN هي الموقع الرئيسي للتنكس العصبي في مرض باركنسون 26,27 ، وأنه في حين أن فقدان خلايا SN في مرض باركنسون لا يرتبط بفقدان الخلايا في الشيخوخة الطبيعية28 ، إلا أنه يرتبط بمدة المرض 29 . على عكس معظم طرق التحقيق في نظام الدوبامين ، فإن عدم التدخل الجراحي والفعالية من حيث التكلفة ونقص الإشعاع المؤين يجعل NM-MRI علامة حيوية متعددة الاستخدامات30.
تم تطوير بروتوكول NM-MRI الموصوف في هذه الورقة لزيادة قابلية استنساخ NM-MRI داخل الموضوع وعبر الموضوع. يضمن هذا البروتوكول تغطية كاملة ل SN على الرغم من التغطية المحدودة لفحوصات NM-MRI في الاتجاه الأدنى الأعلى. يستخدم البروتوكول الصور السهمية والإكليلية والمحورية ثلاثية الأبعاد (3D) T1-weighted (T1w) ، ويجب اتباع الخطوات لتحقيق وضع مكدس الشرائح المناسب. تم استخدام البروتوكول المبين في هذه الورقة في دراسات متعددة31,32 وتم اختباره على نطاق واسع. أكمل Wengler et al. دراسة لموثوقية هذا البروتوكول حيث تم الحصول على صور NM-MRI مرتين في كل مشارك عبر أيام متعددة32. أظهرت معاملات الارتباط داخل الفئة موثوقية ممتازة للاختبار وإعادة الاختبار لهذه الطريقة للتحليلات القائمة على منطقة الاهتمام (ROI) و voxelwise ، بالإضافة إلى التباين العالي في الصور.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: تم إجراء البحث الذي تم إجراؤه لتطوير هذا البروتوكول وفقا لإرشادات مجلس المراجعة المؤسسية لمعهد ولاية نيويورك للطب النفسي (IRB # 7655). تم مسح موضوع واحد لتسجيل فيديو البروتوكول ، وتم الحصول على موافقة خطية مستنيرة. راجع جدول المواد للحصول على تفاصيل حول ماسح التصوير بالرنين المغناطيسي المستخدم في هذا البروتوكول.
1. معلمات اكتساب التصوير بالرنين المغناطيسي
- الاستعداد للحصول على صور T1w عالية الدقة باستخدام تسلسل صدى التدرج السريع المعد للمغنطة ثلاثية الأبعاد (MPRAGE) مع المعلمات التالية: الدقة المكانية = 0.8 × 0.8 × 0.8 مم3 ؛ مجال الرؤية (FOV) = 176 × 240 × 240 مم3 ؛ وقت الصدى (TE) = 3.43 مللي ثانية ؛ وقت التكرار (TR) = 2462 مللي ثانية ؛ وقت الانعكاس (TI) = 1060 مللي ثانية ؛ زاوية الوجه = 8 درجات ؛ عامل التصوير المتوازي داخل الطائرة (ARC) = 2 ؛ عامل التصوير المتوازي عبر المستوى (ARC) = 233 ؛ عرض النطاق الترددي = 208 هرتز / بكسل ؛ إجمالي وقت الاستحواذ = 6 دقائق و 39 ثانية.
- الاستعداد للحصول على صور NM-MRI باستخدام تسلسل صدى متدرج ثنائي الأبعاد (2D) مع تباين نقل المغنطة (2D GRE-MTC) مع المعلمات التالية: الدقة = 0.43 × 0.43 مم2 ؛ مجال الرؤية = 220 × 220 مم2 ؛ سمك الشريحة = 1.5 مم ؛ 20 شريحة فجوة الشريحة = 0 مم ؛ TE = 4.8 مللي ثانية ؛ TR = 500 مللي ثانية ؛ زاوية الوجه = 40 درجة ؛ عرض النطاق الترددي = 122 هرتز / بكسل ؛ إزاحة تردد MT = 1.2 كيلو هرتز ؛ مدة نبض MT = 8 مللي ثانية ؛ زاوية الوجه MT = 670 درجة ؛ عدد المتوسطات = 5 ؛ إجمالي وقت الاستحواذ = 10 دقائق 4 ثوان.
ملاحظة: على الرغم من أن النتائج المعروضة استخدمت معلمات اكتساب التصوير بالرنين المغناطيسي هذه ، إلا أن هذا البروتوكول صالح للعديد من بروتوكولات التصوير T1w و NM-MRI. يجب أن يغطي بروتوكول NM-MRI ~ 25 مم في الاتجاه الأدنى الأعلى لضمان التغطية الكاملة ل SN.
2. وضع حجم NM-MRI
- الحصول على صورة T1w عالية الدقة (حجم فوكسل الخواص ≤1 مم). استخدم إعادة التنسيق عبر الإنترنت مباشرة بعد الحصول على الصورة لإنشاء صور T1w عالية الدقة محاذاة لخط المفصل الأمامي واللاحق (AC-PC) وخط الوسط.
- قم بإجراء إعادة التهيئة عبر الإنترنت باستخدام البرنامج الذي يوفره البائع (على سبيل المثال ، في حالة الحصول على بيانات على ماسح ضوئي GE: إعادة الإعمار متعدد المستويات (MPR) في التخطيط ؛ في حالة الحصول على بيانات على ماسح ضوئي من Siemens: MPR في بطاقة المهام ثلاثية الأبعاد ؛ في حالة الحصول على بيانات على ماسح ضوئي من Philips: MPR في وضع العرض لحزمة VolumeView).
- قم بإنشاء عمليات إعادة بناء متعددة المستويات لصورة 3D T1w في المستوى المحوري بشكل عمودي على خط AC-PC لتغطية الدماغ بالكامل بأقل فجوة شريحة.
- قم بإنشاء عمليات إعادة بناء متعددة المستويات لصورة 3D T1w في المستوى الإكليلي بشكل عمودي على خط AC-PC لتغطية الدماغ بالكامل بأقل فجوة شرائح.
- قم بإنشاء عمليات إعادة بناء متعددة المستويات لصورة 3D T1w في المستوى السهمي الموازي لخط AC-PC لتغطية الدماغ بالكامل بأقل فجوة شرائح.
- قم بإجراء إعادة التهيئة عبر الإنترنت باستخدام البرنامج الذي يوفره البائع (على سبيل المثال ، في حالة الحصول على بيانات على ماسح ضوئي GE: إعادة الإعمار متعدد المستويات (MPR) في التخطيط ؛ في حالة الحصول على بيانات على ماسح ضوئي من Siemens: MPR في بطاقة المهام ثلاثية الأبعاد ؛ في حالة الحصول على بيانات على ماسح ضوئي من Philips: MPR في وضع العرض لحزمة VolumeView).
- قم بتحميل طرق العرض السهمية والإكليلية والمحورية لصورة T1w عالية الدقة المعاد تنسيقها وتأكد من وجود خطوط مرجعية تصور موقع كل شريحة معروضة.
- حدد الصورة السهمية التي توضح أكبر فصل بين الدماغ المتوسط والمهاد (الشكل 1 أ). للقيام بذلك ، افحص بصريا الشرائح السهمية لصورة T1w المعاد تنسيقها حتى يتم تحديد الشريحة التي تظهر هذا الفصل الأكبر.
- باستخدام الصورة السهمية من نهاية الخطوة 2.3 ، حدد بصريا المستوى الإكليلي الذي يحدد الجانب الأمامي من الدماغ المتوسط (الشكل 1 ب).
- باستخدام الصورة الإكليلية من نهاية الخطوة 2.4 ، حدد بصريا المستوى المحوري الذي يحدد الجانب السفلي من البطين الثالث (الشكل 1C).
- في الصورة السهمية من نهاية الخطوة 2.3 ، قم بمحاذاة الحد العلوي لحجم NM-MRI مع المستوى المحوري المحدد في الخطوة 2.5 (الشكل 1D).
- حرك الحد العلوي لحجم NM-MRI 3 مم في الاتجاه المتفوق (الشكل 1E).
- قم بمحاذاة حجم NM-MRI مع خط الوسط في الصور المحورية والإكليلية (الشكل 1F).
- الحصول على صور NM-MRI.
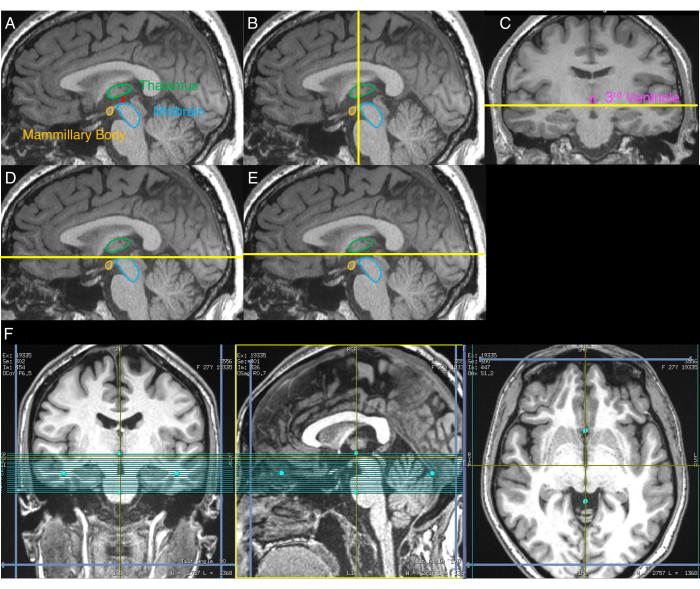
الشكل 1: صور تعرض إجراء وضع حجم NM-MRI خطوة بخطوة. تشير الخطوط الصفراء إلى موقع الشرائح المستخدمة لوضع الحجم كما هو موضح في البروتوكول. (أ) أولا، يتم تحديد الصورة السهمية ذات الفصل الأكبر بين الدماغ المتوسط والمهاد (الخطوة 2.3 من البروتوكول). (ب) ثانيا، باستخدام الصورة من ( أ)، يتم تحديد المستوى الإكليلي الذي يحدد الجانب الأمامي من الدماغ المتوسط (الخطوة 2.4). (ج) ثالثا، في الصورة الإكليلية من المستوى المحدد في المستوى ( ب)، يتم تحديد المستوى المحوري الذي يحدد الجانب السفلي من البطين الثالث (الخطوة 2.5). (د) رابعا ، يتم عرض المستوى المحوري المحدد في C على الصورة السهمية من A (الخطوة 2.6). (ه) خامسا، إزاحة المستوى المحوري من D بمقدار 3 مم في الاتجاه الأعلى، ويشير هذا المستوى إلى الحد الأعلى لحجم التصوير بالرنين المغناطيسي NM-MRI (الخطوة 2.7). (F) موضع حجم NM-MRI النهائي حيث تتوافق الصورة الإكليلية مع C ، وتقابل الصورة السهمية A ، والصورة المحورية تتوافق مع المستوى المحوري في E. يتم محاذاة حجم NM-MRI مع خط الوسط في الدماغ في الصور الإكليلية والمحورية وخط AC-PC في الصورة السهمية (الخطوة 2.8). تمت إعادة طباعة جزء من هذا الرقم بإذن من Elsevier من 30. الاختصارات: NM-MRI = التصوير بالرنين المغناطيسي الحساس للميلانين العصبي ؛ AC-PC = المفصل الأمامي الخلفي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
3. فحوصات مراقبة الجودة
- تأكد من أن صور NM-MRI المكتسبة تغطي SN بالكامل وأن SN مرئي في الصور المركزية ولكن ليس في الصور الأكثر تفوقا أو الأقل شأنا لحجم NM-MRI. بخلاف ذلك (الشكل 2) ، كرر الخطوات 2.3-2.9 لضمان وضع حجم NM-MRI الصحيح. إذا تحرك المشارك بشكل ملحوظ منذ الحصول على فحص T1w عالي الدقة ، فكرر الخطوات 2.1-2.9.
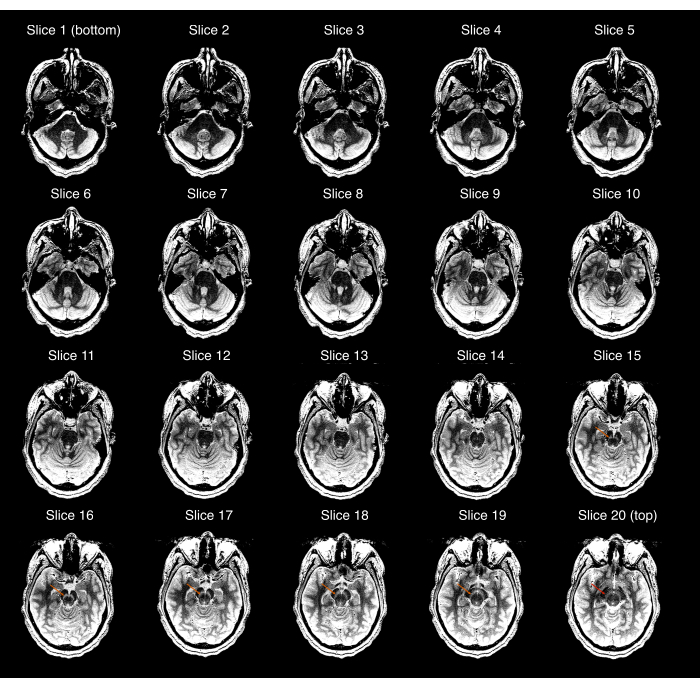
الشكل 2: مثال على اكتساب NM-MRI الذي فشل في فحص مراقبة الجودة الأول (الخطوة 3.1 من البروتوكول). يتم عرض كل شريحة من شرائح 20 NM-MRI من الأكثر شأنا (الصورة العلوية اليسرى) إلى الأكثر تفوقا (الصورة السفلية اليمنى) ؛ تم تعيين نافذة / مستوى الصورة للمبالغة في التباين بين المادة السوداء و Crus cerebri. توضح الأسهم البرتقالية في الشرائح 15-19 موقع المادة السوداء في تلك الشرائح. يظهر السهم الأحمر في الشريحة الأكثر تفوقا (الشريحة 20) أن المادة السوداء لا تزال مرئية في هذه الشريحة ، وبالتالي ، فإن الاستحواذ يفشل في فحص الجودة. اختصار: NM-MRI = التصوير بالرنين المغناطيسي الحساس للميلانين العصبي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
- تحقق من القطع الأثرية ، خاصة تلك التي تمر عبر SN والمادة البيضاء المحيطة ، عن طريق الفحص البصري لكل شريحة من فحص NM-MRI المكتسب.
- ابحث عن التغييرات المفاجئة في شدة الإشارة بنمط خطي لا يحترم الحدود التشريحية العادية. على سبيل المثال ، قد يظهر هذا كمنطقة منخفضة الكثافة محاطة بمنطقتين عاليتي الكثافة.
- إذا كانت القطعة الأثرية ناتجة عن الأوعية الدموية (الشكل 3 أ) ، فاحتفظ بصور NM-MRI لأن هذه القطع الأثرية ستكون موجودة دائما على الأرجح.
- إذا كانت القطع الأثرية ناتجة عن حركة رأس المشارك (الشكل 3 ب) ، فذكر المشارك بالبقاء ثابتا قدر الإمكان واستعادة صور NM-MRI وفقا للخطوة 3.2.5.
- إذا كانت القطع الأثرية غامضة (الشكل 3C) ، فأعد الحصول على صور NM-MRI وفقا للخطوة 3.2.5. عند إعادة الاستحواذ ، إذا ظلت القطع الأثرية موجودة ، فتابع هذه الصور لأنها من المحتمل أن تكون بيولوجية وليست نتيجة لمشكلات الاستحواذ.
- إذا اجتازت صور NM-MRI فحص مراقبة الجودة في الخطوة 3.1 ، فانسخ موضع حجم NM-MRI السابق. إذا فشلت صور NM-MRI في فحص مراقبة الجودة في الخطوة 3.1 ، كرر الخطوات 2.3-2.9 لضمان وضع حجم NM-MRI الصحيح (أو الخطوات 2.1-2.9 إذا تحرك المشارك بشكل كبير).

الشكل 3: أمثلة على عمليات الاستحواذ على NM-MRI التي فشلت في فحص مراقبة الجودة الثاني (الخطوة 3.2 من البروتوكول). يتم عرض شريحة تمثيلية واحدة فقط لكل حالة. (أ) اكتساب NM-MRI الذي يفشل في فحص مراقبة الجودة بسبب قطعة أثرية للأوعية الدموية (الأسهم الحمراء) التي هي نتيجة للوعاء الدموي الذي تم تحديده بواسطة الأسهم الزرقاء. (ب) اقتناء NM-MRI الذي يفشل في فحص مراقبة الجودة بسبب القطع الأثرية المتحركة (الأسهم الحمراء). (ج) اقتناء NM-MRI الذي يفشل في فحص مراقبة الجودة بسبب قطعة أثرية غامضة (الأسهم الحمراء). اختصار: NM-MRI = التصوير بالرنين المغناطيسي الحساس للميلانين العصبي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Access restricted. Please log in or start a trial to view this content.
النتائج
يوضح الشكل 4 النتائج التمثيلية لمشاركة تبلغ من العمر 28 عاما لا تعاني من اضطرابات نفسية أو عصبية. يضمن بروتوكول NM-MRI تغطية كاملة ل SN ، والتي يتم تحقيقها باتباع الخطوة 2 من البروتوكول الموضحة في الشكل 1 ، وصور NM-MRI مرضية باتباع الخطوة 3 من البروتوكول. يمكن رؤية تب?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يلعب نظام الدوبامين دورا حاسما في الإدراك الصحي والاضطرابات العصبية والنفسية. يعد تطوير طرق غير جراحية يمكن استخدامها للتحقيق بشكل متكرر في نظام الدوبامين في الجسم الحي أمرا بالغ الأهمية لتطوير مؤشرات حيوية ذات مغزى سريري. يوفر البروتوكول الموصوف هنا إرشادات خطوة بخطوة للحصول على ص...
Access restricted. Please log in or start a trial to view this content.
Disclosures
أبلغ كل من الدكتور هورغا وفينجلر عن حصولهما على براءات اختراع لتحليل واستخدام تصوير الميلانين العصبي في اضطرابات الجهاز العصبي المركزي (WO2021034770A1 ، WO2020077098A1) ، مرخص لشركة Terran Biosciences ، لكنهما لم يتلقيا أي إتاوات.
Acknowledgements
تلقى الدكتور هورغا الدعم من NIMH (R01-MH114965 ، R01-MH117323). تلقى الدكتور فينجلر الدعم من NIMH (F32-MH125540).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 3T Magnetic Resonance Imaging | General Electric | GE SIGNA Premier with 48-channel head coil |
References
- Zecca, L., et al. New melanic pigments in the human brain that accumulate in aging and block environmental toxic metals. Proceedings of the National Academy of Sciences of the United States of America. 105 (45), 17567-17572 (2008).
- Zucca, F. A., et al. The neuromelanin of human substantia nigra: physiological and pathogenic aspects. Pigment Cell Research. 17 (6), 610-617 (2004).
- Sulzer, D., et al. Neuromelanin biosynthesis is driven by excess cytosolic catecholamines not accumulated by synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 97 (22), 11869-11874 (2000).
- Cowen, D. The melanoneurons of the human cerebellum (nucleus pigmentosus cerebellaris) and homologues in the monkey. Journal of Neuropathology & Experimental Neurology. 45 (3), 205-221 (1986).
- Zecca, L., et al. The absolute concentration of nigral neuromelanin, assayed by a new sensitive method, increases throughout the life and is dramatically decreased in Parkinson's disease. FEBS Letters. 510 (3), 216-220 (2002).
- Sulzer, D., et al. Neuromelanin detection by magnetic resonance imaging (MRI) and its promise as a biomarker for Parkinson's disease. NPJ Parkinson's Disease. 4 (1), 11(2018).
- Zucca, F. A., et al. Neuromelanin organelles are specialized autolysosomes that accumulate undegraded proteins and lipids in aging human brain and are likely involved in Parkinson's disease. NPJ Parkinson's Disease. 4 (1), 17(2018).
- Chen, X., et al. Simultaneous imaging of locus coeruleus and substantia nigra with a quantitative neuromelanin MRI approach. Magnetic Resonance Imaging. 32 (10), 1301-1306 (2014).
- Sasaki, M., et al. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson's disease. Neuroreport. 17 (11), 1215-1218 (2006).
- Trujillo, P., et al. Contrast mechanisms associated with neuromelanin-MRI. Magnetic Resonance in Medicine. 78 (5), 1790-1800 (2017).
- Kitao, S., et al. Correlation between pathology and neuromelanin MR imaging in Parkinson's disease and dementia with Lewy bodies. Neuroradiology. 55 (8), 947-953 (2013).
- Cassidy, C. M., et al. Neuromelanin-sensitive MRI as a noninvasive proxy measure of dopamine function in the human brain. Proceedings of the National Academy of Sciences of the United States of America. 116 (11), 5108-5117 (2019).
- Abi-Dargham, A., et al. Increased striatal dopamine transmission in schizophrenia: confirmation in a second cohort. American Journal of Psychiatry. 155 (6), 761-767 (1998).
- Laruelle, M., et al. Single photon emission computerized tomography imaging of amphetamine-induced dopamine release in drug-free schizophrenic subjects. Proceedings of the National Academy of Sciences of the United States of America. 93 (17), 9235-9240 (1996).
- Breier, A., et al. Schizophrenia is associated with elevated amphetamine-induced synaptic dopamine concentrations: evidence from a novel positron emission tomography method. Proceedings of the National Academy of Sciences of the United States of America. 94 (6), 2569-2574 (1997).
- Abi-Dargham, A., et al. Increased baseline occupancy of D-2 receptors by dopamine in schizophrenia. Proceedings of the National Academy of Sciences of the United States of America. 97 (14), 8104-8109 (2000).
- Hietala, J., et al. Presynaptic dopamine function in striatum of neuroleptic-naive schizophrenic patients. Lancet. 346 (8983), 1130-1131 (1995).
- Lindström, L. H., et al. Increased dopamine synthesis rate in medial prefrontal cortex and striatum in schizophrenia indicated by L-(β-11C) DOPA and PET. Biological Psychiatry. 46 (5), 681-688 (1999).
- Meyer-Lindenberg, A., et al. Reduced prefrontal activity predicts exaggerated striatal dopaminergic function in schizophrenia. Nature Neuroscience. 5 (3), 267-271 (2002).
- McGowan, S., Lawrence, A. D., Sales, T., Quested, D., Grasby, P. Presynaptic dopaminergic dysfunction in schizophrenia: a positron emission tomographic [18F] fluorodopa study. Archives of General Psychiatry. 61 (2), 134-142 (2004).
- Bose, S. K., et al. Classification of schizophrenic patients and healthy controls using [18F] fluorodopa PET imaging. Schizophrenia Research. 106 (2-3), 148-155 (2008).
- Kegeles, L. S., et al. Increased synaptic dopamine function in associative regions of the striatum in schizophrenia. Archives of General Psychiatry. 67 (3), 231-239 (2010).
- Toru, M., et al. Neurotransmitters, receptors and neuropeptides in post-mortem brains of chronic schizophrenic patients. Acta Psychiatrica Scandinavica. 78 (2), 121-137 (1988).
- Perez-Costas, E., Melendez-Ferro, M., Rice, M. W., Conley, R. R., Roberts, R. C. Dopamine pathology in schizophrenia: analysis of total and phosphorylated tyrosine hydroxylase in the substantia nigra. Frontiers in Psychiatry. 3, 31(2012).
- Howes, O. D., et al. Midbrain dopamine function in schizophrenia and depression: a post-mortem and positron emission tomographic imaging study. Brain. 136 (11), 3242-3251 (2013).
- Bernheimer, H., Birkmayer, W., Hornykiewicz, O., Jellinger, K., Seitelberger, F. Brain dopamine and the syndromes of Parkinson and Huntington Clinical, morphological and neurochemical correlations. Journal of the Neurological Sciences. 20 (4), 415-455 (1973).
- Hirsch, E., Graybiel, A. M., Agid, Y. A. Melanized dopaminergic neurons are differentially susceptible to degeneration in Parkinson's disease. Nature. 334 (6180), 345(1988).
- Fearnley, J. M., Lees, A. J. Ageing and Parkinson's disease: substantia nigra regional selectivity. Brain. 114 (5), 2283-2301 (1991).
- Damier, P., Hirsch, E., Agid, Y., Graybiel, A. The substantia nigra of the human brain: II. Patterns of loss of dopamine-containing neurons in Parkinson's disease. Brain. 122 (8), 1437-1448 (1999).
- Horga, G., Wengler, K., Cassidy, C. M. Neuromelanin-sensitive magnetic resonance imaging as a proxy marker for catecholamine function in psychiatry. JAMA Psychiatry. 78 (7), 788-789 (2021).
- Wengler, K., et al. Cross-scanner harmonization of neuromelanin-sensitive MRI for multisite studies. Journal of Magnetic Resonance Imaging. , (2021).
- Wengler, K., He, X., Abi-Dargham, A., Horga, G. Reproducibility assessment of neuromelanin-sensitive magnetic resonance imaging protocols for region-of-interest and voxelwise analyses. NeuroImage. 208, 116457(2020).
- Griswold, M. A., et al. Generalized autocalibrating partially parallel acquisitions (GRAPPA). Magnetic Resonance in Medicine. 47 (6), 1202-1210 (2002).
- vander Pluijm, M., et al. Reliability and reproducibility of neuromelanin-sensitive imaging of the substantia nigra: a comparison of three different sequences. Journal of Magnetic Resonance Imaging. 53 (5), 712-721 (2020).
- Cassidy, C. M., et al. Evidence for dopamine abnormalities in the substantia nigra in cocaine addiction revealed by neuromelanin-sensitive MRI. American Journal of Psychiatry. 177 (11), 1038-1047 (2020).
- Wengler, K., et al. Association between neuromelanin-sensitive MRI signal and psychomotor slowing in late-life depression. Neuropsychopharmacology. 46, 1233-1239 (2020).
- Biondetti, E., et al. Spatiotemporal changes in substantia nigra neuromelanin content in Parkinson's disease. Brain. 143 (9), 2757-2770 (2020).
- Shibata, E., et al. Use of neuromelanin-sensitive MRI to distinguish schizophrenic and depressive patients and healthy individuals based on signal alterations in the substantia nigra and locus ceruleus. Biological Psychiatry. 64 (5), 401-406 (2008).
- Fabbri, M., et al. Substantia nigra neuromelanin as an imaging biomarker of disease progression in Parkinson's disease. Journal of Parkinson's Disease. 7 (3), 491-501 (2017).
- Matsuura, K., et al. Neuromelanin magnetic resonance imaging in Parkinson's disease and multiple system atrophy. European Neurology. 70 (1-2), 70-77 (2013).
- Watanabe, Y., et al. Neuromelanin magnetic resonance imaging reveals increased dopaminergic neuron activity in the substantia nigra of patients with schizophrenia. PLoS One. 9 (8), 104619(2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved