JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
흑질의 뉴로멜라닌 민감성 자기공명영상을 위한 표준화된 데이터 수집
요약
이 프로토콜은 흑질의 뉴로멜라닌 민감성 자기공명영상 데이터를 획득하는 방법을 보여준다.
초록
도파민 성 시스템은 건강한인지 (예 : 보상 학습 및 불확실성) 및 신경 정신 장애 (예 : 파킨슨 병 및 정신 분열증)에 중요한 역할을합니다. 뉴로멜라닌은 흑질의 도파민성 뉴런에 축적되는 도파민 합성의 부산물입니다. 뉴로멜라닌 민감성 자기공명영상(NM-MRI)은 이러한 도파민성 뉴런에서 뉴로멜라닌을 측정하는 비침습적 방법으로, 흑질의 도파민성 세포 손실을 직접 측정하고 도파민 기능의 대리 측정을 제공합니다. NM-MRI는 다양한 신경 정신 장애를 연구하는 데 유용한 것으로 나타 났지만, 열등한 우월한 방향의 제한된 시야로 인해 흑질의 일부를 우발적으로 배제하여 데이터가 손실 될 수 있습니다. 또한이 분야에는 대규모 다중 사이트 연구 및 임상 번역을 촉진하는 중요한 단계 인 NM-MRI 데이터 수집을위한 표준화 된 프로토콜이 부족합니다. 이 프로토콜은 전체 흑질에 대한 양질의 데이터 수집을 보장하기 위해 단계별 NM-MRI 볼륨 배치 절차 및 온라인 품질 관리 검사를 설명합니다.
서문
뉴로멜라닌(NM)은 흑질질(SN)의 도파민성 뉴런과 유전자좌(LC)의 노르아드레날린성 뉴런에서 발견되는 어두운 색소입니다.1,2. NM은 시토졸 도파민과 노르에피네프린의 철 의존적 산화에 의해 합성되며 소마3의 자가포식 액포에 저장됩니다. 2-3세 경에 인간에게 처음 나타나며 1,4,5세에 축적됩니다.
SN 및 LC 뉴런의 NM 함유 액포 내에서 NM은 철과 복합체를 형성합니다. 이러한 NM-철 복합체는 상자성이므로 자기 공명 영상(MRI)6,7을 사용하여 NM의 비침습적 시각화가 가능합니다. NM을 시각화 할 수있는 MRI 스캔은 NM 민감성 MRI (NM-MRI)로 알려져 있으며 직접 또는 간접 자화 전달 효과를 사용하여 NM 농도가 높은 영역 (예 : SN)과 주변 백질 8,9 간의 대비를 제공합니다.
자화 전달 대비는 거대 분자 결합 물 양성자 (자화 전달 펄스에 의해 포화 됨)와 주변 자유 수 양성자 사이의 상호 작용의 결과입니다. NM-MRI에서, NM-철 복합체의 상자성 성질은 주변 자유수 양성자의T1 을 단축시켜 자화 전달 효과를 감소시켜 NM-MRI 스캔(10)에서 NM 농도가 높은 영역이 초강렬하게 나타나도록 하는 것으로 여겨진다. 반대로, SN을 둘러싼 백질은 고분자 함량이 높기 때문에 자화 전달 효과가 커서 NM-MRI 스캔에서 이러한 영역이 저강도로 나타나 SN과 주변 백질 사이에 높은 대비를 제공합니다.
SN에서, NM-MRI는 도파민성 세포 손실(11) 및 도파민계 기능(12)의 마커를 제공할 수 있다. 이 두 과정은 여러 신경 정신병 적 장애와 관련이 있으며 방대한 임상 및 전임상 작업에 의해 뒷받침됩니다. 예를 들어, 도파민 기능의 이상은 정신 분열증에서 널리 관찰되었습니다. 양전자 방출 단층 촬영 (PET)을 사용한 생체 내 연구에 따르면 선조체 도파민 방출13,14,15,16이 증가하고 도파민 합성 능력이17,18,19,20,21,22 증가했습니다. . 또한, 사후 연구에 따르면 정신 분열증 환자는 기저핵23 및 SN 24,25에서 도파민 합성에 관여하는 속도 제한 효소 인 티로신 하이드 록 실라 제 수치가 증가했습니다.
여러 연구에서 특히 파킨슨 병에서 도파민 성 세포 손실 패턴을 조사했습니다. 사후 연구에 따르면 SN의 색소 도파민 성 뉴런은 파킨슨 병에서 신경 퇴행의 주요 부위이며26,27, 파킨슨 병의 SN 세포 손실은 정상 노화의 세포 손실과 상관 관계가 없지만28, 질병의 지속 기간과 상관 관계가 있습니다 29 . 도파민 성 시스템을 조사하는 대부분의 방법과 달리 비 침습성, 비용 효율성 및 전리 방사선의 부족으로 인해 NM-MRI는 다목적 바이오 마커30입니다.
이 논문에 설명된 NM-MRI 프로토콜은 NM-MRI의 피험자 내 및 피험자 간 재현성을 모두 증가시키기 위해 개발되었습니다. 이 프로토콜은 열등한 우수한 방향의 NM-MRI 스캔의 제한된 적용 범위에도 불구하고 SN의 전체 범위를 보장합니다. 이 프로토콜은 시상, 관상 및 축 3차원(3D) T1 강조(T1w) 이미지를 사용하며 적절한 슬라이스 스택 배치를 달성하기 위해 단계를 따라야 합니다. 이 논문에 요약 된 프로토콜은 여러 연구31,32에서 활용되었으며 광범위하게 테스트되었습니다. Wengler et al. NM-MRI 이미지가 여러 날에 걸쳐 각 참가자에서 두 번 획득 된이 프로토콜의 신뢰성에 대한 연구를 완료했습니다32. 클래스 내 상관 계수는 관심 영역(ROI) 기반 및 복셀와이즈 분석에 대한 이 방법의 우수한 테스트-재테스트 신뢰성과 이미지의 높은 대비를 입증했습니다.
프로토콜
참고 :이 프로토콜을 개발하기 위해 수행 된 연구는 뉴욕 주 정신과 연구소 기관 검토위원회 지침 (IRB # 7655)에 따라 수행되었습니다. 한 명의 피험자를 프로토콜 비디오 녹화를 위해 스캔하고 서면 사전 동의를 얻었습니다. 이 프로토콜에 사용되는 MRI 스캐너에 대한 자세한 내용은 재료 표를 참조하십시오.
1. MRI 획득 매개 변수
- 다음 매개 변수를 사용하여 3D 자화 준비된 고속 획득 그래디언트 에코 (MPRAGE) 시퀀스를 사용하여 고해상도 T1w 이미지 획득 준비 : 공간 해상도 = 0.8 x 0.8 x 0.8 mm3; 시야 (FOV) = 176 x 240 x 240 mm3; 에코 시간 (TE) = 3.43ms; 반복 시간 (TR) = 2462ms; 반전 시간 (TI) = 1060ms; 플립 각도 = 8°; 평면 내 병렬 이미징 계수(ARC) = 2; 관통면 병렬 이미징 계수(ARC) = 233; 대역폭 = 208Hz/픽셀; 총 획득 시간 = 6분 39초
- 다음 매개 변수를 사용하여 자화 전달 대비 (2D GRE-MTC)가있는 2 차원 (2D) 그래디언트 리콜 에코 시퀀스를 사용하여 NM-MRI 이미지 획득 준비 : 해상도 = 0.43 x 0.43 mm2; 시야 = 220 x 220 밀리미터2; 슬라이스 두께 = 1.5 mm; 20 조각; 슬라이스 간격 = 0mm; TE = 4.8 ms; TR = 500ms; 플립 각도 = 40°; 대역폭 = 122Hz/픽셀; MT 주파수 오프셋 = 1.2kHz; MT 펄스 지속 시간 = 8ms; MT 플립 각도 = 670°; 평균 수 = 5; 총 획득 시간 = 10분 4초
알림: 표시된 결과는 이러한 MRI 획득 매개변수를 사용했지만 이 프로토콜은 다양한 T1w 및 NM-MRI 이미징 프로토콜에 유효합니다. NM-MRI 프로토콜은 SN의 완전한 커버리지를 보장하기 위해 열등-상위 방향으로 ~25mm를 커버해야 합니다.
2. NM-MRI 부피의 배치
- 고해상도 T1w 이미지(≤1mm 등방성 복셀 크기)를 획득합니다. 이미지 획득 직후 온라인 포맷 재포맷을 사용하여 전방 교합-후방 교합(AC-PC) 라인과 정중선에 정렬된 고해상도 T1w 이미지를 생성합니다.
- 공급업체에서 제공한 소프트웨어를 사용하여 온라인 재포맷을 수행합니다(예: GE 스캐너에서 데이터를 수집하는 경우: 계획의 MPR(다중 평면 재구성), Siemens 스캐너에서 데이터를 수집하는 경우: 3D 작업 카드의 MPR, 필립스 스캐너에서 데이터를 수집하는 경우: VolumeView 패키지의 렌더링 모드에서 MPR).
- AC-PC 라인에 수직 인 축 평면에서 3D T1w 이미지의 다중 평면 재구성을 생성하여 최소한의 슬라이스 간격으로 전체 뇌를 덮습니다.
- AC-PC 라인에 수직 인 관상 평면에서 3D T1w 이미지의 다중 평면 재구성을 생성하여 최소한의 슬라이스 간격으로 전체 뇌를 덮습니다.
- AC-PC 라인과 평행한 시상면에서 3D T1w 이미지의 다중 평면 재구성을 생성하여 최소한의 슬라이스 간격으로 전체 뇌를 덮습니다.
- 공급업체에서 제공한 소프트웨어를 사용하여 온라인 재포맷을 수행합니다(예: GE 스캐너에서 데이터를 수집하는 경우: 계획의 MPR(다중 평면 재구성), Siemens 스캐너에서 데이터를 수집하는 경우: 3D 작업 카드의 MPR, 필립스 스캐너에서 데이터를 수집하는 경우: VolumeView 패키지의 렌더링 모드에서 MPR).
- 다시 포맷된 고해상도 T1w 이미지의 시상도, 관상 및 축 뷰를 로드하고 표시된 각 슬라이스의 위치를 나타내는 참조선이 있는지 확인합니다.
- 중뇌와 시상 사이의 가장 큰 간격을 보여주는 시상 이미지를 식별합니다(그림 1A). 이렇게 하려면 이 가장 큰 간격을 보여주는 슬라이스가 식별될 때까지 다시 포맷된 T1w 이미지의 시상 슬라이스를 육안으로 검사합니다.
- 2.3 단계 끝의 시상 이미지를 사용하여 중뇌의 가장 앞쪽 측면을 묘사하는 관상 평면을 시각적으로 식별합니다 (그림 1B).
- 2.4단계 끝의 코로나 이미지를 사용하여 제3뇌실의 하복부를 묘사하는 축면을 시각적으로 식별합니다(그림 1C).
- 2.3단계 끝의 시상 이미지에서 NM-MRI 볼륨의 상위 경계를 2.5단계에서 식별된 축 평면에 맞춥니다(그림 1D).
- NM-MRI 볼륨의 상위 경계를 상위 방향으로 3mm 이동합니다(그림 1E).
- NM-MRI 볼륨을 축 및 코로나 이미지의 정중선에 맞춥니다(그림 1F).
- NM-MRI 이미지를 획득합니다.
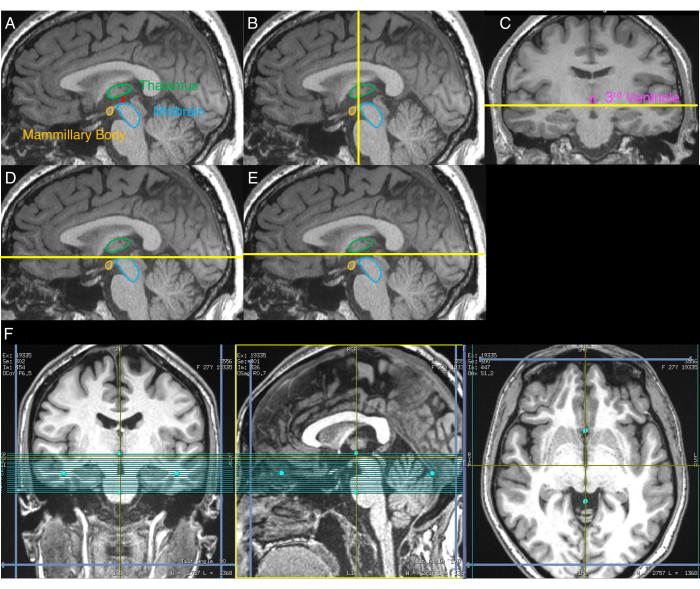
그림 1: 단계별 NM-MRI 볼륨 배치 절차를 보여주는 이미지. 노란색 선은 프로토콜에 설명된 대로 볼륨 배치에 사용되는 슬라이스의 위치를 나타냅니다. (A) 먼저, 중뇌와 시상 사이의 가장 큰 분리를 가진 시상 이미지가 확인됩니다 (프로토콜의 2.3 단계). (B) 둘째, A로부터의 이미지를 사용하여, 중뇌의 가장 앞쪽 측면을 묘사하는 관상 평면이 식별된다 (단계 2.4). (C) 셋째, B에서 확인된 평면으로부터의 코로나 이미지 상에서 , 제3 뇌실의 열등한 측면을 묘사하는 축 평면이 식별된다(단계 2.5). (D) 넷째, C 에서 식별된 축면이 A 로부터의 시상 이미지에 표시된다(단계 2.6). (E) 다섯째, D 로부터의 축 평면은 상한 방향으로 3mm 이동하고,이 평면은 NM-MRI 부피의 상위 경계를 나타낸다 (단계 2.7). (F) 관상 영상이 C에 해당하고, 시상 영상이 A에 해당하며, 축 영상이 E의 축 평면에 해당하는 최종 NM-MRI 부피 배치. NM-MRI 볼륨은 코로나 및 축 이미지의 뇌 정중선과 시상 이미지의 AC-PC 라인에 정렬됩니다 (2.8 단계). 이 그림의 일부는 엘스비어의 허가를 받아 30세부터 재인쇄되었습니다. 약어 : NM-MRI = 신경 멜라닌 민감성 자기 공명 영상; AC-PC = 전방 교합-후방 교합. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 품질 관리 검사
- 획득한 NM-MRI 이미지가 전체 SN을 덮고 SN이 중앙 이미지에서 볼 수 있지만 NM-MRI 볼륨의 가장 우수하거나 가장 낮은 이미지에서는 보이지 않는지 확인합니다. 그렇지 않으면(그림 2) 2.3-2.9단계를 반복하여 올바른 NM-MRI 볼륨 배치를 확인합니다. 고해상도 T1w 스캔을 획득한 이후 참가자가 크게 이동한 경우 2.1-2.9단계를 반복합니다.
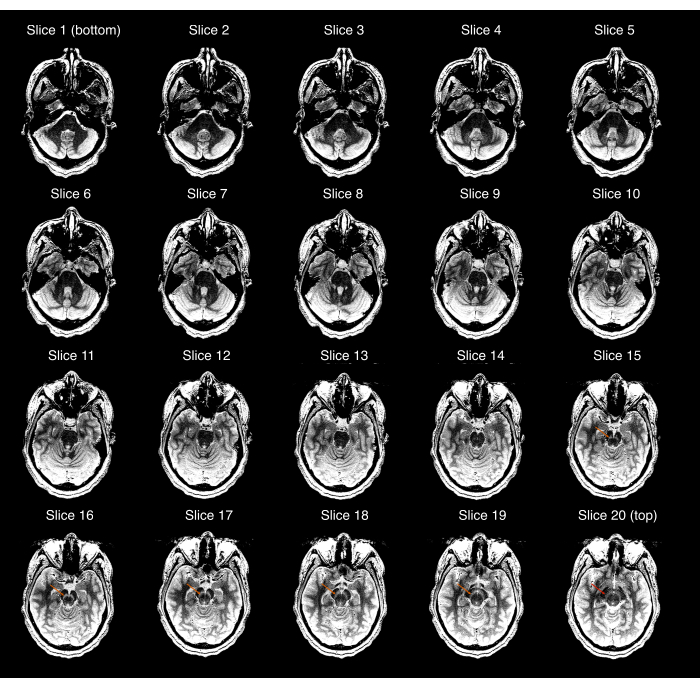
그림 2: 첫 번째 품질 관리 검사(프로토콜의 3.1단계)에 실패한 NM-MRI 획득의 예. 20개의 NM-MRI 슬라이스 각각은 가장 열등한(왼쪽 상단 이미지)에서 가장 우수한 것(오른쪽 하단 이미지)까지 표시되었습니다. 이미지 창/레벨은 흑질과 CRUS cerebri 사이의 대비를 과장하도록 설정되었습니다. 슬라이스 15-19의 주황색 화살표는 해당 슬라이스에서 흑질의 위치를 나타냅니다. 가장 우수한 슬라이스(슬라이스 20)의 빨간색 화살표는 이 슬라이스에서 흑질이 여전히 표시되므로 획득이 품질 검사에 실패했음을 나타냅니다. 약어 : NM-MRI = 신경 멜라닌에 민감한 자기 공명 영상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 획득한 NM-MRI 스캔의 각 조각을 육안으로 검사하여 인공물, 특히 SN과 주변 백질을 통과하는 인공물을 확인합니다.
- 정상적인 해부학적 경계를 존중하지 않는 선형 패턴으로 신호 강도의 급격한 변화를 찾으십시오. 예를 들어, 이것은 두 개의 고강도 영역에 의해 측면에 있는 저강도 영역으로 나타날 수 있습니다.
- 인공물이 혈관의 결과인 경우(그림 3A) 이러한 인공물이 항상 존재할 가능성이 높기 때문에 NM-MRI 이미지를 유지하십시오.
- 아티팩트가 참가자의 머리 움직임의 결과인 경우(그림 3B) 참가자에게 가능한 한 가만히 있고 3.2.5단계에 따라 NM-MRI 이미지를 다시 획득하도록 상기시킵니다.
- 아티팩트가 모호한 경우(그림 3C) 3.2.5단계에 따라 NM-MRI 이미지를 다시 획득합니다. 재획득 시 아티팩트가 남아 있는 경우 획득 문제의 결과가 아니라 생물학적 이미지일 가능성이 있으므로 이러한 이미지를 계속 진행합니다.
- NM-MRI 이미지가 3.1단계의 품질 관리 검사를 통과하면 이전 NM-MRI 볼륨 배치를 복사합니다. NM-MRI 이미지가 3.1단계의 품질 관리 검사에 실패하면 2.3-2.9단계를 반복하여 올바른 NM-MRI 볼륨 배치를 확인합니다(또는 참가자가 크게 이동한 경우 2.1-2.9단계).

그림 3: 두 번째 품질 관리 검사(프로토콜의 3.2단계)에 실패한 NM-MRI 획득의 예. 각 케이스에 대해 하나의 대표 슬라이스만 표시됩니다. (A) 파란색 화살표로 식별된 혈관의 결과인 혈관 인공물(빨간색 화살표)로 인해 품질 관리 검사에 실패한 NM-MRI 획득. (B) 모션 아티팩트 (빨간색 화살표)로 인해 품질 관리 검사에 실패한 NM-MRI 획득. (C) 모호한 인공물 (빨간색 화살표)로 인해 품질 관리 검사에 실패한 NM-MRI 획득. 약어 : NM-MRI = 신경 멜라닌에 민감한 자기 공명 영상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
그림 4 는 정신 또는 신경 장애가없는 28 세 여성 참가자의 대표 결과를 보여줍니다. NM-MRI 프로토콜은 그림 1에 설명된 프로토콜의 2단계에 따라 달성된 SN의 완전한 커버리지와 프로토콜의 3단계에 따라 만족스러운 NM-MRI 이미지를 보장합니다. NM 농도가 무시할 수 있는 SN과 이웃 백질 영역(즉, crus cerebri) 사이의 우수한 대비를 볼 수 있습니다. 이러한 이?...
토론
도파민 성 시스템은 건강한인지 및 신경 정신병 장애에 중요한 역할을합니다. 생체 내에서 도파민성 시스템을 반복적으로 조사하는 데 사용할 수 있는 비침습적 방법의 개발은 임상적으로 의미 있는 바이오마커의 개발에 매우 중요합니다. 여기에 설명된 프로토콜은 사용 가능한 데이터를 보장하기 위한 NM-MRI 볼륨 배치 및 품질 관리 검사를 포함하여 SN의 고품질 NM-MRI 이미지를 획득하기 위...
공개
호르가 박사와 벵글러 박사는 각각 중추신경계 장애에서 뉴로멜라닌 영상의 분석 및 사용에 대한 특허(WO2021034770A1, WO2020077098A1)를 보유하고 있다고 보고했으며, 테란 바이오사이언스에 라이선스를 받았지만 로열티는 받지 못했다.
감사의 말
호르가 박사는 NIMH (R01-MH114965, R01-MH117323)의 지원을 받았습니다. 벵글러 박사는 NIMH (F32-MH125540)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3T Magnetic Resonance Imaging | General Electric | GE SIGNA Premier with 48-channel head coil |
참고문헌
- Zecca, L., et al. New melanic pigments in the human brain that accumulate in aging and block environmental toxic metals. Proceedings of the National Academy of Sciences of the United States of America. 105 (45), 17567-17572 (2008).
- Zucca, F. A., et al. The neuromelanin of human substantia nigra: physiological and pathogenic aspects. Pigment Cell Research. 17 (6), 610-617 (2004).
- Sulzer, D., et al. Neuromelanin biosynthesis is driven by excess cytosolic catecholamines not accumulated by synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 97 (22), 11869-11874 (2000).
- Cowen, D. The melanoneurons of the human cerebellum (nucleus pigmentosus cerebellaris) and homologues in the monkey. Journal of Neuropathology & Experimental Neurology. 45 (3), 205-221 (1986).
- Zecca, L., et al. The absolute concentration of nigral neuromelanin, assayed by a new sensitive method, increases throughout the life and is dramatically decreased in Parkinson's disease. FEBS Letters. 510 (3), 216-220 (2002).
- Sulzer, D., et al. Neuromelanin detection by magnetic resonance imaging (MRI) and its promise as a biomarker for Parkinson's disease. NPJ Parkinson's Disease. 4 (1), 11 (2018).
- Zucca, F. A., et al. Neuromelanin organelles are specialized autolysosomes that accumulate undegraded proteins and lipids in aging human brain and are likely involved in Parkinson's disease. NPJ Parkinson's Disease. 4 (1), 17 (2018).
- Chen, X., et al. Simultaneous imaging of locus coeruleus and substantia nigra with a quantitative neuromelanin MRI approach. Magnetic Resonance Imaging. 32 (10), 1301-1306 (2014).
- Sasaki, M., et al. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson's disease. Neuroreport. 17 (11), 1215-1218 (2006).
- Trujillo, P., et al. Contrast mechanisms associated with neuromelanin-MRI. Magnetic Resonance in Medicine. 78 (5), 1790-1800 (2017).
- Kitao, S., et al. Correlation between pathology and neuromelanin MR imaging in Parkinson's disease and dementia with Lewy bodies. Neuroradiology. 55 (8), 947-953 (2013).
- Cassidy, C. M., et al. Neuromelanin-sensitive MRI as a noninvasive proxy measure of dopamine function in the human brain. Proceedings of the National Academy of Sciences of the United States of America. 116 (11), 5108-5117 (2019).
- Abi-Dargham, A., et al. Increased striatal dopamine transmission in schizophrenia: confirmation in a second cohort. American Journal of Psychiatry. 155 (6), 761-767 (1998).
- Laruelle, M., et al. Single photon emission computerized tomography imaging of amphetamine-induced dopamine release in drug-free schizophrenic subjects. Proceedings of the National Academy of Sciences of the United States of America. 93 (17), 9235-9240 (1996).
- Breier, A., et al. Schizophrenia is associated with elevated amphetamine-induced synaptic dopamine concentrations: evidence from a novel positron emission tomography method. Proceedings of the National Academy of Sciences of the United States of America. 94 (6), 2569-2574 (1997).
- Abi-Dargham, A., et al. Increased baseline occupancy of D-2 receptors by dopamine in schizophrenia. Proceedings of the National Academy of Sciences of the United States of America. 97 (14), 8104-8109 (2000).
- Hietala, J., et al. Presynaptic dopamine function in striatum of neuroleptic-naive schizophrenic patients. Lancet. 346 (8983), 1130-1131 (1995).
- Lindström, L. H., et al. Increased dopamine synthesis rate in medial prefrontal cortex and striatum in schizophrenia indicated by L-(β-11C) DOPA and PET. Biological Psychiatry. 46 (5), 681-688 (1999).
- Meyer-Lindenberg, A., et al. Reduced prefrontal activity predicts exaggerated striatal dopaminergic function in schizophrenia. Nature Neuroscience. 5 (3), 267-271 (2002).
- McGowan, S., Lawrence, A. D., Sales, T., Quested, D., Grasby, P. Presynaptic dopaminergic dysfunction in schizophrenia: a positron emission tomographic [18F] fluorodopa study. Archives of General Psychiatry. 61 (2), 134-142 (2004).
- Bose, S. K., et al. Classification of schizophrenic patients and healthy controls using [18F] fluorodopa PET imaging. Schizophrenia Research. 106 (2-3), 148-155 (2008).
- Kegeles, L. S., et al. Increased synaptic dopamine function in associative regions of the striatum in schizophrenia. Archives of General Psychiatry. 67 (3), 231-239 (2010).
- Toru, M., et al. Neurotransmitters, receptors and neuropeptides in post-mortem brains of chronic schizophrenic patients. Acta Psychiatrica Scandinavica. 78 (2), 121-137 (1988).
- Perez-Costas, E., Melendez-Ferro, M., Rice, M. W., Conley, R. R., Roberts, R. C. Dopamine pathology in schizophrenia: analysis of total and phosphorylated tyrosine hydroxylase in the substantia nigra. Frontiers in Psychiatry. 3, 31 (2012).
- Howes, O. D., et al. Midbrain dopamine function in schizophrenia and depression: a post-mortem and positron emission tomographic imaging study. Brain. 136 (11), 3242-3251 (2013).
- Bernheimer, H., Birkmayer, W., Hornykiewicz, O., Jellinger, K., Seitelberger, F. Brain dopamine and the syndromes of Parkinson and Huntington Clinical, morphological and neurochemical correlations. Journal of the Neurological Sciences. 20 (4), 415-455 (1973).
- Hirsch, E., Graybiel, A. M., Agid, Y. A. Melanized dopaminergic neurons are differentially susceptible to degeneration in Parkinson's disease. Nature. 334 (6180), 345 (1988).
- Fearnley, J. M., Lees, A. J. Ageing and Parkinson's disease: substantia nigra regional selectivity. Brain. 114 (5), 2283-2301 (1991).
- Damier, P., Hirsch, E., Agid, Y., Graybiel, A. The substantia nigra of the human brain: II. Patterns of loss of dopamine-containing neurons in Parkinson's disease. Brain. 122 (8), 1437-1448 (1999).
- Horga, G., Wengler, K., Cassidy, C. M. Neuromelanin-sensitive magnetic resonance imaging as a proxy marker for catecholamine function in psychiatry. JAMA Psychiatry. 78 (7), 788-789 (2021).
- Wengler, K., et al. Cross-scanner harmonization of neuromelanin-sensitive MRI for multisite studies. Journal of Magnetic Resonance Imaging. , (2021).
- Wengler, K., He, X., Abi-Dargham, A., Horga, G. Reproducibility assessment of neuromelanin-sensitive magnetic resonance imaging protocols for region-of-interest and voxelwise analyses. NeuroImage. 208, 116457 (2020).
- Griswold, M. A., et al. Generalized autocalibrating partially parallel acquisitions (GRAPPA). Magnetic Resonance in Medicine. 47 (6), 1202-1210 (2002).
- vander Pluijm, M., et al. Reliability and reproducibility of neuromelanin-sensitive imaging of the substantia nigra: a comparison of three different sequences. Journal of Magnetic Resonance Imaging. 53 (5), 712-721 (2020).
- Cassidy, C. M., et al. Evidence for dopamine abnormalities in the substantia nigra in cocaine addiction revealed by neuromelanin-sensitive MRI. American Journal of Psychiatry. 177 (11), 1038-1047 (2020).
- Wengler, K., et al. Association between neuromelanin-sensitive MRI signal and psychomotor slowing in late-life depression. Neuropsychopharmacology. 46, 1233-1239 (2020).
- Biondetti, E., et al. Spatiotemporal changes in substantia nigra neuromelanin content in Parkinson's disease. Brain. 143 (9), 2757-2770 (2020).
- Shibata, E., et al. Use of neuromelanin-sensitive MRI to distinguish schizophrenic and depressive patients and healthy individuals based on signal alterations in the substantia nigra and locus ceruleus. Biological Psychiatry. 64 (5), 401-406 (2008).
- Fabbri, M., et al. Substantia nigra neuromelanin as an imaging biomarker of disease progression in Parkinson's disease. Journal of Parkinson's Disease. 7 (3), 491-501 (2017).
- Matsuura, K., et al. Neuromelanin magnetic resonance imaging in Parkinson's disease and multiple system atrophy. European Neurology. 70 (1-2), 70-77 (2013).
- Watanabe, Y., et al. Neuromelanin magnetic resonance imaging reveals increased dopaminergic neuron activity in the substantia nigra of patients with schizophrenia. PLoS One. 9 (8), 104619 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유