Method Article
فحص نشاط مقترن بإنزيم عالي الإنتاجية لفحص تفاعل الجزيء الصغير مع dNTPase SAMHD1
In This Article
Summary
SAMHD1 هو ثلاثي فوسفوهيدرولاز ثلاثي فوسفات ديوكسي نيوكليوزيد له أدوار حاسمة في صحة الإنسان ومرضه. نقدم هنا مقايسة نشاط SAMHD1 متعددة الاستخدامات مقترنة بالإنزيم ، يتم نشرها في شكل صفيحة دقيقة 384 بئرا ، والتي تسمح بتقييم الجزيئات الصغيرة ونظائر النوكليوتيدات كركائز ومنشطات ومثبطات SAMHD1.
Abstract
شكل ألفا المعقم والبروتين 1 المحتوي على مجال HD (SAMHD1) هو منظم محوري لبرك ثلاثي فوسفات الديوكسي نيوكليوزيد داخل الخلايا (dNTP) ، حيث يمكن لهذا الإنزيم أن يتحلل dNTPs إلى النيوكليوسيدات المقابلة لها وثلاثي الفوسفات غير العضوي. نظرا لدوره الحاسم في استقلاب النوكليوتيدات ، وارتباطه بالعديد من الأمراض ، ودوره في مقاومة العلاج ، يتم حاليا إجراء أبحاث مكثفة لفهم أفضل لكل من التنظيم والوظيفة الخلوية لهذا الإنزيم. لهذا السبب ، فإن تطوير طرق بسيطة وغير مكلفة عالية الإنتاجية قابلة للتحقيق في تفاعل الجزيئات الصغيرة مع SAMHD1 ، مثل المنظمات الخيفية أو الركائز أو المثبطات ، أمر حيوي. لهذا الغرض ، فإن مقايسة الملكيت الأخضر المقترنة بالإنزيم هي مقايسة لونية بسيطة وقوية يمكن نشرها في شكل لوحة 384 ميكروويل مما يسمح بالقياس غير المباشر لنشاط SAMHD1. نظرا لأن SAMHD1 يطلق مجموعة ثلاثي الفوسفات من ركائز النيوكليوتيدات ، يمكننا إقران نشاط بيروفوسفاتيز بهذا التفاعل ، وبالتالي إنتاج فوسفات غير عضوي ، والذي يمكن قياسه كميا بواسطة كاشف الملكيت الأخضر من خلال تكوين مركب أخضر من الملكيت فوسفومولبدات. هنا ، نعرض تطبيق هذه المنهجية لتوصيف مثبطات SAMHD1 المعروفة وفك رموز الآليات المشاركة في تحفيز SAMHD1 للركائز غير المتعارف عليها والتنظيم بواسطة المنشطات الخيفية ، والتي تمثلها الأدوية المضادة للسرطان القائمة على النيوكليوسيد. وبالتالي ، فإن مقايسة الملكيت الأخضر المقترنة بالإنزيم هي أداة قوية لدراسة SAMHD1 ، وعلاوة على ذلك ، يمكن استخدامها أيضا في دراسة العديد من الإنزيمات التي تطلق أنواع الفوسفات.
Introduction
عزر ألفا المعقم والبروتين المحتوي على مجال الهستيدين الأسبارتات 1 (SAMHD1) هو منظم مركزي لتوازن النوكليوتيدات في خلايا الثدييات1 مع العديد من الأدوار في صحة الإنسان والمرض2. هذا الإنزيم قادر على التحلل المائي لثلاثي فوسفات الديوكسي نيوكليوزيد (dNTPs) في جزيئات الديوكسي نيوكليوزيد غير العضويةوجزيئات ثلاثي الفوسفات غير العضوية 3,4 ، مع تنظيم هذا النشاط خيفيا بواسطة (د) وفرة NTP (تمت مراجعته في المرجع5). يحتوي كل مونومر SAMHD1 على موقعين خيفيين (AS1 و AS2) وموقع تحفيزي واحد ، ويتطلب تكوين الإنزيم النشط التجميع المرتب ل homotetramer عند ارتباط NTP (d). يتم تشغيل ديمومرات SAMHD1 أولا من خلال ربط ثلاثي فوسفات الجوانين (GTP أو dGTP) ب AS1 ، ويتم تحقيق رباعي لاحق عندما يرتبط جزيء dNTP إضافي ب AS2 ، مما يتيح وصول الركيزة إلى الموقع التحفيزي والتحلل المائي اللاحق.
تشمل ركائز SAMHD1 أربعة dNTPs الكنسي 3,4 جنبا إلى جنب مع بعض النيوكليوتيدات الأساسية والمعدلة بالسكر ، بما في ذلك مستقلبات ثلاثي الفوسفات للعديد من الأدوية القائمة على النيوكليوزيد المستخدمة في علاج الالتهابات الفيروسية والسرطان ، والعديد منها يمكن أن يكون أيضا بمثابة منشطات خيفية6،7،8،9،10،11. ونتيجة لذلك ، يعدل SAMHD1 فعالية العديد من هذه المركبات في نماذج المرض7،8،9،10،11،12،13،14،15 ، وعلاوة على ذلك ، في حالة السيتارابين التماثلي deoxycytidine (ara-C) ، الذي ظل علاجا قياسيا للرعاية لسرطان الدم النخاعي الحاد (AML) لعقود ، يملي في الواقع فعالية العلاج في هذا المرض7،8،16. وبالتالي فإن SAMHD1 هو علامة حيوية محتملة وهدف علاجي لتحسين فعالية العلاجات القائمة على النيوكليوزيد17 ، وبناء على ذلك ، سعينا نحن وآخرون إلى تحديد استراتيجيات لتعطيل SAMHD1 في الخلايا. اقترحنا استخدام البروتين الفيروسي X (Vpx) كمثبط بيولوجي لاستهداف SAMHD1 للتحلل داخل الخلايا السرطانية7 ، ومع ذلك ، فإن هذا النهج له عدد من القيود (تمت مناقشته في المرجع12) ، كما أبلغنا مؤخرا عن نهج غير مباشر لقمع نشاط SAMHD1 عن طريق تثبيط اختزال الريبونوكليوتيد الذي أظهرناه في نماذج مختلفة من AML18. سعى عدد من الدراسات إلى تحديد الجزيئات الصغيرة القادرة على تثبيط SAMHD1 مباشرة ، وحتى الآن ، تم الإبلاغ عن العديد من هذه الجزيئات ، ومع ذلك ، فقط توثيق التثبيط في المختبر6،9،19،20،21،22. ونتيجة لذلك ، فإن نقص الجزيئات الصغيرة التي تمنع بقوة نشاط SAMHD1 في الخلايا إلى جانب الآليات المعقدة لتحفيز SAMHD1 للعلاجات القائمة على النيوكليوزيد ، يؤكد الحاجة إلى مزيد من التحقيق. وبالتالي ، فإن الطرق القوية والقابلة للتعديل عالية الإنتاجية بشكل مثالي لفحص تفاعل الجزيئات الصغيرة مع SAMHD1 مثالية من أجل تحديد الركائز والمنظمين والمثبطات الخيفية لهذا الإنزيم ذي الصلة سريريا.
تتوفر العديد من المنهجيات التي تقيس مباشرة نشاط dNTPase ل SAMHD1 ، مثل كروماتوغرافيا الطبقة الرقيقة (TLC) 9،20،23 والكروماتوغرافيا السائلة عالية الأداء (HPLC) 9،21 ، ولكن هذه ليست قابلة بسهولة للإعدادات عالية الإنتاجية. استثناء واحد هو الفحص الذي أبلغ عنه Mauney et al. ، والذي يستغل قدرة SAMHD1 على التحلل المائي لفوسفات مكرر (4-نيتروفينيل) (b4NPP) إلى p-nitrophenol و p-nitrophenyl phosphate عند استخدام Mn2+ ككاتيون تنشيط ، مما يؤدي إلى تغيير لوني يمكن قياسه بسهولة في لوحة microwell21. تم استخدام هذا الاختبار بنجاح لتحديد وتوصيف مثبطات SAMHD1 ، ولكن تجدر الإشارة إلى أن التحلل المائي يحدث في غياب منشطات NTP (d) وفي وجود كاتيون تنشيط غير فسيولوجي محتمل ، وكلاهما محاذير مهمة يجب مراعاتها. هذا أيضا يجعل هذا الاختبار أقل قابلية للتطبيق على دراسة وتحديد المنظمين الخيفي ل SAMHD1.
في هذا السياق ، يمكن أن يكون النهج المقترن بالإنزيم جنبا إلى جنب مع كاشف الملكيت الأخضر ، كما هو مفصل في هذا التقرير ، طريقة متعددة الاستخدامات لقياس نشاط dNTPase ل SAMHD1 بشكل غير مباشر ، علاوة على ذلك ، استجواب تأثير الجزيئات الصغيرة المختلفة عليه. مقايسة الملكيت الخضراء هي تقنية لونية قوية وموثوقة للكشف عن الفوسفات غير العضوي الحر (Pi) ، بناء على تكوين مركب حمض الموليبدوفوسفوريك الذي يؤدي إلى تغيير لوني يقاس عند 620 نانومتر24. نظرا لأن التحلل المائي SAMHD1 يطلق مجموعة ثلاثي الفوسفات من ركائز النوكليوتيدات ، فمن الضروري بالتالي إقران هذا التفاعل بنشاط الفوسفاتيز (pyro) ، والذي سيولد فوسفات غير عضوي حر ، قبل إضافة كاشف الملكيت الأخضر. مقايسة الملكيت الخضراء حساسة وفعالة من حيث التكلفة وقد استخدمت على نطاق واسع لتحديد وتوصيف مثبطات وركائز الإنزيمات التي تطلق مجموعات الفوسفات غير العضوية إما في تفاعلاتها أو في وجود إنزيم اقتران. وقد تم تطبيقه على نطاق واسع في توصيف أنشطة ATPase لطائرات الهالبية25،26،27 ، أو دراسة النشاط الأنزيمي CD73 ، الذي يتوسط في تدهور AMP إلى الأدينوزين والفوسفات غير العضوي28. بالإضافة إلى ذلك ، عند إقرانه ، تم استخدامه في اكتشاف أدوية المضادات الحيوية التي تستهدف UDP-2،3-diacylglucosamine pyrophosphatase LpxH ، وهو إنزيم أساسي في معظم مسببات الأمراض سالبةالجرام 29. فيما يتعلق بأبحاث السرطان ، تم نشر النهج المقترن بالإنزيم على نطاق واسع ضد هيدرولاز NUDIX ، وهي عائلة من إنزيمات استقلاب النوكليوتيدات ، سواء في توصيف الركائز30،31،32 وفي تحديد وتطوير الأدوية والمجسات الكيميائية33،34،35،36.
فيما يتعلق ب dNTPase SAMHD1 ، تم استخدام هذا النهج في العديد من التقارير. باستخدام exopolyphosphatase Ppx1 من Saccharomyces cerevisiae كإنزيم اقتران ، تم استخدام هذا الاختبار لاختبار العديد من نظائر النوكليوتيدات إما كركائز أو منشطات أو مثبطات ل SAMHD1 ، وأدى إلى تحديد مستقلب ثلاثي الفوسفات لعقار كلوفارابين المضاد لسرطان الدم كمنشط وركيزة6. بالإضافة إلى ذلك ، مع بيروفوسفاتيز غير عضوي من الإشريكية القولونية كإنزيم اقتران ، تم استخدامه في فحص مكتبة من المركبات المعتمدة سريريا ضد SAMHD1 لتحديد مثبطات20. في بحثنا ، استخدمنا هذا النهج لإظهار أن ara-CTP ، المستقلب النشط ل ara-C ، هو ركيزة SAMHD1 ولكن ليس المنشطالخيفي 7 واستخدمنا هذا الاختبار لاحقا لإظهار أن العديد من الجزيئات الصغيرة التي يمكن أن تحسس نماذج AML ل ara-C بطريقة تعتمد على SAMHD1 ، في الواقع لم تثبط بشكل مباشر SAMHD118. في هذا التقرير ، سنقوم بتفصيل هذه الطريقة متعددة الاستخدامات وإثبات قابليتها للتطبيق ، في إعداد قابل للتعديل عالي الإنتاجية ، لتحديد مثبطات ومنشطات وركائز SAMHD1.
Protocol
يتم توضيح نظرة عامة تخطيطية للطرق أدناه في الشكل 1 وتتوفر قائمة مفصلة بالمواد والكواشف في جدول المواد.
1. إعداد مخازن الفحص.
- إعداد احتياطيات المخزون.
ملاحظة: نظرا لأن الفحص حساس للكشف عن الفوسفات ، والذي يمكن أن يكون شائعا ، اشطف الأواني الزجاجية ثلاث مرات بماء عالي النقاء أو مقطر مزدوج لتجنب التلوث. يمكن تخزين جميع المخازن المؤقتة في درجة حرارة الغرفة (RT).- تحضير 1 لتر من محلول مخزون تفاعل SAMHD1 (RB) (25 mM Tris-Acetate pH 8 ، 40 mM NaCl ، 1 mM MgCl2) عن طريق إذابة 4.5 جم Tris Acetate ، 2.3 جم كلوريد الصوديوم ، و 0.2 جم MgCl2 ، في حوالي 800 مل من الماء قبل التكيف مع الرقم الهيدروجيني 8 والحجم النهائي.
- قم بإعداد 5 مل من محلول مخزون TCEP 0.1 M عن طريق تخفيف 1 مل من 0.5 M TCEP إلى 4 مل من الماء.
- قم بإعداد 50 مل من محلول مخزون Tween-20 بنسبة 11٪ عن طريق تخفيف 5 مل من 100٪ Tween-20 إلى 44.5 مل من الماء.
ملاحظة: Tween-20 حساس للضوء. - قم بإعداد 50 مل من محلول توقف EDTA 0.5 M عن طريق إذابة 9.3 جم EDTA في حوالي 40 مل من الماء قبل التكيف مع الرقم الهيدروجيني 8 والحجم النهائي.
- قم بإعداد محلول مخزون الملكيت الأخضر (MG) (3.2 مللي متر أخضر الملكيت في H2SO4) عن طريق إضافة 60 مل من حمض الكبريتيك المركز ببطء إلى 300 مل من الماء في زجاجة زجاجية بنية. تبريد الحل إلى RT وحل 0.44 غرام الملكيت الأخضر.
أنذر: تفاعل حمض الكبريتيك مع الماء طارد للحرارة وبالتالي قد تسخن الزجاجة مما يؤدي إلى تراكم الضغط. تأكد من تحرير هذا الضغط بشكل متكرر.
ملاحظة: المحلول البرتقالي الناتج حساس للضوء (وبالتالي زجاجة بنية) ومستقر لمدة 1 سنة على الأقل في RT. قد يتشكل الراسب بمرور الوقت ، تأكد من استخدام المادة الطافية فقط. - تحضير 50 مل من محلول مخزون موليبدات الأمونيوم 7٪ عن طريق إذابة 3.75 جم من موليبدات الأمونيوم في 50 مل من الماء.
ملاحظة: قد يتشكل الراسب بمرور الوقت ، تأكد من استخدام المادة الطافية فقط.
- إعداد مخازن مقايسة كاملة
ملاحظة: يجب أن يتم ذلك في يوم التجربة- تحضير كامل SAMHD1 RB (25 مللي متر تريس أسيتات درجة الحموضة 8 ، 40 ملليمتر كلوريد الصوديوم ، 1 مليمول MgCl2 ، 0.3 ملليمتر TCEP ، 0.005٪ توين -20). استخدم مخزون Tween-20 و 0.1 M TCEP المعد مسبقا لإضافة هذه المكونات بتركيز نهائي قدره 0.005٪ ل Tween-20 و 0.3 mM ل TCEP إلى مخزون SAMHD1 RB.
- تحضير محلول إيقاف EDTA (25 مللي متر Tris-Acetate pH 8 ، 40 mM NaCl ، 1 mM MgCl2 ، 0.3 mM TCEP ، 0.005٪ Tween-20 ، 7.9 mM EDTA). لإكمال SAMHD1 RB ، استخدم محلول مخزون 0.5 M EDTA لإضافة EDTA إلى تركيز نهائي يبلغ 7.9 مللي مول.
- قم بإعداد محلول العمل MG (2.5 مللي متر أخضر ملكيت ، 1.4٪ موليبدات الأمونيوم ، 0.18٪ توين -20) عن طريق خلط 10 أجزاء من محلول مخزون MG مع 2.5 جزء من 7٪ موليبدات الأمونيوم و 0.2 جزء من 11٪ توين -20.
2. مقايسة تثبيط SAMHD1 وتحديد مركب IC50
ملاحظة: شروط الفحص النهائي موضحة في الجدول 1.
- تحضير المركبات في لوحة الفحص
ملاحظة: عادة ما يتم إذابة مركبات الوزن الجزيئي الصغيرة في 100٪ DMSO ونظائرها النوكليوتيدات في الماء. يتراوح تركيز المخزون من 10 إلى 100 mM ويتأثر بقوة المركبات وقابليتها للذوبان ، جنبا إلى جنب مع تحمل DMSO للفحص. تأكد من أن تركيز DMSO النهائي في التفاعل لا يتجاوز 1٪ لضمان عدم تأثر أنشطة الإنزيم بهذا المذيب. من الممارسات الجيدة اختبار تحمل الفحص للمذيب قبل التجربة.- تحضير مركبات الاختبار المخففة بشكل متسلسل بتركيز نهائي 100x في المذيب ذي الصلة (على سبيل المثال ، DMSO 100٪ للجزيئات الصغيرة أو الماء لنظائر النوكليوتيدات) في لوحة شفافة مستديرة القاع من مادة البولي بروبيلين 96 بئرا باستخدام ماصة متعددة القنوات أو معدات معالجة السوائل الآلية.
ملاحظة: اعتمادا على استقرار المركب ، يمكن تحضير ألواح التخفيف مسبقا وإغلاقها وتخزينها عند -20 درجة مئوية. اسمح للألواح بالتوازن مع RT قبل متابعة البروتوكول. - باستخدام SAMHD1 RB الكامل ، قم بتخفيف المركبات إلى تركيز نهائي 25x (للحفاظ على تركيز المذيب النهائي أقل من 1٪) ونقل 5 ميكرولتر إلى الآبار المناسبة للوحة فحص مسطحة القاع 384 بئرا. كرر الإجراء مع عينات التحكم بالمذيبات فقط.
- تحضير مركبات الاختبار المخففة بشكل متسلسل بتركيز نهائي 100x في المذيب ذي الصلة (على سبيل المثال ، DMSO 100٪ للجزيئات الصغيرة أو الماء لنظائر النوكليوتيدات) في لوحة شفافة مستديرة القاع من مادة البولي بروبيلين 96 بئرا باستخدام ماصة متعددة القنوات أو معدات معالجة السوائل الآلية.
- تحضير مكونات التفاعل
ملاحظة: يجب أن يتم ذلك في يوم الفحص. يتم تخزين قسامات SAMHD1 و E. coli pyrophosphatase (PPase) البشرية المؤتلفة على المدى الطويل عند -80 درجة مئوية مخففة عند 9.1 مجم / مل و 23.0 مجم / مل ، على التوالي ، في مخزن مؤقت للتخزين (20 mM HEPES pH 7.5 ، 300 mM NaCl ، 10٪ glycerol ، 2 mM TCEP). بمجرد إذابتها ، يتم تخزين القسامات على المدى القصير عند -20 درجة مئوية.- تحضير مزيج الإنزيم الرئيسي (SAMHD1 / PPase) عن طريق تخفيف بروتين SAMHD1 البشري المؤتلف و PPase المؤتلف في SAMHD1 RB الكامل إلى 4x التركيز النهائي المطلوب ، وبالتالي 1.4 ميكرومتر SAMHD1 و 50 وحدة / مل PPase.
- تحضير المنشط / الركيزة dGTP عن طريق تخفيف مخزون dGTP (عادة 10 أو 100 mM في الماء) في SAMHD1 RB الكامل إلى 2x التركيز النهائي ، وبالتالي 50 μM dGTP.
- إجراء الفحص
ملاحظة: يجب موازنة جميع مكونات الفحص مع RT. يمكن إجراء الإضافات السائلة إما باستخدام ماصة متعددة القنوات أو موزع سائل كاشف سائب.- إلى لوحة فحص 384 بئرا تحتوي على تخفيفات مركبة وأدوات تحكم بالمذيبات فقط ، قم بتوزيع 5 ميكرولتر من المزيج الرئيسي SAMHD1 / PPase. لعدم وجود آبار للتحكم في الإنزيم ، قم بتوزيع 5 ميكرولتر من SAMHD1 RB الكامل. قبل احتضان الإنزيم والمركبات لمدة 10 دقائق في RT.
- لجميع الآبار ، قم بتوزيع 10 ميكرولتر من محلول 2x dGTP لبدء التفاعل.
- احتضان رد الفعل لمدة 20 دقيقة في RT.
- أوقف التفاعل عن طريق توزيع محلول إيقاف EDTA سعة 20 ميكرولتر على جميع الآبار.
ملاحظة: يمكن إيقاف التجربة مؤقتا هنا إذا رغبت في ذلك. - أضف 10 ميكرولتر MG حل العمل لجميع الآبار.
أنذر: يحتوي محلول العمل MG على حمض الكبريتيك. - تأكد من خلط محتويات البئر باستخدام شاكر لوحة microwell المداري والطرد المركزي عند 1000 × جم لمدة دقيقة واحدة.
- احتضان الطبق لمدة 20 دقيقة في RT.
- اقرأ الامتصاص عند الطول الموجي 630 نانومتر في قارئ لوحة microwell.
- تصور البيانات وتحليلها
- حساب المتوسط والانحراف المعياري لآبار التحكم الإيجابية والسلبية (تفاعل إيجابي كامل مع المذيب ؛ سلبي ، dGTP وحده مع المذيب). احسب عامل Z37 كمؤشر لجودة الفحص.
- قم بتطبيع كل قيمة امتصاص إلى القيم المتوسطة للعناصر الموجبة والسالبة ، مع تعيين عنصر التحكم الإيجابي على أنه نشاط SAMHD1 بنسبة 100٪ والتحكم السلبي على أنه نشاط 0٪ SAMHD1.
- رسم نشاط SAMHD1 (٪) كدالة لتركيز المركب وتناسب منحنى استجابة جرعة المنحدر المتغير رباعي المعلمات ، مما يسمح بتحديد المركب IC50.
3. SAMHD1 المنشط وشاشة الركيزة
ملاحظة: شروط الفحص النهائي موضحة في الجدول 2. يتم تخزين حصص SAMHD1 و PPase المؤتلفة على المدى الطويل عند -80 درجة مئوية مخففة عند 9.1 مجم / مل و 23.0 مجم / مل ، على التوالي ، في مخزن مؤقت للتخزين (20 mM HEPES pH 7.5 ، 300 mM NaCl ، 10٪ glycerol ، 2 mM TCEP) عند -80 درجة مئوية. بمجرد إذابتها ، يتم تخزين القسامات على المدى القصير عند -20 درجة مئوية.
- إعداد نظائرها النوكليوتيدات في لوحة الفحص
- قم بتخفيف مخزون النوكليوتيدات التناظرية (عادة 10 أو 100 مللي متر في الماء) إلى 4 أضعاف التركيز النهائي في SAMHD1 RB الكامل ، في حالتنا 800 ميكرومتر نظير النوكليوتيدات ، ونقل 5 ميكرولتر إلى الآبار المناسبة للوحة فحص 384 بئرا.
- تحضير مكونات التفاعل
ملاحظة: يجب أن يتم ذلك في يوم الفحص- تحضير المزيج الرئيسي للإنزيم (SAMHD1 / PPase) عن طريق تخفيف بروتين SAMHD1 البشري المؤتلف و E. coli PPase المؤتلف في SAMHD1 RB الكامل إلى 2x التركيز النهائي المطلوب ، وبالتالي 0.7 ميكرومتر SAMHD1 و 25 وحدة / مل PPase.
- تحضير محلول PPase وحده عن طريق تخفيف E . coli PPase المؤتلف في SAMHD1 RB الكامل إلى 2x التركيز النهائي المطلوب ، وبالتالي 25 U / mL PPase.
- تحضير المنشطات GTP (AS1) و dGTPαS (AS1 و AS2) مخزون مخفف (عادة 10 أو 100 مللي متر في الماء) في SAMHD1 RB كامل إلى تركيز نهائي 4x ، وبالتالي 50 ميكرومتر GTP أو dGTPαS.
- إجراء الفحص
ملاحظة: يجب موازنة جميع مكونات الفحص مع RT. يمكن إجراء الإضافات السائلة إما باستخدام ماصة متعددة القنوات أو موزع سائل كاشف سائب.- إلى لوحة فحص 384 بئرا تحتوي على نظائر النوكليوتيدات ، قم بتوزيع 5 ميكرولتر من المنشط (إما GTP أو dGTPαS) أو أكمل SAMHD1 RB إلى الآبار المناسبة.
- ابدأ التفاعل عن طريق توزيع 10 ميكرولتر من المزيج الرئيسي SAMHD1 / PPase ، PPase وحده ، أو أكمل SAMHD1 RB إلى الآبار المناسبة.
- احتضان رد الفعل لمدة 20 دقيقة في RT.
- أوقف التفاعل عن طريق توزيع محلول توقف EDTA سعة 20 ميكرولتر على جميع الآبار.
ملاحظة: يمكن إيقاف التجربة مؤقتا هنا إذا رغبت في ذلك. - أضف 10 ميكرولتر MG حل العمل لجميع الآبار.
أنذر: يحتوي محلول العمل MG على حمض الكبريتيك. - تأكد من خلط محتويات البئر باستخدام شاكر لوحة microwell المداري والطرد المركزي عند 1000 × جم لمدة دقيقة واحدة.
- احتضان الطبق لمدة 20 دقيقة في RT.
- اقرأ الامتصاص عند الطول الموجي 630 نانومتر في قارئ لوحة microwell.
- تصور البيانات وتحليلها
- احسب متوسط قيم الامتصاص لآبار تفاعل PPase فقط (التحكم السلبي أو إشارة الخلفية).
ملاحظة: كتحكم إيجابي في المنشط والركيزة الخيفية SAMHD1 ، يمكن تضمين dGTP في اللوحة. في هذه الحالة ، يمكنك استخدام هذا الشرط لحساب عامل Z كمؤشر لجودة الفحص. - اطرح قيمة الخلفية من الآبار المقابلة في تفاعلات SAMHD1 / PPase.
- رسم قيم الامتصاص المصححة لكل نظير نيوكليوتيد مع ظروف المخزن المؤقت و GTP و dGTPαS.
- احسب متوسط قيم الامتصاص لآبار تفاعل PPase فقط (التحكم السلبي أو إشارة الخلفية).
النتائج
يصف البروتوكول الموضح في الشكل 1 سير العمل الأساسي لاستخدام مقايسة الملكيت الأخضر المقترنة بالإنزيم لاستكشاف تفاعل الجزيئات الصغيرة مع dNTPase SAMHD1 ويمكن تكييفها بعدد من الطرق لاستجواب الأسئلة الكيميائية الحيوية المختلفة. في النتائج التمثيلية التي تمت مناقشتها في الفقرات أدناه ، نوضح أمثلة على استخدام هذا الاختبار لتحديد الخصائص المثبطة للجزيئات الصغيرة تجاه SAMHD1 واختبار ما إذا كانت نظائر النوكليوتيدات المختلفة هي ركائز و / أو منشطات لهذا الإنزيم.
توضح النتائج الموضحة في الشكل 2 العديد من المبادئ الأساسية لهذا الفحص. يسمح كاشف الملكيت الأخضر بالكشف اللوني عن الفوسفات غير العضوي من خلال تكوين مركب أخضر من الملكيت الفوسفومولبداتي ، وبالتالي ، يمكن تطبيق هذا النهج على دراسة التفاعلات الأنزيمية التي يكون منتجها هو الفوسفات. لإثبات حساسية هذه الطريقة للكشف عن الفوسفات غير العضوي الحر ، يوضح الشكل 2 أ قيم الامتصاص التي تم الحصول عليها مع زيادة تركيزات Na3PO4 بعد حضانة لمدة 20 دقيقة مع كاشف الملكيت الأخضر. بينما تصل الإشارة إلى التشبع عند 0.25 mMNa 3PO4 ، يكون نطاق الكشف الخطي للفوسفات مرئيا من 0.004 إلى 0.03 mM (الشكل 2A ، اللوحة اليمنى) ، بالاتفاق مع الدراسات الأخرى التي أبلغت عن نطاق خطي للفوسفات يصل إلى 10-20 ميكرومتر باستخدام مقايسة الملكيت الأخضر38.
SAMHD1 هو dNTPase الذي يطلق ثلاثي الفوسفات غير العضوي عند التحلل المائي لجزيء dNTP ، وبالتالي من أجل توليد فوسفات غير عضوي مجاني للكشف عن طريق الملكيت الأخضر ، يلزم وجود إنزيم اقتران. وقد ثبت أن البيروفوسفاتيز غير العضوي (PPase) من الإشريكية القولونية مفيد لهذا الغرض ، سواء فيما يتعلق ب SAMHD1 7,20 ، ولكن أيضا إنزيمات استقلاب النوكليوتيداتالأخرى 30،33،35. بالإضافة إلى ذلك ، SAMHD1 هو dNTPase نشط عندما يكون متجانسا ، وهذا يتطلب تنشيطا خيفيا بواسطة (d) NTPs ، وتحديدا ثلاثي فوسفات الجوانين (GTP أو dGTP) في AS1 وأي dNTP عند AS2. بعد ذلك ، يصبح الموقع الحفاز متاحا لربط الركيزة ويحدث التفاعل الأنزيمي. نظرا لأن dGTP يفي بمتطلبات الارتباط ب AS1 و AS2 ، وهو ركيزة ، فإن استخدام هذه النوكليوتيدات في مقايسة التثبيط يبسط سير العمل إلى حد كبير. يوضح الشكل 2B متطلبات مكونات الفحص المختلفة لتحقيق نشاط SAMHD1 القابل للقياس المشار إليه بزيادة الامتصاص عند 630 نانومتر. لا SAMHD1 ولا PPase وحدهما قادران على توليد فوسفات غير عضوي في وجود dGTP ، بما يتفق مع الأنشطة الموثقة لهذه الإنزيمات. ومع ذلك ، في الحالة التي توجد فيها جميع مكونات الفحص (SAMHD1 ، PPase ، والمنشط / الركيزة dGTP) نلاحظ زيادة في الإشارة. كان العامل Z37 من المثال الموضح هنا (عدم أخذ أي إنزيمات + dGTP كعنصر تحكم سلبي و SAMHD1 / PPase + dGTP كعنصر تحكم إيجابي) 0.74 ، مما يشير إلى اختبار قوي.
أحد التطبيقات المحتملة لمقايسة نشاط SAMHD1 المقترنة بالإنزيم هو تحديد المثبطات من خلال الفحص عالي الإنتاجية (HTS). وبالتالي ، في هذا التقرير ، نتحقق من صحة اكتشاف تثبيط SAMHD1 في هذا الفحص باستخدام مجموعة متنوعة من المركبات الموصوفة بالفعل في الأدبيات. قام Seamon et al. بتقييم التثبيط المعتمد على الجرعة للنيوكليوسيدات الكنسية تجاه SAMHD1 باستخدام مقايسة مماثلة كما هو موضح هنا ، ووجدوا أن deoxyguanosine (dGuo) كان النوكليوزيد الكنسي الوحيد القادر على تثبيط SAMHD1 بشكل كبير ، بقيمة IC50 تبلغ 488 ميكرومتر20. كشفت HTS للأدوية المعتمدة من إدارة الغذاء والدواء الأمريكية (FDA) التي تم إجراؤها باستخدام مقايسة b4NPP المباشرة عن العديد من الضربات التي تثبط نشاط SAMHD1 بتركيزات ميكرومولار ، والتي كان lomofungin هو الجزيء الذي يثبط نشاط SAMHD1 dNTPase بشكل أقوى في المختبر ، حيث يظهر IC50 من 20.1 ميكرومتر عند تحديده في وجود dGTP كركيزة21. بالإضافة إلى ذلك ، تم أيضا تحديد نظائر α،β-imido-dNTP الأربعة كمثبطات تنافسية ل SAMHD1 باستخدام مستشعر MDCC-PBP و SAMHD1 مقترنة بنشاط Ppx ، مما أظهر أن الثوابت المثبطة لنظائر dNMPNPP كانت في النطاق الميكرومولي المنخفض / النانويالعالي 6,22. وبالتالي ، لإثبات أنه يمكن استخدام مقايسة نشاط SAMHD1 المقترنة بالإنزيم لتحديد مثبطات SAMHD1 ، تم استخدام dGuo و lomofungin و 2'-deoxythymidine-5'-[(α،β)-imido] ثلاثي الفوسفات (dTMPNPP) ، للتحقق من صحة التقنية. يوضح الشكل 3 أ منحنيات الجرعة والاستجابة التي تم الحصول عليها لهذه المركبات ، مما يدل على أن زيادة التركيزات تمنع بشكل فعال نشاط SAMHD1. كان متوسط قيم IC50 التي تم الحصول عليها لهذه الجزيئات من ثلاث تجارب مستقلة (± الانحراف المعياري) كما يلي: dGuo = 361.9 ± 72.8 μM ، lomofungin 6.78 ± 3.9 μM ، و dTMPNPP = 2.10 ± 0.9 μM. كمثال على النتيجة السلبية ، تم أيضا تحديد تأثير هيدروكسي يوريا (HU) على نشاط SAMHD1. HU هو مثبط لاختزال الريبونوكليوتيد ، وعلى الرغم من أنه يحد من نشاط SAMHD1 ara-CTPase في نماذج AML المختلفة ، فقد ثبت أن تأثيرات HU على SAMHD1 غير مباشرة وتعتمد على إزعاج التنظيم الخيفي ل SAMHD118. يظهر منحنى استجابة الجرعة ل HU في الشكل 3B ، ولم تلاحظ أي تغييرات في نشاط SAMHD1 مع زيادة جرعات HU ، مما يدل على أن HU لا يثبط نشاط SAMHD1 في المختبر.
استخدام آخر لمقايسة نشاط SAMHD1 المقترن بالإنزيم هو استجواب ما إذا كانت النيوكليوتيدات ونظائرها ركائز و / أو منشطات خيفية لهذا الإنزيم ، كما هو موضح في الشكل 4. في هذه التجربة ، تم اختبار النيوكليوتيدات المتعارف عليها ، وكذلك المستقلبات النشطة للعديد من نظائر النوكليوزيد المضادة للسرطان ، مثل السيتارابين (ara-CTP) ، وكلوفارابين (Cl-F-ara-ATP) ، وجيمسيتابين (dF-dCTP) ، كركائز ومنشطات SAMHD1. نظرا للتنظيم الخيفي المعقد ل SAMHD1 ، يتم إجراء التفاعل في وجود GTP كمنشط AS1 أو نظير dGTP غير قابل للتحلل المائي 2'-deoxyguanosine-5'- (α-thio) -triphosphate (dGTPαS) ، والذي يمكن أن يشغل AS1 و AS2. يشير نشاط SAMHD1 في وجود نظير النوكليوتيدات المختبر و GTP إلى أن النوكليوتيدات قادرة على الارتباط بالموقع الخيفي الثانوي والموقع الحفاز (أي المنشط AS2 والركيزة) ، بينما يشير نشاط SAMHD1 مع نظير النوكليوتيدات و dGTPαS إلى أن النوكليوتيدات يمكن أن تشغل الموقع الحفاز فقط (أي الركيزة فقط). إذا كانت النوكليوتيدات قادرة على الارتباط بكل من المواقع الخيفية AS1 و AS2 والموقع التحفيزي ، فسيكون SAMHD1 نشطا في وجود النوكليوتيدات وحدها ، كما هو موضح في حالة dGTP. أظهرت النتائج أن جميع dNTPs المتعارف عليها قادرة على الارتباط بموقع AS2 والموقع الحفاز. في حالة نظائر النوكليوتيدات ، فإن كلوفارابين ثلاثي الفوسفات هو منشط AS2 وركيزة ، في حين أن ثلاثي فوسفات السيتارابين قادر فقط على احتلال الموقع الحفاز. من ناحية أخرى ، لم يلاحظ أي نشاط مع gemcitabine triphosphate ، مما يشير إلى أنه في ظل الظروف التي تم اختبارها ، فإن gemcitabine triphosphate غير قادر على العمل كمستجيب خيفي ولا ركيزة. على الرغم من أن هذه النتيجة تتفق مع التوقعات السابقة9 ، إلا أن الدراسات اللاحقة للتبلوروالحركية 10 كشفت أن gemcitabine triphosphate قادر على ربط الجيب الحفاز SAMHD1 ، وأنه بالفعل ركيزة للإنزيم. ومع ذلك ، في الدراسة الأخيرة10 ، أظهر المؤلفون أن معدل التحلل المائي أقل بكثير مقارنة بالركائز الأخرى المبلغ عنها ، مثل سيتارابين ثلاثي الفوسفات ، مما يفسر سبب عدم تمكننا من ملاحظة ذلك باستخدام إعداد الفحص هذا.
إجمالا ، تتحقق هذه النتائج التمثيلية من صحة استخدام مقايسة نشاط SAMHD1 المقترنة بالإنزيم كتقنية قوية لتحديد وتوصيف مثبطات SAMHD1 والمنظمين الخيفي والركائز. ومع ذلك ، على غرار جميع الأساليب التجريبية ، فإن هذه الطريقة لها محاذيرها ، وبالتالي يجب استخدام المقايسات المتعامدة (على سبيل المثال ، باستخدام تقنية فحص مختلفة) لمزيد من التحقق من صحة النتائج.
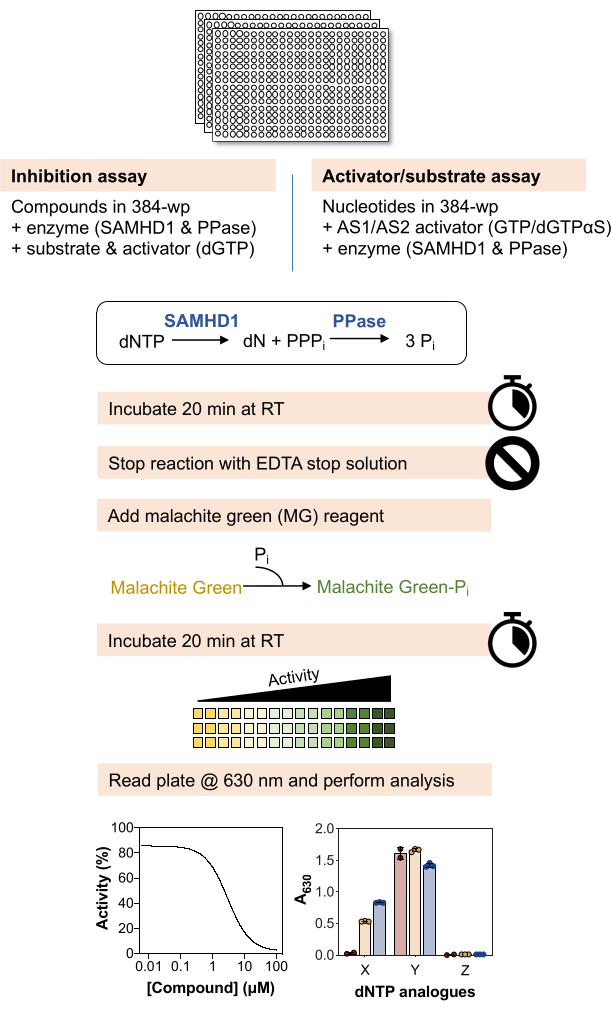
الشكل 1: نظرة عامة تخطيطية للبروتوكول الموضح في هذه المقالة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
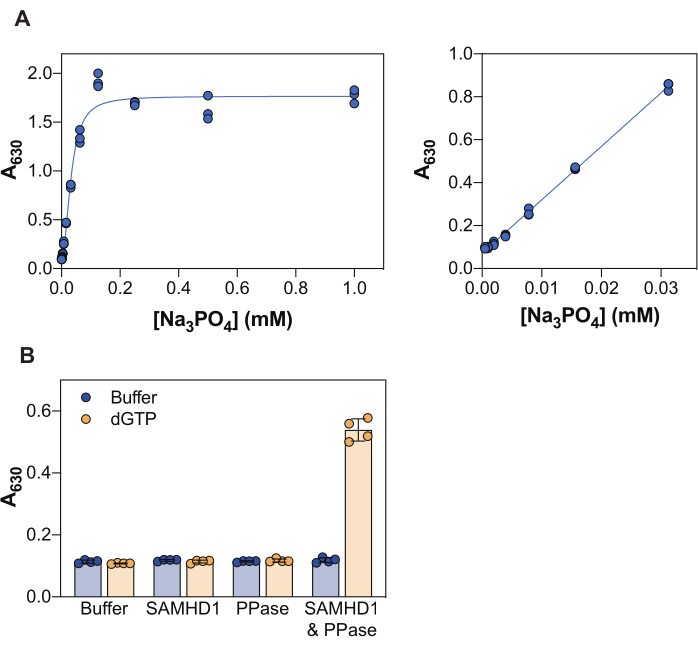
الشكل 2: مقايسة نشاط SAMHD1 المقترنة بالإنزيم. (أ) المنحنى القياسي Na3PO4 في مقايسة الملكيت الأخضر. تم تحضير التخفيف التسلسلي Na3PO4 (2 أضعاف) من 1 mM إلى 0.004 mM في ثلاث نسخ وتم تحضينه بكاشف أخضر من الملكيت لمدة 20 دقيقة. يتم عرض قيم الامتصاص الخام على النطاق الكامل للتركيزات المختبرة في اللوحة اليسرى والنطاق الخطي في اللوحة اليمنى. ممثل تجربتين مستقلتين موضحة. ب: التحقق من صحة مقايسة النشاط المقترن بالإنزيمات. تم تحضين SAMHD1 (0.35 ميكرومتر) و / أو PPase (12.5 وحدة / مل) في وجود أو عدم وجود المنشط / الركيزة dGTP (25 ميكرومتر) لمدة 20 دقيقة في مقايسة النشاط المقترن بالإنزيم. تشير الرباعيات من ممثل تجربتين مستقلتين موضحتين بقيم امتصاص خام مرسومة ، والأشرطة ، وأشرطة الخطأ إلى المتوسط و SD. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
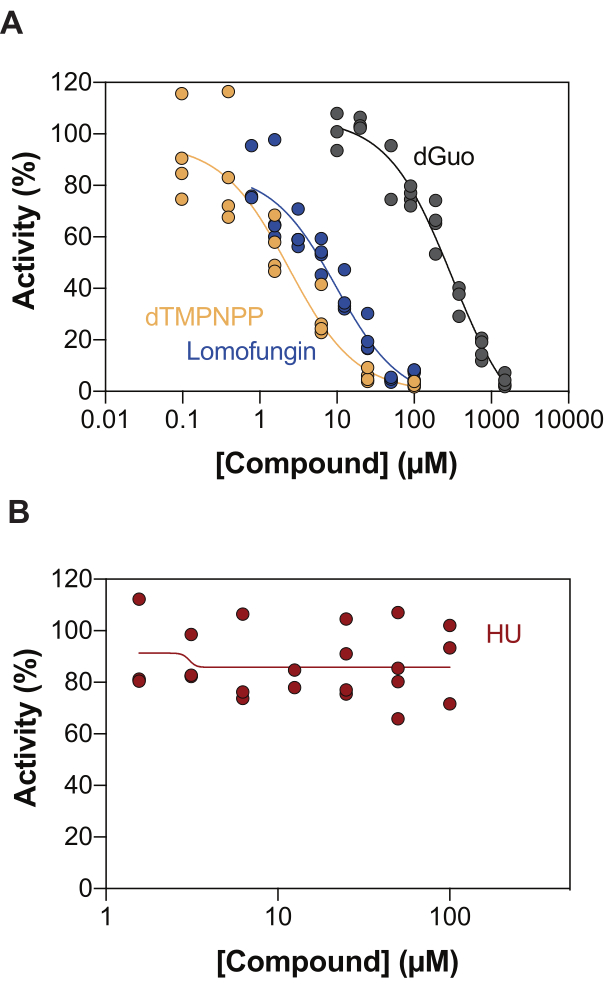
الشكل 3: تقييم مركبات تثبيط SAMHD1 في مقايسة النشاط المقترن بالإنزيمات. استجابة جرعة لوموفونجين (0.78-100 ميكرومتر) ، 2'-ديوكسي ثيميدين-5'-[(α،β)-إيميدو] ثلاثي الفوسفات (dTMPNPP ، 0.01-100 ميكرومتر) وديوكسي جوانوزين (dGuo ، 10-1500 ميكرومتر) (A) أو هيدروكسي يوريا (HU) (0.78-100 ميكرومتر) (B) في مقايسة نشاط SAMHD1 المقترنة بالإنزيم مع dGTP (25 ميكرومتر) كمنشط / ركيزة. النسبة المئوية للنشاط بالنسبة لعناصر التحكم في التفاعل من النسخ المتماثلة الفردية المرسومة (DMSO + SAMHD1 / PPase + dGTP = نشاط 100٪ ، DMSO + dGTP = 0٪ نشاط) مع عرض ممثل لثلاث تجارب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
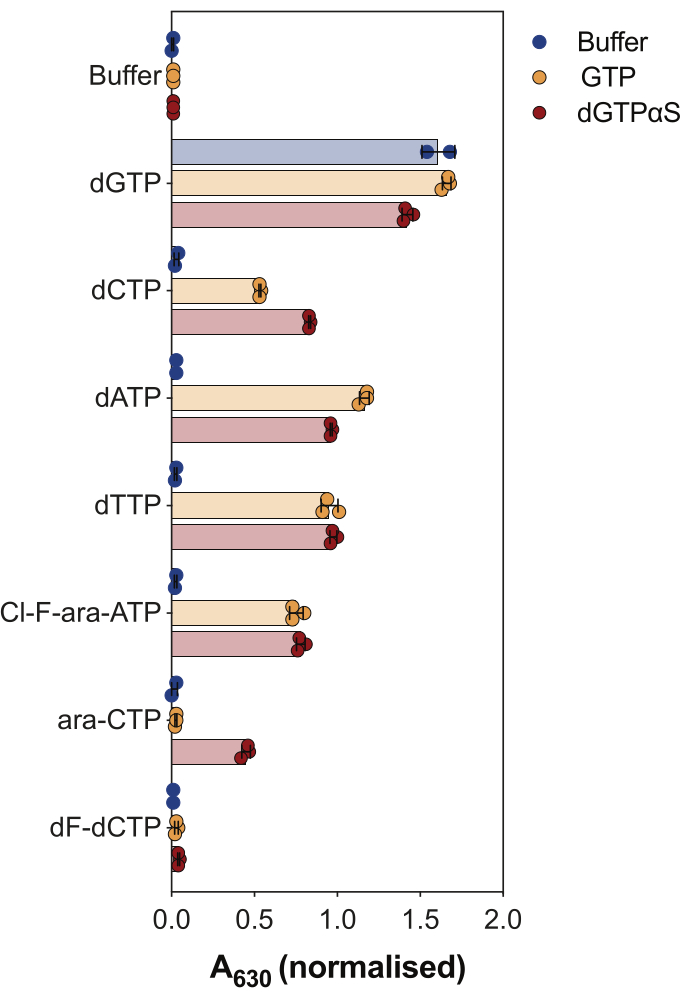
الشكل 4: تقييم نظائر النيوكليوتيدات كمنشطات وركائز خيفية SAMHD1 في مقايسة النشاط المقترن بالإنزيمات. تم اختبار النيوكليوتيدات المتعارف عليها ومستقلبات ثلاثية الفوسفات المختارة للأدوية المضادة للسرطان سيتارابين (ARA-CTP) ، كلوفارابين (Cl-F-ara-ATP) ، وجيمسيتابين (dF-dCTP) ، عند 200 ميكرومتر في مقايسة نشاط SAMHD1 المقترنة بالإنزيم في وجود أو عدم وجود GTP أو dGTP التناظري dGTPαS غير القابل للتحلل المائي (12.5 ميكرومتر). يشار إلى قيم الامتصاص الطبيعية من النسخ المتماثلة التجريبية الفردية المرسومة والمتوسط و SD. ممثل تجربتين مستقلتين معروضتين ، مقتبسة من دراستنا السابقة7. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| درج | الكاشف | حجم الاستغناء (ميكرولتر) | حجم التفاعل النهائي (ميكرولتر) | التركيز الاستغناء | أضعاف التخفيف في رد الفعل | التركيز النهائي في رد الفعل |
| 1 | المانع | 5 | 20 | 0.4 مللي متر | 4 | 0.1 مللي متر |
| 2 | سامهد 1 + مزيج بولي باز | 5 | 1.4 ميكرومتر SAMHD1 ، 50 وحدة / مل PPase | 4 | 0.35 ميكرومتر SAMHD1 ، 12.5 وحدة / مل Ppase | |
| 3 | dGTP | 10 | 50 ميكرومتر | 2 | 25 ميكرومتر | |
| 4 | الحضانة لمدة 20 دقيقة | |||||
| 5 | حل EDTA | 20 | 40 | 7.9 مللي متر | 2 | 3.95 مللي متر |
| 6 | كاشف MG | 10 | 50 | 2.5 مللي متر أخضر ملكيت ، 64.4 مللي متر موليبدات الأمونيوم ، 0.18٪ توين -20 | 5 | 0.5 مللي متر أخضر ملكيت ، 12.9 مللي متر موليبدات الأمونيوم ، 0.036٪ توين -20 |
| 7 | الحضانة لمدة 20 دقيقة | |||||
| 8 | قراءة @ 630 نانومتر | |||||
الجدول 1: ملخص الشروط النهائية في الفحص المقترن بالإنزيم لفحص المثبطات.
| درج | الكاشف | حجم الاستغناء (ميكرولتر) | حجم التفاعل النهائي (ميكرولتر) | التركيز الاستغناء | أضعاف التخفيف في رد الفعل | التركيز النهائي في رد الفعل |
| 1 | منظم ألوستيريك | 5 | 20 | 800 ميكرومتر | 4 | 200 ميكرومتر |
| 2 | GTP أو dGTPαS | 5 | 50 ميكرومتر | 4 | 12.5 ميكرومتر | |
| 3 | SAMHD1 و / أو PPase | 10 | 0.7 ميكرومتر SAMHD1 ، 25 وحدة / مل PPase | 2 | 0.35 ميكرومتر SAMHD1 ، 12.5 وحدة / مل PPase | |
| 4 | الحضانة لمدة 20 دقيقة | |||||
| 5 | حل EDTA | 20 | 40 | 7.9 مللي متر | 2 | 3.95 مللي متر |
| 6 | كاشف MG | 10 | 50 | 2.5 مللي متر أخضر ملكيت ، 64.4 مللي متر موليبدات الأمونيوم ، 0.18٪ توين -20 | 5 | 0.5 مللي متر أخضر ملكيت ، 12.9 مللي متر موليبدات الأمونيوم ، 0.036٪ توين -20 |
| 7 | الحضانة لمدة 20 دقيقة | |||||
| 8 | قراءة @ 630 نانومتر | |||||
الجدول 2: ملخص الشروط النهائية في الفحص المقترن بالإنزيم لفحص المنظمين الخيفي
Discussion
مقايسة النشاط المقترنة بالإنزيم المفصلة هنا هي مقايسة لونية عالية الإنتاجية وقابلة للتعديل تسمح بالقياس غير المباشر للتحلل المائي dNTP بواسطة SAMHD1. تستغل هذه الطريقة قدرة PPase غير العضوي من الإشريكية القولونية ، والتي عند تضمينها في خليط التفاعل ، تحول كل ثلاثي فوسفات غير عضوي ناتج عن SAMHD1 إلى ثلاثة فوسفات حر فردي يمكن قياسه كميا باستخدام كاشف الملكيت الأخضر البسيط والاقتصادي. نحن نقدم هذا الفحص في شكل لوحة 384 microwell ، وهو مثالي لفحص المكتبات المركبة ، ونوضح قابلية تطبيق هذه التقنية وتعدد استخداماتها في تحديد وتوصيف مثبطات ومنشطات وركائز SAMHD1.
كما هو الحال مع جميع فحوصات الفحص الكيميائي الحيوي في المختبر ، هناك عدد من الخطوات الحاسمة والاعتبارات المهمة ، وتمت مناقشة العديد منها بعمق في دليل إرشادات الفحص39 المتاح مجانا. تعتبر سلامة الإنزيمات المؤتلفة المنقاة ، كل من SAMHD1 والإنزيم غير العضوي PPase المقترن ، مهمة للغاية ، ويجب تأكيدها قبل إنشاء الفحص. وبناء على ذلك ، يجب أن تخضع كل تنقية جديدة لهذه الإنزيمات لمستوى معين من اختبار الدفعات ، حيث يمكن أن تؤدي المتغيرات من دفعة إلى أخرى إلى حدوث تناقضات في النتائج. من الناحية المثالية ، يجب استخدام مقايسة مباشرة متعامدة ، مثل HPLC ، والتي تسمح بالكشف عن كل من الركيزة ومنتج التفاعل ، للتحقق من نشاط dNTP ثلاثي الفوسفوهيدرولاز ل SAMHD1 المنقى المؤتلف المستخدم.
فيما يتعلق بالقيود المفروضة على هذا الفحص ، فإن المبدأ الأول هو أنه يقيس نشاط dNTPase ل SAMHD1 بطريقة غير مباشرة ، مستغلا نشاط PPase غير العضوي ، والذي له عدد من الآثار. من المهم التأكد من أن PPase يمتلك نشاطا ضئيلا أو معدوما تجاه النيوكليوتيدات المستخدمة في الفحص ، وبالمثل ، فإن الجزيئات الصغيرة المثبطة المحددة ليس لها أي نشاط تجاه PPase. وبالتالي ، فيما يتعلق بالفحص ، يمكن أن تكون الشاشة المضادة ضد PPase اعتبارا مهما. كما أن وجود PPase في التفاعل يجعل من الضروري استخدام مقايسة متعامدة لتأكيد النتائج. فيما يتعلق بمقايسات النشاط المباشر ، تم الإبلاغ عن عدد منها حتى الآن ، بما في ذلك TLC9،20،23 و HPLC9،21 ، والتي تكتشف بدقة استنفاد الركيزة وتكوين المنتج. بالإضافة إلى ذلك ، يمكن استخدام اختبار b4NPP21 ، وهو أيضا عالي الإنتاجية ، لاختبار المثبطات المحتملة. ومع ذلك ، فإنه ليس مثاليا لاختبار ركائز أو المنشطات allosteric. يمكن أن تكون المقايسات الفيزيائية الحيوية ، مثل القياس الفلوري للمسح التفاضلي (DSF) ، والتي أبلغنا عنها سابقا مع SAMHD118 ، قوية بشكل خاص في تحديد وتوصيف الروابط. هناك قيد آخر للفحص ، وتحديدا كما هو موضح في الإعداد هنا لتحديد الركائز والمنشطات ، وهو استخدام dGTP التناظري dGTPαS غير القابل للتحلل المائي كمنشط AS1 و AS2. في حين أن هذا يسمح بتنشيط SAMHD1 دون أي نشاط يمكن ملاحظته في الفحص ، فإن dGTPαS هو مثبط تنافسي ل SAMHD1 ، وبالتالي فإن استخدام تركيزات عالية سيؤدي إلى تعطيل الإنزيم. مع تقدم فهمنا ل SAMHD1 ، يمكن للدراسات المستقبلية استخدام الجزيئات التي تشغل حصريا كل موقع من مواقع SAMHD1 ، وبالتالي إبطال هذه المشكلة المحتملة.
كما أوضحنا هنا ، هذه الطريقة متعددة الاستخدامات ويمكن استخدامها لمعالجة عدد من الأسئلة البيوكيميائية. لقد وصفنا نوعين مختلفين من هذا الفحص ، أحدهما لتحديد المنظمين الخيفي وركائز SAMHD1 ، والآخر لتوصيف المثبطات ، ولكن يمكن إجراء المزيد من التعديلات. فيما يتعلق بالمثبطات المحتملة ، فإن هذا الفحص ، كونه قائما على لوحة microwell ، يجعله مناسبا تماما لآلية المصب لدراساتالعمل 39,40. وبالمثل ، لمزيد من توصيف الركائز والمنظمين الخيفي ، يمكن استخدام هذه التقنية لتحديد المعلمات الحركية للحفز ، كما أجرينا للمستقلب النشط للسيتارابين والكلوفارابين7. ومع ذلك ، فإن أحد العيوب هو أن الفحص المقترن بالإنزيم المبلغ عنه هنا هو فحص نقطة النهاية ، وبالتالي ، على الرغم من أنه مناسب تماما للفحص ، فإن الفحص المستمر سيكون أكثر ملاءمة لبعض الدراسات الآلية. أبلغ Arnold et al. عن مقايسة مستمرة مقترنة بالإنزيم تستخدم المستشعر الحيوي MDCC-PBP6 ، والذي يعتمد على استخدام بروتين ربط الفوسفات المحيطي (PBP) المسمى بفلوروفور الكومارين ماليميد (MDCC) الذي يمكن أن يرتبط بمجموعة فوسفات حرة. MDCC-PBP حساس للغاية ويتيح القياس الكمي لتركيزات الفوسفات المنخفضة جدا ، حيث يكون وقت استجابة المستشعر في المقياس الزمني من ميلي ثانية إلى ثانية.
يلعب SAMHD1 عددا من الوظائف المهمة في صحة الإنسان والمرض2 والتي يمكن ربط العديد منها بدوره المركزي في الحفاظ على مستويات dNTP داخل الخلايا1. وبالتالي ، فإن تحديد مسبار كيميائي عالي الجودة نحو نشاط dNTPase ل SAMHD1 سيكون أداة قوية في تحديد هذه الروابط ، ويمكن استخدام الفحص المقترن بالإنزيم المذكور هنا بسهولة لتحديد مثل هذه المجسات. علاوة على ذلك ، نظرا لأن الأدوية القائمة على النوكليوزيد ، والتي يتم تعديل العديد منها بواسطة SAMHD1 ، هي مجموعة متنوعة ومهمة منالعلاج 41. يمكن تطوير المجسات الكيميائية إلى أدوية لاستهداف SAMHD1 في الإعداد السريري ، بهدف تعزيز فعالية هذه العلاجات. من الأهمية بمكان أيضا فهم المدى الكامل لتفاعل هذه المركبات القائمة على النيوكليوزيد مع SAMHD1 ، وهو سؤال يمكن معالجته باستخدام هذا الفحص المقترن بالإنزيم أيضا. مجتمعة ، فإن مقايسة نشاط SAMHD1 المقترنة بالإنزيم كما هو مذكور هنا ، هي اختبار منخفض التكلفة ومتعدد الاستخدامات وعالي الإنتاجية يمكن استخدامه لزيادة فهمنا لهذا الإنزيم المهم.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر توماس لوندباك وأعضاء مختبر توماس هيلداي على المشورة والدعم. تم تسهيل جزء من هذا العمل من قبل مرفق علوم البروتين في معهد كارولينسكا / SciLifeLab (http://ki.se/psf) ، ونحن نعترف بالمعهد الوطني للسرطان (NCI) ، وقسم علاج السرطان وتشخيصه (DCTD) ، وبرنامج العلاجات التنموية (DTP) (http://dtp.cancer.gov) لتوفير مركب. تم توفير التمويل من خلال المنح الممنوحة ل SGR من مجلس البحوث السويدي (2018-02114) ، وجمعية السرطان السويدية (19-0056-JIA ، 20-0879-PJ) ، والصندوق السويدي لسرطان الأطفال (PR2019-0014) ، ومعهد كارولينسكا.
Materials
| Name | Company | Catalog Number | Comments |
| 2'-deoxyadenosine-5'-triphosphate (dATP) | Jena bioscience | NU-1001 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-deoxycytidine-5'-triphosphate (dCTP) | Jena bioscience | NU-1002 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-Deoxyguanosine-5'-(α-thio)-triphosphate (dGTPαS) | Jena bioscience | NU-424 | Non-hydrolyzable dGTP analogue for SAMHD1 activator/substrate assay |
| 2'-deoxyguanosine-5'-triphosphate (dGTP) | GE Healthcare | 27-1870-04 | SAMHD1 allosteric activator and substrate used in inhibition assay and activator/substrate assay |
| 2'-Deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP) | Jena bioscience | NU-907-1 | Compound tested in SAMHD1 inhibition assay |
| 2'-deoxythymidine-5'-triphosphate (dTTP) | Jena bioscience | NU-1004 | Compound tested in SAMHD1 activator/substrate assay |
| 2'Deoxyguanosine mohohydrate (dGuo) | Sigma-Aldrich | D0901 | Compound tested in SAMHD1 inhibition assay |
| 384 well clear flat-bottom microplate | Thermo Fisher Scientific | 262160 | Assay plate |
| 96 well clear U-bottom polypropylene microplate | Thermo Fisher Scientific | 267245 | Compound dilution plate |
| Ammonium heptamolybdate tetrahydrate | Sigma-Aldrich | A1343 | Reagent required for malachite green working reagent |
| ara-Cytidine-5'-triphosphate (ara-CTP) | Jena bioscience | NU-1170 | Compound tested in SAMHD1 activator/substrate assay |
| Clofarabine-5'-triphosphate (Cl-F-ara-ATP) | Jena bioscience | NU-874 | Compound tested in SAMHD1 activator/substrate assay |
| Dimethyl sulphoxide (DMSO) | VWR | 23486.297 | Solvent |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich | E5134 | EDTA stop solution component |
| Gemcitabine-5'-triphosphate (dF-dCTP) | Jena bioscience | NU-1607 | Compound tested in SAMHD1 activator/substrate assay |
| GraphPad Prism | GraphPad Software | Prism 8 | Data analysis and visualisation |
| Guanosine 5′-triphosphate (GTP) sodium salt hydrate | Sigma-Aldrich | G8877 | Allosteric activator for SAMHD1 activator/substrate assay |
| His-tagged E. coli inorganic pyrophosphatase (PPase) | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant PPase protein, hydrolises inorganic triphosphate and pyrophosphate to orthophosphate so it can form complex with malachite green |
| His-tagged human SAMHD1 | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant SAMHD1 protein, hydrolizes dNTPs into its corresponding nucleoside and inorganic triphosphate |
| Hydroxyurea | Sigma-Aldrich | H8627 | Compound tested in SAMHD1 inhibition assay |
| Lomofungin | National Cancer Institute (NCI)/Division of Cancer Treatment and Diagnosis (DCTD)/Developmental Therapeutics Program (DTP) | NSC106995 | Compound tested in SAMHD1 inhibition assay |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | SAMHD1 reaction buffer component |
| Malachite green Carbinol hydrochloride | Sigma-Aldrich | 213020 | Malachite green stock component |
| Microplate Reader | Hidex | Hidex Sense Microplate reader | Data acquisition, absorption read at 630 nm wavelength |
| Sodium Chloride (NaCl) | Sigma-Aldrich | 31434 | SAMHD1 reaction buffer component |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 567530 | SAMHD1 reaction buffer component |
| Sodium phosphate (Na3PO4) | Sigma-Aldrich | 342483 | Required for phosphate standard curve |
| Sulphuric acid 95-97% | Sigma-Aldrich | 84720 | Malachite green stock component |
| Tris-Acetate salt | Sigma-Aldrich | T1258 | SAMHD1 reaction buffer component |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) | Sigma-Aldrich | C4706 | SAMHD1 reaction buffer component |
| Tween-20 | Sigma-Aldrich | P1379 | SAMHD1 reaction buffer and malachite green working reagent component |
References
- Franzolin, E., et al. The deoxynucleotide triphosphohydrolase SAMHD1 is a major regulator of DNA precursor pools in mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14272-14277 (2013).
- Coggins, S. A., Mahboubi, B., Schinazi, R. F., Kim, B. SAMHD1 functions and human diseases. Viruses. 12 (4), 382 (2020).
- Goldstone, D. C., et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase. Nature. 480 (7377), 379-382 (2011).
- Powell, R. D., Holland, P. J., Hollis, T., Perrino, F. W. Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase. The Journal of Biological Chemistry. 286 (51), 43596-43600 (2011).
- Morris, E. R., Taylor, I. A. The missing link: Allostery and catalysis in the anti-viral protein SAMHD1. Biochemical Society Transactions. 47 (4), 1013-1027 (2019).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2015).
- Herold, N., et al. Targeting SAMHD1 with the Vpx protein to improve cytarabine therapy for hematological malignancies. Nature Medicine. 23 (2), 256-263 (2017).
- Schneider, C., et al. SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia. Nature Medicine. 23 (2), 250-255 (2017).
- Hollenbaugh, J. A., et al. Substrates and inhibitors of SAMHD1. PloS One. 12 (1), 0169052 (2017).
- Knecht, K. M., et al. The structural basis for cancer drug interactions with the catalytic and allosteric sites of SAMHD1. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10022-10031 (2018).
- Oellerich, T., et al. Selective inactivation of hypomethylating agents by SAMHD1 provides a rationale for therapeutic stratification in AML. Nature Communications. 10 (1), 3475 (2019).
- Herold, N., et al. SAMHD1 protects cancer cells from various nucleoside-based antimetabolites. Cell Cycle. 16 (11), 1029-1038 (2017).
- Rothenburger, T., et al. SAMHD1 is a key regulator of the lineage-specific response of acute lymphoblastic leukaemias to nelarabine. Communications Biology. 3 (1), 324 (2020).
- Ordonez, P., et al. SAMHD1 enhances nucleoside- analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824 (2017).
- Castellví, M., et al. Pharmacological modulation of SAMHD1 activity by CDK4/6 inhibitors improves anticancer therapy. Cancers. 12 (3), 713-719 (2020).
- Rassidakis, G. Z., et al. Low-level expression of SAMHD1 in acute myeloid leukemia (AML) blasts correlates with improved outcome upon consolidation chemotherapy with high-dose cytarabine-based regimens. Blood Cancer Journal. 8 (11), 98 (2018).
- Rudd, S. G., Schaller, T., Herold, N. SAMHD1 is a barrier to antimetabolite-based cancer therapies. Molecular & Cellular Oncology. 4 (2), 1287554 (2017).
- Rudd, S. G., et al. Ribonucleotide reductase inhibitors suppress SAMHD1 ara-CTPase activity enhancing cytarabine efficacy. EMBO Molecular Medicine. 41, 10419 (2020).
- Seamon, K. J., et al. Small molecule inhibition of SAMHD1 dNTPase by tetramer destabilization. Journal of the American Chemical Society. 136 (28), 9822-9825 (2014).
- Seamon, K. J., Stivers, J. T. A high-throughput enzyme-coupled assay for SAMHD1 dNTPase. Journal of Biomolecular Screening. 20 (6), 801-809 (2015).
- Mauney, C. H., Perrino, F. W., Hollis, T. Identification of inhibitors of the dNTP triphosphohydrolase SAMHD1 using a novel and direct high-throughput assay. Biochemistry. 57 (47), 6624-6636 (2018).
- Morris, E. R., et al. Crystal structures of SAMHD1 inhibitor complexes reveal the mechanism of water-mediated dNTP hydrolysis. Nature Communications. 11 (1), 3165 (2020).
- Hansen, E. C., Seamon, K. J., Cravens, S. L., Stivers, J. T. GTP activator and dNTP substrates of HIV-1 restriction factor SAMHD1 generate a long-lived activated state. Proceedings of the National Academy of Sciences of the United States of America. 111 (18), 1843-1851 (2014).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Hyun, M., Bohr, V. A., Ahn, B. Biochemical characterization of the WRN-1 RecQ helicase of Caenorhabditis elegans. Biochemistry. 47 (28), 7583-7593 (2008).
- Lin, H. -. H., Huang, C. -. Y. Characterization of flavonol inhibition of DnaB helicase: real-time monitoring, structural modeling, and proposed mechanism. Journal of Biomedicine & Biotechnology. 2012 (4), 735368 (2012).
- Yang, M., Wang, G. ATPase activity measurement of DNA replicative helicase from Bacillus stearothermophilus by malachite green method. Analytical Biochemistry. 509, 46-49 (2016).
- Allard, B., Cousineau, I., Spring, K., Stagg, J. Measurement of CD73 enzymatic activity using luminescence-based and colorimetric assays. Methods in Enzymology. 629, 269-289 (2019).
- Lee, M., et al. Structure-activity relationship of sulfonyl piperazine LpxH inhibitors analyzed by an LpxE-coupled malachite green assay. ACS Infectious Diseases. 5 (4), 641-651 (2019).
- Carreras-Puigvert, J., et al. A comprehensive structural, biochemical and biological profiling of the human NUDIX hydrolase family. Nature Communications. 8 (1), 1541 (2017).
- Valerie, N. C. K., et al. NUDT15 hydrolyzes 6-thio-deoxyGTP to mediate the anticancer efficacy of 6-thioguanine. Cancer Research. 76 (18), 5501-5511 (2016).
- Carter, M., et al. Human NUDT22 Is a UDP-glucose/galactose hydrolase exhibiting a unique structural fold. Structure. 26 (2), 295-303 (2018).
- Gad, H., et al. MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool. Nature. 508 (7495), 215-221 (2014).
- Page, B. D. G., et al. Targeted NUDT5 inhibitors block hormone signaling in breast cancer cells. Nature Communications. 9 (1), 250 (2018).
- Zhang, S. M., et al. Development of a chemical probe against NUDT15. Nature Chemical Biology. 16 (10), 1120-1128 (2020).
- Michel, M., et al. In silico druggability assessment of the NUDIX hydrolase protein family as a workflow for target prioritization. Frontiers in Chemistry. 8, 443 (2020).
- Zhang, J., Chung, T., Oldenburg, K. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67 (1999).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Markossian, S., et al. Assay guidance manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Holdgate, G. A., Meek, T. D., Grimley, R. L. Mechanistic enzymology in drug discovery: a fresh perspective. Nature Reviews Drug Discovery. 17 (2), 115-132 (2018).
- Tsesmetzis, N., Paulin, C. B. J., Rudd, S. G., Herold, N. Nucleobase and nucleoside analogues: resistance and re-sensitisation at the level of pharmacokinetics, pharmacodynamics and metabolism. Cancers. 10 (7), 240 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved