Method Article
dNTPase SAMHD1 ile Küçük Molekül Etkileşimini Araştırmak için Yüksek Verimli Enzime Bağlı Aktivite Testi
Bu Makalede
Özet
SAMHD1, insan sağlığı ve hastalığında kritik rolleri olan bir deoksinükleozit trifosfat trifosfohidrolazdır. Burada, küçük moleküllerin ve nükleotid analoglarının SAMHD1 substratları, aktivatörleri ve inhibitörleri olarak değerlendirilmesine izin veren, 384 oyuklu bir mikroplaka formatında konuşlandırılan çok yönlü bir enzime bağlı SAMHD1 aktivite testi sunuyoruz.
Özet
Steril alfa motifi ve HD alan içeren protein 1 (SAMHD1), hücre içi deoksinükleosit trifosfat (dNTP) havuzlarının önemli bir düzenleyicisidir, çünkü bu enzim dNTP'leri karşılık gelen nükleositlerine ve inorganik trifosfatlara hidrolize edebilir. Nükleotid metabolizmasındaki kritik rolü, çeşitli patolojilerle ilişkisi ve tedavi direncindeki rolü nedeniyle, bu enzimin hem düzenlenmesi hem de hücresel işlevinin daha iyi anlaşılması için şu anda yoğun araştırmalar yapılmaktadır. Bu nedenle, allosterik düzenleyiciler, substratlar veya inhibitörler gibi SAMHD1 ile küçük molekül etkileşimini araştırmak için basit ve ucuz, yüksek verimli uygun yöntemlerin geliştirilmesi hayati önem taşımaktadır. Bu amaçla, enzime bağlı malakit yeşili tahlili, SAMHD1 aktivitesinin dolaylı ölçümüne izin veren 384 mikrokuyucuklu plaka formatında konuşlandırılabilen basit ve sağlam bir kolorimetrik tahlildir. SAMHD1, nükleotid substratlarından trifosfat grubunu serbest bıraktığından, bu reaksiyona bir pirofosfataz aktivitesini bağlayabiliriz, böylece bir fosfomolibdat malakit yeşil kompleksinin oluşumu yoluyla malakit yeşil reaktifi tarafından ölçülebilen inorganik fosfat üretebiliriz. Burada, bilinen SAMHD1 inhibitörlerini karakterize etmek ve kanonik olmayan substratların SAMHD1 katalizinde yer alan mekanizmaları deşifre etmek ve nükleosid bazlı antikanser ilaçlarla örneklenen allosterik aktivatörler tarafından regülasyonu için bu metodolojinin uygulanmasını gösteriyoruz. Bu nedenle, enzime bağlı malakit yeşili tahlili, SAMHD1'i incelemek için güçlü bir araçtır ve ayrıca, fosfat türlerini serbest bırakan çeşitli enzimlerin çalışmasında da kullanılabilir.
Giriş
Steril alfa motifi ve histidin-aspartat alan içeren protein 1 (SAMHD1), insan sağlığı ve hastalığında birçok rolü olanmemeli hücrelerinde 1 nükleotid homeostazının merkezi bir düzenleyicisidir2. Bu enzim, deoksinükleosit trifosfatları (dNTP'ler) kendi soydaş deoksinükleosit ve inorganik trifosfat moleküllerine 3,4 hidrolize etme yeteneğine sahiptir ve bu aktivite (d)NTP bolluğu tarafından allosterik olarak düzenlenir (referans5'te gözden geçirilmiştir). Her SAMHD1 monomeri, iki allosterik bölge (AS1 ve AS2) ve bir katalitik bölge içerir ve aktif enzimin oluşumu, (d) NTP bağlanması üzerine bir homotetramerin sıralı montajını gerektirir. SAMHD1 monomerlerinin dimerizasyonu ilk olarak bir guanin trifosfatın (GTP veya dGTP) AS1'e bağlanmasıyla tetiklenir ve ek bir dNTP molekülü AS2'ye bağlandığında müteakip tetramerizasyon elde edilir, bu da katalitik bölgeye substrat erişimini ve ardından hidrolizi sağlar.
SAMHD1 substratları, viral enfeksiyonların ve kanserin tedavisinde kullanılan birkaç nükleosid bazlı ilacın trifosfat metabolitleri de dahil olmak üzere bazı baz ve şekerle modifiye edilmiş nükleotidlerle birlikte dört kanonik dNTP 3,4'ü içerir ve bunların birçoğu allosterik aktivatörler olarak da işlev görebilir 6,7,8,9,10,11. Sonuç olarak SAMHD1, bu bileşiklerin birçoğunun hastalık modellerindeetkinliğini modüle eder 7,8,9,10,11,12,13,14,15 ve ayrıca, akut miyeloid lösemi (AML) için standart bakım tedavisi olarak kalan deoksisitidin analogu sitarabin (ara-C) on yıllardır Bu hastalıkta tedavi etkinliği 7,8,16. Bu nedenle SAMHD1, nükleosid bazlı tedavilerin17 etkinliğini artırmak için potansiyel bir biyobelirteç ve terapötik hedeftir ve buna göre, biz ve diğerleri, hücrelerde SAMHD1'i etkisiz hale getirmek için stratejiler belirlemeye çalıştık. Kanser hücreleri7 içindeki bozunma için SAMHD1'i hedeflemek için biyolojik bir inhibitör olarak viral protein X'in (Vpx) kullanılmasını önerdik, ancak bu yaklaşımın bir takım sınırlamaları vardır (referans12'de tartışılmıştır) ve ayrıca yakın zamanda AML18'in çeşitli modellerinde gösterdiğimiz ribonükleotid redüktazın inhibisyonu yoluyla SAMHD1 aktivitesini baskılamak için dolaylı bir yaklaşım bildirdik. Bir dizi çalışma, SAMHD1'i doğrudan inhibe edebilen küçük molekülleri tanımlamaya çalışmıştır ve bugüne kadar, bu tür birkaç molekül rapor edilmiştir, ancak yalnızca in vitro 6,9,19,20,21,22 inhibisyonu belgelemiştir. Sonuç olarak, nükleosid bazlı terapötiklerin SAMHD1 katalizinin karmaşık mekanizmaları ile birleştiğinde hücrelerde SAMHD1 aktivitesini güçlü bir şekilde inhibe eden küçük moleküllerin eksikliği, daha fazla araştırma ihtiyacının altını çizmektedir. Bu nedenle, SAMHD1 ile küçük molekül etkileşimini araştırmak için sağlam ve ideal olarak yüksek verimli uygun yöntemler, klinik olarak ilgili bu enzimin substratlarını, allosterik düzenleyicilerini ve inhibitörlerini tanımlamak için idealdir.
İnce tabaka kromatografisi (TLC)9,20,23 ve yüksek performanslı sıvı kromatografisi (HPLC)9,21 gibi SAMHD1'in dNTPaz aktivitesini doğrudan ölçen çeşitli metodolojiler mevcuttur, ancak bunlar yüksek verimli kurulumlara kolayca uygun değildir. Bunun bir istisnası, SAMHD1'in bis (4-nitrofenil) fosfatı (b4NPP) p-nitrofenol ve p-nitrofenil fosfata hidrolize etme yeteneğinden yararlanan testtir Mn2+ aktive edici katyon olarak kullanıldığında, bir mikrokuyu plakasında kolayca ölçülebilen kolorimetrik bir değişiklikle sonuçlanır21. Bu test, SAMHD1 inhibitörlerinin tanımlanması ve karakterizasyonu için başarıyla kullanılmıştır, ancak hidrolizin, (d) NTP aktivatörlerinin yokluğunda ve muhtemelen fizyolojik olmayan bir aktive edici katyonun varlığında meydana geldiğine dikkat edilmelidir, her ikisi de dikkate alınması gereken önemli uyarılardır. Bu aynı zamanda bu testi SAMHD1'in allosterik düzenleyicilerinin incelenmesi ve tanımlanması için daha az uygulanabilir hale getirir.
Bu bağlamda, bu raporda detaylandırıldığı gibi, malakit yeşil reaktifi ile birleştirilmiş enzime bağlı bir yaklaşım, SAMHD1'in dNTPaz aktivitesini dolaylı olarak ölçmek ve ayrıca çeşitli küçük moleküllerin üzerindeki etkisini sorgulamak için çok yönlü bir yöntem olabilir. Malakit yeşili tahlili, 620nm24'te ölçülen kolorimetrik bir değişikliğe yol açan bir molibdofosforik asit kompleksinin oluşumuna dayanan serbest inorganik fosfatın (Pi) tespiti için sağlam ve güvenilir bir kolorimetrik tekniktir. SAMHD1 hidrolizi, nükleotid substratlarından trifosfat grubunu serbest bıraktığından, bu reaksiyonu, malakit yeşil reaktifinin eklenmesinden önce serbest inorganik fosfat üretecek bir (piro)fosfataz aktivitesi ile birleştirmek gerekir. Malakit yeşili tahlili hassas ve uygun maliyetlidir ve reaksiyonlarında veya bir birleştirme enziminin varlığında inorganik fosfat gruplarını serbest bırakan enzimler için inhibitörlerin ve substratların tanımlanması ve karakterizasyonu için yaygın olarak kullanılmaktadır. Helikaz 25,26,27'nin ATPaz aktivitelerinin karakterizasyonunda veya AMP'nin adenosin ve inorganik fosfat28'e bozunmasına aracılık eden CD73 enzimatik aktivitesinin incelenmesinde yaygın olarak uygulanmıştır. Ek olarak, birleştirildiğinde, çoğu Gram-negatif patojende önemli bir enzim olan UDP-2,3-diasilglukozamin pirofosfataz LpxH'yi hedefleyen antibiyotik ilaçların keşfinde kullanılmıştır29. Kanser araştırmaları ile ilgili olarak, enzime bağlı yaklaşım, hem substratların30,31,32 karakterizasyonunda hem de ilaçların ve kimyasal probların tanımlanmasında ve geliştirilmesinde bir nükleotid metabolize edici enzim ailesi olan NUDIX hidrolazlara karşı kapsamlı bir şekilde konuşlandırılmıştır 33,34,35,36.
dNTPase SAMHD1 ile ilgili olarak, bu yaklaşım çeşitli raporlarda kullanılmıştır. Bağlanma enzimi olarak Saccharomyces cerevisiae'den ekzopolifosfataz Ppx1 kullanılarak, bu test, SAMHD1'in substratları, aktivatörleri veya inhibitörleri olarak birkaç nükleotid analogunu test etmek için kullanıldı ve anti-lösemik ilaç klofarabinin trifosfat metabolitinin bir aktivatör ve substrat olarak tanımlanmasıyla sonuçlandı6. Ek olarak, bağlanma enzimi olarak Escherichia coli'den inorganik pirofosfataz ile, inhibitörleri20 tanımlamak için SAMHD1'e karşı klinik olarak onaylanmış bileşiklerin bir kütüphanesinin taranmasında kullanılmıştır. Araştırmamızda, ara-C'nin aktif metaboliti olan ara-CTP'nin bir SAMHD1 substratı olduğunu, ancak allosterik aktivatör7 olmadığını göstermek için bu yaklaşımı kullandık ve daha sonra bu testi, AML modellerini SAMHD1'e bağımlı bir şekilde ara-C'ye duyarlı hale getirebilen birkaç küçük molekülün aslında SAMHD118'i doğrudan inhibe etmediğini göstermek için kullandık. Bu raporda, bu çok yönlü yöntemi detaylandıracağız ve SAMHD1'in inhibitörlerinin, aktivatörlerinin ve substratlarının tanımlanması için yüksek verimli uygun bir kurulumda uygulanabilirliğini göstereceğiz.
Protokol
Aşağıdaki yöntemlere şematik bir genel bakış Şekil 1'de gösterilmiştir ve malzeme ve reaktiflerin ayrıntılı bir listesi Malzeme Tablosunda mevcuttur.
1. Tahlil tamponlarının hazırlanması.
- Stok tamponlarının hazırlanması.
NOT: Tahlil, yaygın olabilen fosfatların tespitine duyarlı olduğundan, kontaminasyonu önlemek için cam eşyaları ultra saf veya çift damıtılmış su ile üç kez durulayın. Tüm tamponlar oda sıcaklığında (RT) saklanabilir.- 4.5 g Tris Asetat, 2.3 g NaCl ve 0.2 g MgCl2'yi pH 8'e ayarlamadan önce yaklaşık 800 mL suda çözerek 1 L SAMHD1 reaksiyon tamponu (RB) stok çözeltisi (25 mM Tris-Asetat pH 8, 40 mM NaCl, 1 mM MgCl2) hazırlayın.
- 1 mL 0.5 M TCEP'yi 4 mL suya seyrelterek 5 mL 0.1 M TCEP stok çözeltisi hazırlayın.
- 5 mL %100 Tween-20'yi 44.5 mL suya seyrelterek 50 mL %11 Tween-20 stok çözeltisi hazırlayın.
NOT: Tween-20 ışığa duyarlıdır. - pH 8'e ve son hacme ayarlamadan önce 9,3 g EDTA'yı yaklaşık 40 mL suda çözerek 50 mL 0,5 M EDTA durdurma çözeltisi hazırlayın.
- Kahverengi bir cam şişede 300 mL suya 60 mL konsantre sülfürik asidi yavaşça ekleyerek Malakit Yeşili (MG) stok çözeltisini (H2S04'te 3.2 mM malakit yeşili) hazırlayın. Çözeltiyi RT'ye soğutun ve 0.44 g malakit yeşili çözün.
DİKKAT: Sülfürik asidin su ile reaksiyonu ekzotermiktir ve bu nedenle şişe ısınarak basınç birikmesine neden olabilir; Bu basıncın sık sık boşaltıldığından emin olun.
NOT: Elde edilen turuncu çözelti ışığa duyarlıdır (dolayısıyla kahverengi şişe) ve RT'de en az 1 yıl stabildir. Çökelti zamanla oluşabilir, sadece süpernatantın kullanıldığından emin olun. - 3.75 g amonyum molibdatı, 50 mL suda çözerek 50 mL% 7 amonyum molibdat stok çözeltisi hazırlayın.
NOT: Çökelti zamanla oluşabilir, sadece süpernatantın kullanıldığından emin olun.
- Tam tahlil tamponlarının hazırlanması
NOT: Bu, deney günü yapılmalıdır- Tam SAMHD1 RB (25 mM Tris-Asetat pH 8, 40 mM NaCl, 1 mM MgCl2, 0.3 mM TCEP, %0.005 Tween-20) hazırlayın. Bu bileşenleri Tween-20 için %0,005 ve TCEP için 0,3 mM'lik bir nihai konsantrasyonda SAMHD1 RB stoğuna eklemek için önceden hazırlanmış %11 Tween-20 ve 0,1 M TCEP stoklarını kullanın.
- EDTA durdurma çözeltisi hazırlayın (25 mM Tris-Asetat pH 8, 40 mM NaCl, 1 mM MgCl2, 0.3 mM TCEP, %0.005 Tween-20, 7.9 mM EDTA). SAMHD1 RB'yi tamamlamak için, EDTA'yı 7,9 mM'lik bir nihai konsantrasyona eklemek için 0,5 M EDTA stok çözeltisi kullanın.
- 10 kısım MG stok çözeltisini 2,5 kısım %7 amonyum molibdat ve 0,2 kısım %11 Tween-20 ile karıştırarak MG çalışma solüsyonu (2,5 mM malakit yeşili, %1,4 amonyum molibdat, %0,18 Tween-20) hazırlayın.
2. SAMHD1 inhibisyon testi ve IC50 bileşiğinin belirlenmesi
NOT: Son tahlil koşulları Tablo 1'de gösterilmiştir.
- Tahlil plakasında bileşiklerin hazırlanması
NOT: Küçük moleküler ağırlıklı bileşikler tipik olarak suda %100 DMSO ve nükleotid analoglarında çözülür. Stok konsantrasyonu 10 ila 100 mM arasında değişir ve tahlilin DMSO toleransı ile birlikte bileşiklerin gücü ve çözünürlüğünden etkilenir. Enzim aktivitelerinin bu çözücüden etkilenmediğinden emin olmak için reaksiyondaki nihai DMSO konsantrasyonunun %1'i geçmediğini kontrol edin. Deneyden önce testin çözücüye toleransını test etmek iyi bir uygulamadır.- Çok kanallı bir pipet veya otomatik sıvı işleme ekipmanı kullanarak şeffaf yuvarlak tabanlı polipropilen 100 oyuklu bir plakada ilgili çözücüde (örneğin, küçük moleküller için %100 DMSO veya nükleotid analogları için su) 96x nihai konsantrasyonda seri olarak seyreltilmiş test bileşikleri hazırlayın.
NOT: Bileşik stabilitesine bağlı olarak, seyreltme plakaları önceden hazırlanabilir, kapatılabilir ve -20 °C'de saklanabilir. Protokole devam etmeden önce plakaların RT'ye dengelenmesini bekleyin. - Tam SAMHD1 RB kullanarak, bileşikleri 25x nihai konsantrasyona seyreltin (nihai çözücü konsantrasyonunu% 1'in altında tutmak için) ve 5 μL'yi şeffaf 384 oyuklu düz tabanlı bir test plakasının uygun kuyucuklarına aktarın. Prosedürü yalnızca solvent içeren kontrol numuneleri ile tekrarlayın.
- Çok kanallı bir pipet veya otomatik sıvı işleme ekipmanı kullanarak şeffaf yuvarlak tabanlı polipropilen 100 oyuklu bir plakada ilgili çözücüde (örneğin, küçük moleküller için %100 DMSO veya nükleotid analogları için su) 96x nihai konsantrasyonda seri olarak seyreltilmiş test bileşikleri hazırlayın.
- Reaksiyon bileşenlerinin hazırlanması
NOT: Bu, tahlil gününde yapılmalıdır. Rekombinant insan SAMHD1 ve E. coli pirofosfataz (PPase) alikotları, depolama tamponunda (20 mM HEPES pH 7.5, 300 mM NaCl, %10 gliserol, 2 mM TCEP) sırasıyla 9.1 mg/mL ve 23.0 mg/mL'de seyreltilerek -80 °C'de uzun süreli olarak saklanır. Çözüldükten sonra, alikotlar -20 ° C'de kısa süreli olarak saklanır.- Rekombinant insan SAMHD1 proteinini ve rekombinant PPaz'ı tam SAMHD1 RB'de istenen nihai konsantrasyonun 4 katına kadar seyrelterek enzim (SAMHD1/PPaz) ana karışımını hazırlayın, böylece 1.4 μM SAMHD1 ve 50 U/mL PPaz.
- dGTP stoğunu (tipik olarak 10 veya 100 mM suda) tam SAMHD1 RB'de 2x nihai konsantrasyona, dolayısıyla 50 μM dGTP'ye seyrelterek aktivatör/substrat dGTP'yi hazırlayın.
- Testi gerçekleştirin
NOT: Tüm tahlil bileşenleri RT'ye dengelenmelidir. Sıvı ilaveleri, çok kanallı bir pipet veya bir toplu reaktif sıvı dağıtıcısı ile gerçekleştirilebilir.- Bileşik dilüsyonlar ve yalnızca çözücü kontrolleri içeren 384 oyuklu tahlil plakasına 5 μL SAMHD1/PPase ana karışımı dağıtın. Hiçbir enzim kontrol kuyusuna 5 μL tam SAMHD1 RB dağıtın. Enzim ve bileşikleri RT'de 10 dakika önceden inkübe edin.
- Tüm kuyucuklara, reaksiyonu başlatmak için 10 μL 2x dGTP çözeltisi dağıtın.
- Reaksiyonu RT'de 20 dakika inkübe edin.
- Tüm kuyucuklara 20 μL EDTA durdurma çözeltisi dağıtarak reaksiyonu durdurun.
NOT: İstenirse deney burada duraklatılabilir. - Tüm kuyucuklara 10 μL MG çalışma solüsyonu ekleyin.
DİKKAT: MG çalışma çözeltisi sülfürik asit içerir. - Orbital bir mikro kuyu plakası çalkalayıcı ve 1,000 x g'da 1 dakika boyunca santrifüjleme kullanarak kuyu içeriğinin karıştırılmasını sağlayın.
- Plakayı RT'de 20 dakika inkübe edin.
- Bir mikrokuyu plaka okuyucusunda 630 nm dalga boyunda absorpsiyonu okuyun.
- Veri görselleştirme ve analiz
- Pozitif ve negatif kontrol kuyucuklarının ortalama ve standart sapmasını hesaplayın (pozitif, çözücü ile tam reaksiyon; negatif, çözücü ile tek başına dGTP). Test kalitesinin bir göstergesi olarak Z-faktörü37'yi hesaplayın.
- Pozitif kontrolü %100 SAMHD1 aktivitesi ve negatif kontrolü %0 SAMHD1 aktivitesi olarak ayarlayarak her absorbans değerini pozitif ve negatif kontrollerin ortalama değerlerine normalleştirin.
- SAMHD1 aktivitesini (%) bileşik konsantrasyonun bir fonksiyonu olarak çizin ve bileşik IC50'nin belirlenmesine izin veren dört parametreli değişken eğim doz-yanıt eğrisine uyun.
3. SAMHD1 aktivatörü ve substrat ekranı
NOT: Son tahlil koşulları Tablo 2'de gösterilmiştir. Rekombinant SAMHD1 ve PPase alikotları, -80 °C'de depolama tamponunda (20 mM HEPES pH 7.5, 300 mM NaCl, %10 gliserol, 2 mM TCEP) sırasıyla 9.1 mg/mL ve 23.0 mg/mL'de seyreltilerek -80 °C'de uzun süreli olarak saklanır. Çözüldükten sonra, alikotlar -20 ° C'de kısa süreli olarak saklanır.
- Test plakasında nükleotid analoglarının hazırlanması
- Nükleotid analog stoklarını (tipik olarak suda 10 veya 100 mM) tam SAMHD1 RB'de, bizim durumumuzda 800 μM nükleotid analogunda 4x nihai konsantrasyona seyreltin ve 5 μL'yi 384 oyuklu bir test plakasının uygun kuyucuklarına aktarın.
- Reaksiyon bileşenlerinin hazırlanması
NOT: Bu, tahlil gününde yapılmalıdır- Rekombinant insan SAMHD1 proteinini ve rekombinant E. coli PPaz'ı tam SAMHD1 RB'de istenen nihai konsantrasyonun 2 katına seyrelterek enzim (SAMHD1 / PPase) ana karışımını hazırlayın, böylece 0.7 μM SAMHD1 ve 25 U / mL PPaz.
- Rekombinant E. coli PPase'i tam SAMHD1 RB'de istenen nihai konsantrasyonun 2 katına, dolayısıyla 25 U / mL PPase'ye seyrelterek tek başına PPaz çözeltisi hazırlayın.
- Aktivatörler GTP (AS1) ve dGTPαS (AS1 ve AS2) seyreltme stoğu (tipik olarak 10 veya 100 mM suda) tam SAMHD1 RB'den 4x nihai konsantrasyona, dolayısıyla 50 μM GTP veya dGTPαS'ye hazırlayın.
- Testi gerçekleştirin
NOT: Tüm tahlil bileşenleri RT'ye dengelenmelidir. Sıvı ilaveleri, çok kanallı bir pipet veya bir toplu reaktif sıvı dağıtıcısı ile gerçekleştirilebilir.- Nükleotid analogları içeren 384 oyuklu tahlil plakasına, 5 μL aktivatör (GTP veya dGTPαS) dağıtın veya SAMHD1 RB'yi uygun kuyucuklara tamamlayın.
- 10 μL SAMHD1/PPase ana karışımı, tek başına PPase veya tam SAMHD1 RB'yi uygun kuyucuklara dağıtarak reaksiyonu başlatın.
- Reaksiyonu RT'de 20 dakika inkübe edin.
- Tüm kuyucuklara 20 μL EDTA durdurma çözeltisi dağıtarak reaksiyonu durdurun.
NOT: İstenirse deney burada duraklatılabilir. - Tüm kuyucuklara 10 μL MG çalışma solüsyonu ekleyin.
DİKKAT: MG çalışma çözeltisi sülfürik asit içerir. - Orbital bir mikro kuyu plakası çalkalayıcı ve 1,000 x g'da 1 dakika boyunca santrifüjleme kullanarak kuyu içeriğinin karıştırılmasını sağlayın.
- Plakayı RT'de 20 dakika inkübe edin.
- Bir mikrokuyu plaka okuyucusunda 630 nm dalga boyunda absorpsiyonu okuyun.
- Veri görselleştirme ve analiz
- Yalnızca PPaz reaksiyon kuyucukları (negatif kontrol veya arka plan sinyali) için ortalama absorbans değerlerini hesaplayın.
NOT: Bir SAMHD1 allosterik aktivatörün ve substratın pozitif kontrolü olarak, dGTP plakaya dahil edilebilir. Bu durumda, test kalitesinin bir göstergesi olarak Z faktörünü hesaplamak için bu koşulu kullanabilirsiniz. - SAMHD1/PPase reaksiyonlarında karşılık gelen kuyucuklardan arka plan değerini çıkarın.
- Tampon, GTP ve dGTPαS koşulları ile her nükleotid analoğu için düzeltilmiş absorbans değerlerini çizin.
- Yalnızca PPaz reaksiyon kuyucukları (negatif kontrol veya arka plan sinyali) için ortalama absorbans değerlerini hesaplayın.
Sonuçlar
Şekil 1'de özetlenen protokol, küçük moleküllerin dNTPase SAMHD1 ile etkileşimini araştırmak için enzime bağlı malakit yeşili tahlilini kullanmak için temel iş akışını açıklar ve farklı biyokimyasal soruları sorgulamak için çeşitli şekillerde uyarlanabilir. Aşağıdaki paragraflarda tartışılan temsili sonuçlarda, küçük moleküllerin SAMHD1'e karşı inhibitör özelliklerini belirlemek ve farklı nükleotid analoglarının bu enzimin substratları ve/veya aktivatörleri olup olmadığını test etmek için bu testin kullanılmasının örneklerini gösteriyoruz.
Şekil 2'de gösterilen sonuçlar, bu testin birkaç temel ilkesini göstermektedir. Malakit yeşili reaktifi, bir fosfomolibdat malakit yeşili kompleksinin oluşumu yoluyla inorganik fosfatın kolorimetrik olarak saptanmasına izin verir ve buna göre, bu yaklaşım, ürünü fosfat olan enzimatik reaksiyonların incelenmesine uygulanabilir. Bu yöntemin serbest inorganik fosfatı tespit etme hassasiyetini göstermek için, Şekil 2A, malakit yeşili reaktifi ile 20 dakikalık bir inkübasyonun ardından artan Na3PO4 konsantrasyonları ile elde edilen absorbans değerlerini göstermektedir. Sinyal 0.25 mM Na3PO4'te doygunluğaulaşırken, fosfatın doğrusal algılama aralığı 0.004 ila 0.03 mM arasında görülebilir (Şekil 2A, sağ panel), malakit yeşili tahlili38 kullanılarak 10-20 μM'ye kadar bir fosfat doğrusal aralığı bildiren diğer çalışmalarla uyumlu olarak.
SAMHD1, bir dNTP molekülünü hidrolize ederken inorganik trifosfat açığa çıkaran bir dNTPazdır ve bu nedenle malakit yeşili tarafından tespit edilmek üzere serbest inorganik fosfat üretmek için bir birleştirme enzimi gereklidir. E. coli'den elde edilen inorganik pirofosfatazın (PPaz), hem SAMHD1 7,20 hem de diğer nükleotid metabolize edici enzimler30,33,35 açısından bu amaç için yararlı olduğu gösterilmiştir. Ek olarak, SAMHD1, bir homotetramer olarak aktif bir dNTPazdır ve bu, (d)NTP'ler, özellikle AS1'de bir guanin trifosfat (GTP veya dGTP) ve AS2'de herhangi bir dNTP tarafından allosterik aktivasyon gerektirir. Daha sonra, katalitik bölge substrat bağlanması için erişilebilir hale gelir ve enzimatik reaksiyon gerçekleşir. dGTP, AS1 ve AS2'ye bağlanma gereksinimlerini karşıladığından ve bir substrat olduğundan, bu nükleotidin inhibisyon testinde kullanılması iş akışını büyük ölçüde basitleştirir. Şekil 2B, 630 nm'de absorbansta bir artışla gösterilen ölçülebilir SAMHD1 aktivitesi elde etmek için farklı tahlil bileşenlerinin gereksinimini göstermektedir. Ne SAMHD1 ne de PPase tek başına, bu enzimlerin belgelenmiş aktiviteleri ile tutarlı olarak, dGTP varlığında inorganik fosfat üretme yeteneğine sahip değildir. Bununla birlikte, tüm tahlil bileşenlerinin mevcut olduğu durumda (SAMHD1, PPase ve dGTP aktivatörü/substratı) sinyalde bir artış gözlemleriz. Burada gösterilen örneğin Z faktörü37 (negatif kontrol olarak enzim + dGTP ve pozitif kontrol olarak SAMHD1/PPase + dGTP alınarak) 0.74 idi ve bu da sağlam bir testi gösteriyordu.
Enzime bağlı SAMHD1 aktivite testinin potansiyel uygulamalarından biri, yüksek verimli tarama (HTS) yoluyla inhibitörlerin tanımlanmasıdır. Bu nedenle, bu raporda, literatürde daha önce tarif edilmiş çeşitli bileşikler kullanarak bu tahlilde SAMHD1 inhibisyonunun tespitini doğruluyoruz. Seamon ve ark. burada gösterilene benzer bir tahlil kullanarak kanonik nükleozitlerin SAMHD1'e karşı doza bağlı inhibisyonunu değerlendirdi ve deoksiguanozinin (dGuo), 488 μM20'lik bir IC50 değeri ile SAMHD1'i önemli ölçüde inhibe edebilen tek kanonik nükleosit olduğunu buldu. Doğrudan b4NPP testi ile gerçekleştirilen FDA onaylı ilaçların HTS'si, mikromolar konsantrasyonlarda SAMHD1 aktivitesini inhibe eden birkaç isabet ortaya çıkardı, bunlardan lomofungin, SAMHD1 dNTPaz aktivitesini in vitro olarak en güçlü şekilde inhibe eden moleküldü ve bir substrat olarak dGTP varlığında belirlendiğinde 20.1 μM'lik bir IC50 sergiledi21. Ek olarak, dört α,β-imido-dNTP analogu, MDCC-PBP sensörü ve Ppx aktivitesine bağlı SAMHD1 kullanılarak SAMHD1'in rekabetçi inhibitörleri olarak tanımlanmıştır, bu da dNMPNPP analoglarının inhibitör sabitlerinin düşük mikromolar / yüksek nanomolar aralıktaolduğunu göstermiştir 6,22. Bu nedenle, enzime bağlı SAMHD1 aktivite testinin SAMHD1 inhibitörlerini tanımlamak için kullanılabileceğini göstermek için, tekniği doğrulamak için dGuo, lomofungin ve 2'-deoksitimidin-5' [(α,β)-imido] trifosfat (dTMPNPP) kullanıldı. Şekil 3A, bu bileşikler için elde edilen doz-yanıt eğrilerini göstermekte ve artan konsantrasyonların SAMHD1 aktivitesini etkili bir şekilde inhibe ettiğini göstermektedir. Bu moleküller için üç bağımsız deneyden (± standart sapma) elde edilen ortalama IC50 değerleri aşağıdaki gibidir: dGuo = 361.9 ± 72.8 μM, lomofungin 6.78 ± 3.9 μM ve dTMPNPP = 2.10 ± 0.9 μM. Negatif bir sonuç örneği olarak, hidroksiürenin (HU) SAMHD1 aktivitesi üzerindeki etkisi de belirlenmiştir. HU, ribonükleotid redüktazın bir inhibitörüdür ve çeşitli AML modellerinde SAMHD1 ara-CTPaz aktivitesini sınırlamasına rağmen, HU'nun SAMHD1 üzerindeki etkilerinin dolaylı olduğu ve SAMHD118'in allosterik regülasyonunu bozmaya dayandığı gösterilmiştir. HU'nun doz yanıt eğrisi Şekil 3B'de gösterilmiştir ve artan HU dozları ile SAMHD1 aktivitesinde herhangi bir değişiklik gözlenmemiştir, bu da HU'nun in vitro SAMHD1 aktivitesini inhibe etmediğini göstermektedir.
Enzime bağlı SAMHD1 aktivite testinin bir başka kullanımı, nükleotidlerin ve analoglarının, Şekil 4'te gösterilen bu enzimin substratları ve/veya allosterik aktivatörleri olup olmadığını sorgulamaktır. Bu deneyde, kanonik nükleotidlerin yanı sıra sitarabin (ara-CTP), klofarabin (Cl-F-ara-ATP) ve gemsitabin (dF-dCTP) gibi çeşitli anti-kanser nükleosid analoglarının aktif metabolitleri SAMHD1 substratları ve aktivatörleri olarak test edildi. SAMHD1'in karmaşık allosterik regülasyonu nedeniyle, reaksiyon, bir AS1 aktivatörü olarak GTP veya AS1 ve AS2'yi işgal edebilen hidrolize edilemeyen dGTP analoğu 2'-deoksiguanozin-5'-(α-tiyo)-trifosfat (dGTPαS) varlığında gerçekleştirilir. Test edilen nükleotid analoğu ve GTP'nin varlığında SAMHD1 aktivitesi, nükleotidin ikincil allosterik bölgeye ve katalitik bölgeye (yani AS2 aktivatörü ve substratı) bağlanabildiğini gösterirken, nükleotid analogu ve dGTPαS ile SAMHD1 aktivitesi, nükleotidin yalnızca katalitik bölgeyi (yani sadece bir substratı) işgal edebileceğini gösterir. Nükleotid hem AS1 hem de AS2 allosterik bölgelere ve katalitik bölgeye bağlanabiliyorsa, SAMHD1, dGTP durumunda gösterildiği gibi, tek başına nükleotid varlığında aktif olacaktır. Sonuçlar, tüm kanonik dNTP'lerin AS2 bölgesine ve katalitik bölgeye bağlanabildiğini göstermektedir. Nükleotid analogları söz konusu olduğunda, klofarabin trifosfat bir AS2 aktivatörü ve bir substrattır, oysa sitarabin trifosfat sadece katalitik bölgeyi işgal edebilir. Öte yandan, gemsitabin trifosfat ile herhangi bir aktivite gözlenmedi, bu da test edilen koşullar altında gemsitabin trifosfatın allosterik efektör veya substrat olarak hareket edemediğini düşündürdü. Bu sonuç önceki tahminlerle9 tutarlı olsa da, daha sonraki kristalleşme ve kinetik çalışmalar10 , gemsitabin trifosfatın SAMHD1 katalitik cebini bağlayabildiğini ve bunun gerçekten de enzimin bir substratı olduğunu ortaya koydu. Bununla birlikte, ikinci çalışmada10, yazarlar hidroliz oranının sitarabin trifosfat gibi bildirilen diğer substratlara kıyasla önemli ölçüde daha düşük olduğunu göstermekte ve bu nedenle bunu neden bu tarama kurulumuyla gözlemleyemediğimizi açıklamaktadır.
Toplamda, bu temsili sonuçlar, SAMHD1 inhibitörlerinin, allosterik düzenleyicilerin ve substratların tanımlanması ve karakterizasyonu için sağlam bir teknik olarak enzime bağlı SAMHD1 aktivite testinin kullanımını doğrulamaktadır. Bununla birlikte, tüm deneysel yaklaşımlara benzer şekilde, bu yöntemin de uyarıları vardır ve bu nedenle bulguları daha fazla doğrulamak için ortogonal testler (örneğin, farklı bir test teknolojisi kullanarak) kullanılmalıdır.
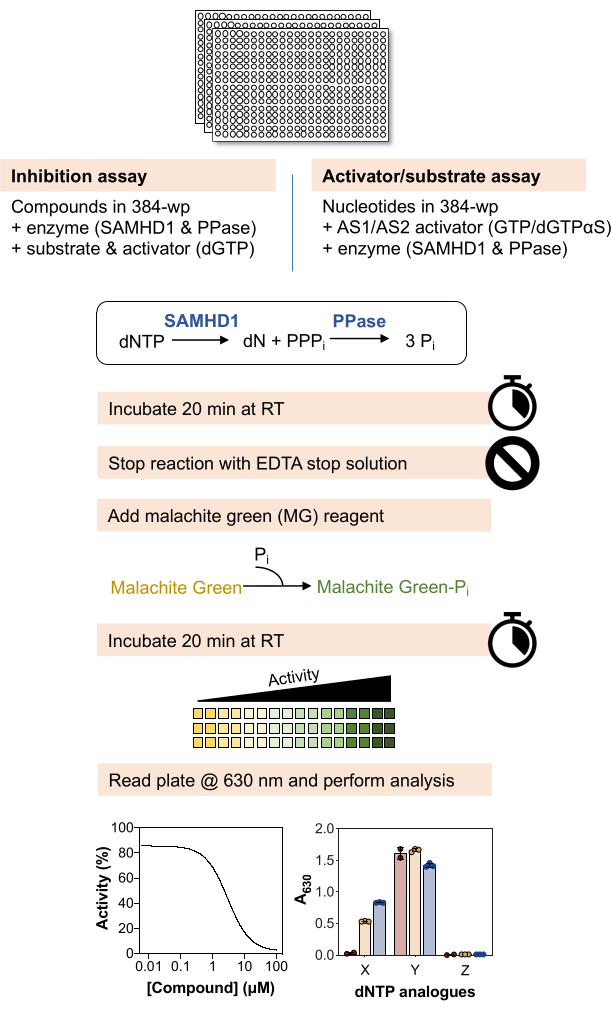
Şekil 1: Bu makalede açıklanan protokole şematik genel bakış. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
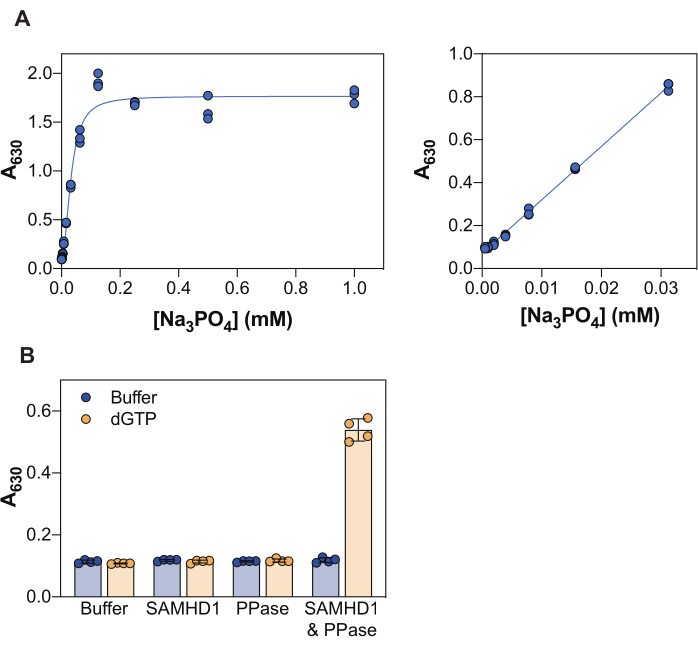
Şekil 2: Enzime bağlı SAMHD1 aktivite testi. (A) Malakit yeşili tahlilindeNa3PO4standart eğrisi. Na3PO4 seri seyreltme (2 kat) üç kopya halinde 1 mM'den 0.004 mM'ye kadar hazırlandı ve malakit yeşili reaktifi ile 20 dakika inkübe edildi. Test edilen konsantrasyonların tamamındaki ham absorbans değerleri sol panelde ve doğrusal aralık sağ panelde gösterilir. Gösterilen iki bağımsız deneyin temsilcisi. (B) Enzime bağlı aktivite testinin doğrulanması. Aktivatör / substrat dGTP (25 μM) varlığında veya yokluğunda SAMHD1 (0.35 μM) ve / veya PPaz (12.5 U / mL), enzime bağlı aktivite testinde 20 dakika inkübe edildi. Çizilen ham absorbans değerleri, çubuklar ve hata çubukları ile gösterilen iki bağımsız deneyin bir temsilcisinden alınan dörtlüler, ortalama ve SD'yi gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
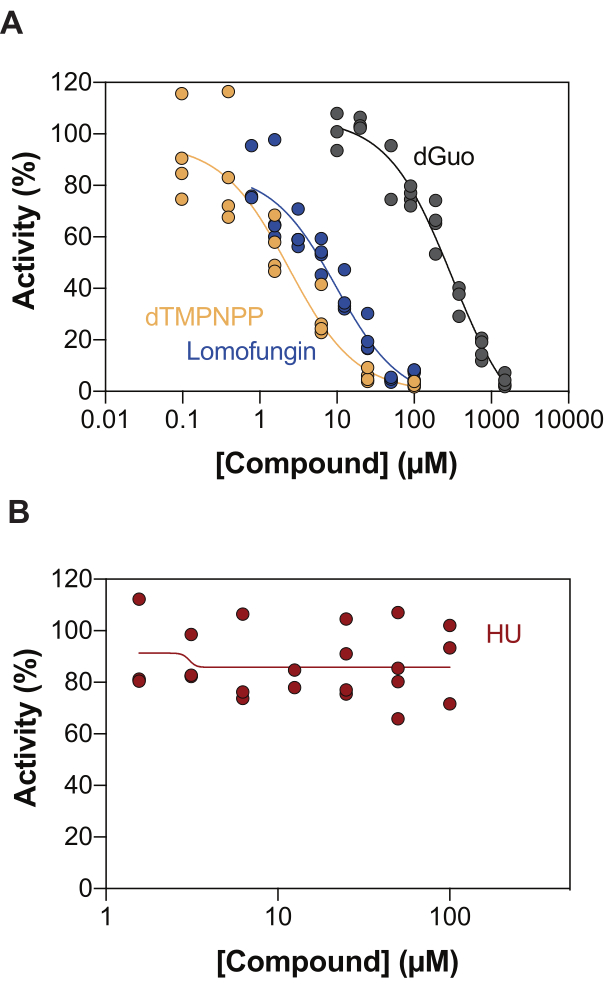
Şekil 3: Enzime bağlı aktivite testinde SAMHD1 inhibisyonu için bileşiklerin değerlendirilmesi. Lomofungin (0.78-100 μM), 2'-deoksitimidin-5'-[(α,β)-imido]trifosfat (dTMPNPP, 0.01-100 μM) ve deoksiguanozin (dGuo, 10-1.500 μM) (A) veya hidroksiüre (HU) (0.78-100 μM) (B) aktivatör / substrat olarak dGTP (25 μM) ile enzime bağlı SAMHD1 aktivite testinde. Gösterilen üç deneyin bir temsilcisi ile çizilen bireysel kopyalardan (DMSO + SAMHD1 / PPase + dGTP =% 100 aktivite, DMSO + dGTP =% 0 aktivite) reaksiyon kontrollerine göre yüzde aktivite. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
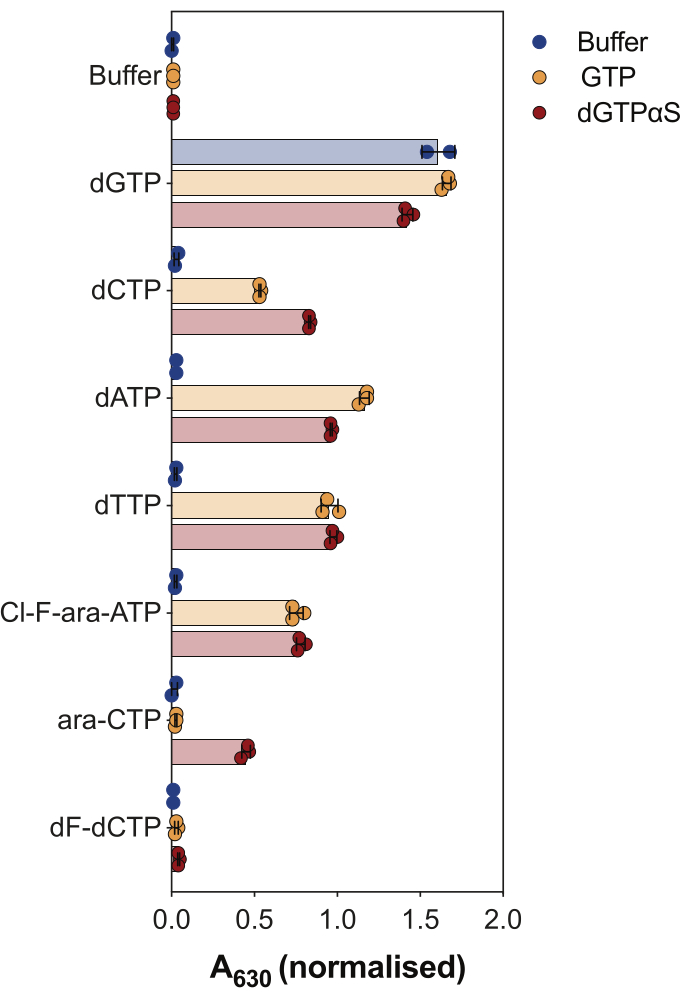
Şekil 4: Enzime bağlı aktivite testinde nükleotid analoglarının SAMHD1 allosterik aktivatörleri ve substratları olarak değerlendirilmesi. Antikanser ilaçları sitarabin (ara-CTP), klafarabin (Cl-F-ara-ATP) ve gemsitabinin (dF-dCTP) kanonik nükleotidleri ve seçilmiş trifosfat metabolitleri, enzime bağlı SAMHD1 aktivite testinde 200 μM'de test edildi GTP veya hidrolize edilemeyen dGTPαS (12.5 μM) varlığında veya yokluğunda. Çizilen bireysel deneysel kopyalardan normalleştirilmiş absorbans değerleri, ortalama ve SD belirtilir. Önceki çalışmamızdan uyarlanan iki bağımsız deneyin temsilcisi7. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Adım | Reaktif | Dağıtılan hacim (μL) | Son reaksiyon hacmi (μL) | Konsantrasyon dağıtıldı | Reaksiyonda katlama seyreltmesi | Reaksiyondaki son konsantrasyon |
| 1 | Inhibitörü | 5 | 20 | 0,4 milyon | 4 | 0,1 milyon |
| 2 | SAMHD1+PPase karışımı | 5 | 1,4 μM SAMHD1, 50 U/mL PPaz | 4 | 0,35 μM SAMHD1, 12,5 U/mL Ppaz | |
| 3 | dGTP | 10 | 50 μM | 2 | 25 μM | |
| 4 | 20 dakika inkübasyon | |||||
| 5 | EDTA çözümü | 20 | 40 | 7,9 milyon | 2 | 3,95 milyon |
| 6 | MG reaktifi | 10 | 50 | 2.5 mM Malakit yeşili, 64.4 mM Amonyum Molibdat, %0.18 Tween-20 | 5 | 0,5 mM Malakit yeşili, 12,9 mM Amonyum Molibdat, %0,036 Tween-20 |
| 7 | 20 dakika inkübasyon | |||||
| 8 | Okuma @ 630 nm | |||||
Tablo 1: İnhibitör taraması için enzime bağlı testteki son koşulların özeti.
| Adım | Reaktif | Dağıtılan hacim (μL) | Son reaksiyon hacmi (μL) | Konsantrasyon dağıtıldı | Reaksiyonda katlama seyreltmesi | Reaksiyondaki son konsantrasyon |
| 1 | Allosterik regülatör | 5 | 20 | 800 μM | 4 | 200 μM |
| 2 | GTP veya dGTPαS | 5 | 50 μM | 4 | 12,5 μM | |
| 3 | SAMHD1 ve/veya PPase | 10 | 0,7 μM SAMHD1, 25 U/mL PPaz | 2 | 0,35 μM SAMHD1, 12,5 U/mL PPaz | |
| 4 | 20 dakika inkübasyon | |||||
| 5 | EDTA çözümü | 20 | 40 | 7,9 milyon | 2 | 3,95 milyon |
| 6 | MG reaktifi | 10 | 50 | 2.5 mM Malakit yeşili, 64.4 mM Amonyum Molibdat, %0.18 Tween-20 | 5 | 0,5 mM Malakit yeşili, 12,9 mM Amonyum Molibdat, %0,036 Tween-20 |
| 7 | 20 dakika inkübasyon | |||||
| 8 | Okuma @ 630 nm | |||||
Tablo 2: Allosterik düzenleyiciler taraması için enzime bağlı testteki son koşulların özeti
Tartışmalar
Burada ayrıntıları verilen enzime bağlı aktivite testi, SAMHD1 ile dNTP hidrolizinin dolaylı ölçümüne izin veren yüksek verimliliğe uygun bir kolorimetrik testtir. Bu yöntem, reaksiyon karışımına fazla dahil edildiğinde, SAMHD1 tarafından üretilen her bir inorganik trifosfatı, basit ve ekonomik malakit yeşil reaktifi kullanılarak miktarı belirlenebilen üç ayrı serbest fosfata dönüştüren E. coli'den inorganik PPaz yeteneğinden yararlanır. Bu testi, bileşik kütüphanelerin taranması için ideal olan 384 mikrokuyu plakası formatında sağlıyoruz ve bu tekniğin SAMHD1 inhibitörlerinin, aktivatörlerinin ve substratlarının tanımlanmasında ve karakterizasyonunda uygulanabilirliğini ve çok yönlülüğünü gösteriyoruz.
Tüm in vitro biyokimyasal tarama testlerinde olduğu gibi, bir dizi kritik adım ve önemli hususlar vardır ve bunların çoğu, ücretsiz olarak sunulan Test Kılavuz Kılavuzu39'da derinlemesine tartışılmaktadır. Saflaştırılmış rekombinant enzimlerin, hem SAMHD1 hem de bağlı enzim inorganik PPaz'ın bütünlüğü son derece önemlidir ve test yapılmadan önce doğrulanmalıdır. Ve buna göre, bu enzimlerin her yeni saflaştırılması, partiden partiye değişkenlikler sonuçlarda tutarsızlıklara neden olabileceğinden, bir miktar parti testine tabi tutulmalıdır. İdeal olarak, kullanılan saflaştırılmış rekombinant SAMHD1'in dNTP trifosfohidrolaz aktivitesini doğrulamak için hem substratın hem de reaksiyon ürününün saptanmasına izin veren HPLC gibi ortogonal bir doğrudan tahlilin kullanılması kullanılmalıdır.
Bu tahlilin sınırlamaları ile ilgili olarak, birinci ilke, SAMHD1'in dNTPaz aktivitesini dolaylı bir şekilde ölçmesi ve bir takım etkileri olan inorganik PPaz aktivitesinden yararlanmasıdır. PPaz'ın tahlilde kullanılan nükleotidlere karşı çok az aktiviteye sahip olduğunu veya hiç aktiviteye sahip olmadığını ve benzer şekilde, tanımlanan inhibitör küçük moleküllerin PPaz'a karşı hiçbir aktiviteye sahip olmadığını doğrulamak önemlidir. Bu nedenle, tarama ile ilgili olarak, PPase'e karşı bir karşı ekran önemli bir husus olabilir. Reaksiyonda PPaz'ın varlığı, bulguları doğrulamak için ortogonal bir tahlil kullanmayı da kritik hale getirir. Doğrudan aktivite tahlilleri ile ilgili olarak, substrat tükenmesini ve ürün oluşumunu doğru bir şekilde tespit eden TLC 9,20,23 ve HPLC 9,21 dahil olmak üzere bugüne kadar bir dizi rapor edilmiştir. Ek olarak, aynı zamanda yüksek verimli olan b4NPP testi21, potansiyel inhibitörleri test etmek için kullanılabilir; Bununla birlikte, substratları veya allosterik aktivatörleri test etmek ideal değildir. Daha önce SAMHD118 ile bildirdiğimiz diferansiyel taramalı florimetri (DSF) gibi biyofiziksel testler de ligandların tanımlanmasında ve karakterize edilmesinde özellikle güçlü olabilir. Testin bir başka sınırlaması, özellikle substratları ve aktivatörleri tanımlamak için buradaki kurulumda gösterildiği gibi, hidrolize edilemeyen dGTP analog dGTPαS'nin bir AS1 ve AS2 aktivatörü olarak kullanılmasıdır. Bu, tahlilde gözlemlenebilir bir aktivite olmadan SAMHD1'in aktivasyonuna izin verirken, dGTPαS, SAMHD1'in rekabetçi bir inhibitörüdür ve bu nedenle yüksek konsantrasyonların kullanılması enzimi etkisiz hale getirecektir. SAMHD1 anlayışımız ilerledikçe, gelecekteki çalışmalar sadece SAMHD1'in her bir bölgesini işgal eden molekülleri kullanabilir ve böylece bu potansiyel sorunu ortadan kaldırabilir.
Burada gösterdiğimiz gibi, bu yöntem çok yönlüdür ve bir dizi biyokimyasal soruyu ele almak için kullanılabilir. Bu testin, biri SAMHD1'in allosterik düzenleyicilerinin ve substratlarının tanımlanması ve diğeri inhibitörlerin karakterizasyonu için olmak üzere iki varyasyonunu tanımladık, ancak daha fazla uyarlama yapılabilir. Potansiyel inhibitörlerle ilgili olarak, mikrokuyu plakası bazlı olan bu tahlil, onu aşağı akış etki mekanizması çalışmaları için çok uygun hale getirir39,40. Benzer şekilde, substratların ve allosterik düzenleyicilerin daha fazla karakterizasyonu için, bu teknik, sitarabin ve klofarabin7'nin aktif metaboliti için yaptığımız gibi, katalizin kinetik parametrelerini belirlemek için kullanılabilir. Bununla birlikte, bir dezavantaj, burada bildirilen enzime bağlı testin bir son nokta testi olmasıdır ve bu nedenle, tarama için çok uygun olmasına rağmen, bazı mekanik çalışmalar için sürekli bir test daha uygun olacaktır. Arnold ve ark. serbest bir fosfat grubuna bağlanabilen kumarin maleimid (MDCC) florofor ile etiketlenmiş periplazmik fosfat bağlayıcı proteinin (PBP) kullanımına dayanan biyosensör MDCC-PBP6'yı kullanan sürekli bir enzime bağlı test bildirdi. MDCC-PBP çok hassastır ve sensörün yanıt süresi milisaniye ila saniye zaman ölçeğinde olmak üzere çok düşük fosfat konsantrasyonlarının ölçülmesini sağlar.
SAMHD1, insan sağlığı ve hastalığında bir dizi önemli işlev görür2 ve bunların çoğu, hücre içi dNTP seviyelerininkorunmasındaki merkezi rolüyle bağlantılı olabilir 1. Bu nedenle, SAMHD1'in dNTPaz aktivitesine yönelik yüksek kaliteli bir kimyasal probun tanımlanması, bu bağlantıların tanımlanmasında güçlü bir araç olacaktır ve burada bildirilen enzim bağlı tahlil, bu tür probları tanımlamak için kolayca kullanılabilir. Ayrıca, birçoğu SAMHD1 tarafından modüle edilen nükleosid bazlı ilaçlar, çeşitli ve önemli bir terapötik41 grubudur; kimyasal problar, bu tedavilerin etkinliğini arttırmak amacıyla klinik ortamda SAMHD1'i hedef alan ilaçlara daha da geliştirilebilir. Bu nükleosid bazlı bileşiklerin SAMHD1 ile etkileşiminin tam kapsamını anlamak da çok önemlidir, bu enzime bağlı test kullanılarak da ele alınabilecek bir soru. Birlikte ele alındığında, burada bildirildiği gibi enzime bağlı SAMHD1 aktivite testi, bu önemli enzimi daha iyi anlamamız için kullanılabilecek düşük maliyetli, çok yönlü, yüksek verimli bir testtir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Thomas Lundbäck'a ve Thomas Helleday'in laboratuvarının üyelerine tavsiye ve destekleri için teşekkür ederiz. Bu çalışmanın bir kısmı Karolinska Institutet / SciLifeLab'daki (http://ki.se/psf) Protein Bilimi Tesisi tarafından kolaylaştırılmıştır ve Ulusal Kanser Enstitüsü (NCI), Kanser Tedavisi ve Teşhisi Bölümü (DCTD) ve Gelişimsel Terapötik Programı (DTP) (http://dtp.cancer.gov) bir bileşik sağladıkları için. Finansman, İsveç Araştırma Konseyi (2018-02114), İsveç Kanser Derneği (19-0056-JIA, 20-0879-PJ), İsveç Çocukluk Çağı Kanser Fonu (PR2019-0014) ve Karolinska Enstitüsü'nden SGR'ye verilen hibelerle sağlandı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2'-deoxyadenosine-5'-triphosphate (dATP) | Jena bioscience | NU-1001 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-deoxycytidine-5'-triphosphate (dCTP) | Jena bioscience | NU-1002 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-Deoxyguanosine-5'-(α-thio)-triphosphate (dGTPαS) | Jena bioscience | NU-424 | Non-hydrolyzable dGTP analogue for SAMHD1 activator/substrate assay |
| 2'-deoxyguanosine-5'-triphosphate (dGTP) | GE Healthcare | 27-1870-04 | SAMHD1 allosteric activator and substrate used in inhibition assay and activator/substrate assay |
| 2'-Deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP) | Jena bioscience | NU-907-1 | Compound tested in SAMHD1 inhibition assay |
| 2'-deoxythymidine-5'-triphosphate (dTTP) | Jena bioscience | NU-1004 | Compound tested in SAMHD1 activator/substrate assay |
| 2'Deoxyguanosine mohohydrate (dGuo) | Sigma-Aldrich | D0901 | Compound tested in SAMHD1 inhibition assay |
| 384 well clear flat-bottom microplate | Thermo Fisher Scientific | 262160 | Assay plate |
| 96 well clear U-bottom polypropylene microplate | Thermo Fisher Scientific | 267245 | Compound dilution plate |
| Ammonium heptamolybdate tetrahydrate | Sigma-Aldrich | A1343 | Reagent required for malachite green working reagent |
| ara-Cytidine-5'-triphosphate (ara-CTP) | Jena bioscience | NU-1170 | Compound tested in SAMHD1 activator/substrate assay |
| Clofarabine-5'-triphosphate (Cl-F-ara-ATP) | Jena bioscience | NU-874 | Compound tested in SAMHD1 activator/substrate assay |
| Dimethyl sulphoxide (DMSO) | VWR | 23486.297 | Solvent |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich | E5134 | EDTA stop solution component |
| Gemcitabine-5'-triphosphate (dF-dCTP) | Jena bioscience | NU-1607 | Compound tested in SAMHD1 activator/substrate assay |
| GraphPad Prism | GraphPad Software | Prism 8 | Data analysis and visualisation |
| Guanosine 5′-triphosphate (GTP) sodium salt hydrate | Sigma-Aldrich | G8877 | Allosteric activator for SAMHD1 activator/substrate assay |
| His-tagged E. coli inorganic pyrophosphatase (PPase) | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant PPase protein, hydrolises inorganic triphosphate and pyrophosphate to orthophosphate so it can form complex with malachite green |
| His-tagged human SAMHD1 | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant SAMHD1 protein, hydrolizes dNTPs into its corresponding nucleoside and inorganic triphosphate |
| Hydroxyurea | Sigma-Aldrich | H8627 | Compound tested in SAMHD1 inhibition assay |
| Lomofungin | National Cancer Institute (NCI)/Division of Cancer Treatment and Diagnosis (DCTD)/Developmental Therapeutics Program (DTP) | NSC106995 | Compound tested in SAMHD1 inhibition assay |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | SAMHD1 reaction buffer component |
| Malachite green Carbinol hydrochloride | Sigma-Aldrich | 213020 | Malachite green stock component |
| Microplate Reader | Hidex | Hidex Sense Microplate reader | Data acquisition, absorption read at 630 nm wavelength |
| Sodium Chloride (NaCl) | Sigma-Aldrich | 31434 | SAMHD1 reaction buffer component |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 567530 | SAMHD1 reaction buffer component |
| Sodium phosphate (Na3PO4) | Sigma-Aldrich | 342483 | Required for phosphate standard curve |
| Sulphuric acid 95-97% | Sigma-Aldrich | 84720 | Malachite green stock component |
| Tris-Acetate salt | Sigma-Aldrich | T1258 | SAMHD1 reaction buffer component |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) | Sigma-Aldrich | C4706 | SAMHD1 reaction buffer component |
| Tween-20 | Sigma-Aldrich | P1379 | SAMHD1 reaction buffer and malachite green working reagent component |
Referanslar
- Franzolin, E., et al. The deoxynucleotide triphosphohydrolase SAMHD1 is a major regulator of DNA precursor pools in mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14272-14277 (2013).
- Coggins, S. A., Mahboubi, B., Schinazi, R. F., Kim, B. SAMHD1 functions and human diseases. Viruses. 12 (4), 382(2020).
- Goldstone, D. C., et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase. Nature. 480 (7377), 379-382 (2011).
- Powell, R. D., Holland, P. J., Hollis, T., Perrino, F. W. Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase. The Journal of Biological Chemistry. 286 (51), 43596-43600 (2011).
- Morris, E. R., Taylor, I. A. The missing link: Allostery and catalysis in the anti-viral protein SAMHD1. Biochemical Society Transactions. 47 (4), 1013-1027 (2019).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2015).
- Herold, N., et al. Targeting SAMHD1 with the Vpx protein to improve cytarabine therapy for hematological malignancies. Nature Medicine. 23 (2), 256-263 (2017).
- Schneider, C., et al. SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia. Nature Medicine. 23 (2), 250-255 (2017).
- Hollenbaugh, J. A., et al. Substrates and inhibitors of SAMHD1. PloS One. 12 (1), 0169052(2017).
- Knecht, K. M., et al. The structural basis for cancer drug interactions with the catalytic and allosteric sites of SAMHD1. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10022-10031 (2018).
- Oellerich, T., et al. Selective inactivation of hypomethylating agents by SAMHD1 provides a rationale for therapeutic stratification in AML. Nature Communications. 10 (1), 3475(2019).
- Herold, N., et al. SAMHD1 protects cancer cells from various nucleoside-based antimetabolites. Cell Cycle. 16 (11), 1029-1038 (2017).
- Rothenburger, T., et al. SAMHD1 is a key regulator of the lineage-specific response of acute lymphoblastic leukaemias to nelarabine. Communications Biology. 3 (1), 324(2020).
- Ordonez, P., et al. SAMHD1 enhances nucleoside- analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824(2017).
- Castellví, M., et al. Pharmacological modulation of SAMHD1 activity by CDK4/6 inhibitors improves anticancer therapy. Cancers. 12 (3), 713-719 (2020).
- Rassidakis, G. Z., et al. Low-level expression of SAMHD1 in acute myeloid leukemia (AML) blasts correlates with improved outcome upon consolidation chemotherapy with high-dose cytarabine-based regimens. Blood Cancer Journal. 8 (11), 98(2018).
- Rudd, S. G., Schaller, T., Herold, N. SAMHD1 is a barrier to antimetabolite-based cancer therapies. Molecular & Cellular Oncology. 4 (2), 1287554(2017).
- Rudd, S. G., et al. Ribonucleotide reductase inhibitors suppress SAMHD1 ara-CTPase activity enhancing cytarabine efficacy. EMBO Molecular Medicine. 41, 10419(2020).
- Seamon, K. J., et al. Small molecule inhibition of SAMHD1 dNTPase by tetramer destabilization. Journal of the American Chemical Society. 136 (28), 9822-9825 (2014).
- Seamon, K. J., Stivers, J. T. A high-throughput enzyme-coupled assay for SAMHD1 dNTPase. Journal of Biomolecular Screening. 20 (6), 801-809 (2015).
- Mauney, C. H., Perrino, F. W., Hollis, T. Identification of inhibitors of the dNTP triphosphohydrolase SAMHD1 using a novel and direct high-throughput assay. Biochemistry. 57 (47), 6624-6636 (2018).
- Morris, E. R., et al. Crystal structures of SAMHD1 inhibitor complexes reveal the mechanism of water-mediated dNTP hydrolysis. Nature Communications. 11 (1), 3165(2020).
- Hansen, E. C., Seamon, K. J., Cravens, S. L., Stivers, J. T. GTP activator and dNTP substrates of HIV-1 restriction factor SAMHD1 generate a long-lived activated state. Proceedings of the National Academy of Sciences of the United States of America. 111 (18), 1843-1851 (2014).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Hyun, M., Bohr, V. A., Ahn, B. Biochemical characterization of the WRN-1 RecQ helicase of Caenorhabditis elegans. Biochemistry. 47 (28), 7583-7593 (2008).
- Lin, H. -H., Huang, C. -Y. Characterization of flavonol inhibition of DnaB helicase: real-time monitoring, structural modeling, and proposed mechanism. Journal of Biomedicine & Biotechnology. 2012 (4), 735368(2012).
- Yang, M., Wang, G. ATPase activity measurement of DNA replicative helicase from Bacillus stearothermophilus by malachite green method. Analytical Biochemistry. 509, 46-49 (2016).
- Allard, B., Cousineau, I., Spring, K., Stagg, J. Measurement of CD73 enzymatic activity using luminescence-based and colorimetric assays. Methods in Enzymology. 629, 269-289 (2019).
- Lee, M., et al. Structure-activity relationship of sulfonyl piperazine LpxH inhibitors analyzed by an LpxE-coupled malachite green assay. ACS Infectious Diseases. 5 (4), 641-651 (2019).
- Carreras-Puigvert, J., et al. A comprehensive structural, biochemical and biological profiling of the human NUDIX hydrolase family. Nature Communications. 8 (1), 1541(2017).
- Valerie, N. C. K., et al. NUDT15 hydrolyzes 6-thio-deoxyGTP to mediate the anticancer efficacy of 6-thioguanine. Cancer Research. 76 (18), 5501-5511 (2016).
- Carter, M., et al. Human NUDT22 Is a UDP-glucose/galactose hydrolase exhibiting a unique structural fold. Structure. 26 (2), 295-303 (2018).
- Gad, H., et al. MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool. Nature. 508 (7495), 215-221 (2014).
- Page, B. D. G., et al. Targeted NUDT5 inhibitors block hormone signaling in breast cancer cells. Nature Communications. 9 (1), 250(2018).
- Zhang, S. M., et al. Development of a chemical probe against NUDT15. Nature Chemical Biology. 16 (10), 1120-1128 (2020).
- Michel, M., et al. In silico druggability assessment of the NUDIX hydrolase protein family as a workflow for target prioritization. Frontiers in Chemistry. 8, 443(2020).
- Zhang, J., Chung, T., Oldenburg, K. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67(1999).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Markossian, S., et al. Assay guidance manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , Bethesda (MD). (2004).
- Holdgate, G. A., Meek, T. D., Grimley, R. L. Mechanistic enzymology in drug discovery: a fresh perspective. Nature Reviews Drug Discovery. 17 (2), 115-132 (2018).
- Tsesmetzis, N., Paulin, C. B. J., Rudd, S. G., Herold, N. Nucleobase and nucleoside analogues: resistance and re-sensitisation at the level of pharmacokinetics, pharmacodynamics and metabolism. Cancers. 10 (7), 240(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır