Method Article
Um ensaio de atividade enzimática acoplada de alto rendimento para sondar a interação de pequenas moléculas com a dNTPase SAMHD1
Neste Artigo
Resumo
SAMHD1 é um desoxinucleosídeo trifosfato trifosfohidrolase com papéis críticos na saúde humana e na doença. Aqui apresentamos um versátil ensaio de atividade SAMHD1 acoplado à enzima, implantado em um formato de microplaca de 384 poços, que permite a avaliação de pequenas moléculas e análogos de nucleotídeos como substratos, ativadores e inibidores de SAMHD1.
Resumo
O motivo alfa estéril e a proteína 1 contendo domínio HD (SAMHD1) é um regulador fundamental dos pools intracelulares de desoxinucleosídeo trifosfato (dNTP), pois essa enzima pode hidrolisar dNTPs em seus nucleosídeos correspondentes e trifosfatos inorgânicos. Devido ao seu papel crítico no metabolismo de nucleotídeos, sua associação a diversas patologias e seu papel na resistência à terapia, intensas pesquisas estão sendo realizadas atualmente para um melhor entendimento tanto da regulação quanto da função celular dessa enzima. Por essa razão, o desenvolvimento de métodos simples e baratos de alto rendimento para sondar a interação de pequenas moléculas com SAMHD1, como reguladores, substratos ou inibidores alostéricos, é vital. Para este propósito, o ensaio verde de malaquita acoplado à enzima é um ensaio colorimétrico simples e robusto que pode ser implantado em um formato de placa de 384 micropoços, permitindo a medição indireta da atividade SAMHD1. Como SAMHD1 libera o grupo trifosfato de substratos nucleotídicos, podemos acoplar uma atividade pirofosfatase a esta reação, produzindo fosfato inorgânico, que pode ser quantificado pelo reagente verde de malaquita através da formação de um complexo verde de malaquita fosfomolibdato. Aqui, mostramos a aplicação desta metodologia para caracterizar inibidores conhecidos de SAMHD1 e decifrar os mecanismos envolvidos na catálise de SAMHD1 de substratos não-canônicos e regulação por ativadores alostéricos, exemplificados por drogas anticâncer baseadas em nucleosídeos. Assim, o ensaio verde de malaquita acoplado à enzima é uma ferramenta poderosa para o estudo da SAMHD1 e, além disso, também pode ser utilizado no estudo de várias enzimas que liberam espécies de fosfato.
Introdução
O motivo alfa estéril e a proteína contendo domínio histidina-aspartato 1 (SAMHD1) é um regulador central da homeostase de nucleotídeos em células de mamíferos1 com muitos papéis na saúde e doença humana2. Essa enzima é capaz de hidrolisar desoxinucleosídeos trifosfatos (dNTPs) em suas moléculas cognatas de desoxinucleosídeo e trifosfato inorgânico 3,4, sendo essa atividade regulada alostericamente pela abundância de (d)NTP (revisada na referência5). Cada monômero SAMHD1 contém dois sítios alostéricos (AS1 e AS2) e um sítio catalítico, e a formação da enzima ativa requer a montagem ordenada de um homotetrâmero após a ligação (d)NTP. A dimerização dos monômeros SAMHD1 é desencadeada primeiramente através da ligação de um trifosfato de guanina (GTP ou dGTP) ao AS1, e a tetramerização subsequente é alcançada quando uma molécula adicional de dNTP se liga ao AS2, permitindo o acesso do substrato ao sítio catalítico e subsequente hidrólise.
Os substratos do SAMHD1 incluem os quatro dNTPs canônicos 3,4 juntamente com alguns nucleotídeos modificados por base e açúcar, incluindo os metabólitos trifosfato de várias drogas baseadas em nucleosídeos usadas no tratamento de infecções virais e câncer, vários dos quais também podem servir como ativadores alostéricos 6,7,8,9,10,11. Em consequência, o SAMHD1 modula a eficácia de muitos desses compostos em modelos de doença 7,8,9,10,11,12,13,14,15 e, além disso, no caso do análogo da desoxicitidina citarabina (ara-C), que permaneceu como terapia padrão para leucemia mieloide aguda (LMA) por décadas, realmente dita eficácia do tratamento dessa doença 7,8,16. O SAMHD1 é, portanto, um potencial biomarcador e alvo terapêutico para melhorar a eficácia de terapias baseadas em nucleosídeos17 e, consequentemente, nós e outros temos procurado identificar estratégias para inativar SAMHD1 em células. Nós propusemos o uso da proteína viral X (Vpx) como um inibidor biológico para atingir SAMHD1 para degradação dentrode células cancerosas7, no entanto, essa abordagem tem uma série de limitações (discutidas na referência12), e também relatamos recentemente uma abordagem indireta para suprimir a atividade da SAMHD1 via inibição da ribonucleotídeo redutase, que demonstramos em vários modelos deLMA18. Vários estudos têm buscado identificar pequenas moléculas capazes de inibir diretamente a SAMHD1 e, até o momento, várias dessas moléculas têm sido relatadas, porém, documentando apenas a inibição in vitro6,9,19,20,21,22. Em consequência, a falta de pequenas moléculas que inibem potentemente a atividade de SAMHD1 em células, juntamente com os complexos mecanismos de catálise SAMHD1 de terapêutica baseada em nucleosídeos, ressalta a necessidade de mais investigações. Assim, métodos robustos e idealmente de alto rendimento para sondar a interação de pequenas moléculas com SAMHD1 são ideais para identificar substratos, reguladores alostéricos e inibidores dessa enzima clinicamente relevante.
Várias metodologias estão disponíveis para medir diretamente a atividade da dNTPase de SAMHD1, como cromatografia em camada delgada (CCD)9,20,23 e cromatografia líquida de alta eficiência (CLAE)9,21, mas estas não são prontamente passíveis de configurações de alto rendimento. Uma exceção é o ensaio relatado por Mauney e cols., que explora a capacidade do SAMHD1 de hidrolisar bis (4-nitrofenil) fosfato (b4NPP) para p-nitrofenol e p-nitrofenil fosfato quando Mn2+ é usado como cátion ativador, resultando em uma mudança colorimétrica que pode ser prontamente medida em uma placa demicropoço21. Este ensaio tem sido usado com sucesso para a identificação e caracterização de inibidores de SAMHD1, mas deve-se notar que a hidrólise ocorre na ausência de ativadores de (d)NTP e na presença de um provável cátion ativador não fisiológico, sendo ambas importantes ressalvas a serem consideradas. Isso também torna este ensaio menos aplicável ao estudo e identificação de reguladores alostéricos de SAMHD1.
Neste contexto, uma abordagem enzimática combinada com o reagente verde de malaquita, como detalhado neste relatório, pode ser um método versátil para medir indiretamente a atividade da dNTPase da SAMHD1 e, além disso, interrogar o impacto de várias pequenas moléculas sobre ela. O ensaio verde de malaquita é uma técnica colorimétrica robusta e confiável para a detecção de fosfato inorgânico (Pi) livre, baseada na formação de um complexo de ácido molibdofosfórico que leva a uma mudança colorimétrica medida a 620 nm24. Como a hidrólise do SAMHD1 libera o grupo trifosfato dos substratos nucleotídicos, é necessário acoplar essa reação com uma atividade de (piro)fosfatase, que gerará fosfato inorgânico livre, antes da adição do reagente verde de malaquita. O ensaio verde de malaquita é sensível e custo-efetivo e tem sido amplamente utilizado para a identificação e caracterização de inibidores e substratos para enzimas que liberam grupos fosfato inorgânico em suas reações ou na presença de uma enzima de acoplamento. Tem sido amplamente aplicada na caracterização das atividades ATPase de helicases 25,26,27, ou no estudo da atividade enzimática CD73, que medeia a degradação do AMP em adenosina e fosfato inorgânico 28. Além disso, quando acoplada, tem sido empregada na descoberta de drogas antibióticas visando a UDP-2,3-diacilglicosamina pirofosfatase LpxH, uma enzima essencial na maioria dos patógenos Gram-negativos29. Com relação à pesquisa do câncer, a abordagem enzimática acoplada tem sido extensivamente empregada contra as hidrolases NUDIX, uma família de enzimas metabolizadoras de nucleotídeos, tanto na caracterização de substratos 30,31,32 quanto na identificação e desenvolvimento de fármacos e sondas químicas 33,34,35,36.
Com relação à dNTPase SAMHD1, essa abordagem tem sido utilizada em vários relatos. Usando a exopolifosfatase Ppx1 de Saccharomyces cerevisiae como enzima de acoplamento, este ensaio foi usado para testar vários análogos de nucleotídeos como substratos, ativadores ou inibidores de SAMHD1, e resultou na identificação do metabólito trifosfato da droga antileucêmica clofarabina como ativador e substrato6. Adicionalmente, com pirofosfatase inorgânica de Escherichia coli como enzima de acoplamento, ela tem sido empregada na triagem de uma biblioteca de compostos clinicamente aprovados contra SAMHD1 para identificar inibidores20. Em nossa pesquisa, utilizamos essa abordagem para mostrar que ara-CTP, o metabólito ativo de ara-C, é um substrato SAMHD1, mas não ativador alostérico7 e, posteriormente, usamos este ensaio para mostrar que várias pequenas moléculas que poderiam sensibilizar modelos de LMA a ara-C de maneira dependente de SAMHD1, na verdade não inibiram diretamente SAMHD118. Neste relato, detalharemos esse método versátil e demonstraremos sua aplicabilidade, em uma configuração amigável de alto rendimento, para a identificação de inibidores, ativadores e substratos de SAMHD1.
Protocolo
Uma visão geral esquemática dos métodos abaixo é mostrada na Figura 1 e uma lista detalhada de materiais e reagentes está disponível na Tabela de materiais.
1. Preparação de tampões de ensaio.
- Preparação de buffers de estoque.
OBS: Como o ensaio é sensível à detecção de fosfatos, o que pode ser comum, lave os vidros três vezes com água ultrapura ou bidestilada para evitar contaminação. Todos os buffers podem ser armazenados à temperatura ambiente (TR).- Preparar 1 L de solução-mãe de tampão de reação SAMHD1 (25 mM Tris-Acetato pH 8, 40 mM NaCl, 1 mM MgCl2) dissolvendo 4,5 g de Acetato de Tris, 2,3 g de NaCl e 0,2 g de MgCl2, em aproximadamente 800 mL de água antes de ajustar para pH 8 e volume final.
- Preparar 5 ml de solução-mãe de TCEP 0,1 M diluindo 1 ml de TCEP 0,5 M em 4 ml de água.
- Preparar 50 mL de solução-mãe de Tween-20 a 11% diluindo 5 mL de Tween-20 a 100% em 44,5 mL de água.
NOTA: Tween-20 é sensível à luz. - Preparar 50 ml de solução parada de EDTA 0,5 M dissolvendo 9,3 g de EDTA em aproximadamente 40 ml de água antes de ajustar para pH 8 e volume final.
- Preparar a solução-mãe de Malachite Green (MG) (3,2 mM de verde de malaquita em H2SO4) adicionando lentamente 60 mL de ácido sulfúrico concentrado a 300 mL de água em um frasco de vidro marrom. Arrefecer a solução até RT e dissolver 0,44 g de verde malaquita.
CUIDADO: A reação do ácido sulfúrico com a água é exotérmica e, portanto, a garrafa pode esquentar causando um acúmulo de pressão; Certifique-se de que essa pressão seja liberada com frequência.
NOTA: A solução laranja resultante é sensível à luz (portanto, garrafa marrom) e estável por pelo menos 1 ano no RT. O precipitado pode se formar ao longo do tempo, certifique-se de que apenas o sobrenadante seja usado. - Preparar 50 ml de solução-mãe de molibdato de amónio a 7%, dissolvendo 3,75 g de molibdato de amónio em 50 ml de água.
NOTA: O precipitado pode formar-se ao longo do tempo, certifique-se de que apenas o sobrenadante é usado.
- Preparação de buffers de ensaio completos
NOTA: Isso deve ser feito no dia do experimento- Preparar SAMHD1 RB completo (25 mM Tris-Acetato pH 8, 40 mM NaCl, 1 mM MgCl2, 0,3 mM TCEP, 0,005% Tween-20). Utilizar estoques TCEP de 11% Tween-20 e 0,1 M previamente preparados para adicionar esses componentes a uma concentração final de 0,005% para Tween-20 e 0,3 mM para TCEP ao estoque SAMHD1 RB.
- Preparar solução de parada de EDTA (25 mM Tris-Acetato pH 8, 40 mM NaCl, 1 mM MgCl2, 0,3 mM TCEP, 0,005% Tween-20, 7,9 mM EDTA). Para completar o SAMHD1 RB, use a solução-mãe EDTA 0,5 M para adicionar EDTA a uma concentração final de 7,9 mM.
- Preparar a solução de trabalho MG (verde de malaquita 2,5 mM, molibdato de amónio a 1,4%, Tween-20 a 0,18%) misturando 10 partes da solução-mãe MG com 2,5 partes de molibdato de amónio a 7% e 0,2 partes de Tween-20 a 11%.
2. Ensaio de inibição SAMHD1 e determinação do composto CI50
NOTA: As condições finais do ensaio são mostradas na Tabela 1.
- Preparação de compostos em placa de ensaio
NOTA: Compostos de pequeno peso molecular são tipicamente dissolvidos em 100% DMSO e análogos de nucleotídeos em água. A concentração de estoque varia de 10 a 100 mM e é influenciada pela potência e solubilidade dos compostos, juntamente com a tolerância DMSO do ensaio. Verifique se a concentração final de DMSO na reação não excede 1% para garantir que as atividades enzimáticas não sejam afetadas por este solvente. É uma boa prática testar a tolerância do ensaio ao solvente antes do experimento.- Preparar compostos de teste diluídos em série na concentração final de 100x no solvente relevante (por exemplo, 100% DMSO para moléculas pequenas ou água para análogos de nucleotídeos) em uma placa de polipropileno de fundo redondo transparente de 96 poços usando uma pipeta multicanal ou um equipamento automatizado de manuseio de líquidos.
NOTA: Dependendo da estabilidade do composto, as placas de diluição podem ser preparadas com antecedência, seladas e armazenadas a -20 °C. Permitir que as placas se equilibrem para RT antes de continuar o protocolo. - Usando SAMHD1 RB completo, diluir os compostos até a concentração final de 25x (para manter a concentração final de solvente abaixo de 1%) e transferir 5 μL para os poços apropriados de uma placa de ensaio de fundo plano transparente de 384 poços. Repetir o procedimento com amostras de controlo apenas com solventes.
- Preparar compostos de teste diluídos em série na concentração final de 100x no solvente relevante (por exemplo, 100% DMSO para moléculas pequenas ou água para análogos de nucleotídeos) em uma placa de polipropileno de fundo redondo transparente de 96 poços usando uma pipeta multicanal ou um equipamento automatizado de manuseio de líquidos.
- Preparação de componentes de reação
NOTA: Isso deve ser feito no dia do ensaio. Alíquotas humanas recombinantes de SAMHD1 e E. coli pirofosfatase (PPase) são armazenadas a longo prazo a -80 °C diluídas a 9,1 mg/mL e 23,0 mg/mL, respectivamente, em tampão de armazenamento (20 mM HEPES pH 7,5, 300 mM NaCl, 10% glicerol, 2 mM TCEP). Depois de descongeladas, as alíquotas são armazenadas a curto prazo a -20 °C.- Preparar a mistura mestre da enzima (SAMHD1/PPase) diluindo a proteína SAMHD1 humana recombinante e a PPase recombinante em SAMHD1 RB completo até 4x a concentração final desejada, portanto, 1,4 μM SAMHD1 e 50 U/mL PPase.
- Prepare o ativador/substrato dGTP diluindo o estoque de dGTP (tipicamente 10 ou 100 mM em água) em SAMHD1 RB completo para 2x concentração final, portanto, 50 μM dGTP.
- Realizar o ensaio
NOTA: Todos os componentes do ensaio devem ser equilibrados para RT. As adições de líquidos podem ser realizadas com uma pipeta multicanal ou um dispensador de líquido reagente a granel.- Para uma placa de ensaio de 384 poços contendo diluições de compostos e controles somente com solvente, dispense 5 μL da mistura mestre SAMHD1/PPase. Para nenhum poço de controle enzimático, dispensar 5 μL de SAMHD1 RB completo. Pré-incubar enzimas e compostos por 10 min em TR.
- Para todos os poços, dispensar 10 μL de solução de 2x dGTP para iniciar a reação.
- Incubar a reação por 20 min em TR.
- Pare a reação distribuindo 20 μL de solução parada de EDTA em todos os poços.
NOTA: O experimento pode ser pausado aqui, se desejado. - Adicionar 10 μL de MG de solução de trabalho a todos os poços.
CUIDADO: A solução de trabalho MG contém ácido sulfúrico. - Garanta a mistura do conteúdo do poço usando um agitador de placa de micropoço orbital e centrifugação a 1.000 x g por 1 min.
- Incubar a placa por 20 min no TR.
- Leia a absorção no comprimento de onda de 630 nm em um leitor de placas de micropoço.
- Visualização e análise dos dados
- Calcular a média e o desvio padrão dos poços de controle positivo e negativo (positivo, reação completa com solvente; negativo, dGTP isolado com solvente). Calcule o fator Z37 como um indicador da qualidade do ensaio.
- Normalizar cada valor de absorbância para os valores médios dos controles positivo e negativo, definindo o controle positivo como 100% de atividade SAMHD1 e o controle negativo como 0% de atividade SAMHD1.
- Plotar a atividade de SAMHD1 (%) em função da concentração do composto e ajustar uma curva dose-resposta de inclinação variável de quatro parâmetros, permitindo a determinação do composto CI50.
3. SAMHD1 ativador e tela de substrato
NOTA: As condições finais do ensaio são mostradas na Tabela 2. As alíquotas recombinantes SAMHD1 e PPase são armazenadas a longo prazo a -80 °C diluídas a 9,1 mg/mL e 23,0 mg/mL, respectivamente, em tampão de armazenamento (20 mM HEPES pH 7,5, 300 mM NaCl, 10% glicerol, 2 mM TCEP) a -80 °C. Depois de descongeladas, as alíquotas são armazenadas a curto prazo a -20 °C.
- Preparação de análogos de nucleotídeos em placa de ensaio
- Diluir estoques análogos de nucleotídeos (tipicamente 10 ou 100 mM em água) para concentração final de 4x em SAMHD1 RB completo, no nosso caso análogo de nucleotídeos de 800 μM, e transferir 5 μL para os poços apropriados de uma placa de ensaio de 384 poços.
- Preparação de componentes de reação
NOTA: Isso deve ser feito no dia do ensaio- Preparar a mistura principal da enzima (SAMHD1/PPase) diluindo a proteína SAMHD1 humana recombinante e a PPase recombinante de E. coli em SAMHD1 RB completo até 2x a concentração final desejada, portanto, 0,7 μM SAMHD1 e 25 U/mL PPase.
- Preparar a solução isolada de PPase diluindo a PPase recombinante de E. coli em SAMHD1 RB completa até 2x a concentração final desejada, portanto, 25 U/mL de PPase.
- Preparar os ativadores GTP (AS1) e dGTPαS (AS1 e AS2) diluindo estoque (tipicamente 10 ou 100 mM em água) em SAMHD1 RB completo para concentração final de 4x, portanto, 50 μM GTP ou dGTPαS.
- Realizar o ensaio
NOTA: Todos os componentes do ensaio devem ser equilibrados para RT. As adições de líquidos podem ser realizadas com uma pipeta multicanal ou um dispensador de líquido reagente a granel.- Para uma placa de ensaio de 384 poços contendo análogos de nucleotídeos, dispense 5 μL do ativador (GTP ou dGTPαS) ou complete SAMHD1 RB para os poços apropriados.
- Iniciar a reação dispensando 10 μL da mistura mestre SAMHD1/PPase, PPase isoladamente ou SAMHD1 RB completo nos poços apropriados.
- Incubar a reação por 20 min em TR.
- Pare a reação distribuindo 20 μL de solução parada de EDTA em todos os poços.
NOTA: O experimento pode ser pausado aqui, se desejado. - Adicionar 10 μL de MG de solução de trabalho a todos os poços.
CUIDADO: A solução de trabalho MG contém ácido sulfúrico. - Garanta a mistura do conteúdo do poço usando um agitador de placa de micropoço orbital e centrifugação a 1.000 x g por 1 min.
- Incubar a placa por 20 min no TR.
- Leia a absorção no comprimento de onda de 630 nm em um leitor de placas de micropoço.
- Visualização e análise dos dados
- Calcular os valores médios de absorbância para os poços de reação somente PPase (controle negativo ou sinal de fundo).
NOTA: Como um controle positivo de um ativador alostérico SAMHD1 e substrato, dGTP pode ser incluído na placa. Nesse caso, você pode usar essa condição para calcular o fator Z como um indicador da qualidade do ensaio. - Subtrair o valor de fundo dos poços correspondentes nas reações SAMHD1/PPase.
- Plotar valores de absorbância corrigidos para cada análogo de nucleotídeos com condições de tampão, GTP e dGTPαS.
- Calcular os valores médios de absorbância para os poços de reação somente PPase (controle negativo ou sinal de fundo).
Resultados
O protocolo descrito na Figura 1 descreve o fluxo de trabalho básico para utilizar o ensaio verde de malaquita acoplado à enzima para sondar a interação de pequenas moléculas com a dNTPase SAMHD1 e pode ser adaptado de várias maneiras para interrogar diferentes questões bioquímicas. Nos resultados representativos discutidos nos parágrafos abaixo, ilustramos exemplos de uso deste ensaio para determinar as propriedades inibitórias de pequenas moléculas em relação ao SAMHD1 e para testar se diferentes análogos de nucleotídeos são substratos e/ou ativadores dessa enzima.
Os resultados apresentados na Figura 2 ilustram vários princípios centrais deste ensaio. O reagente verde de malaquita permite a detecção colorimétrica de fosfato inorgânico através da formação de um complexo verde de malaquita fosfomolibdato e, consequentemente, esta abordagem pode ser aplicada ao estudo de reações enzimáticas cujo produto é o fosfato. Para demonstrar a sensibilidade deste método em detectar fosfato inorgânico livre, a Figura 2A mostra os valores de absorbância obtidos com concentrações crescentes de Na3PO4 após 20 min de incubação com o reagente verde de malaquita. Enquanto o sinal atinge a saturação em 0,25 mM Na3PO4, a faixa linear de detecção de fosfato é visível de 0,004 a 0,03 mM (Figura 2A, painel direito), em concordância com outros estudos que relataram uma faixa linear de fosfato de até 10-20 μM usando o ensaio verde de malaquita38.
SAMHD1 é uma dNTPase que libera trifosfato inorgânico ao hidrolisar uma molécula de dNTP e, portanto, para gerar fosfato inorgânico livre para detecção por verde de malaquita, uma enzima de acoplamento é necessária. A pirofosfatase inorgânica (PPase) de E. coli tem se mostrado útil para esse fim, tanto em relação à SAMHD1 7,20, como também a outras enzimas metabolizadoras de nucleotídeos 30,33,35. Além disso, SAMHD1 é uma dNTPase ativa quando como homotetrâmero, e isso requer ativação alostérica por (d)NTPs, especificamente um trifosfato de guanina (GTP ou dGTP) em AS1 e qualquer dNTP em AS2. Posteriormente, o sítio catalítico torna-se acessível para ligação ao substrato e ocorre a reação enzimática. Como o dGTP atende aos requisitos para ligação a AS1 e AS2, e é um substrato, o uso desse nucleotídeo no ensaio de inibição simplifica muito o fluxo de trabalho. A Figura 2B ilustra a necessidade dos diferentes componentes do ensaio para alcançar uma atividade SAMHD1 mensurável indicada por um aumento na absorbância a 630 nm. Nem SAMHD1 nem PPase isoladamente são capazes de gerar fosfato inorgânico na presença de dGTP, consistente com as atividades documentadas dessas enzimas. Entretanto, na condição em que todos os componentes do ensaio estão presentes (SAMHD1, PPase e ativador/substrato dGTP) observamos um aumento no sinal. O fator Z37 do exemplo mostrado aqui (sem enzimas + dGTP como controle negativo e SAMHD1/PPase + dGTP como controle positivo) foi de 0,74, indicando um ensaio robusto.
Uma das aplicações potenciais do ensaio de atividade SAMHD1 acoplado à enzima é a identificação de inibidores através da triagem de alto rendimento (HTS). Assim, neste trabalho, validamos a detecção da inibição de SAMHD1 neste ensaio utilizando um conjunto diversificado de compostos já descritos na literatura. avaliaram a inibição dose-dependente de nucleosídeos canônicos em direção a SAMHD1 usando um ensaio semelhante como mostrado aqui, e descobriram que a desoxiguanosina (dGuo) foi o único nucleosídeo canônico capaz de inibir significativamente SAMHD1, com um valor de IC50 de 488 μM20. Um HTS de fármacos aprovados pela FDA realizado com o ensaio direto de b4NPP revelou vários acertos que inibiram a atividade de SAMHD1 em concentrações micromolares, dos quais a lomofungina foi a molécula que mais potente inibiu a atividade da SAMHD1 dNTPase in vitro, exibindo um IC50 de 20,1 μM quando determinado na presença de dGTP como substrato21. Adicionalmente, os quatro análogos α,β-imido-dNTP também foram identificados como inibidores competitivos de SAMHD1 usando o sensor MDCC-PBP e SAMHD1 acoplado à atividade de Ppx, o que mostrou que as constantes inibitórias dos análogos dNMPNPP estavam na faixa de baixo micromolar/alto nanomolar 6,22. Assim, para demonstrar que o ensaio de atividade SAMHD1 acoplado à enzima pode ser usado para identificar inibidores de SAMHD1, dGuo, lomofungina e 2'-desoxitimidina-5'-[(α,β)-imido]trifosfato (dTMPNPP), foram usados para validar a técnica. A Figura 3A ilustra as curvas dose-resposta obtidas para esses compostos, mostrando que concentrações crescentes inibem efetivamente a atividade da SAMHD1. Os valores médios de CI50 obtidos para essas moléculas a partir de três experimentos independentes (desvio padrão ±) foram os seguintes: dGuo = 361,9 ± 72,8 μM, lomofungina 6,78 ± 3,9 μM e dTMPNPP = 2,10 ± 0,9 μM. Como exemplo de resultado negativo, o impacto da hidroxiureia (HU) na atividade de SAMHD1 também foi determinado. A HU é um inibidor da ribonucleotídeo redutase e, embora limite a atividade da SAMHD1 ara-CTPase em vários modelos de LMA, os efeitos da UH sobre a SAMHD1 mostraram-se indiretos e dependem da perturbação da regulação alostérica da SAMHD118. A curva dose-resposta da UH é mostrada na Figura 3B, e não foram observadas alterações na atividade da SAMHD1 com o aumento das doses de UH, demonstrando que a UH não inibe a atividade da SAMHD1 in vitro.
Outro uso do ensaio de atividade SAMHD1 acoplado à enzima é interrogar se os nucleotídeos e seus análogos são substratos e/ou ativadores alostéricos dessa enzima, o que é ilustrado na Figura 4. Neste experimento, nucleotídeos canônicos, bem como os metabólitos ativos de vários análogos de nucleosídeos anticâncer, como citarabina (ara-CTP), clofarabina (Cl-F-ara-ATP) e gemcitabina (dF-dCTP), foram testados como substratos e ativadores de SAMHD1. Devido à complexa regulação alostérica do SAMHD1, a reação é realizada na presença de GTP como ativador de AS1 ou do análogo não hidrolisável dGTP 2'-desoxiguanosina-5'-(α-tio)-trifosfato (dGTPαS), que pode ocupar AS1 e AS2. A atividade de SAMHD1 na presença do análogo de nucleotídeo testado e GTP indica que o nucleotídeo é capaz de se ligar ao sítio alostérico secundário e ao sítio catalítico (isto é, ativador e substrato AS2), enquanto a atividade de SAMHD1 com o análogo do nucleotídeo e dGTPαS indica que o nucleotídeo só pode ocupar o sítio catalítico (ou seja, apenas um substrato). Se o nucleotídeo for capaz de se ligar aos sítios alostéricos AS1 e AS2 e ao sítio catalítico, SAMHD1 será ativo na presença do nucleotídeo sozinho, como mostrado no caso do dGTP. Os resultados mostram que todos os dNTPs canônicos são capazes de se ligar ao sítio AS2 e ao sítio catalítico. No caso dos análogos de nucleotídeos, o trifosfato de clofarabina é um ativador de AS2 e um substrato, enquanto o trifosfato de citarabina é capaz de ocupar apenas o sítio catalítico. Por outro lado, nenhuma atividade foi observada com o trifosfato de gemcitabina, sugerindo que nas condições testadas o trifosfato de gemcitabina não é capaz de atuar como efetor alostérico nem substrato. Embora esse resultado seja consistente com previsões anteriores9, estudos posteriores de cristalização e cinética10 revelaram que o trifosfato de gemcitabina é capaz de se ligar à bolsa catalítica SAMHD1, e que é de fato um substrato da enzima. No entanto, neste último estudo10, os autores mostram que a taxa de hidrólise é consideravelmente menor em comparação com outros substratos relatados, como o trifosfato de citarabina, explicando por que não pudemos observar isso com essa configuração de triagem.
Em conjunto, esses resultados representativos validam o uso do ensaio de atividade SAMHD1 acoplado à enzima como uma técnica robusta para a identificação e caracterização de inibidores de SAMHD1, reguladores alostéricos e substratos. No entanto, como todas as abordagens experimentais, esse método tem suas ressalvas e, portanto, ensaios ortogonais (por exemplo, usando uma tecnologia de ensaio diferente) devem ser usados para validar ainda mais os achados.
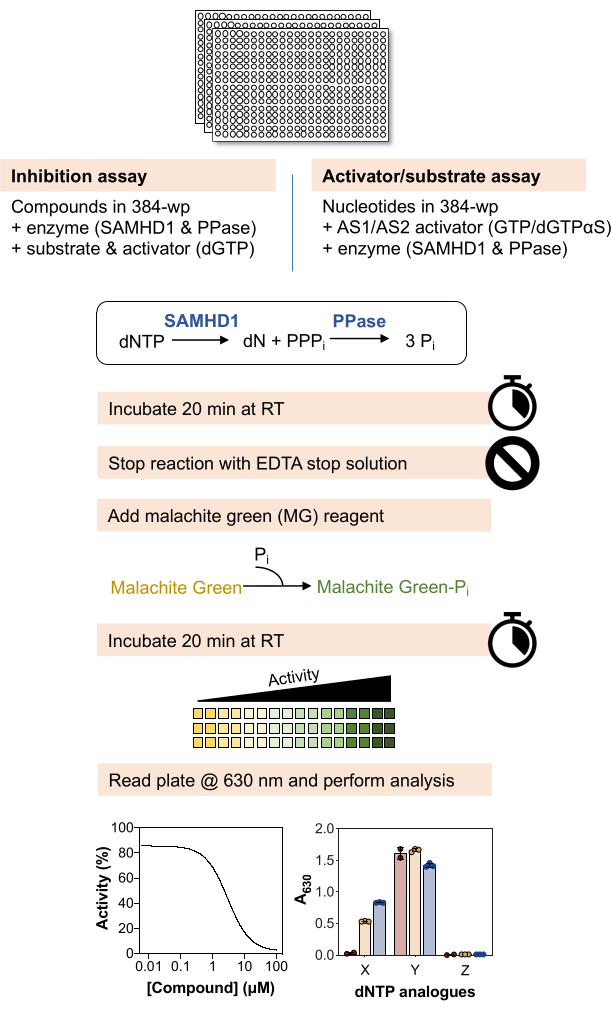
Figura 1: Visão geral esquemática do protocolo descrito neste artigo. Clique aqui para ver uma versão maior desta figura.
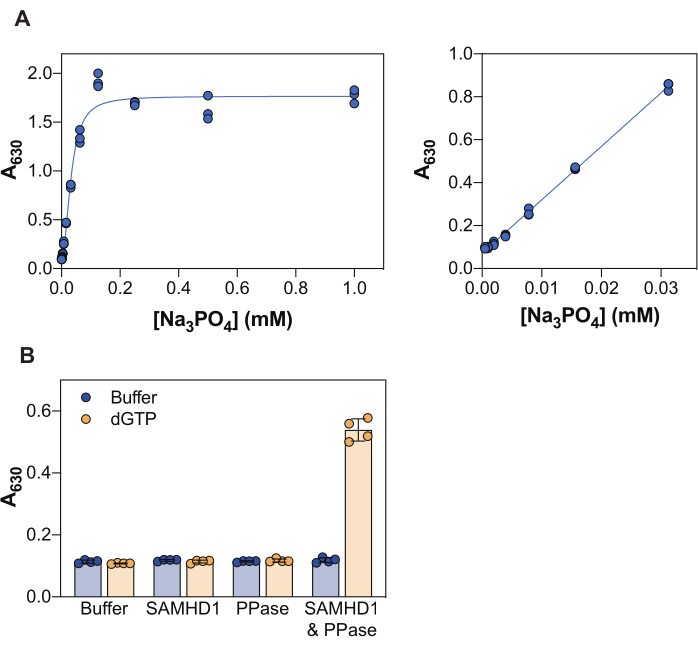
Figura 2: Ensaio de atividade SAMHD1 acoplado à enzima. (A) Curva padrão Na3PO4 no ensaio verde de malaquita. Na3PO4 diluição seriada (2 vezes) foi preparada de 1 mM a 0,004 mM em triplicata e incubada com reagente verde de malaquita por 20 min. Os valores de absorbância bruta ao longo de toda a gama de concentrações testadas são mostrados no painel esquerdo e o intervalo linear no painel direito. Representante de dois experimentos independentes mostrados. (B) Validação do ensaio de atividade enzimática. SAMHD1 (0,35 μM) e/ou PPase (12,5 U/mL) na presença ou ausência de dGTP (25 μM) foram incubadas por 20 min no ensaio de atividade acoplada à enzima. Quadrigêmeos de um representante de dois experimentos independentes mostrados com valores brutos de absorbância plotados, barras e barras de erro indicam média e DP. Por favor, clique aqui para ver uma versão maior desta figura.
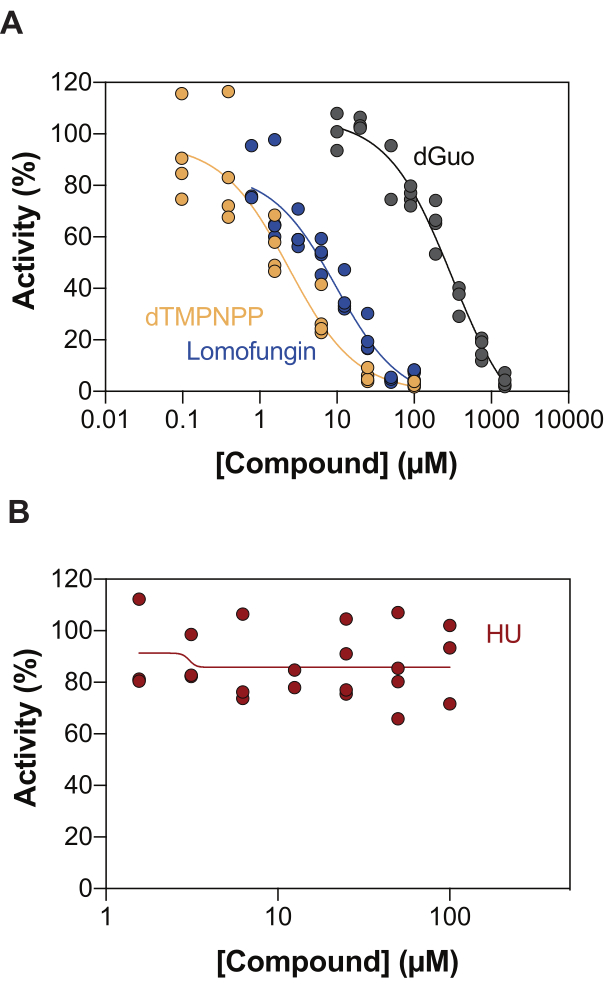
Figura 3: Avaliação dos compostos para inibição de SAMHD1 no ensaio de atividade enzimática acoplada. Resposta à dose de lomofungina (0,78-100 μM), 2'-desoxitimidina-5'-[(α,β)-imido]trifosfato (dTMPNPP, 0,01-100 μM) e desoxiguanosina (dGuo, 10-1.500 μM) (A) ou hidroxiureia (HU) (0,78-100 μM) (B) no ensaio de atividade SAMHD1 acoplado à enzima com dGTP (25 μM) como ativador/substrato. Porcentagem de atividade em relação aos controles de reação de réplicas individuais plotadas (DMSO + SAMHD1/PPase + dGTP = 100% de atividade, DMSO + dGTP = 0% de atividade) com um representante de três experimentos mostrados. Clique aqui para ver uma versão maior desta figura.
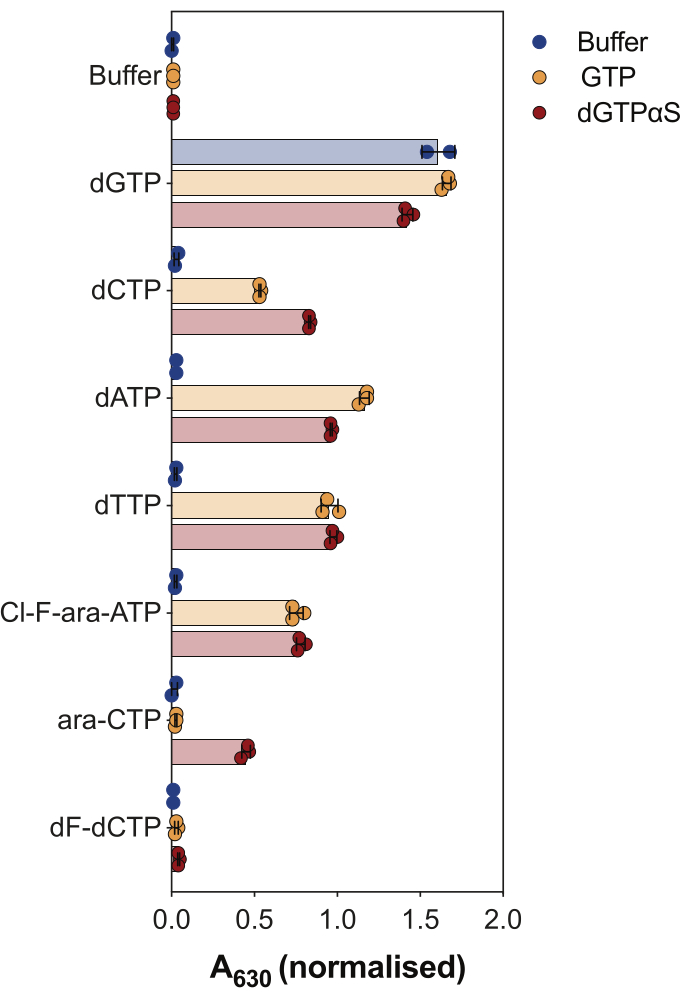
Figura 4: Avaliação de análogos de nucleotídeos como ativadores alostéricos SAMHD1 e substratos no ensaio de atividade enzimática acoplada. Nucleotídeos canônicos e metabólitos trifosfatos selecionados das drogas anticâncer citarabina (ara-CTP), clofarabina (Cl-F-ara-ATP) e gemcitabina (dF-dCTP) foram testados a 200 μM no ensaio de atividade SAMHD1 acoplado à enzima na presença ou ausência de GTP ou dGTP analógico não hidrolisável dGTPαS (12,5 μM). Valores de absorbância normalizados a partir de réplicas experimentais individuais plotadas, média e DP são indicados. Representativo de dois experimentos independentes apresentados, adaptados de nosso estudo anterior7. Clique aqui para ver uma versão maior desta figura.
| Passo | Reagente | Volume dispensado (μL) | Volume final da reação (μL) | Concentração dispensada | Diluição da dobra em reação | Concentração final em reação |
| 1 | Inibidor | 5 | 20 | 0,4 mM | 4 | 0,1 mM |
| 2 | SAMHD1+PPase mistura | 5 | 1,4 μM SAMHD1, 50 U/mL PPase | 4 | 0,35 μM SAMHD1, 12,5 U/mL Ppase | |
| 3 | dGTP | 10 | 50 μM | 2 | 25 μM | |
| 4 | Incubação por 20 minutos | |||||
| 5 | Solução EDTA | 20 | 40 | 7,9 mM | 2 | 3,95 mM |
| 6 | Reagente MG | 10 | 50 | 2,5 mM verde de malaquita, 64,4 mM Molibdato de amônio, 0,18% Tween-20 | 5 | 0,5 mM verde de malaquita, 12,9 mM Molibdato de amônio, 0,036% Tween-20 |
| 7 | Incubação por 20 minutos | |||||
| 8 | Leitura @ 630 nm | |||||
Tabela 1: Resumo das condições finais no ensaio acoplado à enzima para triagem de inibidores.
| Passo | Reagente | Volume dispensado (μL) | Volume final da reação (μL) | Concentração dispensada | Diluição da dobra em reação | Concentração final em reação |
| 1 | Regulador alostérico | 5 | 20 | 800 μM | 4 | 200 μM |
| 2 | GTP ou dGTPαS | 5 | 50 μM | 4 | 12,5 μM | |
| 3 | SAMHD1 e/ou PPase | 10 | 0,7 μM SAMHD1, 25 U/mL PPase | 2 | 0,35 μM SAMHD1, 12,5 U/mL PPase | |
| 4 | Incubação por 20 minutos | |||||
| 5 | Solução EDTA | 20 | 40 | 7,9 mM | 2 | 3,95 mM |
| 6 | Reagente MG | 10 | 50 | 2,5 mM verde de malaquita, 64,4 mM Molibdato de amônio, 0,18% Tween-20 | 5 | 0,5 mM verde de malaquita, 12,9 mM Molibdato de amônio, 0,036% Tween-20 |
| 7 | Incubação por 20 minutos | |||||
| 8 | Leitura @ 630 nm | |||||
Tabela 2: Resumo das condições finais no ensaio acoplado à enzima para triagem de reguladores alostéricos
Discussão
O ensaio de atividade enzimática acoplada detalhado aqui é um ensaio colorimétrico de alto rendimento, permitindo a medição indireta da hidrólise de dNTP por SAMHD1. Este método explora a capacidade da PPase inorgânica de E. coli, que quando incluída em excesso na mistura de reação, converte cada trifosfato inorgânico gerado por SAMHD1 em três fosfatos livres individuais que podem ser quantificados usando o reagente verde de malaquita simples e econômico. Fornecemos este ensaio em formato de placa de micropoço 384, ideal para triagem de bibliotecas de compostos, e demonstramos a aplicabilidade e versatilidade desta técnica na identificação e caracterização de inibidores, ativadores e substratos de SAMHD1.
Como acontece com todos os ensaios de triagem bioquímica in vitro, há uma série de etapas críticas e considerações importantes, e muitas delas são discutidas em profundidade no Manual de Orientação de Ensaios disponível gratuitamente 39. A integridade das enzimas recombinantes purificadas, tanto SAMHD1 quanto da enzima acoplada PPase inorgânica, é extremamente importante e deve ser confirmada antes do estabelecimento do ensaio. E, consequentemente, cada nova purificação dessas enzimas deve ser submetida a algum nível de teste em lote, pois as variabilidades lote a lote podem introduzir inconsistências nos resultados. Idealmente, o uso de um ensaio ortogonal direto, como HPLC, que permite a detecção tanto do substrato quanto do produto da reação, deve ser usado para verificar a atividade da trifosfohidrolase dNTP do SAMHD1 recombinante purificado que está sendo usado.
Quanto às limitações deste ensaio, o princípio é que ele mede a atividade dNTPase da SAMHD1 de forma indireta, explorando a atividade da PPase inorgânica, que tem uma série de implicações. É importante confirmar que a PPase possui pouca ou nenhuma atividade em relação aos nucleotídeos usados no ensaio e, da mesma forma, que as pequenas moléculas inibitórias identificadas não possuem atividade em relação à PPase. Assim, no que diz respeito à triagem, uma contra-tela contra a PPase pode ser uma consideração importante. A presença de PPase na reação também torna fundamental o uso de um ensaio ortogonal para confirmar os achados. Com relação aos ensaios de atividade direta, vários deles foram relatados até o momento, incluindo a CCD 9,20,23 e a CLAE9,21, que detectam com precisão a exaustão do substrato e a formação do produto. Além disso, o ensaio b4NPP21, que também é de alto rendimento, poderia ser usado para testar potenciais inibidores; no entanto, não é ideal testar substratos ou ativadores alostéricos. Ensaios biofísicos, como a fluorimetria diferencial de varredura (DSF), que relatamos anteriormente com SAMHD118, também podem ser particularmente poderosos na identificação e caracterização de ligantes. Outra limitação do ensaio, especificamente como mostrado no setup aqui para identificação de substratos e ativadores, é o uso do dGTP analógico não hidrolisável dGTPαS como ativador AS1 e AS2. Enquanto isso permite a ativação de SAMHD1 sem atividade observável no ensaio, dGTPαS é um inibidor competitivo de SAMHD1 e, portanto, o uso de altas concentrações irá inativar a enzima. À medida que nossa compreensão da SAMHD1 progride, estudos futuros poderão utilizar moléculas que ocupem exclusivamente cada sítio da SAMHD1, negando assim esse problema potencial.
Como mostramos aqui, esse método é versátil e pode ser usado para abordar uma série de questões bioquímicas. Descrevemos duas variações deste ensaio, uma para a identificação de reguladores alostéricos e substratos de SAMHD1, e outra para a caracterização de inibidores, mas adaptações adicionais podem ser feitas. Em relação aos potenciais inibidores, este ensaio, por ser baseado em placas de micropoços, o torna adequado para estudos de mecanismo de ação a jusante39,40. Da mesma forma, para posterior caracterização de substratos e reguladores alostéricos, essa técnica pode ser utilizada para determinar parâmetros cinéticos de catálise, como realizamos para o metabólito ativo citarabina e clofarabina7. No entanto, uma desvantagem é que o ensaio acoplado à enzima relatado aqui é um ensaio de desfecho e, portanto, embora bem adequado para triagem, um ensaio contínuo seria mais adequado para alguns estudos mecanísticos. relataram um ensaio enzimático contínuo acoplado que utiliza o biossensor MDCC-PBP6, que se baseia no uso da proteína ligadora de fosfato periplasmático (PBP) marcada com fluoróforo de maleimida cumarínica (MDCC) que pode se ligar a um grupo fosfato livre. O MDC-PBP é muito sensível e permite a quantificação de concentrações muito baixas de fosfato, com o tempo de resposta do sensor na escala de tempo de milissegundos a segundos.
O SAMHD1 desempenha uma série de funções importantes na saúde e na doença humanas2 , muitas das quais podem estar ligadas ao seu papel central na manutenção dos níveis de dNTP intracelular1. Assim, a identificação de uma sonda química de alta qualidade em direção à atividade dNTPase de SAMHD1 seria uma ferramenta poderosa na definição dessas ligações, e o ensaio acoplado a enzimas relatado aqui poderia ser prontamente empregado para identificar tais sondas. Além disso, como drogas nucleosídeos, muitas das quais são moduladas pelo SAMHD1, constituem um grupo diversificado e importante deterapêuticas 41; sondas químicas poderiam ser desenvolvidas em drogas para atingir SAMHD1 no cenário clínico, com o objetivo de aumentar a eficácia dessas terapias. Também é fundamental entender toda a extensão da interação desses compostos baseados em nucleosídeos com SAMHD1, uma questão que pode ser abordada utilizando este ensaio acoplado a enzimas também. Em conjunto, o ensaio de atividade SAMHD1 acoplado à enzima, conforme relatado aqui, é um ensaio de baixo custo, versátil e de alto rendimento que pode ser usado para aprofundar nossa compreensão dessa importante enzima.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Thomas Lundbäck e aos membros do laboratório de Thomas Helleday pelo aconselhamento e apoio. Parte deste trabalho foi facilitada pelo Protein Science Facility no Karolinska Institutet/SciLifeLab (http://ki.se/psf), e agradecemos ao National Cancer Institute (NCI), Division of Cancer Treatment and Diagnosis (DCTD) e Developmental Therapeutics Program (DTP) (http://dtp.cancer.gov) pelo fornecimento de um composto. O financiamento foi fornecido por subsídios concedidos à S.G.R. do Conselho de Pesquisa Sueco (2018-02114), da Sociedade Sueca de Câncer (19-0056-JIA, 20-0879-PJ), do Fundo Sueco para o Câncer Infantil (PR2019-0014) e do Karolinska Institutet.
Materiais
| Name | Company | Catalog Number | Comments |
| 2'-deoxyadenosine-5'-triphosphate (dATP) | Jena bioscience | NU-1001 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-deoxycytidine-5'-triphosphate (dCTP) | Jena bioscience | NU-1002 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-Deoxyguanosine-5'-(α-thio)-triphosphate (dGTPαS) | Jena bioscience | NU-424 | Non-hydrolyzable dGTP analogue for SAMHD1 activator/substrate assay |
| 2'-deoxyguanosine-5'-triphosphate (dGTP) | GE Healthcare | 27-1870-04 | SAMHD1 allosteric activator and substrate used in inhibition assay and activator/substrate assay |
| 2'-Deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP) | Jena bioscience | NU-907-1 | Compound tested in SAMHD1 inhibition assay |
| 2'-deoxythymidine-5'-triphosphate (dTTP) | Jena bioscience | NU-1004 | Compound tested in SAMHD1 activator/substrate assay |
| 2'Deoxyguanosine mohohydrate (dGuo) | Sigma-Aldrich | D0901 | Compound tested in SAMHD1 inhibition assay |
| 384 well clear flat-bottom microplate | Thermo Fisher Scientific | 262160 | Assay plate |
| 96 well clear U-bottom polypropylene microplate | Thermo Fisher Scientific | 267245 | Compound dilution plate |
| Ammonium heptamolybdate tetrahydrate | Sigma-Aldrich | A1343 | Reagent required for malachite green working reagent |
| ara-Cytidine-5'-triphosphate (ara-CTP) | Jena bioscience | NU-1170 | Compound tested in SAMHD1 activator/substrate assay |
| Clofarabine-5'-triphosphate (Cl-F-ara-ATP) | Jena bioscience | NU-874 | Compound tested in SAMHD1 activator/substrate assay |
| Dimethyl sulphoxide (DMSO) | VWR | 23486.297 | Solvent |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich | E5134 | EDTA stop solution component |
| Gemcitabine-5'-triphosphate (dF-dCTP) | Jena bioscience | NU-1607 | Compound tested in SAMHD1 activator/substrate assay |
| GraphPad Prism | GraphPad Software | Prism 8 | Data analysis and visualisation |
| Guanosine 5′-triphosphate (GTP) sodium salt hydrate | Sigma-Aldrich | G8877 | Allosteric activator for SAMHD1 activator/substrate assay |
| His-tagged E. coli inorganic pyrophosphatase (PPase) | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant PPase protein, hydrolises inorganic triphosphate and pyrophosphate to orthophosphate so it can form complex with malachite green |
| His-tagged human SAMHD1 | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant SAMHD1 protein, hydrolizes dNTPs into its corresponding nucleoside and inorganic triphosphate |
| Hydroxyurea | Sigma-Aldrich | H8627 | Compound tested in SAMHD1 inhibition assay |
| Lomofungin | National Cancer Institute (NCI)/Division of Cancer Treatment and Diagnosis (DCTD)/Developmental Therapeutics Program (DTP) | NSC106995 | Compound tested in SAMHD1 inhibition assay |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | SAMHD1 reaction buffer component |
| Malachite green Carbinol hydrochloride | Sigma-Aldrich | 213020 | Malachite green stock component |
| Microplate Reader | Hidex | Hidex Sense Microplate reader | Data acquisition, absorption read at 630 nm wavelength |
| Sodium Chloride (NaCl) | Sigma-Aldrich | 31434 | SAMHD1 reaction buffer component |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 567530 | SAMHD1 reaction buffer component |
| Sodium phosphate (Na3PO4) | Sigma-Aldrich | 342483 | Required for phosphate standard curve |
| Sulphuric acid 95-97% | Sigma-Aldrich | 84720 | Malachite green stock component |
| Tris-Acetate salt | Sigma-Aldrich | T1258 | SAMHD1 reaction buffer component |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) | Sigma-Aldrich | C4706 | SAMHD1 reaction buffer component |
| Tween-20 | Sigma-Aldrich | P1379 | SAMHD1 reaction buffer and malachite green working reagent component |
Referências
- Franzolin, E., et al. The deoxynucleotide triphosphohydrolase SAMHD1 is a major regulator of DNA precursor pools in mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14272-14277 (2013).
- Coggins, S. A., Mahboubi, B., Schinazi, R. F., Kim, B. SAMHD1 functions and human diseases. Viruses. 12 (4), 382(2020).
- Goldstone, D. C., et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase. Nature. 480 (7377), 379-382 (2011).
- Powell, R. D., Holland, P. J., Hollis, T., Perrino, F. W. Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase. The Journal of Biological Chemistry. 286 (51), 43596-43600 (2011).
- Morris, E. R., Taylor, I. A. The missing link: Allostery and catalysis in the anti-viral protein SAMHD1. Biochemical Society Transactions. 47 (4), 1013-1027 (2019).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2015).
- Herold, N., et al. Targeting SAMHD1 with the Vpx protein to improve cytarabine therapy for hematological malignancies. Nature Medicine. 23 (2), 256-263 (2017).
- Schneider, C., et al. SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia. Nature Medicine. 23 (2), 250-255 (2017).
- Hollenbaugh, J. A., et al. Substrates and inhibitors of SAMHD1. PloS One. 12 (1), 0169052(2017).
- Knecht, K. M., et al. The structural basis for cancer drug interactions with the catalytic and allosteric sites of SAMHD1. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10022-10031 (2018).
- Oellerich, T., et al. Selective inactivation of hypomethylating agents by SAMHD1 provides a rationale for therapeutic stratification in AML. Nature Communications. 10 (1), 3475(2019).
- Herold, N., et al. SAMHD1 protects cancer cells from various nucleoside-based antimetabolites. Cell Cycle. 16 (11), 1029-1038 (2017).
- Rothenburger, T., et al. SAMHD1 is a key regulator of the lineage-specific response of acute lymphoblastic leukaemias to nelarabine. Communications Biology. 3 (1), 324(2020).
- Ordonez, P., et al. SAMHD1 enhances nucleoside- analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824(2017).
- Castellví, M., et al. Pharmacological modulation of SAMHD1 activity by CDK4/6 inhibitors improves anticancer therapy. Cancers. 12 (3), 713-719 (2020).
- Rassidakis, G. Z., et al. Low-level expression of SAMHD1 in acute myeloid leukemia (AML) blasts correlates with improved outcome upon consolidation chemotherapy with high-dose cytarabine-based regimens. Blood Cancer Journal. 8 (11), 98(2018).
- Rudd, S. G., Schaller, T., Herold, N. SAMHD1 is a barrier to antimetabolite-based cancer therapies. Molecular & Cellular Oncology. 4 (2), 1287554(2017).
- Rudd, S. G., et al. Ribonucleotide reductase inhibitors suppress SAMHD1 ara-CTPase activity enhancing cytarabine efficacy. EMBO Molecular Medicine. 41, 10419(2020).
- Seamon, K. J., et al. Small molecule inhibition of SAMHD1 dNTPase by tetramer destabilization. Journal of the American Chemical Society. 136 (28), 9822-9825 (2014).
- Seamon, K. J., Stivers, J. T. A high-throughput enzyme-coupled assay for SAMHD1 dNTPase. Journal of Biomolecular Screening. 20 (6), 801-809 (2015).
- Mauney, C. H., Perrino, F. W., Hollis, T. Identification of inhibitors of the dNTP triphosphohydrolase SAMHD1 using a novel and direct high-throughput assay. Biochemistry. 57 (47), 6624-6636 (2018).
- Morris, E. R., et al. Crystal structures of SAMHD1 inhibitor complexes reveal the mechanism of water-mediated dNTP hydrolysis. Nature Communications. 11 (1), 3165(2020).
- Hansen, E. C., Seamon, K. J., Cravens, S. L., Stivers, J. T. GTP activator and dNTP substrates of HIV-1 restriction factor SAMHD1 generate a long-lived activated state. Proceedings of the National Academy of Sciences of the United States of America. 111 (18), 1843-1851 (2014).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Hyun, M., Bohr, V. A., Ahn, B. Biochemical characterization of the WRN-1 RecQ helicase of Caenorhabditis elegans. Biochemistry. 47 (28), 7583-7593 (2008).
- Lin, H. -H., Huang, C. -Y. Characterization of flavonol inhibition of DnaB helicase: real-time monitoring, structural modeling, and proposed mechanism. Journal of Biomedicine & Biotechnology. 2012 (4), 735368(2012).
- Yang, M., Wang, G. ATPase activity measurement of DNA replicative helicase from Bacillus stearothermophilus by malachite green method. Analytical Biochemistry. 509, 46-49 (2016).
- Allard, B., Cousineau, I., Spring, K., Stagg, J. Measurement of CD73 enzymatic activity using luminescence-based and colorimetric assays. Methods in Enzymology. 629, 269-289 (2019).
- Lee, M., et al. Structure-activity relationship of sulfonyl piperazine LpxH inhibitors analyzed by an LpxE-coupled malachite green assay. ACS Infectious Diseases. 5 (4), 641-651 (2019).
- Carreras-Puigvert, J., et al. A comprehensive structural, biochemical and biological profiling of the human NUDIX hydrolase family. Nature Communications. 8 (1), 1541(2017).
- Valerie, N. C. K., et al. NUDT15 hydrolyzes 6-thio-deoxyGTP to mediate the anticancer efficacy of 6-thioguanine. Cancer Research. 76 (18), 5501-5511 (2016).
- Carter, M., et al. Human NUDT22 Is a UDP-glucose/galactose hydrolase exhibiting a unique structural fold. Structure. 26 (2), 295-303 (2018).
- Gad, H., et al. MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool. Nature. 508 (7495), 215-221 (2014).
- Page, B. D. G., et al. Targeted NUDT5 inhibitors block hormone signaling in breast cancer cells. Nature Communications. 9 (1), 250(2018).
- Zhang, S. M., et al. Development of a chemical probe against NUDT15. Nature Chemical Biology. 16 (10), 1120-1128 (2020).
- Michel, M., et al. In silico druggability assessment of the NUDIX hydrolase protein family as a workflow for target prioritization. Frontiers in Chemistry. 8, 443(2020).
- Zhang, J., Chung, T., Oldenburg, K. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67(1999).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Markossian, S., et al. Assay guidance manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , Bethesda (MD). (2004).
- Holdgate, G. A., Meek, T. D., Grimley, R. L. Mechanistic enzymology in drug discovery: a fresh perspective. Nature Reviews Drug Discovery. 17 (2), 115-132 (2018).
- Tsesmetzis, N., Paulin, C. B. J., Rudd, S. G., Herold, N. Nucleobase and nucleoside analogues: resistance and re-sensitisation at the level of pharmacokinetics, pharmacodynamics and metabolism. Cancers. 10 (7), 240(2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados