Method Article
בדיקת פעילות מצומדת אנזימים בתפוקה גבוהה לבדיקת אינטראקציה של מולקולות קטנות עם dNTPase SAMHD1
In This Article
Summary
SAMHD1 הוא deoxynucleoside triphosphate triphosphohydrolase עם תפקידים קריטיים בבריאות האדם ובמחלות. כאן אנו מציגים בדיקת פעילות רב-תכליתית של SAMHD1 מצומדת אנזימים, הפרוסה בפורמט מיקרו-צלחות של 384 בארות, המאפשרת הערכה של מולקולות קטנות ואנלוגים של נוקלאוטידים כסובסטרטים, מפעילים ומעכבים של SAMHD1.
Abstract
מוטיב אלפא סטרילי וחלבון 1 המכיל תחום HD (SAMHD1) הוא מווסת מרכזי של מאגרי דה-אוקסינוקלאוזיד טריפוספט תוך-תאיים (dNTP), שכן אנזים זה יכול לבצע הידרוליזה של dNTPs לנוקלאוזידים ולטריפוספטים אנאורגניים המתאימים להם. בשל תפקידו הקריטי במטבוליזם של נוקלאוטידים, הקשר שלו למספר פתולוגיות, ותפקידו בעמידות לטיפול, מתבצע כיום מחקר אינטנסיבי להבנה טובה יותר של הוויסות והתפקוד התאי של אנזים זה. מסיבה זו, פיתוח שיטות פשוטות וזולות בעלות תפוקה גבוהה לבדיקת אינטראקציה של מולקולות קטנות עם SAMHD1, כגון וסתים אלוסטריים, מצעים או מעכבים, הוא חיוני. למטרה זו, בדיקת מלכיט ירוק מצומד אנזים היא בדיקה קולורימטרית פשוטה וחזקה הניתנת לפריסה בפורמט צלחת 384 מיקרו-באר המאפשרת מדידה עקיפה של פעילות SAMHD1. כאשר SAMHD1 משחרר את קבוצת הטריפוספט ממצעי נוקלאוטידים, אנו יכולים להצמיד פעילות פירופוספטאז לתגובה זו, ובכך לייצר פוספט אנאורגני, אשר ניתן לכמת על ידי מגיב ירוק מלכיט באמצעות היווצרות קומפלקס ירוק מלכיט פוסהומוליבדט. כאן, אנו מראים את היישום של מתודולוגיה זו כדי לאפיין מעכבים ידועים של SAMHD1 ולפענח את המנגנונים המעורבים בקטליזה של SAMHD1 של מצעים לא קנוניים וויסות על ידי מפעילים אלוסטריים, המודגמים על ידי תרופות אנטי סרטניות מבוססות נוקלאוזידים. לפיכך, בדיקת מלכיט ירוק מצומד אנזימים היא כלי רב עוצמה לחקר SAMHD1, ויתרה מכך, ניתן להשתמש בה גם במחקר של מספר אנזימים המשחררים מיני פוספטים.
Introduction
מוטיב אלפא סטרילי וחלבון 1 המכיל היסטידין-אספרטט (SAMHD1) הוא מווסת מרכזי של הומאוסטזיס נוקלאוטיד בתאי יונקים1 עם תפקידים רבים בבריאות האדם ובמחלות2. אנזים זה מסוגל לבצע הידרוליזה של טריפוספטים deoxynucleoside (dNTPs) לתוך מולקולות deoxynucleoside וטריפוספט אנאורגניות 3,4 שלהם, כאשר פעילות זו מווסתת באופן אלוסטרי על ידי (d)NTP שפע (נסקר בהפניה5). כל מונומר SAMHD1 מכיל שני אתרים אלוסטריים (AS1 ו-AS2) ואתר קטליטי אחד, והיווצרות האנזים הפעיל דורשת הרכבה מסודרת של הומוטטרמר על קשירת (d)NTP. דימריזציה של מונומרים מסוג SAMHD1 מופעלת לראשונה באמצעות קשירה של גואנין טריפוספט (GTP או dGTP) ל-AS1, וטטרמריזציה לאחר מכן מושגת כאשר מולקולת dNTP נוספת נקשרת ל-AS2, מה שמאפשר גישה למצע לאתר הקטליטי ולהידרוליזה שלאחר מכן.
מצעי SAMHD1 כוללים את ארבעת dNTPs 3,4 הקנוניים יחד עם כמה נוקלאוטידים מהונדסים בסיסים וסוכר, כולל מטבוליטים של טריפוספט של מספר תרופות מבוססות נוקלאוזיד המשמשות לטיפול בזיהומים ויראליים וסרטן, שכמה מהן יכולות לשמש גם כמפעילים אלוסטריים 6,7,8,9,10,11. כתוצאה מכך, SAMHD1 מווסת את היעילות של רבות מהתרכובות הללו במודלים של מחלות 7,8,9,10,11,12,13,14,15, ויתר על כן, במקרה של ציטראבין אנלוגי דאוקסיציטידין (ara-C), שנשאר טיפול סטנדרטי בלוקמיה מיאלואידית חריפה (AML) במשך עשרות שנים, למעשה מכתיב יעילות הטיפול במחלה זו 7,8,16. לפיכך, SAMHD1 הוא סמן ביולוגי פוטנציאלי ומטרה טיפולית לשיפור היעילות של טיפולים מבוססי נוקלאוזיד17, ובהתאם לכך, אנו ואחרים ביקשנו לזהות אסטרטגיות להשבתת SAMHD1 בתאים. הצענו להשתמש בחלבון נגיפי X (Vpx) כמעכב ביולוגי כדי לכוון את SAMHD1 לפירוק בתוך תאים סרטניים7, אולם לגישה זו יש מספר מגבלות (שנדונו בהתייחסות12), ולאחרונה דיווחנו גם על גישה עקיפה לדיכוי פעילות SAMHD1 באמצעות עיכוב ריבונוקלאוטיד רדוקטאז שהדגמנו במודלים שונים של AML18. מספר מחקרים ביקשו לזהות מולקולות קטנות המסוגלות לעכב ישירות את SAMHD1, ועד כה דווחו מספר מולקולות כאלה, עם זאת, המתעדות רק עיכוב במבחנה 6,9,19,20,21,22. כתוצאה מכך, מחסור במולקולות קטנות המעכבות בעוצמה את פעילות SAMHD1 בתאים, יחד עם המנגנונים המורכבים של קטליזה SAMHD1 של טיפולים מבוססי נוקלאוזידים, מדגיש את הצורך בחקירה נוספת. לפיכך, שיטות חזקות ואידיאליות בעלות תפוקה גבוהה לבדיקת אינטראקציה של מולקולות קטנות עם SAMHD1 הן אידיאליות על מנת לזהות סובסטרטים, רגולטורים אלוסטריים ומעכבים, של אנזים רלוונטי קלינית זה.
קיימות מספר מתודולוגיות המודדות ישירות את פעילות dNTPase של SAMHD1, כגון כרומטוגרפיה בשכבה דקה (TLC)9,20,23 וכרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC)9,21, אך אלה אינן ניתנות להתאמה בקלות להגדרות בעלות תפוקה גבוהה. יוצא דופן אחד הוא הבדיקה שדווחה על ידי Mauney et al., אשר מנצלת את היכולת של SAMHD1 לבצע הידרוליזה ביס (4-nitrophenyl) פוספט (b4NPP) ל-p-nitrophenol ו-p-nitrophenyl פוספט כאשר Mn2+ משמש כקטיון המפעיל, וכתוצאה מכך שינוי קולורימטרי שניתן למדוד בקלות בצלחת microwell21. בדיקה זו שימשה בהצלחה לזיהוי ואפיון של מעכבי SAMHD1, אך יש לציין כי הידרוליזה מתרחשת בהיעדר (d)NTP activators ובנוכחות קטיון הפעלה לא פיזיולוגי סביר, שניהם אזהרות חשובות שיש לקחת בחשבון. זה גם הופך את הבדיקה הזו לפחות ישימה למחקר ולזיהוי של רגולטורים אלוסטריים של SAMHD1.
בהקשר זה, גישה מצומדת אנזימים בשילוב עם מגיב ירוק מלכיט, כמפורט בדו"ח זה, יכולה להיות שיטה רב-תכליתית למדוד בעקיפין את פעילות dNTPase של SAMHD1, ויתרה מכך, לחקור את ההשפעה של מולקולות קטנות שונות עליו. בדיקת ירוק מלכיט היא טכניקה קולורימטרית חזקה ואמינה לזיהוי פוספט אנאורגני חופשי (Pi), המבוססת על היווצרות קומפלקס חומצה מוליבדופוספורית המוביל לשינוי קולורימטרי שנמדד ב 620 ננומטר24. מכיוון שהידרוליזה SAMHD1 משחררת את קבוצת הטריפוספט ממצעי הנוקלאוטידים, לכן יש צורך להתאים תגובה זו לפעילות פוספטאז (פירו), שתייצר פוספט אנאורגני חופשי, לפני הוספת מגיב ירוק מלכיט. בדיקת מלכיט ירוק היא רגישה וחסכונית ונמצאת בשימוש נרחב לזיהוי ואפיון מעכבים ומצעים לאנזימים המשחררים קבוצות פוספט אנאורגניות בתגובותיהם או בנוכחות אנזים צימוד. זה כבר מיושם נרחב באפיון של פעילויות ATPase של helicases25,26,27, או במחקר של פעילות אנזימטית CD73, אשר מתווך את השפלה של AMP אדנוזין ופוספט אנאורגני28. בנוסף, כאשר הוא משולב, הוא שימש בגילוי תרופות אנטיביוטיות המכוונות ל- UDP-2,3-diacylglucosamine pyrophosphatase LpxH, אנזים חיוני ברוב הפתוגנים גראם-שליליים29. באשר לחקר הסרטן, הגישה המצמידה אנזימים נפרסה באופן נרחב נגד NUDIX hydrolases, משפחה של אנזימים מטבוליזם נוקלאוטידים, הן באפיון סובסטרטים 30,31,32 והן בזיהוי ופיתוח תרופות ובדיקות כימיות 33,34,35,36.
לגבי dNTPase SAMHD1, גישה זו שימשה במספר דוחות. באמצעות exopolyphosphatase Ppx1 מ Saccharomyces cerevisiae כאנזים צימוד, בדיקה זו שימשה לבדיקת מספר אנלוגים נוקלאוטידים כמו סובסטרטים, activators, או מעכבים של SAMHD1, והביא לזיהוי של מטבוליט triphosphate של התרופה האנטי לוקמית clofarabine כמו activator ומצע6. נוסף על כך, עם פירופוספטאז אנאורגני מ-Escherichia coli כאנזים הצימוד, נעשה בו שימוש בסינון ספריה של תרכובות שאושרו קלינית כנגד SAMHD1 כדי לזהות מעכבים20. במחקר שלנו, השתמשנו בגישה זו כדי להראות כי ara-CTP, המטבוליט הפעיל של ara-C, הוא מצע SAMHD1 אך לא מפעיל אלוסטרי7 ולאחר מכן השתמשנו בבדיקה זו כדי להראות שמספר מולקולות קטנות שיכולות לגרום למודלים של AML להיות רגישים ל- ara-C באופן תלוי SAMHD1, למעשה לא עיכבו ישירות את SAMHD118. בדוח זה נפרט שיטה רב-תכליתית זו ונדגים את יישומה, במערך מקובל בתפוקה גבוהה, לזיהוי מעכבים, מפעילים ומצעים של SAMHD1.
Protocol
סקירה סכמטית של השיטות להלן מתוארת באיור 1 , ורשימה מפורטת של חומרים וריאגנטים זמינה בטבלת החומרים.
1. הכנת מאגרי בדיקה.
- הכנת מאגרי מניות.
הערה: מכיוון שהבדיקה רגישה לזיהוי פוספטים, דבר שיכול להיות דבר שבשגרה, שטפו כלי זכוכית שלוש פעמים במים טהורים במיוחד או מזוקקים פעמיים כדי למנוע זיהום. ניתן לאחסן את כל המאגרים בטמפרטורת החדר (RT).- הכן 1 ליטר של תמיסת מאגר תגובה SAMHD1 (RB) (25 mM Tris-Acetate pH 8, 40 mM NaCl, 1 mM MgCl2) על ידי המסת 4.5 גרם Tris אצטט, 2.3 גרם NaCl ו- 0.2 גרם MgCl2, בכ- 800 מ"ל מים לפני התאמה ל- pH 8 ולנפח הסופי.
- הכן 5 מ"ל של תמיסת מלאי TCEP 0.1 M על ידי דילול 1 מ"ל של 0.5 M TCEP לתוך 4 מ"ל מים.
- הכן 50 מ"ל של 11% תמיסת מלאי Tween-20 על ידי דילול 5 מ"ל של 100% Tween-20 לתוך 44.5 מ"ל מים.
הערה: Tween-20 רגיש לאור. - הכן 50 מ"ל של תמיסת עצירה EDTA 0.5 M על ידי המסת 9.3 גרם EDTA בכ- 40 מ"ל מים לפני התאמה ל- pH 8 ולנפח הסופי.
- הכינו תמיסת מלאי מלכיט ירוק (MG) (3.2 מ"מ מלכיט ירוק ב H2SO4) על ידי הוספה איטית של 60 מ"ל חומצה גופרתית מרוכזת ל -300 מ"ל מים בבקבוק זכוכית חום. מצננים את התמיסה ל-RT וממיסים 0.44 גרם מלכיט ירוק.
זהירות: התגובה של חומצה גופרתית עם מים היא אקסותרמית ולכן הבקבוק עלול להתחמם ולגרום להצטברות לחץ; ודא לחץ זה משתחרר לעתים קרובות.
הערה: התמיסה הכתומה המתקבלת היא רגישה לאור (ומכאן בקבוק חום) ויציבה למשך שנה לפחות ב- RT. משקעים עשויים להיווצר עם הזמן, ודא שרק supernatant משמש. - הכינו 50 מ"ל של 7% תמיסת מלאי אמוניום מוליבדט על ידי המסת 3.75 גרם מוליבדט אמוניום ב-50 מ"ל מים.
הערה: משקע עשוי להיווצר עם הזמן, ודא רק supernatant משמש.
- הכנת מאגרי בדיקה מלאים
הערה: יש לעשות זאת ביום הניסוי- הכן SAMHD1 RB מלא (25 mM Tris-אצטט pH 8, 40 mM NaCl, 1 mM MgCl2, 0.3 mM TCEP, 0.005% Tween-20). השתמש בעבר במניות Tween-20 ו- 0.1 M TCEP שהוכנו בעבר כדי להוסיף רכיבים אלה בריכוז סופי של 0.005% עבור Tween-20 ו- 0.3 מילימטר עבור TCEP למלאי SAMHD1 RL.
- הכן פתרון עצירת EDTA (25 mM Tris-אצטט pH 8, 40 mM NaCl, 1 mM MgCl2, 0.3 mM TCEP, 0.005% Tween-20, 7.9 mM EDTA). כדי להשלים SAMHD1 RB, השתמש בתמיסת מלאי EDTA של 0.5 M כדי להוסיף EDTA לריכוז סופי של 7.9 mM.
- הכן את תמיסת העבודה MG (2.5 mM מלכיט ירוק, 1.4% אמוניום מוליבדט, 0.18% Tween-20) על ידי ערבוב 10 חלקים של תמיסת מלאי MG עם 2.5 חלקים של 7% מוליבדט אמוניום ו 0.2 חלקים של 11% Tween-20.
2. בדיקת עיכוב SAMHD1 וקביעה של תרכובת IC50
הערה: תנאי הבדיקה הסופיים מוצגים בטבלה 1.
- הכנת תרכובות בצלחת הבדיקה
הערה: תרכובות קטנות בעלות משקל מולקולרי מומסות בדרך כלל באנלוגים של 100% DMSO ונוקלאוטידים במים. ריכוז המלאי נע בין 10 ל -100 מילימטר והוא מושפע מהעוצמה והמסיסות של התרכובות, יחד עם סבילות DMSO של הבדיקה. בדוק כי ריכוז DMSO הסופי בתגובה אינו עולה על 1% כדי להבטיח שפעילויות האנזים אינן מושפעות מממס זה. מומלץ לבדוק את הסבילות של הבדיקה לממס לפני הניסוי.- הכינו תרכובות בדיקה בדילול סדרתי בריכוז סופי של 100x בממס הרלוונטי (למשל, 100% DMSO עבור מולקולות קטנות או מים עבור אנלוגים לנוקלאוטידים) בלוח פוליפרופילן 96 בארות שקוף בעל תחתית עגולה באמצעות פיפטה רב ערוצית או ציוד אוטומטי לטיפול בנוזלים.
הערה: בהתאם ליציבות התרכובת, ניתן להכין לוחות דילול מראש, לאטום ולאחסן בטמפרטורה של -20°C. אפשר ללוחות להתאזן ל- RT לפני המשך הפרוטוקול. - באמצעות SAMHD1 RB מלא, לדלל תרכובות לריכוז סופי של פי 25 (כדי לשמור על ריכוז הממס הסופי מתחת ל-1%) ולהעביר 5 μL לבארות המתאימות של לוח בדיקה שקוף בעל תחתית שטוחה של 384 בארות. חזור על ההליך עם דגימות בקרה של ממס בלבד.
- הכינו תרכובות בדיקה בדילול סדרתי בריכוז סופי של 100x בממס הרלוונטי (למשל, 100% DMSO עבור מולקולות קטנות או מים עבור אנלוגים לנוקלאוטידים) בלוח פוליפרופילן 96 בארות שקוף בעל תחתית עגולה באמצעות פיפטה רב ערוצית או ציוד אוטומטי לטיפול בנוזלים.
- הכנת רכיבי תגובה
הערה: יש לעשות זאת ביום הבדיקה. אליציטוטים רקומביננטיים של SAMHD1 ו-E. coli pyrophosphatase (PPase) מאוחסנים לטווח ארוך ב-80°C מדוללים ב-9.1 מ"ג/מ"ל ו-23.0 מ"ג/מ"ל, בהתאמה, במאגר אחסון (20 mM HEPES pH 7.5, 300 mM NaCl, 10% גליצרול, 2 mM TCEP). לאחר הפשרה, aliquots מאוחסנים לטווח קצר ב -20 ° C.- הכינו תערובת מאסטר של אנזימים (SAMHD1/PPase) על ידי דילול חלבון SAMHD1 אנושי רקומביננטי ו-PPase רקומביננטי ב-SAMHD1 RB מלא לריכוז הסופי הרצוי פי 4, וכך 1.4 מיקרומטר SAMHD1 ו-50 U/mL PPase.
- הכן activator/substrate dGTP על ידי דילול מלאי dGTP (בדרך כלל 10 או 100 mM במים) ב SAMHD1 RB מלא לריכוז סופי פי 2, ובכך 50 μM dGTP.
- בצע את הבדיקה
הערה: יש לאזן את כל רכיבי הבדיקה ל- RT. ניתן לבצע תוספות נוזלים עם פיפטה רב ערוצית או מתקן נוזלים מגיב בתפזורת.- לצלחת בדיקה של 384 בארות המכילה דילול מורכב ובקרות ממס בלבד, יש להוציא 5 μL של תערובת מאסטר SAMHD1/PPase. ללא בארות בקרת אנזימים, יש להוציא 5 μL של SAMHD1 RB מלא. קדם-דגירה של אנזים ותרכובות למשך 10 דקות ב-RT.
- לכל הבארות, לוותר 10 μL של פתרון dGTP 2x כדי להתחיל את התגובה.
- דגרו על התגובה במשך 20 דקות ב-RT.
- עצור את התגובה על ידי מתן 20 μL EDTA להפסיק פתרון לכל הבארות.
הערה: ניתן להשהות את הניסוי כאן אם תרצה. - הוסף 10 μL MG פתרון עבודה לכל הבארות.
זהירות: פתרון עבודה MG מכיל חומצה גופרתית. - ודא ערבוב של תכולת הבאר באמצעות שייקר צלחת microwell מסלולית וצנטריפוגה ב 1,000 x גרם במשך 1 דקה.
- לדגור על הצלחת במשך 20 דקות ב RT.
- קרא את הבליעה באורך גל של 630 ננומטר בקורא לוחות microwell.
- תצוגה חזותית וניתוח נתונים
- חישוב הממוצע וסטיית התקן של בארות הבקרה החיוביות והשליליות (תגובה חיובית, מלאה עם ממס; שלילי, dGTP לבד עם ממס). חישוב Z-factor37 כאינדיקטור לאיכות המבחן.
- נרמל כל ערך ספיגה לערכים הממוצעים של הפקדים החיוביים והשליליים, והגדר את הבקרה החיובית כפעילות SAMHD1 100% ואת הבקרה השלילית כפעילות 0% SAMHD1.
- התווה פעילות SAMHD1 (%) כפונקציה של ריכוז התרכובת והתאים לעקומת מנה-תגובה בשיפוע משתנה של ארבעה פרמטרים, המאפשרת קביעת תרכובת IC50.
3. מפעיל SAMHD1 ומסך מצע
הערה: תנאי הבדיקה הסופיים מוצגים בטבלה 2. אליציטוטים רקומביננטיים מסוג SAMHD1 ו-PPase מאוחסנים לטווח ארוך ב-80°C מדוללים ב-9.1 מ"ג/מ"ל ו-23.0 מ"ג/מ"ל, בהתאמה, במאגר אחסון (20 mM HEPES pH 7.5, 300 mM NaCl, 10% גליצרול, 2 mM TCEP) ב-80°C-. לאחר הפשרה, aliquots מאוחסנים לטווח קצר ב -20 ° C.
- הכנת אנלוגים נוקלאוטידים בצלחת הבדיקה
- לדלל מלאי אנלוגי של נוקלאוטידים (בדרך כלל 10 או 100 מילימטר במים) לריכוז סופי פי 4 ב- SAMHD1 RB מלא, במקרה שלנו 800 מיקרומטר אנלוגי לנוקלאוטידים, ולהעביר 5 μL לבארות המתאימות של צלחת בדיקה של 384 בארות.
- הכנת רכיבי תגובה
הערה: יש לעשות זאת ביום הבדיקה- הכינו תערובת מאסטר של אנזים (SAMHD1/PPase) על ידי דילול חלבון SAMHD1 אנושי רקומביננטי ואי קולי PPase רקומביננטי ב-SAMHD1 RB מלא עד פי 2 מהריכוז הסופי הרצוי, וכך 0.7 מיקרומטר SAMHD1 ו-25 U/mL PPase.
- הכן PPase לבד פתרון על ידי דילול רקומביננטי E. coli PPase ב SAMHD1 RB מלא לריכוז הסופי הרצוי פי 2, ובכך 25 U/mL PPase.
- הכינו מלאי דילול מפעילים GTP (AS1) ו-dGTPαS (AS1 ו-AS2) (בדרך כלל 10 או 100 מילימטר במים) ב-SAMHD1 RB מלא עד פי 4 מהריכוז הסופי, כלומר 50 מיקרומטר GTP או dGTPαS.
- בצע את הבדיקה
הערה: יש לאזן את כל רכיבי הבדיקה ל- RT. ניתן לבצע תוספות נוזלים עם פיפטה רב ערוצית או מתקן נוזלים מגיב בתפזורת.- לצלחת בדיקה של 384 בארות המכילה אנלוגים לנוקלאוטידים, יש לחלק 5 μL של האקטיבטור (GTP או dGTPαS) או להשלים SAMHD1 RB לבארות המתאימות.
- התחל את התגובה על ידי ניפוק 10 μL של תערובת מאסטר SAMHD1/PPase, PPase בלבד, או SAMHD1 RB מלא לבארות המתאימות.
- דגרו על התגובה במשך 20 דקות ב-RT.
- עצור את התגובה על ידי מתן 20 μL EDTA להפסיק פתרון לכל הבארות.
הערה: ניתן להשהות את הניסוי כאן אם תרצה. - הוסף 10 μL MG פתרון עבודה לכל הבארות.
זהירות: פתרון עבודה MG מכיל חומצה גופרתית. - ודא ערבוב של תכולת הבאר באמצעות שייקר צלחת microwell מסלולית וצנטריפוגה ב 1,000 x גרם במשך 1 דקה.
- לדגור על הצלחת במשך 20 דקות ב RT.
- קרא את הבליעה באורך גל של 630 ננומטר בקורא לוחות microwell.
- תצוגה חזותית וניתוח נתונים
- חשב את ערכי הספיגה הממוצעים עבור בארות התגובה PPase בלבד (בקרה שלילית או אות רקע).
הערה: כבקרה חיובית של מפעיל ומצע אלוסטרי SAMHD1, dGTP יכול להיכלל בלוחית. במקרה זה, תוכל להשתמש בתנאי זה כדי לחשב Z-factor כאינדיקטור לאיכות המבחן. - הפחת את ערך הרקע מהבארות המתאימות בתגובות SAMHD1/PPase.
- התוויית ערכי ספיגה מתוקנים עבור כל אנלוג נוקלאוטיד עם תנאי חיץ, GTP ו- dGTPαS.
- חשב את ערכי הספיגה הממוצעים עבור בארות התגובה PPase בלבד (בקרה שלילית או אות רקע).
תוצאות
הפרוטוקול המתואר באיור 1 מתאר את זרימת העבודה הבסיסית לשימוש בבדיקת מלכיט ירוק מצומד אנזים כדי לחקור את האינטראקציה של מולקולות קטנות עם dNTPase SAMHD1, וניתן להתאים אותו במספר דרכים כדי לחקור שאלות ביוכימיות שונות. בתוצאות המייצגות הנדונות בפסקאות הבאות, אנו מדגימים דוגמאות לשימוש בבדיקה זו כדי לקבוע את התכונות המעכבות של מולקולות קטנות כלפי SAMHD1 ולבדוק אם אנלוגים שונים של נוקלאוטידים הם סובסטרטים ו / או מפעילים של אנזים זה.
התוצאות המוצגות באיור 2 ממחישות כמה עקרונות ליבה של בדיקה זו. מגיב ירוק מלכיט מאפשר זיהוי קולורימטרי של פוספט אנאורגני באמצעות היווצרות של קומפלקס ירוק מלכיט פוסהומוליבדט, ובהתאם, גישה זו יכולה להיות מיושמת לחקר תגובות אנזימטיות שתוצרתן היא פוספט. כדי להדגים את הרגישות של השיטה הזו לזיהוי פוספט אנאורגני חופשי, איור 2A מראה את ערכי הספיגה שהתקבלו עם ריכוזים הולכים וגדלים של Na3PO4 לאחר דגירה של 20 דקות עם מגיב ירוק מלכיט. בעוד שהאות מגיע לרוויה ב-0.25 מילימטר Na3PO4, טווח הזיהוי הליניארי של פוספט נראה בין 0.004 ל-0.03 מילימטר (איור 2A, פאנל ימני), בהתאם למחקרים אחרים שדיווחו על טווח ליניארי של פוספט עד 10-20 מיקרומטר באמצעות בדיקת מלכיט גרין38.
SAMHD1 הוא dNTPase המשחרר טריפוספט אנאורגני בעת הידרוליזה של מולקולת dNTP, ולכן על מנת לייצר פוספט אנאורגני חופשי לגילוי על ידי מלכיט ירוק, נדרש אנזים צימוד. פירופוספטאז אנאורגני (PPase) מ E. coli הוכח שימושי למטרה זו, הן לגבי SAMHD1 7,20, אבל גם אנזימים מטבוליזם נוקלאוטידים אחרים 30,33,35. בנוסף, SAMHD1 הוא dNTPase פעיל כאשר הוא הומוטטרמר, וזה דורש הפעלה אלוסטרית על ידי (d)NTPs, במיוחד גואנין טריפוספט (GTP או dGTP) ב- AS1 וכל dNTP ב- AS2. לאחר מכן, האתר הקטליטי הופך נגיש לקשירת המצע והתגובה האנזימטית מתרחשת. מכיוון ש- dGTP ממלא את הדרישות לקשירה ל- AS1 ו- AS2, והוא מצע, השימוש בנוקלאוטיד זה בבדיקת העיכוב מפשט מאוד את זרימת העבודה. איור 2B ממחיש את הדרישה של רכיבי הבדיקה השונים כדי להשיג פעילות SAMHD1 מדידה, המתבטאת בעלייה בספיגה של 630 ננומטר. לא SAMHD1 ולא PPase לבדם מסוגלים לייצר פוספט אנאורגני בנוכחות dGTP, בהתאם לפעילויות המתועדות של אנזימים אלה. עם זאת, במצב שבו כל רכיבי הבדיקה נמצאים (SAMHD1, PPase ומפעיל / מצע dGTP) אנו רואים עלייה בסיגנל. פקטור Z37 בדוגמה המוצגת כאן (ללא נטילת אנזימים + dGTP כבקרה שלילית ו- SAMHD1/PPase + dGTP כבקרה חיובית) היה 0.74, מה שמצביע על בדיקה חזקה.
אחד היישומים האפשריים של בדיקת פעילות SAMHD1 מצומד אנזימים הוא זיהוי מעכבים באמצעות סינון בתפוקה גבוהה (HTS). לפיכך, בדו"ח זה, אנו מאמתים את הזיהוי של עיכוב SAMHD1 בבדיקה זו באמצעות קבוצה מגוונת של תרכובות שכבר תוארו בספרות. Seamon et al. העריכו את העיכוב תלוי המינון של נוקלאוזידים קנוניים כלפי SAMHD1 באמצעות בדיקה דומה כפי שמוצג כאן, ומצאו כי deoxyguanosine (dGuo) היה הנוקלאוזיד הקנוני היחיד המסוגל לעכב באופן משמעותי SAMHD1, עם ערך IC50 של 488 μM20. HTS של תרופות שאושרו על ידי ה- FDA שבוצעו עם בדיקת b4NPP ישירה חשפה מספר פגיעות שעיכבו את פעילות SAMHD1 בריכוזים מיקרומולאריים, מהם לומופונגין הייתה המולקולה שעיכבה בצורה החזקה ביותר את פעילות SAMHD1 dNTPase במבחנה, והציגה IC50 של 20.1 מיקרומטר כאשר נקבע בנוכחות dGTP כמצע21. בנוסף, ארבעת האנלוגים α,β-imido-dNTP זוהו גם כמעכבים תחרותיים של SAMHD1 באמצעות חיישן MDCC-PBP ו-SAMHD1 המצומדים לפעילות PPX, מה שהראו כי קבועי העיכוב של אנלוגי dNMPNPP היו בטווח המיקרומולרי הנמוך / ננו-מולארי גבוה 6,22. לפיכך, כדי להדגים כי ניתן להשתמש בבדיקת פעילות SAMHD1 מצומדת לאנזים כדי לזהות מעכבי SAMHD1, dGuo, lomofungin ו- 2'-deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP), שימשו לאימות הטכניקה. איור 3A מדגים את עקומות המינון-תגובה המתקבלות עבור תרכובות אלה, ומראה כי ריכוזים הולכים וגדלים מעכבים ביעילות את פעילות SAMHD1. ערכי IC50 הממוצעים שהתקבלו עבור מולקולות אלה משלושה ניסויים עצמאיים (± סטיית תקן) היו כדלקמן: dGuo = 361.9 ± 72.8 μM, lomofungin 6.78 ± 3.9 μM, ו- dTMPNPP = 2.10 ± 0.9 μM. כדוגמה לתוצאה שלילית, נקבעה גם ההשפעה של הידרוקסיאוריאה (HU) על פעילות SAMHD1. HU הוא מעכב של ריבונוקלאוטיד רדוקטאז, ולמרות שהוא מגביל את פעילות SAMHD1 ara-CTPase במודלים שונים של AML, ההשפעות של HU על SAMHD1 הוכחו כעקיפות ומסתמכות על הפרעה לוויסות האלוסטארי של SAMHD118. עקומת תגובת המינון של HU מוצגת באיור 3B, ולא נצפו שינויים בפעילות SAMHD1 עם עלייה במינונים של HU, מה שמוכיח כי HU אינו מעכב את פעילות SAMHD1 במבחנה.
שימוש נוסף בבדיקת הפעילות של SAMHD1 המצומד לאנזים הוא לחקור אם נוקלאוטידים והאנלוגים שלהם הם סובסטרטים ו/או מפעילים אלוסטריים של האנזים הזה, כפי שמודגם באיור 4. בניסוי זה, נוקלאוטידים קנוניים, כמו גם מטבוליטים פעילים של מספר אנלוגים נוקלאוזידים אנטי-סרטניים, כגון ציטראבין (ara-CTP), קלופראבין (Cl-F-ara-ATP) וגמציטאבין (dF-dCTP), נבדקו כמצעים ומפעילים של SAMHD1. בשל הרגולציה האלוסטרית המורכבת של SAMHD1, התגובה מבוצעת בנוכחות GTP כמפעיל AS1 או dGTP אנלוגי שאינו הידרוליזה 2'-deoxyguanosine-5'-(α-thio)-triphosphate (dGTPαS), אשר יכול לכבוש AS1 ו- AS2. פעילות SAMHD1 בנוכחות הנוקלאוטיד הנבדק אנלוגי ו-GTP מצביעה על כך שהנוקלאוטיד מסוגל להיקשר לאתר אלוסטרי משני ולאתר קטליטי (כלומר, מפעיל ומצע AS2), בעוד שפעילות SAMHD1 עם הנוקלאוטיד אנלוגי ו-dGTPαS מצביעה על כך שהנוקלאוטיד יכול לתפוס רק את האתר הקטליטי (כלומר, רק מצע). אם הנוקלאוטיד מסוגל להיקשר הן לאתרים אלוסטריים AS1 ו-AS2 והן לאתר הקטליטי, SAMHD1 יהיה פעיל בנוכחות הנוקלאוטיד בלבד, כפי שמוצג במקרה של dGTP. התוצאות מראות כי כל dNTPs הקנוניים מסוגלים להיקשר לאתר AS2 ולאתר הקטליטי. במקרה של אנלוגים נוקלאוטידים, clofarabine triphosphate הוא מפעיל AS2 ומצע, בעוד cytarabine triphosphate הוא רק מסוגל לתפוס את האתר הקטליטי. מצד שני, לא נצפתה פעילות עם gemcitabine triphosphate, דבר המצביע על כך שבתנאים שנבדקו gemcitabine triphosphate אינו מסוגל לפעול כאפקט אלוסטרי ולא כמצע. למרות שתוצאה זו עולה בקנה אחד עם תחזיות קודמות9, התגבשות מאוחרת יותר ומחקרים קינטיים10 גילו כי גמציטאבין טריפוספט מסוגל לקשור את הכיס הקטליטי SAMHD1, וכי הוא אכן מצע של האנזים. עם זאת, במחקר האחרון10, המחברים מראים כי שיעור ההידרוליזה נמוך במידה ניכרת בהשוואה למצעים מדווחים אחרים, כגון ציטראבין טריפוספט, ובכך מסבירים מדוע לא הצלחנו לצפות בכך באמצעות מערך סינון זה.
בסך הכל, תוצאות מייצגות אלה מאמתות את השימוש בבדיקת פעילות SAMHD1 מצומדת לאנזים כטכניקה חזקה לזיהוי ואפיון של מעכבי SAMHD1, ווסתי אלוסטרי וסובסטרטים. עם זאת, בדומה לכל הגישות הניסיוניות, לשיטה זו יש את הסייגים שלה, ולכן יש להשתמש בבדיקות אורתוגונליות (למשל, באמצעות טכנולוגיית בדיקה שונה) כדי לאמת עוד יותר את הממצאים.
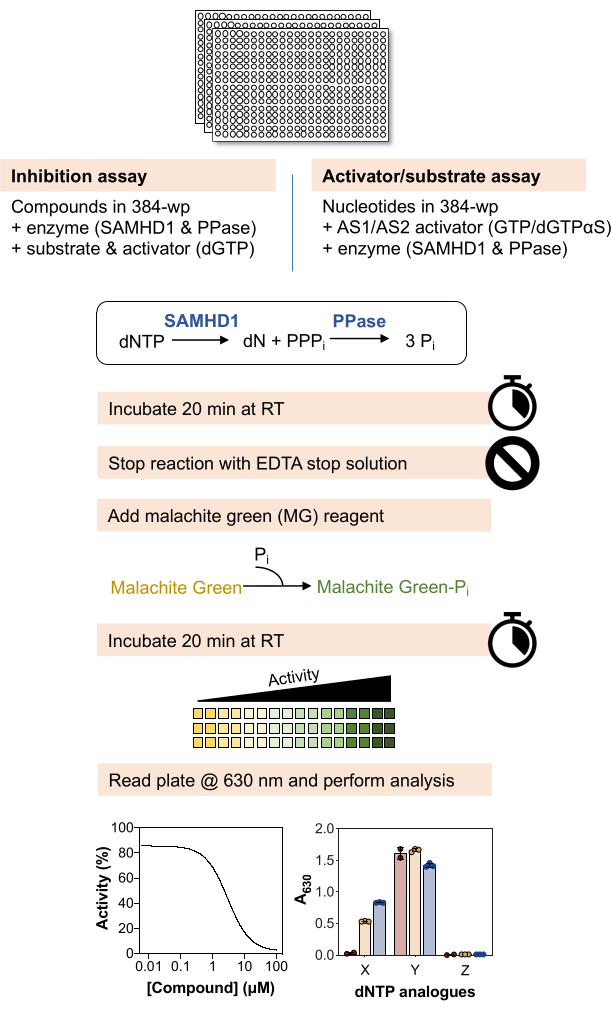
איור 1: סקירה סכמטית של הפרוטוקול המתואר במאמר זה. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
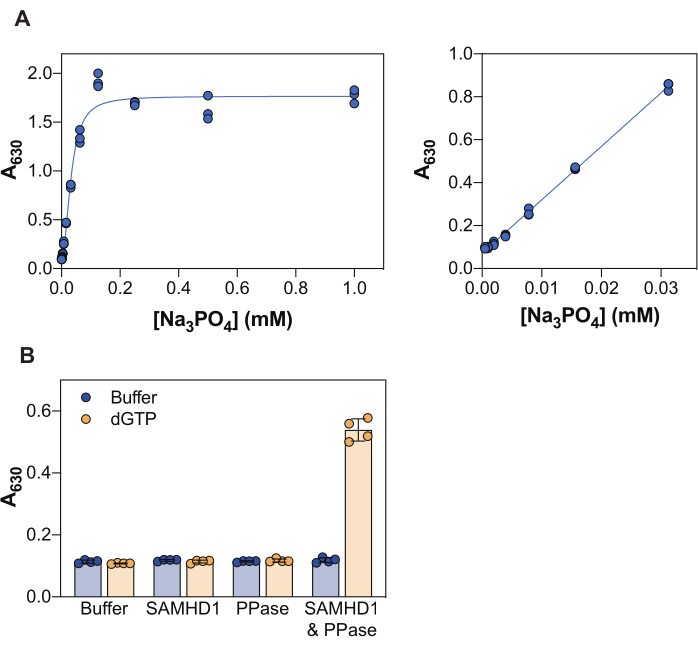
איור 2: בדיקת פעילות SAMHD1 מצומד אנזימים. (A) עקומה סטנדרטית Na3PO4 במבחן הירוק מלכיט. Na3PO4 דילול סדרתי (פי 2) הוכן מ 1 mM ל 0.004 mM ב triplicate ו מודגר עם מגיב ירוק מלכיט במשך 20 דקות. ערכי ספיגה גולמיים בטווח המלא של הריכוזים שנבדקו מוצגים בלוח השמאלי ובטווח הליניארי בלוח הימני. נציג של שני ניסויים עצמאיים שהוצגו. (B) אימות של בדיקת פעילות מצומדת אנזימים. SAMHD1 (0.35 מיקרומטר) ו/או PPase (12.5 U/mL) בנוכחות או היעדר activator/substrate dGTP (25 μM) הודגרו במשך 20 דקות בבדיקת הפעילות המצומדת לאנזים. רביעיות מנציג של שני ניסויים עצמאיים המוצגים עם ערכי ספיגה גולמיים משורטטים, עמודות וקווי שגיאה מציינים ממוצע ו- SD. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
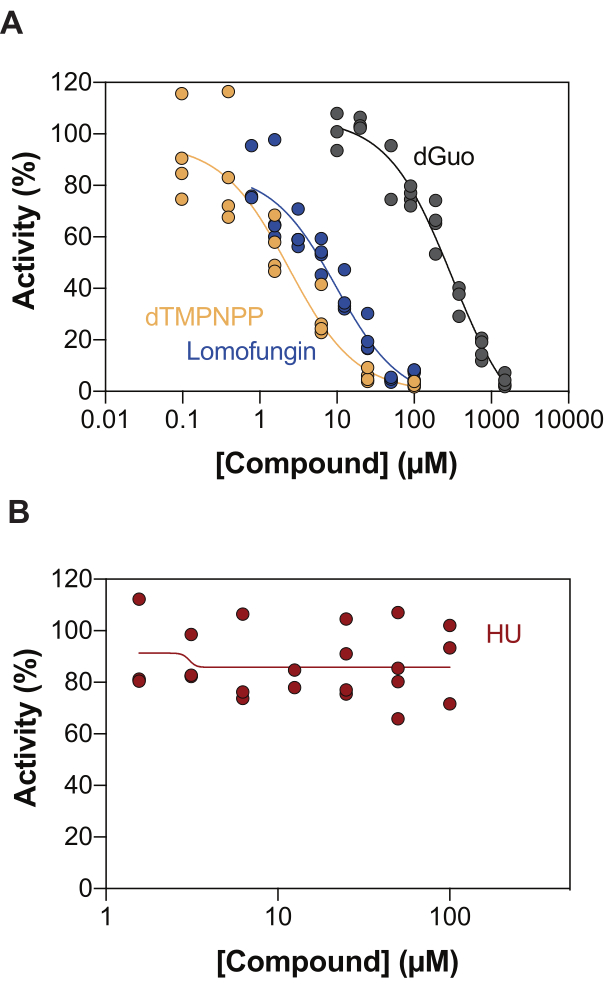
איור 3: הערכת תרכובות עבור עיכוב SAMHD1 בבדיקת פעילות מצומדת אנזימים. תגובת מינון של lomofungin (0.78-100 μM), 2'-deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP, 0.01-100 μM) ו deoxyguanosine (dGuo, 10-1,500 μM) (A) או hydroxyurea (HU) (0.78-100 μM) (B) בבדיקת פעילות SAMHD1 מצומד אנזים עם dGTP (25 μM) כמפעיל/סובסטרט. אחוזי פעילות ביחס לבקרות תגובה ממשוכפלים בודדים שהותוו (DMSO + SAMHD1/PPase + dGTP = 100% פעילות, DMSO + dGTP = 0% פעילות) עם נציג של שלושה ניסויים מוצגים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
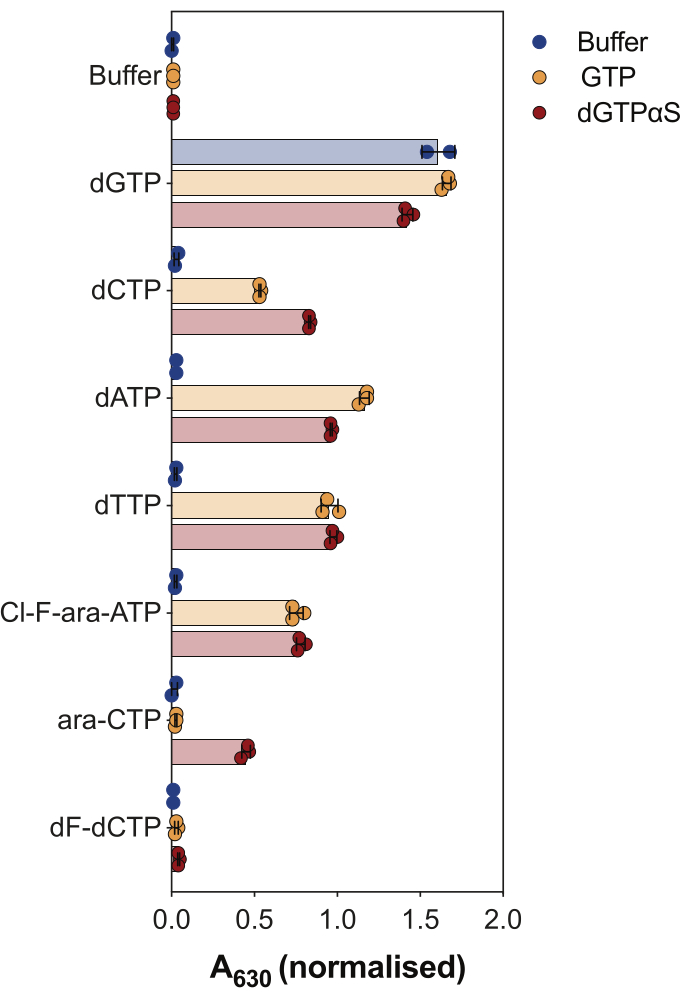
איור 4: הערכת אנלוגים של נוקלאוטידים כמפעילים אלוסטריים וסובסטרטים של SAMHD1 בבדיקת הפעילות המצומדת לאנזים. נוקלאוטידים קנוניים ומטבוליטים נבחרים של טריפוספט של תרופות אנטי-סרטניות ציטראבין (ara-CTP), קלופראבין (Cl-F-ara-ATP) וגמציטאבין (dF-dCTP), נבדקו ב-200 מיקרומטר בבדיקת פעילות SAMHD1 מצומד אנזים בנוכחות או היעדר GTP או dGTP אנלוגי dGTPαS שאינו ניתן להידרוליזה (12.5 מיקרומטר). ערכי ספיגה מנורמלים משכפלים ניסיוניים בודדים מסומנים, ממוצע ו- SD מסומנים. נציג של שני ניסויים עצמאיים שהוצגו, הותאמו מהמחקר הקודם שלנו7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| צעד | מגיב | נפח מנופק (μL) | נפח תגובה סופי (μL) | ריכוז משוחרר | דילול קפל בתגובה | ריכוז סופי בתגובה |
| 1 | מעכב | 5 | 20 | 0.4 מ"מ | 4 | 0.1 מ"מ |
| 2 | תערובת SAMHD1+PPase | 5 | 1.4 מיקרומטר SAMHD1, 50 U/מ"ל PPase | 4 | 0.35 מיקרומטר SAMHD1, 12.5 U/מ"ל Ppase | |
| 3 | dGTP | 10 | 50 מיקרומטר | 2 | 25 מיקרומטר | |
| 4 | דגירה למשך 20 דקות | |||||
| 5 | פתרון EDTA | 20 | 40 | 7.9 מ"מ | 2 | 3.95 מ"מ |
| 6 | מגיב MG | 10 | 50 | 2.5 מ"מ מלכיט ירוק, 64.4 מ"מ אמוניום מוליבדט, 0.18% טווין-20 | 5 | 0.5 מ"מ מלכיט ירוק, 12.9 מ"מ אמוניום מוליבדט, 0.036% טווין-20 |
| 7 | דגירה למשך 20 דקות | |||||
| 8 | קרא @ 630 ננומטר | |||||
טבלה 1: סיכום התנאים הסופיים בבדיקת האנזימים המצומדים לבדיקת מעכבים.
| צעד | מגיב | נפח מנופק (μL) | נפח תגובה סופי (μL) | ריכוז משוחרר | דילול קפל בתגובה | ריכוז סופי בתגובה |
| 1 | הרגולטור האלוסטריק | 5 | 20 | 800 מיקרומטר | 4 | 200 מיקרומטר |
| 2 | GTP או dGTPαS | 5 | 50 מיקרומטר | 4 | 12.5 מיקרומטר | |
| 3 | SAMHD1 ו/או PPase | 10 | 0.7 מיקרומטר SAMHD1, 25 U/מ"ל PPase | 2 | 0.35 מיקרומטר SAMHD1, 12.5 U/מ"ל PPase | |
| 4 | דגירה למשך 20 דקות | |||||
| 5 | פתרון EDTA | 20 | 40 | 7.9 מ"מ | 2 | 3.95 מ"מ |
| 6 | מגיב MG | 10 | 50 | 2.5 מ"מ מלכיט ירוק, 64.4 מ"מ אמוניום מוליבדט, 0.18% טווין-20 | 5 | 0.5 מ"מ מלכיט ירוק, 12.9 מ"מ אמוניום מוליבדט, 0.036% טווין-20 |
| 7 | דגירה למשך 20 דקות | |||||
| 8 | קרא @ 630 ננומטר | |||||
טבלה 2: סיכום התנאים הסופיים בבדיקת האנזים המצמיד לבדיקת רגולטורים אלוסטריים
Discussion
בדיקת הפעילות המצומדת לאנזים המפורטת כאן היא בדיקה קולורימטרית בעלת תפוקה גבוהה המאפשרת מדידה עקיפה של הידרוליזה dNTP על ידי SAMHD1. שיטה זו מנצלת את היכולת של PPase אנאורגני מ E. coli, אשר כאשר נכלל עודף בתערובת התגובה, ממיר כל טריפוספט אנאורגני שנוצר על ידי SAMHD1 לשלושה פוספטים חופשיים בודדים שניתן לכמת באמצעות מגיב ירוק מלכיט פשוט וחסכוני. אנו מספקים בדיקה זו בפורמט צלחת מיקרווול 384, שהיא אידיאלית לסינון ספריות מורכבות, ומדגימים את הישימות והרבגוניות של טכניקה זו בזיהוי ואפיון של מעכבי SAMHD1, מפעילים ומצעים.
כמו בכל בדיקות הסקר הביוכימיות במבחנה , ישנם מספר שלבים קריטיים ושיקולים חשובים, ורבים מהם נדונים לעומק במדריך ההדרכה39 הזמין בחינם. שלמות האנזימים הרקומביננטיים המטוהרים, הן SAMHD1 והן האנזים המצומד PPase אנאורגני, חשובה ביותר, ויש לאשר אותה לפני הקמת הבדיקה. ובהתאם לכך, כל טיהור חדש של אנזימים אלה צריך להיות כפוף לרמה מסוימת של בדיקות אצווה, שכן שינויים מאצווה לאצווה עלולים לגרום לחוסר עקביות בתוצאות. באופן אידיאלי, יש להשתמש בבדיקה ישירה אורתוגונלית, כגון HPLC, המאפשרת זיהוי הן של המצע והן של מוצר התגובה, כדי לאמת את פעילות dNTP triphosphohydrolase של SAMHD1 רקומביננטי מטוהר בשימוש.
באשר למגבלות של בדיקה זו, העיקרון הראשון הוא שהיא מודדת את פעילות dNTPase של SAMHD1 באופן עקיף, תוך ניצול הפעילות של PPase אנאורגני, שיש לה מספר השלכות. חשוב לוודא של-PPase יש פעילות מועטה, אם בכלל, כלפי נוקלאוטידים המשמשים בבדיקה, וכמו כן, שלמולקולות קטנות מעכבות שזוהו אין פעילות כלפי PPase. לכן, לגבי הקרנה, מסך נגדי נגד PPase יכול להיות שיקול חשוב. הנוכחות של PPase בתגובה גם עושה את זה קריטי להשתמש בבדיקה אורתוגונלית כדי לאשר את הממצאים. באשר למבחני פעילות ישירה, דווחו עד כה כמה מהם, כולל TLC 9,20,23 ו- HPLC 9,21, המזהים במדויק מיצוי מצע והיווצרות מוצרים. בנוסף, בדיקת b4NPP21, שהיא גם תפוקה גבוהה, יכולה לשמש לבדיקת מעכבים פוטנציאליים; עם זאת, זה לא אידיאלי לבדוק מצעים או activators allosteric. בדיקות ביופיזיקליות, כגון פלואורימטריית סריקה דיפרנציאלית (DSF), עליה דיווחנו בעבר עם SAMHD118, יכולות גם להיות חזקות במיוחד בזיהוי ואפיון ליגנדות. מגבלה נוספת של הבדיקה, במיוחד כפי שמוצג בהתקנה כאן לזיהוי מצעים ומפעילים, היא השימוש ב- dGTP אנלוגי dGTPαS שאינו ניתן להידרוליזה כמפעיל AS1 ו- AS2. בעוד שזה מאפשר הפעלה של SAMHD1 ללא פעילות נצפית בבדיקה, dGTPαS הוא מעכב תחרותי של SAMHD1, ולכן השימוש בריכוזים גבוהים ישבית את האנזים. ככל שהבנתנו את SAMHD1 תתקדם, מחקרים עתידיים יוכלו להשתמש במולקולות המאכלסות באופן בלעדי כל אתר של SAMHD1, ובכך לשלול בעיה פוטנציאלית זו.
כפי שהראינו כאן, שיטה זו היא רב-תכליתית וניתן להשתמש בה כדי לענות על מספר שאלות ביוכימיות. תיארנו שתי וריאציות של בדיקה זו, אחת לזיהוי רגולטורים אלוסטריים ומצעים של SAMHD1, והשנייה לאפיון מעכבים, אך ניתן לבצע התאמות נוספות. באשר למעכבים פוטנציאליים, בדיקה זו, בהיותה מבוססת צלחת מיקרווול, הופכת אותה למתאימה היטב למנגנון במורד הזרם של מחקרי פעולה39,40. באופן דומה, לאפיון נוסף של מצעים ורגולטורים אלוסטריים, ניתן להשתמש בטכניקה זו כדי לקבוע פרמטרים קינטיים של קטליזה, כפי שביצענו עבור מטבוליט פעיל של cytarabine ו clofarabine7. עם זאת, חסרון אחד הוא שהבדיקה המצומדת לאנזימים המדווחת כאן היא בדיקת נקודות קצה, ולכן, למרות שהיא מתאימה היטב לבדיקה, בדיקה רציפה תתאים יותר לכמה מחקרים מכניסטיים. ארנולד ועמיתיו דיווחו על בדיקה רציפה מצומדת אנזימים המשתמשת בחיישן הביולוגי MDCC-PBP6, המסתמך על השימוש בחלבון קושר פוספט פריפלסמי (PBP) המסומן עם פלואורופור קומרין מלימיד (MDCC) שיכול להיקשר לקבוצת פוספט חופשי. MDCC-PBP רגיש מאוד ומאפשר כימות של ריכוזי פוספט נמוכים מאוד, כאשר זמן התגובה של החיישן הוא בטווח הזמן של אלפית השנייה עד השנייה.
SAMHD1 ממלא מספר תפקידים חשובים בבריאות האדם ובמחלות2 , שרבים מהם עשויים להיות קשורים לתפקידו המרכזי בשמירה על רמות dNTP תוך-תאיות1. לפיכך, זיהוי של בדיקה כימית איכותית לקראת פעילות dNTPase של SAMHD1 יהיה כלי רב עוצמה בהגדרת קישורים אלה, והבדיקה המצומדת לאנזים המדווחת כאן יכולה לשמש בקלות לזיהוי בדיקות כאלה. יתר על כן, כתרופות מבוססות נוקלאוזידים, שרבות מהן מווסתות על ידי SAMHD1, הן קבוצה מגוונת וחשובה של טיפול41; בדיקות כימיות יכולות להיות מפותחות עוד יותר לתרופות כדי להתמקד SAMHD1 בסביבה הקלינית, במטרה לשפר את היעילות של טיפולים אלה. כמו כן, חיוני להבין את מלוא היקף האינטראקציה של תרכובות מבוססות נוקלאוזידים אלה עם SAMHD1, שאלה שניתן להתייחס אליה גם באמצעות בדיקה מצומדת אנזימים זו. ביחד, בדיקת הפעילות SAMHD1 המצומדת לאנזים, כפי שדווחה כאן, היא בדיקת עלות, רב-תכליתית ובעלת תפוקה גבוהה שניתן להשתמש בה כדי לקדם את הבנתנו את האנזים החשוב הזה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לתומאס לונדבק ולחברי מעבדתו של תומאס הלדיי על הייעוץ והתמיכה. חלק מעבודה זו הונחה על ידי המתקן למדעי החלבונים במכון קרולינסקה / SciLifeLab (http://ki.se/psf), ואנו מכירים במכון הלאומי לסרטן (NCI), המחלקה לטיפול ואבחון סרטן (DCTD) והתוכנית הטיפולית ההתפתחותית (DTP) (http://dtp.cancer.gov) על אספקת תרכובת. המימון ניתן על ידי מענקים שהוענקו ל- SGR ממועצת המחקר השבדית (2018-02114), האגודה השבדית לסרטן (19-0056-JIA, 20-0879-PJ), הקרן השבדית לסרטן ילדים (PR2019-0014) ומכון קרולינסקה.
Materials
| Name | Company | Catalog Number | Comments |
| 2'-deoxyadenosine-5'-triphosphate (dATP) | Jena bioscience | NU-1001 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-deoxycytidine-5'-triphosphate (dCTP) | Jena bioscience | NU-1002 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-Deoxyguanosine-5'-(α-thio)-triphosphate (dGTPαS) | Jena bioscience | NU-424 | Non-hydrolyzable dGTP analogue for SAMHD1 activator/substrate assay |
| 2'-deoxyguanosine-5'-triphosphate (dGTP) | GE Healthcare | 27-1870-04 | SAMHD1 allosteric activator and substrate used in inhibition assay and activator/substrate assay |
| 2'-Deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP) | Jena bioscience | NU-907-1 | Compound tested in SAMHD1 inhibition assay |
| 2'-deoxythymidine-5'-triphosphate (dTTP) | Jena bioscience | NU-1004 | Compound tested in SAMHD1 activator/substrate assay |
| 2'Deoxyguanosine mohohydrate (dGuo) | Sigma-Aldrich | D0901 | Compound tested in SAMHD1 inhibition assay |
| 384 well clear flat-bottom microplate | Thermo Fisher Scientific | 262160 | Assay plate |
| 96 well clear U-bottom polypropylene microplate | Thermo Fisher Scientific | 267245 | Compound dilution plate |
| Ammonium heptamolybdate tetrahydrate | Sigma-Aldrich | A1343 | Reagent required for malachite green working reagent |
| ara-Cytidine-5'-triphosphate (ara-CTP) | Jena bioscience | NU-1170 | Compound tested in SAMHD1 activator/substrate assay |
| Clofarabine-5'-triphosphate (Cl-F-ara-ATP) | Jena bioscience | NU-874 | Compound tested in SAMHD1 activator/substrate assay |
| Dimethyl sulphoxide (DMSO) | VWR | 23486.297 | Solvent |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich | E5134 | EDTA stop solution component |
| Gemcitabine-5'-triphosphate (dF-dCTP) | Jena bioscience | NU-1607 | Compound tested in SAMHD1 activator/substrate assay |
| GraphPad Prism | GraphPad Software | Prism 8 | Data analysis and visualisation |
| Guanosine 5′-triphosphate (GTP) sodium salt hydrate | Sigma-Aldrich | G8877 | Allosteric activator for SAMHD1 activator/substrate assay |
| His-tagged E. coli inorganic pyrophosphatase (PPase) | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant PPase protein, hydrolises inorganic triphosphate and pyrophosphate to orthophosphate so it can form complex with malachite green |
| His-tagged human SAMHD1 | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant SAMHD1 protein, hydrolizes dNTPs into its corresponding nucleoside and inorganic triphosphate |
| Hydroxyurea | Sigma-Aldrich | H8627 | Compound tested in SAMHD1 inhibition assay |
| Lomofungin | National Cancer Institute (NCI)/Division of Cancer Treatment and Diagnosis (DCTD)/Developmental Therapeutics Program (DTP) | NSC106995 | Compound tested in SAMHD1 inhibition assay |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | SAMHD1 reaction buffer component |
| Malachite green Carbinol hydrochloride | Sigma-Aldrich | 213020 | Malachite green stock component |
| Microplate Reader | Hidex | Hidex Sense Microplate reader | Data acquisition, absorption read at 630 nm wavelength |
| Sodium Chloride (NaCl) | Sigma-Aldrich | 31434 | SAMHD1 reaction buffer component |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 567530 | SAMHD1 reaction buffer component |
| Sodium phosphate (Na3PO4) | Sigma-Aldrich | 342483 | Required for phosphate standard curve |
| Sulphuric acid 95-97% | Sigma-Aldrich | 84720 | Malachite green stock component |
| Tris-Acetate salt | Sigma-Aldrich | T1258 | SAMHD1 reaction buffer component |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) | Sigma-Aldrich | C4706 | SAMHD1 reaction buffer component |
| Tween-20 | Sigma-Aldrich | P1379 | SAMHD1 reaction buffer and malachite green working reagent component |
References
- Franzolin, E., et al. The deoxynucleotide triphosphohydrolase SAMHD1 is a major regulator of DNA precursor pools in mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14272-14277 (2013).
- Coggins, S. A., Mahboubi, B., Schinazi, R. F., Kim, B. SAMHD1 functions and human diseases. Viruses. 12 (4), 382(2020).
- Goldstone, D. C., et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase. Nature. 480 (7377), 379-382 (2011).
- Powell, R. D., Holland, P. J., Hollis, T., Perrino, F. W. Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase. The Journal of Biological Chemistry. 286 (51), 43596-43600 (2011).
- Morris, E. R., Taylor, I. A. The missing link: Allostery and catalysis in the anti-viral protein SAMHD1. Biochemical Society Transactions. 47 (4), 1013-1027 (2019).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2015).
- Herold, N., et al. Targeting SAMHD1 with the Vpx protein to improve cytarabine therapy for hematological malignancies. Nature Medicine. 23 (2), 256-263 (2017).
- Schneider, C., et al. SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia. Nature Medicine. 23 (2), 250-255 (2017).
- Hollenbaugh, J. A., et al. Substrates and inhibitors of SAMHD1. PloS One. 12 (1), 0169052(2017).
- Knecht, K. M., et al. The structural basis for cancer drug interactions with the catalytic and allosteric sites of SAMHD1. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10022-10031 (2018).
- Oellerich, T., et al. Selective inactivation of hypomethylating agents by SAMHD1 provides a rationale for therapeutic stratification in AML. Nature Communications. 10 (1), 3475(2019).
- Herold, N., et al. SAMHD1 protects cancer cells from various nucleoside-based antimetabolites. Cell Cycle. 16 (11), 1029-1038 (2017).
- Rothenburger, T., et al. SAMHD1 is a key regulator of the lineage-specific response of acute lymphoblastic leukaemias to nelarabine. Communications Biology. 3 (1), 324(2020).
- Ordonez, P., et al. SAMHD1 enhances nucleoside- analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824(2017).
- Castellví, M., et al. Pharmacological modulation of SAMHD1 activity by CDK4/6 inhibitors improves anticancer therapy. Cancers. 12 (3), 713-719 (2020).
- Rassidakis, G. Z., et al. Low-level expression of SAMHD1 in acute myeloid leukemia (AML) blasts correlates with improved outcome upon consolidation chemotherapy with high-dose cytarabine-based regimens. Blood Cancer Journal. 8 (11), 98(2018).
- Rudd, S. G., Schaller, T., Herold, N. SAMHD1 is a barrier to antimetabolite-based cancer therapies. Molecular & Cellular Oncology. 4 (2), 1287554(2017).
- Rudd, S. G., et al. Ribonucleotide reductase inhibitors suppress SAMHD1 ara-CTPase activity enhancing cytarabine efficacy. EMBO Molecular Medicine. 41, 10419(2020).
- Seamon, K. J., et al. Small molecule inhibition of SAMHD1 dNTPase by tetramer destabilization. Journal of the American Chemical Society. 136 (28), 9822-9825 (2014).
- Seamon, K. J., Stivers, J. T. A high-throughput enzyme-coupled assay for SAMHD1 dNTPase. Journal of Biomolecular Screening. 20 (6), 801-809 (2015).
- Mauney, C. H., Perrino, F. W., Hollis, T. Identification of inhibitors of the dNTP triphosphohydrolase SAMHD1 using a novel and direct high-throughput assay. Biochemistry. 57 (47), 6624-6636 (2018).
- Morris, E. R., et al. Crystal structures of SAMHD1 inhibitor complexes reveal the mechanism of water-mediated dNTP hydrolysis. Nature Communications. 11 (1), 3165(2020).
- Hansen, E. C., Seamon, K. J., Cravens, S. L., Stivers, J. T. GTP activator and dNTP substrates of HIV-1 restriction factor SAMHD1 generate a long-lived activated state. Proceedings of the National Academy of Sciences of the United States of America. 111 (18), 1843-1851 (2014).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Hyun, M., Bohr, V. A., Ahn, B. Biochemical characterization of the WRN-1 RecQ helicase of Caenorhabditis elegans. Biochemistry. 47 (28), 7583-7593 (2008).
- Lin, H. -H., Huang, C. -Y. Characterization of flavonol inhibition of DnaB helicase: real-time monitoring, structural modeling, and proposed mechanism. Journal of Biomedicine & Biotechnology. 2012 (4), 735368(2012).
- Yang, M., Wang, G. ATPase activity measurement of DNA replicative helicase from Bacillus stearothermophilus by malachite green method. Analytical Biochemistry. 509, 46-49 (2016).
- Allard, B., Cousineau, I., Spring, K., Stagg, J. Measurement of CD73 enzymatic activity using luminescence-based and colorimetric assays. Methods in Enzymology. 629, 269-289 (2019).
- Lee, M., et al. Structure-activity relationship of sulfonyl piperazine LpxH inhibitors analyzed by an LpxE-coupled malachite green assay. ACS Infectious Diseases. 5 (4), 641-651 (2019).
- Carreras-Puigvert, J., et al. A comprehensive structural, biochemical and biological profiling of the human NUDIX hydrolase family. Nature Communications. 8 (1), 1541(2017).
- Valerie, N. C. K., et al. NUDT15 hydrolyzes 6-thio-deoxyGTP to mediate the anticancer efficacy of 6-thioguanine. Cancer Research. 76 (18), 5501-5511 (2016).
- Carter, M., et al. Human NUDT22 Is a UDP-glucose/galactose hydrolase exhibiting a unique structural fold. Structure. 26 (2), 295-303 (2018).
- Gad, H., et al. MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool. Nature. 508 (7495), 215-221 (2014).
- Page, B. D. G., et al. Targeted NUDT5 inhibitors block hormone signaling in breast cancer cells. Nature Communications. 9 (1), 250(2018).
- Zhang, S. M., et al. Development of a chemical probe against NUDT15. Nature Chemical Biology. 16 (10), 1120-1128 (2020).
- Michel, M., et al. In silico druggability assessment of the NUDIX hydrolase protein family as a workflow for target prioritization. Frontiers in Chemistry. 8, 443(2020).
- Zhang, J., Chung, T., Oldenburg, K. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67(1999).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Markossian, S., et al. Assay guidance manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , Bethesda (MD). (2004).
- Holdgate, G. A., Meek, T. D., Grimley, R. L. Mechanistic enzymology in drug discovery: a fresh perspective. Nature Reviews Drug Discovery. 17 (2), 115-132 (2018).
- Tsesmetzis, N., Paulin, C. B. J., Rudd, S. G., Herold, N. Nucleobase and nucleoside analogues: resistance and re-sensitisation at the level of pharmacokinetics, pharmacodynamics and metabolism. Cancers. 10 (7), 240(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved