Method Article
低分子とdNTPase SAMHD1の相互作用を調べるためのハイスループット酵素共役活性アッセイ
要約
SAMHD1は、ヒトの健康と疾患に重要な役割を果たすデオキシヌクレオシド三リン酸トリホスホヒドロラーゼです。ここでは、低分子およびヌクレオチド類似体をSAMHD1基質、活性化剤、および阻害剤として評価できる、384ウェルマイクロプレートフォーマットで展開された汎用性の高い酵素共役SAMHD1活性アッセイを紹介します。
要約
無菌アルファモチーフおよびHDドメイン含有タンパク質1(SAMHD1)は、この酵素がdNTPを対応するヌクレオシドおよび無機三リン酸に加水分解できるため、細胞内デオキシヌクレオシド三リン酸(dNTP)プールの極めて重要な調節因子です。ヌクレオチド代謝におけるその重要な役割、いくつかの病理学との関連、および治療抵抗性におけるその役割のために、この酵素の調節と細胞機能の両方をよりよく理解するために現在集中的な研究が行われています。このため、アロステリックレギュレーター、基質、阻害剤など、SAMHD1との低分子相互作用を調べるためのシンプルで安価なハイスループット対応法の開発が不可欠です。この目的のために、酵素結合マラカイトグリーンアッセイは、SAMHD1活性の間接的な測定を可能にする384マイクロウェルプレートフォーマットで展開できるシンプルで堅牢な比色アッセイです。SAMHD1はヌクレオチド基質から三リン酸基を放出するため、この反応にピロホスファターゼ活性を結合させ、それによって無機リン酸を生成し、リンモリブデン酸マラカイトグリーン複合体の形成を通じてマラカイトグリーン試薬で定量することができます。本稿では、SAMHD1の既知の阻害剤を特徴づけ、SAMHD1の非標準基質の触媒作用に関与するメカニズムと、ヌクレオシド系抗がん剤に代表されるアロステリック活性化因子による調節に関与するメカニズムを解読するためのこの方法論の応用を示します。したがって、酵素共役マラカイトグリーンアッセイは、SAMHD1を研究するための強力なツールであり、さらに、リン酸塩種を放出するいくつかの酵素の研究にも利用することができます。
概要
無菌アルファモチーフとヒスチジン-アスパラギン酸ドメイン含有タンパク質1(SAMHD1)は、哺乳類細胞1のヌクレオチドホメオスタシスの中心的な調節因子であり、ヒトの健康と疾患2に多くの役割を果たしています。この酵素は、デオキシヌクレオシド三リン酸(dNTP)を加水分解して同族のデオキシヌクレオシド分子と無機三リン酸分子に分解することができ3,4、この活性は(d)NTPの存在量によってアロステリックに制御されています(参考文献5でレビュー)。各SAMHD1モノマーは、2つのアロステリック部位(AS1およびAS2)と1つの触媒部位を含み、活性酵素の形成には、(d)NTP結合時にホモ四量体の秩序ある集合が必要です。SAMHD1モノマーの二量体化は、まずグアニン三リン酸(GTPまたはdGTP)のAS1への結合によって引き起こされ、その後の四量体化は、追加のdNTP分子がAS2に結合することで達成され、触媒部位への基質アクセスとその後の加水分解が可能になります。
SAMHD1基質には、ウイルス感染症や癌の治療に使用されるいくつかのヌクレオシドベースの薬剤の三リン酸代謝物を含む、いくつかの塩基および糖修飾ヌクレオチドとともに、4つの標準的なdNTP3,4が含まれ、そのうちのいくつかはアロステリック活性化因子としても機能します6,7,8,9,10,11 .その結果、SAMHD1は、疾患モデル7、8、9、10、11、12、13、14、15においてこれらの化合物の多くの有効性を調節し、さらに、急性骨髄性白血病(AML)の標準治療として何十年にもわたって維持されてきたデオキシシチジン類似体シタラビン(ara-C)の場合、実際にこの病気の治療効果7,8,16。したがって、SAMHD1は、ヌクレオシドベースの治療の有効性を向上させるための潜在的なバイオマーカーおよび治療標的であり17、したがって、私たちと他の人は、細胞内でSAMHD1を不活性化する戦略を特定しようとしてきました。我々は、がん細胞内でSAMHD1を分解する生物学的阻害剤としてウイルスプロテインX(Vpx)を用いることを提案したが7、このアプローチには多くの限界があり(参考文献12で議論)、我々は最近、リボヌクレオチドレダクターゼの阻害を介してSAMHD1活性を抑制する間接的なアプローチを報告し、AMLの様々なモデルで実証した18.多くの研究がSAMHD1を直接阻害できる低分子を同定しようとしており、現在までにそのような分子がいくつか報告されていますが、in vitroでの阻害しか報告されていません6,9,19,20,21,22。その結果、細胞内のSAMHD1活性を強力に阻害する低分子の欠如と、ヌクレオシドベースの治療薬のSAMHD1触媒作用の複雑なメカニズムが相まって、さらなる研究の必要性が強調されています。したがって、SAMHD1 との低分子相互作用をプローブするための頑健で理想的にハイスループットな方法は、この臨床的に重要な酵素の基質、アロステリック調節因子および阻害剤を同定するために理想的です。
薄層クロマトグラフィー(TLC)9,20,23や高速液体クロマトグラフィー(HPLC)9,21など、SAMHD1のdNTPase活性を直接測定する方法論はいくつかありますが、これらはハイスループットセットアップに容易には適していません。1つの例外は、Mauneyらによって報告されたアッセイであり、これは、Mn2+が活性化カチオンとして使用されるときに、ビス(4−ニトロフェニル)リン酸(b4NPP)をp−ニトロフェノールおよびp−ニトロフェニルホスフェートに加水分解するSAMHD1の能力を利用し、マイクロウェルプレート21において容易に測定することができる比色変化をもたらす。このアッセイは、SAMHD1阻害剤の同定と特性評価に使用されていますが、加水分解は、(d)NTP活性化剤の非存在下および非生理学的活性化カチオンの存在下で発生することに注意する必要があります。これにより、このアッセイはSAMHD1のアロステリック制御因子の研究と同定に適しにくくなります。
これに関連して、このレポートで詳述されているように、マラカイトグリーン試薬と組み合わせた酵素結合アプローチは、SAMHD1のdNTPase活性を間接的に測定し、さらに、さまざまな低分子がSAMHD1に及ぼす影響を調べるための汎用性の高い方法となり得ます。マラカイトグリーンアッセイは、620 nmで測定される比色変化をもたらすモリブドリン酸錯体の形成に基づく、遊離無機リン酸(Pi)を検出するための堅牢で信頼性の高い比色技術です24。SAMHD1の加水分解はヌクレオチド基質から三リン酸基を遊離させるため、マラカイトグリーン試薬を添加する前に、この反応を遊離無機リン酸を生成する(パイロ)ホスファターゼ活性と結合させる必要があります。マラカイトグリーンアッセイは高感度で費用対効果が高く、反応中またはカップリング酵素の存在下で無機リン酸基を放出する酵素の阻害剤および基質の同定および特性評価に広く使用されています。ヘリカーゼ25,26,27のATPase活性の特性評価や、AMPのアデノシンおよび無機リン酸への分解を媒介するCD73酵素活性の研究に広く適用されています28。さらに、結合すると、ほとんどのグラム陰性病原体に必須の酵素であるUDP-2,3-ジアシルグルコサミンピロホスファターゼLpxHを標的とする抗生物質の発見にも使用されています29。がん研究に関しては、基質30,31,32の特性評価と、薬物および化学プローブ33,34,35,36の同定と開発の両方において、ヌクレオチド代謝酵素ファミリーであるNUDIX加水分解酵素に対して、酵素共役アプローチが広く展開されています。
dNTPase SAMHD1に関しては、このアプローチがいくつかの報告で利用されています。 出芽酵母由来のエキソポリホスファターゼPpx1をカップリング酵素として使用し、このアッセイを使用して、SAMHD1の基質、活性化因子、または阻害剤としていくつかのヌクレオチド類似体を試験し、抗白血病薬クロファラビンの三リン酸代謝産物を活性化因子および基質6として同定しました。さらに、大 腸菌 由来の無機ピロホスファターゼをカップリング酵素として用いることで、阻害剤を同定するためのSAMHD1に対する臨床的に承認された化合物のライブラリーのスクリーニングに用いられている20。本研究では、このアプローチを用いて、ara-Cの活性代謝物であるara-CTPがSAMHD1基質であるが、アロステリックアクチベーターではないことを示し7 、その後、このアッセイを用いて、SAMHD1依存的にAMLモデルをara-Cに感作できるいくつかの低分子が、実際にはSAMHD1を直接阻害しないことを示した18。このレポートでは、SAMHD1の阻害剤、活性化剤、および基質の同定に、この汎用性の高い分析法を詳述し、ハイスループットに適したセットアップでその適用性を実証します。
プロトコル
以下の分析法の概略図を 図 1 に示し、材料と試薬の詳細なリストを 材料表に示します。
1. アッセイバッファーの調製
- ストックバッファーの調製。
注:このアッセイは、ありふれたリン酸塩の検出に敏感であるため、汚染を避けるために、ガラス器具を超純水または二重蒸留水で3回すすぎます。すべてのバッファーは室温(RT)で保存できます。- 4.5 gのTris Acetate、2.3 gのNaCl、および0.2 gのMgCl2を約800 mLの水に溶解して、1 LのSAMHD1反応バッファー(RB)ストック溶液(25 mM Tris-Acetate pH 8、40 mM NaCl、1 mM MgCl2)を調製し、pH 8および最終容量に調整します。
- 1 mL の 0.5 M TCEP を 4 mL の水に希釈して、5 mL の 0.1 M TCEP ストック溶液を調製します。
- 5 mL の 100% Tween-20 を 44.5 mL の水に希釈して、50 mL の 11% Tween-20 ストック溶液を調製します。
注意: Tween-20は光に敏感です。 - 9.3 g の EDTA を約 40 mL の水に溶解して 50 mL の 0.5 M EDTA 停止液を調製し、pH 8 および最終容量に調整します。
- 茶色のガラス瓶内の300 mLの水に60 mLの濃硫酸をゆっくりと加えて、マラカイトグリーン(MG)原液(3.2 mMマラカイトグリーン、H2SO4)を調製します。溶液をRTに冷却し、0.44gのマラカイトグリーンを溶解します。
注意: 硫酸と水の反応は発熱性であるため、ボトルが熱くなり、圧力が上昇する可能性があります。この圧力が頻繁に解放されるようにしてください。
注:得られたオレンジ色の溶液は感光性(したがって茶色のボトル)で、室温で少なくとも1年間安定しています。 沈殿物は時間の経過とともに形成される可能性があるため、上清のみを使用してください。 - 3.75gのモリブデン酸アンモニウムを50mLの水に溶解して、50 mLの7%モリブデン酸アンモニウムストック溶液を調製します。
注意: 沈殿物は時間の経過とともに形成される可能性があるため、上澄みのみが使用されていることを確認してください。
- 完全なアッセイバッファーの調製
注:これは実験当日に行う必要があります- 完全なSAMHD1 RB(25 mM Tris-Acetate pH 8、40 mM NaCl、1 mM MgCl2、0.3 mM TCEP、0.005% Tween-20)を調製します。事前に調製した 11% Tween-20 および 0.1 M TCEP ストックを使用して、これらの成分を最終濃度 Tween-20 で 0.005%、TCEP で 0.3 mM で SAMHD1 RB ストックに添加します。
- EDTA停止溶液(25 mM Tris-Acetate pH 8、40 mM NaCl、1 mM MgCl2、0.3 mM TCEP、0.005% Tween-20、7.9 mM EDTA)を調製します。SAMHD1 RB を完成するには、0.5 M EDTA ストック溶液を使用して、最終濃度 7.9 mM になるまで EDTA を添加します。
- MG原液10部を7%モリブデン酸アンモニウム2.5部および11%Tween-20000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000
2. SAMHD1阻害アッセイおよび化合物IC50の定量
注:最終的なアッセイ条件を 表1に示します。
- アッセイプレートでの化合物の調製
注:低分子量化合物は通常、100%DMSOおよびヌクレオチド類似体に水に溶解します。ストック濃度は10〜100 mMの範囲で、化合物の効力と溶解度、およびアッセイのDMSO耐性の影響を受けます。反応液中の最終的なDMSO濃度が1%を超えないようにし、酵素活性がこの溶媒の影響を受けないようにしてください。実験の前に、溶媒に対するアッセイの耐性をテストすることをお勧めします。- マルチチャンネルピペットまたは自動リキッドハンドリング装置を使用して、透明な丸底ポリプロピレン製96ウェルプレートで、関連する溶媒(低分子の場合は100%DMSO、ヌクレオチド類似体の場合は水など)で最終濃度100倍に段階希釈した試験化合物を調製します。
注:化合物の安定性に応じて、希釈プレートを事前に調製し、密封し、-20°Cで保存することができます。 プロトコルを続行する前に、プレートをRTに平衡化させます。 - 完全な SAMHD1 RB を使用して、化合物を最終濃度の 25 倍に希釈し(最終溶媒濃度を 1% 未満に維持するため)、透明な 384 ウェル平底アッセイプレートの適切なウェルに 5 μL を移します。溶媒のみのコントロールサンプルでこの手順を繰り返します。
- マルチチャンネルピペットまたは自動リキッドハンドリング装置を使用して、透明な丸底ポリプロピレン製96ウェルプレートで、関連する溶媒(低分子の場合は100%DMSO、ヌクレオチド類似体の場合は水など)で最終濃度100倍に段階希釈した試験化合物を調製します。
- 反応成分の調製
注:これはアッセイの日に行う必要があります。組換えヒトSAMHD1および 大腸菌 ピロホスファターゼ(PPase)アリコートは、それぞれ9.1 mg/mLおよび23.0 mg/mLで希釈して-80°Cで保存バッファー(20 mM HEPES pH 7.5、300 mM NaCl、10%グリセロール、2 mM TCEP)で長期保存します。解凍後、アリコートは-20°Cで短期間保存されます。- 組換えヒトSAMHD1タンパク質および組換えPPaseを完全なSAMHD1 RBで目的の最終濃度の4倍(1.4 μM SAMHD1および50 U/mL PPase)に希釈して、酵素(SAMHD1/PPase)マスターミックスを調製します。
- dGTPストック(通常は10 mMまたは100 mMの水溶液)を完全なSAMHD1 RBで2倍の最終濃度(50 μM dGTP)に希釈して、アクチベーター/基質dGTPを調製します。
- アッセイの実行
注:すべてのアッセイ成分はRTに平衡化する必要があります。 液体添加は、マルチチャンネルピペットまたはバルク試薬リキッドディスペンサーのいずれかで行うことができます。- 化合物の希釈液と溶媒のみのコントロールを含む 384 ウェルアッセイプレートに、5 μL の SAMHD1/PPase マスターミックスを分注します。酵素コントロールウェルがない場合は、5 μL の完全 SAMHD1 RB を分注します。酵素と化合物を室温で10分間プレインキュベートします。
- すべてのウェルに、10 μL の 2x dGTP 溶液を分注して反応を開始します。
- 室温で反応液を20分間インキュベートします。
- 20 μLのEDTA停止溶液をすべてのウェルに分注して反応を停止します。
注: 必要に応じて、ここで実験を一時停止できます。 - 10 μLのMGワーキング溶液をすべてのウェルに加えます。
注意: MGワーキング溶液には硫酸が含まれています。 - 軌道マイクロウェルプレートシェーカーを使用してウェル内容物を混合し、1,000 x g で1分間遠心分離します。
- プレートを室温で20分間インキュベートします。
- 波長630 nmでの吸収をマイクロウェルプレートリーダーで読み取ります。
- データの可視化と分析
- ポジティブコントロールウェルとネガティブコントロールウェルの平均偏差と標準偏差を計算します(ポジティブ、溶媒との完全な反応、ネガティブ、溶媒とのdGTPのみ)。アッセイ品質の指標としてZファクター37を計算します。
- 各吸光度値をポジティブコントロールとネガティブコントロールの平均値に正規化し、ポジティブコントロールを 100% SAMHD1 活性、ネガティブコントロールを 0% SAMHD1 活性に設定します。
- SAMHD1 活性 (%) を化合物濃度の関数としてプロットし、4 パラメーター可変スロープの用量反応曲線に適合させることで、化合物 IC50 を決定できます。
3. SAMHD1活性剤および基質スクリーン
注:最終アッセイ条件を 表2に示します。組換えSAMHD1およびPPaseアリコートは、それぞれ9.1 mg/mLおよび23.0 mg/mLで希釈して-80°Cで保存バッファー(20 mM HEPES pH 7.5、300 mM NaCl、10%グリセロール、2 mM TCEP)で-80°Cで長期保存します。 解凍後、アリコートは-20°Cで短期間保存されます。
- アッセイプレートでのヌクレオチド類似体の調製
- ヌクレオチド類似体ストック(通常は水中10または100 mM)を完全なSAMHD1 RB(この場合は800 μMヌクレオチドアナログ)で最終濃度の4倍に希釈し、5 μLを384ウェルアッセイプレートの適切なウェルに移します。
- 反応成分の調製
注:これはアッセイの日に行う必要があります- 組換えヒトSAMHD1タンパク質および組換え大 腸菌 PPaseを完全なSAMHD1 RBで目的の最終濃度の2倍に希釈することにより、酵素(SAMHD1/PPase)マスターミックスを調製し、0.7 μMのSAMHD1および25 U/mL PPaseを調製します。
- 組換え 大腸菌 PPaseを完全なSAMHD1 RBで目的の最終濃度の2倍(25 U/mL)に希釈して、PPase単独溶液を調製します。
- 活性化剤GTP(AS1)およびdGTPαS(AS1およびAS2)を調製し、完全なSAMHD1 RBで最終濃度の4倍(50 μM GTPまたはdGTPαS)に希釈した原液(通常は10または100 mMの水溶液)を調製します。
- アッセイの実行
注:すべてのアッセイ成分はRTに平衡化する必要があります。 液体添加は、マルチチャンネルピペットまたはバルク試薬リキッドディスペンサーのいずれかで行うことができます。- ヌクレオチド類似体を含む 384 ウェルアッセイプレートに、5 μL のアクチベーター(GTP または dGTPαS)または完全な SAMHD1 RB を適切なウェルに分注します。
- 10 μL の SAMHD1/PPase マスターミックス、PPase 単独、または完全な SAMHD1 RB を適切なウェルに分注して反応を開始します。
- 室温で反応液を20分間インキュベートします。
- 20 μLのEDTA停止溶液をすべてのウェルに分注して反応を停止します。
注: 必要に応じて、ここで実験を一時停止できます。 - すべてのウェルに10 μLのMGワーキング溶液を加えます。
注意: MGワーキング溶液には硫酸が含まれています。 - 軌道マイクロウェルプレートシェーカーを使用してウェル内容物を混合し、1,000 x g で1分間遠心分離します。
- プレートを室温で20分間インキュベートします。
- 波長630 nmでの吸収をマイクロウェルプレートリーダーで読み取ります。
- データの可視化と分析
- PPaseのみの反応ウェル(ネガティブコントロールまたはバックグラウンドシグナル)の平均吸光度値を計算します。
注:SAMHD1アロステリックアクチベーターおよび基質のポジティブコントロールとして、dGTPをプレートに含めることができます。この場合、この条件を使用して、アッセイ品質の指標としてZファクターを計算できます。 - SAMHD1/PPase反応の対応するウェルからバックグラウンド値を差し引きます。
- バッファー、GTP、およびdGTPαS条件で各ヌクレオチドアナログの補正された吸光度値をプロットします。
- PPaseのみの反応ウェル(ネガティブコントロールまたはバックグラウンドシグナル)の平均吸光度値を計算します。
結果
図1に概説したプロトコールは、酵素共役マラカイトグリーンアッセイを利用して、低分子とdNTPase SAMHD1との相互作用を調べるための基本的なワークフローを説明しており、さまざまな生化学的疑問を解明するためにさまざまな方法で適応させることができます。以下の段落で説明する代表的な結果では、このアッセイを使用して、SAMHD1に対する低分子の阻害特性を決定し、異なるヌクレオチド類似体がこの酵素の基質および/または活性化因子であるかどうかをテストする例を示しています。
図 2 に示す結果は、このアッセイのいくつかの基本原理を示しています。マラカイトグリーン試薬は、リンモリブデン酸マラカイトグリーン錯体の形成による無機リン酸塩の比色検出を可能にするため、このアプローチは、生成物がリン酸塩である酵素反応の研究に適用できます。遊離無機リン酸塩を検出するためのこの分析法の感度を実証するために、図 2A は、マラカイト緑色試薬との 20 分間のインキュベーション後に Na3PO4 の濃度を増加させて得られた吸光度値を示しています。シグナルは0.25mMのNa3PO4で飽和に達するが、リン酸塩の線形検出範囲は0.004〜0.03mMで見え(図2A、右パネル)、マラカイトグリーンアッセイを用いて最大10〜20μMのリン酸塩の線形範囲を報告した他の研究と一致している38。
SAMHD1は、dNTP分子を加水分解する際に無機三リン酸を放出するdNTPaseであるため、マラカイトグリーンで検出するための遊離無機リン酸を生成するためには、カップリング酵素が必要です。大腸菌由来の無機ピロホスファターゼ(PPase)は、SAMHD1 7,20だけでなく、他のヌクレオチド代謝酵素30,33,35に関しても、この目的に有用であることが示されている。さらに、SAMHD1はホモ四量体として活性型dNTPaseであり、これには(d)NTP、具体的にはAS1のグアニン三リン酸(GTPまたはdGTP)とAS2の任意のdNTPによるアロステリック活性化が必要です。その後、触媒部位は基質結合のためにアクセス可能になり、酵素反応が起こります。dGTPはAS1およびAS2に結合するための要件を満たし、基質であるため、阻害アッセイにこのヌクレオチドを使用することでワークフローが大幅に簡素化されます。図 2B は、630 nm での吸光度の増加によって示される測定可能な SAMHD1 活性を達成するための、さまざまなアッセイ成分の要件を示しています。SAMHD1もPPaseも、dGTPの存在下では無機リン酸を生成することができず、これらの酵素の文書化された活性と一致しています。しかし、すべてのアッセイ成分(SAMHD1、PPase、およびdGTPアクチベーター/基質)が存在する状態では、シグナルの増加が観察されます。ここに示した例(酵素なし + dGTP をネガティブコントロール、SAMHD1/PPase + dGTP をポジティブコントロールとした場合)の Z 係数37 は 0.74 であり、頑健なアッセイであることを示しています。
酵素共役SAMHD1活性アッセイの潜在的な用途の1つは、ハイスループットスクリーニング(HTS)による阻害剤の同定です。したがって、このレポートでは、すでに文献に記載されている多様な化合物のセットを使用して、このアッセイでのSAMHD1阻害の検出を検証します。Seamonらは、ここに示されているのと同様のアッセイを用いて、SAMHD1に対するカノニカルヌクレオシドの用量依存的な阻害を評価し、デオキシグアノシン(dGuo)がSAMHD1を有意に阻害できる唯一のカノニカルヌクレオシドであり、IC50値は488μM20であることを発見しました。直接b4NPPアッセイで実施されたFDA承認薬物のHTSは、マイクロモル濃度でSAMHD1活性を阻害するいくつかのヒットを明らかにし、そこからロモファンギンはin vitroでSAMHD1 dNTPase活性を最も強力に阻害する分子であり、基質としてdGTPの存在下で測定すると20.1μMのIC50を示しました21.さらに、4つのα,β-imido-dNTP類似体は、MDCC-PBPセンサーとSAMHD1をPpx活性に結合させることでSAMHD1の競合阻害剤として同定され、dNMPNPP類似体の阻害定数が低マイクロモル/高ナノモルの範囲にあることが示されました6,22。したがって、酵素共役SAMHD1活性アッセイがSAMHD1阻害剤、dGuo、ロモファンギンおよび2'-デオキシチミジン-5'-[(α,β)-イミド]三リン酸(dTMPNPP)の同定に使用できることを実証するために、この技術を検証するために使用しました。図3Aは、これらの化合物について得られた用量反応曲線を示しており、濃度の上昇がSAMHD1活性を効果的に阻害することを示しています。3つの独立した実験から得られたこれらの分子の平均IC50値(標準偏差±)は、dGuo = 361.9 ± 72.8 μM、ロモファンギン6.78±3.9 μM、およびdTMPNPP = 2.10±0.9 μMであった。陰性結果の例として、SAMHD1活性に対するヒドロキシ尿素(HU)の影響も決定されました。HUはリボヌクレオチドレダクターゼの阻害剤であり、さまざまなAMLモデルでSAMHD1 ara-CTPase活性を制限しますが、SAMHD1に対するHUの影響は間接的であり、SAMHD1のアロステリック調節の攪乱に依存していることが示されました18。HUの用量反応曲線を図3Bに示し、HUの用量を増やしてもSAMHD1活性の変化は観察されず、HUがin vitroでSAMHD1活性を阻害しないことが実証された。
酵素結合SAMHD1活性アッセイの別の用途は、ヌクレオチドおよびその類似体がこの酵素の基質および/またはアロステリック活性化因子であるかどうかを調べることであり、これは 図4に示されています。この実験では、標準ヌクレオチド、およびシタラビン(ara-CTP)、クロファラビン(Cl-F-ara-ATP)、ゲムシタビン(dF-dCTP)などのいくつかの抗がんヌクレオシド類似体の活性代謝物を、SAMHD1基質および活性化剤として試験しました。SAMHD1の複雑なアロステリック制御により、AS1活性化因子としてのGTPまたはAS1およびAS2を占有する可能性のある非加水分解性dGTPアナログ2'-デオキシグアノシン-5'-(α-チオ)-三リン酸(dGTPαS)の存在下で反応が行われます。試験されたヌクレオチド類似体およびGTPの存在下でのSAMHD1活性は、ヌクレオチドが二次アロステリック部位および触媒部位(すなわち、AS2活性化因子および基質)に結合できることを示し、ヌクレオチド類似体およびdGTPαSによるSAMHD1活性は、ヌクレオチドが触媒部位(すなわち、基質のみ)のみを占有できることを示します。ヌクレオチドがAS1とAS2の両方のアロステリック部位と触媒部位に結合できる場合、dGTPの場合に示されるように、SAMHD1はヌクレオチドのみの存在下で活性を発揮します。この結果は、すべての標準的なdNTPがAS2部位と触媒部位に結合できることを示しています。ヌクレオチド類似体の場合、クロファラビン三リン酸はAS2活性化因子および基質であるのに対し、シタラビン三リン酸は触媒部位のみを占めることができる。一方、ゲムシタビン三リン酸では活性は観察されず、試験された条件下ではゲムシタビン三リン酸はアロステリックエフェクターまたは基質として作用できないことを示唆しています。この結果は以前の予測と一致しているが9、その後の結晶化と速度論的研究10 により、ゲムシタビン三リン酸がSAMHD1触媒ポケットに結合することができ、実際に酵素の基質であることが明らかになった。しかし、後者の研究10では、加水分解速度がシタラビン三リン酸などの他の報告された基質と比較してかなり低いことを示しており、このスクリーニング設定でこれを観察できなかった理由を説明しています。
全体として、これらの代表的な結果は、SAMHD1阻害剤、アロステリック調節因子、および基質の同定および特性評価のための堅牢な技術としての酵素共役SAMHD1活性アッセイの使用を実証しています。ただし、すべての実験的アプローチと同様に、この方法にも注意点があるため、直交アッセイ(異なるアッセイ技術を使用するなど)を使用して、所見をさらに検証する必要があります。
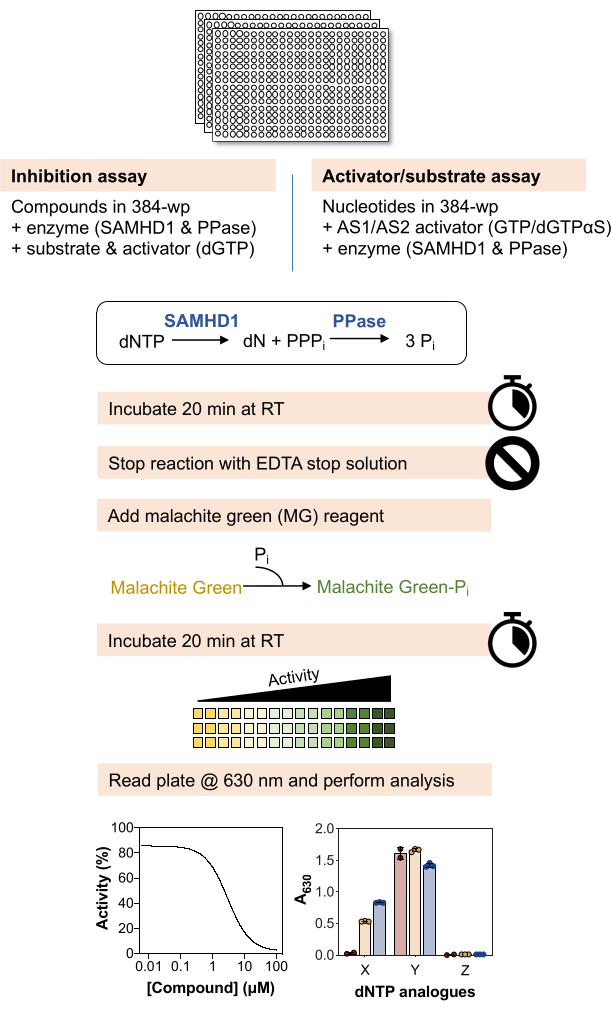
図1:この記事で説明するプロトコルの概略図。 この図の拡大版を表示するには、ここをクリックしてください。
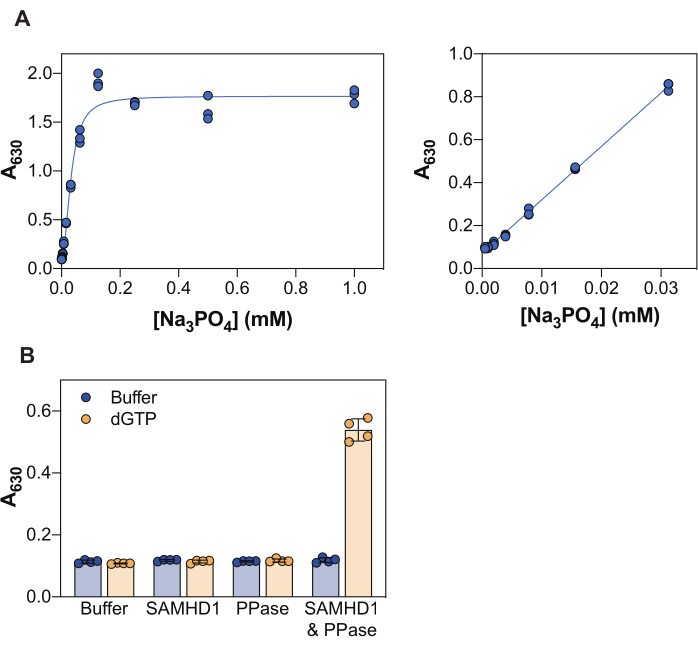
図2:酵素共役SAMHD1活性アッセイ。 (a)マラカイトグリーンアッセイにおけるNa3PO4標準曲線。 Na3PO4 段階希釈液(2 倍)を 1 mM から 0.004 mM まで 3 回に分けて調製し、マラカイト緑色試薬と 20 分間インキュベートしました。試験濃度の全範囲にわたる生の吸光度値は、左のパネルに、線形範囲は右のパネルに示されています。示されている2つの独立した実験の代表。(B)酵素共役活性アッセイのバリデーション。SAMHD1(0.35 μM)および/またはPPase(12.5 U/mL)を、アクチベーター/基質dGTP(25 μM)の存在下または非存在下で、酵素共役活性アッセイで20分間インキュベートしました。生の吸光度値をプロットした2つの独立した実験の代表的な4つ子、棒グラフ、およびエラーバーは平均とSDを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
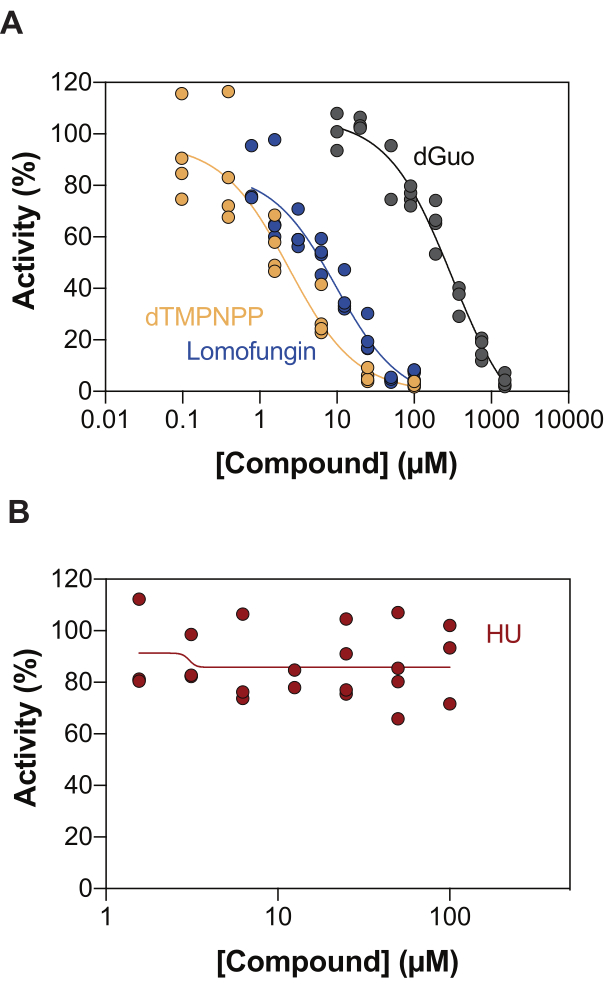
図3:酵素共役活性アッセイにおけるSAMHD1阻害化合物の評価。 活性化剤/基質としてdGTP(25μM)を用いた酵素結合SAMHD1活性アッセイにおけるロモファンギン(0.78-100μM)、2'-デオキシチミジン-5'-[(α,β)-イミド]三リン酸(dTMPNPP、0.01-100μM)およびデオキシグアノシン(dGuo、10-1,500μM)(A)またはヒドロキシ尿素(HU)(0.78-100μM)(B)の用量反応。個々の繰り返しからの反応コントロールに対する活性の割合をプロットし(DMSO + SAMHD1/PPase + dGTP = 100% 活性、DMSO + dGTP = 0% 活性)、3 つの実験の代表を示しました。 この図の拡大版をご覧になるには、ここをクリックしてください。
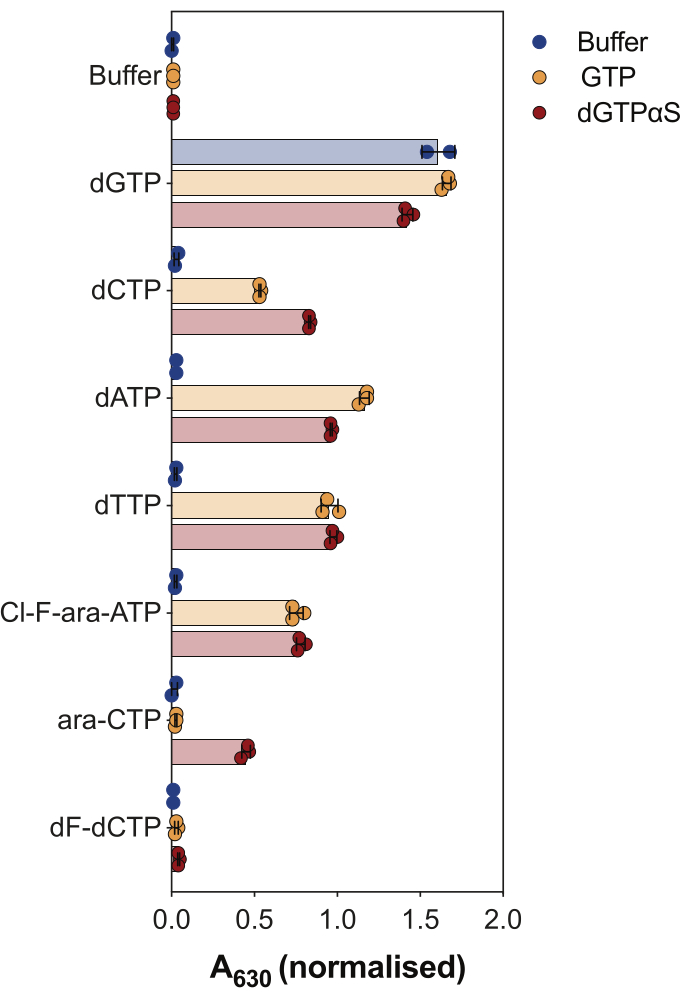
図4:酵素共役活性アッセイにおけるSAMHD1アロステリックアクチベーターおよび基質としてのヌクレオチド類似体の評価。 抗がん剤シタラビン(ara-CTP)、クロファラビン(Cl-F-ara-ATP)、およびゲムシタビン(dF-dCTP)の標準ヌクレオチドおよび選択された三リン酸代謝物を、GTPまたは非加水分解性dGTPアナログdGTPαS(12.5μM)の存在下または非存在下で、酵素結合SAMHD1活性アッセイで200 μMで試験しました。プロットされた個々の実験反復からの正規化された吸光度値、平均、およびSDが示されています。示されている2つの独立した実験の代表であり、以前の研究7から適応されています。 この図の拡大版をご覧になるには、ここをクリックしてください。
| 歩 | 試薬 | 分注量(μL) | 最終反応量(μL) | 分注濃度 | 反応による倍増希釈 | 反応中の最終濃縮 |
| 1 | 阻害 剤 | 5 | 20 | 0.4ミリメートル | 4 | 0.1ミリメートル |
| 2 | SAMHD1+PPaseミックス | 5 | 1.4 μM SAMHD1、50 U/mL PPase | 4 | 0.35 μM SAMHD1、12.5 U/mL Ppase | |
| 3 | dGTPの | 10 | 50μM | 2 | 25 μM | |
| 4 | 20分間のインキュベーション | |||||
| 5 | EDTAソリューション | 20 | 40 | 7.9ミリメートル | 2 | 3.95メートル |
| 6 | MG試薬 | 10 | 50 | 2.5 mM マラカイトグリーン、64.4 mM モリブデン酸アンモニウム、0.18% Tween-20 | 5 | 0.5 mM マラカイトグリーン、12.9 mM モリブデン酸アンモニウム、0.036% Tween-20 |
| 7 | 20分間のインキュベーション | |||||
| 8 | 読み取り@ 630 nm | |||||
表1:阻害剤スクリーニングのための酵素共役アッセイの最終条件の要約。
| 歩 | 試薬 | 分注量(μL) | 最終反応量(μL) | 分注濃度 | 反応による倍増希釈 | 反応中の最終濃縮 |
| 1 | アロステリックレギュレーター | 5 | 20 | 800μM | 4 | 200μM |
| 2 | GTP または dGTPαS | 5 | 50μM | 4 | 12.5μM | |
| 3 | SAMHD1および/またはPPase | 10 | 0.7 μM SAMHD1、25 U/mL PPase | 2 | 0.35 μM SAMHD1、12.5 U/mL PPase | |
| 4 | 20分間のインキュベーション | |||||
| 5 | EDTAソリューション | 20 | 40 | 7.9ミリメートル | 2 | 3.95メートル |
| 6 | MG試薬 | 10 | 50 | 2.5 mM マラカイトグリーン、64.4 mM モリブデン酸アンモニウム、0.18% Tween-20 | 5 | 0.5 mM マラカイトグリーン、12.9 mM モリブデン酸アンモニウム、0.036% Tween-20 |
| 7 | 20分間のインキュベーション | |||||
| 8 | 読み取り@ 630 nm | |||||
表2:アロステリックレギュレータースクリーニングのための酵素共役アッセイの最終条件の要約
ディスカッション
ここで詳述する酵素共役活性アッセイは、SAMHD1によるdNTP加水分解の間接的な測定を可能にするハイスループットで適した比色アッセイです。この方法では、 大腸菌由来の無機PPaseの能力を利用しており、反応混合物に過剰に含まれると、SAMHD1によって生成された各無機三リン酸を、シンプルで経済的なマラカイトグリーン試薬を使用して定量できる3つの個別の遊離リン酸に変換します。このアッセイは、化合物ライブラリーのスクリーニングに理想的な384マイクロウェルプレートフォーマットで提供し、SAMHD1阻害剤、活性化剤、および基質の同定および特性評価におけるこの手法の適用性と汎用性を実証しています。
すべての in vitro 生化学的スクリーニングアッセイと同様に、多くの重要なステップと重要な考慮事項があり、これらの多くは、無料で入手できる アッセイガイダンスマニュアル39で詳細に説明されています。精製された組換え酵素(SAMHD1と共役酵素無機PPaseの両方)の完全性は非常に重要であり、アッセイを確立する前に確認する必要があります。したがって、これらの酵素の新たな精製は、バッチ間のばらつきによって結果に矛盾が生じる可能性があるため、ある程度のバッチ試験を受ける必要があります。理想的には、基質と反応生成物の両方を検出できるHPLCなどの直交直接アッセイを使用して、使用する精製組換えSAMHD1のdNTPトリホスホヒドロラーゼ活性を検証する必要があります。
このアッセイの限界については、原理的な1つは、SAMHD1のdNTPase活性を間接的に測定し、無機PPaseの活性を利用することであり、これは多くの意味を持ちます。PPaseは、アッセイに用いたヌクレオチドに対してほとんど活性をもたず、同様に、同定された阻害性低分子はPPaseに対して活性を持たないことを確認することが重要です。したがって、スクリーニングに関しては、PPaseに対するカウンタースクリーニングが重要な考慮事項となり得ます。また、反応液中にPPaseが存在するため、直交アッセイを使用して所見を確認することも重要です。直接活性アッセイに関しては、TLC 9,20,23やHPLC 9,21など、基質の枯渇や生成物の形成を正確に検出する多くのアッセイがこれまでに報告されています。さらに、同じくハイスループットであるb4NPPアッセイ21は、潜在的な阻害剤の試験に用いることができる。ただし、基質やアロステリック活性剤の試験は理想的ではありません。SAMHD118で以前に報告した示差走査蛍光分析(DSF)などの生物物理学的アッセイも、リガンドの同定と特性評価において特に強力です。アッセイのもう1つの制限は、特に基質および活性化因子を同定するためのここでのセットアップに示されているように、AS1およびAS2活性化因子として非加水分解性dGTP類似体dGTPαSを使用することである。これにより、アッセイで観察可能な活性を示さずにSAMHD1を活性化できますが、dGTPαSはSAMHD1の競合阻害剤であるため、高濃度を使用すると酵素が不活性化されます。SAMHD1の理解が進むにつれて、今後の研究では、SAMHD1の各部位を独占的に占有する分子を利用することができ、この潜在的な問題が否定される可能性があります。
ここで示したように、この方法は用途が広く、多くの生化学的問題に対処するために使用できます。このアッセイには、SAMHD1のアロステリック調節因子および基質の同定用と、阻害剤の特性評価用の2つのバリエーションについて記載しましたが、さらなる適応が可能です。潜在的な阻害剤に関しては、このアッセイはマイクロウェルプレートベースであるため、下流の作用機序研究に適しています39,40。同様に、基質およびアロステリック調節因子のさらなる特性評価のために、この手法を使用して、シタラビンおよびクロファラビンの活性代謝物に対して行ったように、触媒作用の速度論的パラメータを決定することができます7。ただし、ここで報告されている酵素共役アッセイはエンドポイントアッセイであるため、スクリーニングには適していますが、一部の機構研究には連続アッセイの方が適しているという欠点があります。Arnoldらは、遊離リン酸基に結合できるクマリンマレイミド(MDCC)蛍光色素で標識されたペリプラズムリン酸結合タンパク質(PBP)の使用に依存するバイオセンサーMDCC-PBP6を利用する連続酵素共役アッセイを報告しました。MDCC-PBPは非常に感度が高く、非常に低いリン酸塩濃度の定量化が可能で、センサの応答時間はミリ秒から秒の時間スケールです。
SAMHD1は、ヒトの健康と疾患において多くの重要な機能を担っており2 、その多くは、細胞内dNTPレベルの維持における中心的な役割に関連している可能性があります1。したがって、SAMHD1のdNTPase活性に対する高品質の化学プローブの同定は、これらのリンクを定義するための強力なツールであり、ここで報告された酵素共役アッセイは、そのようなプローブを同定するために容易に使用できます。さらに、ヌクレオシドベースの薬剤として、その多くがSAMHD1によって調節されており、多様で重要な治療グループである41;化学プローブは、臨床現場でSAMHD1を標的とする薬剤にさらに開発され、これらの治療法の有効性を高めることが期待されます。また、これらのヌクレオシド系化合物とSAMHD1との相互作用の全容を理解することも重要であり、この酵素共役アッセイを利用して対処することもできます。まとめると、ここで報告されている酵素共役SAMHD1活性アッセイは、低コストで汎用性の高いハイスループットアッセイであり、この重要な酵素の理解を深めるために使用できます。
開示事項
著者は何も開示していません。
謝辞
Thomas Lundbäck氏とThomas Helleday氏の研究室のメンバーのアドバイスとサポートに感謝します。この研究の一部は、カロリンスカ研究所/サイライフラボ(http://ki.se/psf)のタンパク質科学施設によって促進され、米国国立がん研究所(NCI)、がん治療診断部門(DCTD)、および開発治療プログラム(DTP)(http://dtp.cancer.gov)が化合物を提供してくれたことに感謝します。資金は、スウェーデン研究評議会(2018-02114)、スウェーデンがん協会(19-0056-JIA、20-0879-PJ)、スウェーデン小児がん基金(PR2019-0014)、およびカロリンスカ研究所からSGRに授与された助成金によって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 2'-deoxyadenosine-5'-triphosphate (dATP) | Jena bioscience | NU-1001 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-deoxycytidine-5'-triphosphate (dCTP) | Jena bioscience | NU-1002 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-Deoxyguanosine-5'-(α-thio)-triphosphate (dGTPαS) | Jena bioscience | NU-424 | Non-hydrolyzable dGTP analogue for SAMHD1 activator/substrate assay |
| 2'-deoxyguanosine-5'-triphosphate (dGTP) | GE Healthcare | 27-1870-04 | SAMHD1 allosteric activator and substrate used in inhibition assay and activator/substrate assay |
| 2'-Deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP) | Jena bioscience | NU-907-1 | Compound tested in SAMHD1 inhibition assay |
| 2'-deoxythymidine-5'-triphosphate (dTTP) | Jena bioscience | NU-1004 | Compound tested in SAMHD1 activator/substrate assay |
| 2'Deoxyguanosine mohohydrate (dGuo) | Sigma-Aldrich | D0901 | Compound tested in SAMHD1 inhibition assay |
| 384 well clear flat-bottom microplate | Thermo Fisher Scientific | 262160 | Assay plate |
| 96 well clear U-bottom polypropylene microplate | Thermo Fisher Scientific | 267245 | Compound dilution plate |
| Ammonium heptamolybdate tetrahydrate | Sigma-Aldrich | A1343 | Reagent required for malachite green working reagent |
| ara-Cytidine-5'-triphosphate (ara-CTP) | Jena bioscience | NU-1170 | Compound tested in SAMHD1 activator/substrate assay |
| Clofarabine-5'-triphosphate (Cl-F-ara-ATP) | Jena bioscience | NU-874 | Compound tested in SAMHD1 activator/substrate assay |
| Dimethyl sulphoxide (DMSO) | VWR | 23486.297 | Solvent |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich | E5134 | EDTA stop solution component |
| Gemcitabine-5'-triphosphate (dF-dCTP) | Jena bioscience | NU-1607 | Compound tested in SAMHD1 activator/substrate assay |
| GraphPad Prism | GraphPad Software | Prism 8 | Data analysis and visualisation |
| Guanosine 5′-triphosphate (GTP) sodium salt hydrate | Sigma-Aldrich | G8877 | Allosteric activator for SAMHD1 activator/substrate assay |
| His-tagged E. coli inorganic pyrophosphatase (PPase) | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant PPase protein, hydrolises inorganic triphosphate and pyrophosphate to orthophosphate so it can form complex with malachite green |
| His-tagged human SAMHD1 | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant SAMHD1 protein, hydrolizes dNTPs into its corresponding nucleoside and inorganic triphosphate |
| Hydroxyurea | Sigma-Aldrich | H8627 | Compound tested in SAMHD1 inhibition assay |
| Lomofungin | National Cancer Institute (NCI)/Division of Cancer Treatment and Diagnosis (DCTD)/Developmental Therapeutics Program (DTP) | NSC106995 | Compound tested in SAMHD1 inhibition assay |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | SAMHD1 reaction buffer component |
| Malachite green Carbinol hydrochloride | Sigma-Aldrich | 213020 | Malachite green stock component |
| Microplate Reader | Hidex | Hidex Sense Microplate reader | Data acquisition, absorption read at 630 nm wavelength |
| Sodium Chloride (NaCl) | Sigma-Aldrich | 31434 | SAMHD1 reaction buffer component |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 567530 | SAMHD1 reaction buffer component |
| Sodium phosphate (Na3PO4) | Sigma-Aldrich | 342483 | Required for phosphate standard curve |
| Sulphuric acid 95-97% | Sigma-Aldrich | 84720 | Malachite green stock component |
| Tris-Acetate salt | Sigma-Aldrich | T1258 | SAMHD1 reaction buffer component |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) | Sigma-Aldrich | C4706 | SAMHD1 reaction buffer component |
| Tween-20 | Sigma-Aldrich | P1379 | SAMHD1 reaction buffer and malachite green working reagent component |
参考文献
- Franzolin, E., et al. The deoxynucleotide triphosphohydrolase SAMHD1 is a major regulator of DNA precursor pools in mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14272-14277 (2013).
- Coggins, S. A., Mahboubi, B., Schinazi, R. F., Kim, B. SAMHD1 functions and human diseases. Viruses. 12 (4), 382(2020).
- Goldstone, D. C., et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase. Nature. 480 (7377), 379-382 (2011).
- Powell, R. D., Holland, P. J., Hollis, T., Perrino, F. W. Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase. The Journal of Biological Chemistry. 286 (51), 43596-43600 (2011).
- Morris, E. R., Taylor, I. A. The missing link: Allostery and catalysis in the anti-viral protein SAMHD1. Biochemical Society Transactions. 47 (4), 1013-1027 (2019).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2015).
- Herold, N., et al. Targeting SAMHD1 with the Vpx protein to improve cytarabine therapy for hematological malignancies. Nature Medicine. 23 (2), 256-263 (2017).
- Schneider, C., et al. SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia. Nature Medicine. 23 (2), 250-255 (2017).
- Hollenbaugh, J. A., et al. Substrates and inhibitors of SAMHD1. PloS One. 12 (1), 0169052(2017).
- Knecht, K. M., et al. The structural basis for cancer drug interactions with the catalytic and allosteric sites of SAMHD1. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10022-10031 (2018).
- Oellerich, T., et al. Selective inactivation of hypomethylating agents by SAMHD1 provides a rationale for therapeutic stratification in AML. Nature Communications. 10 (1), 3475(2019).
- Herold, N., et al. SAMHD1 protects cancer cells from various nucleoside-based antimetabolites. Cell Cycle. 16 (11), 1029-1038 (2017).
- Rothenburger, T., et al. SAMHD1 is a key regulator of the lineage-specific response of acute lymphoblastic leukaemias to nelarabine. Communications Biology. 3 (1), 324(2020).
- Ordonez, P., et al. SAMHD1 enhances nucleoside- analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824(2017).
- Castellví, M., et al. Pharmacological modulation of SAMHD1 activity by CDK4/6 inhibitors improves anticancer therapy. Cancers. 12 (3), 713-719 (2020).
- Rassidakis, G. Z., et al. Low-level expression of SAMHD1 in acute myeloid leukemia (AML) blasts correlates with improved outcome upon consolidation chemotherapy with high-dose cytarabine-based regimens. Blood Cancer Journal. 8 (11), 98(2018).
- Rudd, S. G., Schaller, T., Herold, N. SAMHD1 is a barrier to antimetabolite-based cancer therapies. Molecular & Cellular Oncology. 4 (2), 1287554(2017).
- Rudd, S. G., et al. Ribonucleotide reductase inhibitors suppress SAMHD1 ara-CTPase activity enhancing cytarabine efficacy. EMBO Molecular Medicine. 41, 10419(2020).
- Seamon, K. J., et al. Small molecule inhibition of SAMHD1 dNTPase by tetramer destabilization. Journal of the American Chemical Society. 136 (28), 9822-9825 (2014).
- Seamon, K. J., Stivers, J. T. A high-throughput enzyme-coupled assay for SAMHD1 dNTPase. Journal of Biomolecular Screening. 20 (6), 801-809 (2015).
- Mauney, C. H., Perrino, F. W., Hollis, T. Identification of inhibitors of the dNTP triphosphohydrolase SAMHD1 using a novel and direct high-throughput assay. Biochemistry. 57 (47), 6624-6636 (2018).
- Morris, E. R., et al. Crystal structures of SAMHD1 inhibitor complexes reveal the mechanism of water-mediated dNTP hydrolysis. Nature Communications. 11 (1), 3165(2020).
- Hansen, E. C., Seamon, K. J., Cravens, S. L., Stivers, J. T. GTP activator and dNTP substrates of HIV-1 restriction factor SAMHD1 generate a long-lived activated state. Proceedings of the National Academy of Sciences of the United States of America. 111 (18), 1843-1851 (2014).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Hyun, M., Bohr, V. A., Ahn, B. Biochemical characterization of the WRN-1 RecQ helicase of Caenorhabditis elegans. Biochemistry. 47 (28), 7583-7593 (2008).
- Lin, H. -H., Huang, C. -Y. Characterization of flavonol inhibition of DnaB helicase: real-time monitoring, structural modeling, and proposed mechanism. Journal of Biomedicine & Biotechnology. 2012 (4), 735368(2012).
- Yang, M., Wang, G. ATPase activity measurement of DNA replicative helicase from Bacillus stearothermophilus by malachite green method. Analytical Biochemistry. 509, 46-49 (2016).
- Allard, B., Cousineau, I., Spring, K., Stagg, J. Measurement of CD73 enzymatic activity using luminescence-based and colorimetric assays. Methods in Enzymology. 629, 269-289 (2019).
- Lee, M., et al. Structure-activity relationship of sulfonyl piperazine LpxH inhibitors analyzed by an LpxE-coupled malachite green assay. ACS Infectious Diseases. 5 (4), 641-651 (2019).
- Carreras-Puigvert, J., et al. A comprehensive structural, biochemical and biological profiling of the human NUDIX hydrolase family. Nature Communications. 8 (1), 1541(2017).
- Valerie, N. C. K., et al. NUDT15 hydrolyzes 6-thio-deoxyGTP to mediate the anticancer efficacy of 6-thioguanine. Cancer Research. 76 (18), 5501-5511 (2016).
- Carter, M., et al. Human NUDT22 Is a UDP-glucose/galactose hydrolase exhibiting a unique structural fold. Structure. 26 (2), 295-303 (2018).
- Gad, H., et al. MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool. Nature. 508 (7495), 215-221 (2014).
- Page, B. D. G., et al. Targeted NUDT5 inhibitors block hormone signaling in breast cancer cells. Nature Communications. 9 (1), 250(2018).
- Zhang, S. M., et al. Development of a chemical probe against NUDT15. Nature Chemical Biology. 16 (10), 1120-1128 (2020).
- Michel, M., et al. In silico druggability assessment of the NUDIX hydrolase protein family as a workflow for target prioritization. Frontiers in Chemistry. 8, 443(2020).
- Zhang, J., Chung, T., Oldenburg, K. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67(1999).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Markossian, S., et al. Assay guidance manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , Bethesda (MD). (2004).
- Holdgate, G. A., Meek, T. D., Grimley, R. L. Mechanistic enzymology in drug discovery: a fresh perspective. Nature Reviews Drug Discovery. 17 (2), 115-132 (2018).
- Tsesmetzis, N., Paulin, C. B. J., Rudd, S. G., Herold, N. Nucleobase and nucleoside analogues: resistance and re-sensitisation at the level of pharmacokinetics, pharmacodynamics and metabolism. Cancers. 10 (7), 240(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved