Method Article
dNTPase SAMHD1과의 저분자 상호작용을 프로브하기 위한 고처리량 효소 결합 활성 분석
요약
SAMHD1은 인체 건강과 질병에 중요한 역할을 하는 디옥시뉴클레오시드 삼인산삼인산삼인산가수분해효소입니다. 여기에서는 SAMHD1 기질, 활성제 및 억제제로서 소분자 및 뉴클레오티드 유사체를 평가할 수 있는 384웰 마이크로플레이트 형식으로 배포된 다목적 효소 결합 SAMHD1 활성 분석을 제시합니다.
초록
멸균 알파 모티프 및 HD 도메인 함유 단백질 1(SAMHD1)은 세포 내 디옥시뉴클레오시드 삼인산(dNTP) 풀의 중추적인 조절자이며, 이 효소는 dNTP를 해당 뉴클레오시드 및 무기 삼인산으로 가수분해할 수 있습니다. 뉴클레오티드 대사에 중요한 역할, 여러 병리학과의 연관성 및 치료 내성에서의 역할로 인해 현재 이 효소의 조절과 세포 기능을 더 잘 이해하기 위한 집중적인 연구가 진행되고 있습니다. 이러한 이유로, 알로스테릭 조절자, 기질 또는 억제제와 같은 SAMHD1과의 저분자 상호작용을 조사하기 위한 간단하고 저렴한 고처리량 조정 가능한 방법의 개발이 필수적입니다. 이를 위해 효소 결합 말라카이트 그린 분석법은 SAMHD1 활성을 간접적으로 측정할 수 있는 384-마이크로웰 플레이트 형식으로 배포할 수 있는 간단하고 강력한 비색 분석법입니다. SAMHD1이 뉴클레오티드 기질에서 삼인산기를 방출함에 따라 피로포스파타제 활성을 이 반응에 결합하여 무기 인산염을 생성할 수 있으며, 이는 포스몰리브덴산염 말라카이트 그린 복합체의 형성을 통해 말라카이트 그린 시약으로 정량화할 수 있습니다. 여기서는 SAMHD1의 알려진 억제제를 특성화하고 뉴클레오시드 기반 항암제로 대표되는 알로스테릭 활성제에 의한 비표준 기질의 SAMHD1 촉매 및 조절과 관련된 메커니즘을 해독하기 위해 이 방법론을 적용하는 방법을 보여줍니다. 따라서 효소 결합 말라카이트 그린 분석은 SAMHD1을 연구하는 강력한 도구이며, 또한 인산염 종을 방출하는 여러 효소 연구에도 활용될 수 있습니다.
서문
멸균 알파 모티프와 히스티딘-아스파르테이트 도메인 함유 단백질 1(SAMHD1)은 포유류 세포에서 뉴클레오티드 항상성의 중심 조절자이며1 인간의 건강과 질병에 많은 역할을 한다2. 이 효소는 디옥시뉴클레오시드 삼인산(dNTP)을 동족 디옥시뉴클레오시드 및 무기 삼인산 분자 3,4로 가수분해할 수 있으며, 이 활성은 (d)NTP 풍부도에 의해 알로스테릭하게 조절됩니다(참고 문헌5에서 검토). 각 SAMHD1 단량체는 2개의 알로스테릭 부위(AS1 및 AS2)와 1개의 촉매 부위를 포함하며, 활성 효소의 형성은 (d)NTP 결합 시 호모테트라머의 정렬된 조립을 필요로 합니다. SAMHD1 단량체의 이합체화는 먼저 구아닌 삼인산(GTP 또는 dGTP)과 AS1의 결합을 통해 촉발되며, 추가 dNTP 분자가 AS2에 결합할 때 후속 사중합체화가 달성되어 촉매 부위에 대한 기질 접근 및 후속 가수분해가 가능합니다.
SAMHD1 기질은 바이러스 감염 및 암의 치료에 사용되는 여러 뉴클레오시드 기반 약물의 삼인산 대사 산물을 포함하여 일부 염기 및 당 변형 뉴클레오티드와 함께 4개의 표준 dNTP 3,4를 포함하며, 이들 중 일부는 알로스테릭 활성제(6,7,8,9,10,11)로도 작용할 수 있습니다 . 결과적으로 SAMHD1은 질병 모델 7,8,9,10,11,12,13,14,15에서 이러한 화합물의 효능을 조절하며, 수십 년 동안 급성 골수성 백혈병(AML)에 대한 표준 치료법으로 남아 있는 데옥시시티딘 유사체 시타라빈(ara-C)의 경우 실제로 이 질병의 치료 효능 7,8,16. 따라서 SAMHD1은 뉴클레오시드 기반 치료제의 효능을 개선하기 위한 잠재적인 바이오마커 및 치료 표적이며,17 따라서 당사와 다른 연구자들은 세포에서 SAMHD1을 비활성화하기 위한 전략을 식별하기 위해 노력해 왔습니다. 우리는암세포 내부의 분해를 위해 SAMHD1을 표적으로 하는 생물학적 억제제로서 바이러스 단백질 X(Vpx)의 사용을 제안했으나7, 이 접근법은 여러 가지 한계가 있으며(참고 문헌12에서 논의), 최근에는 AML18의 다양한 모델에서 입증한 리보뉴클레오티드 환원효소의 억제를 통해 SAMHD1 활성을 억제하는 간접적인 접근법도 보고했습니다. 많은 연구에서 SAMHD1을 직접 억제할 수 있는 작은 분자를 식별하기 위해 노력했으며, 현재까지 이러한 분자 몇 개가 보고되었지만 시험관 내억제만 문서화되었습니다 6,9,19,20,21,22. 결과적으로, 뉴클레오시드 기반 치료제의 SAMHD1 촉매 작용의 복잡한 메커니즘과 결합된 세포에서 SAMHD1 활성을 강력하게 억제하는 소분자의 부족은 추가 연구의 필요성을 강조합니다. 따라서 SAMHD1과의 저분자 상호작용을 조사하기 위한 견고하고 이상적으로 처리량이 높은 조정 가능한 방법은 이 임상적으로 관련된 효소의 기질, 알로스테릭 조절자 및 억제제를 식별하는 데 이상적입니다.
박층 크로마토그래피(TLC)9,20,23 및 고성능 액체 크로마토그래피(HPLC)9,21와 같이 SAMHD1의 dNTPase 활성을 직접 측정하는 여러 방법을 사용할 수 있지만 고처리량 설정에는 쉽게 적용할 수 없습니다. 한 가지 예외는 Mauney et al.에 의해 보고된 분석법인데, 이는 Mn2+가 활성화 양이온으로 사용될 때 비스(4-니트로페닐) 포스페이트(b4NPP)를 p-니트로페놀 및 p-니트로페닐 포스페이트로 가수분해하는 SAMHD1의 능력을 이용하여, 마이크로웰 플레이트(21)에서 용이하게 측정될 수 있는 비색 변화를 초래한다. 이 분석법은 SAMHD1 억제제의 식별 및 특성 분석에 성공적으로 사용되었지만, (d)NTP 활성제가 없는 경우와 비생리학적 활성화 양이온이 있을 가능성이 있는 경우 가수분해가 발생한다는 점에 유의해야 하며, 이 두 가지 모두 고려해야 할 중요한 주의 사항입니다. 이것은 또한 이 분석을 SAMHD1의 알로스테릭 조절인자의 연구 및 식별에 덜 적용할 수 있도록 합니다.
이러한 맥락에서, 이 보고서에 자세히 설명된 바와 같이 말라카이트 그린 시약과 결합된 효소 결합 접근법은 SAMHD1의 dNTPase 활성을 간접적으로 측정하고 더 나아가 다양한 소분자가 SAMHD1에 미치는 영향을 조사하는 다목적 방법이 될 수 있습니다. 말라카이트 그린 분석은 620nm에서 측정된 비색 변화를 유발하는 몰리브도인산 복합체의 형성을 기반으로 유리 무기 인산염(Pi)을 검출하기 위한 강력하고 신뢰할 수 있는 비색 기법입니다(24). SAMHD1 가수분해는 뉴클레오티드 기질에서 삼인산기를 방출하므로 말라카이트 녹색 시약을 첨가하기 전에 이 반응을 유리 무기 인산염을 생성하는 (파이로)포스파타제 활성과 결합해야 합니다. 말라카이트 그린 분석은 민감하고 비용 효율적이며 반응 시 또는 결합 효소의 존재 하에서 무기 인산기를 방출하는 효소에 대한 억제제 및 기질의 식별 및 특성 분석에 널리 사용되었습니다. 그것은 helicases25,26,27의 ATPase 활성의 특성화 또는 아데노신 및 무기 인산염28에 대한 AMP의 분해를 매개하는 CD73 효소 활성의 연구에 널리 적용되었습니다. 또한, 결합하면 UDP-2,3-diacylglucosamine pyrophosphatase LpxH를 표적으로 하는 항생제 약물의 발견에 사용되어 왔으며, 대부분의 그람 음성 병원체의 필수 효소입니다29. 암 연구와 관련하여, 효소 결합 접근법은 뉴클레오티드 대사 효소 계열인 NUDIX 가수분해효소에 대해 기질(30,31,32)의 특성 분석과 약물 및 화학 프로브(33,34,35,36)의 식별 및 개발에 광범위하게 적용되었습니다.
dNTPase SAMHD1과 관련하여 이 접근 방식은 여러 보고서에서 활용되었습니다. 이 분석법은 맥주효모균 cerevisiae의 엑소폴리포스파타제 Ppx1을 결합 효소로 사용하여 SAMHD1의 기질, 활성제 또는 억제제로서 여러 뉴클레오티드 유사체를 테스트하는 데 사용되었으며, 그 결과 항백혈병 약물인 클로파라빈의 삼인산 대사산물을 활성제 및 기질로 식별했습니다6. 또한, 결합 효소로서 대장균(Escherichia coli )의 무기 피로포스파타아제(inorganic pyrophosphatase)를 사용하여, 억제제(inhibitors)를 식별하기 위해 SAMHD1에 대해 임상적으로 승인된 화합물 라이브러리의 스크리닝에 사용되었다20. 우리의 연구에서, 우리는 이 접근법을 활용하여 ara-C의 활성 대사 산물인 ara-CTP가 SAMHD1 기질이지만 알로스테릭 활성제는 아님을 보여주었고, 이후 이 분석을 사용하여 AML 모델을 SAMHD1 의존적 방식으로 ara-C에 민감하게 할 수 있는 여러 소분자가 실제로 SAMHD1을 직접 억제하지 않는다는 것을 보여주었습니다18. 이 보고서에서는 이 다용도 방법을 자세히 설명하고 SAMHD1의 억제제, 활성제 및 기질을 식별하기 위해 고처리량 조정 가능한 설정에서 적용 가능성을 입증합니다.
프로토콜
아래 분석법의 개략적인 개요는 그림 1 에 나와 있으며 재료 및 시약의 자세한 목록은 재료 표에서 확인할 수 있습니다.
1. 분석 완충액의 준비.
- 스톡 버퍼 준비.
알림: 분석은 흔할 수 있는 인산염 검출에 민감하므로 오염을 방지하기 위해 유리 제품을 초순수 또는 이중 증류수로 세 번 헹굽니다. 모든 버퍼는 실온(RT)에서 보관할 수 있습니다.- pH 8 및 최종 부피로 조정하기 전에 약 800mL의 물에 4.5g Tris Acetate, 2.3g NaCl 및 0.2g MgCl2를 용해시켜 SAMHD1 반응 완충액(RB) 원액(25mM Tris-Acetate pH 8, 40mM NaCl, 1mM MgCl2) 1L를 준비합니다.
- 0.5M TCEP 1mL를 물 4mL에 희석하여 0.1M TCEP 원액 5mL를 준비합니다.
- 100% Tween-20 5mL를 물 44.5mL에 희석하여 11% Tween-20 원액 50mL를 준비합니다.
참고: Tween-20은 빛에 민감합니다. - pH 8 및 최종 부피로 조정하기 전에 약 40mL의 물에 9.3g EDTA를 용해시켜 50mL의 0.5M EDTA 정지 용액을 준비합니다.
- 갈색 유리병에 담긴 물 300mL에 60mL의 진황산을 천천히 첨가하여 말라카이트 그린(MG) 원액(H2SO4의 3.2mM 말라카이트 그린)을 준비합니다. 용액을 RT로 식히고 0.44g의 말라카이트 그린을 녹입니다.
주의: 황산과 물의 반응은 발열성이므로 병이 가열되어 압력이 상승할 수 있습니다. 이 압력이 자주 해제되는지 확인하십시오.
알림: 생성된 주황색 용액은 빛에 민감하고(따라서 갈색 병) RT에서 최소 1년 동안 안정적입니다. 침전물은 시간이 지남에 따라 형성될 수 있으므로 상층액만 사용해야 합니다. - 몰리브덴산 암모늄 3.75g을 물 50mL에 녹여 7% 몰리브덴산 암모늄 원액 50mL를 준비합니다.
알림: 침전물은 시간이 지남에 따라 형성될 수 있으므로 상층액만 사용해야 합니다.
- 완전한 분석 완충액의 준비
참고: 이 작업은 실험 당일에 수행해야 합니다- 완전한 SAMHD1 RB(25mM Tris-Acetate pH 8, 40mM NaCl, 1mM MgCl2, 0.3mM TCEP, 0.005% Tween-20)를 준비합니다. 이전에 준비한 11% Tween-20 및 0.1M TCEP 스톡을 사용하여 이러한 성분을 Tween-20의 경우 0.005%, TCEP의 경우 0.3mM의 최종 농도로 SAMHD1 RB 스톡에 첨가합니다.
- EDTA 정지 용액 (25 mM Tris-Acetate pH 8, 40 mM NaCl, 1 mM MgCl2, 0.3 mM TCEP, 0.005 % Tween-20, 7.9 mM EDTA)을 준비합니다. SAMHD1 RB를 완성하려면 0.5M EDTA 원액을 사용하여 EDTA를 최종 농도 7.9mM에 첨가합니다.
- MG 원액 10 부와 7 % 몰리브덴 암모늄 2.5 부 및 11 % 트윈 -20 0.2 부를 혼합하여 MG 작업 용액 (2.5 mM 말라카이트 그린, 1.4 % 몰리브덴 암모늄, 0.18 % Tween-20)을 제조합니다.
2. SAMHD1 억제 분석 및 화합물 IC50 측정
참고: 최종 분석 조건은 표 1에 나와 있습니다.
- 분석 플레이트에서 화합물의 준비
참고: 저분자량 화합물은 일반적으로 물에 있는 100% DMSO 및 뉴클레오티드 유사체에 용해됩니다. 스톡 농도 범위는 10 - 100 mM이며 분석의 DMSO 내성과 함께 화합물의 효능 및 용해도의 영향을 받습니다. 반응의 최종 DMSO 농도가 1%를 초과하지 않는지 확인하여 효소 활성이 이 용매의 영향을 받지 않도록 합니다. 실험 전에 용매에 대한 분석의 내성을 테스트하는 것이 좋습니다.- 멀티채널 피펫 또는 자동 액체 처리 장비를 사용하여 투명한 둥근 바닥 폴리프로필렌 96웰 플레이트에서 관련 용매(예: 저분자의 경우 100% DMSO, 뉴클레오티드 유사체의 경우 물)에서 최종 농도 100배로 연속적으로 희석된 테스트 화합물을 준비합니다.
참고: 화합물 안정성에 따라 희석 플레이트를 미리 준비하고 밀봉하여 -20°C에서 보관할 수 있습니다. 프로토콜을 계속하기 전에 플레이트가 RT와 평형을 이루도록 합니다. - 완전한 SAMHD1 RB를 사용하여 화합물을 최종 농도의 25배로 희석하고(최종 용매 농도를 1% 미만으로 유지하기 위해) 투명한 384웰 평평한 바닥 분석 플레이트의 적절한 웰로 5μL를 옮깁니다. 용매만 사용하는 대조 샘플로 절차를 반복합니다.
- 멀티채널 피펫 또는 자동 액체 처리 장비를 사용하여 투명한 둥근 바닥 폴리프로필렌 96웰 플레이트에서 관련 용매(예: 저분자의 경우 100% DMSO, 뉴클레오티드 유사체의 경우 물)에서 최종 농도 100배로 연속적으로 희석된 테스트 화합물을 준비합니다.
- 반응 성분의 제조
참고: 이 작업은 분석 당일에 수행해야 합니다. 재조합 인간 SAMHD1 및 대장균 피로포스파타제(PPase) 분취액은 -80°C에서 각각 9.1mg/mL 및 23.0mg/mL로 희석하여 보관 완충액(20mM HEPES pH 7.5, 300mM NaCl, 10% 글리세롤, 2mM TCEP)에 장기간 보관합니다. 해동된 부분 표본은 -20°C에서 단기간 보관됩니다.- 재조합 인간 SAMHD1 단백질과 재조합 PPase를 완전한 SAMHD1 RB에서 원하는 최종 농도의 4배로 희석하여 효소(SAMHD1/PPase) 마스터 믹스를 준비합니다(따라서 1.4μM SAMHD1 및 50U/mL PPase).
- dGTP 스톡(일반적으로 물에 10 또는 100mM)을 완전한 SAMHD1 RB에 희석하여 최종 농도 50μM dGTP를 제조합니다.
- 분석 수행
참고: 모든 분석 구성 요소는 RT와 평형을 이루어야 합니다. 액체 첨가는 멀티채널 피펫 또는 벌크 시약 액체 디스펜서를 사용하여 수행할 수 있습니다.- 화합물 희석액과 용매 전용 대조군이 포함된 384웰 분석 플레이트에 5μL의 SAMHD1/PPase 마스터 믹스를 분주합니다. 효소 조절 웰이 없는 경우 5μL의 완전한 SAMHD1 RB를 분주합니다. 효소와 화합물을 RT에서 10분 동안 사전 배양합니다.
- 모든 웰에 10μL의 2x dGTP 용액을 분주하여 반응을 시작합니다.
- RT에서 20분 동안 반응을 배양합니다.
- 모든 웰에 20μL EDTA 정지 용액을 분주하여 반응을 중지합니다.
참고: 원하는 경우 여기에서 실험을 일시 중지할 수 있습니다. - 모든 웰에 10μL MG 작업 용액을 추가합니다.
주의: MG 작업 용액에는 황산이 포함되어 있습니다. - 오비탈 마이크로웰 플레이트 쉐이커를 사용하여 웰 내용물을 혼합하고 1,000 x g 에서 1분 동안 원심분리합니다.
- 플레이트를 RT에서 20분 동안 배양합니다.
- 마이크로웰 플레이트 리더에서 630nm 파장에서의 흡수를 판독합니다.
- 데이터 시각화 및 분석
- 포지티브 및 네거티브 대조군의 평균 및 표준 편차를 계산합니다(양극, 용매와의 완전 반응, 음수, 용매와 dGTP 단독). Z-factor37을 분석 품질의 지표로 계산합니다.
- 각 흡광도 값을 양성 대조군과 음성 대조군의 평균값으로 정규화하여 양성 대조군을 100% SAMHD1 활성으로, 음성 대조군을 0% SAMHD1 활성으로 설정합니다.
- 화합물 농도의 함수로 SAMHD1 활성(%)을 표시하고 4-파라미터 가변 기울기 용량-반응 곡선을 피팅하여 화합물 IC50을 측정할 수 있습니다.
3. SAMHD1 활성제와 기질 스크린
참고: 최종 분석 조건은 표 2에 나와 있습니다. 재조합 SAMHD1 및 PPase 부분 표본은 -80°C에서 각각 9.1mg/mL 및 23.0mg/mL로 희석하여 -80°C의 보관 완충액(20mM HEPES pH 7.5, 300mM NaCl, 10% 글리세롤, 2mM TCEP)에 장기간 보관합니다. 해동된 부분 표본은 -20°C에서 단기간 보관됩니다.
- 분석 플레이트에서 뉴클레오티드 유사체의 준비
- 뉴클레오티드 유사체 스톡(일반적으로 물에서 10 또는 100mM)을 완전한 SAMHD1 RB(이 경우 800μM 뉴클레오티드 유사체)에서 최종 농도의 4배로 희석하고 5μL를 384웰 분석 플레이트의 적절한 웰로 옮깁니다.
- 반응 성분의 제조
참고: 이 작업은 분석 당일에 수행해야 합니다- 재조합 인간 SAMHD1 단백질과 재조합 대장균 PPase를 완전한 SAMHD1 RB에 희석하여 원하는 최종 농도를 2배로 희석하여 효소(SAMHD1/PPase) 마스터 믹스를 준비합니다(따라서 0.7μM SAMHD1 및 25U/mL PPase).
- 완전한 SAMHD1 RB의 재조합 E. coli PPase를 원하는 최종 농도의 2배, 즉 25U/mL PPase로 희석하여 PPase 단독 용액을 준비합니다.
- 활성제 GTP(AS1) 및 dGTPαS(AS1 및 AS2) 희석 스톡(일반적으로 물에서 10 또는 100mM)을 완전한 SAMHD1 RB에서 최종 농도의 4배(50μM GTP 또는 dGTPαS)로 준비합니다.
- 분석 수행
참고: 모든 분석 구성 요소는 RT와 평형을 이루어야 합니다. 액체 첨가는 멀티채널 피펫 또는 벌크 시약 액체 디스펜서를 사용하여 수행할 수 있습니다.- 뉴클레오티드 유사체를 포함하는 384웰 분석 플레이트에 활성제(GTP 또는 dGTPαS) 5μL를 분주하거나 SAMHD1 RB를 적절한 웰에 완전히 투여합니다.
- 10μL의 SAMHD1/PPase 마스터 믹스, PPase 단독 또는 완전한 SAMHD1 RB를 적절한 웰에 분주하여 반응을 시작합니다.
- RT에서 20분 동안 반응을 배양합니다.
- 모든 웰에 20μL EDTA 정지 용액을 분주하여 반응을 중지합니다.
참고: 원하는 경우 여기에서 실험을 일시 중지할 수 있습니다. - 모든 웰에 10μL MG 작업 용액을 추가합니다.
주의: MG 작업 용액에는 황산이 포함되어 있습니다. - 오비탈 마이크로웰 플레이트 쉐이커를 사용하여 웰 내용물을 혼합하고 1,000 x g 에서 1분 동안 원심분리합니다.
- 플레이트를 RT에서 20분 동안 배양합니다.
- 마이크로웰 플레이트 리더에서 630nm 파장에서의 흡수를 판독합니다.
- 데이터 시각화 및 분석
- PPase 전용 반응 웰(음성 대조군 또는 배경 신호)에 대한 평균 흡광도 값을 계산합니다.
참고: SAMHD1 알로스테릭 활성제 및 기질의 양성 대조군으로 dGTP를 플레이트에 포함할 수 있습니다. 이 경우 이 조건을 사용하여 분석 품질의 지표로 Z 계수를 계산할 수 있습니다. - SAMHD1/PPase 반응의 해당 웰에서 배경 값을 뺍니다.
- 완충액, GTP 및 dGTPαS 조건을 사용하여 각 뉴클레오티드 유사체에 대해 보정된 흡광도 값을 플롯합니다.
- PPase 전용 반응 웰(음성 대조군 또는 배경 신호)에 대한 평균 흡광도 값을 계산합니다.
결과
그림 1에 요약된 프로토콜은 효소 결합 말라카이트 그린 어세이를 활용하여 소분자와 dNTPase SAMHD1의 상호 작용을 조사하기 위한 기본 워크플로우를 설명하며, 다양한 생화학적 질문을 조사하기 위해 다양한 방법으로 적용할 수 있습니다. 아래 단락에서 논의된 대표적인 결과에서는 이 분석을 사용하여 SAMHD1에 대한 소분자의 억제 특성을 결정하고 다른 뉴클레오티드 유사체가 이 효소의 기질 및/또는 활성제인지 여부를 테스트하는 예를 설명합니다.
그림 2에 표시된 결과는 이 분석의 몇 가지 핵심 원리를 보여줍니다. 말라카이트 그린 시약은 포스몰리브덴산염 말라카이트 그린 복합체의 형성을 통해 무기 인산염의 비색 검출을 가능하게 하며, 따라서 이 접근법은 생성물이 인산염인 효소 반응 연구에 적용될 수 있습니다. 유리 무기 인산염을 검출하기 위한 이 방법의 민감도를 입증하기 위해, 그림 2A는 말라카이트 그린 시약으로 20분 배양한 후 Na3PO4의 농도를 증가시켜 얻은 흡광도 값을 보여줍니다. 신호가 0.25 mM Na3PO4 에서 포화에 도달하는 동안, 인산염의 선형 검출 범위는 0.004 내지 0.03 mM (그림 2A, 오른쪽 패널)에서 볼 수 있으며, 이는 말라카이트 그린 어세이38을 사용하여 최대 10-20 μM의 인산염 선형 범위를 보고한 다른 연구와 일치한다.
SAMHD1은 dNTP 분자를 가수분해할 때 무기 삼인산을 방출하는 dNTPase이므로 말라카이트 그린에 의한 검출을 위한 유리 무기 인산염을 생성하기 위해서는 커플링 효소가 필요합니다. 대장균으로부터의 무기 피로포스파타제(PPase)는 SAMHD1 7,20 뿐만 아니라 다른 뉴클레오티드 대사 효소 30,33,35와 관련하여 이러한 목적에 유용한 것으로 나타났다. 또한, SAMHD1은 호모테트라머(homotetramer)일 때 활성 dNTPase이며, 이는 (d)NTP, 특히 AS1의 구아닌 삼인산(GTP 또는 dGTP) 및 AS2의 모든 dNTP에 의한 알로스테릭 활성화를 필요로 합니다. 그 후, 촉매 부위는 기질 결합을 위해 접근 가능해지고 효소 반응이 일어난다. dGTP는 AS1 및 AS2에 결합하기 위한 요구 사항을 충족하고 기질이므로 억제 분석에서 이 뉴클레오티드를 사용하면 워크플로우가 크게 간소화됩니다. 그림 2B는 630nm에서 흡광도 증가로 표시되는 측정 가능한 SAMHD1 활성을 달성하기 위한 다양한 분석 성분의 요구 사항을 보여줍니다. SAMHD1 또는 PPase 단독으로는 dGTP가 있는 상태에서 무기 인산염을 생성할 수 없으며, 이는 이러한 효소의 문서화된 활성과 일치합니다. 그러나 모든 분석 성분(SAMHD1, PPase 및 dGTP 활성제/기질)이 존재하는 조건에서는 신호가 증가하는 것을 관찰할 수 있습니다. 여기에 표시된 예의 Z 계수37(효소 + dGTP를 음성 대조군으로 사용하지 않고 SAMHD1/PPase + dGTP를 양성 대조군으로 사용)은 0.74로 강력한 분석을 나타냅니다.
효소 결합 SAMHD1 활성 분석의 잠재적 응용 분야 중 하나는 고처리량 스크리닝(HTS)을 통한 억제제 식별입니다. 따라서 이 보고서에서는 문헌에 이미 설명된 다양한 화합물 세트를 사용하여 이 분석에서 SAMHD1 억제 검출을 검증합니다. Seamon et al.은 여기에 표시된 것과 유사한 분석을 사용하여 SAMHD1에 대한 표준 뉴클레오시드의 용량 의존적 억제를 평가했으며, deoxyguanosine(dGuo)이 IC50 값이 488μM20인 SAMHD1을 유의하게 억제할 수 있는 유일한 표준 뉴클레오시드임을 발견했습니다. 직접 b4NPP 분석으로 수행된 FDA 승인 약물의 HTS는 마이크로몰 농도에서 SAMHD1 활성을 억제하는 몇 가지 히트를 나타냈으며, 여기서 lomofungin은 시험관 내에서 SAMHD1 dNTPase 활성을 가장 강력하게 억제하는 분자였으며, dGTP를 기질로 하여 측정했을 때 20.1μM의 IC50을 나타냈습니다21. 또한, 4개의 α,β-imido-dNTP 유사체는 MDCC-PBP 센서와 Ppx 활성에 결합된 SAMHD1을 사용하여 SAMHD1의 경쟁 억제제로 확인되었으며, 이는 dNMPNPP 유사체의 억제 상수가 낮은 마이크로몰/높은 나노몰 범위 6,22에 있음을 보여주었습니다. 따라서, 효소 결합 SAMHD1 활성 분석법이 SAMHD1 억제제를 식별하는 데 사용될 수 있음을 입증하기 위해 dGuo, lomofungin 및 2'-deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP)를 사용하여 기술을 검증했습니다. 그림 3A는 이러한 화합물에 대해 얻은 용량-반응 곡선을 보여주며, 농도를 높이면 SAMHD1 활성을 효과적으로 억제한다는 것을 보여줍니다. 3 개의 독립적 인 실험 (± 표준 편차)에서이 분자에 대해 얻은 평균 IC50 값은 dGuo = 361.9 ± 72.8 μM, lomofungin 6.78 ± 3.9 μM, dTMPNPP = 2.10 ± 0.9 μM입니다. 음성 결과의 예로, SAMHD1 활성에 대한 하이드록시우레아(HU)의 영향도 측정되었습니다. HU는 리보뉴클레오티드 환원효소의 억제제이며, 다양한 AML 모델에서 SAMHD1 ara-CTPase 활성을 제한하지만, SAMHD1에 대한 HU의 영향은 간접적이며 SAMHD1의 알로스테릭 조절을 교란하는 데 의존하는 것으로 나타났다18. HU의 용량 반응 곡선은 그림 3B에 나와 있으며, HU 용량이 증가함에 따라 SAMHD1 활성의 변화가 관찰되지 않았으며, 이는 HU가 시험관 내에서 SAMHD1 활성을 억제하지 않음을 보여줍니다.
효소 결합 SAMHD1 활성 분석의 또 다른 용도는 뉴클레오티드와 그 유사체가 이 효소의 기질 및/또는 알로스테릭 활성제인지 여부를 조사하는 것입니다( 그림 4 참조). 이 실험에서는 표준 뉴클레오티드와 시타라빈(ara-CTP), 클로파라빈(Cl-F-ara-ATP) 및 젬시타빈(dF-dCTP)과 같은 여러 항암 뉴클레오시드 유사체의 활성 대사 산물을 SAMHD1 기질 및 활성제로 테스트했습니다. SAMHD1의 복잡한 알로스테릭 조절로 인해 AS1 활성제인 GTP 또는 AS1 및 AS2를 점유할 수 있는 비가수분해성 dGTP 아날로그 2'-데옥시구아노신-5'-(α-티오)-삼인산(dGTPαS)의 존재 하에서 반응이 수행됩니다. 시험된 뉴클레오티드 유사체 및 GTP의 존재 하에서의 SAMHD1 활성은 뉴클레오티드가 2차 알로스테릭 부위 및 촉매 부위(즉, AS2 활성제 및 기질)에 결합할 수 있음을 나타내는 반면, 뉴클레오티드 유사체 및 dGTPαS를 사용한 SAMHD1 활성은 뉴클레오티드가 촉매 부위(즉, 기질만)를 점유할 수 있음을 나타냅니다. 뉴클레오티드가 AS1 및 AS2 알로스테릭 부위 모두와 촉매 부위에 결합할 수 있는 경우, dGTP의 경우와 같이 SAMHD1은 뉴클레오티드 단독 존재 하에서 활성화될 것입니다. 결과는 모든 표준 dNTP가 AS2 사이트 및 촉매 사이트에 바인딩할 수 있음을 보여줍니다. 뉴클레오티드 유사체의 경우, 클로파라빈 삼인산은 AS2 활성제이자 기질인 반면, 시타라빈 삼인산은 촉매 부위만 점유할 수 있습니다. 반면에, 젬시타빈 삼인산에서는 어떠한 활성도 관찰되지 않았으며, 이는 테스트된 조건 하에서 젬시타빈 삼인산이 알로스테릭 효과기 또는 기질로 작용할 수 없음을 시사한다. 이 결과는 이전의 예측9과 일치하지만, 이후의 결정화 및 동역학 연구10 는 젬시타빈 삼인산이 SAMHD1 촉매 주머니에 결합할 수 있으며, 실제로 효소의 기질이라는 것을 밝혀냈다. 그러나 후자의 연구10에서 저자는 가수분해율이 시타라빈 삼인산과 같은 다른 보고된 기질에 비해 상당히 낮다는 것을 보여주었으며, 따라서 이 스크리닝 설정으로 이를 관찰할 수 없었던 이유를 설명합니다.
전체적으로, 이러한 대표적인 결과는 SAMHD1 억제제, 알로스테릭 조절자 및 기질의 식별 및 특성 분석을 위한 강력한 기술로서 효소 결합 SAMHD1 활성 분석의 사용을 검증합니다. 그러나 모든 실험적 접근법과 마찬가지로 이 방법에는 주의 사항이 있으므로 결과를 추가로 검증하기 위해 직교 분석(예: 다른 분석 기술 사용)을 사용해야 합니다.
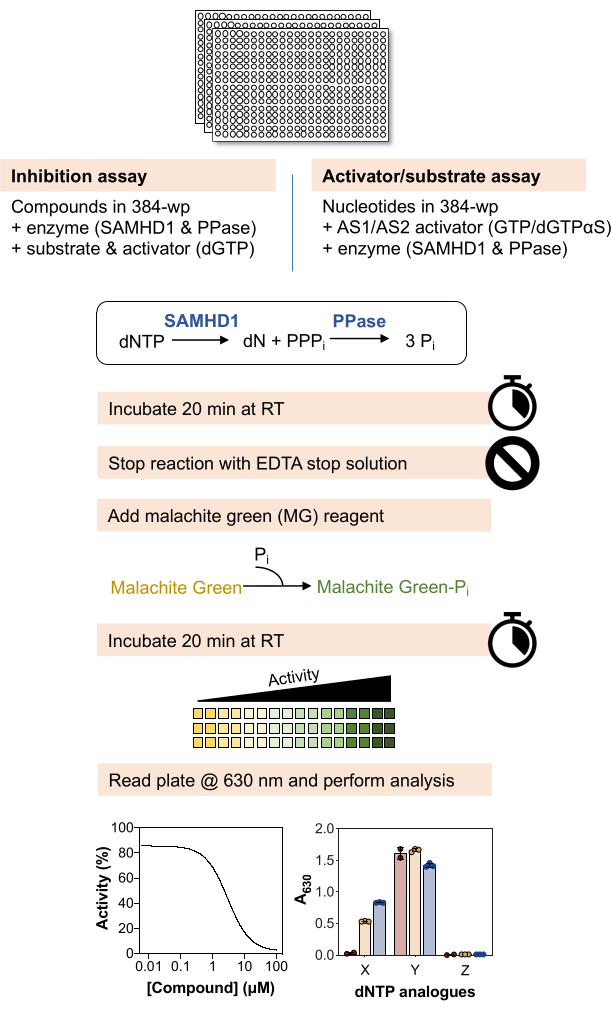
그림 1: 이 문서에 설명된 프로토콜의 개략도 개요. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
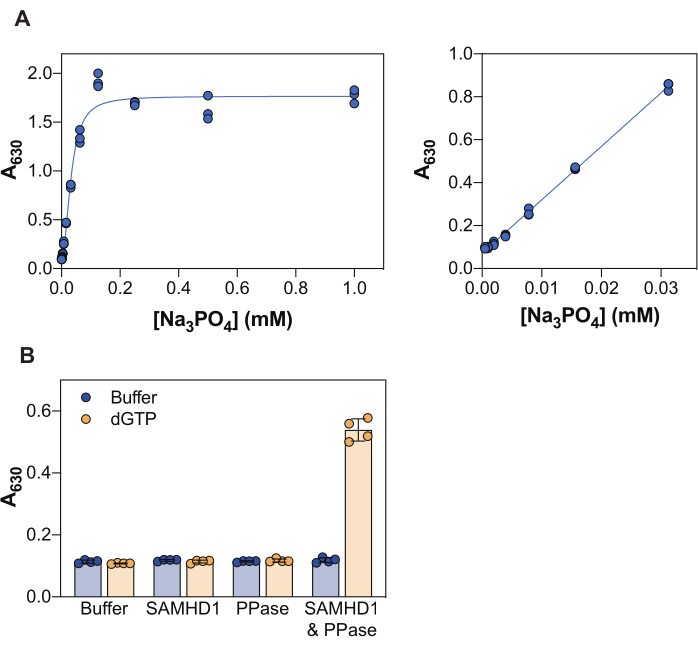
그림 2: 효소 결합 SAMHD1 활성 분석. (A) Na3PO4 말라카이트 그린 분석에서의 표준 곡선. Na3PO4 연속 희석(2배)을 1mM 내지 0.004mM의 삼중으로 제조하고, 말라카이트 그린 시약으로 20분 동안 배양하였다. 테스트된 농도의 전체 범위에 대한 원시 흡광도 값은 왼쪽 패널에 표시되고 선형 범위는 오른쪽 패널에 표시됩니다. 표시된 두 개의 독립적인 실험을 대표합니다. (B) 효소 결합 활성 분석의 검증. 활성제/기질 dGTP(25μM)의 존재 또는 부재 하에서 SAMHD1(0.35μM) 및/또는 PPase(12.5U/mL)를 효소 결합 활성 분석에서 20분 동안 배양했습니다. 원시 흡광도 값이 표시된 두 개의 독립적인 실험을 대표하는 Quadruplet, 막대 및 오차 막대는 평균과 SD를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
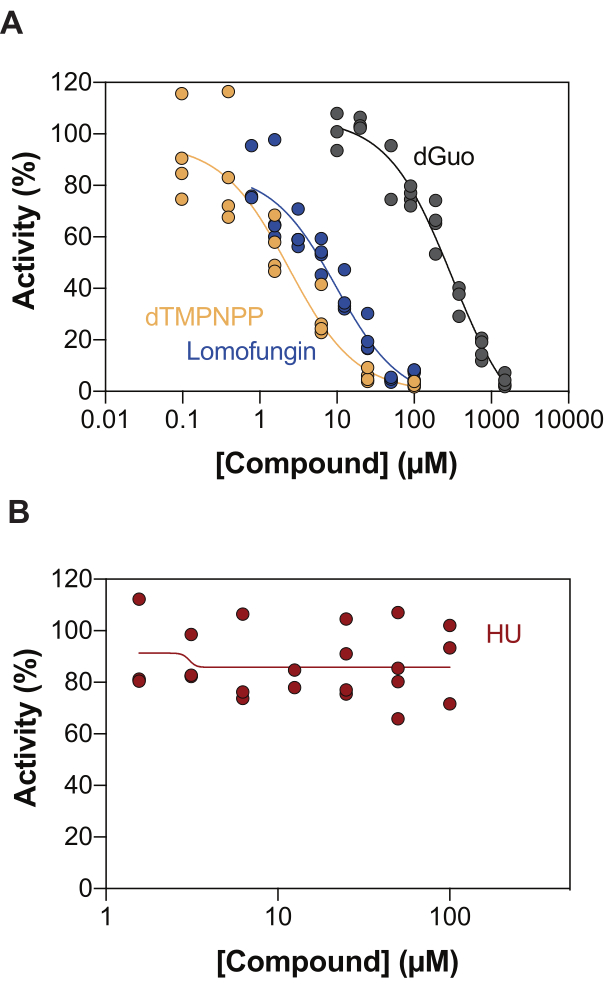
그림 3: 효소 결합 활성 분석에서 SAMHD1 억제를 위한 화합물 평가. dGTP(25μM)를 활성제/기질로 사용하는 효소 결합 SAMHD1 활성 분석에서 lomofungin(0.78-100μM), 2'-deoxythymidine-5'-[(α,β)-imido]triphosphate(dTMPNPP, 0.01-100μM) 및 deoxyguanosine(dGuo, 10-1,500μM)(A) 또는 하이드록시우레아(HU)(0.78-100μM)(B)의 용량 반응. 표시된 3개의 실험을 대표하는 개별 반복실험(DMSO + SAMHD1/PPase + dGTP = 100% 활성, DMSO + dGTP = 0% 활성)의 반응 대조군에 대한 활성 비율. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
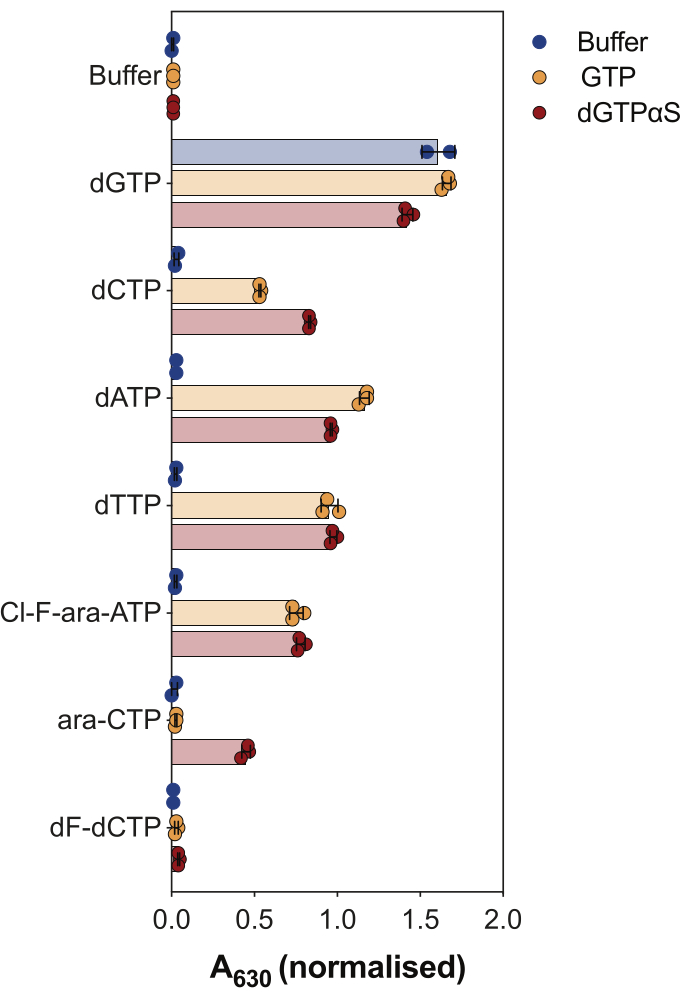
그림 4: 효소 결합 활성 분석에서 SAMHD1 알로스테릭 활성제 및 기질로서의 뉴클레오티드 유사체 평가. 항암제 시타라빈(ara-CTP), 클로파라빈(Cl-F-ara-ATP) 및 젬시타빈(dF-dCTP)의 표준 뉴클레오티드 및 선택된 삼인산 대사 산물은 GTP 또는 비가수분해성 dGTP 아날로그 dGTPαS(12.5μM)의 존재 또는 부재 하에서 효소 결합 SAMHD1 활성 분석에서 200μM에서 테스트되었습니다. 플롯된 개별 실험 반복실험의 정규화된 흡광도 값, 평균 및 SD가 표시됩니다. 이전 연구에서 채택한 두 개의 독립적인 실험을 대표합니다7. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 걸음 | 시약 | 분배 용량(μL) | 최종 반응 부피(μL) | 농축액 분배 | 반응 중 희석 | 반응의 최종 농도 |
| 1 | 억제제 | 5 | 20 | 0.4 mM의 | 4 | 0.1 밀리미터 |
| 2 | SAMHD1+PPase 믹스 | 5 | 1.4μM SAMHD1, 50U/mL PPase | 4 | 0.35μM SAMHD1, 12.5U/mL 파제 | |
| 3 | dGTP (디지트피) | 10 | 50 마이크로미터 | 2 | 25 마이크로미터 | |
| 4 | 20분 동안 배양 | |||||
| 5 | EDTA 솔루션 | 20 | 40 | 7.9 밀리미터 | 2 | 3.95 밀리미터 |
| 6 | MG 시약 | 10 | 50 | 2.5mM 말라카이트 그린, 64.4mM 몰리브덴산 암모늄, 0.18% 트윈-20 | 5 | 0.5 mM 말라카이트 그린, 12.9 mM 몰리브덴산 암모늄, 0.036 % 트윈 -20 |
| 7 | 20분 동안 배양 | |||||
| 8 | 읽기 @ 630nm | |||||
표 1: 억제제 스크리닝을 위한 효소 결합 분석의 최종 조건 요약.
| 걸음 | 시약 | 분배 용량(μL) | 최종 반응 부피(μL) | 농축액 분배 | 반응 중 희석 | 반응의 최종 농도 |
| 1 | 알로스테릭 레귤레이터 | 5 | 20 | 800 마이크로미터 | 4 | 200 마이크로미터 |
| 2 | GTP 또는 dGTPαS | 5 | 50 마이크로미터 | 4 | 12.5 마이크로미터 | |
| 3 | SAMHD1 및/또는 PPase | 10 | 0.7μM SAMHD1, 25U/mL PPase | 2 | 0.35μM SAMHD1, 12.5U/mL PPase | |
| 4 | 20분 동안 배양 | |||||
| 5 | EDTA 솔루션 | 20 | 40 | 7.9 밀리미터 | 2 | 3.95 밀리미터 |
| 6 | MG 시약 | 10 | 50 | 2.5mM 말라카이트 그린, 64.4mM 몰리브덴산 암모늄, 0.18% 트윈-20 | 5 | 0.5 mM 말라카이트 그린, 12.9 mM 몰리브덴산 암모늄, 0.036 % 트윈 -20 |
| 7 | 20분 동안 배양 | |||||
| 8 | 읽기 @ 630nm | |||||
표 2: 알로스테릭 조절자 스크리닝을 위한 효소 결합 분석의 최종 조건 요약
토론
여기에 자세히 설명된 효소 결합 활성 분석은 SAMHD1에 의한 dNTP 가수분해의 간접 측정을 가능하게 하는 고처리량 비색 분석법입니다. 이 방법은 대장균의 무기 PPase 능력을 이용하며, 이 PPase는 반응 혼합물에 과도하게 포함될 때 SAMHD1에 의해 생성된 각 무기 삼인산을 간단하고 경제적인 말라카이트 녹색 시약을 사용하여 정량화할 수 있는 3개의 개별 유리 인산염으로 변환합니다. 자사는 이 분석을 화합물 라이브러리의 스크리닝에 이상적인 384 마이크로웰 플레이트 형식으로 제공하며, SAMHD1 억제제, 활성제 및 기질의 식별 및 특성 분석에서 이 기법의 적용 가능성과 다양성을 입증합니다.
모든 체외 생화학 스크리닝 분석과 마찬가지로 여러 가지 중요한 단계와 중요한 고려 사항이 있으며, 이 중 많은 부분이 무료로 제공되는 분석 지침 매뉴얼39에서 자세히 논의됩니다. 정제된 재조합 효소인 SAMHD1 및 결합 효소 무기 PPase의 무결성은 매우 중요하며 분석을 수립하기 전에 확인해야 합니다. 따라서 이러한 효소의 각각의 새로운 정제는 배치 간 변동성으로 인해 결과에 불일치가 발생할 수 있으므로 일정 수준의 배치 테스트를 거쳐야 합니다. 이상적으로는 기질과 반응 생성물을 모두 검출할 수 있는 HPLC와 같은 직교 직접 분석을 사용하여 사용 중인 정제된 재조합 SAMHD1의 dNTP 삼인산가수분해효소 활성을 검증해야 합니다.
이 분석법의 한계와 관련하여, 원칙은 SAMHD1의 dNTPase 활성을 간접적으로 측정하여 무기 PPase의 활성을 이용한다는 것인데, 이는 여러 가지 의미를 내포하고 있습니다. PPase가 분석에 사용된 뉴클레오티드에 대해 활성을 거의 또는 전혀 가지고 있지 않다는 것을 확인하는 것이 중요하며, 마찬가지로 식별된 억제성 소분자는 PPase에 대해 활성을 갖지 않는다는 것을 확인하는 것이 중요합니다. 따라서, 스크리닝과 관련하여, PPase에 대한 카운터 스크리닝은 중요한 고려사항이 될 수 있다. 반응에 PPase가 존재하기 때문에 결과를 확인하기 위해 직교 분석을 사용하는 것도 중요합니다. 직접 활성 분석과 관련하여 TLC 9,20,23 및 HPLC 9,21을 포함하여 기질 고갈 및 산물 형성을 정확하게 감지하는 여러 분석이 현재까지 보고되었습니다. 또한, 역시 높은 처리량을 가진 b4NPP 분석21은 잠재적 억제제를 테스트하는 데 사용될 수 있습니다. 그러나 기질 또는 알로스테릭 활성제를 테스트하는 것은 이상적이지 않습니다. 이전에 SAMHD118로 보고한 바 있는 시차 주사 형광측정법(DSF)과 같은 생물물리학 분석법도 리간드를 식별하고 특성화하는 데 특히 강력할 수 있습니다. 분석의 또 다른 한계는, 특히 기질 및 활성제를 식별하기 위한 설정에 표시된 바와 같이, 비가수분해성 dGTP 아날로그 dGTPαS를 AS1 및 AS2 활성제로 사용하는 것입니다. 이를 통해 분석에서 관찰 가능한 활성 없이 SAMHD1을 활성화할 수 있지만, dGTPαS는 SAMHD1의 경쟁 억제제이므로 고농도를 사용하면 효소가 비활성화됩니다. SAMHD1에 대한 이해가 진행됨에 따라 향후 연구에서는 SAMHD1의 각 부위를 독점적으로 차지하는 분자를 활용하여 이 잠재적인 문제를 무효화할 수 있습니다.
여기에서 보았듯이 이 방법은 다재다능하며 여러 생화학적 질문을 해결하는 데 사용할 수 있습니다. 이 분석법의 두 가지 변형, 즉 SAMHD1의 알로스테릭 조절자 및 기질 식별을 위한 변형과 억제제의 특성 분석을 설명했지만 추가 조정이 이루어질 수 있습니다. 잠재적 억제제와 관련하여, 마이크로웰 플레이트 기반인 이 분석법은 다운스트림 작용 메커니즘 연구에 매우 적합합니다39,40. 유사하게, 기질 및 알로스테릭 조절제의 추가 특성 분석을 위해 이 기술은 시타라빈 및 클로파라빈7의 활성 대사 산물에 대해 수행한 것처럼 촉매 작용의 역학 매개변수를 결정하는 데 사용할 수 있습니다. 그러나 한 가지 단점은 여기에 보고된 효소 결합 분석이 종말점 분석이므로 스크리닝에 적합하지만 연속 분석이 일부 기계론적 연구에 더 적합하다는 것입니다. Arnold et al.은 유리 인산염 그룹에 결합할 수 있는 쿠마린 말레이미드(MDCC) 형광단으로 표지된 플라스마 주변 인산염 결합 단백질(PBP)의 사용에 의존하는 바이오센서 MDCC-PBP6을 활용하는 연속 효소 결합 분석을 보고했습니다. MDCC-PBP는 매우 민감하며 센서의 반응 시간이 밀리초에서 초 단위인 매우 낮은 인산염 농도의 정량화를 가능하게 합니다.
SAMHD1은 인체건강과 질병에서 여러 가지 중요한 기능을 수행하며2 그 중 다수는 세포 내 dNTP 수준1 유지에 있어 중심적인 역할과 관련이 있을 수 있습니다. 따라서 SAMHD1의 dNTPase 활성에 대한 고품질 화학 프로브의 식별은 이러한 연결을 정의하는 강력한 도구가 될 것이며, 여기에 보고된 효소 결합 분석은 이러한 프로브를 식별하기 위해 쉽게 사용될 수 있습니다. 또한, 뉴클레오시드 기반 약물로서, 그 중 다수가 SAMHD1에 의해 조절되며, 다양하고 중요한 치료제군이다41; 화학 프로브는 이러한 치료법의 효능을 높이기 위해 임상 환경에서 SAMHD1을 표적으로 하는 약물로 더 발전할 수 있습니다. 또한 이러한 뉴클레오시드 기반 화합물과 SAMHD1의 상호 작용의 전체 범위를 이해하는 것이 중요하며, 이 효소 결합 분석법도 사용하여 해결할 수 있습니다. 종합하면, 여기에 보고된 효소 결합 SAMHD1 활성 분석법은 이 중요한 효소에 대한 이해를 높이는 데 사용할 수 있는 저비용, 다용도, 고처리량 분석법입니다.
공개
저자는 공개할 것이 없습니다.
감사의 말
조언과 지원을 아끼지 않은 Thomas Lundbäck과 Thomas Helleday 연구실 구성원에게 감사드립니다. 이 연구의 일부는 Karolinska Institutet/SciLifeLab(http://ki.se/psf)의 단백질 과학 시설에 의해 촉진되었으며, 화합물을 제공한 National Cancer Institute(NCI), Division of Cancer Treatment and Diagnosis(DCTD) 및 Developmental Therapeutics Program(DTP)(http://dtp.cancer.gov)에 감사드립니다. 기금은 스웨덴 연구 위원회(2018-02114), 스웨덴 암 학회(19-0056-JIA, 20-0879-PJ), 스웨덴 소아암 기금(PR2019-0014) 및 카롤린스카 연구소에서 SGR에 수여한 보조금으로 제공되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 2'-deoxyadenosine-5'-triphosphate (dATP) | Jena bioscience | NU-1001 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-deoxycytidine-5'-triphosphate (dCTP) | Jena bioscience | NU-1002 | Compound tested in SAMHD1 activator/substrate assay |
| 2'-Deoxyguanosine-5'-(α-thio)-triphosphate (dGTPαS) | Jena bioscience | NU-424 | Non-hydrolyzable dGTP analogue for SAMHD1 activator/substrate assay |
| 2'-deoxyguanosine-5'-triphosphate (dGTP) | GE Healthcare | 27-1870-04 | SAMHD1 allosteric activator and substrate used in inhibition assay and activator/substrate assay |
| 2'-Deoxythymidine-5'-[(α,β)-imido]triphosphate (dTMPNPP) | Jena bioscience | NU-907-1 | Compound tested in SAMHD1 inhibition assay |
| 2'-deoxythymidine-5'-triphosphate (dTTP) | Jena bioscience | NU-1004 | Compound tested in SAMHD1 activator/substrate assay |
| 2'Deoxyguanosine mohohydrate (dGuo) | Sigma-Aldrich | D0901 | Compound tested in SAMHD1 inhibition assay |
| 384 well clear flat-bottom microplate | Thermo Fisher Scientific | 262160 | Assay plate |
| 96 well clear U-bottom polypropylene microplate | Thermo Fisher Scientific | 267245 | Compound dilution plate |
| Ammonium heptamolybdate tetrahydrate | Sigma-Aldrich | A1343 | Reagent required for malachite green working reagent |
| ara-Cytidine-5'-triphosphate (ara-CTP) | Jena bioscience | NU-1170 | Compound tested in SAMHD1 activator/substrate assay |
| Clofarabine-5'-triphosphate (Cl-F-ara-ATP) | Jena bioscience | NU-874 | Compound tested in SAMHD1 activator/substrate assay |
| Dimethyl sulphoxide (DMSO) | VWR | 23486.297 | Solvent |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich | E5134 | EDTA stop solution component |
| Gemcitabine-5'-triphosphate (dF-dCTP) | Jena bioscience | NU-1607 | Compound tested in SAMHD1 activator/substrate assay |
| GraphPad Prism | GraphPad Software | Prism 8 | Data analysis and visualisation |
| Guanosine 5′-triphosphate (GTP) sodium salt hydrate | Sigma-Aldrich | G8877 | Allosteric activator for SAMHD1 activator/substrate assay |
| His-tagged E. coli inorganic pyrophosphatase (PPase) | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant PPase protein, hydrolises inorganic triphosphate and pyrophosphate to orthophosphate so it can form complex with malachite green |
| His-tagged human SAMHD1 | Generated in house using Protein Science Facility, Karolinska Institutet | - | Recombinant SAMHD1 protein, hydrolizes dNTPs into its corresponding nucleoside and inorganic triphosphate |
| Hydroxyurea | Sigma-Aldrich | H8627 | Compound tested in SAMHD1 inhibition assay |
| Lomofungin | National Cancer Institute (NCI)/Division of Cancer Treatment and Diagnosis (DCTD)/Developmental Therapeutics Program (DTP) | NSC106995 | Compound tested in SAMHD1 inhibition assay |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | SAMHD1 reaction buffer component |
| Malachite green Carbinol hydrochloride | Sigma-Aldrich | 213020 | Malachite green stock component |
| Microplate Reader | Hidex | Hidex Sense Microplate reader | Data acquisition, absorption read at 630 nm wavelength |
| Sodium Chloride (NaCl) | Sigma-Aldrich | 31434 | SAMHD1 reaction buffer component |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 567530 | SAMHD1 reaction buffer component |
| Sodium phosphate (Na3PO4) | Sigma-Aldrich | 342483 | Required for phosphate standard curve |
| Sulphuric acid 95-97% | Sigma-Aldrich | 84720 | Malachite green stock component |
| Tris-Acetate salt | Sigma-Aldrich | T1258 | SAMHD1 reaction buffer component |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) | Sigma-Aldrich | C4706 | SAMHD1 reaction buffer component |
| Tween-20 | Sigma-Aldrich | P1379 | SAMHD1 reaction buffer and malachite green working reagent component |
참고문헌
- Franzolin, E., et al. The deoxynucleotide triphosphohydrolase SAMHD1 is a major regulator of DNA precursor pools in mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14272-14277 (2013).
- Coggins, S. A., Mahboubi, B., Schinazi, R. F., Kim, B. SAMHD1 functions and human diseases. Viruses. 12 (4), 382 (2020).
- Goldstone, D. C., et al. HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase. Nature. 480 (7377), 379-382 (2011).
- Powell, R. D., Holland, P. J., Hollis, T., Perrino, F. W. Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase. The Journal of Biological Chemistry. 286 (51), 43596-43600 (2011).
- Morris, E. R., Taylor, I. A. The missing link: Allostery and catalysis in the anti-viral protein SAMHD1. Biochemical Society Transactions. 47 (4), 1013-1027 (2019).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2015).
- Herold, N., et al. Targeting SAMHD1 with the Vpx protein to improve cytarabine therapy for hematological malignancies. Nature Medicine. 23 (2), 256-263 (2017).
- Schneider, C., et al. SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia. Nature Medicine. 23 (2), 250-255 (2017).
- Hollenbaugh, J. A., et al. Substrates and inhibitors of SAMHD1. PloS One. 12 (1), 0169052 (2017).
- Knecht, K. M., et al. The structural basis for cancer drug interactions with the catalytic and allosteric sites of SAMHD1. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10022-10031 (2018).
- Oellerich, T., et al. Selective inactivation of hypomethylating agents by SAMHD1 provides a rationale for therapeutic stratification in AML. Nature Communications. 10 (1), 3475 (2019).
- Herold, N., et al. SAMHD1 protects cancer cells from various nucleoside-based antimetabolites. Cell Cycle. 16 (11), 1029-1038 (2017).
- Rothenburger, T., et al. SAMHD1 is a key regulator of the lineage-specific response of acute lymphoblastic leukaemias to nelarabine. Communications Biology. 3 (1), 324 (2020).
- Ordonez, P., et al. SAMHD1 enhances nucleoside- analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824 (2017).
- Castellví, M., et al. Pharmacological modulation of SAMHD1 activity by CDK4/6 inhibitors improves anticancer therapy. Cancers. 12 (3), 713-719 (2020).
- Rassidakis, G. Z., et al. Low-level expression of SAMHD1 in acute myeloid leukemia (AML) blasts correlates with improved outcome upon consolidation chemotherapy with high-dose cytarabine-based regimens. Blood Cancer Journal. 8 (11), 98 (2018).
- Rudd, S. G., Schaller, T., Herold, N. SAMHD1 is a barrier to antimetabolite-based cancer therapies. Molecular & Cellular Oncology. 4 (2), 1287554 (2017).
- Rudd, S. G., et al. Ribonucleotide reductase inhibitors suppress SAMHD1 ara-CTPase activity enhancing cytarabine efficacy. EMBO Molecular Medicine. 41, 10419 (2020).
- Seamon, K. J., et al. Small molecule inhibition of SAMHD1 dNTPase by tetramer destabilization. Journal of the American Chemical Society. 136 (28), 9822-9825 (2014).
- Seamon, K. J., Stivers, J. T. A high-throughput enzyme-coupled assay for SAMHD1 dNTPase. Journal of Biomolecular Screening. 20 (6), 801-809 (2015).
- Mauney, C. H., Perrino, F. W., Hollis, T. Identification of inhibitors of the dNTP triphosphohydrolase SAMHD1 using a novel and direct high-throughput assay. Biochemistry. 57 (47), 6624-6636 (2018).
- Morris, E. R., et al. Crystal structures of SAMHD1 inhibitor complexes reveal the mechanism of water-mediated dNTP hydrolysis. Nature Communications. 11 (1), 3165 (2020).
- Hansen, E. C., Seamon, K. J., Cravens, S. L., Stivers, J. T. GTP activator and dNTP substrates of HIV-1 restriction factor SAMHD1 generate a long-lived activated state. Proceedings of the National Academy of Sciences of the United States of America. 111 (18), 1843-1851 (2014).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Hyun, M., Bohr, V. A., Ahn, B. Biochemical characterization of the WRN-1 RecQ helicase of Caenorhabditis elegans. Biochemistry. 47 (28), 7583-7593 (2008).
- Lin, H. -. H., Huang, C. -. Y. Characterization of flavonol inhibition of DnaB helicase: real-time monitoring, structural modeling, and proposed mechanism. Journal of Biomedicine & Biotechnology. 2012 (4), 735368 (2012).
- Yang, M., Wang, G. ATPase activity measurement of DNA replicative helicase from Bacillus stearothermophilus by malachite green method. Analytical Biochemistry. 509, 46-49 (2016).
- Allard, B., Cousineau, I., Spring, K., Stagg, J. Measurement of CD73 enzymatic activity using luminescence-based and colorimetric assays. Methods in Enzymology. 629, 269-289 (2019).
- Lee, M., et al. Structure-activity relationship of sulfonyl piperazine LpxH inhibitors analyzed by an LpxE-coupled malachite green assay. ACS Infectious Diseases. 5 (4), 641-651 (2019).
- Carreras-Puigvert, J., et al. A comprehensive structural, biochemical and biological profiling of the human NUDIX hydrolase family. Nature Communications. 8 (1), 1541 (2017).
- Valerie, N. C. K., et al. NUDT15 hydrolyzes 6-thio-deoxyGTP to mediate the anticancer efficacy of 6-thioguanine. Cancer Research. 76 (18), 5501-5511 (2016).
- Carter, M., et al. Human NUDT22 Is a UDP-glucose/galactose hydrolase exhibiting a unique structural fold. Structure. 26 (2), 295-303 (2018).
- Gad, H., et al. MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool. Nature. 508 (7495), 215-221 (2014).
- Page, B. D. G., et al. Targeted NUDT5 inhibitors block hormone signaling in breast cancer cells. Nature Communications. 9 (1), 250 (2018).
- Zhang, S. M., et al. Development of a chemical probe against NUDT15. Nature Chemical Biology. 16 (10), 1120-1128 (2020).
- Michel, M., et al. In silico druggability assessment of the NUDIX hydrolase protein family as a workflow for target prioritization. Frontiers in Chemistry. 8, 443 (2020).
- Zhang, J., Chung, T., Oldenburg, K. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67 (1999).
- Baykov, A. A., Evtushenko, O. A., Avaeva, S. M. A malachite green procedure for orthophosphate determination and its use in alkaline phosphatase-based enzyme immunoassay. Analytical Biochemistry. 171 (2), 266-270 (1988).
- Markossian, S., et al. Assay guidance manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Holdgate, G. A., Meek, T. D., Grimley, R. L. Mechanistic enzymology in drug discovery: a fresh perspective. Nature Reviews Drug Discovery. 17 (2), 115-132 (2018).
- Tsesmetzis, N., Paulin, C. B. J., Rudd, S. G., Herold, N. Nucleobase and nucleoside analogues: resistance and re-sensitisation at the level of pharmacokinetics, pharmacodynamics and metabolism. Cancers. 10 (7), 240 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유