Method Article
نموذج محاكاة حيوية ثلاثي الأبعاد في المختبر للورم الأرومي العصبي باستخدام السقالات القائمة على الكولاجين
* These authors contributed equally
In This Article
Erratum Notice
Summary
تسرد هذه الورقة الخطوات المطلوبة لزرع خطوط خلايا الورم الأرومي العصبي على سقالات ثلاثية الأبعاد قائمة على الكولاجين الموصوفة سابقا ، والحفاظ على نمو الخلايا لإطار زمني محدد مسبقا ، واسترداد السقالات للعديد من نمو الخلايا وتحليلات سلوك الخلية والتطبيقات النهائية ، قابلة للتكيف لتلبية مجموعة من الأهداف التجريبية.
Abstract
الورم الأرومي العصبي هو الورم الصلب خارج الجمجمة الأكثر شيوعا لدى الأطفال، وهو ما يمثل 15٪ من إجمالي وفيات سرطان الأطفال. نسيج الورم الأصلي عبارة عن بيئة مجهرية معقدة ثلاثية الأبعاد (3D) تتضمن طبقات من الخلايا السرطانية وغير السرطانية محاطة بمصفوفة خارج الخلية (ECM). يوفر ECM الدعم المادي والبيولوجي ويساهم في تطور المرض وتشخيص المريض والاستجابة العلاجية.
تصف هذه الورقة بروتوكولا لتجميع نظام قائم على سقالة 3D لتقليد البيئة المكروية للورم الأرومي العصبي باستخدام خطوط خلايا الورم الأرومي العصبي والسقالات القائمة على الكولاجين. تستكمل السقالات إما بهيدروكسيباتيت نانو هيدروكسيباتيت (nHA) أو جليكوزامينوجليكان (GAGs) ، يوجد بشكل طبيعي بتركيزات عالية في العظام ونخاع العظام ، وهي أكثر المواقع النقيلية شيوعا للورم الأرومي العصبي. يسمح الهيكل المسامي 3D لهذه السقالات بربط خلايا الورم الأرومي العصبي والانتشار والهجرة وتشكيل مجموعات الخلايا. في هذه المصفوفة 3D ، تكون استجابة الخلية للعلاجات أكثر انعكاسا للوضع في الجسم الحي .
يمكن لنظام الاستزراع القائم على السقالات الحفاظ على كثافة خلايا أعلى من ثقافة الخلايا التقليدية ثنائية الأبعاد (2D). لذلك ، تعتمد بروتوكولات التحسين لأرقام خلايا البذر الأولية على الأطر الزمنية التجريبية المطلوبة. تتم مراقبة النموذج من خلال تقييم نمو الخلايا عن طريق تحديد كمية الحمض النووي ، وصلاحية الخلية عن طريق المقايسات الأيضية ، وتوزيع الخلايا داخل السقالات عن طريق التلوين النسيجي.
تشمل تطبيقات هذا النموذج تقييم ملامح التعبير الجيني والبروتيني بالإضافة إلى اختبار السمية الخلوية باستخدام الأدوية التقليدية و miRNAs. يسمح نظام الثقافة 3D بالتلاعب الدقيق بمكونات الخلية و ECM ، مما يخلق بيئة أكثر تشابها من الناحية الفسيولوجية مع أنسجة الورم الأصلية. لذلك ، فإن هذا النموذج 3D في المختبر سيعزز فهم التسبب في المرض ويحسن العلاقة بين النتائج التي تم الحصول عليها في المختبر ، في الجسم الحي في النماذج الحيوانية ، والموضوعات البشرية.
Introduction
الورم الأرومي العصبي هو سرطان يصيب الأطفال في الجهاز العصبي الودي ينشأ أثناء التطور الجنيني أو الحياة المبكرة بعد الولادة بسبب تحول خلايا القمة العصبية1. إنه الورم الصلب خارج الجمجمة الأكثر شيوعا عند الأطفال ، ويمثل 8٪ من الأورام الخبيثة التي تم تشخيصها في المرضى الذين تقل أعمارهم عن 15 عاما وهو مسؤول عن 15٪ من جميع وفيات سرطان الأطفال. يظهر المرض سلوكيات سريرية غير متجانسة للغاية بسبب تغيرات كروموسومية وجينية وجينية محددة ، وميزات علم التشريح المرضي.
تساهم هذه التعديلات في عدوانية الورم الأرومي العصبي والنتائج السيئة لدى مرضى الأطفال. وبالتالي ، أثبتت العلاجات الحالية عدم فعاليتها على المدى الطويل لما يقرب من 80 ٪ من المرضى الذين يعانون من المرض العدواني سريريا2 ، مما يسلط الضوء على حقيقة أن العلاج لهذه المجموعة من المرضى لا يزال يمثل تحديا. من المحتمل أن يكون هذا بسبب آليات عدم تجانس الورم الأرومي العصبي والنقائل التي لا تزال غير مفهومة تماما. ومع ذلك ، يعتقد الآن على نطاق واسع أن البيئة المكروية للورم (TME) تلعب دورا في تطور العديد من أنواع السرطان. ومع ذلك ، فإنه لا يزال غير مدروس في الورم الأرومي العصبي 3,4.
TME الأصلي هو بيئة دقيقة 3D معقدة تنطوي على خلايا سرطانية وغير سرطانية محاطة ب ECM. يشير ECM إلى المكون اللاخلوي للنسيج الذي يوفر الدعم الهيكلي والكيميائي الحيوي لسكانه الخلويين ويساهم في تطور المرض وتشخيص المريض والاستجابة العلاجية5. يرجع هذا الترويج لتطور المرض إلى "المعاملة بالمثل الديناميكية" أو الاتصال ثنائي الاتجاه المستمر بين الخلايا و ECM6،7،8. مع تقدم السرطان ، يتم إعادة تنظيم الكولاجين اللحمي في كثير من الأحيان في أنماط خطية عمودية على واجهة سرطان السدى ، والتي تستخدمها الخلايا السرطانية كطريق مهاجر إلى ورم خبيث9،10،11.
تشمل المكونات الرئيسية لهذه السقالة البيولوجية الوظيفية الأصلية شبكة ليفية من الكولاجين من النوع الأول والثاني وبروتينات أخرى ، بما في ذلك الإيلاستين والبروتينات السكرية مثل اللامينين ، بالإضافة إلى مجموعة من البروتيوغليكان والمكونات الأخرى القابلة للذوبان12,13. أصبحت هذه البروتينات من ECM الأصلية الآن جزيئات حيوية طبيعية جذابة لتطوير نماذج ثلاثية الأبعاد في المختبر 3. يزداد تطبيق سقالات 3D لثقافة الخلايا في المختبر بسبب تمثيلها الفسيولوجي الأكبر ل TME مقارنة بثقافة 2D أحادية الطبقة التقليدية. تساعد سقالات 3D المصنعة على ربط الخلايا ، والانتشار ، والهجرة ، والتمثيل الغذائي ، والاستجابة للمنبهات التي تظهر في الأنظمة البيولوجية في الجسم الحي.
المكون الرئيسي لهذه السقالات 3D هو الكولاجين ، وهو لاعب رئيسي في العديد من العمليات البيولوجية الطبيعية بما في ذلك إصلاح الأنسجة ، وتكوين الأوعية ، وتشكل الأنسجة ، والتصاق الخلايا ، والهجرة11. أظهرت مصفوفات 3D القائمة على الكولاجين وظائفها القوية لنمذجة ECM ، حيث تعمل كبيئة دقيقة للمحاكاة الحيوية في المختبر مع تمكين تفاعلات الخلايا ECM بالإضافة إلى هجرة الخلايا وغزوها. توفر هذه المصفوفات ثلاثية الأبعاد أيضا تحليلا أكثر دقة لاستجابة الخلايا لأدوية العلاج الكيميائي من الثقافة التقليدية ثنائية الأبعاد أو "المسطحة" في العديد من نماذج السرطان 14،15،16 ، بما في ذلك الورم الأرومي العصبي17،18. أبلغ التحليل الجيني لثقافات الخلايا ثلاثية الأبعاد عن ارتباط أعلى مع ملف الأنسجة البشرية حتى عند مقارنته بالنماذج الحيوانية19. بشكل عام ، فإن حجر الزاوية في هذه السقالات ثلاثية الأبعاد هو توفير خلايا مناسبة في بيئة المختبر ، والتي تلخص بنية الأنسجة الأصلية وتسهل الحديث المتبادل الجزيئيثنائي الاتجاه 8.
لزيادة تعقيد النماذج القائمة على الكولاجين ، يتم دمج مكونات ECM الشائعة الأخرى في عملية هندسة الأنسجة ، وبالتالي إنشاء نماذج أكثر صلة من الناحية الفسيولوجية لتعكس TMEs المتخصصة للأنسجة المختلفة. على سبيل المثال ، GAGs ، السكريات سالبة الشحنة الموجودة في جميع أنسجة الثدييات20 ، تسهل ارتباط الخلايا والهجرة والانتشار والتمايز. كبريتات شوندروتن هي نوع معين من GAG الموجود في العظام والغضاريف ، والذي تم استخدامه سابقا في تطبيقات هندسة الأنسجة لإصلاح العظام21،22،23،24،25. نانو هيدروكسيباتيت (nHA) هو المكون غير العضوي الرئيسي للتكوين المعدني لأنسجة العظام البشرية ، ويشكل ما يصل إلى 65٪ من العظام بالوزن26 ، وبالتالي يستخدم على نطاق واسع لاستبدال العظام وتجديدها27. وبالتالي ، فإن GAGs و nHA هي مركبات جذابة لإعادة بناء الورم الأرومي العصبي الأولي ECM ونمذجة المواقع النقيلية الأكثر شيوعا للورم الأرومي العصبي ونخاع العظام (70.5٪) والعظام (55.7٪) 28.
تم تطوير السقالات التي تتضمن مكونات ECM هذه في الأصل لتطبيقات هندسة أنسجة العظام مع تحليل مكثف للتوافق الحيوي والسمية والسمات الموصلة للعظام والحثالعظمي 29,30. إنها مصفوفات مسامية قائمة على الكولاجين يتم إنتاجها باستخدام تقنيات التجفيف بالتجميد للتحكم في خصائصها الفيزيائية والبيولوجية. أظهرت سقالات الكولاجين المكملة إما ب nHA (Coll-I-nHA) أو شوندروتن-6-كبريتات (Coll-I-GAG) نجاحا في محاكاة TME الأساسي في سرطان الثدي31 وورم خبيث للعظام في سرطان البروستاتا15 وكذلك الورم الأرومي العصبي17. تنتج تقنية التجفيف بالتجميد المستخدمة في تصنيع هذه السقالات المركبة تجانسا قابلا للتكرار في حجم المسام والمسامية داخل السقالات22،23،24. باختصار ، يتم تصنيع ملاط الكولاجين (0.5 بالوزن٪) عن طريق مزج الكولاجين الليفي مع 0.05 M حمض الأسيتيك. بالنسبة ل Coll-I-GAG ، تتم إضافة 0.05٪ بالوزن من كروندويتين-6-سلفات المعزولة من غضروف سمك القرش إلى ملاط الكولاجين أثناء المزج. بالنسبة لسقالات Coll-I-nHA المركبة ، يتم تصنيع جزيئات هيدروكسيباتيت بحجم النانو كما هو موضح سابقا27 وتضاف إلى ملاط الكولاجين بنسبة 2: 1 إلى وزن الكولاجين أثناء عملية المزج. يتم ربط جميع السقالات وتعقيمها جسديا باستخدام المعالجة الحرارية المائية عند 105 درجة مئوية لمدة 24 ساعة25. يتم الحصول على سقالات أسطوانية (قطرها 6 مم ، ارتفاع 4 مم) باستخدام لكمة خزعة ويمكن ربطها كيميائيا مع 3 mM N- (3-dimethylaminopropyl) -N'-ethylcarbodiimide hydrochloride و 5.5 mM N-hydroxysuccinimide (EDAC / NHS) في الماء المقطر (dH2O) لتحسين الخواص الميكانيكية للتركيبات30. تخلق عملية التصنيع المحسنة جيدا لسقالتين من الكولاجين سقالات ذات خصائص ميكانيكية قابلة للتكرار ، بما في ذلك حجم المسام والمسامية والصلابة (كيلو باسكال). تتميز كل من سقالات Coll-I-GAG و Coll-I-nHA بخصائص فيزيائية مختلفة ، مما يخلق ظروفا بيئية مختلفة. يتم عرض خصائص كل سقالة في الجدول 1.
| كول آي جاج | كول-I-nHA | |
| حجم سقالة (القطر [مم] × الارتفاع [مم]) | 6 س 4 17 | 6 س 4 17 |
| تركيز الكولاجين (بالوزن٪) | 0.5 17 | 0.5 17 |
| تركيز الركيزة (بالوزن٪) [على أساس وزن الكولاجين] | 0.05 15,17 | 200 17 |
| متوسط حجم المسام (مم) | 96 22 | 96 – 120 29 |
| المسامية (٪) | 99.5 23 | 98.9 – 99.4 27 |
| صلابة (كيلو باسكال) | 1.5 27 | 5.5 - 8.63 29 |
الجدول 1: نظرة عامة على الخواص الميكانيكية للسقالتين المعتمدتين لدراسة بيولوجيا الورم الأرومي العصبي.
تصف هذه الورقة بروتوكولا لتجميع نظام قائم على سقالة 3D لمحاكاة البيئة المكروية للورم الأرومي العصبي بشكل أفضل باستخدام خطوط خلايا الورم الأرومي العصبي والسقالات القائمة على الكولاجين الموصوفة سابقا والتي تستكمل إما ب nHA (Coll-I-nHA) أو شوندروتن-6-كبريتات (Coll-I-GAG). يتضمن البروتوكول طرقا نهائية لتحليل آليات نمو خلايا الورم الأرومي العصبي في بيئة أكثر صلة من الناحية الفسيولوجية باستخدام طرق غير مكلفة محسنة مسبقا مقتبسة من ثقافة أحادية الطبقة 2D الشكل 1.
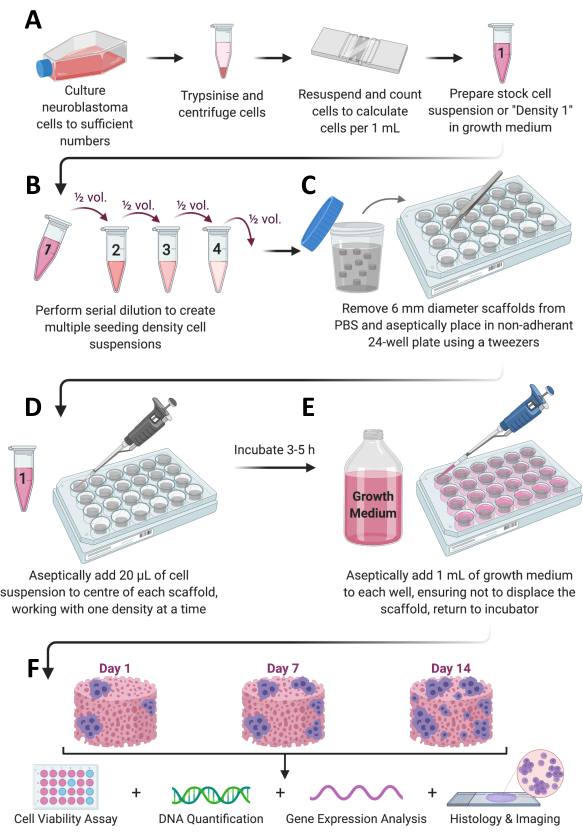
الشكل 1: سير عمل البروتوكول بشكل عام. (أ) تنمو الخلايا إلى أعداد كافية، وتنقسم وتعد، ويعاد تعليقها في حجم مناسب من الوسط. (ب) يخضع مخزون الخلية هذا بعد ذلك للتخفيف المتسلسل لتحضير إجمالي 4 معلقات خلوية بكثافات مختلفة. (ج) يتم طلاء السقالات القائمة على الكولاجين بشكل معقم في ألواح غير ملتصقة من 24 بئرا ، و (د) يضاف 20 ميكرولتر من معلق الخلية إلى مركز كل سقالة ويترك لاحتضانه عند 37 درجة مئوية ، و 5٪ CO2 ، و 95٪ رطوبة لمدة 3-5 ساعات. (ه) ثم يضاف وسط النمو الكامل (1 مل) ببطء إلى كل سقالة ، وتوضع الألواح مرة أخرى في الحاضنة للسماح بنمو الخلايا للإطار الزمني المطلوب. (F) في كل نقطة زمنية محددة مسبقا ، يتم استرداد العديد من السقالات لتقييم صلاحية الخلية ونموها ، وتحليل التعبير الجيني ، والتلطيخ النسيجي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. التصميم التجريبي
ملاحظة: سيعتمد عدد السقالات والخلايا اللازمة لكل تجربة على حجم التجربة ويمكن حسابها باستخدام الأدوات الموجودة في هذا القسم حول التصميم التجريبي.
- عدد السقالات المطلوبة
- تحديد الجدول الزمني التجريبي العام وفترات التقييم للتغيرات في بيولوجيا الخلية (على سبيل المثال ، نمو الخلايا والتمثيل الغذائي).
ملاحظة: على سبيل المثال ، الإطار الزمني التجريبي هو 14 يوما ، مع تقييم نمو الخلايا كل 7 أيام. وبالتالي ، فإن النقاط الزمنية التجريبية هي الأيام 1 و 7 و 14 مما يعطي ما مجموعه 3 نقاط زمنية. - بعد ذلك ، حدد عدد التطبيقات التجريبية التي سيتم تطبيقها في كل نقطة زمنية. حاول إكمال نفس التحليلات في كل نقطة زمنية لمراقبة التغييرات.
ملاحظة: تشمل التحليلات النموذجية لنمو الخلايا على السقالات فحوصات صلاحية الخلية ، وتحديد كمية الحمض النووي ، والتلوين النسيجي والتصوير ، وتحليل التعبير الجيني. وستناقش هذه المسائل بمزيد من التفصيل في الفرع 5. - قرر متى تستخدم نفس السقالة لتطبيقات متعددة في المصب ، على سبيل المثال ، بعد تقييم صلاحية الخلية باستخدام مقايسة مناسبة ، أعد استخدام السقالة لعزل الحمض النووي / الحمض النووي الريبي (تمت مناقشته في 5.1.11).
- احتفظ بما لا يقل عن 3 نسخ بيولوجية لكل تطبيق ، على سبيل المثال ، 3 سقالات لصلاحية الخلية وقياس كمية الحمض النووي ، و 3 لعلم الأنسجة ، و 3 لتحليل التعبير الجيني. نظرا لأن هذا يساوي 9 سقالات لكل نقطة زمنية ، خطط لاستخدام 27 سقالة لمدة 3 نقاط زمنية.
- أخيرا ، اضرب هذا الرقم في عدد المعلمات أو الظروف التجريبية (على سبيل المثال ، تقييم خطوط الخلايا المتعددة ، وكثافات البذر الأولية ، وتركيبات السقالة).
ملاحظة: في هذا البروتوكول ، تم تقييم 4 كثافات أولية مختلفة لخط خلية واحد ، مما أدى إلى 108 سقالات (27 سقالة × 4 شروط) مطلوبة. لحساب الخطأ البشري وإعطاء تغطية إضافية ، أضف ~ 10٪ إلى هذا الرقم ، على سبيل المثال ، إذا كانت هناك حاجة إلى 108 سقالات ، فقم بإعداد 120 سقالة.
- تحديد الجدول الزمني التجريبي العام وفترات التقييم للتغيرات في بيولوجيا الخلية (على سبيل المثال ، نمو الخلايا والتمثيل الغذائي).
- عدد الخلايا المطلوبة
ملاحظة: يوصى بحجم 20 ميكرولتر من تعليق الخلية لبذر الخلايا على سقالة أسطوانية (قطرها 6 مم ، ارتفاع 4 مم) في اليوم 0. يتم ضبط عدد الخلايا لكل 20 ميكرولتر من تعليق الخلية وفقا للتصميم التجريبي ، المحسوب في القسم 1.1. كثافة البذر الأولية الشائعة هي 2 × 105 خلايا لكل 20 ميكرولتر ، تستخدم كمثال للبروتوكول أدناه.- لحساب إجمالي عدد الخلايا المطلوبة للتجربة ، اضرب أول 2 × 105 خلايا لكل 20 ميكرولتر في عدد السقالات المطلوبة.
ملاحظة: على سبيل المثال ، 30 سقالة مضروبة في 20 ميكرولتر تعطي حجما إجماليا قدره 600 ميكرولتر. إذا كانت كل سقالة تتطلب 2 × 105 خلايا ، فإن 600 ميكرولتر من المعلق تحتوي على إجمالي 6 × 10 6 خلايا (2 × 105 × 30) ، مما يعطي مطلبا نهائيا قدره 6 × 106 خلايا في 600 ميكرولتر. سيحدد عدد المعلمات التجريبية العدد الإجمالي للخلايا المطلوبة. ومن ثم، يحدد هذا البروتوكول زراعة الخلايا باستخدام دورق زراعة خلية متعدد الطبقات، والذي يمكنه التعامل مع نفس عدد الخلايا مثل 10 قارورة تقليدية طولها 175 سم2.
- لحساب إجمالي عدد الخلايا المطلوبة للتجربة ، اضرب أول 2 × 105 خلايا لكل 20 ميكرولتر في عدد السقالات المطلوبة.
2. تحضير السقالات القائمة على الكولاجين
ملاحظة: يتم تحضير السقالات الأسطوانية Coll-I-nHA و Coll-I-GAG (قطرها 6 مم ، ارتفاع 4 مم) باستخدام الطرق المعمول بها15،21،27. بمجرد الربط الكيميائي وفقا للطرقالمنشورة سابقا 17 ، يجب استخدام السقالات في غضون أسبوع واحد.
- بعد تصنيع السقالات بالخصائص الميكانيكية المطلوبة ، تأكد من ترطيب السقالات بالكامل وغسلها جيدا في محلول ملحي مخزن بالفوسفات (PBS).
ملاحظة: يستغرق هذا بشكل عام ~ 12 ساعة بعد تشابك السقالات ويمكن تنفيذه في حاويات نفايات زراعة الأنسجة سعة 100 مل عند 4 °C ، بحد أقصى 50 سقالة لكل حاوية و 2 مل من PBS لكل سقالة. - قم بتخزين السقالات في برنامج تلفزيوني على حرارة 4 درجات مئوية حتى تصبح جاهزة للاستخدام.
3. نشر خلايا الورم الأرومي العصبي في قارورة ثقافة الخلايا متعددة الطبقات
ملاحظة: ستختلف كثافة البذر المثلى للقارورة متعددة الطبقات. بالنسبة للقارورة المستخدمة في هذه التجربة ، فإن الكثافة المثلى وفقا لتعليمات الشركة المصنعة هي 1 × 107 خلايا. قبل بذر الدورق متعدد الطبقات ، قم بنشر الخلايا بكثافة 1 × 107 خلايا أو أعلى في دورق زراعة الأنسجة المناسب (على سبيل المثال ، دورق زراعة الأنسجة T175 سم2 ). لزرع الخلايا في القارورة متعددة الطبقات (القسم 3.1) ، قم بزراعتها حتى تتجمع 70-80٪ ، وحصاد ، وحساب عدد الخلايا لكل مل ، مع الإشارة إلى الخطوات 3.2.16-3.2.20 لإجراء عدد الخلايا. بمجرد حساب تعليق الخلية ، انتقل فورا إلى بذر القارورة متعددة الطبقات. يجب أن يتم عمل زراعة الخلايا في غطاء التدفق الصفحي للحفاظ على العقم.
- بذر قارورة ثقافة الخلايا متعددة الطبقات
- قم بتسخين 550 مل من وسط النمو الكامل (يختلف حسب خط الخلية المستخدم) و 100 مل من برنامج تلفزيوني معقم في حمام مائي 37 درجة مئوية لمدة 20 دقيقة.
- باستخدام معلق الخلية المحصودة ، احسب الحجم المطلوب لتعليق الخلية اللازم لتحقيق كثافة البذر المثلى لخلايا 1 × 107 باستخدام المعادلة (1) ، حيث يشير WANT إلى عدد الخلايا المطلوبة لبذر القارورة متعددة الطبقات ، ويشير HAVE إلى عدد الخلايا / مل في تعليق الخلية:
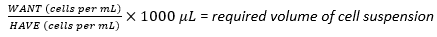 (1)
(1)
على سبيل المثال،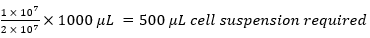
- أضف الحجم المطلوب من تعليق الخلية إلى 100 مل من وسط النمو المسخن مسبقا.
- خذ قارورة جديدة متعددة الطبقات في الغطاء ، وقم بإزالة الغطاء ، وأمسك القارورة بزاوية 60 درجة. ماصة ببطء كل 100 مل من تعليق الخلية في القارورة ، أسفل الجانب المائل من الرقبة. قم بتغطية القارورة وضعها على جانبها للسماح للخلايا بالتوزيع عبر الطبقات بالتساوي.
- بزاوية 60 درجة ، أضف 400 مل من وسط النمو المسخن مسبقا إلى الدورق متعدد الطبقات عن طريق سكبه أو سحبه ببطء أسفل الجانب المائل من الرقبة. إذا أصبحت الرقبة ممتلئة ، أعد القارورة إلى وضع مستقيم ، أو قم بتغطية القارورة وضعها على جانبها قبل العودة إلى الصب.
ملاحظة: صب ببطء لتجنب تكوين الفقاعة المفرطة. اضغط برفق على القارورة في الوضع الرأسي للسماح لجميع الفقاعات بالارتفاع إلى الأعلى وإزالتها باستخدام ماصة سعة 10 مل. تأكد من ملء القارورة إلى الخيط السفلي للرقبة ؛ أضف المزيد من الوسائط ، إذا لزم الأمر ، لتحقيق ذلك. - قم بتغطية القارورة متعددة الطبقات واحتضانها بحيث تكون الرقبة المائلة متجهة لأسفل عند 37 درجة مئوية ، و 5٪ CO2 ، و 95٪ رطوبة.
- تحقق من النمو كل 2-3 أيام للالتقاء. للتحقق من التقاء الطبقتين السفليتين من القارورة متعددة الطبقات ، قم بعرضها تحت عدسة موضوعية 4x لمجهر مقلوب.
ملاحظة: عند البذر مع 1 × 107 خلايا الورم الأرومي العصبي ، فإن القارورة المكونة من 10 طبقات تستغرق عادة أسبوعا واحدا لتصبح متقاربة - على الرغم من أن هذا قد يختلف اعتمادا على خط الخلية المستخدم.
- الصيانة الروتينية للخلايا في القارورة متعددة الطبقات
- قم بتسخين 550 مل من وسط النمو الكامل (يختلف حسب خط الخلية المستخدم) ، و 50-100 مل من التربسين ، و 300 مل من برنامج تلفزيوني معقم في حمام مائي 37 درجة مئوية لمدة 20 دقيقة.
- تحقق من القارورة متعددة الطبقات لالتقاء 70-80٪.
- ضع القارورة متعددة الطبقات في غطاء التدفق الصفحي وتخلص من الوسط المستهلك من القارورة عن طريق سكب. في البداية ، قم بإمالة القارورة بحيث يصب الوسيط فوق سد الهواء في حاوية نفايات. أثناء الصب ، قم بتدوير القارورة بمقدار 180 درجة حتى يتدفق الوسط أسفل عنق القارورة بزاوية. قم بتدوير الدورق ذهابا وإيابا على طول هذا المحور للتخلص من أي سائل متبقي.
- اغسل الخلايا بإضافة 100 مل من برنامج تلفزيوني معقم مسخن ببطء أسفل الرقبة المائلة. قم بتغطية القارورة ، وضعها على جانبها للسماح بتوزيع موحد ل PBS ، وقم بتدوير القارورة للخلف وللأمام لغسل الخلايا.
- تخلص من غسل PBS بنفس طريقة 3.2.3. كرر خطوات الغسيل.
- تمييع 50 مل من التربسين المسخن مسبقا في 50 مل من برنامج تلفزيوني معقم مسخن مسبقا. أضف 100 مل من محلول التربسين المخفف إلى الدورق متعدد الطبقات ، وقم بتغطيته ، وضع القارورة على جانبها للسماح بتوزيع موحد للتربسين. إذا كان خط الخلية شديد الالتصاق ، فاستخدم 100 مل من التربسين غير المخفف.
- احتضان القارورة لمدة 2-5 دقائق عند 37 درجة مئوية ، 5٪ CO2 ، و 95٪ رطوبة ، ومراقبة انفصال الخلايا تحت المجهر. إذا لزم الأمر ، اضغط على القارورة بقوة للمساعدة في الانفصال أو ضعها مرة أخرى في الحاضنة لمدة دقيقة أخرى.
- ضع القارورة متعددة الطبقات في غطاء التدفق الصفحي وقم بتحييد التربسين ب 100 مل من وسط النمو. قم بتغطية القارورة ، وضعها على جانبها ، وهزها للخلف وللأمام لضمان التحييد الكامل.
- صب تعليق الخلية المحايدة في أنابيب طرد مركزي مخروطية 4 × 50 مل.
ملاحظة: إذا كان الحصاد الكامل للخلايا مطلوبا ، اغسل القارورة متعددة الطبقات مرة أخرى ب 100 مل من PBS المعقم واسكبها في أنابيب طرد مركزي 2 × 50 مل. - أجهزة الطرد المركزي تعليق الخلية في أنابيب الطرد المركزي 50 مل في 340 × غرام لمدة 3-4 دقائق لحبيبات الخلايا.
- أعد أنابيب الطرد المركزي إلى غطاء التدفق الصفحي وتخلص بعناية من أكبر قدر ممكن من المواد الطافية من كل حبيبة.
ملاحظة: ستكون الحبيبات كبيرة وفضفاضة نسبيا ، وبالتالي يمكن تعطيلها بسهولة. - أضف 1-5 مل من وسط النمو إلى كل حبيبة وأعد تعليقها عن طريق السحب لأعلى ولأسفل عدة مرات.
- قم بتجميع 4 كريات معاد تعليقها معا في أنبوب طرد مركزي واحد سعة 50 مل ، وامزجها جيدا مع الماصة ، ولاحظ الحجم الإجمالي.
- قم بعمل تخفيف مناسب لتعليق الخلية لعد الخلايا بحيث يحتوي كل مربع خارجي على مقياس الدم على 30-100 خلية.
ملاحظة: تخفيف البدء المناسب هو 1: 100 ؛ لهذا ، ماصة 10 ميكرولتر من تعليق الخلية في أنبوب طرد مركزي مخروطي جديد سعة 15 مل وتخفيفه ب 990 ميكرولتر من برنامج تلفزيوني معقم. ماصة الخليط صعودا وهبوطا عدة مرات لخلط جيدا. - ضع أنبوب طرد مركزي سعة 50 مل يحتوي على مخزون الخلية في الحاضنة أثناء العد.
- بأخذ مقياس دم نظيف ، ضع غطاء نظيفا على الشبكة ، كما هو موضح في الشكل 2.
- ماصة 10 ميكرولتر من تعليق الخلية المخففة في غرفة مقياس الدم. إذا أصبحت الغرفة ممتلئة قبل توزيع كل 10 ميكرولتر ، فتوقف عن سحب الماصة.
- ضع مقياس الدم تحت هدف 4x للمجهر الضوئي. اضبط التركيز الخشن والدقيق لتصور الخلايا.
- احسب عدد الخلايا في مربعات الزاوية الخارجية الأربعة للغرفة كما هو موضح في الشكل 2. اجمع الأعداد الأربعة واقسم على 4 لحساب متوسط الخلايا لكل مربع.
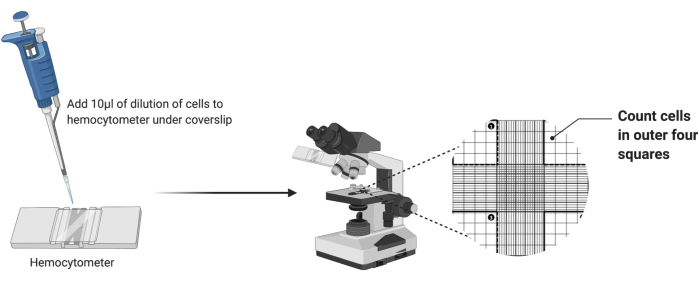
الشكل 2: عد الخلايا باستخدام مقياس الدم. تتم إضافة عشرة ميكرولترات من تعليق الخلية إلى مقياس الدم أسفل الغطاء. ثم يتم وضع الغرفة تحت العدسة الموضوعية 4x للمجهر ، ويتم حساب عدد الخلايا في الزوايا الخارجية الأربعة للشبكة. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
- اضرب متوسط العدد في عامل التخفيف (على سبيل المثال ، 100) واضرب هذا الرقم في 10000 للحصول على عدد الخلايا لكل مل باستخدام المعادلة (2).
 (2)
(2) - احسب العدد الإجمالي للخلايا في محلول المخزون بالضرب في الحجم الإجمالي لمخزون الخلية (على سبيل المثال ، إذا كانت الكريات المعلقة الأربعة المجمعة تصنع محلول 20 مل ، فاضرب الخلايا / مل في 20).
- للحفاظ على الدورق متعدد الطبقات ، استخدم المعادلة (1) الموضحة في الخطوة 3.1.2 لحساب حجم مخزون الخلية اللازم لزرع 1 × 107 خلايا مرة أخرى في القارورة وتنفيذ الخطوات 3.1.3-3.1.6 لإعادة زرع القارورة. إذا كنت مستعدا لزرع السقالات ، فانتقل إلى القسم التالي.
4. خلايا الورم الأرومي العصبي البذور على السقالات
- إعداد تعليق خلية الأسهم
ملاحظة: سيحدد هذا البروتوكول خطوات إنشاء أربع كثافات بذر مختلفة لخلايا الورم الأرومي العصبي ، مع عامل ضرب 2 بين كل كثافة. لذلك سيتم استخدام التخفيف التسلسلي لإنشاء ثلاث معلقات خلايا أخرى من تعليق المخزون. يجب أن يتم عمل زراعة الخلايا في غطاء التدفق الصفحي للحفاظ على العقم.- استخدم المعادلة (3) لحساب حجم الخلايا المطلوبة من إجمالي عدد الخلايا في الدورق متعدد الطبقات (محسوب في القسم 3.2.19) لإعداد كثافة البذر الأولى أو تعليق مخزون الخلية.
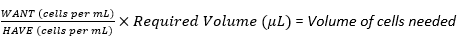 (3)
(3)
ملاحظة: على سبيل المثال ، إذا كانت أعلى كثافة للبذر هي 6 × 10 5 خلايا لكل سقالة مطلوبة ل 30 سقالة ، مع تلقي كل سقالة 20 ميكرولتر من تعليق الخلية ، فإن تعليق خلية المخزون سيتطلب 1.8 × 107 خلايا (6 × 105 خلايا × 30 سقالة) في حجم إجمالي قدره 600 ميكرولتر (20 ميكرولتر × 30 سقالة).
نظرا لأنه سيتم إجراء تخفيف تسلسلي من هذا المستحضر ، يجب مضاعفة هذه الأرقام ، أي 3.6 × 107 خلايا بحجم إجمالي يبلغ 1200 ميكرولتر. لتحويل هذا إلى WANT في الخلايا لكل مل ؛ قسم 3.6 × 10 7 على 1200 ميكرولتر واضربه في 1000 ميكرولتر ، مما يعطي 3 × 107 خلايا لكل مل.

- أضف الحجم المطلوب من مخزون الخلية إلى أنبوب طرد مركزي معقم سعة 2 مل أو 15 مل ووصل إلى الحجم النهائي البالغ 1200 ميكرولتر مع متوسط النمو. قم بتسمية هذا الأنبوب بالكثافة 1 (الشكل 3).
- استخدم المعادلة (3) لحساب حجم الخلايا المطلوبة من إجمالي عدد الخلايا في الدورق متعدد الطبقات (محسوب في القسم 3.2.19) لإعداد كثافة البذر الأولى أو تعليق مخزون الخلية.
- قم بإجراء التخفيف التسلسلي لإنشاء معلقات متعددة لخلايا كثافة البذر.
- من الكثافة 1 المحضرة في الخطوة 4.1.1 ، قم بإعداد ثلاث كثافات أخرى من تعليق الخلية من خلال التخفيف التسلسلي كما هو موضح في الشكل 3.
- خفف كل كثافة بعامل 2 في وسط النمو. أولا ، أضف الحجم النهائي المطلوب (600 ميكرولتر من المثال السابق) من متوسط النمو إلى ثلاثة أنابيب طرد مركزي معقمة سعة 2 مل أو 15 مل.
- انقل نصف الكثافة 1 (600 ميكرولتر) إلى أحد الأنابيب ، واخلط تعليق الخلية جيدا مع الوسط للتخفيف. قم بتسمية هذا الأنبوب باسم الكثافة 2.
- انقل نصف الكثافة 2 (600 ميكرولتر) إلى الأنبوب التالي ، مع خلط تعليق الخلية جيدا مع الوسط للتخفيف. قم بتسمية هذا الأنبوب باسم الكثافة 3.
- انقل نصف الكثافة 3 (600 ميكرولتر) إلى الأنبوب التالي ، مع خلط تعليق الخلية جيدا مع الوسط للتخفيف. قم بتسمية هذا الأنبوب باسم الكثافة 4.
- تخلص من 600 ميكرولتر من الكثافة 4 بحيث يكون لجميع المستحضرات الأربعة حجم نهائي يبلغ 600 ميكرولتر.
- كعنصر تحكم سلبي ، أضف 600 ميكرولتر من وسط النمو فقط إلى أنبوب طرد مركزي معقم سعة 2 مل. انظر الشكل 3 للحصول على مخطط لعملية التخفيف التسلسلي.
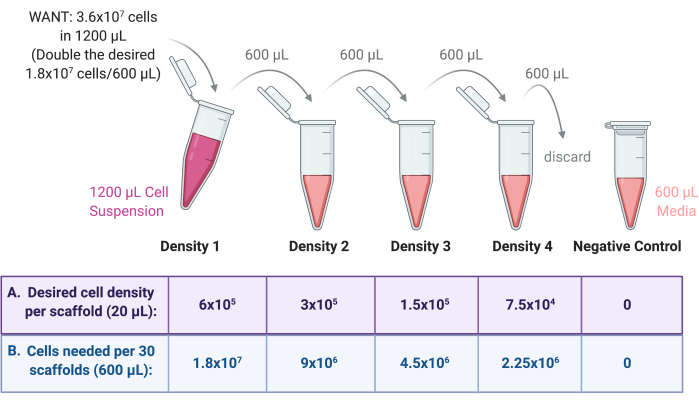
الشكل 3: التخفيف التسلسلي لمخزون الخلية لتحضير 4 معلقات ل 4 كثافات مختلفة لبذر السقالة. (أ) يمكن تعديل الأرقام لتناسب كثافة البذر المطلوبة لكل سقالة و (ب) مضروبة في العدد الإجمالي للسقالات لكل كثافة ، حيث تتلقى كل سقالة 20 ميكرولتر من تعليق الخلية. في هذا المثال ، تتطلب الكثافة 1 6 × 105 خلايا لكل سقالة ، أي ما يعادل 1.8 × 107 خلايا في 600 ميكرولتر ل 30 سقالة. يتم مضاعفة هذا الرقم لبدء التخفيف التسلسلي ، حيث يتم بعد ذلك نقل 600 ميكرولتر وتخفيفه في 600 ميكرولتر من وسط النمو في الأنبوب التالي. تستمر هذه العملية حتى يكون هناك 4 معلقات للخلايا بعامل 2 بين كل منها. يتم إجراء تحكم سلبي عن طريق إضافة 600 ميكرولتر من الوسط فقط إلى أنبوب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- إضافة معلقات الخلايا إلى السقالات
ملاحظة: قم بإزالة السقالات (المخزنة في PBS) من الثلاجة واتركها تصل إلى درجة حرارة الغرفة (RT) قبل إضافة الخلايا.- أحضر السقالات في PBS إلى غطاء التدفق الصفحي.
- باستخدام ملاقط معقمة ، ضع السقالات في ألواح غير ملتصقة من 24 بئرا مع سقالة واحدة لكل بئر (الشكل 1 ج). ارفع السقالات برفق من زواياها واضغط عليها برفق على جانب الحاوية لإزالة PBS الزائد. أضف السقالات إلى وسط جلد الآبار من جانب لأسفل (جانب الطبقة اللامع من السقالة ، متجها لأسفل في الألواح البلاستيكية المكونة من 24 بئرا).
- قم بتسمية الألواح المكونة من 24 بئرا بتفاصيل خط الخلية والمعلمات ذات الصلة (على سبيل المثال ، كثافة البذر) والنقاط الزمنية. اعمل بكثافة بذر خلية واحدة في كل مرة ، مع الحفاظ على الكثافات المتبقية في حاضنة 37 درجة مئوية حتى تصبح جاهزة للاستخدام.
- في غطاء التدفق الصفحي ، استخدم ماصة P20 ونصائح معقمة لإضافة 20 ميكرولتر برفق من تعليق الخلية ذي الصلة إلى مركز كل سقالة (الشكل 1 د). احتفظ بالخلايا معلقة جيدا عن طريق الخلط جيدا أثناء إضافة الخلايا إلى السقالات. تأكد من بقاء التعليق أعلى السقالة وعدم الانزلاق على قاعدة البئر ، لأن هذا لن يسمح بربط الخلية بالسقالة.
- بمجرد إضافة الخلايا ، احتضن الألواح لمدة 3-5 ساعات (37 درجة مئوية ، 5٪ CO2 ، و 95٪ رطوبة) للسماح لمعظم الخلايا بالالتصاق.
- بعد الحضانة ، أضف ببطء ورفق 1 مل من وسط النمو المسخن مسبقا إلى كل بئر (الشكل 1E). استخدم ماصة P1000 لإضافة الوسط للسماح بمزيد من الحركة البطيئة والتحكم ، مما يمنع إزاحة السقالات. إذا كنت تعمل مع عدد كبير جدا من السقالات ، فاستخدم ماصة سعة 10 مل مع ضبط مسدس الماصة على "إسقاط" و "منخفض".
- احتضان الألواح المكونة من 24 بئرا طوال الليل (37 درجة مئوية ، 5٪ CO2 ، و 95٪ رطوبة).
- صيانة الخلايا على السقالات
- بعد أول 24 ساعة من مرفق الخلية (اليوم الأول) ، انقل السقالات المصنفة إلى ألواح جديدة غير ملتصقة ب 24 بئرا ، وأضف 1-2 مل من وسط النمو الطازج.
ملاحظة: تزيل هذه الخطوة الخلايا التي سقطت في قاع الألواح البلاستيكية المكونة من 24 بئرا بدلا من السماح لها بالنمو على السقالات. سيتم إزالة النسخ المتماثلة للسقالة المعينة على أنها يوم 1 بعد 24 ساعة ، كما تمت مناقشته في القسم 5 ؛ وبالتالي ، لا تنطبق الصيانة على هذه السقالات. - راقب السقالات في البداية كل 2-3 أيام لتغيير لون وسط النمو. مع تقدم الوقت وتكاثر الخلايا داخل السقالات ، قم بتغذية الخلايا بشكل متكرر.
- باستخدام مسدس ماصة سعة 10 مل ، في الوضع البطيء ، قم بإزالة 1 مل من الوسط المستهلك وتجاهله. في حالة إجراء تجارب تتطلب وسيطا مشروطا ، اجمع الوسط المستهلك من النسخ البيولوجية في أنبوب طرد مركزي سعة 15 مل ، وأجهزة طرد مركزي عند 340 × جم لمدة 2 دقيقة لتكوير الحطام الخلوي ، ونقل المادة الطافية إلى أنبوب جديد ، وتخزينها في -80 درجة مئوية.
- أضف برفق 2 مل من وسط النمو المسخن مسبقا إلى السقالات ، باستخدام وظيفة التنقيط مرة أخرى على الماصة ، وأعد اللوحة المكونة من 24 بئرا إلى الحاضنة (37 درجة مئوية ، 5٪ CO2 ، و 95٪ رطوبة). كرر كلما تم إنفاق الوسيط طوال فترة النمو المطلوبة.
- بعد أول 24 ساعة من مرفق الخلية (اليوم الأول) ، انقل السقالات المصنفة إلى ألواح جديدة غير ملتصقة ب 24 بئرا ، وأضف 1-2 مل من وسط النمو الطازج.
5. استرجاع السقالة وتطبيقاتها
ملاحظة: في كل نقطة زمنية ، يمكن استخدام العديد من التطبيقات لمراقبة نمو الخلايا على السقالات أو تقييم ملفات تعريف التعبير الجيني والبروتيني. تعتمد شروط استرجاع السقالة على التحليل الذي سيتم إجراؤه ، مع طرق استرجاع متعددة موضحة في الأقسام الفرعية التالية والموضحة في الشكل 4.
- تقييم صلاحية الخلية داخل السقالات
- تعقيم كاشف فحص صلاحية الخلية المناسب عن طريق الترشيح من خلال مرشح معقم 0.2 ميكرومتر في أنبوب طرد مركزي في غطاء التدفق الصفحي. سخن هذا المحلول المعقم مع وسط النمو الكامل و PBS المعقم في حمام مائي 37 درجة مئوية.
- في غطاء التدفق الصفحي ، استخدم ملاقط معقمة لنقل السقالات لتحليلها إلى لوحة جديدة من 24 بئرا. قم بتسمية اللوحة بجميع التفاصيل ذات الصلة.
ملاحظة: قم بإجراء التحليل في ثلاث نسخ. - أضف 900 ميكرولتر من وسط النمو المسخن مسبقا إلى كل بئر ، متبوعا ب 100 ميكرولتر من كاشف صلاحية الخلية المعقمة. قم بتضمين عنصر تحكم سلبي عن طريق إضافة 900 ميكرولتر من الوسط و 100 ميكرولتر من كاشف صلاحية الخلية المعقمة إلى بئر بدون سقالة. استبدل الغطاء الموجود على اللوحة ، وقم بهز اللوحة برفق لمدة ~ 3 دقائق لتوزيع كاشف صلاحية الخلية المخفف بالتساوي في جميع أنحاء البئر. احتضان اللوحة عند 37 درجة مئوية ، 5٪ CO2 ، و 95٪ رطوبة.
ملاحظة: يجب تحسين أوقات الحضانة لكل خط خلوي ؛ راجع إرشادات الشركة المصنعة. بالنسبة لخطوط خلايا الورم الأرومي العصبي ، يبدو أن الحضانة لمدة 4-6 ساعات هي الأمثل. - بعد الحضانة ، قم بإزالة اللوحة من الحاضنة وهزها برفق لبضع ثوان.
- في غطاء التدفق الصفحي ، افتح صفيحة جديدة شفافة من 96 بئرا. من كل بئر في الصفيحة المكونة من 24 بئرا ، قم بنقل الوسط المحتضن والكاشف إلى ثلاثة آبار من صفيحة 96 بئرا مع 100 ميكرولتر لكل بئر ، مما يعطي ثلاث نسخ تقنية.
ملاحظة: سيترك هذا النقل 700 ميكرولتر في آبار لوحة 24 بئرا. - قم بتغطية لوحة 96 بئرا بورق الألمنيوم لحماية كاشف صلاحية الخلية من الضوء.
- قم بإزالة وتجاهل 700 ميكرولتر المتبقية من محتويات البئر من كل سقالة في لوحة 24 بئر. اغسل كل سقالة مرتين مع 1 مل من برنامج تلفزيوني معقم.
ملاحظة: لن تتم إزالة جميع الألوان من السقالات. يمكن بعد ذلك استخدام هذه السقالات لمزيد من التطبيقات ، على سبيل المثال ، تحديد كمية الحمض النووي ، عن طريق وضعها في 1 مل من 1٪ Triton X-100 في محلول بيكربونات الصوديوم 0.1 متر (NaHCO3) وتخزينها عند -80 درجة مئوية (انظر القسم 5.2 ، الشكل 4 ب). - قم بإزالة لوحة 96 بئرا من غطاء التدفق الصفحي وقم بقياس امتصاص كل بئر بأطوال موجية تبلغ 570 نانومتر و 600 نانومتر باستخدام قارئ صفيحة دقيقة. سجل قيم الامتصاص عند كلا الطولين الموجيين واتبع تعليمات الشركة المصنعة لحساب النسبة المئوية لتخفيض كاشف صلاحية الخلية بواسطة الخلايا.
- رسم بياني وتحليل إحصائي لنتائج صلاحية الخلية باستخدام البرامج المناسبة. أدخل قيما ثلاثية بيولوجية لإنتاج أشرطة خطأ والإشارة إلى تباين الفحص.
- لفحص التغيرات في صلاحية الخلية خلال الإطار الزمني التجريبي ، قم بإجراء تحليل أحادي الاتجاه لاختبار التباين (ANOVA) مع مقارنات متعددة للوسائل باستخدام برنامج الإحصاء الحيوي المناسب.
- أشر إلى فروق ذات دلالة إحصائية بين النقاط الزمنية على الرسوم البيانية مثل ns (P>0.05) و * (P≤0.05) و ** (P≤0.01) و *** (P≤0.001) و **** (P≤0.0001).
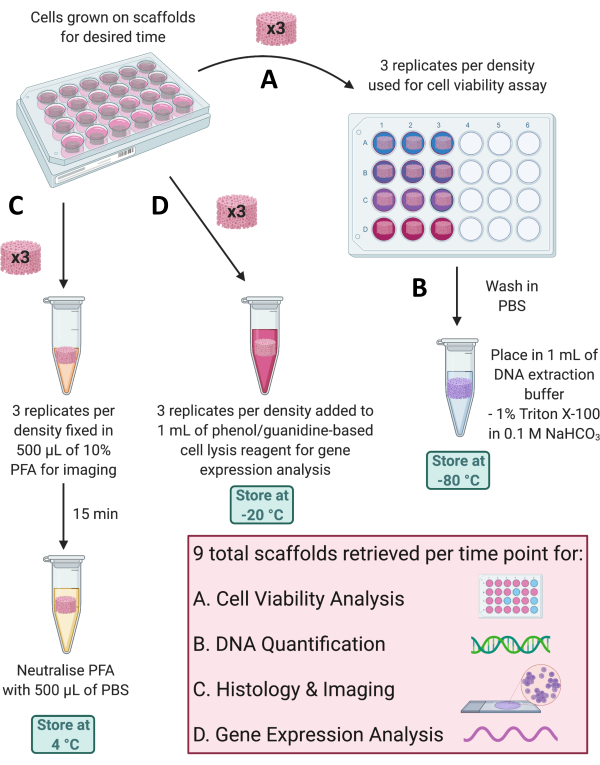
الشكل 4: استرجاع السقالات لتحليلات مختلفة في كل نقطة زمنية. (أ) يتم استرجاع ثلاث نسخ سقالة لتحليل صلاحية الخلية. (ب) يمكن بعد ذلك غسل هذه السقالات في PBS ، ووضعها في 1٪ Triton X-100 في 0.1 M NaHCO3 ، وتخزينها في -80 درجة مئوية لتحديد كمية الحمض النووي. (ج) يتم تثبيت ثلاث مكررات أخرى في 10٪ PFA لمدة 15 دقيقة ، ويتم تحييدها في PBS ، وتخزينها عند 4 درجات مئوية للتلطيخ والتصوير النسيجي. (د) وأخيرا، تضاف 3 مكررات إلى كاشف تحلل الخلايا القائم على الفينول/جوانيدين وتخزن عند -20 درجة مئوية لتحليل التعبير الجيني. الاختصارات: PBS = محلول ملحي مخزن بالفوسفات ؛ PFA = بارافورمالدهيد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- القياس الكمي للحمض النووي من الخلايا الموجودة في السقالات
ملاحظة: كما ذكر في الملاحظة بعد الخطوة 5.1.7 ، فإن استرجاع السقالات لتحديد كمية الحمض النووي ينطوي على وضع السقالات في أنابيب طرد مركزي سعة 2 مل تحتوي على 1 مل من 1٪ Triton X-100 في محلول 0.1 M NaHCO3 متبوعا بالتخزين عند -80 درجة مئوية. قبل إجراء تحليل الحمض النووي ، يجب أن تخضع الخلايا لثلاث دورات تجميد وذوبان لتحلل خلايا الورم الأرومي العصبي بشكل مناسب وإطلاق الحمض النووي للتحديد الكمي.- قم بإزالة العينات المخزنة مسبقا في Triton X-100 من -80 درجة مئوية. اترك العينات في RT لمدة 1-3 ساعات أو حتى تذوب.
- دوامة العينات لمدة 10-20 ثانية ، ووضع العينات مرة أخرى في -80 درجة مئوية لمدة 18-24 ساعة أو حتى تجمد تماما. كرر هذه العملية لما مجموعه ثلاث دورات تجميد وذوبان.
- لزيادة إنتاجية الحمض النووي ، استخدم محلل الأنسجة لتعطيل الخلايا في السقالات.
- ضع حبة معدنية في أنبوب الطرد المركزي سعة 2 مل الذي يحتوي على سقالة في Triton X-100 ، وضع الأنبوب داخل المحول لهز العينة عند 50 تذبذبا / ثانية لمدة 2-3 دقائق.
ملاحظة: استخدم أنابيب طرد مركزي مستديرة القاع حيث قد تستقر الخرزة المعدنية في أنبوب مدبب القاع.
- ضع حبة معدنية في أنبوب الطرد المركزي سعة 2 مل الذي يحتوي على سقالة في Triton X-100 ، وضع الأنبوب داخل المحول لهز العينة عند 50 تذبذبا / ثانية لمدة 2-3 دقائق.
- قم بقياس الحمض النووي في محلول Triton X-100 عن طريق تطبيق صبغة الحمض النووي الفلورية المزدوجة (dsDNA) وقياس الانبعاثات باستخدام قارئ الصفيحة الدقيقة. الرجوع إلى إرشادات الشركة المصنعة ؛ قم بتخفيف العينات بشكل مناسب في المخزن المؤقت Tris-ethylenediamine tetraacetic acid (TE) لإعداد 8 معايير dsDNA من خلال التخفيف التسلسلي في المخزن المؤقت TE (الشكل 5).
- في ألواح 96 بئرا سوداء غير شفافة ، أضف 100 ميكرولتر من كل معيار أو عينة إلى الآبار في ثلاث نسخ تقنية.
- قم بتخفيف صبغة dsDNA الفلورية 200 ضعف في المخزن المؤقت TE وأضف 100 ميكرولتر لكل معيار / عينة باستخدام ماصة متعددة القنوات. غطي الطبق بورق القصدير واحتضانه في RT لمدة 5 دقائق.
- قياس وتسجيل مضان كل بئر عند 520 نانومتر. اتبع إرشادات الشركة المصنعة لحساب تركيز الحمض النووي في كل عينة.
ملاحظة: إذا كان متوسط تركيز الحمض النووي لكل خلية معروفا لخط الخلية المستخدم، فيمكن تحويل قيم تركيز الحمض النووي إلى أرقام الخلايا باستخدام المعادلة (4). (4)
(4) - الرسم البياني والتحليل الإحصائي لنتائج قياس كمية الحمض النووي باستخدام البرامج المناسبة. أدخل قيما ثلاثية بيولوجية لإنتاج أشرطة خطأ والإشارة إلى تباين الفحص.
- لفحص التغيرات في تركيز الحمض النووي / أرقام الخلايا خلال الإطار الزمني التجريبي ، قم بإجراء اختبار ANOVA أحادي الاتجاه مع مقارنات متعددة للوسائل باستخدام برنامج الإحصاء الحيوي المناسب.
- أشر إلى فروق ذات دلالة إحصائية بين النقاط الزمنية على الرسوم البيانية مثل ns (P>0.05) و * (P≤0.05) و ** (P≤0.01) و *** (P≤0.001) و **** (P≤0.0001).
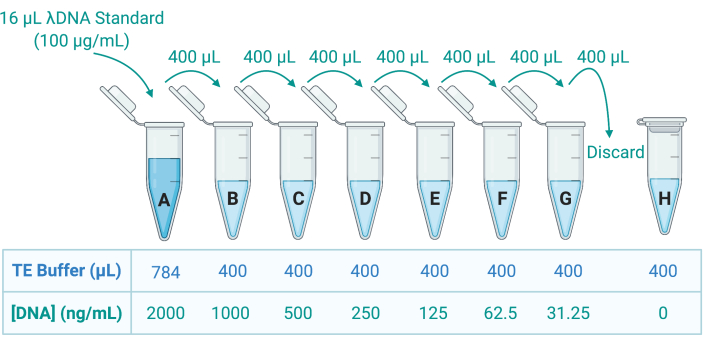
الشكل 5: تحضير ثمانية معايير للحمض النووي (DNA) لتوليد منحنى قياسي. يتم توفير محلول مخزون من λDNA عند 100 ميكروغرام / مل. يتم تخفيف هذا 50 ضعفا في المخزن المؤقت TE لإنشاء معيار A عند 2000 نانوغرام / مل ؛ ثم يتم نقل 400 ميكرولتر من A إلى الأنبوب B ، الذي يحتوي على 400 ميكرولتر TE buffer ؛ ثم يتم نقل 400 ميكرولتر من B وتخفيفه 2 أضعاف في C ، وهكذا حتى يتكون G. Standard H من مخزن مؤقت TE فقط وبالتالي يكون تركيز الحمض النووي 0 نانوغرام / مل. اختصار: TE = Tris-EDTA. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحضير السقالات للتلطيخ النسيجي
ملاحظة: يمكن تثبيت السقالات وتلطيخها لأغراض الفحص المجهري والتصوير إما كسقالات كاملة للتألق المناعي (IF) أو كشرائح مدمجة بالبارافين مثبتة بالفورمالين (FFPE) للتلطيخ النسيجي أو الكيمياء الهيستولوجية المناعية (IHC). وهذا يسمح بالتقييم النوعي لاختراق الخلايا وتوزيعها داخل السقالات ويمكن استخدامه لتقييم التعبير عن البروتينات.- تحضير محلول بارافورمالدهايد (PFA) بنسبة 10٪ في برنامج تلفزيوني. تأكد من وجود حل كاف لحجم نهائي يبلغ 500 ميكرولتر لكل سقالة.
- سخن هذا المحلول عند 37 درجة مئوية وأضف 500 ميكرولتر إلى أنابيب الطرد المركزي 2 مل لاسترجاع السقالة.
- قم بإزالة السقالات من الألواح غير الملتصقة المكونة من 24 بئرا (الخطوة 4.4.4) وضعها في غطاء التدفق الصفحي.
- باستخدام ملاقط معقمة ، انقل السقالات إلى أنابيب الطرد المركزي المصنفة التي تحتوي على 10٪ PFA. اترك السقالات مثبتة في محلول PFA لمدة 15 دقيقة. قم بتحييد PFA عن طريق إضافة 500 ميكرولتر PBS إلى كل أنبوب وتخزينها عند 4 درجات مئوية.
- لتحضير السقالات لمعالج الأنسجة الأوتوماتيكي ، قم بإزالتها من 4 درجات مئوية واستخدم الملقط لوضعها في أشرطة بلاستيكية تحمل جميع التفاصيل ذات الصلة بالقلم الرصاص. ضع جميع العلب في الحاوية المعدنية لمعالج المناديل.
- ابدأ البروتوكول المكون من 12 مرحلة على معالج الأنسجة لإصلاح السقالات وتجفيفها وتنظيفها والتسلل إليها بالبارافين طوال الليل. اجمع الكاسيتات التي تحتوي على العينات المعالجة.
- بعد ذلك ، قم بتضمين السقالات في كتل شمع البارافين للسماح ببضع السقالات في شرائح رفيعة جدا للتلطيخ.
ملاحظة: من المهم بشكل خاص مراعاة اتجاه السقالات عند إزالتها من الكاسيت وتضمينها في الشمع ، حيث سيؤثر ذلك على الزاوية التي يتم بها التقاط الصور. هذا مهم عند تقييم تسلل الخلايا إلى السقالات. - قم بتشغيل أداة تضمين الشمع واللوحة الباردة ؛ ارفع الغطاء للتحقق من مستوى الشمع. أعد التعبئة إذا لزم الأمر.
- العمل مع عينة واحدة في كل مرة ، افتح الكاسيت ، وأزل السقالة ، وقم بتوسيطها في القالب البلاستيكي.
- صب الشمع الساخن على العينة ، مع التأكد من الحفاظ على الاتجاه الصحيح وضبطه بملاقط دافئة ، إذا لزم الأمر ، قبل أن يصلب الشمع. صب المزيد من الشمع لملء القالب.
- ضع غطاء الكاسيت المسمى أعلى القالب البلاستيكي وأضف الشمع في الأعلى. ضع القالب على الطبق البارد لتصلب الشمع. يحفظ طوال الليل على حرارة 4 درجات مئوية لضمان تصلب شمع البارافين بالكامل قبل بضع المجهر.
- للتحضير للبضع المجهري ، قم بتشغيل حمام مائي بدرجة حرارة 35 درجة مئوية ، ولوحة التجفيف ، والميكروتوم.
- أدخل شفرة في الحامل وشد الرافعة لتثبيتها.
- اضبط سمك القطع والمقطع ، بشكل عام 5 مم لأقسام السقالة.
- قم بإزالة سقالة FFPE من القالب ، وقم بتثبيتها في الحامل الموجود في مقدمة الميكروتوم ، وقم بقص الشمع الزائد بعناية حول حواف العينة قبل قطع الأقسام.
- ابدأ في قطع كتلة الشمع عن طريق تدوير ذراع الميكروتوم ، مما يضمن حركة سلسة.
- اجمع المقاطع التي تشبه الشريط ، حوالي 3 أقسام سقالة في المرة الواحدة ، وضعها برفق في حمام مائي 35 درجة مئوية لإزالة التجاعيد. افصل الأقسام برفق أثناء وجودك في حمام مائي باستخدام الملقط.
- باستخدام شرائح المجهر الزجاجي المطلي بالبولي سين ، ارفع كل قسم من الحمام المائي بحيث يجلس القسم في وسط الشريحة. قم بتسمية كل شريحة بقلم رصاص.
- ضع الشرائح الزجاجية على لوح التجفيف أو في فرن تجفيف بدرجة حرارة 60 درجة مئوية. بمجرد تجفيفها ، قم بتخزينها في درجة حرارة 4 درجات مئوية وتابع البقعة النسيجية أو IHC المطلوبة.
- استرجاع السقالات لتحليل التعبير الجيني
- قم بإزالة السقالات من الألواح غير الملتصقة المكونة من 24 بئرا من الحاضنة (الخطوة 4.4.4) وضعها في غطاء التدفق الصفحي.
- باستخدام ملاقط معقمة ، انقل السقالات إلى أنابيب طرد مركزي جديدة سعة 2 مل.
- في غطاء الدخان ، أضف 1 مل من كاشف تحلل الخلايا القائم على الفينول / الجوانيدين إلى كل أنبوب لتحليل الخلايا في السقالات والسماح باستعادة الحمض النووي الريبي عالي الجودة.
- قم بتخزين الأنابيب في درجة حرارة -20 درجة مئوية حتى تصبح جاهزة لإجراء استخراج الحمض النووي الريبي باستخدام مجموعة مناسبة. باستخدام تفاعل البوليميراز الكمي المتسلسل القياسي للنسخ العكسي (RT-qPCR)17 ، قم بتقييم التعبير الجيني في الخلايا في السقالات.
النتائج
يحتوي نموذج السقالة القائم على الكولاجين الموصوف هنا على العديد من التطبيقات التي تتراوح من دراسة بيولوجيا الورم الأرومي العصبي إلى فحص العلاجات المضادة للسرطان في بيئة تشبه الأورام الأصلية من الناحية الفسيولوجية أكثر من زراعة الخلايا 2D التقليدية. قبل اختبار سؤال بحثي معين ، من الأهمية بمكان الحصول على توصيف كامل لارتباط الخلية وانتشارها وتسللها ضمن الإطار الزمني التجريبي المطلوب. تعتمد ظروف النمو على بيولوجيا كل خط خلية محدد. الأهم من ذلك ، يجب تنفيذ عدة طرق لتقييم نمو الخلايا لتحديد الظروف المثلى والأداء القوي.
هنا ، تم تقييم صلاحية خلايا الورم الأرومي العصبي المزروعة على السقالات باستخدام مقايسة صلاحية الخلية اللونية. يمكن إجراء هذا الفحص بشكل متكرر حسب الرغبة طوال الإطار الزمني التجريبي. بالنسبة للتجربة الموصوفة ، تم إجراء تقييم لصلاحية الخلية في الأيام 1 و 7 و 14 لخطين من خلايا الورم الأرومي العصبي ، KellyLuc و IMR32 ، نمت على سقالات Coll-I-nHA بكثافة 4 مختلفة (الشكل 6). تم تعيين الجدوى في اليوم 1 كخط أساس لمقارنة جميع القياسات اللاحقة. يعكس معدل انخفاض كاشف صلاحية الخلية بيولوجيا الخلية وخصائص نمو خطوط الخلايا الفردية ، بما في ذلك معدلات انتشارها والتمثيل الغذائي. كان من المتوقع وجود علاقة بين عدد الخلايا المزروعة على السقالات ومستوى الانخفاض. في هذه التجربة ، زاد انخفاض كاشف صلاحية الخلية بشكل عام مع كل نقطة زمنية لكلا خطي الخلية في جميع الكثافات ، كما هو متوقع.
ثم تم تقييم كل كثافة على حدة لكلا خطي الخلية لمقارنة الانخفاض عبر النقاط الزمنية. تم إجراء ANOVA أحادي الاتجاه مع اختبار المقارنات المتعددة ل Tukey للكشف عن الاختلافات الكبيرة في التقليل بين النقاط الزمنية (الشكل 7). بالنسبة لكل من خطوط الخلايا وجميع كثافات البذر ، كانت هناك زيادة كبيرة (P<0.05) في تقليل كاشف صلاحية الخلية عند مقارنة اليوم 1 واليوم 14. هذا يشير إلى زيادة كبيرة في الخلايا النشطة الأيضية الموجودة على السقالات. لم تكن هذه الزيادة كبيرة في جميع الحالات عند تقييم فترات السبعة أيام (اليوم 1 مقابل اليوم 7 ، اليوم 7 مقابل اليوم 14) ، مما يدل على أهمية تحسين كثافة البذر لتحقيق نافذة النمو المطلوبة.
لدعم نتائج مقايسة صلاحية الخلية ، يمكن أيضا قياس نمو الخلايا على السقالات بشكل غير مباشر من خلال القياس الكمي ل dsDNA المستخرج من السقالات باستخدام صبغة dsDNA الفلورية (الشكل 8 أ). مثل صلاحية الخلية ، يمكن إجراء قياس كمية الحمض النووي بشكل متكرر حسب الرغبة ضمن الجدول الزمني التجريبي. ومع ذلك ، يتطلب هذا التحليل الاسترجاع الكامل للسقالات وإنهاء نمو الخلايا ، وبالتالي يجب أن يؤخذ في الاعتبار في التخطيط التجريبي كما تمت مناقشته في القسم 1. في هذه التجربة ، تم قياس الحمض النووي في الأيام 1 و 7 و 14 لخطين من خلايا الورم الأرومي العصبي ، KellyLuc و IMR32 ، نمت على سقالات Coll-I-nHA بكثافة 4 مختلفة. نظرا لأن متوسط تركيز dsDNA لكل خلية معروف لخطوط الخلايا هذه ، فقد كان من الممكن اشتقاق عدد الخلايا لكل عينة من الحمض النووي الكمي (الشكل 8B).
أدى القياس الكمي للحمض النووي إلى تباين أعلى بين النسخ البيولوجية من تقييم صلاحية الخلية ولكنه زاد بشكل عام لكل نقطة زمنية ، مع تحديد أعلى المستويات في اليوم 14. يبدو أن خلايا IMR32 تصل إلى أعداد خلايا أعلى على سقالات Coll-I-nHA ، كما يتضح من تركيز الحمض النووي ، من خلايا KellyLuc. ثم تم تقييم كل كثافة على حدة لخطي الخلية لمقارنة الانخفاض عبر النقاط الزمنية. تم إجراء ANOVA أحادي الاتجاه مع اختبار المقارنات المتعددة ل Tukey للكشف عن الاختلافات الكبيرة في التقليل بين النقاط الزمنية (الشكل 8 ب).
بالنسبة لكل من خطوط الخلايا وجميع كثافات البذر ، كانت هناك زيادة كبيرة (P<0.05) في أعداد الخلايا عند مقارنة اليوم 1 واليوم 14 ، باستثناء KellyLuc عند كثافة البذر 4 (1 × 105 خلايا / سقالة) ، والتي لم تسفر عن زيادات كبيرة عبر أي من النقاط الزمنية. على غرار نتائج صلاحية الخلية ، لم تكن الزيادات كبيرة في جميع الحالات عند تقييم فترات السبعة أيام (اليوم 1 مقابل اليوم 7 ، اليوم 7 مقابل اليوم 14). عند مقارنة اتجاهات النقطة الزمنية لصلاحية الخلية وقياس كمية الحمض النووي ، كانت هناك بعض الاختلافات الطفيفة بين التحليلين. ومع ذلك ، لوحظت اتجاهات مماثلة بشكل عام ، مع زيادة القيم المتوسطة بين فترات 7 أيام لمعظم الكثافات. هذا يدل على أهمية مراقبة نمو الخلايا باستخدام أكثر من طريقة واحدة.
تم بعد ذلك تنفيذ تقييم بصري لمورفولوجيا نمو الخلايا وتوزيعها على السقالات ، بما في ذلك تلطيخ الهيماتوكسيلين واليوزين (H&E) التقليدي بالإضافة إلى IHC. من المتوقع أن تؤدي أنماط النمو المختلفة لخطوط الخلايا الفردية إلى ترتيبات مكانية متنوعة على السقالات ، بما في ذلك درجات مختلفة من الاختراق في السقالة وتجمع الخلايا. كانت السقالات مثبتة بالفورمالين ، ومدمجة بالبارافين ، ومقطعة إلى أقسام 5 مم (الشكل 9 أ) ، مما يعد السقالات لتقنيات التصور المتعددة ، بما في ذلك التلوين النسيجي و IHC.
تم تطبيق تلطيخ H&E الروتيني على خلايا Kelly و KellyCis83 و IMR32 المزروعة على سقالات قائمة على الكولاجين في الأيام 1 و 7 و 14 (الشكل 9 ب). سمح ذلك بتصور الاتجاه المكاني للخلايا على سقالتين قائمتين على الكولاجين على مدار 14 يوما. نمت خلايا كيلي الحساسة للسيسبلاتين وخلايا KellyCis83 المقاومة على كل من سقالات Coll-I-nHA (الشكل 9B ، i) وسقالات Coll-I-GAG (الشكل 9B ، ii). تمشيا مع البيانات المنشورة سابقا ، نمت خلايا KellyCis83 بمعدل أعلى وتسللت بشكل أعمق في كل من تركيبات السقالة من خط خلايا كيلي الأقل توغلا. تظهر بقعة H&E لخط خلايا ورم أرومي عصبي آخر ، IMR32 ، نمت على Coll-I-nHA نمط نمو متباين (الشكل 9B ، iii). نما خط الخلايا هذا في مجموعات كبيرة مكتظة بكثافة على سقالات الكولاجين خلال فترة 14 يوما. يمكن استخدام الفحص المجهري متحد البؤر برايتفيلد لتصور البنية المسامية للسقالات القائمة على الكولاجين (الشكل 9C) بسبب التألق الذاتي لألياف الكولاجين.
قمنا بتلوين الخلايا بالقضيب الذي يستهدف الأكتين الهيكلي الخلوي والبقع المضادة النووية ، 4 ، 6-دياميدينو -2-فينيليندول (DAPI) ، لمراقبة سمات خلية معينة طوال الجدول الزمني التجريبي. لوحظت وفرة من الأكتين في خلايا Kelly و KellyCis83 على سقالات Coll-I-GAG باستخدام هذه التقنية (الشكل 9D). توضح هذه النتائج كيف يمكن استخدام تقنيات التصوير المتعددة لاشتقاق المعلومات التي تم حلها مكانيا من خلايا الورم الأرومي العصبي المزروعة على السقالات باستخدام هذا البروتوكول. هذا التوصيف لأنماط نمو الخلايا على السقالات القائمة على الكولاجين خلال فترة معينة سيحسن فهم وتفسير أي مقايسات كيميائية حيوية في اتجاه مجرى النهر.
يمكن تحليل تعبير البروتين بواسطة الخلايا المزروعة على سقالات قائمة على الكولاجين لمقارنة النشاط الخلوي بالسيناريوهات في الجسم الحي . فحصت البيانات المنشورة سابقا تعبير chromogranin A (CgA) كعلامة إفرازية بديلة للورم الأرومي العصبي بواسطة خلايا KellyLuc و KellyCis83Luc المزروعة في أحاديات الخلايا وكذلك على سقالات Coll-I-nHA و Coll-I-GAG (الشكل 10). تم تقييم CgA في الوسائط المكيفة باستخدام مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) (الشكل 10A). يتم إفراز CgA بمعدل أعلى في خط خلايا KellyCis83 الأكثر عدوانية ومقاومة للعلاج الكيميائي مقارنة بكيلي (الشكل 10B ، C). كان هذا مهما في اليوم 7 على كل من سقالات Coll-I-GAG و Coll-I-nHA (P<0.05) ، في حين لم يكن هناك فرق كبير في هذه النقطة الزمنية للخلايا التي نمت كطبقة أحادية بواسطة ثقافة 2D التقليدية.
تسلط هذه النتائج الضوء أيضا على الجدول الزمني التجريبي المقيد عند نمو الخلايا في طبقة أحادية ، مع 7 أيام فقط من النمو تثبت أنها مجدية قبل أن تصل الخلايا إلى نقطة التقاء. يتغلب نمو الخلايا على السقالات على هذا القيد حيث يمكن الحفاظ عليها على مدى فترة أطول في ظروف أكثر صلة من الناحية الفسيولوجية. إن الجمع أعلاه من التقنيات للحصول على معلومات حول صلاحية الخلية ومحتوى الحمض النووي والتشكل الخلوي والترتيب المكاني وملامح التعبير يسهل تقييم نمو خلايا الورم الأرومي العصبي على مجموعة من السقالات القائمة على الكولاجين. يمكن أيضا تكييف هذا البروتوكول بسهولة لتلبية المتطلبات التجريبية المحددة والتطبيقات المطلوبة.
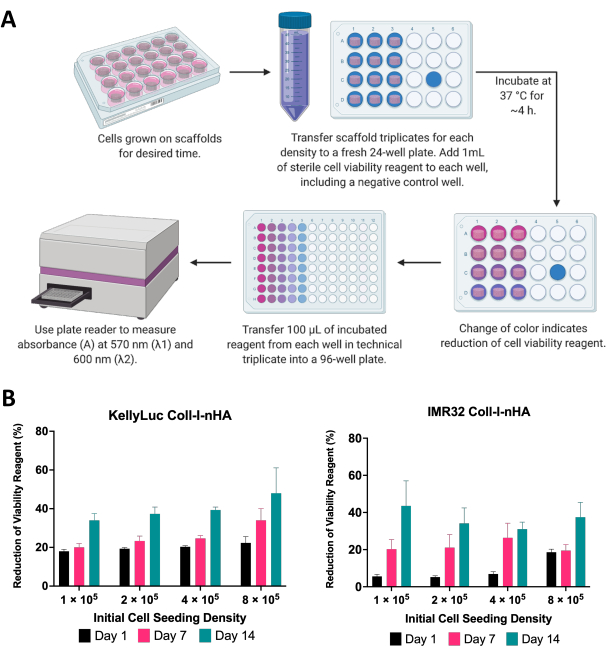
الشكل 6: تحليل صلاحية الخلية. (أ) الإجراء العام لقياس صلاحية خلايا الورم الأرومي العصبي على السقالات القائمة على الكولاجين باستخدام مقايسة صلاحية الخلية اللونية. يجب تحسين فترة الحضانة لكل خط خلية جديد ، بالإشارة إلى إرشادات الشركة المصنعة. (ب) النسبة المئوية لانخفاض كاشف صلاحية الخلية بواسطة خلايا KellyLuc و IMR32 المزروعة على سقالات Coll-I-nHA بأربع كثافات بذر أولية مختلفة ، تم قياسها في الأيام 1 و 7 و 14. تم تقييم العينات في ثلاث نسخ بيولوجية مع أشرطة خطأ تمثل الانحراف المعياري. الاختصارات: nHA = نانوهيدروكسيباتيت. Coll-I-nHA = سقالات الكولاجين المكملة ب nHA. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
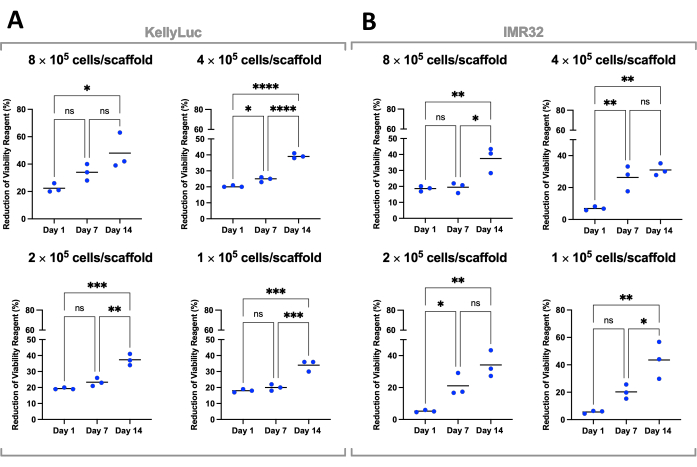
الشكل 7: صلاحية الخلية عن طريق كثافة البذر للخلايا المزروعة على Coll-I-nHA خلال فترة 14 يوما. (أ) كيليلوك؛ (ب) IMR32. تشير أرقام الخلايا المعنونة إلى كثافة بذر الخلايا الأولية على السقالات في اليوم 0. تم تقييم العينات في ثلاث نسخ بيولوجية ، يشار إليها بنقاط ثلاثية ، مع أشرطة تمثل المتوسط. تم استخدام ANOVA أحادي الاتجاه مع مقارنات متعددة للكشف عن الاختلافات الكبيرة في ٪ انخفاض كاشف صلاحية الخلية عبر النقاط الزمنية الثلاث ، المذكورة في الرسوم البيانية (ns P > 0.05 ، * P ≤ 0.05 ، ** P ≤ 0.01 ، *** P ≤ 0.001 ، **** P ≤ 0.0001). الاختصارات: nHA = نانوهيدروكسيباتيت. Coll-I-nHA = سقالات الكولاجين المكملة ب nHA ؛ ANOVA = تحليل التباين ؛ ns = غير مهم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
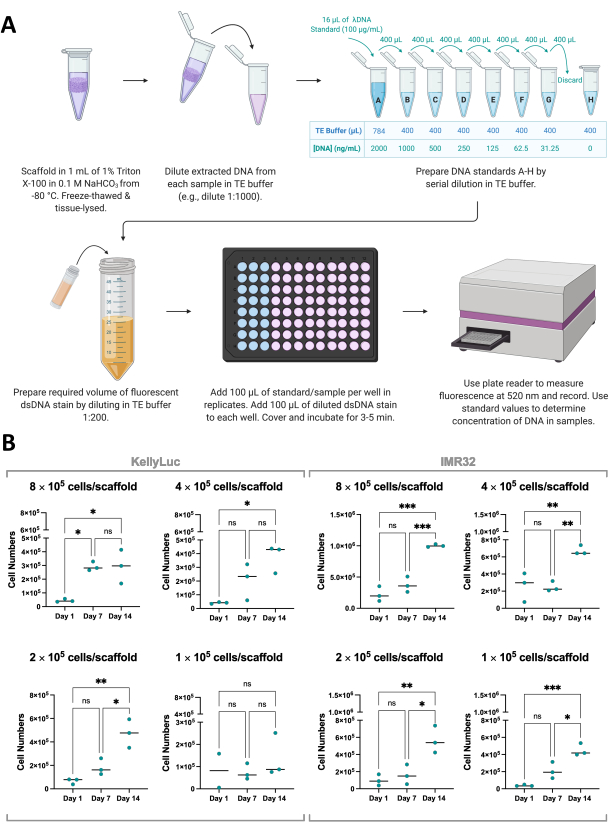
الشكل 8: تحديد كمية الحمض النووي المستخرج من الخلايا الموجودة في السقالات . (أ) عملية تحديد كمية dsDNA من الخلايا المزروعة على سقالات قائمة على الكولاجين باستخدام صبغة dsDNA الفلورية. (ب) أعداد الخلايا من تحليل تكميم الحمض النووي عن طريق كثافة البذر لخلايا KellyLuc و IMR32 المزروعة على Coll-I-nHA على مدار 14 يوما. تشير أرقام الخلايا المعنونة إلى كثافة بذر الخلايا الأولية على السقالات في اليوم 0. تم تقييم العينات في ثلاث نسخ بيولوجية ، يشار إليها بنقاط ثلاثية ، مع أشرطة تمثل المتوسط. تم استخدام ANOVA أحادي الاتجاه مع مقارنات متعددة للكشف عن الاختلافات ذات الدلالة الدلالة في أعداد الخلايا عبر النقاط الزمنية الثلاث ، المذكورة في الرسوم البيانية (ns P > 0.05 ، * P ≤ 0.05 ، ** P ≤ 0.01 ، *** P ≤ 0.001 ، **** P ≤ 0.0001). الاختصارات: nHA = نانوهيدروكسيباتيت. Coll-I-nHA = سقالات الكولاجين المكملة ب nHA ؛ dsDNA = الحمض النووي المزدوج الذين تقطعت بهم السبل ؛ TE = تريس إيدتا; ANOVA = تحليل التباين ؛ ns = غير مهم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
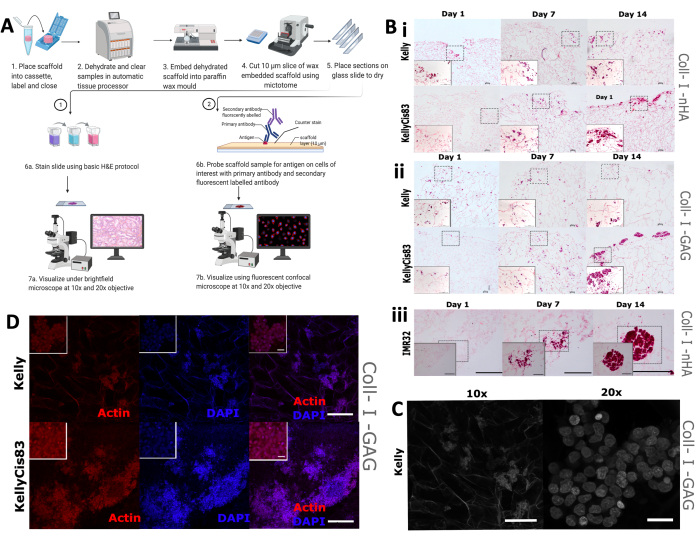
الشكل 9: خطوات معالجة الأنسجة لتحليل الكيمياء الهيستولوجية المناعية للسقالات . (أ) تمثيل تخطيطي لبروتوكول معالجة السقالات لتحليل الصور. تسمح هذه العملية بالتلوين النسيجي الروتيني وفحص الأجسام المضادة المحددة باستخدام الأجسام المضادة الأولية والأجسام المضادة الثانوية الموسومة بالفلورسنت. ب: صور تمثيلية لثلاثة خطوط خلايا للورم الأرومي العصبي معرضة لتلطيخ H&E . يتم التقاط صور H&E في الأيام 1 و 7 و 14 لمراقبة أنماط النمو على مدار فترة التجربة. شريط المقياس = 200 ميكرومتر. تمثل المربعات المتقطعة المساحة التي تم اختيارها للصور المكبرة بمعدل 20 ضعفا عند الحافة اليسرى السفلية. شريط المقياس = 20 ميكرومتر. (i و ii) H&E من خطوط خلايا الورم الأرومي العصبي Kelly و KellyCis83 (الألواح العلوية والسفلية ، على التوالي) على نوعين من السقالات القائمة على الكولاجين. (iii) H&E من خط خلايا IMR32 ، يمثل النمو الخلوي العنقودي على سقالة Coll-I-nHA. (ج) صورة تمثيلية لخط خلية كيلي، تخضع لمجهر برايت فيلد متحد البؤر. يسمح التألق الذاتي للكولاجين بتصور السقالة المسامية. شريط مقياس 10x = 200 ميكرومتر ، شريط مقياس 20x = 20 ميكرومتر. (د) صورة تمثيلية للسقالات المدمجة متبوعة بتحليل من قبل IHC مع phalloidin و DAPI عند تكبير 10x ، شريط المقياس = 200 ميكرومتر. تمثل المربعات الداخلية الأصغر الصور المكبرة (20x) ، شريط المقياس = 20 ميكرومتر. الاختصارات: nHA = نانوهيدروكسيباتيت. Coll-I-nHA = سقالات الكولاجين المكملة ب nHA ؛ هفوة = الجليكوزامينوجليكان. Coll-I-GAG = سقالات الكولاجين المكملة بكبريتات شوندروتن -6 ؛ H&E = الهيماتوكسيلين ويوزين. IHC = الكيمياء الهيستولوجية المناعية ؛ DAPI = 4 ′ ، 6-دياميدينو -2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
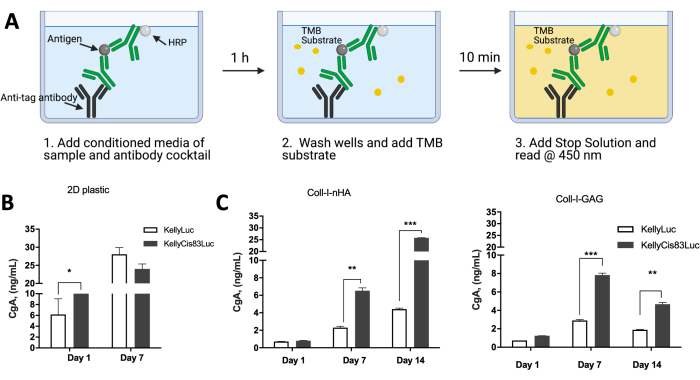
الشكل 10: التعبير البروتيني عن طريق خلايا الورم الأرومي العصبي المزروعة على سقالات قائمة على الكولاجين ثلاثي الأبعاد مقارنة بالبلاستيك ثنائي الأبعاد . (أ) رسم تخطيطي لكيفية إجراء CgA ELISA على وسائط مكيفة للخلايا المزروعة على سقالات بلاستيكية ثنائية الأبعاد أو سقالات 3D قائمة على الكولاجين. (ب) مستويات تعبير بروتين CgA مأخوذة من وسائط مكيفة للخلايا المزروعة على طبقة أحادية من البلاستيك 2D. عندما وصلت الخلايا إلى نقطة التقاء بعد 7 أيام ، لم تكن النقطة الزمنية البالغة 14 يوما قابلة للقراءة. بحلول اليوم 7 على البلاستيك ، لم يكن هناك فرق كبير في مستويات CgA بين خطوط خلايا Kelly و KellyCis83. (ج) تم إجراء CgA ELISA باستخدام وسائط مكيفة للخلايا المزروعة على سقالات قائمة على الكولاجين لمدة 14 يوما متتاليا. في اليوم 7 ، على كل من سقالات الكولاجين ، تكون مستويات CgA أعلى في خط خلايا KellyCis83 الأكثر عدوانية ، مما يسلط الضوء على مستويات أكثر فسيولوجية ذات صلة من CgA في مصفوفة 3D مقارنة بطبقة أحادية 2D. تم تعديل هذا الرقم من Curtin et al.17. الاختصارات: 3D = ثلاثي الأبعاد ؛ 2D = ثنائي الأبعاد ؛ CgA = كروموجرانين أ ؛ ELISA = مقايسة الممتز المناعي المرتبط بالإنزيم ؛ nHA = نانوهيدروكسيباتيت ؛ Coll-I-nHA = سقالات الكولاجين المكملة ب nHA ؛ هفوة = الجليكوزامينوجليكان. Coll-I-GAG = سقالات الكولاجين المكملة بكبريتات شوندروتن -6 ؛ TMB = 3،3 '، 5،5'-رباعي ميثيل بنزيدين ؛ HRP = بيروكسيديز الفجل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
لقد ثبت أن نموذج خلية سرطان السقالة ثلاثية الأبعاد أداة قيمة ومتعددة الاستخدامات لاكتساب نظرة ثاقبة ميكانيكية لنمو خلايا الورم الأرومي العصبي ، وقدرتها على البقاء ، وتسلل الخلايا في TME32 المبسط. يحاكي نموذج الورم الأرومي العصبي 3D الموصوف هنا الحد الأدنى من TME ويوفر بيانات ذات صلة من الناحية الفسيولوجية أكثر من ثقافة أحادية الطبقة 2D. عيب رئيسي في ثقافة الخلايا 3D هو زيادة التعقيد التجريبي والأطر الزمنية الأطول. الموصوف هنا هو بروتوكول محسن لبذر ونمو وصيانة خلايا الورم الأرومي العصبي على السقالات القائمة على الكولاجين تليها تحليلات وتطبيقات المصب ، مما يؤدي إلى توصيف قوي لنمو الخلايا. كنا نهدف إلى اكتساب نظرة ثاقبة حول كثافة بذر الخلايا المثلى للسقالات لخلق بيئة يمكن التنبؤ بها ويمكن التحكم فيها لتقييم العلاجات الدوائية المضادة للسرطان في نافذة تجريبية سريعة مدتها 14 يوما. يوفر الجمع بين كل هذه البروتوكولات البسيطة الموصوفة تقييما شاملا لنمو خلايا الورم الأرومي العصبي في نظام الزراعة في المختبر القائم على السقالة.
تم التأكيد على النقاط الحرجة في إعداد البروتوكول للسماح للعلماء بتأسيسها في مختبراتهم بسرعة. على سبيل المثال ، تسمح أوقات الحضانة المشار إليها للحصول على أداء أفضل لمقايسة صلاحية الخلية اللونية باختراق أعمق للكاشف في مسام السقالة للوصول إلى جميع الخلايا. علاوة على ذلك ، فإن تقنية تلطيخ dsDNA الفلورية قوية ومباشرة. ومع ذلك ، فإن إطلاق الحمض النووي من السقالات يتطلب تحللا قويا للخلايا لأن الخلايا "محاصرة" داخل ألياف الكولاجين.
باستخدام مقايسة قياس كمية الحمض النووي البسيطة الموصوفة ، يمكننا تحديد مرحلة نمو السجل على السقالات القائمة على الكولاجين لفحص الأدوية المضادة للسرطان باستخدام هذا النموذج. في الإعداد التجريبي الموصوف ، تم استخدام 4 كثافات أولية لبذر الخلايا مع فترة إجمالية مدتها 14 يوما ونقاط زمنية للتحليل في الأيام 1 و 7 و 14. حددنا أن خلايا KellyLuc المصنفة في 4 × 105 خلايا / سقالة لديها نافذة الانتشار الأكثر نشاطا بين اليومين 7 و 14. ستسمح بيانات نمو مرحلة السجل هذه بتفسير موثوق لمختلف تجارب السمية الخلوية للخلايا. إنه يزيل التكهنات حول أي انخفاض في النمو أو موت الخلايا الناتج عن النمو المكبوت على منصة 3D المسامية بدلا من سمية الأدوية. تعد صلاحية الخلية أيضا تقييما مستخدما على نطاق واسع لمدى ملاءمة منصات 3D لدعم نمو أنواع الخلايا المختلفة33,34. في حين أن هناك العديد من المقايسات لقياس صلاحية الخلية ، بما في ذلك التلوين الحي / الميت ، وقياس ATP ، ومقايسات الانتشار ، وجدنا أن استخدام مقايسة بقاء الخلية اللونية Alamar Blue هو تقنية بسيطة وفعالة لدعم بيانات قياس كمية الحمض النووي.
قدم الاستخدام المشترك لقياس كمية الحمض النووي وصلاحية الخلية دليلا تكميليا على أن الكثافة المثلى لخلايا البذور على السقالة لتحقيق نمو مستمر على مدى فترة 14 يوما هي 2-4 × 105 خلايا / سقالة. ومع ذلك ، يمكن بسهولة تكييف هذا البروتوكول لتلبية الأطر الزمنية التجريبية المختلفة والنقاط الزمنية للتحليل والتطبيقات النهائية. على الرغم من أن هذا البروتوكول يصف تقييم نمو الخلايا أحادية الزراعة لخلايا الورم الأرومي العصبي على السقالات ، إلا أن السقالات قابلة للتعديل بسهولة لاستخدامها كمنصة للثقافة المشتركة ، كما وصفها دو أمارال وآخرون ، الذين استخدموا سقالات الكولاجين GAG للمشاركة في زراعة الخلايا الكيراتينية والخلايا الليفية في التحقيق في التئام الجروح35.
يتيح نموذج 3D الموصوف تصور نمو الخلايا وتسللها باستخدام تقنيات مختلفة معروفة ، مثل التألق المناعي و H&E القياسي. من المهم تصور الخلايا جنبا إلى جنب مع توصيف النمو باستخدام المقايسات الكيميائية الحيوية بسبب تنوع مورفولوجيا الخلية وأنماط النمو على السقالات. يمكن أن يؤدي فهم نمط النمو إلى رؤى حول سلوك النمو والاستجابة المستقبلية للأدوية المضادة للسرطان. على سبيل المثال ، ينتج عن نمو IMR32 باستخدام القياس الكمي للحمض النووي أنماطا مماثلة لكيلي ، على الرغم من أنه عند التصور باستخدام H&E ، ينمو IMR32 في مجموعات أكبر من كيلي ، والتي أظهرت نموا أكثر تشتتا (الشكل 9). تعكس أنماط النمو المتنوعة لخطوط الخلايا في السقالات السيناريو السريري لعدم تجانس الورم. إن فحص الاستجابة للأدوية المضادة للسرطان باستخدام لوحة من خطوط الخلايا ذات الأشكال المختلفة في سقالات 3D سيزيد من القيمة التنبؤية لاستجابة المريض لنفس الأدوية.
يمكن أيضا إجراء الكشف عن التعبير الجيني أو البروتيني باستخدام طرق أخرى مثل RT-qPCR أو ELISA إذا تم إفراز البروتين محل الاهتمام. تم استخدام علامة بديلة لتطور الورم الأرومي العصبي ، chromogranin A (CgA) 36 ، لتوصيف نمو خلايا الورم الأرومي العصبي في 3D. كما هو موضح في العمل السابق17 ، زاد إفراز CgA مع تكاثر الخلايا (الشكل 10). في حين أن زراعة الخلايا أحادية الطبقة لم تستطع التقاط هذه الزيادة ، حيث أن الانتشار يعني أن الخلايا وصلت إلى التقاء كامل في أطباق الاستزراع ، فإن استخدام سقالات الكولاجين 3D سمح بالتقييم المطول لإفراز CgA.
قد لا يكون نموذج 3D في المختبر مناسبا لجميع الأسئلة البحثية لدراسة بيولوجيا الورم الأرومي العصبي والاستجابة للعلاجات. أحد القيود هو الاختراق غير المتكافئ للخلايا داخل السقالات وتشكيل مجموعات خلايا متفاوتة الحجم ، والتي تعتمد على خط خلية معين وقد تؤدي إلى انتشار لا يمكن السيطرة عليه للمغذيات وأدوية الاختبار. تؤثر هذه الميزة على متانة الفحص العلاجي. ومع ذلك ، على الرغم من هذا القيد ، من المهم مراعاة أن الأورام الأصلية غير متجانسة أيضا في الحجم وتوزيع الخلايا السرطانية وتحتوي على العديد من أنواع الخلايا الأخرى داخل أنسجة الورم. للتغلب على هذا القيد ، نقترح استخدام كل سقالة مملوءة بالخلايا كنسيج مجهري واحد سيتم تحسين المعلمات التالية له: (أ) أوقات الحضانة لكاشف صلاحية الخلية للوصول إلى الخلايا ومجموعات الخلايا ، و (ب) تحلل الخلايا في المخزن المؤقت Triton X-100 عن طريق المعالجة المسبقة للخلايا على السقالات باستخدام محلل الأنسجة لتحرير الحمض النووي للخلايا الموجودة في عمق السقالة.
هناك قيد تقني آخر لهذا البروتوكول وهو عدم وجود اختبار ميكانيكي لكل دفعة من السقالات المصنعة حديثا لهذا النموذج. ومع ذلك ، فإن استخدام عملية التصنيع القوية للسقالات ، والتي تم وصفها على نطاق واسع فيما يتعلق بالخصائص الفيزيائية والكيميائية للسقالات ، مثل معامل الانضغاط والشد ، والمسامية وهيكل المسام البصري ، والتجانس ، يضمن الحفاظ على صفات السقالة من خلال الدفعات21،24،27،30،37.
باختصار ، تقدم هذه الورقة سلسلة من الطرق البسيطة لتحليل النمو الخلوي على السقالات القائمة على الكولاجين. يمكن تبادل كل من الجدول الزمني التجريبي ونقاط التحليل اعتمادا على أسئلة البحث المحددة. هذا البروتوكول قابل للتكيف أيضا مع أنواع الخلايا الأخرى. تقدم النتائج الموضحة أعلاه دليلا على كيفية إعطاء هذا التجميع من الأساليب نظرة ثاقبة لكثافة البذر المثلى لمختلف خطوط خلايا الورم الأرومي العصبي لخلق نمو مستمر على مدار 14 يوما. يؤدي دمج النتائج التي تم الحصول عليها من جميع الطرق في هذا البروتوكول إلى فهم فائق لنمو الخلايا داخل مصفوفة الكولاجين 3D. من المحتمل أن يشمل الاستخدام المستقبلي لهذا النموذج أنظمة الاستزراع المشترك الخاصة بالورم الأرومي العصبي TME واختبار العديد من الأدوية الجديدة المضادة للسرطان.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل المركز الوطني لأبحاث الأطفال (NCRC) ، ومجلس البحوث الأيرلندي (IRC) ، والورم الأرومي العصبي في المملكة المتحدة. تم إنشاء الرسوم التوضيحية باستخدام BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| Cells | |||
| IMR-32 | ATCC | CCL-127 | |
| Kelly | ECACC | 82110411 | |
| KellyCis83 | Made in lab – derived from Kelly (Piskareva et al., 2015) | - | Increasing exposure to cisplatin. Cross resistance acquired |
| SH-SY5Y | ATCC | CRL-2266 | |
| Disposable | |||
| 0.22 µm syringe filter | Millex | SLHP033RS | |
| 1.5 mL Eppendorf tube | Eppendorf | 0030 120.086 | |
| 100 mL sterile Pot | Starstedt | - | |
| 10 mL plastic pipette | Cellstar | 607 180 | |
| 15 mL Falcon tube | Starstedt | 62.554.502 | |
| 25 mL plastic pipette | Cellstar | 760 180 | |
| 50 mL Falcon tube | Starstedt | 62.547.254 | |
| 5 mL plastic pipette | Cellstar | 606 180 | |
| 6 mm Biopsy punches | Kai Medical | BP-60F | |
| Aluminium foil | - | - | |
| Cover Slip | Menzel-Glaser | - | |
| HYPERflask | Corning | CLS10030 | |
| Microscope slides | Thermo Scientific | J1840AMNT | |
| Opaque black 96-well plate | Costar | 3915 | |
| Sterile P10 tips | Starlab | S1121-3810 | |
| Sterile P1000 tips | Starlab | S1122-1830 | |
| Sterile P20 tips | Starlab | S1123-1810 | |
| Sterile P200 tips | Starlab | S1120-8810 | |
| T-175 (175 cm2 flask) | Sarstedt | 83.3912 | |
| T-75 (75 cm2 flask) | Sarstedt | 83.3911.302 | |
| Translucent clear 96 well plate | Cellstar | 655180 | |
| Translucent non-adherent 24 well plates | Cellstar | 83.3922.500 | |
| Equipment | |||
| Autoclave | Astell | - | |
| Automatic tissue processor | Leica | TP1020 | |
| Centrifuge 5804 | Eppendorf | - | |
| Hemocytometer | Hausser Scientific | - | |
| Incubator | ThermoScientific | - | |
| Microtome | Leica | RM2255 | |
| Oven | Memmert | Calibrated by: Cruinn diagnostics Ltd | |
| P10 pipette | Gilson | ||
| P100 pipette | Gilson | ||
| P1000 pipette | Gilson | ||
| P20 pipette | Gilson | Calibrated by: Cruinn diagnostics Ltd | |
| P200 pipette | Gilson | Calibrated by: Cruinn diagnostics Ltd | |
| Paraffin section flotation bath | Electrothermal | MH8517 | Calibrated by: Cruinn diagnostics Ltd |
| Pipette electronic dispenser | Corning | StripipetterUltra | Calibrated by: Cruinn diagnostics Ltd |
| Plate cooler | Leica | EG1140C | Calibrated by: Cruinn diagnostics Ltd |
| Refrigerator -20 °C | Liebherr | - | |
| Refrigerator -80 °C | Liebherr | - | |
| Refrigerator 4 °C | Liebherr | - | |
| Seesaw Rocker | DLAb | SK-D1807-E | |
| Spectrophotometer – Victor3V Platereader | PerkinElmer | 1420 | |
| Tissue culture hood/Laminar flow hood | GMI | 8038-30-1044 | |
| Tissue Lyser | Qiagen | TissueLyser LT | |
| Tweezers | - | - | |
| Water bath | Grant | - | |
| Wax embedder | Leica | EG1140H | |
| Materials | |||
| 1 L Water | Adrona - Biosciences | 568 | |
| 1% Triton-X | Sigma Aldrich | 9002-93-1 | |
| 10x PBS tablets | Sigma Aldrich | P4417-100TAB | |
| 37% paraformaldehyde | Sigma-Aldrich | F8775 | |
| Alamar Blue Cell Viability Reagent | Invitrogen | DAL1100 | |
| Collagen- glycosaminoglycan scaffold | Tissue engineering research group (TERG) | ||
| Collagen-nanohydroxyapatite scaffold | Tissue engineering research group (TERG) | ||
| dH20 | Adrona - Biosciences | 568 | |
| Eosin | Sigma-Aldrich | E4009 | Made as per: (Cunniffe et al., 2010, Fitzgerald et al., 2015; O’Brien et al., 2005) |
| EtOH | Sigma-Aldrich | 1.00983.2500 | Made as per: (Cunniffe et al., 2010, Fitzgerald et al., 2015; O’Brien et al., 2005) |
| F12 | Gibco | 21765-029 | |
| FBS | Gibco | 10270-106 | |
| Hemaytoxylin | Sigma-Aldrich | HHS32-1L | |
| L-Glutamine | Gibco | 25030-024 | |
| MEM | Gibco | 21090-022 | |
| miRNA easy Kit | Qiagen | 217004 | |
| MNEAA’s | Gibco | 11140-035 | |
| Penicillin/streptomycin | Gibco | 015140-122 | |
| Qiazol | Qiagen | 79306 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| RPMI | Gibco | 21875-034 | |
| Sodium bicarbonate | Sigma Aldrich | S7795-500G | |
| Tissue embedding Medium | Sigma | A6330-4LB | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| Software | |||
| Excel | - | Excel 2016 | |
| ImageJ | - | - | |
| Prism | - | Version 9 |
References
- Davidoff, A. M. Neuroblastoma. Seminars in Pediatric Surgery. 21 (1), 2-14 (2012).
- Matthay, K. K., et al. Neuroblastoma. Nature Reviews Disease Primers. 2, 16078 (2016).
- Costard, L. S., Hosn, R. R., Ramanayake, H., O'Brien, F. J., Curtin, C. M. Influences of the 3D microenvironment on cancer cell behaviour and treatment responsiveness: a recent update on lung, breast and prostate cancer models. Acta Biomaterialia. , (2021).
- Borriello, L., Seeger, R. C., Asgharzadeh, S., Declerck, Y. A. More than the genes, the tumor microenvironment in neuroblastoma. Cancer Letters. 380 (1), 304-318 (2016).
- Walker, C., Mojares, E., Del Río Hernández, A. Role of extracellular matrix in development and cancer progression. International Journal of Molecular Sciences. 19 (10), 3028 (2018).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Schultz, G. S., Davidson, J. M., Kirsner, R. S., Bornstein, P., Herman, I. M. Dynamic reciprocity in the wound microenvironment. Wound Repair and Regeneration. 19 (2), 134-148 (2011).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Provenzano, P. P., et al. Collagen density promotes mammary tumor initiation and progression. BMC Medicine. 6, 11 (2008).
- Provenzano, P. P., et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Medicine. 4, 38 (2006).
- Ouellette, J. N., et al. Navigating the collagen jungle: The biomedical potential of fiber organization in cancer. Bioengineering. 8 (2), 1-19 (2021).
- Kreger, S. T., Voytik-Harbin, S. L. Hyaluronan concentration within a 3D collagen matrix modulates matrix viscoelasticity, but not fibroblast response. Matrix Biology. 28 (6), 336-346 (2009).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hume, R. D., et al. Tumour cell invasiveness and response to chemotherapeutics in adipocyte invested 3D engineered anisotropic collagen scaffolds. Scientific Reports. 8 (1), 12658 (2018).
- Fitzgerald, K. A., et al. The use of collagen-based scaffolds to simulate prostate cancer bone metastases with potential for evaluating delivery of nanoparticulate gene therapeutics. Biomaterials. 66, 53-66 (2015).
- Sapudom, J., Pompe, T. Biomimetic tumor microenvironments based on collagen matrices. Biomaterials Science. 6 (8), 2009-2024 (2018).
- Curtin, C., et al. A physiologically relevant 3D collagen-based scaffold-neuroblastoma cell system exhibits chemosensitivity similar to orthotopic xenograft models. Acta Biomaterialia. 70, 84-97 (2018).
- Gavin, C., et al. Neuroblastoma invasion strategies are regulated by the extracellular matrix. Cancers. 13 (4), 1-23 (2021).
- Ridky, T. W., Chow, J. M., Wong, D. J., Khavari, P. A. Invasive three-dimensional organotypic neoplasia from multiple normal human epithelia. Nature Medicine. 16 (12), 1450-1456 (2010).
- Casal, e. J., Crane, J. S. . Biochemistry, Glycosaminoglycans. , (2019).
- O'Brien, F. J., Harley, B. A., Yannas, I. V., Gibson, L. J. The effect of pore size on cell adhesion in collagen-GAG scaffolds. Biomaterials. 26 (4), 433-441 (2005).
- O'Brien, F. J., Harley, B. A., Yannas, I. V., Gibson, L. Influence of freezing rate on pore structure in freeze-dried collagen-GAG scaffolds. Biomaterials. 25 (6), 1077-1086 (2004).
- Haugh, M. G., Murphy, C. M., McKiernan, R. C., Altenbuchner, C., O'Brien, F. J. Crosslinking and mechanical properties significantly influence cell attachment, proliferation, and migration within collagen glycosaminoglycan scaffolds. Tissue Engineering. Part A. 17 (9-10), 1201-1208 (2011).
- Murphy, C. M., Haugh, M. G., O'Brien, F. J. The effect of mean pore size on cell attachment, proliferation and migration in collagen-glycosaminoglycan scaffolds for bone tissue engineering. Biomaterials. 31 (3), 461-466 (2010).
- Haugh, M. G., Jaasma, M. J., O'Brien, F. J. The effect of dehydrothermal treatment on the mechanical and structural properties of collagen-GAG scaffolds. Journal of Biomedical Materials Research - Part A. 89 (2), 363-369 (2009).
- Lowe, B., Hardy, J. G., Walsh, L. J. Optimizing nanohydroxyapatite nanocomposites for bone tissue engineering. ACS Omega. 5 (1), 1-9 (2020).
- Cunniffe, G. M., Dickson, G. R., Partap, S., Stanton, K. T., O'Brien, F. J. Development and characterisation of a collagen nano-hydroxyapatite composite scaffold for bone tissue engineering. Journal of Materials Science. Materials in Medicine. 21 (8), 2293-2298 (2010).
- DuBois, S. G., et al. Metastatic sites in stage IV and IVS neuroblastoma correlate with age, tumor biology, and survival. Journal of Pediatric Hematology/Oncology. 21 (3), 181-189 (1999).
- Ryan, A. J., Gleeson, J. P., Matsiko, A., Thompson, E. M., O'Brien, F. J. Effect of different hydroxyapatite incorporation methods on the structural and biological properties of porous collagen scaffolds for bone repair. Journal of Anatomy. 227 (6), 732-745 (2015).
- Tierney, C. M., et al. The effects of collagen concentration and crosslink density on the biological, structural and mechanical properties of collagen-GAG scaffolds for bone tissue engineering. Journal of the Mechanical Behavior of Biomedical Materials. 2 (2), 202-209 (2009).
- Cox, R. F., Jenkinson, A., Pohl, K., O'Brien, F. J., Morgan, M. P. Osteomimicry of mammary adenocarcinoma cells in vitro; increased expression of bone matrix proteins and proliferation within a 3D collagen environment. PLoS One. 7 (7), 41679 (2012).
- Nolan, J. C., et al. Preclinical models for neuroblastoma: advances and challenges. Cancer Letters. 474, 53-62 (2020).
- Sirivisoot, S., Pareta, R., Harrison, B. S. Protocol and cell responses in threedimensional conductive collagen gel scaffolds with conductive polymer nanofibres for tissue regeneration. Interface Focus. 4 (1), 20130050 (2014).
- Thevenot, P., Nair, A., Dey, J., Yang, J., Tang, L. Method to analyze three-dimensional cell distribution and infiltration in degradable scaffolds. Tissue Engineering. Part C-Methods. 14 (4), 319-331 (2008).
- do Amaral, R. J. F. C., et al. Functionalising collagen-based scaffolds with platelet-rich plasma for enhanced skin wound healing potential. Frontiers in Bioengineering and Biotechnology. 7, 371 (2019).
- Gkolfinopoulos, S., Tsapakidis, K., Papadimitriou, K., Papamichael, D., Kountourakis, P. Chromogranin A as a valid marker in oncology: Clinical application or false hopes. World Journal of Methodology. 7 (1), 9-15 (2017).
- O'Brien, F. J., et al. The effect of pore size on permeability and cell attachment in collagen scaffolds for tissue engineering. Technology and Health Care. 15 (1), 3-17 (2007).
Erratum
Formal Correction: Erratum: Three-dimensional In Vitro Biomimetic Model of Neuroblastoma using Collagen-based Scaffolds
Posted by JoVE Editors on 6/23/2022. Citeable Link.
An erratum was issued for: Three-dimensional In Vitro Biomimetic Model of Neuroblastoma using Collagen-based Scaffolds. The Authors section was updated.
The Authors section was updated from:
Ciara Gallagher*1,2,3
Catherine Murphy*1,2,3
Fergal J. O’Brien3,4,5
Olga Piskareva1,2,3,5,6
1Cancer Bioengineering Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
2School of Pharmacy and Biomolecular Sciences, RCSI University of Medicine and Health Sciences, Dublin, Ireland
3Tissue Engineering Research Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
4Trinity Centre for Bioengineering, Trinity College Dublin, Dublin, Ireland
5Advanced Materials and Bioengineering Research Centre (AMBER), RCSI and TCD, Dublin, Ireland
6National Children’s Research Centre, Our Lady's Children's Hospital Crumlin, Dublin, Ireland
* These authors contributed equally
to:
Ciara Gallagher*1,2,3
Catherine Murphy*1,2,3
Graeme Kelly4
Fergal J. O’Brien3,5,6
Olga Piskareva1,2,3,6,7
1Cancer Bioengineering Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
2School of Pharmacy and Biomolecular Sciences, RCSI University of Medicine and Health Sciences, Dublin, Ireland
3Tissue Engineering Research Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
4Department of Chemistry, Royal College of Surgeons in Ireland (RCSI), 123 St. Stephen’s Green, Dublin 2, Ireland
5Trinity Centre for Bioengineering, Trinity College Dublin, Dublin, Ireland
6Advanced Materials and Bioengineering Research Centre (AMBER), RCSI and TCD, Dublin, Ireland
7National Children’s Research Centre, Our Lady's Children's Hospital Crumlin, Dublin, Ireland
* These authors contributed equally
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved