Method Article
Kollajen Bazlı İskeleler Kullanılarak Nöroblastomun Üç Boyutlu İn Vitro Biyomimetik Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Erratum Notice
Özet
Bu makale, daha önce tarif edilen üç boyutlu kollajen bazlı iskelelerde nöroblastom hücre hatlarını tohumlamak, önceden belirlenmiş bir zaman dilimi için hücre büyümesini sürdürmek ve çeşitli hücre büyümesi ve hücre davranışı analizleri ve aşağı akış uygulamaları için iskeleleri almak için gereken adımları listeler.
Özet
Nöroblastom, çocuklarda en sık görülen ekstrakraniyal solid tümördür ve genel pediatrik kanser ölümlerinin %15'ini oluşturur. Doğal tümör dokusu, hücre dışı bir matris (ECM) ile çevrili kanserli ve kanserli olmayan hücre katmanlarını içeren karmaşık bir üç boyutlu (3D) mikro ortamdır. ECM, fiziksel ve biyolojik destek sağlar ve hastalığın ilerlemesine, hasta prognozuna ve terapötik yanıta katkıda bulunur.
Bu makale, nöroblastom hücre hatları ve kollajen bazlı iskeleler kullanarak nöroblastom mikroçevresini taklit etmek için 3D iskele tabanlı bir sistemin montajı için bir protokolü açıklamaktadır. İskeleler, nöroblastomun en yaygın metastatik bölgeleri olan kemik ve kemik iliğinde doğal olarak yüksek konsantrasyonlarda bulunan nanohidroksiapatit (nHA) veya glikozaminoglikanlar (GAG'ler) ile desteklenir. Bu iskelelerin 3 boyutlu gözenekli yapısı, nöroblastom hücre bağlanmasına, çoğalmasına ve göçüne ve hücre kümelerinin oluşumuna izin verir. Bu 3D matriste, terapötiklere hücre tepkisi, in vivo durumu daha iyi yansıtmaktadır.
İskele tabanlı kültür sistemi, geleneksel iki boyutlu (2D) hücre kültüründen daha yüksek hücre yoğunluklarını koruyabilir. Bu nedenle, ilk tohumlama hücre sayıları için optimizasyon protokolleri, istenen deneysel zaman dilimlerine bağlıdır. Model, DNA ölçümü yoluyla hücre büyümesini, metabolik deneyler yoluyla hücre canlılığını ve histolojik boyama yoluyla yapı iskeleleri içindeki hücre dağılımını değerlendirerek izlenir.
Bu modelin uygulamaları, gen ve protein ekspresyon profillerinin değerlendirilmesinin yanı sıra geleneksel ilaçlar ve miRNA'lar kullanılarak sitotoksisite testini içerir. 3D kültür sistemi, hücre ve ECM bileşenlerinin hassas bir şekilde manipüle edilmesine izin vererek, fizyolojik olarak doğal tümör dokusuna daha benzer bir ortam yaratır. Bu nedenle, bu 3D in vitro model, hastalık patogenezinin anlaşılmasını ilerletecek ve elde edilen sonuçlar arasındaki korelasyonu geliştirecektir in vitro, in vivo hayvan modelleri ve insan denekler.
Giriş
Nöroblastom, nöral krest hücrelerinin dönüşümü nedeniyle embriyonik gelişim veya doğum sonrası erken yaşam sırasında ortaya çıkan sempatik sinir sisteminin pediatrik bir kanseridir1. Çocuklarda en sık görülen solid ekstrakraniyal tümördür, 15 yaşın altındaki hastalarda teşhis edilen malignitelerin %8'ini temsil eder ve tüm çocukluk çağı kanser ölümlerinin %15'inden sorumludur. Hastalık, spesifik kromozomal, genetik ve epigenetik değişiklikler ve histopatoloji özellikleri nedeniyle oldukça heterojen klinik davranışlar gösterir.
Bu değişiklikler nöroblastomun agresifliğine ve pediatrik hastalarda kötü sonuçlara katkıda bulunur. Bu nedenle, mevcut tedavilerin klinik olarak agresif hastalığı olan hastaların neredeyse %80'i için uzun vadede etkisiz olduğu kanıtlanmıştır2 ve bu hasta grubu için tedavinin zor olduğu gerçeğini vurgulamaktadır. Bunun nedeni muhtemelen nöroblastom heterojenliği ve metastaz mekanizmalarının hala tam olarak anlaşılamamasıdır. Bununla birlikte, tümör mikroçevresinin (TME) artık birçok kanserin ilerlemesinde rol oynadığına inanılmaktadır; Yine de nöroblastomdayeterince çalışılmamıştır 3,4.
Doğal TME, bir ECM ile çevrili kanserli ve kanserli olmayan hücreleri içeren karmaşık bir 3D mikro ortamdır. ECM, hücresel sakinlerine yapısal ve biyokimyasal destek sağlayan ve hastalığın ilerlemesine, hasta prognozuna ve terapötik yanıta katkıda bulunan bir dokunun hücresel olmayan bileşenini ifade eder5. Hastalığın ilerlemesinin bu şekilde teşvik edilmesi, "dinamik karşılıklılık" veya hücreler ile ECM 6,7,8 arasında devam eden çift yönlü iletişimden kaynaklanmaktadır. Kanser ilerledikçe, stromal kollajen genellikle kanser hücrelerinin metastaziçin bir göç yolu olarak kullandığı stroma-kanser arayüzüne dik doğrusal desenlerde yeniden düzenlenir 9,10,11.
Bu doğal fonksiyonel biyolojik iskelenin ana bileşenleri, lifli bir kollajen ağı tip I ve II ve elastin, laminin gibi glikoproteinlerin yanı sıra bir dizi proteoglikan ve diğer çözünür bileşenleri içeren diğer proteinleri içerir12,13. Doğal ECM'nin bu proteinleri artık 3D in vitro modeller geliştirmek için çekici doğal biyomoleküller haline geldi3. İn vitro hücre kültürü için 3D yapı iskelelerinin uygulanması, geleneksel 2D tek tabakalı kültüre kıyasla TME'nin daha fazla fizyolojik temsili nedeniyle popülaritesini artırmaktadır. Üretilen 3D iskeleler, hücre bağlanmasına, çoğalmasına, göçüne, metabolizmaya ve in vivo biyolojik sistemlerde görülen uyaranlara yanıt vermeye yardımcı olur.
Bu 3D yapı iskelelerinin ana bileşeni, doku onarımı, anjiyogenez, doku morfogenezi, hücre yapışması ve göç dahil olmak üzere birçok normal biyolojik süreçte önemli bir oyuncu olan kolajendir11. Kollajen bazlı 3D matrisler, hücre-ECM etkileşimlerinin yanı sıra hücre göçü ve istilasını sağlarken in vitro biyomimetik bir mikro ortam olarak hizmet ederek ECM'yi modellemek için sağlam işlevselliklerini göstermiştir. Bu 3D matrisler ayrıca, nöroblastom17,18 dahil olmak üzere birçok kanser modelinde 14,15,16 geleneksel 2D veya "düz" kültürden kemoterapötik ilaçlara hücre yanıtının daha doğru bir analizini sağlar. 3D hücre kültürlerinin genetik analizi, hayvan modelleriyle karşılaştırıldığında bile insan doku profili ile daha yüksek bir korelasyon bildirmiştir19. Genel olarak, bu 3D yapı iskelelerinin temel taşı, hücrelere doğal doku mimarisini özetleyen ve çift yönlü moleküler karışmayı kolaylaştıran uygun bir in vitro ortam sağlamaktır8.
Kollajen bazlı modellerin karmaşıklığını artırmak için, diğer yaygın ECM bileşenleri doku mühendisliği sürecine dahil edilir, böylece farklı dokuların niş TME'lerini yansıtmak için fizyolojik olarak daha ilgili modeller oluşturulur. Örneğin, tüm memeli dokularında20 bulunan negatif yüklü polisakkaritler olan GAG'lar, hücre bağlanmasını, göçünü, çoğalmasını ve farklılaşmasını kolaylaştırır. Kondroitin sülfat, daha önce kemik onarımı için doku mühendisliği uygulamalarında kullanılmış olankemik ve kıkırdakta bulunan spesifik bir GAG türüdür 21,22,23,24,25. Nano-hidroksiapatit (nHA), insan kemik dokularının mineral bileşiminin ana inorganik bileşenidir ve ağırlığın %65'inioluşturur 26 ve bu nedenle kemik replasmanı ve rejenerasyonu için yaygın olarak kullanılır27. Bu nedenle, GAG'lar ve nHA, primer nöroblastom ECM'sini yeniden yapılandırmak ve nöroblastom, kemik iliği (%70.5) ve kemiğin (%55.7) en yaygın metastatik bölgelerini modellemek için çekici bileşiklerdir28.
Bu ECM bileşenlerini içeren iskeleler, başlangıçta biyouyumluluk, toksisite ve osteokondüktif ve osteoindüktif özelliklerinin kapsamlı analizi ile kemik dokusu mühendisliği uygulamaları için geliştirilmiştir29,30. Fiziksel ve biyolojik özelliklerini kontrol etmek için dondurarak kurutma teknikleri kullanılarak üretilen gözenekli, kolajen bazlı matrislerdir. nHA (Coll-I-nHA) veya kondroitin-6-sülfat (Coll-I-GAG) ile takviye edilen kollajen iskeleleri, meme kanserinde31 primer TME'yi taklit etmede ve prostat kanserinde15 kemiğe metastaz yapmada başarı gösterdi ve nöroblastom17. Bu kompozit iskeleleri üretmek için kullanılan dondurarak kurutma tekniği, iskeleler içinde gözenek boyutu ve gözeneklilik açısından tekrarlanabilir homojenlik sağlar22,23,24. Kısaca, fibriller kollajenin 0.05 M asetik asit ile karıştırılmasıyla bir kollajen bulamacı (ağırlıkça% 0.5) üretilir. Coll-I-GAG için, karıştırma sırasında kollajen bulamacına köpekbalığı kıkırdağından izole edilen krondoitin-6-sülfatın ağırlıkça% 0.05'i eklenir. Kompozit Coll-I-nHA iskeleleri için, nano boyutlu hidroksiapatit parçacıkları daha önce tarif edildiği gibisentezlenir 27 ve harmanlama işlemi sırasında kollajen ağırlığına 2: 1 oranında kollajen bulamacına eklenir. Tüm iskeleler fiziksel olarak çapraz bağlanır ve 105 °C'de 24 saat25 boyunca dehidrotermal işlem kullanılarak sterilize edilir. Silindirik iskeleler (6 mm çap, 4 mm yükseklik) bir biyopsi zımbası kullanılarak elde edilir ve yapıların mekanik özelliklerini iyileştirmek için damıtılmış suda (dH2O) 3 mM N- (3-dimetilaminopropil) -N'-etilkarbodiimid hidroklorür ve 5.5 mM N-hidroksisüksinimid (EDAC / NHS) ile kimyasal olarak çapraz bağlanabilir30. İki kollajen iskelesinin bu iyi optimize edilmiş üretim süreci, gözenek boyutu, gözeneklilik ve sertlik (kPa) dahil olmak üzere tekrarlanabilir mekanik özelliklere sahip iskeleler oluşturur. Hem Coll-I-GAG hem de Coll-I-nHA iskeleleri, farklı çevresel koşullar yaratan farklı fiziksel özelliklere sahiptir. Her iskelenin özellikleri Tablo 1'de gösterilmektedir.
| Coll-I-GAG | Coll-I-nHA | |
| İskele Boyutu (çap [mm] x yükseklik [mm]) | 6 x 4 17 | 6 x 4 17 |
| Kollajen Konsantrasyonu (ağırlıkça%) | 0,5 17 | 0,5 17 |
| Substrat Konsantrasyonu (ağırlıkça%) [kollajen ağırlığına göre] | 0,05 15,17 | 200 17 |
| Ortalama gözenek boyutu (mm) | 96 22 | 96 – 120 29 |
| Gözeneklilik (%) | 99.5 23 | 98,9 – 99,4 27 |
| Sertlik (kPa) | 1.5 27 | 5,5 - 8,63 29 |
Tablo 1: Nöroblastom biyolojisini incelemek için kullanılan iki iskelenin mekanik özelliklerine genel bakış.
Bu makale, nöroblastom hücre hatlarını ve daha önce nHA (Coll-I-nHA) veya kondroitin-6-sülfat (Coll-I-GAG) ile desteklenmiş kollajen bazlı iskeleleri kullanarak nöroblastom mikroçevresini daha iyi taklit etmek için 3D iskele tabanlı bir sistemin bir araya getirilmesi protokolünü açıklamaktadır. Protokol, 2D tek katmanlı kültürden uyarlanmış önceden optimize edilmiş ucuz yöntemler kullanarak nöroblastom hücrelerinin büyüme mekanizmalarını fizyolojik olarak daha ilgili bir ortamda analiz etmek için aşağı akış yöntemlerini içerir Şekil 1.
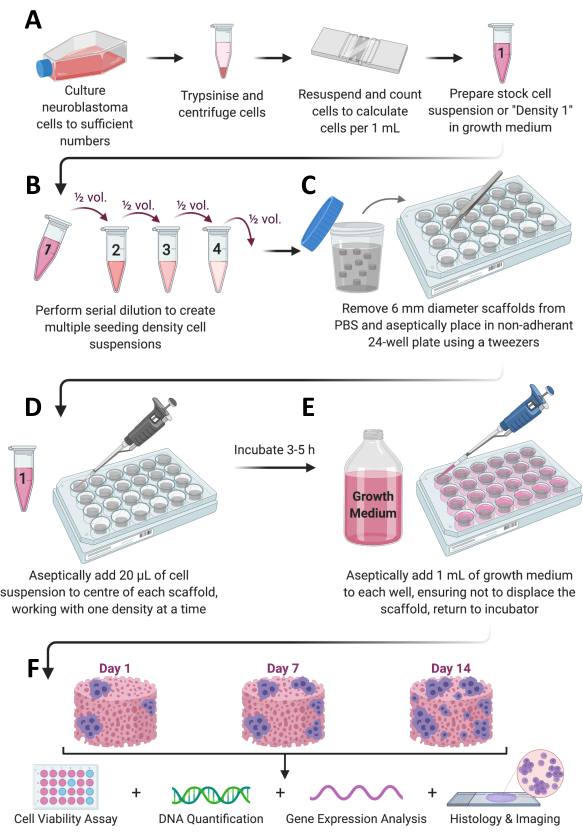
Şekil 1: Genel protokol iş akışı. (A) Hücreler yeterli sayıya kadar büyütülür, bölünür, sayılır ve uygun bir hacimde yeniden süspanse edilir. (B) Bu hücre stoğu daha sonra farklı yoğunluklarda toplam 4 hücre süspansiyonu hazırlamak için seri seyreltmeye tabi tutulur. (C) Kollajen bazlı iskeleler, yapışmayan 24 oyuklu plakalara steril olarak kaplanır ve (D) her bir iskelenin ortasına 20 μL hücre süspansiyonu eklenir ve 37 °C, %5CO2 ve %95 nemde 3-5 saat inkübe edilmeye bırakılır. (E) Tam büyüme ortamı (1 mL) daha sonra her bir iskeleye yavaşça eklenir ve plakalar, istenen zaman dilimi için hücre büyümesine izin vermek için inkübatöre geri yerleştirilir. (F) Önceden belirlenmiş her zaman noktasında, hücre canlılığı ve büyüme değerlendirmesi, gen ekspresyon analizi ve histolojik boyama için birkaç iskele alınır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Deneysel tasarım
NOT: Her deney için gereken yapı iskelesi ve hücre sayısı, deneyin ölçeğine bağlı olacaktır ve deney tasarımıyla ilgili bu bölümdeki araçlar kullanılarak hesaplanabilir.
- Gerekli iskele sayısı
- Hücre biyolojisindeki değişiklikler (örneğin, hücre büyümesi ve metabolizması) için genel deneysel zaman çizelgesini ve değerlendirme aralıklarını belirleyin.
NOT: Örneğin, deneysel zaman çerçevesi 14 gündür ve her 7 günde bir hücre büyümesi değerlendirilir. Böylece, deneysel zaman noktaları 1, 7, 14. günlerdir ve toplam 3 zaman noktası verir. - Ardından, her bir zaman noktasında uygulanacak deneysel uygulama sayısına karar verin. Değişiklikleri izlemek için her zaman noktasında aynı analizleri tamamlamaya çalışın.
NOT: İskelelerde hücre büyümesinin tipik analizleri, hücre canlılığı deneylerini, DNA miktar tayini, histolojik boyama ve görüntülemeyi ve gen ekspresyon analizini içerir. Bunlar bölüm 5'te daha ayrıntılı olarak tartışılacaktır. - Birden fazla aşağı akış uygulaması için aynı iskelenin ne zaman kullanılacağına karar verin, örneğin, uygun bir tahlil kullanarak hücre canlılığı değerlendirmesinden sonra, yapı iskelesini DNA/RNA izolasyonu için yeniden kullanın (5.1.11'de tartışılmıştır).
- Her uygulama için en az 3 biyolojik kopya bulundurun, örneğin hücre canlılığı ve DNA ölçümü için 3 iskele, histoloji için 3 ve gen ekspresyon analizi için 3 iskele. Bu, zaman noktası başına 9 iskeleye eşit olduğundan, 3 zaman noktası için 27 iskele kullanmayı planlayın.
- Son olarak, bu sayıyı deneysel parametrelerin veya koşulların sayısıyla çarpın (örneğin, çoklu hücre hatlarının değerlendirilmesi, ilk tohumlama yoğunlukları, iskele bileşimleri).
NOT: Bu protokolde, bir hücre hattı için 4 farklı başlangıç tohumlama yoğunluğu değerlendiriliyor ve bu da 108 (27 iskele x 4 koşul) iskele gerektiğiyle sonuçlanıyordu. İnsan hatasını hesaba katmak ve ekstra teminat sağlamak için bu sayıya ~%10 ekleyin, örneğin 108 iskele gerekiyorsa 120 iskele hazırlayın.
- Hücre biyolojisindeki değişiklikler (örneğin, hücre büyümesi ve metabolizması) için genel deneysel zaman çizelgesini ve değerlendirme aralıklarını belirleyin.
- Gerekli hücre sayısı
NOT: Hücrelerin Gün 0'da silindirik bir iskeleye (çap 6 mm, yükseklik 4 mm) ekilmesi için 20 μL hacimde bir hücre süspansiyonu önerilir. Bu 20 μL hücre süspansiyonu başına hücre sayısı, bölüm 1.1'de hesaplanan deneysel tasarıma göre ayarlanır. Yaygın bir başlangıç tohumlama yoğunluğu, aşağıdaki protokol için örnek olarak kullanılan 20 μL başına 2 ×10 5 hücredir.- Deney için gereken toplam hücre miktarını hesaplamak için, 20 μL'de ilk 2 ×10 5 hücreyi gerekli iskele sayısıyla çarpın.
NOT: Örneğin, 30 iskelenin 20 μL ile çarpımı toplam 600 μL hacim verir. Her iskele 2 × 10 5 hücre gerektiriyorsa, 600 μL süspansiyon toplam 6 × 10 6 hücre (2 × 105 × 30) içerir ve 600 μL'de 6 ×10 6 hücrelik nihai bir gereksinim verir. Deneysel parametrelerin sayısı, gereken toplam hücre sayısını belirleyecektir. Bu nedenle bu protokol, 10 geleneksel 175cm2 şişeyle aynı sayıda hücreyi işleyebilen çok katmanlı bir hücre kültürü şişesi kullanarak hücre kültürünü ana hatlarıyla belirtir.
- Deney için gereken toplam hücre miktarını hesaplamak için, 20 μL'de ilk 2 ×10 5 hücreyi gerekli iskele sayısıyla çarpın.
2. Kollajen bazlı iskelelerin hazırlanması
NOT: Coll-I-nHA ve Coll-I-GAG silindirik iskeleler (çap 6 mm, yükseklik 4 mm) yerleşik yöntemler kullanılarak hazırlanır 15,21,27. Daha önce yayınlanmış yöntemlere17 göre kimyasal olarak çapraz bağlandıktan sonra, iskeleler 1 hafta içinde kullanılmalıdır.
- İstenilen mekanik özelliklere sahip iskelelerin imalatını takiben, iskelelerin tamamen hidratlandığından ve fosfat tamponlu salin (PBS) ile iyice yıkandığından emin olun.
NOT: Bu genellikle iskelelerin çapraz bağlanmasından sonra ~12 saat sürer ve 4 °C'de 100 mL doku kültürü atık kaplarında, kap başına maksimum 50 iskele ve iskele başına 2 mL PBS ile gerçekleştirilebilir. - İskeleleri kullanıma hazır olana kadar PBS'de 4 °C'de saklayın.
3. Nöroblastom hücrelerini çok katmanlı bir hücre kültürü şişesinde çoğaltın
NOT: Çok katmanlı şişe için en uygun tohumlama yoğunluğu değişecektir. Bu deneyde kullanılan şişe için, üreticinin talimatlarına göre optimum yoğunluk 1 × 107 hücredir. Çok katmanlı şişeyi tohumlamadan önce, hücreleri uygun bir doku kültürü şişesinde (örneğin, bir T175cm2 doku kültürü şişesi) 1 × 107 hücre veya daha yüksek bir yoğunluğa çoğaltın. Hücreleri çok katmanlı şişeye tohumlamak için (bölüm 3.1), onları %70-80 birleşene kadar büyütün, hasat edin ve hücre sayımını gerçekleştirmek için 3.2.16-3.2.20 adımlarına bakarak mL başına hücre sayısını sayın. Hücre süspansiyonu sayıldıktan sonra, hemen çok katmanlı şişenin tohumlanmasına geçin. Hücre kültürü çalışması, steriliteyi korumak için laminer akış başlığında yapılmalıdır.
- Çok katmanlı hücre kültürü şişesinin tohumlanması
- 550 mL tam büyüme ortamını (kullanılan hücre hattına bağlı olarak değişir) ve 100 mL steril PBS'yi 37 ° C'lik bir su banyosunda 20 dakika önceden ısıtın.
- Hasat edilen hücre süspansiyonunu kullanarak, denklem (1)'i kullanarak 1 × 107 hücrenin optimum tohumlama yoğunluğunu elde etmek için gereken hücre süspansiyonunun gerekli hacmini hesaplayın, burada WANT, çok katmanlı şişeyi tohumlamak için gereken hücre sayısını ifade eder ve HAVE, hücre süspansiyonundaki hücre / mL sayısını ifade eder:
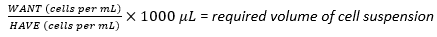 (1)
(1)
Örneğin,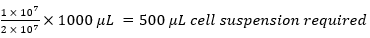
- Gerekli hücre süspansiyonu hacmini önceden ısıtılmış büyüme ortamının 100 mL'sine ekleyin.
- Kaputa yeni bir çok katmanlı şişe alın, kapağı çıkarın ve şişeyi 60° açıyla tutun. Hücre süspansiyonunun 100 mL'sinin tamamını boynun açılı tarafından aşağı doğru şişeye yavaşça pipetleyin. Şişeyi kapatın ve hücrelerin katmanlar boyunca eşit olarak dağılmasını sağlamak için yan tarafına yerleştirin.
- 60°'lik bir açıyla, boynun açılı tarafını yavaşça dökerek veya pipetleyerek çok katmanlı şişeye 400 mL önceden ısıtılmış büyüme ortamı ekleyin. Boyun dolarsa, şişeyi dik konuma getirin veya şişeyi kapatın ve dökmeye geri dönmeden önce yan yatırın.
NOT: Aşırı kabarcık oluşumunu önlemek için yavaşça dökün. Tüm baloncukların yukarı çıkmasına izin vermek için şişeye dik konumda hafifçe vurun ve 10 mL'lik bir pipetle çıkarın. Şişenin boynun alt ipliğine kadar doldurulduğundan emin olun; Bunu başarmak için gerekirse daha fazla ortam ekleyin. - Çok katmanlı şişeyi kapatın ve açılı boyun 37 °C, %5CO2 ve %95 nemde aşağı bakacak şekilde inkübe edin.
- Büyümeyi her 2-3 günde bir izdiham için kontrol edin. Çok katmanlı şişenin alt iki katmanının birleşip birleşmediğini kontrol etmek için, bunları ters çevrilmiş bir mikroskobun 4x objektif merceği altında görüntüleyin.
NOT: 1 × 107 nöroblastom hücresi ile tohumlandığında, 10 katmanlı şişenin birleşime dönüşmesi tipik olarak bir hafta sürer - ancak bu, kullanılan hücre hattına bağlı olarak değişebilir.
- Çok katmanlı şişedeki hücrelerin rutin bakımı
- 550 mL tam büyüme ortamını (kullanılan hücre hattına bağlı olarak değişir), 50-100 mL tripsin ve 300 mL steril PBS'yi 37 °C'lik bir su banyosunda 20 dakika önceden ısıtın.
- Çok katmanlı şişeyi% 70-80 birleşme açısından kontrol edin.
- Çok katmanlı şişeyi laminer akış başlığına yerleştirin ve harcanan ortamı dökerek şişeden atın. İlk olarak, şişeyi, ortam hava barajının üzerinden bir atık kabına dökülecek şekilde eğin. Dökerken, ortam şişenin açılı boynundan aşağı akana kadar şişeyi 180° döndürün. Kalan sıvıyı ortadan kaldırmak için şişeyi bu eksen boyunca ileri geri döndürün.
- Açılı boyundan yavaşça 100 mL önceden ısıtılmış steril PBS ekleyerek hücreleri yıkayın. Şişeyi kapatın, PBS'nin eşit dağılımını sağlamak için yan tarafına yerleştirin ve hücreleri yıkamak için şişeyi ileri geri döndürün.
- PBS yıkamayı 3.2.3 ile aynı şekilde atın. Yıkama adımlarını tekrarlayın.
- 50 mL önceden ısıtılmış tripsin 50 mL önceden ısıtılmış steril PBS içinde seyreltin. Çok katmanlı şişeye 100 mL seyreltilmiş tripsin çözeltisi ekleyin, kapak ve tripsinin eşit dağılımını sağlamak için şişeyi yan tarafına yerleştirin. Hücre hattı yüksek derecede yapışırsa, 100 mL seyreltilmemiş tripsin kullanın.
- Şişeyi 37 °C, %5CO2 ve %95 nemde 2-5 dakika inkübe ederek mikroskop altında hücre ayrılmasını izleyin. Gerekirse, ayırmaya yardımcı olmak için şişeye sıkıca vurun veya bir dakika daha inkübatöre geri koyun.
- Çok katmanlı şişeyi laminer bir akış başlığına yerleştirin ve tripsini 100 mL büyüme ortamı ile nötralize edin. Şişeyi kapatın, yan yatırın ve tam nötralizasyonu sağlamak için ileri geri sallayın.
- Nötralize hücre süspansiyonunu 4 x 50 mL konik santrifüj tüplerine dökün.
NOT: Tam hücre hasadı gerekiyorsa, çok katmanlı şişeyi tekrar 100 mL steril PBS ile yıkayın ve 2 x 50 mL santrifüj tüplerine dökün. - Hücreleri peletlemek için hücre süspansiyonunu 50 mL santrifüj tüplerinde 340 × g'da 3-4 dakika santrifüjleyin.
- Santrifüj tüplerini laminer akış başlığına geri koyun ve her peletten mümkün olduğunca fazla süpernatanı dikkatlice atın.
NOT: Pelet büyük ve nispeten gevşek olacaktır ve bu nedenle kolayca bozulabilir. - Her pelete 1-5 mL büyüme ortamı ekleyin ve birkaç kez yukarı ve aşağı pipetleyerek yeniden süspanse edin.
- 4 adet yeniden süspanse edilmiş peleti 50 mL'lik bir santrifüj tüpünde bir araya getirin, pipetle iyice karıştırın ve toplam hacmi not edin.
- Hemositometredeki her bir dış kare 30-100 hücre içerecek şekilde hücre sayımı için hücre süspansiyonunun uygun bir seyreltmesini yapın.
NOT: Uygun bir başlangıç seyreltmesi 1:100'dür; bunun için 10 μL hücre süspansiyonunu 15 mL'lik yeni bir konik santrifüj tüpüne pipetleyin ve 990 μL steril PBS ile seyreltin. İyice karıştırmak için karışımı birkaç kez yukarı ve aşağı pipetleyin. - Sayarken hücre stoğunu içeren 50 mL'lik bir santrifüj tüpünü inkübatöre yerleştirin.
- Temiz bir hemositometre alarak, Şekil 2'de gösterildiği gibi ızgaranın üzerine temiz bir lamel yerleştirin.
- Seyreltilmiş hücre süspansiyonunun 10 μL'sini hemositometre odasına pipetleyin. 10 μL'nin tamamı dağıtılmadan hazne dolarsa, pipetlemeyi durdurun.
- Hemositometreyi bir ışık mikroskobunun 4x objektifinin altına yerleştirin. Hücreleri görselleştirmek için kaba ve ince odağı ayarlayın.
- Şekil 2'de vurgulandığı gibi odanın dört dış köşe karesindeki hücre sayısını sayın. Dört sayıyı toplayın ve kare başına ortalama hücre sayısını hesaplamak için 4'e bölün.
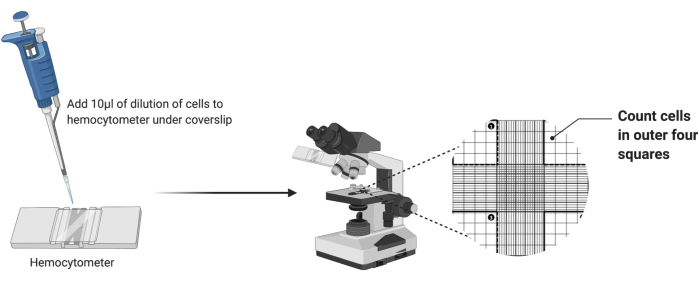
Şekil 2: Hemositometre kullanarak hücre sayımı. Lamel altındaki hemositometreye on mikrolitre hücre süspansiyonu eklenir. Oda daha sonra bir mikroskobun 4x objektif merceğinin altına yerleştirilir ve ızgaranın dört dış köşesindeki hücre sayısı sayılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Ortalama sayıyı seyreltme faktörü (örneğin, 100) ile çarpın ve denklem (2)'yi kullanarak mL başına hücre sayısını elde etmek için bu sayıyı 10.000 ile çarpın.
 (2)
(2) - Stok çözeltisindeki toplam hücre sayısını, hücre stoğunun toplam hacmiyle çarparak hesaplayın (örneğin, bir araya getirilen 4 yeniden askıda pelet 20 mL'lik bir çözelti oluşturduysa, hücreleri/mL'yi 20 ile çarpın).
- Çok katmanlı şişeyi korumak için, 1 × 107 hücreyi şişeye geri tohumlamak için gereken hücre stoğu hacmini hesaplamak için adım 3.1.2'de özetlenen denklemi (1) kullanın ve şişeyi yeniden tohumlamak için 3.1.3-3.1.6 adımlarını gerçekleştirin. İskeleleri tohumlamaya hazırsanız, bir sonraki bölüme geçin.
4. İskelelerde nöroblastom hücrelerini tohumlayın
- Stok hücresi süspansiyonunu hazırlayın
NOT: Bu protokol, her yoğunluk arasında 2'lik bir çarpma faktörü ile dört farklı nöroblastom hücresi tohumlama yoğunluğu oluşturma adımlarını özetleyecektir. Bu nedenle, stok süspansiyonundan üç hücre süspansiyonu daha oluşturmak için bir seri seyreltme kullanılacaktır. Hücre kültürü çalışması, steriliteyi korumak için laminer akış başlığında yapılmalıdır.- İlk tohumlama yoğunluğunu veya hücre stoğu süspansiyonunu hazırlamak için çok katmanlı şişedeki (bölüm 3.2.19'da sayılan) toplam hücre sayısından ihtiyaç duyulan hücre hacmini hesaplamak için denklem (3) kullanın.
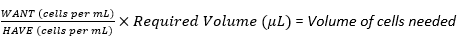 (3)
(3)
NOT: Örneğin, en yüksek tohumlama yoğunluğu 30 iskele için iskele başına 6 × 10 5 hücre gerekiyorsa ve her bir iskele 20 μL hücre süspansiyonu alıyorsa, stok hücre süspansiyonu toplam 600 μL (20 μL × 30 iskele) hacimde 1,8 × 107 hücre (6 ×10 5 hücre × 30 iskele) gerektirecektir.
Bu preparattan seri bir seyreltme yapılacağından, bu sayılar iki katına çıkarılmalıdır, yani toplam 1200 μL hacimde 3.6 ×10 7 hücre. Bunu mL başına hücre cinsinden WANT'a dönüştürmek için; 3.6 × 107'yi 1200 μL'ye bölün ve 1000 μL ile çarpın, mL başına 3 × 107 hücre verin.

- Gerekli hacimde hücre stoğu steril 2 mL veya 15 mL'lik bir santrifüj tüpüne ekleyin ve büyüme ortamı ile 1200 μL'lik bir nihai hacme getirin. Bu tüpü Yoğunluk 1 olarak etiketleyin (Şekil 3).
- İlk tohumlama yoğunluğunu veya hücre stoğu süspansiyonunu hazırlamak için çok katmanlı şişedeki (bölüm 3.2.19'da sayılan) toplam hücre sayısından ihtiyaç duyulan hücre hacmini hesaplamak için denklem (3) kullanın.
- Birden fazla tohumlama yoğunluğu hücre süspansiyonu oluşturmak için seri seyreltme gerçekleştirin.
- Adım 4.1.1'de hazırlanan Yoğunluk 1'den , Şekil 3'e göre seri seyreltme yoluyla üç yoğunlukta hücre süspansiyonu daha hazırlayın.
- Büyüme ortamında her yoğunluğu 2 faktörü ile seyreltin. İlk olarak, üç steril 2 mL veya 15 mL santrifüj tüpüne gerekli son hacim (önceki örnekten 600 μL) büyüme ortamı ekleyin.
- Yoğunluk 1'in yarısını (600 μL) tüplerden birine aktarın, hücre süspansiyonunu seyreltmek için ortamla iyice karıştırın. Bu tüpü Yoğunluk 2 olarak etiketleyin.
- Yoğunluk 2'nin yarısını (600 μL) bir sonraki tüpe aktarın, hücre süspansiyonunu seyreltmek için ortamla iyice karıştırın. Bu tüpü Yoğunluk 3 olarak etiketleyin.
- Yoğunluk 3'ün yarısını (600 μL) bir sonraki tüpe aktarın, hücre süspansiyonunu seyreltmek için ortamla iyice karıştırın. Bu tüpü Yoğunluk 4 olarak etiketleyin.
- Yoğunluk 4'ten 600 μL'yi atın, böylece dört preparatın da nihai hacmi 600 μL'dir.
- Negatif kontrol olarak, sadece steril 2 mL'lik bir santrifüj tüpüne 600 μL büyüme ortamı ekleyin. Seri seyreltme işleminin şeması için Şekil 3'e bakın.
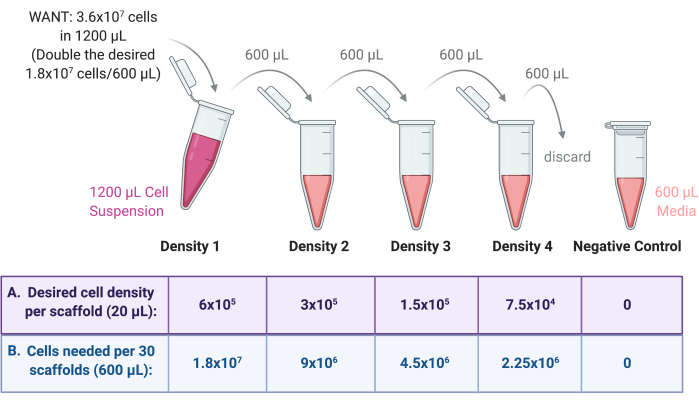
Şekil 3: 4 farklı iskele tohumlama yoğunluğu için 4 süspansiyon hazırlamak için hücre stoğunun seri seyreltilmesi. (A) Sayılar, iskele başına istenen tohumlama yoğunluğuna uyacak şekilde ayarlanabilir ve (B) yoğunluk başına toplam iskele sayısı ile çarpılabilir ve her iskele 20 μL hücre süspansiyonu alır. Bu örnekte, Yoğunluk 1, 30 yapı iskelesi için 600 μL'de 1,8 × 107 hücreye eşdeğer olan yapı iskelesi başına 6 × 105 hücre gerektirir. Bu sayı, seri seyreltmeyi başlatmak için iki katına çıkarılır, çünkü 600 μL daha sonra bir sonraki tüpte 600 μL büyüme ortamında aktarılır ve seyreltilir. Bu işlem, her biri arasında 2 faktör bulunan 4 hücre süspansiyonu olana kadar devam eder. Sadece bir tüpe 600 μL ortam eklenerek negatif bir kontrol yapılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- İskelelere hücre süspansiyonları ekleme
NOT: İskeleleri (PBS'de saklanır) buzdolabından çıkarın ve hücreleri eklemeden önce oda sıcaklığına (RT) gelmelerini bekleyin.- PBS'deki iskeleleri laminer akış başlığına getirin.
- Steril cımbız kullanarak, iskeleleri, oyuk başına bir iskele olacak şekilde yapışmayan 24 oyuklu plakalara yerleştirin (Şekil 1C). İskeleleri köşelerinden yavaşça kaldırın ve fazla PBS'yi çıkarmak için kabın kenarına hafifçe bastırın. İskeleleri, deri tarafı aşağı bakacak şekilde kuyuların ortasına ekleyin (iskelenin parlak katman tarafı, plastik 24 oyuklu plakalara bakacak şekilde).
- 24 oyuklu plakaları hücre hattının ayrıntıları, ilgili parametreler (örneğin, tohumlama yoğunluğu) ve zaman noktaları ile etiketleyin. Her seferinde bir hücre tohumlama yoğunluğu ile çalışın, kalan yoğunlukları kullanıma hazır olana kadar 37 ° C'lik inkübatörde tutun.
- Laminer akış başlığında, her bir iskelenin ortasına 20 μL ilgili hücre süspansiyonunu nazikçe eklemek için bir P20 pipeti ve steril uçlar kullanın (Şekil 1D). Hücreleri iskelelere eklerken iyice karıştırarak hücreleri iyice süspansiyon halinde tutun. Süspansiyonun iskelenin üstünde kaldığından ve kuyu tabanına kaymadığından emin olun, çünkü bu, iskeleye hücre bağlanmasına izin vermeyecektir.
- Hücreler eklendikten sonra, hücrelerin çoğunun yapışmasına izin vermek için plakaları 3-5 saat (37 °C, %5CO2 ve %95 nem) inkübe edin.
- İnkübasyondan sonra, her bir oyuğa yavaşça ve nazikçe 1 mL önceden ısıtılmış büyüme ortamı ekleyin (Şekil 1E). İskelelerin yer değiştirmesini önleyerek daha yavaş ve kontrollü harekete izin vermek için ortamı eklemek için bir P1000 pipet kullanın. Çok fazla sayıda iskele ile çalışıyorsanız, pipet tabancası 'düşme' ve 'düşük' olarak ayarlanmış 10 mL'lik bir pipet kullanın.
- 24 oyuklu plakaları gece boyunca inkübe edin (37 °C, %5CO2 ve %95 nem).
- İskelelerdeki hücrelerin bakımı
- Hücre bağlanmasının ilk 24 saatinden sonra (1. Gün), tohumlanmış iskeleleri yeni yapışmayan 24 oyuklu plakalara aktarın ve 1-2 mL taze büyüme ortamı ekleyin.
NOT: Bu adım, iskelelerde büyümelerine izin vermek yerine plastik 24 oyuklu plakaların dibine düşen hücreleri kaldırır. 1. Gün olarak belirlenen iskele kopyaları, bölüm 5'te tartışıldığı gibi 24 saat sonra kaldırılacaktır; Bu nedenle, bu iskeleler için bakım geçerli değildir. - Büyüme ortamının renginde bir değişiklik olup olmadığını görmek için başlangıçta her 2-3 günde bir iskeleleri izleyin. Zaman ilerledikçe ve hücreler iskeleler içinde çoğaldıkça, hücreleri daha sık besleyin.
- 10 mL'lik bir pipet tabancası kullanarak, yavaş modda, harcanan ortamın 1 mL'sini çıkarın ve atın. Şartlandırılmış ortam gerektiren deneyler yapıyorsanız, kullanılmış biyolojik kopya ortamını 15 mL'lik bir santrifüj tüpünde toplayın, hücresel kalıntıları peletlemek için 2 dakika boyunca 340 × g'da santrifüjleyin, süpernatanı yeni bir tüpe aktarın ve -80 °C'de saklayın.
- Pipet üzerindeki damlama işlevini tekrar kullanarak iskelelere yavaşça 2 mL önceden ısıtılmış büyüme ortamı ekleyin ve 24 oyuklu plakayı inkübatöre geri koyun (37 °C, %5CO2 ve %95 nem). İstenen büyüme periyodu boyunca ortam harcandığında tekrarlayın.
- Hücre bağlanmasının ilk 24 saatinden sonra (1. Gün), tohumlanmış iskeleleri yeni yapışmayan 24 oyuklu plakalara aktarın ve 1-2 mL taze büyüme ortamı ekleyin.
5. İskele alımı ve uygulamaları
NOT: Her zaman noktasında, iskelelerde hücre büyümesini izlemek veya gen ve protein ekspresyon profillerini değerlendirmek için çeşitli uygulamalar kullanılabilir. İskele alma koşulları, aşağıdaki alt bölümlerde özetlenen ve Şekil 4'te gösterilen çoklu geri alma yöntemleriyle gerçekleştirilecek analize bağlı olacaktır.
- İskelelerde hücre canlılığının değerlendirilmesi
- Laminer akış başlığındaki bir santrifüj tüpüne 0,2 μm'lik bir steril filtreden filtreleyerek uygun hücre canlılığı tahlil reaktifini sterilize edin. Bu steril çözeltiyi, tam büyüme ortamı ve steril PBS ile birlikte 37 °C'lik bir su banyosunda önceden ısıtın.
- Laminer akış başlığında, analiz edilecek iskeleleri 24 oyuklu yeni bir plakaya aktarmak için steril cımbız kullanın. Plakayı ilgili tüm ayrıntılarla etiketleyin.
NOT: Analizi üç nüsha halinde gerçekleştirin. - Her bir oyuğa 900 μL önceden ısıtılmış büyüme ortamı ve ardından 100 μL steril hücre canlılığı reaktifi ekleyin. İskelesiz bir kuyucuğa 900 μL ortam ve 100 μL steril hücre canlılığı reaktifi ekleyerek negatif bir kontrol ekleyin. Plakanın üzerindeki kapağı değiştirin ve seyreltilmiş hücre canlılığı reaktifini kuyu boyunca eşit olarak dağıtmak için plakayı ~ 3 dakika hafifçe sallayın. Plakayı 37 °C, %5CO2 ve %95 nemde inkübe edin.
NOT: İnkübasyon sürelerinin her hücre hattı için optimize edilmesi gerekecektir; Üreticinin yönergelerine bakın. Nöroblastom hücre hatları için 4-6 saatlik inkübasyon optimal görünmektedir. - İnkübasyondan sonra, plakayı inkübatörden çıkarın ve birkaç saniye hafifçe sallayın.
- Laminer akış başlığında yeni, yarı saydam 96 oyuklu bir plaka açın. 24 oyuklu plakadaki her bir oyuktan, inkübe edilmiş ortamı ve reaktifi, kuyu başına 100 μL ile 96 oyuklu plakanın üç oyuğuna aktarın ve teknik üçlüler verin.
NOT: Bu transfer, 24 oyuklu plakanın kuyucuklarında 700 μL bırakacaktır. - Hücre canlılığı reaktifini ışıktan korumak için 96 oyuklu plakayı alüminyum folyo ile kaplayın.
- 24 oyuklu plakadaki her bir iskeleden kuyu içeriğinin kalan 700 μL'sini çıkarın ve atın. Her iskeleyi 1 mL steril PBS ile iki kez yıkayın.
NOT: İskelelerden tüm renkler kaldırılmayacaktır. Bu iskeleler daha sonra 0.1 M sodyum bikarbonat (NaHCO3) çözeltisi içinde 1 mL %1 Triton X-100 içine yerleştirilerek ve -80 °C'de saklanarak DNA miktar tayini gibi daha ileri uygulamalar için kullanılabilir (bkz. bölüm 5.2, Şekil 4B). - 96 oyuklu plakayı laminer akış başlığından çıkarın ve bir mikroplaka okuyucu kullanarak her bir oyuğun emilimini 570 nm ve 600 nm dalga boylarında ölçün. Absorbans değerlerini her iki dalga boyunda kaydedin ve hücre canlılığı reaktifinin hücreler tarafından yüzde azalmasını hesaplamak için üreticinin talimatlarını izleyin.
- Uygun yazılımı kullanarak hücre canlılığı sonuçlarını grafiklendirin ve istatistiksel olarak analiz edin. Hata çubukları üretmek ve tahlil değişkenliğini belirtmek için biyolojik üçlü değerleri girin.
- Deneysel zaman dilimi boyunca hücre canlılığındaki değişiklikleri incelemek için, uygun biyoistatistiksel yazılımı kullanarak ortalamaların çoklu karşılaştırmaları ile tek yönlü bir varyans analizi (ANOVA) testi gerçekleştirin.
- Grafiklerdeki zaman noktaları arasındaki anlamlı farkları ns (P>0.05), * (P≤0.05), ** (P≤0.01), *** (P≤0.001) ve **** (P≤0.0001) olarak belirtin.
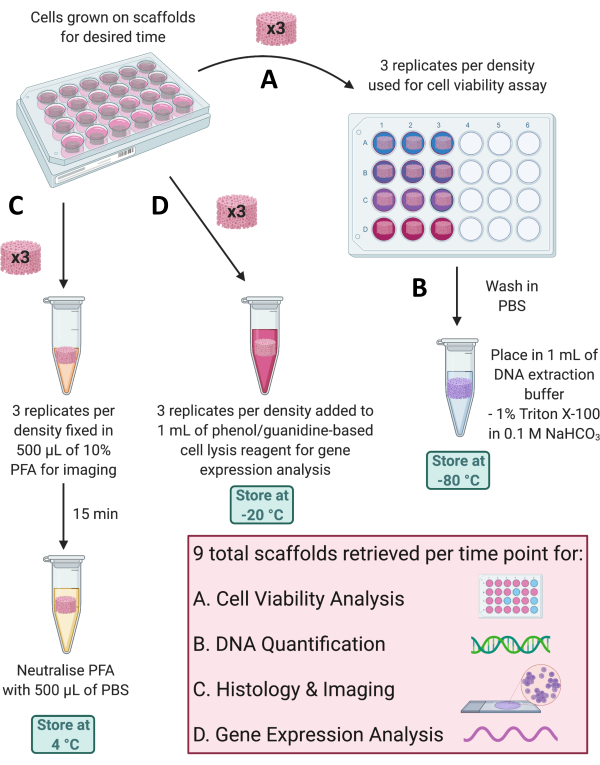
Şekil 4: Her zaman noktasında farklı analizler için iskelelerin alınması. (A) Hücre canlılığı analizi için üç iskele kopyası alınır. (B) Bu iskeleler daha sonra PBS'de yıkanabilir, 0.1 M NaHCO3'te %1 Triton X-100'e yerleştirilebilir ve DNA miktar tayini için -80 °C'de saklanabilir. (C) Üç kopya daha 15 dakika boyunca% 10 PFA'ya sabitlenir, PBS'de nötralize edilir ve histolojik boyama ve görüntüleme için 4 ° C'de saklanır. (D) Son olarak, fenol/guanidin bazlı bir hücre lizis reaktifine 3 kopya eklenir ve gen ekspresyon analizi için -20 °C'de saklanır. Kısaltmalar: PBS = fosfat tamponlu salin; PFA = paraformaldehit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- İskelelerdeki hücrelerden DNA'nın miktar tayini
NOT: Adım 5.1.7'den sonraki notta belirtildiği gibi, DNA miktar tayini için iskelelerin alınması, iskelelerin 0,1 M NaHCO3 çözeltisinde 1 mL %1 Triton X-100 içeren 2 mL santrifüj tüplerine yerleştirilmesini ve ardından -80 °C'de depolanmasını içerir. DNA analizi yapılmadan önce, hücrelerin nöroblastom hücrelerini uygun şekilde parçalamak ve miktar tayini için DNA'yı serbest bırakmak için üç donma-çözülme döngüsünden geçmesi gerekir.- Daha önce Triton X-100'de saklanan numuneleri -80 °C'den çıkarın. Numuneleri 1-3 saat veya çözülene kadar RT'de bırakın.
- Numuneleri 10-20 saniye vorteksleyin ve numuneleri 18-24 saat veya tamamen donana kadar -80 °C'de tekrar yerleştirin. Bu işlemi toplam üç donma-çözülme döngüsü için tekrarlayın.
- DNA verimini en üst düzeye çıkarmak için, iskelelerdeki hücreleri parçalamak için bir doku parçalayıcı kullanın.
- Triton X-100'de bir iskele içeren 2 mL'lik santrifüj tüpüne metal bir boncuk yerleştirin ve numuneyi 50-2 dakika boyunca 3 salınım/saniyede sallamak için tüpü adaptörün içine yerleştirin.
NOT: Metal boncuk konik tabanlı bir tüpe sıkışabileceğinden yuvarlak tabanlı santrifüj tüpleri kullanın.
- Triton X-100'de bir iskele içeren 2 mL'lik santrifüj tüpüne metal bir boncuk yerleştirin ve numuneyi 50-2 dakika boyunca 3 salınım/saniyede sallamak için tüpü adaptörün içine yerleştirin.
- Floresan çift sarmallı DNA (dsDNA) boyası uygulayarak Triton X-100 çözeltisindeki DNA'yı ölçün ve bir mikroplaka okuyucu kullanarak emisyonu ölçün. Üreticinin yönergelerine bakın; TE tamponunda seri seyreltme yoluyla 8 dsDNA standardı hazırlamak için numuneleri Tris-etilendiamin tetraasetik asit (TE) tamponunda uygun şekilde seyreltin (Şekil 5).
- Siyah opak 96 oyuklu plakalarda, her bir standarttan veya numuneden 100 μL'yi teknik üçlü olarak kuyucuklara ekleyin.
- Floresan dsDNA boyasını TE tamponunda 200 kat seyreltin ve çok kanallı bir pipet kullanarak her standart/numuneye 100 μL ekleyin. Plakayı folyo folyo ile kaplayın ve RT'de 5 dakika inkübe edin.
- Her kuyucuğun floresansını 520 nm'de ölçün ve kaydedin. Her numunedeki DNA konsantrasyonunu hesaplamak için üreticinin yönergelerini izleyin.
NOT: Kullanılan hücre hattı için hücre başına ortalama DNA konsantrasyonu biliniyorsa, DNA konsantrasyon değerleri denklem (4) kullanılarak hücre numaralarına dönüştürülebilir. (4)
(4) - Uygun yazılımı kullanarak DNA niceleme sonuçlarını grafiklendirin ve istatistiksel olarak analiz edin. Hata çubukları üretmek ve tahlil değişkenliğini belirtmek için biyolojik üçlü değerleri girin.
- Deneysel zaman dilimi boyunca DNA konsantrasyonu / hücre sayısındaki değişiklikleri incelemek için, uygun biyoistatistiksel yazılımı kullanarak araçların çoklu karşılaştırmalarını içeren tek yönlü bir ANOVA testi gerçekleştirin.
- Grafiklerdeki zaman noktaları arasındaki önemli farkları ns (P>0.05), * (P≤0.05), ** (P≤0.01), *** (P≤0.001) ve **** (P≤0.0001) olarak belirtin.
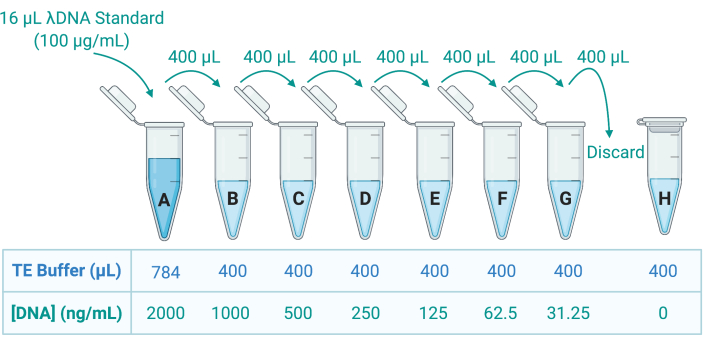
Şekil 5: Standart bir eğrinin oluşturulması için sekiz DNA standardının hazırlanması. 100 μg/mL'de bir λDNA stok çözeltisi sağlanır. Bu, 2000 ng/mL'de standart A oluşturmak için TE tamponunda 50 kat seyreltilir; 400 μL A daha sonra 400 μL TE tamponu içeren B tüpüne aktarılır; 400 μL B daha sonra aktarılır ve C'de 2 kat seyreltilir ve G'ye kadar devam eder. Standart H sadece TE tamponundan oluşur ve bu nedenle 0 ng / mL'lik bir DNA konsantrasyonuna sahiptir. Kısaltma: TE = Tris-EDTA. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Histolojik boyama için iskelelerin hazırlanması
NOT: İskeleler, immünofloresan (IF) için tam iskeleler olarak veya histolojik boyama veya immünohistokimya (IHC) için formalinle sabitlenmiş parafine gömülü (FFPE) dilimler olarak mikroskopi ve görüntüleme amacıyla sabitlenebilir ve boyanabilir. Bu, yapı iskeleleri içindeki hücre penetrasyonunun ve dağılımının kalitatif değerlendirmesine izin verir ve proteinlerin ekspresyonunu değerlendirmek için kullanılabilir.- PBS'de %10'luk bir paraformaldehit (PFA) çözeltisi hazırlayın. İskele başına 500 μL'lik bir nihai hacim için yeterli çözelti olduğundan emin olun.
- Bu çözeltiyi 37 °C'de önceden ısıtın ve iskele alımı için etiketli 2 mL'lik santrifüj tüplerine 500 μL ekleyin.
- İskeleleri yapışmayan 24 oyuklu plakalardan çıkarın (adım 4.4.4) ve laminer akış başlığına yerleştirin.
- Steril cımbız kullanarak iskeleleri %10 PFA içeren etiketli santrifüj tüplerine aktarın. İskelelerin PFA çözeltisinde 15 dakika sabitlenmesine izin verin. Her tüpe 500 μL PBS ekleyerek PFA'yı nötralize edin ve 4 °C'de saklayın.
- İskeleleri Otomatik Temizlik Mendili İşlemcisine hazırlamak için 4 °C'den çıkarın ve cımbız kullanarak ilgili tüm ayrıntıların kurşun kalemle etiketlenmiş plastik kasetlere yerleştirmesini sağlayın. Tüm kasetleri Doku İşlemcisinin metal kabına yerleştirin.
- İskeleleri sabitlemek, kurutmak, temizlemek ve gece boyunca parafinle sızmak için Doku İşlemcisindeki 12 aşamalı protokole başlayın. İşlenmiş numuneleri içeren kasetleri toplayın.
- Daha sonra, iskelelerin mikrotomisinin boyama için çok ince dilimler halinde olmasını sağlamak için iskeleleri parafin balmumu bloklarına gömün.
NOT: İskeleleri kasetlerden çıkarırken ve balmumuna gömerken, görüntülerin çekildiği açıyı etkileyeceğinden, yönlerini dikkate almak özellikle önemlidir. Bu, yapı iskelelerine hücre sızmasını değerlendirirken önemlidir. - Balmumu gömücüyü ve soğuk plakayı açın; Balmumu seviyesini kontrol etmek için kapağı kaldırın. Gerekirse yeniden doldurun.
- Her seferinde bir örnekle çalışarak kaseti açın, iskeleyi çıkarın ve plastik kalıba ortalayın.
- Numunenin üzerine sıcak balmumu dökün, doğru yönün korunduğundan emin olun ve balmumu katılaşmadan önce gerekirse ılık cımbızla ayarlayın. Kalıbı doldurmak için daha fazla balmumu dökün.
- Etiketli kaset kapağını plastik kalıbın üzerine yerleştirin ve üstüne balmumu ekleyin. Balmumu katılaştırmak için kalıbı soğuk tabağa yerleştirin. Parafin mumunun mikrotomiden önce tamamen katılaşmasını sağlamak için gece boyunca 4 °C'de saklayın.
- Mikrotomiye hazırlanmak için 35 °C'lik bir su banyosunu, kurutma plakasını ve mikrotomu açın.
- Tutucuya bir bıçak yerleştirin ve sabitlemek için kolu sıkın.
- İskele bölümleri için genellikle 5 mm olmak üzere trim ve kesit kalınlığını ayarlayın.
- FFPE iskelesini kalıptan çıkarın, mikrotomun önündeki tutucuya sabitleyin ve bölümleri kesmeden önce numunenin kenarlarındaki fazla mumu dikkatlice kesin.
- Mikrotomun kolunu döndürerek balmumu bloğunu kesmeye başlayın ve yumuşak hareket sağlayın.
- Bir seferde yaklaşık 3 iskele bölümü olmak üzere şerit benzeri bölümler toplayın ve kırışıklıkları gidermek için bunları nazikçe 35 °C su banyosuna yerleştirin. Su banyosundayken cımbız kullanarak bölümleri nazikçe ayırın.
- Polisin kaplı cam mikroskop slaytları kullanarak, her bir bölümü su banyosundan kaldırın, böylece bölüm slaydın ortasına oturur. Her slaydı bir kalemle etiketleyin.
- Cam slaytları kurutma plakasına veya 60 °C'lik bir kurutma fırınına yerleştirin. Kuruduktan sonra 4 °C'de saklayın ve gerekli histolojik veya IHC boyası ile devam edin.
- Gen ekspresyon analizi için iskelelerin alınması
- İskeleleri inkübatörden yapışmayan 24 oyuklu plakalardan çıkarın (adım 4.4.4) ve laminer akış başlığına yerleştirin.
- Steril cımbız kullanarak iskeleleri yeni etiketli 2 mL'lik santrifüj tüplerine aktarın.
- Bir çeker ocakta, hücreleri iskelelerde parçalamak ve yüksek kaliteli RNA'nın geri kazanılmasına izin vermek için her tüpe 1 mL fenol/guanidin bazlı hücre lizis reaktifi ekleyin.
- Uygun bir kit kullanarak RNA ekstraksiyonu yapmaya hazır olana kadar tüpleri -20 °C'de saklayın. Standart bir ters transkripsiyon kantitatif polimeraz zincir reaksiyonu (RT-qPCR)17 kullanarak, iskelelerdeki hücrelerdeki gen ekspresyonunu değerlendirin.
Sonuçlar
Burada açıklanan kollajen bazlı iskele modeli, nöroblastom biyolojisinin incelenmesinden, geleneksel 2D hücre kültüründen daha fizyolojik olarak doğal tümörlere daha benzer bir ortamda antikanser terapötiklerinin taranmasına kadar birçok uygulamaya sahiptir. Belirli bir araştırma sorusunu test etmeden önce, istenen deneysel zaman dilimi içinde hücre bağlanması, proliferasyonu ve infiltrasyonunun tam bir karakterizasyonunu elde etmek çok önemlidir. Büyüme koşulları, her bir spesifik hücre hattının biyolojisine bağlı olacaktır. Daha da önemlisi, optimal koşulları ve sağlam performansı belirlemek için çeşitli hücre büyümesi değerlendirme yöntemleri uygulanmalıdır.
Burada, iskelelerde büyütülen nöroblastom hücrelerinin canlılığı, kolorimetrik hücre canlılığı testi kullanılarak değerlendirildi. Bu test, deneysel zaman dilimi boyunca istenildiği kadar sık gerçekleştirilebilir. Açıklanan deney için, 4 farklı yoğunlukta Coll-I-nHA iskelelerinde büyütülen iki nöroblastom hücre hattı, KellyLuc ve IMR32 için 1, 7 ve 14. günlerde hücre canlılığı değerlendirmesi yapıldı (Şekil 6). 1. Gündeki canlılık, sonraki tüm ölçümleri karşılaştırmak için bir temel olarak belirlendi. Hücre canlılığı reaktifinin azalma hızı, proliferasyon hızları ve metabolizmaları dahil olmak üzere tek tek hücre hatlarının hücre biyolojisini ve büyüme özelliklerini yansıtır. İskelelere ekilen hücre sayısı ile azalma seviyesi arasında bir korelasyon bekleniyordu. Bu deneyde, hücre canlılığı reaktifinin azalması, beklendiği gibi, her iki hücre hattı için her bir zaman noktasında genellikle artmıştır.
Her yoğunluk daha sonra zaman noktaları arasındaki azalmayı karşılaştırmak için her iki hücre hattı için ayrı ayrı değerlendirildi. Zaman noktaları arasındaki azalmada önemli farklılıkları tespit etmek için Tukey'in çoklu karşılaştırma testi ile tek yönlü ANOVA yapıldı (Şekil 7). Hem hücre hatları hem de tüm tohumlama yoğunlukları için, 1. gün ve 14. gün karşılaştırıldığında hücre canlılığı reaktifinin azalmasında önemli bir artış (P<0.05) vardı. Bu, iskelelerde bulunan metabolik olarak aktif hücrelerde önemli bir artış olduğunu gösterdi. Bu artış, 7 günlük aralıklar (1. gün - 7. gün, 7. gün - 14. gün) değerlendirilirken her durumda önemli değildi ve istenen büyüme penceresini elde etmek için tohumlama yoğunluğunun optimizasyonunun önemini gösterdi.
Hücre canlılığı testinin sonuçlarını desteklemek için, iskelelerdeki hücre büyümesi, bir floresan dsDNA boyası kullanılarak iskelelerden ekstrakte edilen dsDNA'nın miktar tayini yoluyla dolaylı olarak da ölçülebilir (Şekil 8A). Hücre canlılığı gibi, DNA nicelemesi de deneysel zaman çizelgesi içinde istenildiği kadar sık yapılabilir. Bununla birlikte, bu analiz, iskelelerin tamamen alınmasını ve hücre büyümesinin sonlandırılmasını gerektirir ve bu nedenle bölüm 1'de tartışıldığı gibi deneysel planlamaya dahil edilmelidir. Bu deney için, DNA, 4 farklı yoğunlukta Coll-I-nHA iskelelerinde büyütülen iki nöroblastom hücre dizisi olan KellyLuc ve IMR32 için 1, 7 ve 14. günlerde ölçüldü. Bu hücre dizileri için hücre başına ortalama dsDNA konsantrasyonu bilindiğinden, niceliklenmiş DNA'dan numune başına hücre sayısını elde etmek mümkün olmuştur (Şekil 8B).
DNA nicelemesi, biyolojik kopyalar arasında hücre canlılığı değerlendirmesinden daha yüksek değişkenliğe yol açtı, ancak genellikle her zaman noktası için arttı ve en yüksek seviyeler 14. günde ölçüldü. IMR32 hücreleri, DNA konsantrasyonu ile gösterildiği gibi, Coll-I-nHA iskelelerinde KellyLuc hücrelerinden daha yüksek hücre sayılarına ulaşıyor gibi görünmektedir. Her yoğunluk daha sonra zaman noktaları arasındaki azalmayı karşılaştırmak için iki hücre hattı için ayrı ayrı değerlendirildi. Zaman noktaları arasındaki azalmada önemli farklılıkları tespit etmek için Tukey'in çoklu karşılaştırma testi ile tek yönlü ANOVA yapıldı (Şekil 8B).
Hem hücre hatları hem de tüm tohumlama yoğunlukları için, 1. gün ve 14. gün karşılaştırıldığında hücre sayılarında önemli bir artış (P<0.05) vardı, tohumlama yoğunluğu 4'teki KellyLuc hariç (1 × 105 hücre/iskele), bu da herhangi bir zaman noktasında önemli artışlar sağlamadı. Hücre canlılığı sonuçlarına benzer şekilde, 7 günlük aralıklar değerlendirilirken artışlar tüm vakalarda anlamlı değildi (1. gün vs. 7. gün, 7. gün vs. 14. gün). Hücre canlılığı ve DNA ölçümü için zaman noktası eğilimlerini karşılaştırırken, iki analiz arasında bazı küçük farklılıklar vardı. Bununla birlikte, genel olarak benzer eğilimler gözlendi ve çoğu yoğunluk için ortalama değerler 7 günlük aralıklarla arttı. Bu, hücre büyümesinin birden fazla yöntem kullanılarak izlenmesinin önemini göstermektedir.
Daha sonra, geleneksel hematoksilen ve eozin (H & E) boyamanın yanı sıra IHC'yi de kapsayan, yapı iskeleleri üzerindeki hücre büyümesi morfolojisi ve dağılımının görsel bir değerlendirmesi uygulandı. Bireysel hücre hatlarının farklı büyüme modellerinin, iskeleye farklı derecelerde penetrasyon ve hücre kümelenmesi dahil olmak üzere iskeleler üzerinde çeşitli mekansal düzenlemelere yol açması beklenmektedir. İskeleler formalinle sabitlendi, parafine gömüldü ve 5 mm'lik kesitler halinde kesildi (Şekil 9A), iskeleler histolojik boyama ve IHC dahil olmak üzere çoklu görselleştirme teknikleri için hazırlandı.
Kollajen bazlı iskelelerde büyütülen Kelly, KellyCis83 ve IMR32 hücrelerine 1, 7 ve 14. günlerde rutin H&E boyaması uygulandı (Şekil 9B). Bu, hücrelerin uzamsal yöneliminin 14 günlük bir süre boyunca iki kollajen bazlı iskele üzerinde görselleştirilmesine izin verdi. Sisplatine duyarlı Kelly hücreleri ve dirençli KellyCis83 hücreleri, hem Coll-I-nHA iskelelerinde (Şekil 9B, i) hem de Coll-I-GAG iskelelerinde (Şekil 9B, ii) büyütüldü. Daha önce yayınlanmış verilerle tutarlı olarak, KellyCis83 hücreleri daha yüksek bir oranda büyüdü ve daha az invaziv Kelly hücre hattından daha az invaziv olan her iki iskele bileşimine de daha derine sızdı. Coll-I-nHA üzerinde büyüyen başka bir nöroblastom hücre hattı olan IMR32'nin H&E boyası, zıt bir büyüme paterni gösterir (Şekil 9B, iii). Bu hücre dizisi, 14 günlük süre boyunca kollajen iskeleleri üzerinde büyük, yoğun bir şekilde paketlenmiş kümeler halinde büyüdü. Brightfield konfokal mikroskopi, kollajen liflerinin otofloresansı nedeniyle kollajen bazlı iskelelerin gözenekli mimarisini görselleştirmek için kullanılabilir (Şekil 9C).
Deneysel zaman çizelgesi boyunca spesifik hücre özelliklerini izlemek için hücre iskeleti aktinini ve nükleer karşı boyayı hedefleyen falloidin ve nükleer karşı boya, 4',6-diamidino-2-fenilindol (DAPI) ile hücreleri boyadık. Bu teknik kullanılarak Coll-I-GAG iskelelerinde Kelly ve KellyCis83 hücrelerinde bol miktarda aktin gözlendi (Şekil 9D). Bu sonuçlar, bu protokolü kullanarak iskelelerde büyütülen nöroblastom hücrelerinden uzamsal olarak çözülmüş bilgi elde etmek için çoklu görüntüleme tekniklerinin nasıl kullanılabileceğini göstermektedir. Belirli bir süre boyunca kollajen bazlı iskeleler üzerindeki hücre büyüme modellerinin bu karakterizasyonu, herhangi bir aşağı akış biyokimyasal tahlillerinin anlaşılmasını ve yorumlanmasını geliştirecektir.
Kollajen bazlı iskelelerde yetiştirilen hücreler tarafından protein ekspresyonu, hücresel aktiviteyi in vivo senaryolarla karşılaştırmak için analiz edilebilir. Daha önce yayınlanmış veriler, hücre tek tabakalarında ve ayrıca Coll-I-nHA ve Coll-I-GAG iskelelerinde büyüyen KellyLuc ve KellyCis83Luc hücreleri tarafından nöroblastomun vekil salgılanan bir belirteci olarak kromogranin A (CgA) ekspresyonunu incelemiştir (Şekil 10). CgA, enzime bağlı immünosorbent testi (ELISA) kullanılarak şartlandırılmış ortamda değerlendirildi (Şekil 10A). CgA, daha agresif kemo-dirençli KellyCis83 hücre hattında Kelly'den daha yüksek oranda salgılanır (Şekil 10B, C). Bu, hem Coll-I-GAG hem de Coll-I-nHA iskelelerinde 7. günde anlamlıydı (P<0.05), oysa bu zaman noktasında geleneksel 2D kültür ile tek tabaka olarak büyütülen hücreler için önemli bir fark yoktu.
Bu sonuçlar aynı zamanda, hücreleri tek katmanlı olarak büyütürken, hücreler birleşmeye ulaşmadan önce yalnızca 7 günlük büyümenin mümkün olduğunu kanıtlayan kısıtlı deneysel zaman çizelgesini vurgulamaktadır. İskelelerdeki hücrelerin büyümesi, fizyolojik olarak daha ilgili koşullarda daha uzun bir süre boyunca korunabildikleri için bu sınırlamanın üstesinden gelir. Hücre canlılığı, DNA içeriği, hücresel morfoloji ve uzamsal düzenleme ve ekspresyon profilleri hakkında bilgi edinmek için yukarıdaki tekniklerin kombinasyonu, bir dizi kollajen bazlı yapı iskelesi üzerinde nöroblastom hücrelerinin büyümesinin değerlendirilmesini kolaylaştırır. Bu protokol ayrıca belirli deneysel gereksinimleri ve istenen uygulamaları karşılamak için kolayca uyarlanabilir.
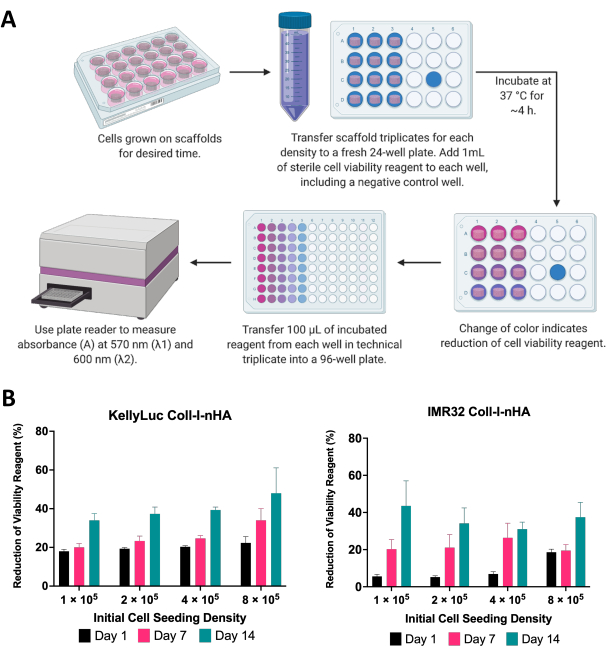
Şekil 6: Hücre canlılığı analizi. (A) Kolorimetrik hücre canlılığı testi kullanılarak kollajen bazlı iskelelerde nöroblastom hücrelerinin canlılığını ölçmek için genel prosedür. Kuluçka süresi, üreticinin yönergelerine atıfta bulunarak her yeni hücre hattı için optimize edilmelidir. (B) 1, 7 ve 14. günlerde ölçülen, dört farklı başlangıç tohumlama yoğunluğunda Coll-I-nHA iskelelerinde yetiştirilen KellyLuc ve IMR32 hücreleri tarafından hücre canlılığı reaktifinin yüzde azalması. Numuneler, standart sapmayı temsil eden hata çubukları ile biyolojik üçlü olarak değerlendirildi. Kısaltmalar: nHA = nanohidroksiapatit; Coll-I-nHA = nHA ile desteklenmiş kollajen iskeleleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
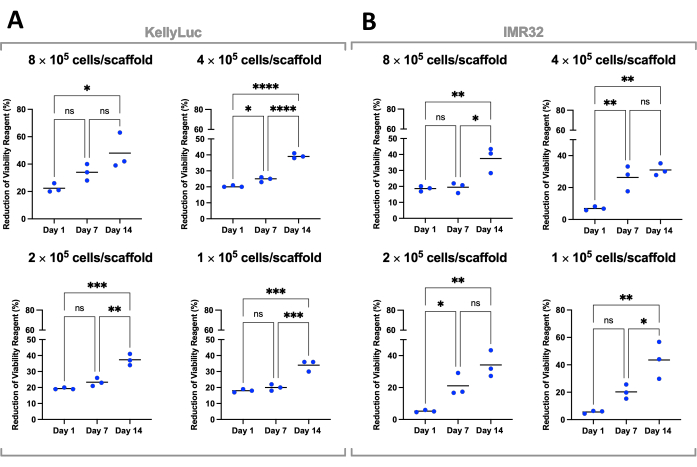
Şekil 7: 14 günlük bir süre boyunca Coll-I-nHA üzerinde yetiştirilen hücreler için tohumlama yoğunluğu ile hücre canlılığı. (a) KellyLuc; (B) IMR32. Başlıklı hücre numaraları, 0. günde iskelelerdeki ilk hücre tohumlama yoğunluğunu ifade eder. Numuneler, ortalamayı temsil eden çubuklarla üçlü noktalarla gösterilen biyolojik üçlü olarak değerlendirildi. Grafiklerde belirtilen üç zaman noktasında % hücre canlılığı reaktif azalmasındaki önemli farklılıkları tespit etmek için Çoklu Karşılaştırmalı Tek Yönlü ANOVA kullanıldı (ns P > 0.05, * P ≤ 0.05, ** P ≤ 0.01, *** P ≤ 0.001, **** P ≤ 0.0001). Kısaltmalar: nHA = nanohidroksiapatit; Coll-I-nHA = nHA ile desteklenmiş kollajen iskeleleri; ANOVA = varyans analizi; ns = önemli değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
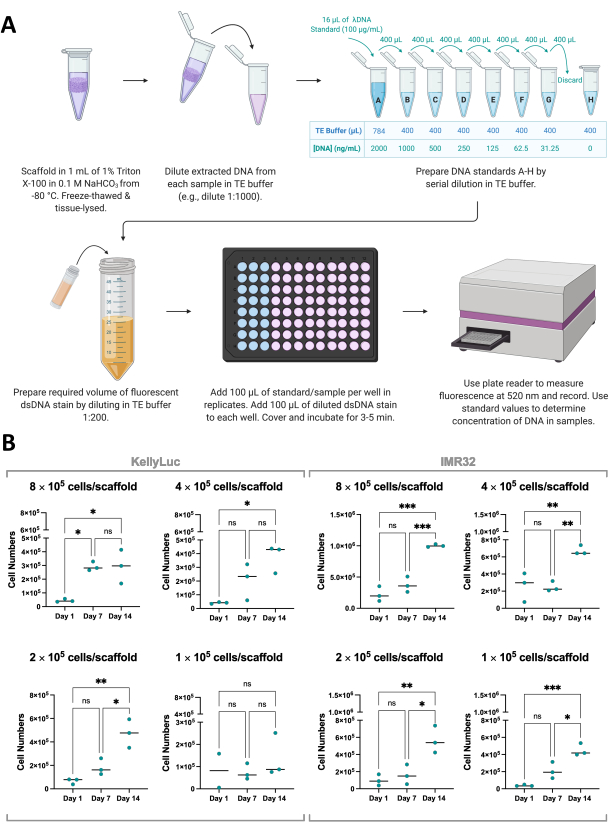
Şekil 8: İskelelerdeki hücrelerden ekstrakte edilen DNA'nın miktarının belirlenmesi . (A) Floresan dsDNA boyası kullanılarak kollajen bazlı iskelelerde büyütülen hücrelerden dsDNA'nın ölçülmesi işlemi. (B) 14 günlük bir süre boyunca Coll-I-nHA üzerinde yetiştirilen KellyLuc ve IMR32 hücreleri için tohumlama yoğunluğu ile DNA miktar tayini analizinden elde edilen hücre sayıları. Başlıklı hücre numaraları, 0. günde iskelelere ilk hücre tohumlama yoğunluğunu ifade eder. Numuneler, ortalamayı temsil eden çubuklarla üçlü noktalarla gösterilen biyolojik üçlü olarak değerlendirildi. Grafiklerde belirtilen üç zaman noktasında hücre sayılarındaki önemli farklılıkları tespit etmek için Çoklu Karşılaştırmalı Tek Yönlü ANOVA kullanıldı (ns P > 0.05, * P ≤ 0.05, ** P ≤ 0.01, *** P ≤ 0.001, **** P ≤ 0.0001). Kısaltmalar: nHA = nanohidroksiapatit; Coll-I-nHA = nHA ile desteklenmiş kollajen iskeleleri; dsDNA = çift sarmallı DNA; TE = Tris-EDTA; ANOVA = varyans analizi; ns = önemli değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
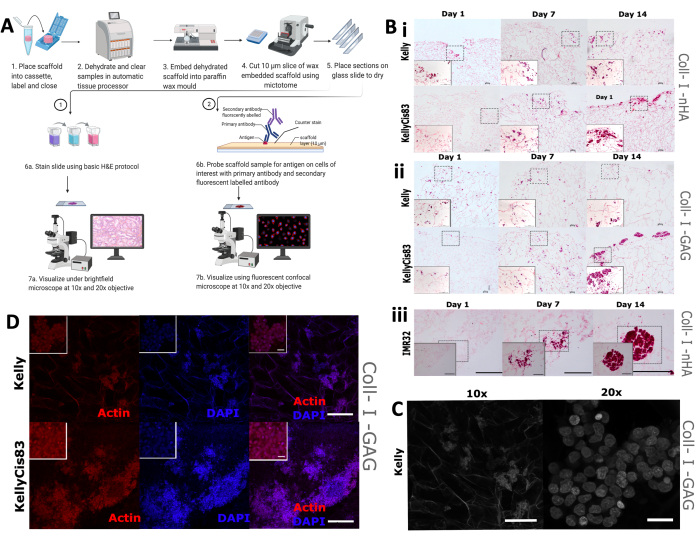
Şekil 9: İskelelerin immünohistokimya analizi için doku işleme adımları . (A) Görüntü analizi için yapı iskelelerinin işlenmesi için protokolün şematik gösterimi. Bu işlem, primer antikorlar ve floresan etiketli sekonder antikorlar kullanılarak rutin histolojik boyamaya ve spesifik antikor araştırmasına izin verir. (B) H&E boyamaya tabi tutulan üç nöroblastom hücre hattının temsili görüntüleri. H&E görüntüleri, deneyin süresi boyunca büyüme modellerini izlemek için 1, 7, 14. günlerde alınır. Ölçek çubuğu = 200 μm. Kesikli kareler, sol alt kenarda yakınlaştırılmış 20x görüntüler için seçilen alanı temsil eder. Ölçek çubuğu = 20 μm. (i ve ii) Kelly ve KellyCis83 nöroblastom hücre hatlarının H&E'si (sırasıyla üst ve alt paneller) iki tip kollajen bazlı iskele üzerinde. (iii) Coll-I-nHA iskelesi üzerinde kümelenmiş hücresel büyümeyi temsil eden IMR32 hücre hattının H&E'si. (C) Parlak alan konfokal mikroskobuna tabi tutulan Kelly hücre hattının temsili görüntüsü. Kollajen otofloresansı, gözenekli iskelenin görselleştirilmesini sağlar. 10x Ölçek çubuğu = 200 μm, 20x ölçek çubuğu = 20 μm. (D) Gömülü iskelelerin temsili görüntüsü, ardından 10x büyütmede phalloidin ve DAPI ile IHC tarafından analiz, Ölçek çubuğu = 200 μm. Daha küçük iç kareler yakınlaştırılmış görüntüleri (20x) temsil eder, ölçek çubuğu = 20 μm. Kısaltmalar: nHA = nanohidroksiapatit; Coll-I-nHA = nHA ile desteklenmiş kollajen iskeleleri; GAG = glikozaminoglikan; Coll-I-GAG = kondroitin-6-sülfat ile takviye edilmiş kollajen iskeleleri; H&E = hematoksilen ve eozin; IHC = immünohistokimya; DAPI = 4′,6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
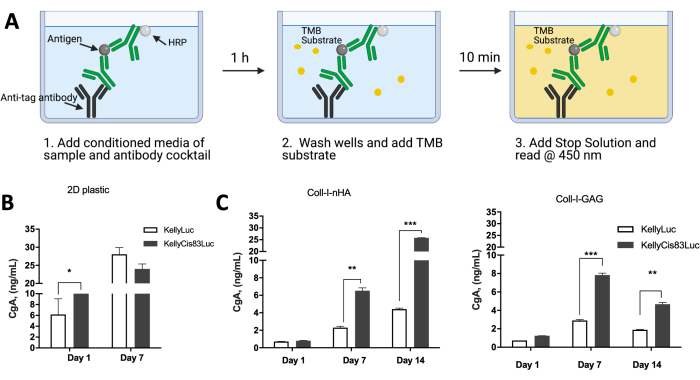
Şekil 10: 2D plastiğe kıyasla 3D kollajen bazlı iskelelerde büyütülen nöroblastom hücreleri tarafından protein ekspresyonu. (A) CgA ELISA'nın 2D plastik veya 3D kollajen bazlı iskeleler üzerinde büyütülen hücrelerin şartlandırılmış ortamında nasıl gerçekleştirildiğinin bir şeması. (B) 2D plastik tek tabaka üzerinde büyütülen hücrelerin şartlandırılmış ortamından alınan CgA protein ekspresyon seviyeleri. Hücreler 7 gün sonra birleştiğinde, 14 günlük zaman noktası okunamıyordu. Plastikte 7. günde, Kelly ve KellyCis83 hücre hatları arasında CgA seviyelerinde anlamlı bir fark yoktu. (C) CgA ELISA, art arda 14 gün boyunca kollajen bazlı iskelelerde büyütülen hücrelerin şartlandırılmış ortamı kullanılarak gerçekleştirildi. 7. günde, her iki kollajen iskelesinde, daha agresif KellyCis83 hücre hattında CgA seviyeleri daha yüksektir ve 2D tek tabakaya kıyasla 3D matriste daha fizyolojik ilgili CgA seviyelerini vurgular. Bu rakam Curtin ve ark.17'den değiştirilmiştir. Kısaltmalar: 3D = üç boyutlu; 2D = iki boyutlu; CgA = kromogranin A; ELISA = enzime bağlı immünosorbent testi; nHA = nanohidroksiapatit; Coll-I-nHA = nHA ile desteklenmiş kollajen iskeleleri; GAG = glikozaminoglikan; Coll-I-GAG = kondroitin-6-sülfat ile takviye edilmiş kollajen iskeleleri; TMB = 3,3',5,5'-tetrametilbenzidin; HRP = yaban turpu peroksidaz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
3D yapı iskelesi-kanser hücresi modelinin, basitleştirilmiş bir TME32'de nöroblastom hücre büyümesi, canlılığı ve hücrelerin infiltrasyonu hakkında mekanik içgörü elde etmek için değerli ve çok yönlü bir araç olduğu kanıtlanmıştır. Burada açıklanan 3D nöroblastom modeli, minimal TME'yi taklit eder ve 2D tek katmanlı bir kültürden daha fizyolojik olarak ilgili veriler sağlar. 3D hücre kültürünün önemli bir dezavantajı, artan deneysel karmaşıklık ve daha uzun zaman dilimleridir. Burada tarif edilen, nöroblastom hücrelerinin kollajen bazlı iskelelerde tohumlanması, büyümesi ve bakımı için optimize edilmiş bir protokoldür ve ardından hücre büyümesinin sağlam karakterizasyonunu sağlayan aşağı akış analizleri ve uygulamaları yapılır. 14 günlük hızlı bir deney penceresinde antikanser ilaç tedavilerini değerlendirmek için öngörülebilir ve kontrol edilebilir bir ortam yaratmak için iskeleler için en uygun hücre tohumlama yoğunluğu hakkında bilgi edinmeyi amaçladık. Açıklanan tüm bu basit protokollerin kombinasyonu, iskele tabanlı in vitro kültür sisteminde nöroblastom hücre büyümesinin çok yönlü bir değerlendirmesini sağlar.
Bilim insanlarının laboratuvarlarında hızlı bir şekilde kurabilmeleri için protokol kurgusundaki kritik noktalar vurgulanmıştır. Örneğin, kolorimetrik hücre canlılığı testinin daha iyi performansı için belirtilen inkübasyon süreleri, reaktifin tüm hücrelere ulaşmak için iskele gözeneklerine daha derin nüfuz etmesine izin verir. Ayrıca, floresan dsDNA boyama tekniği sağlam ve basittir; bununla birlikte, yapı iskelelerinden DNA salınımı, hücreler kollajen lifleri içinde 'sıkışıp kaldığı' için güçlü hücre lizizi gerektirir.
Açıklanan basit DNA miktar tayini testini kullanarak, bu modeli kullanarak antikanser ilaç taraması için kollajen bazlı iskeleler üzerindeki log büyüme fazını tanımlayabiliriz. Açıklanan deney ortamında, toplam 14 günlük bir süre ve 1, 7 ve 14. günlerde analiz zaman noktaları ile 4 başlangıç hücre tohumlama yoğunluğu kullanıldı. 4 × 105 hücre/iskelede tohumlanan KellyLuc hücrelerinin, 7. ve 14. günler arasında en belirgin aktif proliferasyon penceresine sahip olduğunu belirledik. Bu log faz büyüme verileri, çeşitli hücre sitotoksisite deneylerinin güvenilir bir şekilde yorumlanmasına izin verecektir. İlaç toksisitelerinden ziyade 3D gözenekli platformda bastırılmış büyümeden kaynaklanan büyüme veya hücre ölümündeki herhangi bir düşüş hakkındaki spekülasyonları ortadan kaldırır. Hücre canlılığı, farklı hücre tiplerinin büyümesini desteklemek için 3D platformların uygunluğu için de yaygın olarak kullanılan bir değerlendirmedir33,34. Canlı / ölü boyama, ATP ölçümü, proliferasyon testleri dahil olmak üzere hücre canlılığını ölçmek için birçok test olsa da, Alamar Blue kolorimetrik hücre canlılığı testinin kullanımının DNA miktar verilerini desteklemek için basit ve etkili bir teknik olduğunu gördük.
DNA nicelemesi ve hücre canlılığının birlikte kullanımı, ortalama olarak, 14 günlük bir süre boyunca sürekli büyüme elde etmek için iskele üzerindeki tohum hücrelerine optimal yoğunluğun 2-4 × 105 hücre/yapı iskelesi olduğuna dair tamamlayıcı kanıtlar sağlamıştır. Bununla birlikte, bu protokol, farklı deneysel zaman dilimlerini, analiz zaman noktalarını ve aşağı akış uygulamalarını karşılamak için kolayca uyarlanabilir. Bu protokol, yapı iskeleleri üzerinde nöroblastom hücrelerinin monokültür hücre büyümesinin değerlendirilmesini tanımlasa da, iskeleler, yara iyileşmesinin araştırılmasında keratinositleri ve fibroblastları birlikte kültürlemek için kollajen-GAG iskelelerini kullanan do Amaral ve ark. tarafından tanımlanan, ko-kültür için bir platform olarak kullanılmak üzere kolayca değiştirilebilir35.
Açıklanan 3D model, immünofloresan ve standart H&E gibi iyi bilinen farklı teknikler kullanılarak hücre büyümesinin ve infiltrasyonunun görselleştirilmesini sağlar. İskeleler üzerindeki hücre morfolojisi ve büyüme modellerinin çeşitliliği nedeniyle, biyokimyasal tahliller kullanılarak büyümenin karakterizasyonu ile birlikte hücrelerin görselleştirilmesi önemlidir. Büyüme modelini anlamak, büyüme davranışı ve antikanser ilaçlarına gelecekteki yanıt hakkında fikir verebilir. Örneğin, DNA nicelemesi kullanılarak IMR32 büyümesi Kelly'ye benzer modeller verir, ancak H &E kullanılarak görselleştirme üzerine IMR32, daha dağınık büyüme gösteren Kelly'den daha büyük kümelerde büyür (Şekil 9). İskelelerdeki hücre hatlarının bu çeşitli büyüme paternleri, tümör heterojenliğinin klinik senaryosunu yansıtır. 3D iskelelerde farklı morfolojilere sahip bir hücre hatları paneli kullanarak antikanser ilaç yanıtını incelemek, hastanın aynı ilaçlara verdiği yanıtın prediktif değerini artıracaktır.
Gen veya protein ekspresyonunun tespiti, ilgilenilen protein salgılanırsa RT-qPCR veya ELISA gibi diğer yaklaşımlar kullanılarak da gerçekleştirilebilir. Nöroblastom ilerlemesinin vekil bir belirteci olan kromogranin A (CgA)36, nöroblastom hücre büyümesini 3D olarak karakterize etmek için ek olarak kullanıldı. Önceki çalışma17'de açıklandığı gibi, hücreler çoğaldıkça CgA sekresyonu artmıştır (Şekil 10). Tek katmanlı hücre kültürü bu artışı yakalayamazken, proliferasyon, hücrelerin kültür kaplarında tam birleşmeye ulaşması anlamına geldiğinden, 3D kollajen iskelelerinin kullanılması, CgA sekresyonunun uzun süreli değerlendirilmesine izin verdi.
Bu 3D in vitro model, nöroblastom biyolojisini ve terapötiklere yanıtı incelemek için tüm araştırma soruları için uygun olmayabilir. Sınırlamalardan biri, iskeleler içinde eşit olmayan hücre penetrasyonu ve belirli bir hücre hattına bağlı olan ve besinlerin ve test ilaçlarının kontrol edilemeyen difüzyonuna yol açabilen değişen büyüklükte hücre kümelerinin oluşmasıdır. Bu özellik terapötik taramadaki sağlamlığı etkiler. Bununla birlikte, bu sınırlamaya rağmen, doğal tümörlerin boyut ve kanser hücresi dağılımı açısından da heterojen olduğunu ve tümör dokusu içinde birçok başka hücre tipi içerdiğini dikkate almak önemlidir. Bu sınırlamanın üstesinden gelmek için, hücre nüfuslu her bir iskelenin, aşağıdaki parametrelerin optimize edileceği tek bir mikro doku olarak kullanılmasını öneriyoruz: (a) hücre canlılığı reaktifinin hücrelere ve hücre kümelerine ulaşması için inkübasyon süreleri ve (b) yapı iskelesinin derinliklerinde bulunan hücrelerin DNA'sını serbest bırakmak için iskeleler üzerindeki hücrelerin bir doku parçalayıcı ile ön işlenmesiyle Triton X-100 tamponundaki hücrelerin parçalanması.
Bu protokolün bir diğer teknik sınırlaması, bu model için yeni üretilen iskelelerin her partisinin mekanik testinin yapılmamasıdır. Bununla birlikte, basınç ve çekme modülü, gözeneklilik ve görsel gözenek yapısı ve homojenlik gibi iskelelerin fiziksel ve kimyasal özellikleri ile ilgili olarak kapsamlı bir şekilde karakterize edilen iskelelerin sağlam imalat sürecinin kullanılması, iskele kalitelerinin 21,24,27,30,37 partileri aracılığıyla korunmasını sağlar.
Özetle, bu makale, kollajen bazlı iskelelerde hücresel büyümenin analizi için bir dizi basit yöntem sunmaktadır. Hem deneysel zaman çizelgesi hem de analiz noktaları, belirli araştırma sorularına bağlı olarak değiştirilebilir. Bu protokol aynı zamanda diğer hücre tiplerine de uyarlanabilir. Yukarıda gösterilen sonuçlar, bu yöntem derlemesinin, çeşitli nöroblastom hücre hatlarının 14 gün boyunca sürekli büyüme yaratması için en uygun tohumlama yoğunluğu hakkında nasıl fikir verdiğine dair kanıt sağlar. Bu protokoldeki tüm yöntemlerden elde edilen sonuçların birleştirilmesi, 3D kollajen matrisi içinde hücre büyümesinin üstün bir şekilde anlaşılmasını sağlar. Bu modelin gelecekteki kullanımı muhtemelen nöroblastom TME'ye özgü ko-kültür sistemlerini ve çeşitli yeni antikanser ilaçların test edilmesini içerecektir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Bu çalışma Ulusal Çocuk Araştırma Merkezi (NCRC), İrlanda Araştırma Konseyi (IRC) ve Neuroblastoma UK tarafından desteklenmiştir. İllüstrasyonlar BioRender kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cells | |||
| IMR-32 | ATCC | CCL-127 | |
| Kelly | ECACC | 82110411 | |
| KellyCis83 | Made in lab – derived from Kelly (Piskareva et al., 2015) | - | Increasing exposure to cisplatin. Cross resistance acquired |
| SH-SY5Y | ATCC | CRL-2266 | |
| Disposable | |||
| 0.22 µm syringe filter | Millex | SLHP033RS | |
| 1.5 mL Eppendorf tube | Eppendorf | 0030 120.086 | |
| 100 mL sterile Pot | Starstedt | - | |
| 10 mL plastic pipette | Cellstar | 607 180 | |
| 15 mL Falcon tube | Starstedt | 62.554.502 | |
| 25 mL plastic pipette | Cellstar | 760 180 | |
| 50 mL Falcon tube | Starstedt | 62.547.254 | |
| 5 mL plastic pipette | Cellstar | 606 180 | |
| 6 mm Biopsy punches | Kai Medical | BP-60F | |
| Aluminium foil | - | - | |
| Cover Slip | Menzel-Glaser | - | |
| HYPERflask | Corning | CLS10030 | |
| Microscope slides | Thermo Scientific | J1840AMNT | |
| Opaque black 96-well plate | Costar | 3915 | |
| Sterile P10 tips | Starlab | S1121-3810 | |
| Sterile P1000 tips | Starlab | S1122-1830 | |
| Sterile P20 tips | Starlab | S1123-1810 | |
| Sterile P200 tips | Starlab | S1120-8810 | |
| T-175 (175 cm2 flask) | Sarstedt | 83.3912 | |
| T-75 (75 cm2 flask) | Sarstedt | 83.3911.302 | |
| Translucent clear 96 well plate | Cellstar | 655180 | |
| Translucent non-adherent 24 well plates | Cellstar | 83.3922.500 | |
| Equipment | |||
| Autoclave | Astell | - | |
| Automatic tissue processor | Leica | TP1020 | |
| Centrifuge 5804 | Eppendorf | - | |
| Hemocytometer | Hausser Scientific | - | |
| Incubator | ThermoScientific | - | |
| Microtome | Leica | RM2255 | |
| Oven | Memmert | Calibrated by: Cruinn diagnostics Ltd | |
| P10 pipette | Gilson | ||
| P100 pipette | Gilson | ||
| P1000 pipette | Gilson | ||
| P20 pipette | Gilson | Calibrated by: Cruinn diagnostics Ltd | |
| P200 pipette | Gilson | Calibrated by: Cruinn diagnostics Ltd | |
| Paraffin section flotation bath | Electrothermal | MH8517 | Calibrated by: Cruinn diagnostics Ltd |
| Pipette electronic dispenser | Corning | StripipetterUltra | Calibrated by: Cruinn diagnostics Ltd |
| Plate cooler | Leica | EG1140C | Calibrated by: Cruinn diagnostics Ltd |
| Refrigerator -20 °C | Liebherr | - | |
| Refrigerator -80 °C | Liebherr | - | |
| Refrigerator 4 °C | Liebherr | - | |
| Seesaw Rocker | DLAb | SK-D1807-E | |
| Spectrophotometer – Victor3V Platereader | PerkinElmer | 1420 | |
| Tissue culture hood/Laminar flow hood | GMI | 8038-30-1044 | |
| Tissue Lyser | Qiagen | TissueLyser LT | |
| Tweezers | - | - | |
| Water bath | Grant | - | |
| Wax embedder | Leica | EG1140H | |
| Materials | |||
| 1 L Water | Adrona - Biosciences | 568 | |
| 1% Triton-X | Sigma Aldrich | 9002-93-1 | |
| 10x PBS tablets | Sigma Aldrich | P4417-100TAB | |
| 37% paraformaldehyde | Sigma-Aldrich | F8775 | |
| Alamar Blue Cell Viability Reagent | Invitrogen | DAL1100 | |
| Collagen- glycosaminoglycan scaffold | Tissue engineering research group (TERG) | ||
| Collagen-nanohydroxyapatite scaffold | Tissue engineering research group (TERG) | ||
| dH20 | Adrona - Biosciences | 568 | |
| Eosin | Sigma-Aldrich | E4009 | Made as per: (Cunniffe et al., 2010, Fitzgerald et al., 2015; O’Brien et al., 2005) |
| EtOH | Sigma-Aldrich | 1.00983.2500 | Made as per: (Cunniffe et al., 2010, Fitzgerald et al., 2015; O’Brien et al., 2005) |
| F12 | Gibco | 21765-029 | |
| FBS | Gibco | 10270-106 | |
| Hemaytoxylin | Sigma-Aldrich | HHS32-1L | |
| L-Glutamine | Gibco | 25030-024 | |
| MEM | Gibco | 21090-022 | |
| miRNA easy Kit | Qiagen | 217004 | |
| MNEAA’s | Gibco | 11140-035 | |
| Penicillin/streptomycin | Gibco | 015140-122 | |
| Qiazol | Qiagen | 79306 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| RPMI | Gibco | 21875-034 | |
| Sodium bicarbonate | Sigma Aldrich | S7795-500G | |
| Tissue embedding Medium | Sigma | A6330-4LB | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| Software | |||
| Excel | - | Excel 2016 | |
| ImageJ | - | - | |
| Prism | - | Version 9 |
Referanslar
- Davidoff, A. M. Neuroblastoma. Seminars in Pediatric Surgery. 21 (1), 2-14 (2012).
- Matthay, K. K., et al. Neuroblastoma. Nature Reviews Disease Primers. 2, 16078 (2016).
- Costard, L. S., Hosn, R. R., Ramanayake, H., O'Brien, F. J., Curtin, C. M. Influences of the 3D microenvironment on cancer cell behaviour and treatment responsiveness: a recent update on lung, breast and prostate cancer models. Acta Biomaterialia. , (2021).
- Borriello, L., Seeger, R. C., Asgharzadeh, S., Declerck, Y. A. More than the genes, the tumor microenvironment in neuroblastoma. Cancer Letters. 380 (1), 304-318 (2016).
- Walker, C., Mojares, E., Del Río Hernández, A. Role of extracellular matrix in development and cancer progression. International Journal of Molecular Sciences. 19 (10), 3028 (2018).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Schultz, G. S., Davidson, J. M., Kirsner, R. S., Bornstein, P., Herman, I. M. Dynamic reciprocity in the wound microenvironment. Wound Repair and Regeneration. 19 (2), 134-148 (2011).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Provenzano, P. P., et al. Collagen density promotes mammary tumor initiation and progression. BMC Medicine. 6, 11 (2008).
- Provenzano, P. P., et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Medicine. 4, 38 (2006).
- Ouellette, J. N., et al. Navigating the collagen jungle: The biomedical potential of fiber organization in cancer. Bioengineering. 8 (2), 1-19 (2021).
- Kreger, S. T., Voytik-Harbin, S. L. Hyaluronan concentration within a 3D collagen matrix modulates matrix viscoelasticity, but not fibroblast response. Matrix Biology. 28 (6), 336-346 (2009).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hume, R. D., et al. Tumour cell invasiveness and response to chemotherapeutics in adipocyte invested 3D engineered anisotropic collagen scaffolds. Scientific Reports. 8 (1), 12658 (2018).
- Fitzgerald, K. A., et al. The use of collagen-based scaffolds to simulate prostate cancer bone metastases with potential for evaluating delivery of nanoparticulate gene therapeutics. Biomaterials. 66, 53-66 (2015).
- Sapudom, J., Pompe, T. Biomimetic tumor microenvironments based on collagen matrices. Biomaterials Science. 6 (8), 2009-2024 (2018).
- Curtin, C., et al. A physiologically relevant 3D collagen-based scaffold-neuroblastoma cell system exhibits chemosensitivity similar to orthotopic xenograft models. Acta Biomaterialia. 70, 84-97 (2018).
- Gavin, C., et al. Neuroblastoma invasion strategies are regulated by the extracellular matrix. Cancers. 13 (4), 1-23 (2021).
- Ridky, T. W., Chow, J. M., Wong, D. J., Khavari, P. A. Invasive three-dimensional organotypic neoplasia from multiple normal human epithelia. Nature Medicine. 16 (12), 1450-1456 (2010).
- Casal, e. J., Crane, J. S. . Biochemistry, Glycosaminoglycans. , (2019).
- O'Brien, F. J., Harley, B. A., Yannas, I. V., Gibson, L. J. The effect of pore size on cell adhesion in collagen-GAG scaffolds. Biomaterials. 26 (4), 433-441 (2005).
- O'Brien, F. J., Harley, B. A., Yannas, I. V., Gibson, L. Influence of freezing rate on pore structure in freeze-dried collagen-GAG scaffolds. Biomaterials. 25 (6), 1077-1086 (2004).
- Haugh, M. G., Murphy, C. M., McKiernan, R. C., Altenbuchner, C., O'Brien, F. J. Crosslinking and mechanical properties significantly influence cell attachment, proliferation, and migration within collagen glycosaminoglycan scaffolds. Tissue Engineering. Part A. 17 (9-10), 1201-1208 (2011).
- Murphy, C. M., Haugh, M. G., O'Brien, F. J. The effect of mean pore size on cell attachment, proliferation and migration in collagen-glycosaminoglycan scaffolds for bone tissue engineering. Biomaterials. 31 (3), 461-466 (2010).
- Haugh, M. G., Jaasma, M. J., O'Brien, F. J. The effect of dehydrothermal treatment on the mechanical and structural properties of collagen-GAG scaffolds. Journal of Biomedical Materials Research - Part A. 89 (2), 363-369 (2009).
- Lowe, B., Hardy, J. G., Walsh, L. J. Optimizing nanohydroxyapatite nanocomposites for bone tissue engineering. ACS Omega. 5 (1), 1-9 (2020).
- Cunniffe, G. M., Dickson, G. R., Partap, S., Stanton, K. T., O'Brien, F. J. Development and characterisation of a collagen nano-hydroxyapatite composite scaffold for bone tissue engineering. Journal of Materials Science. Materials in Medicine. 21 (8), 2293-2298 (2010).
- DuBois, S. G., et al. Metastatic sites in stage IV and IVS neuroblastoma correlate with age, tumor biology, and survival. Journal of Pediatric Hematology/Oncology. 21 (3), 181-189 (1999).
- Ryan, A. J., Gleeson, J. P., Matsiko, A., Thompson, E. M., O'Brien, F. J. Effect of different hydroxyapatite incorporation methods on the structural and biological properties of porous collagen scaffolds for bone repair. Journal of Anatomy. 227 (6), 732-745 (2015).
- Tierney, C. M., et al. The effects of collagen concentration and crosslink density on the biological, structural and mechanical properties of collagen-GAG scaffolds for bone tissue engineering. Journal of the Mechanical Behavior of Biomedical Materials. 2 (2), 202-209 (2009).
- Cox, R. F., Jenkinson, A., Pohl, K., O'Brien, F. J., Morgan, M. P. Osteomimicry of mammary adenocarcinoma cells in vitro; increased expression of bone matrix proteins and proliferation within a 3D collagen environment. PLoS One. 7 (7), 41679 (2012).
- Nolan, J. C., et al. Preclinical models for neuroblastoma: advances and challenges. Cancer Letters. 474, 53-62 (2020).
- Sirivisoot, S., Pareta, R., Harrison, B. S. Protocol and cell responses in threedimensional conductive collagen gel scaffolds with conductive polymer nanofibres for tissue regeneration. Interface Focus. 4 (1), 20130050 (2014).
- Thevenot, P., Nair, A., Dey, J., Yang, J., Tang, L. Method to analyze three-dimensional cell distribution and infiltration in degradable scaffolds. Tissue Engineering. Part C-Methods. 14 (4), 319-331 (2008).
- do Amaral, R. J. F. C., et al. Functionalising collagen-based scaffolds with platelet-rich plasma for enhanced skin wound healing potential. Frontiers in Bioengineering and Biotechnology. 7, 371 (2019).
- Gkolfinopoulos, S., Tsapakidis, K., Papadimitriou, K., Papamichael, D., Kountourakis, P. Chromogranin A as a valid marker in oncology: Clinical application or false hopes. World Journal of Methodology. 7 (1), 9-15 (2017).
- O'Brien, F. J., et al. The effect of pore size on permeability and cell attachment in collagen scaffolds for tissue engineering. Technology and Health Care. 15 (1), 3-17 (2007).
Erratum
Formal Correction: Erratum: Three-dimensional In Vitro Biomimetic Model of Neuroblastoma using Collagen-based Scaffolds
Posted by JoVE Editors on 6/23/2022. Citeable Link.
An erratum was issued for: Three-dimensional In Vitro Biomimetic Model of Neuroblastoma using Collagen-based Scaffolds. The Authors section was updated.
The Authors section was updated from:
Ciara Gallagher*1,2,3
Catherine Murphy*1,2,3
Fergal J. O’Brien3,4,5
Olga Piskareva1,2,3,5,6
1Cancer Bioengineering Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
2School of Pharmacy and Biomolecular Sciences, RCSI University of Medicine and Health Sciences, Dublin, Ireland
3Tissue Engineering Research Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
4Trinity Centre for Bioengineering, Trinity College Dublin, Dublin, Ireland
5Advanced Materials and Bioengineering Research Centre (AMBER), RCSI and TCD, Dublin, Ireland
6National Children’s Research Centre, Our Lady's Children's Hospital Crumlin, Dublin, Ireland
* These authors contributed equally
to:
Ciara Gallagher*1,2,3
Catherine Murphy*1,2,3
Graeme Kelly4
Fergal J. O’Brien3,5,6
Olga Piskareva1,2,3,6,7
1Cancer Bioengineering Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
2School of Pharmacy and Biomolecular Sciences, RCSI University of Medicine and Health Sciences, Dublin, Ireland
3Tissue Engineering Research Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
4Department of Chemistry, Royal College of Surgeons in Ireland (RCSI), 123 St. Stephen’s Green, Dublin 2, Ireland
5Trinity Centre for Bioengineering, Trinity College Dublin, Dublin, Ireland
6Advanced Materials and Bioengineering Research Centre (AMBER), RCSI and TCD, Dublin, Ireland
7National Children’s Research Centre, Our Lady's Children's Hospital Crumlin, Dublin, Ireland
* These authors contributed equally
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır