Method Article
מודל ביומימטי תלת מימדי במבחנה של נוירובלסטומה באמצעות פיגומים מבוססי קולגן
* These authors contributed equally
In This Article
Erratum Notice
Summary
מאמר זה מפרט את השלבים הדרושים כדי לזרוע שורות תאי נוירובלסטומה על פיגומים תלת-ממדיים מבוססי קולגן שתוארו קודם לכן, לשמור על גדילת התאים למסגרת זמן שנקבעה מראש, ולאחזר פיגומים עבור מספר ניתוחים של צמיחת תאים והתנהגות תאים ויישומים במורד הזרם, הניתנים להתאמה כדי לספק מגוון מטרות ניסוי.
Abstract
נוירובלסטומה הוא הגידול המוצק החוץ-גולגולתי השכיח ביותר בילדים, ומהווה 15% מכלל מקרי המוות מסרטן ילדים. רקמת הגידול הטבעית היא מיקרו-סביבה תלת-ממדית (תלת-ממדית) מורכבת הכוללת שכבות של תאים סרטניים ולא סרטניים המוקפות במטריצה חוץ-תאית (ECM). ה- ECM מספק תמיכה פיזית וביולוגית ותורם להתקדמות המחלה, פרוגנוזה של המטופל ותגובה טיפולית.
מאמר זה מתאר פרוטוקול להרכבת מערכת תלת-ממדית מבוססת פיגומים כדי לחקות את המיקרו-סביבה של נוירובלסטומה באמצעות קווי תאי נוירובלסטומה ופיגומים מבוססי קולגן. לפיגומים מתווספים ננו-הידרוקסיאפטיט (nHA) או גליקוזאמינוגליקנים (GAGs), הנמצאים באופן טבעי בריכוזים גבוהים בעצם ובמח העצם, האתרים הגרורתיים הנפוצים ביותר של נוירובלסטומה. המבנה הנקבובי התלת-ממדי של פיגומים אלה מאפשר התקשרות של תאי נוירובלסטומה, התרבות ונדידה, והיווצרות צבירי תאים. במטריצה תלת-ממדית זו, תגובת התא לטיפולים משקפת יותר את המצב in vivo .
מערכת התרבית מבוססת הפיגומים יכולה לשמור על צפיפות תאים גבוהה יותר מאשר תרבית תאים דו-ממדית (2D) קונבנציונלית. לכן, פרוטוקולי אופטימיזציה עבור מספרי תאי זריעה ראשוניים תלויים במסגרות הזמן הרצויות לניסוי. המודל מנוטר על ידי הערכת גדילת תאים באמצעות כימות DNA, כדאיות התא באמצעות בדיקות מטבוליות, ופיזור תאים בתוך הפיגומים באמצעות צביעה היסטולוגית.
היישומים של מודל זה כוללים הערכה של פרופילי ביטוי גנים וחלבונים וכן בדיקות ציטוטוקסיות באמצעות תרופות קונבנציונליות ו-miRNA. מערכת התרבית התלת-ממדית מאפשרת מניפולציה מדויקת של רכיבי התא וה-ECM, ויוצרת סביבה דומה יותר מבחינה פיזיולוגית לרקמת הגידול המקומית. לכן, מודל תלת-ממדי זה במבחנה יקדם את הבנת הפתוגנזה של המחלה וישפר את המתאם בין תוצאות המתקבלות במבחנה, in vivo במודלים של בעלי חיים ונבדקים אנושיים.
Introduction
נוירובלסטומה הוא סרטן ילדים של מערכת העצבים הסימפתטית המתעורר במהלך התפתחות עוברית או חיים מוקדמים לאחר הלידה עקב טרנספורמציה של תאי פסגה עצבית1. זהו הגידול החוץ-גולגולתי המוצק השכיח ביותר בילדים, המייצג 8% מהממאירויות המאובחנות בחולים מתחת לגיל 15 ואחראי ל -15% מכלל מקרי המוות מסרטן בילדות. המחלה מציגה התנהגויות קליניות הטרוגניות מאוד עקב שינויים כרומוזומליים ספציפיים, גנטיים ואפיגנטיים, ותכונות היסטופתולוגיות.
שינויים אלה תורמים לאגרסיביות של נוירובלסטומה ולתוצאות גרועות בחולים ילדים. לפיכך, הטיפולים הנוכחיים מוכיחים את עצמם כלא יעילים בטווח הארוך עבור כמעט 80% מהחולים עם המחלה האגרסיבית קלינית2, מה שמדגיש את העובדה שהטיפול בקבוצה זו של חולים נותר מאתגר. זה כנראה בגלל המנגנונים של הטרוגניות נוירובלסטומה וגרורות עדיין לא מובנים במלואם. עם זאת, כיום מקובל לחשוב שהמיקרו-סביבה של הגידול (TME) ממלאת תפקיד בהתקדמות של סוגי סרטן רבים; עם זאת, היא עדיין לא נחקרה מספיק בנוירובלסטומה 3,4.
TME המקורי הוא מיקרו-סביבה תלת-ממדית מורכבת הכוללת תאים סרטניים ולא סרטניים המוקפים ב-ECM. ECM מתייחס למרכיב האצלולרי של רקמה המספק תמיכה מבנית וביוכימית ליושבי התא שלה ותורם להתקדמות המחלה, פרוגנוזה של המטופל ותגובה טיפולית5. קידום זה של התקדמות המחלה נובע מ"הדדיות דינמית" או תקשורת דו-כיוונית מתמשכת בין התאים לבין ECM 6,7,8. ככל שהסרטן מתקדם, קולגן סטרומה מאורגן מחדש לעתים קרובות בדפוסים ליניאריים בניצב לממשק סטרומה-סרטן, שבו תאי סרטן משתמשים כנתיב נדידה לגרורות 9,10,11.
המרכיבים העיקריים של פיגום ביולוגי פונקציונלי טבעי זה כוללים רשת סיבית של קולגנים מסוג I ו- II וחלבונים אחרים, כולל אלסטין, גליקופרוטאינים כגון למינין, כמו גם מגוון של פרוטאוגליקנים ורכיבים מסיסים אחרים12,13. חלבונים אלה של ECM המקומי הפכו כעת לביומולקולות טבעיות אטרקטיביות לפיתוח מודלים תלת-ממדיים במבחנה 3. היישום של פיגומים תלת-ממדיים עבור תרבית תאים במבחנה גדל בפופולריות בשל הייצוג הפיזיולוגי הגדול יותר של TME בהשוואה לתרבית חד-שכבתית דו-ממדית מסורתית. הפיגומים התלת-ממדיים המיוצרים מסייעים להתקשרות תאים, להתרבות, לנדידה, לחילוף חומרים ולתגובה לגירויים הנראים במערכות ביולוגיות in vivo.
המרכיב העיקרי של פיגומים תלת-ממדיים אלה הוא קולגן, שהוא שחקן מפתח בתהליכים ביולוגיים נורמליים רבים, כולל תיקון רקמות, אנגיוגנזה, מורפוגנזה של רקמות, הידבקות תאים ונדידה11. מטריצות תלת-ממדיות מבוססות קולגן הוכיחו את הפונקציונליות החזקה שלהן למדל ECM, ומשמשות כמיקרו-סביבה ביומימטית במבחנה תוך מתן אפשרות לאינטראקציות בין תאים ל-ECM, כמו גם נדידת תאים ופלישה. מטריצות תלת-ממדיות אלה מספקות גם ניתוח מדויק יותר של תגובת התא לתרופות כימותרפיות מאשר תרבית דו-ממדית מסורתית או "שטוחה" במודלים רבים של סרטן 14,15,16, כולל נוירובלסטומה 17,18. ניתוח גנטי של תרביות תאים תלת-ממדיות דיווח על מתאם גבוה יותר עם פרופיל הרקמה האנושית גם בהשוואה למודלים של בעלי חיים19. בסך הכל, אבן הפינה של פיגומים תלת-ממדיים אלה היא לספק לתאים סביבה מתאימה במבחנה, אשר משחזרת את ארכיטקטורת הרקמה הטבעית ומאפשרת הצלבה מולקולרית דו-כיוונית8.
כדי להגדיל את המורכבות של מודלים מבוססי קולגן, רכיבי ECM נפוצים אחרים משולבים בתהליך הנדסת הרקמות, ובכך יוצרים מודלים רלוונטיים יותר מבחינה פיזיולוגית כדי לשקף TMEs נישה של רקמות שונות. לדוגמה, GAGs, פוליסכרידים בעלי מטען שלילי הנמצאים בכל רקמות היונקים20, מאפשרים התקשרות תאים, נדידה, התרבות והתמיינות. כונדרויטין סולפט הוא סוג מסוים של GAG שנמצא בעצם ובסחוס, אשר שימש בעבר ביישומי הנדסת רקמות לתיקון עצם 21,22,23,24,25. ננו-הידרוקסיאפטיט (nHA) הוא המרכיב האנאורגני העיקרי בהרכב המינרלים של רקמות העצם האנושיות, המהווה עד 65% מהעצם לפי משקל26 ולכן נמצא בשימוש נרחב להחלפת עצם והתחדשות27. לפיכך, GAGs ו- nHA הם חומרים מרוכבים אטרקטיביים לשחזור הנוירובלסטומה הראשונית ECM ולמידול האתרים הגרורתיים הנפוצים ביותר של נוירובלסטומה, מח עצם (70.5%) ועצם (55.7%)28.
פיגומים המשלבים רכיבי ECM אלה פותחו במקור עבור יישומי הנדסת רקמות עצם עם ניתוח מקיף של התאימות הביולוגית שלהם, רעילות, ותכונות אוסטיאו-מוליכות ואוסטיאואינדוקטיביות 29,30. מדובר במטריצות נקבוביות על בסיס קולגן המיוצרות בטכניקות ייבוש בהקפאה כדי לשלוט בתכונות הפיזיות והביולוגיות שלהן. פיגומי הקולגן בתוספת nHA (Coll-I-nHA) או כונדרויטין-6-סולפט (Coll-I-GAG) הדגימו הצלחה בחיקוי ה-TME הראשוני בסרטן השד31 וגרורות לעצם בסרטן הערמונית15 וכן נוירובלסטומה17. טכניקת הייבוש בהקפאה המשמשת לייצור פיגומים מרוכבים אלה מניבה הומוגניות הניתנת לשחזור בגודל הנקבוביות ובנקבוביות בתוך הפיגומים22,23,24. בקצרה, תרחיף קולגן (0.5 wt%) מיוצר על-ידי ערבוב קולגן פיברילרי עם חומצה אצטית במינון 0.05 M. עבור Coll-I-GAG, 0.05 wt% של chrondoitin-6-sulfate שבודד מסחוס הכריש מתווסף לתמיסת הקולגן בזמן הערבוב. עבור פיגומים מרוכבים Coll-I-nHA, חלקיקי הידרוקסיאפטיט בגודל ננומטרי מסונתזים כפי שתואר קודם לכן27 ומוסיפים לתרחיף הקולגן ביחס של 2:1 למשקל הקולגן בתהליך הערבוב. כל הפיגומים מוצלבים פיזית ומעוקרים באמצעות טיפול דהידרותרמי ב 105 ° C במשך 24 שעות25. פיגומים גליליים (קוטר 6 מ"מ, גובה 4 מ"מ) מתקבלים באמצעות ניקוב ביופסיה וניתן להצליב אותם כימית עם הידרוכלוריד 3 mM N-(3-dimethylaminopropyl)-N'-ethylcarbodiimide hydrochloride ו- 5.5 mM N-hydroxysuccinimide (EDAC/NHS) במים מזוקקים (dH2O) כדי לשפר את התכונות המכניות של המבנים30. תהליך ייצור אופטימלי זה של שני פיגומי קולגן יוצר פיגומים בעלי תכונות מכניות הניתנות לשחזור, כולל גודל נקבוביות, נקבוביות וקשיחות (kPa). גם לפיגומי Coll-I-GAG וגם ל-Coll-I-nHA יש תכונות פיזיקליות שונות, היוצרות תנאים סביבתיים שונים. המאפיינים של כל פיגום מוצגים בטבלה 1.
| קול-אי-גאג | קול-אני-נהה | |
| גודל פיגום (קוטר [מ"מ] x גובה [מ"מ]) | 6 x 4 17 | 6 x 4 17 |
| ריכוז קולגן (wt. %) | 0.5 17 | 0.5 17 |
| ריכוז המצע (wt. %) [מבוסס על משקל קולגן] | 0.05 15,17 | 200 17 |
| גודל נקבוביות ממוצע (מ"מ) | 96 22 | 96 – 120 29 |
| נקבוביות (%) | 99.5 23 | 98.9 – 99.4 27 |
| נוקשות (kPa) | 1.5 27 | 5.5 - 8.63 29 |
טבלה 1: סקירה כללית של התכונות המכניות של שני הפיגומים שאומצו לחקר ביולוגיה של נוירובלסטומה.
מאמר זה מתאר פרוטוקול של הרכבת מערכת מבוססת פיגומים תלת-ממדיים כדי לחקות טוב יותר את המיקרו-סביבה של נוירובלסטומה באמצעות קווי תאי נוירובלסטומה ופיגומים מבוססי קולגן שתוארו קודם לכן בתוספת nHA (Coll-I-nHA) או כונדרויטין-6-סולפט (Coll-I-GAG). הפרוטוקול כולל שיטות במורד הזרם לניתוח מנגנוני הגדילה של תאי נוירובלסטומה בסביבה רלוונטית יותר מבחינה פיזיולוגית באמצעות שיטות זולות שהותאמו בעבר מתרבית חד-שכבתית דו-ממדית איור 1.
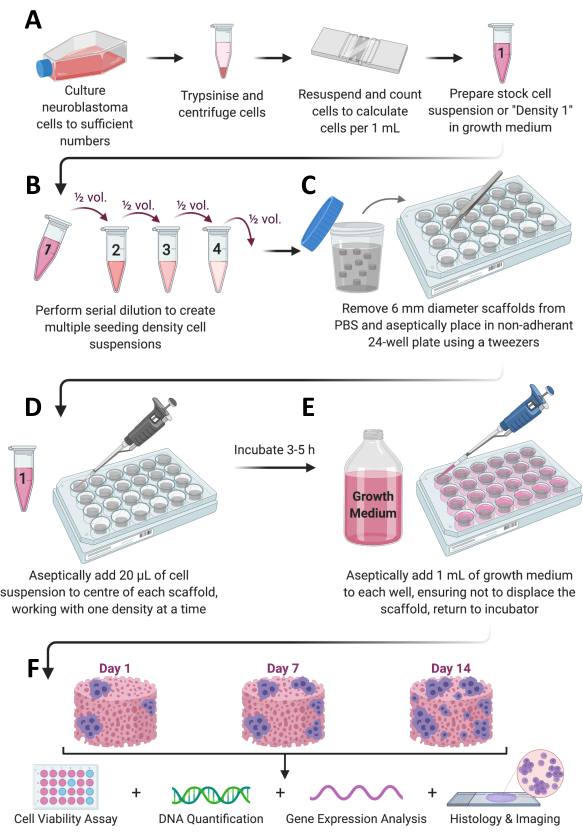
איור 1: זרימת עבודה כוללת של פרוטוקולים. (A) תאים גדלים למספרים מספיקים, מפוצלים, נספרים ומרחפים מחדש בנפח מתאים של תווך. (B) מלאי תאים זה עובר דילול סדרתי כדי להכין סך של 4 תרחיפים של תאים בצפיפויות שונות. (C) פיגומים מבוססי קולגן מצופים באופן סטרילי בלוחות 24 בארות לא דבוקים, ו-(D) 20 מיקרוליטר של תרחיף תאים מתווסף למרכז כל פיגום ונשאר לדגור ב-37°C, 5% CO2 ו-95% לחות במשך 3-5 שעות. (E) מדיום גידול מלא (1 מ"ל) מתווסף באיטיות לכל פיגום, והלוחות מוכנסים חזרה לאינקובטור כדי לאפשר צמיחת תאים למסגרת הזמן הרצויה. (F) בכל נקודת זמן שנקבעה מראש, כמה פיגומים מאוחזרים לצורך הערכת כדאיות התא וגדילתו, ניתוח ביטוי גנים וצביעה היסטולוגית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
1. תכנון ניסיוני
הערה: מספר הפיגומים והתאים הדרושים לכל ניסוי יהיה תלוי בקנה המידה של הניסוי וניתן לחשב אותו באמצעות הכלים בחלק זה על תכנון הניסוי.
- מספר הפיגומים הנדרש
- לקבוע את ציר הזמן הכולל של הניסוי ואת מרווחי ההערכה עבור שינויים בביולוגיה של התא (למשל, גדילת תאים ומטבוליזם).
הערה: לדוגמה, מסגרת הזמן של הניסוי היא 14 יום, עם הערכה של צמיחת תאים כל 7 ימים. לפיכך, נקודות הזמן הניסיוניות הן ימים 1, 7, 14 הנותנות בסך הכל 3 נקודות זמן. - לאחר מכן, החליטו על מספר היישומים הניסיוניים שייושמו בכל נקודת זמן. נסה להשלים את אותם ניתוחים בכל נקודת זמן כדי לעקוב אחר השינויים.
הערה: ניתוחים אופייניים של צמיחת תאים על פיגומים כוללים בדיקות כדאיות תאים, כימות DNA, צביעה והדמיה היסטולוגית וניתוח ביטוי גנים. אלה יידונו עוד בסעיף 5. - החלט מתי להשתמש באותו פיגום עבור יישומים מרובים במורד הזרם, למשל, לאחר הערכת כדאיות התא באמצעות בדיקה מתאימה, השתמש שוב בפיגום לבידוד DNA/RNA (נדון ב- 5.1.11).
- שמור מינימום של 3 עותקים ביולוגיים עבור כל יישום, למשל, 3 פיגומים עבור כדאיות התא וכימות DNA, 3 עבור היסטולוגיה, ו 3 עבור ניתוח ביטוי גנים. מכיוון שזה שווה ל-9 פיגומים לנקודת זמן, תכננו להשתמש ב-27 פיגומים עבור 3 נקודות זמן.
- לבסוף, הכפל מספר זה במספר הפרמטרים או התנאים הניסיוניים (למשל, הערכת קווי תאים מרובים, צפיפות זריעה ראשונית, הרכבי פיגומים).
הערה: בפרוטוקול זה, 4 צפיפויות זריעה ראשוניות שונות הוערכו עבור קו תאים אחד, וכתוצאה מכך נדרשו 108 (27 פיגומים x 4 תנאים) פיגומים. כדי לקחת בחשבון טעויות אנוש ולתת כיסוי נוסף, הוסף ~ 10% למספר זה, למשל, אם נדרשים 108 פיגומים, הכינו 120 פיגומים.
- לקבוע את ציר הזמן הכולל של הניסוי ואת מרווחי ההערכה עבור שינויים בביולוגיה של התא (למשל, גדילת תאים ומטבוליזם).
- מספר התאים הנדרשים
הערה: נפח 20 μL של תרחיף תאים מומלץ לזריעת תאים על פיגום גלילי (קוטר 6 מ"מ, גובה 4 מ"מ) ביום 0. מספר התאים לכל 20 מיקרוליטר זה של תרחיף התא מותאם בהתאם לתכנון הניסוי, המחושב בסעיף 1.1. צפיפות זריעה התחלתית נפוצה היא 2 × 105 תאים לכל 20 μL, המשמשת כדוגמה לפרוטוקול להלן.- כדי לחשב את כמות התאים הכוללת הנדרשת לניסוי, הכפל את 2 × 105 התאים הראשונים לכל 20 מיקרוליטר במספר הפיגומים הנדרשים.
הערה: לדוגמה, 30 פיגומים כפול 20 μL נותן נפח כולל של 600 μL. אם כל פיגום דורש 2 × 10 5 תאים, 600 μL של תרחיף מכיל סך של 6 × 10 6 תאים (2 × 105 × 30), נותן דרישה סופית של 6 × 106 תאים ב 600 μL. מספר הפרמטרים הניסיוניים יכתיב את מספר התאים הכולל הנדרש. פרוטוקול זה, אם כן, מתאר תרבית תאים באמצעות צלוחיות תרבית תאים רב שכבתיות, אשר יכול להתמודד עם אותו מספר תאים כמו 10 מסורתי 175 ס"מ2 צלוחיות.
- כדי לחשב את כמות התאים הכוללת הנדרשת לניסוי, הכפל את 2 × 105 התאים הראשונים לכל 20 מיקרוליטר במספר הפיגומים הנדרשים.
2. הכנת פיגומים על בסיס קולגן
הערה: פיגומים גליליים Coll-I-nHA ו- Coll-I-GAG (קוטר 6 מ"מ, גובה 4 מ"מ) מוכנים בשיטות שנקבעו 15,21,27. לאחר הצלבה כימית לפי שיטות שפורסמו בעבר17, יש להשתמש בפיגומים תוך שבוע.
- לאחר ייצור הפיגומים בעלי התכונות המכאניות הרצויות, יש לוודא שהפיגומים רוויים במים מלאים ונשטפים היטב במי מלח חוצצי פוספט (PBS).
הערה: זה בדרך כלל לוקח ~ 12 שעות לאחר crosslinking של פיגומים והוא יכול להתבצע במיכלי פסולת תרבית רקמה 100 מ"ל ב 4 ° C, עם מקסימום של 50 פיגומים לכל מיכל ו 2 מ"ל של PBS לכל פיגום. - אחסנו את הפיגומים ב-PBS בטמפרטורה של 4°C עד שהם מוכנים לשימוש.
3. להפיץ תאי נוירובלסטומה בבקבוק תרבית תאים רב שכבתי
הערה: צפיפות הזריעה האופטימלית עבור הבקבוק הרב-שכבתי תשתנה. עבור הבקבוק המשמש בניסוי זה, הצפיפות האופטימלית לפי הוראות היצרן היא 1 × 107 תאים. לפני זריעת הצלוחית הרב-שכבתית, יש להפיץ תאים לצפיפות של 1 × 107 תאים ומעלה בבקבוק תרבית רקמה מתאים (למשל, צלוחיות תרבית רקמה T175 ס"מ2 ). כדי לזרוע תאים לתוך הבקבוק הרב-שכבתי (סעיף 3.1), לגדל אותם עד 70-80% נפגשים, לקצור ולספור את מספר התאים למ"ל, תוך התייחסות לשלבים 3.2.16-3.2.20 לביצוע ספירת התאים. לאחר ספירת תרחיף התא, המשך מיד לזריעת הצלוחית הרב-שכבתית. עבודת תרבית תאים חייבת להתבצע במכסה מנוע זרימה למינרית כדי לשמור על סטריליות.
- זריעת בקבוק תרבית התאים הרב-שכבתי
- חימום מראש של 550 מ"ל של מדיום גידול מלא (משתנה בהתאם לקו התאים בשימוש) ו -100 מ"ל של PBS סטרילי באמבט מים של 37 מעלות צלזיוס למשך 20 דקות.
- באמצעות תרחיף התא שנקטף, חשב את הנפח הנדרש של תרחיף התא הדרוש להשגת צפיפות הזריעה האופטימלית של 1 × 107 תאים באמצעות משוואה (1), כאשר WANT מתייחס למספר התאים הדרושים לזריעת הבקבוק הרב-שכבתי, ו- HAVE מתייחס למספר התאים / מ"ל בתרחיף התא:
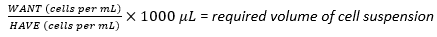 (1)
(1)
לדוגמה,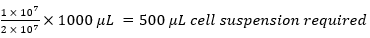
- הוסף את הנפח הנדרש של תרחיף התא ל -100 מ"ל של מדיום הגידול המחומם מראש.
- קחו בקבוק רב-שכבתי חדש במכסה המנוע, הסירו את המכסה והחזיקו את הבקבוק בזווית של 60°. לאט לאט פיפטה כל 100 מ"ל של התא מתלה לתוך הצלוחית, במורד הצד הזוויתי של הצוואר. מכסים את הבקבוק ומניחים אותו על צידו כדי לאפשר לתאים להתפזר בין השכבות באופן שווה.
- בזווית של 60°, הוסיפו 400 מ"ל של מצע הגידול שחומם מראש לבקבוק הרב-שכבתי על ידי מזיגה איטית או פיפטציה במורד הצד הזוויתי של הצוואר. אם הצוואר מתמלא, החזירו את הבקבוק למצב זקוף, או סגרו את הבקבוק והניחו אותו על צידו לפני שתחזרו למזיגה.
הערה: שפכו לאט כדי למנוע היווצרות מוגזמת של בועות. הקש בעדינות על הבקבוק במצב זקוף כדי לאפשר לכל הבועות לעלות למעלה והסר אותן עם פיפטה של 10 מ"ל. ודא שהבקבוק מלא בחוט התחתון של הצוואר; הוסף עוד מדיום, במידת הצורך, כדי להשיג זאת. - מכסים את הבקבוק הרב-שכבתי ודגרים עליו כשהצוואר הזוויתי פונה כלפי מטה ב-37°C, 5%CO2 ו-95% לחות.
- בדוק את הצמיחה כל 2-3 ימים עבור confluency. כדי לבדוק את המפגש של שתי השכבות התחתונות של הצלוחית הרב-שכבתית, צפו בהן תחת עדשה אובייקטיבית 4x של מיקרוסקופ הפוך.
הערה: כאשר זרע עם 1 × 107 תאי נוירובלסטומה, בקבוק 10 שכבות ייקח בדרך כלל שבוע כדי להיות confluent - אם כי זה עשוי להשתנות בהתאם לקו התאים בשימוש.
- תחזוקה שוטפת של תאים בבקבוק הרב שכבתי
- חימום מראש של 550 מ"ל של מדיום גידול מלא (משתנה בהתאם לקו התאים בשימוש), 50-100 מ"ל של טריפסין, ו 300 מ"ל של PBS סטרילי באמבט מים 37 מעלות צלזיוס למשך 20 דקות.
- בדוק את בקבוק רב שכבתי עבור 70-80% confluency.
- מניחים את הבקבוק הרב שכבתי במכסה מנוע זרימה למינרית ומשליכים את המדיום המשומש מהבקבוק על ידי מזיגה. בתחילה, להטות את הבקבוק כך המדיום הוא שפך על סכר האוויר לתוך מיכל פסולת. בזמן המזיגה, סובבו את הבקבוק ב-180 מעלות עד שהתווך זורם במורד הצוואר הזוויתי של הצלוחית. סובבו את הבקבוק קדימה ואחורה לאורך ציר זה כדי לסלק את שאריות הנוזלים.
- שטפו את התאים על ידי הוספת 100 מ"ל של PBS סטרילי שחומם מראש באיטיות במורד הצוואר הזוויתי. מכסים את הצלוחית, מניחים אותה על צדה כדי לאפשר פיזור אחיד של PBS, ומסובבים את הבקבוק קדימה ואחורה כדי לשטוף את התאים.
- יש להשליך את שטיפת PBS באותו אופן כמו 3.2.3. חזרו על שלבי הכביסה.
- לדלל 50 מ"ל של טריפסין שחומם מראש ב 50 מ"ל של PBS סטרילי שחומם מראש. הוסיפו 100 מ"ל של תמיסת טריפסין מדוללת לצלוחית הרב-שכבתית, למכסה והניחו את הבקבוק על צידו כדי לאפשר פיזור אחיד של הטריפסין. אם קו התא הוא דבק מאוד, להשתמש 100 מ"ל של טריפסין לא מדולל.
- יש לדגור על הבקבוק במשך 2-5 דקות בטמפרטורה של 37°C, 5%CO2 ו-95% לחות, תוך ניטור ניתוק התאים מתחת למיקרוסקופ. במידת הצורך, הקש על הבקבוק בחוזקה כדי לסייע בניתוק או החזיר אותו לאינקובטור למשך דקה נוספת.
- מניחים את הבקבוק הרב שכבתי במכסה מנוע זרימה למינרית ומנטרלים את הטריפסין עם 100 מ"ל של מדיום צמיחה. מכסים את הצלוחית, מניחים אותה על צדה, ומתנדנדים קדימה ואחורה כדי להבטיח נטרול מלא.
- יוצקים את מתלה התא המנוטרל לתוך צינורות צנטריפוגות חרוטיות 4 x 50 מ"ל.
הערה: אם נדרש קציר תאים מלא, שטפו שוב את הבקבוק הרב-שכבתי עם 100 מ"ל של PBS סטרילי ושפכו אותו לצינורות צנטריפוגות בגודל 2 x 50 מ"ל. - צנטריפוגה את תרחיף התא בצינורות צנטריפוגות 50 מ"ל ב 340 × גרם במשך 3-4 דקות כדי לגלול את התאים.
- מחזירים את צינורות הצנטריפוגות למכסה המנוע של הזרימה הלמינרית ומשליכים בזהירות כמה שיותר סופרנאטנט מכל כדור.
הערה: הגלולה תהיה גדולה ורופפת יחסית ולכן ניתן לשבש אותה בקלות. - הוסף 1-5 מ"ל של מדיום גידול לכל גלולה והשהה אותו מחדש על ידי פיפטינג למעלה ולמטה מספר פעמים.
- אגרו יחד את 4 הכדוריות התלויות בצינור צנטריפוגה אחד של 50 מ"ל, ערבבו אותן היטב עם הפיפטה, ושימו לב לנפח הכולל.
- בצע דילול מתאים של תרחיף התא לספירת תאים כך שכל ריבוע חיצוני על ההמוציטומטר יכיל 30-100 תאים.
הערה: דילול התחלתי מתאים הוא 1:100; לשם כך, פיפטה 10 μL של השעיית התא לתוך צינור צנטריפוגה חרוטי טרי 15 מ"ל לדלל אותו עם 990 μL של PBS סטרילי. פיפטה את התערובת למעלה ולמטה מספר פעמים כדי לערבב היטב. - מניחים צינור צנטריפוגה בנפח 50 מ"ל המכיל את מלאי התאים באינקובטור בזמן הספירה.
- אם ניקח המוציטומטר נקי, הניחו כיסוי נקי על הרשת, כפי שמוצג באיור 2.
- פיפטה 10 μL של תרחיף התא המדולל לתוך תא hemocytometer. אם התא מתמלא לפני הוצאת כל 10 μL, הפסיקו את הפיפט.
- מקם את ההמוציטומטר תחת המטרה 4x של מיקרוסקופ אור. התאם את המיקוד הגס והעדין כדי להציג את התאים באופן חזותי.
- ספרו את מספר התאים בארבעת הריבועים הפינתיים החיצוניים של התא כפי שמודגש באיור 2. הוסף את ארבע הספירות וחלק ב- 4 כדי לחשב את ממוצע התאים לריבוע.
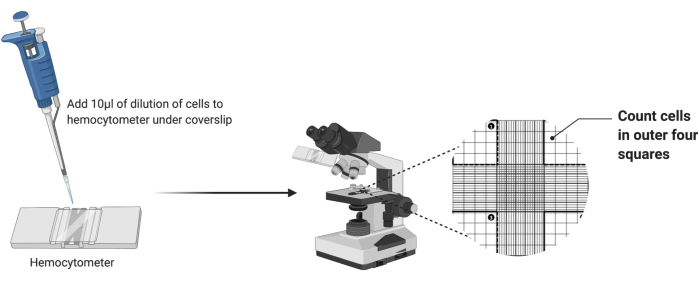
איור 2: ספירת תאים באמצעות המוציטומטר. עשרה מיקרוליטרים של תרחיף תאים מתווספים להמוציטומטר שמתחת לכיסוי. לאחר מכן החדר ממוקם מתחת לעדשה אובייקטיבית 4x של מיקרוסקופ, ומספר התאים בארבע הפינות החיצוניות של הרשת נספרים. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- הכפל את הספירה הממוצעת בגורם הדילול (למשל, 100) והכפיל מספר זה ב- 10,000 כדי לקבל את מספר התאים למ"ל באמצעות משוואה (2).
 (2)
(2) - חשב את מספר התאים הכולל בתמיסת המניות על ידי הכפלה בנפח הכולל של מלאי התאים (לדוגמה, אם 4 הכדוריות המרחפות שאוגדו יצרו תמיסה של 20 מ"ל, הכפל תאים/מ"ל ב- 20).
- כדי לשמור על הבקבוק הרב-שכבתי, השתמש במשוואה (1) המתוארת בשלב 3.1.2 כדי לחשב את נפח מלאי התאים הדרוש כדי לזרוע 1 × 107 תאים בחזרה לתוך הבקבוק ולבצע שלבים 3.1.3-3.1.6 כדי לזרוע מחדש את הצלוחית. אם מוכנים לזרוע את הפיגומים, המשך לסעיף הבא.
4. זרע תאי נוירובלסטומה על פיגומים
- הכנת השעיית תאי מלאי
הערה: פרוטוקול זה יתאר את השלבים ליצירת ארבע צפיפויות זריעה שונות של תאי נוירובלסטומה, עם מקדם כפל של 2 בין כל צפיפות. דילול סדרתי ישמש אפוא ליצירת שלושה מתלי תאים נוספים מהשעיית המלאי. עבודת תרבית תאים חייבת להתבצע במכסה מנוע זרימה למינרית כדי לשמור על סטריליות.- השתמש במשוואה (3) כדי לחשב את נפח התאים הדרוש ממספר התאים הכולל בבקבוק הרב-שכבתי (נספר בסעיף 3.2.19) כדי להכין את צפיפות הזריעה הראשונה או את השעיית מלאי התא.
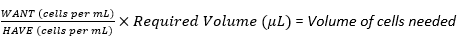 (3)
(3)
הערה: לדוגמה, אם צפיפות הזריעה הגבוהה ביותר היא 6 × 10 5 תאים לכל פיגום הנדרשים עבור 30 פיגומים, כאשר כל פיגום מקבל 20 μL של תרחיף תאים, תרחיף תאי המלאי ידרוש 1.8 × 107 תאים (6 × 105 תאים × 30 פיגומים) בנפח כולל של 600 μL (20 μL × 30 פיגומים).
מכיוון שיבוצע דילול סדרתי מהכנה זו, יש להכפיל מספרים אלה, כלומר 3.6 × 107 תאים בנפח כולל של 1200 μL. כדי להמיר זאת ל- WANT בתאים לכל מ"ל; לחלק 3.6 × 10 7 על ידי 1200 μL ולהכפיל על ידי 1000 μL, נותן 3 × 107 תאים לכל מ"ל.

- הוסף את נפח מלאי התאים הנדרש לצינור צנטריפוגה סטרילי של 2 מ"ל או 15 מ"ל והבא לנפח סופי של 1200 מיקרוליטר עם מדיום גידול. תייגו את הצינור הזה כצפיפות 1 (איור 3).
- השתמש במשוואה (3) כדי לחשב את נפח התאים הדרוש ממספר התאים הכולל בבקבוק הרב-שכבתי (נספר בסעיף 3.2.19) כדי להכין את צפיפות הזריעה הראשונה או את השעיית מלאי התא.
- בצע דילול טורי כדי ליצור תרחיפים מרובים של תאים בצפיפות זריעה.
- מצפיפות 1 שהוכנה בשלב 4.1.1, הכינו שלוש צפיפויות נוספות של תרחיף תאים באמצעות דילול סדרתי לפי איור 3.
- לדלל כל צפיפות בפקטור של 2 בתווך הגידול. ראשית, הוסף את הנפח הסופי הנדרש (600 מיקרוליטר מהדוגמה הקודמת) של מדיום גידול לשלושה צינורות צנטריפוגות סטריליים של 2 מ"ל או 15 מ"ל.
- מעבירים מחצית צפיפות 1 (600 μL) לאחד הצינורות, מערבבים היטב את תרחיף התא עם המדיום לדלל. תייג צינור זה כצפיפות 2.
- מעבירים מחצית מצפיפות 2 (600 μL) לצינור הבא, מערבבים היטב את תרחיף התא עם המדיום לדלל. תייג צינור זה כצפיפות 3.
- מעבירים מחצית צפיפות 3 (600 μL) לצינור הבא, מערבבים היטב את תרחיף התא עם המדיום לדלל. תייג צינור זה כצפיפות 4.
- יש להשליך 600 μL מצפיפות 4 כך שלכל ארבעת התכשירים יהיה נפח סופי של 600 μL.
- כבקרה שלילית, הוסף 600 μL של מדיום גידול רק לצינור צנטריפוגה סטרילי של 2 מ"ל. ראו איור 3 לשרטוט של תהליך הדילול הסדרתי.
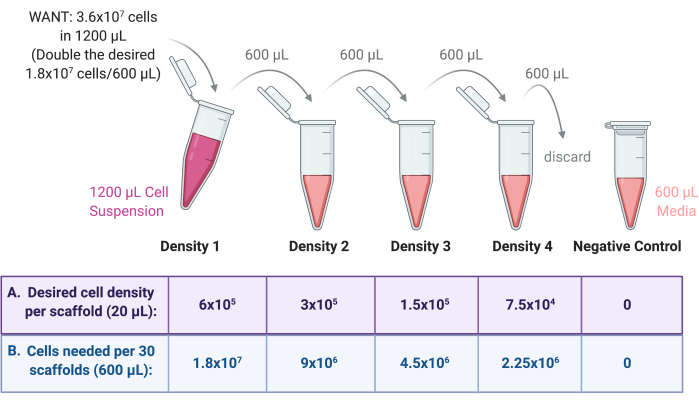
איור 3: דילול סדרתי של מלאי תאים להכנת 4 מתלים עבור 4 צפיפויות שונות של זריעת פיגומים. (A) ניתן לכוונן את המספרים כך שיתאימו לצפיפות הזריעה הרצויה לכל פיגום, ו-(B) להכפיל את המספר הכולל של פיגומים לכל צפיפות, כאשר כל פיגום מקבל 20 מיקרוליטר של תרחיף תאים. בדוגמה זו, צפיפות 1 דורשת 6 × 105 תאים לכל פיגום, שווה ערך ל- 1.8 × 107 תאים ב- 600 μL עבור 30 פיגומים. מספר זה מוכפל כדי להתחיל את הדילול הסדרתי, כאשר 600 μL מועבר ומדולל ב 600 μL של מדיום גידול בצינור הבא. תהליך זה נמשך עד שיש 4 תאים מתלים עם פקטור של 2 בין כל אחד. בקרה שלילית נעשית על ידי הוספת 600 μL של בינוני רק לצינור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- הוספת מתלי תאים לפיגומים
הערה: הסר את הפיגומים (המאוחסנים ב- PBS) מהמקרר ואפשר להם להגיע לטמפרטורת החדר (RT) לפני הוספת התאים.- הכניסו את הפיגומים ב-PBS למכסה המנוע של הזרימה הלמינרית.
- בעזרת פינצטה סטרילית, הניחו את הפיגומים בלוחות לא דבוקים של 24 בארות עם פיגום אחד לכל באר (איור 1C). הרימו בעדינות את הפיגומים בפינותיהם ולחצו אותם קלות לצד המיכל כדי להסיר עודפי PBS. מוסיפים את הפיגומים למרכז הבארות בצד העור כלפי מטה (צד השכבה המבריק של הפיגומים, הפונה מטה אל לוחות 24 בארות הפלסטיק).
- תייגו את לוחות 24 הקידוחים עם פרטים על קו התא, פרמטרים רלוונטיים (למשל, צפיפות זריעה) ונקודות זמן. עבוד עם צפיפות זריעה של תא אחד בכל פעם, תוך שמירה על הצפיפויות הנותרות באינקובטור של 37 מעלות צלזיוס עד מוכן לשימוש.
- במכסה המנוע של הזרימה הלמינרית, השתמשו בפיפטת P20 ובקצוות סטריליים כדי להוסיף בעדינות 20 μL של מתלה התאים הרלוונטי למרכז כל פיגום (איור 1D). שמור היטב את התאים בתרחיף על ידי ערבוב היטב תוך הוספת התאים לפיגומים. ודא כי המתלה נשאר על גבי הפיגום ולא מחליק על בסיס הבאר, שכן זה לא יאפשר חיבור תאים לפיגומים.
- לאחר הוספת התאים, דגרו על הלוחות במשך 3-5 שעות (37°C, 5% CO2 ו-95% לחות) כדי לאפשר לרוב התאים להיחבר.
- לאחר הדגירה, הוסיפו לאט ובעדינות 1 מ"ל של מצע גידול שחומם מראש לכל באר (איור 1E). השתמש פיפטה P1000 כדי להוסיף את המדיום כדי לאפשר תנועה איטית ומבוקרת יותר, מניעת תזוזה של הפיגומים. אם אתם עובדים עם מספר גבוה מאוד של פיגומים, השתמשו בפיפט של 10 מ"ל כאשר אקדח הפיפטה מוגדר ל'נפילה' ו'נמוכה'.
- יש לדגור על צלחות 24 בארות למשך הלילה (37°C, 5%CO2 ו-95% לחות).
- תחזוקת תאים על הפיגומים
- לאחר 24 השעות הראשונות של חיבור התאים (יום 1), מעבירים את פיגומי הזרעים ללוחות חדשים שאינם דבקים ב-24 בארות, ומוסיפים 1-2 מ"ל של מצע גידול טרי.
הערה: שלב זה מסיר תאים שנפלו לתחתית לוחות הפלסטיק בעלי 24 הקידוחים במקום לאפשר להם לגדול על הפיגומים. העתקי פיגומים שנקבעו ליום 1 יוסרו לאחר 24 שעות, כאמור בסעיף 5; לפיכך, התחזוקה אינה חלה על פיגומים אלה. - לפקח על הפיגומים בתחילה כל 2-3 ימים לשינוי צבע של מדיום הגידול. ככל שהזמן מתקדם והתאים מתרבים בתוך הפיגומים, מזינים את התאים בתדירות גבוהה יותר.
- באמצעות אקדח פיפטה 10 מ"ל, במצב איטי, להסיר את 1 מ"ל של המדיום בילה ולהשליך. אם אתם מבצעים ניסויים הדורשים תווך מותנה, אספו את התווך המשומש של העתקים ביולוגיים בצינור צנטריפוגה של 15 מ"ל, צנטריפוגה ב 340 × גרם למשך 2 דקות כדי להשליך את פסולת התא, העבירו את הסופרנאטנט לצינור טרי, ואחסנו ב -80 מעלות צלזיוס.
- מוסיפים בעדינות 2 מ"ל של מצע גידול שחומם מראש לפיגומים, באמצעות פונקציית הטפטוף שוב על הפיפטה, ומחזירים את צלחת 24 הבארות לאינקובטור (37°C, 5% CO2 ו-95% לחות). חזור על הפעולה בכל פעם שהמדיום מושקע למשך תקופת הצמיחה הרצויה.
- לאחר 24 השעות הראשונות של חיבור התאים (יום 1), מעבירים את פיגומי הזרעים ללוחות חדשים שאינם דבקים ב-24 בארות, ומוסיפים 1-2 מ"ל של מצע גידול טרי.
5. שליפת פיגומים ויישומים
הערה: בכל נקודת זמן, ניתן להשתמש במספר יישומים כדי לעקוב אחר גדילת תאים על הפיגומים או להעריך פרופילי ביטוי גנים וחלבונים. תנאי שליפת הפיגום יהיו תלויים בניתוח שיבוצע, עם שיטות שליפה מרובות המתוארות בסעיפים הבאים ומודגמות באיור 4.
- הערכת כדאיות התא בתוך פיגומים
- לעקר את מגיב בדיקת כדאיות התא המתאים על ידי סינון דרך מסנן סטרילי של 0.2 מיקרומטר לתוך צינור צנטריפוגה במכסה המנוע של הזרימה הלמינרית. מחממים מראש תמיסה סטרילית זו יחד עם PBS צמיחה מלאה בינונית וסטרילית באמבט מים של 37 מעלות צלזיוס.
- במכסה המנוע של הזרימה הלמינרית, השתמשו בפינצטה סטרילית כדי להעביר את הפיגומים לניתוח לצלחת טרייה בת 24 בארות. תייגו את הצלחת עם כל הפרטים הרלוונטיים.
הערה: בצע את הניתוח במשולש. - הוסף 900 μL של מדיום הגידול המחומם מראש לכל באר, ואחריו 100 μL של מגיב הכדאיות התא הסטרילי. כלול בקרה שלילית על ידי הוספת 900 μL של בינוני ו 100 μL של מגיב קיימא התא סטרילי לבאר ללא פיגום. החלף את המכסה בצלחת, וניער בעדינות את הצלחת למשך ~3 דקות כדי לפזר באופן שווה את מגיב הכדאיות התא המדולל ברחבי הבאר. יש לדגור על הצלחת בטמפרטורה של 37°C, 5%CO2 ו-95% לחות.
הערה: יהיה צורך למטב את זמני הדגירה עבור כל קו תאים; עיין בהנחיות היצרן. עבור שורות תאי נוירובלסטומה, דגירה של 4-6 שעות נראית אופטימלית. - לאחר הדגירה, מוציאים את הצלחת מהאינקובטור ומנדנדים אותה בעדינות למשך מספר שניות.
- במכסה המנוע של הזרימה הלמינרית, פתחו צלחת חדשה ושקופה בעלת 96 בארות. מכל באר בצלחת 24 הקידוחים, מעבירים את המדיום המודגר והמגיב לשלוש בארות של צלחת 96 בארות עם 100 מיקרוליטר לבאר, תוך מתן טריפליקטים טכניים.
הערה: העברה זו תשאיר 700 μL בבארות של צלחת 24 בארות. - כסו את הצלחת בעלת 96 הבארות ברדיד אלומיניום כדי להגן על מגיב הכדאיות של התא מפני אור.
- מוציאים ומשליכים את 700 מיקרוליטר הנותרים של תכולת הבאר מכל פיגום בצלחת בת 24 הקידוחים. שטפו כל פיגום פעמיים עם 1 מ"ל PBS סטרילי.
הערה: כל הצבע לא יוסר מהפיגומים. פיגומים אלה יכולים לשמש ליישומים נוספים, למשל כימות דנ"א, על-ידי הצבתם ב-1 מ"ל של 1% טריטון X-100 בתמיסת נתרן ביקרבונט 0.1 מ' (NaHCO3) ואחסונם בטמפרטורה של -80°C (ראו סעיף 5.2, איור 4B). - הסר את לוח 96 הקידוחים ממכסה המנוע של הזרימה הלמינרית ומדוד את הבליעה של כל באר באורכי גל של 570 ננומטר ו- 600 ננומטר באמצעות קורא מיקרו-לוחות. רשום את ערכי הבליעה בשני אורכי הגל ופעל לפי הוראות היצרן כדי לחשב את אחוז ההפחתה של מגיב הכדאיות התאית על ידי התאים.
- גרף וניתוח סטטיסטי של תוצאות כדאיות התא באמצעות תוכנה מתאימה. הזן ערכים משולשים ביולוגיים כדי לייצר קווי שגיאה ולציין את השתנות המבחן.
- כדי לבחון שינויים בכדאיות התא לאורך פרק הזמן של הניסוי, בצע ניתוח חד-כיווני של שונות (ANOVA) עם השוואות מרובות של האמצעים באמצעות תוכנה ביוסטטיסטית מתאימה.
- ציין הבדלים משמעותיים בין נקודות הזמן בגרפים כ- ns (P>0.05), * (P≤0.05), ** (P≤0.01), *** (P≤0.001) ו- **** (P≤0.0001).
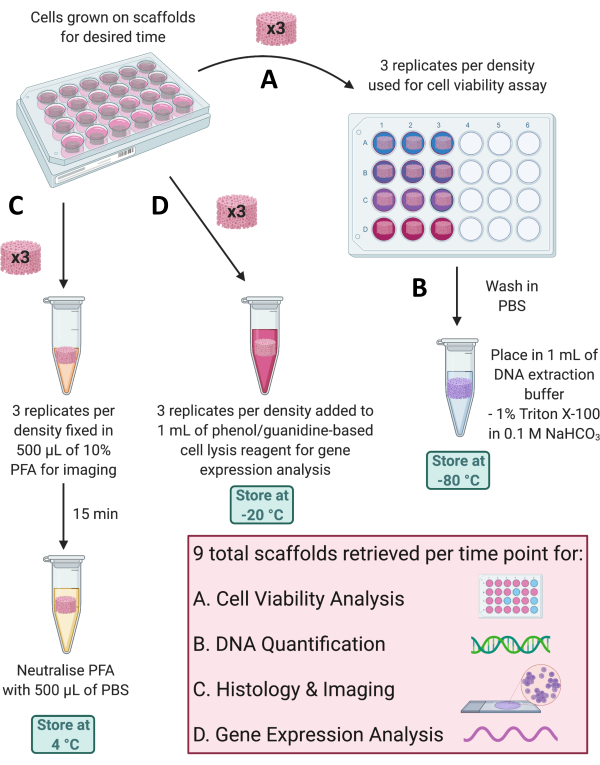
איור 4: שליפת פיגומים לניתוחים שונים בכל נקודת זמן. (A) שלושה פיגומים משוכפלים מאוחזרים לצורך ניתוח כדאיות התא. (B) לאחר מכן ניתן לשטוף את הפיגומים האלה ב-PBS, למקם אותם ב-1% Triton X-100 ב-0.1 M NaHCO3, ולאחסן אותם בטמפרטורה של -80°C לצורך כימות DNA. (C) שלושה עותקים משוכפלים נוספים קבועים ב-10% PFA למשך 15 דקות, מנוטרלים ב-PBS ומאוחסנים ב-4°C לצורך צביעה והדמיה היסטולוגית. (D) לבסוף, 3 עותקים משוכפלים מתווספים למגיב ליזה תאי מבוסס פנול/גואנידין ומאוחסנים בטמפרטורה של -20°C לצורך ניתוח ביטוי גנים. קיצורים: PBS = מלח חוצץ פוספט; PFA = paraformaldehyde. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- כימות הדנ"א מהתאים בפיגומים
הערה: כפי שצוין בהערה לאחר שלב 5.1.7, שליפת הפיגומים לצורך כימות DNA כרוכה בהכנסת הפיגומים לתוך צינורות צנטריפוגות 2 מ"ל המכילים 1 מ"ל של 1% טריטון X-100 בתמיסת 0.1 M NaHCO3 ואחריה אחסון ב -80 ° C. לפני שניתן יהיה לבצע ניתוח DNA, התאים חייבים לעבור שלושה מחזורי הקפאה-הפשרה כדי לשכב את תאי הנוירובלסטומה כראוי ולשחרר DNA לכימות.- הסר את הדגימות שאוחסנו בעבר ב- Triton X-100 מ- -80°C. השאירו את הדגימות ב- RT למשך 1-3 שעות או עד להפשרה.
- מערבלים את הדגימות במשך 10-20 שניות, ומחזירים את הדגימות לטמפרטורה של -80 מעלות צלזיוס למשך 18-24 שעות או עד להקפאה מלאה. חזור על תהליך זה במשך שלושה מחזורי הקפאה-הפשרה.
- כדי למקסם את תפוקת הדנ"א, השתמשו בליזר רקמות כדי לשבש את התאים בפיגומים.
- מניחים חרוז מתכת בצינור צנטריפוגה בנפח 2 מ"ל המכיל פיגום בטריטון X-100, ומניחים את הצינור בתוך המתאם כדי לנער את הדגימה במהירות של 50 תנודות לשנייה למשך 2-3 דקות.
הערה: השתמש בצינורות צנטריפוגות בעלי תחתית עגולה מכיוון שחרוז המתכת עלול להיתקע בצינור בעל תחתית מחודדת.
- מניחים חרוז מתכת בצינור צנטריפוגה בנפח 2 מ"ל המכיל פיגום בטריטון X-100, ומניחים את הצינור בתוך המתאם כדי לנער את הדגימה במהירות של 50 תנודות לשנייה למשך 2-3 דקות.
- כמת את הדנ"א בתמיסת Triton X-100 על ידי יישום כתם DNA דו-גדילי פלואורסצנטי (dsDNA) ומדידת הפליטה באמצעות קורא מיקרו-לוחות. עיין בהנחיות היצרן; דללו את הדגימות כראוי במאגר Tris-ethylenediamine tetraacetic acid (TE) כדי להכין 8 תקני dsDNA באמצעות דילול סדרתי במאגר TE (איור 5).
- בלוחות שחורים אטומים של 96 בארות, מוסיפים 100 מיקרוליטר מכל תקן או דגימה לבארות בשלשה טכנית.
- דללו את כתם dsDNA הפלואורסצנטי פי 200 במאגר TE והוסיפו 100 μL לכל תקן/דגימה באמצעות פיפטה רב ערוצית. מכסים את הצלחת בטינפויל ודגרים ב-RT במשך 5 דקות.
- מדוד ורשום את הפלואורסצנטיות של כל באר ב 520 ננומטר. פעל בהתאם להנחיות היצרן כדי לחשב את ריכוז ה- DNA בכל דגימה.
הערה: אם הריכוז הממוצע של דנ"א לתא ידוע עבור קו התא שבו נעשה שימוש, ניתן להמיר את ערכי ריכוז הדנ"א למספרי תאים באמצעות משוואה (4). (4)
(4) - גרף וניתוח סטטיסטי של תוצאות כימות ה- DNA באמצעות תוכנה מתאימה. הזן ערכים משולשים ביולוגיים כדי לייצר קווי שגיאה ולציין את השתנות המבחן.
- כדי לבחון את השינויים בריכוז הדנ"א / מספרי התאים במהלך פרק הזמן של הניסוי, בצע בדיקת ANOVA חד-כיוונית עם השוואות מרובות של האמצעים באמצעות תוכנה ביוסטטיסטית מתאימה.
- ציין הבדלים משמעותיים בין נקודות הזמן בגרפים כ- ns (P>0.05), * (P≤0.05), ** (P≤0.01), *** (P≤0.001) ו- **** (P≤0.0001).
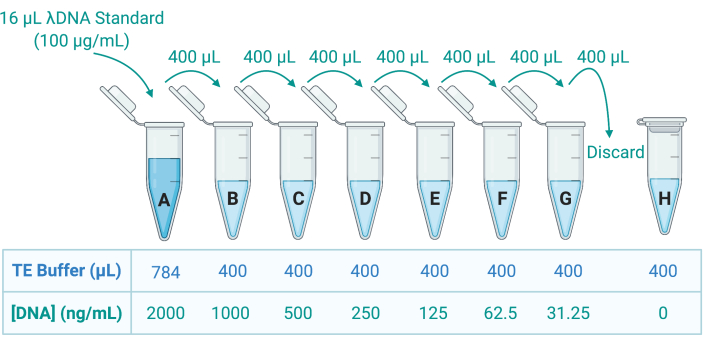
איור 5: הכנת שמונה תקני דנ"א ליצירת עקומה סטנדרטית. תמיסת מלאי של λDNA מסופקת ב 100 מיקרוגרם / מ"ל. זה מדולל פי 50 בחיץ TE כדי ליצור תקן A ב 2000 ng / mL; 400 μL של A מועבר לאחר מכן לצינור B, המכיל 400 μL TE buffer; 400 μL של B מועבר ומדולל פי 2 ב-C, וכך הלאה עד ש-G. תקן H מורכב ממאגר TE בלבד ולכן יש לו ריכוז DNA של 0 ng/mL. קיצור: TE = Tris-EDTA. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- הכנת פיגומים לצביעה היסטולוגית
הערה: פיגומים ניתנים לקיבוע ולצביעה למטרות מיקרוסקופיה והדמיה כפיגומים שלמים לאימונופלואורסנציה (IF) או כפרוסות משובצות פרפין קבועות פורמלין (FFPE) לצביעה היסטולוגית או אימונוהיסטוכימיה (IHC). זה מאפשר הערכה איכותית של חדירת תאים והפצה בתוך פיגומים וניתן להשתמש בהם כדי להעריך את הביטוי של חלבונים.- הכינו תמיסת 10% פרפורמלדהיד (PFA) ב-PBS. ודא שיש מספיק פתרון עבור נפח סופי של 500 μL לכל פיגום.
- חממו מראש תמיסה זו ב-37°C והוסיפו 500 μL לצינורות צנטריפוגות 2 מ"ל מסומנים לאחזור פיגומים.
- מוציאים את הפיגומים מלוחות 24 הקידוחים שאינם דבקים (שלב 4.4.4) ומניחים אותם במכסה המנוע של הזרימה הלמינרית.
- באמצעות פינצטה סטרילית, מעבירים את הפיגומים לצינורות הצנטריפוגות המסומנים המכילים 10% PFA. אפשר לפיגומים להתקבע בתמיסת PFA למשך 15 דקות. נטרל את ה- PFA על ידי הוספת PBS של 500 μL לכל צינור ואחסן ב- 4 ° C.
- כדי להכין את הפיגומים למעבד הרקמות האוטומטי, הסירו אותם מ-4°C והשתמשו בפינצטה כדי להניח אותם בקלטות פלסטיק עם כל הפרטים הרלוונטיים בעיפרון. מניחים את כל הקלטות במיכל המתכת של מעבד הרקמות.
- התחל את פרוטוקול 12 השלבים במעבד הרקמות כדי לתקן, לייבש, לנקות את הפיגומים ולהחדיר אותם עם פרפין למשך הלילה. אספו את הקלטות המכילות את הדגימות המעובדות.
- לאחר מכן, הטמיעו את הפיגומים בגושי שעוות פרפין כדי לאפשר מיקרוטומיה של הפיגומים לפרוסות דקות מאוד להכתמה.
הערה: חשוב במיוחד לקחת בחשבון את כיוון הפיגומים בעת הוצאתם מהקלטות והטמעתם בשעווה, שכן הדבר ישפיע על הזווית בה יצולמו התמונות. זה חשוב בעת הערכת חדירת תאים לתוך הפיגומים. - הפעל את הטמעת השעווה ואת הצלחת הקרה; הרימו את המכסה כדי לבדוק את גובה השעווה. מלאו מחדש במידת הצורך.
- בעבודה עם דגימה אחת בכל פעם, פותחים את הקלטת, מסירים את הפיגום ומרכזים אותו בתבנית הפלסטיק.
- יוצקים שעווה חמה על הדגימה, מבטיחים שמירה על כיוון נכון ומתאימים עם פינצטה חמה, במידת הצורך, לפני שהשעווה מתמצקת. יוצקים עוד שעווה כדי למלא את התבנית.
- מניחים את מכסה הקלטת המסומן על גבי תבנית הפלסטיק ומוסיפים שעווה מעל. מניחים את התבנית על צלחת קרה כדי למצק את השעווה. יש לאחסן למשך הלילה בטמפרטורה של 4°C כדי להבטיח ששעוות הפרפין תתמצק במלואה לפני המיקרוטומיה.
- כדי להתכונן למיקרוטומיה, הפעילו אמבט מים בטמפרטורה של 35 מעלות צלזיוס, את צלחת הייבוש ואת המיקרוטום.
- הכנס להב למחזיק והודק את הידית כדי לאבטח אותו.
- קבעו את עובי החיתוך והחתך, בדרך כלל 5 מ"מ לחלקי פיגומים.
- מוציאים את פיגום ה-FFPE מהתבנית, מאחסנים אותו במחזיק שבחזית המיקרוטום, וקוצצים בזהירות את עודפי השעווה סביב שולי הדגימה לפני חיתוך החתכים.
- התחילו לחתוך לתוך גוש השעווה על ידי סיבוב הידית של המיקרוטום, מה שמבטיח תנועה חלקה.
- אספו חלקים דמויי סרט, סביב 3 חלקי פיגומים בכל פעם, והניחו אותם בעדינות באמבט מים בטמפרטורה של 35 מעלות צלזיוס כדי להסיר קמטים. הפרידו בעדינות את החלקים באמבט המים באמצעות פינצטה.
- באמצעות מגלשות מיקרוסקופ זכוכית מצופות פוליזין, הרימו כל קטע מאמבט המים כך שהקטע ישב במרכז המגלשה. תייג כל שקופית בעיפרון.
- הניחו את מגלשות הזכוכית על צלחת הייבוש או בתנור ייבוש בטמפרטורה של 60°C. לאחר הייבוש, יש לאחסן אותם בטמפרטורה של 4°C ולהמשיך עם הכתם ההיסטולוגי או IHC הנדרש.
- שליפת פיגומים לניתוח ביטוי גנים
- מוציאים את הפיגומים מלוחות 24 הקידוחים שאינם דבקים מהאינקובטור (שלב 4.4.4) ומניחים אותם במכסה המנוע של הזרימה הלמינרית.
- באמצעות פינצטה סטרילית, מעבירים את הפיגומים לצינורות צנטריפוגות טריים מסומנים בנפח 2 מ"ל.
- במכסה אדים, יש להוסיף 1 מ"ל של מגיב ליזה תאי מבוסס פנול/גואנידין לכל צינור כדי לשכב את התאים בפיגומים ולאפשר התאוששות של RNA באיכות גבוהה.
- יש לאחסן את הצינורות בטמפרטורה של -20°C עד שהם מוכנים לביצוע מיצוי RNA באמצעות ערכה מתאימה. באמצעות תגובת שרשרת כמותית סטנדרטית של פולימראז בשעתוק לאחור (RT-qPCR)17, יש להעריך את ביטוי הגנים בתאים בפיגומים.
תוצאות
למודל הפיגום מבוסס הקולגן המתואר כאן יש יישומים רבים, החל מלימוד ביולוגיה של נוירובלסטומה ועד לסינון של טיפולים אנטי-סרטניים בסביבה הדומה יותר מבחינה פיזיולוגית לגידולים מקומיים מאשר תרבית תאים דו-ממדית קונבנציונלית. לפני בדיקת שאלת מחקר נתונה, חיוני לקבל אפיון מלא של התקשרות תאים, התרבות וחדירה במסגרת הזמן הרצויה לניסוי. תנאי הגידול יהיו תלויים בביולוגיה של כל קו תאים ספציפי. חשוב לציין, יש ליישם מספר שיטות להערכת צמיחת תאים כדי לקבוע תנאים אופטימליים וביצועים חזקים.
כאן, הכדאיות של תאי נוירובלסטומה שגדלו על פיגומים הוערכה באמצעות בדיקת כדאיות תאים קולורימטריים. ניתן לבצע בדיקה זו בתדירות הרצויה לאורך פרק הזמן של הניסוי. עבור הניסוי המתואר, הערכת כדאיות התא בוצעה בימים 1, 7 ו-14 עבור שני קווי תאי נוירובלסטומה, KellyLuc ו-IMR32, שגדלו על פיגומים מסוג Coll-I-nHA ב-4 צפיפויות שונות (איור 6). הכדאיות ביום הראשון נקבעה כבסיס להשוואה בין כל המדידות הבאות. קצב ההפחתה של מגיב הכדאיות התאית משקף את הביולוגיה של התא ואת מאפייני הצמיחה של קווי תאים בודדים, כולל קצב ההתרבות שלהם וחילוף החומרים שלהם. היה צפוי מתאם בין מספר התאים שנזרעו על הפיגומים לבין רמת החיזור. בניסוי זה, ההפחתה של מגיב הכדאיות התאית גדלה בדרך כלל עם כל נקודת זמן עבור שני קווי התא בכל הצפיפויות, כצפוי.
לאחר מכן כל צפיפות הוערכה בנפרד עבור שני קווי התאים כדי להשוות את ההפחתה על פני נקודות זמן. ANOVA חד-כיווני עם מבחן ההשוואות המרובות של Tukey בוצע כדי לזהות הבדלים משמעותיים בהפחתה בין נקודות זמן (איור 7). הן עבור קווי התאים והן עבור כל צפיפויות הזריעה, חלה עלייה משמעותית (P<0.05) בהפחתת מגיב הכדאיות התאית בהשוואה בין יום 1 ליום 14. זה הצביע על עלייה משמעותית בתאים פעילים מטבולית הנמצאים על הפיגומים. עלייה זו לא הייתה משמעותית בכל המקרים בעת הערכת מרווחי 7 הימים (יום 1 לעומת יום 7, יום 7 לעומת יום 14), מה שמדגים את חשיבות האופטימיזציה של צפיפות הזריעה להשגת חלון הצמיחה הרצוי.
כדי לתמוך בתוצאות של בדיקת כדאיות התא, גדילת תאים על פיגומים יכולה גם להימדד בעקיפין באמצעות כימות של dsDNA המופק מפיגומים באמצעות כתם dsDNA פלואורסצנטי (איור 8A). בדומה לכדאיות התא, ניתן לכמת את הדנ"א בתדירות הרצויה בתוך ציר הזמן של הניסוי. עם זאת, ניתוח זה דורש שליפה מלאה של פיגומים והפסקת גדילת תאים ולכן יש לקחת בחשבון בתכנון ניסויי כפי שנדון בסעיף 1. עבור ניסוי זה, דנ"א כומת בימים 1, 7 ו-14 עבור שני קווי תאי נוירובלסטומה, KellyLuc ו-IMR32, שגודלו על פיגומים מסוג Coll-I-nHA ב-4 צפיפויות שונות. מאחר שהריכוז הממוצע של dsDNA לתא ידוע עבור קווי התאים האלה, אפשר היה לגזור את מספר התאים לדגימה מהדנ"א המכומת (איור 8B).
כימות הדנ"א הוליד שונות גבוהה יותר בין שכפולים ביולוגיים מאשר הערכת כדאיות התא, אך בדרך כלל גדל עבור כל נקודת זמן, כאשר הרמות הגבוהות ביותר כומתו ביום ה-14. נראה כי תאי IMR32 מגיעים למספרי תאים גבוהים יותר על פיגומים מסוג Coll-I-nHA, כפי שמצוין על ידי ריכוז הדנ"א, מאשר תאי KellyLuc. לאחר מכן כל צפיפות הוערכה בנפרד עבור שני קווי התאים כדי להשוות את ההפחתה על פני נקודות זמן. מבחן ANOVA חד-כיווני עם מבחן השוואות מרובות של Tukey בוצע כדי לזהות הבדלים משמעותיים בהפחתה בין נקודות זמן (איור 8B).
הן עבור קווי התאים והן עבור כל צפיפויות הזריעה, חלה עלייה משמעותית (P<0.05) במספר התאים בהשוואה בין יום 1 ליום 14, למעט KellyLuc בצפיפות הזריעה 4 (1 ×10 5 תאים / פיגום), שלא הניבה עליות משמעותיות באף אחת מנקודות הזמן. בדומה לתוצאות כדאיות התא, העליות לא היו מובהקות בכל המקרים בעת הערכת מרווחי 7 הימים (יום 1 לעומת יום 7, יום 7 לעומת יום 14). כאשר השוו את מגמות נקודת הזמן עבור כדאיות התא וכימות הדנ"א, היו כמה הבדלים קלים בין שני הניתוחים. עם זאת, בסך הכל נצפו מגמות דומות, כאשר הערכים הממוצעים עלו בין מרווחים של 7 ימים עבור רוב הצפיפויות. זה מדגים את החשיבות של ניטור צמיחת תאים באמצעות יותר משיטה אחת.
לאחר מכן בוצעה הערכה חזותית של מורפולוגיה של צמיחת תאים ופיזור על הפיגומים, שכללה צביעה מסורתית של המטוקסילין ואאוזין (H&E) וכן IHC. צפוי כי דפוסי הגידול השונים של קווי תאים בודדים יובילו לסידורים מרחביים מגוונים על הפיגומים, כולל דרגות חדירה שונות לפיגום וקיבוץ תאים. פיגומים היו קבועים פורמלין, משובצים פרפין ונחתכו לחתכים של 5 מ"מ (איור 9A), מה שהכין את הפיגומים לטכניקות הדמיה מרובות, כולל צביעה היסטולוגית ו-IHC.
צביעת H&E שגרתית יושמה על תאי Kelly, KellyCis83 ו-IMR32 שגדלו על פיגומים מבוססי קולגן בימים 1, 7 ו-14 (איור 9B). זה איפשר הדמיה של האוריינטציה המרחבית של התאים על שני פיגומים מבוססי קולגן במשך תקופה של 14 יום. תאי Kelly רגישים לציספלטין ותאי KellyCis83 עמידים גדלו על שני פיגומים מסוג Coll-I-nHA (איור 9B, i) ועל פיגומים מסוג Coll-I-GAG (איור 9B, ii). בהתאם לנתונים שפורסמו בעבר, תאי KellyCis83 גדלו בקצב גבוה יותר וחדרו עמוק יותר לשני הרכבי הפיגומים מאשר לקו תאי קלי הפחות פולשניים. כתם H&E של קו תאי נוירובלסטומה אחר, IMR32, שגדל על Coll-I-nHA מדגים דפוס גדילה מנוגד (איור 9B, iii). קו תאים זה גדל בצבירים גדולים וצפופים על פיגומי הקולגן במהלך 14 הימים. ניתן להשתמש במיקרוסקופ קונפוקלי של ברייטפילד כדי להמחיש את הארכיטקטורה הנקבובית של פיגומים מבוססי קולגן (איור 9C) הודות לאוטופלואורסצנטיות של סיבי קולגן.
צבענו תאים באמצעות פלואדין המכוון לאקטין ציטו-שלד וכתם הנגד הגרעיני, 4′,6-diamidino-2-phenylindole (DAPI), כדי לעקוב אחר תכונות תאים ספציפיות לאורך ציר הזמן של הניסוי. שפע של אקטין נצפה בתאי Kelly ו-KellyCis83 על פיגומים מסוג Coll-I-GAG באמצעות השיטה הזו (איור 9D). תוצאות אלה מדגימות כיצד ניתן להשתמש בטכניקות הדמיה מרובות כדי להפיק מידע מפוענח מרחבית מתאי נוירובלסטומה הגדלים על פיגומים באמצעות פרוטוקול זה. אפיון זה של דפוסי גדילת תאים על פיגומים מבוססי קולגן במשך תקופה נתונה ישפר את ההבנה והפרשנות של כל בדיקה ביוכימית במורד הזרם.
ניתן לנתח את ביטוי החלבונים על ידי תאים הגדלים על פיגומים מבוססי קולגן כדי להשוות את הפעילות התאית לתרחישי in vivo . נתונים שפורסמו בעבר בחנו את הביטוי של כרומוגרנין A (CgA) כסמן חלופי המופרש של נוירובלסטומה על ידי תאי KellyLuc ו-KellyCis83Luc שגדלו בחד-שכבות של תאים, כמו גם על פיגומים Coll-I-nHA ו-Coll-I-GAG (איור 10). CgA הוערך במדיה המותנית באמצעות בדיקת אימונוסורבנט מקושרת אנזימים (ELISA) (איור 10A). CgA מופרש בשיעור גבוה יותר בקו התאים KellyCis83 העמיד יותר לכימותרפיה מאשר בקלי (איור 10B,C). זה היה משמעותי ביום השביעי הן על פיגומים Coll-I-GAG והן על פיגומים Coll-I-nHA (P<0.05), בעוד שלא היה הבדל משמעותי בנקודת זמן זו עבור תאים שגודלו כשכבה אחת על ידי תרבית דו-ממדית קונבנציונלית.
תוצאות אלה גם מדגישות את ציר הזמן הניסויי המוגבל בעת גידול תאים בשכבה אחת, כאשר רק 7 ימים של צמיחה הוכיחו את עצמם כאפשריים לפני שהתאים מגיעים למפגש. גדילת התאים על פיגומים מתגברת על מגבלה זו מכיוון שהם יכולים להישמר לאורך תקופה ארוכה יותר בתנאים רלוונטיים יותר מבחינה פיזיולוגית. השילוב לעיל של טכניקות לרכישת מידע על כדאיות התא, תוכן DNA, מורפולוגיה תאית וסידור מרחבי, ופרופילי ביטוי מאפשר להעריך את הצמיחה של תאי נוירובלסטומה על מגוון של פיגומים מבוססי קולגן. פרוטוקול זה יכול גם להיות מותאם בקלות כדי לספק דרישות ניסוי ספציפיות ויישומים רצויים.
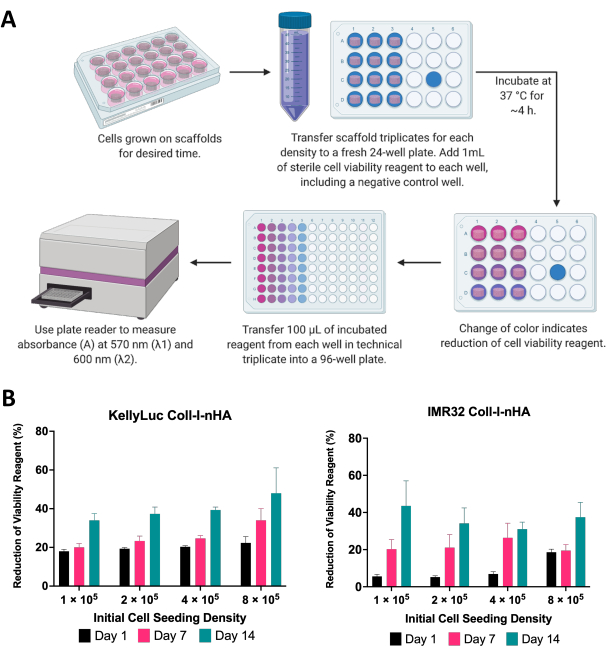
איור 6: ניתוח כדאיות תאים. (A) הליך כללי למדידת הכדאיות של תאי נוירובלסטומה על פיגומים מבוססי קולגן באמצעות בדיקת כדאיות תאים קולורימטריים. תקופת הדגירה חייבת להיות מותאמת לכל קו תאים חדש, תוך התייחסות להנחיות היצרן. (B) הפחתה באחוזים של מגיב כדאיות התא על ידי תאי KellyLuc ו-IMR32 שגדלו על פיגומים מסוג Coll-I-nHA בארבע צפיפויות זריעה התחלתיות שונות, שנמדדו בימים 1, 7 ו-14. הדגימות הוערכו במשולש ביולוגי עם פסי שגיאה המייצגים את סטיית התקן. קיצורים: nHA = nanohydroxyapatite; Coll-I-nHA = פיגומי קולגן בתוספת nHA. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
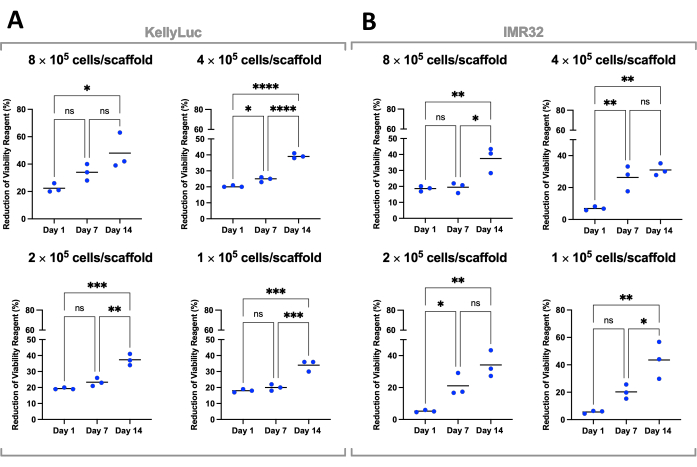
איור 7: כדאיות תאים על-ידי צפיפות זריעה של תאים שגדלו ב-Coll-I-nHA במשך תקופה של 14 יום. (א) קלילוק; (ב) IMR32. מספרי תאים שכותרתם מתייחסים לצפיפות זריעת התאים הראשונית על הפיגומים ביום 0. הדגימות הוערכו במשולש ביולוגי, המסומן על ידי נקודות משולשות, עם עמודות המייצגות את הממוצע. ANOVA חד-כיווני עם השוואות מרובות שימש לזיהוי הבדלים משמעותיים בהפחתת מגיב כדאיות התא % על פני שלוש נקודות הזמן, שצוין בגרפים (ns P > 0.05, * P ≤ 0.05, ** P ≤ 0.01, *** P ≤ 0.001, **** P ≤ 0.0001). קיצורים: nHA = nanohydroxyapatite; Coll-I-nHA = פיגומי קולגן בתוספת nHA; ANOVA = ניתוח שונות; ns = לא משמעותי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
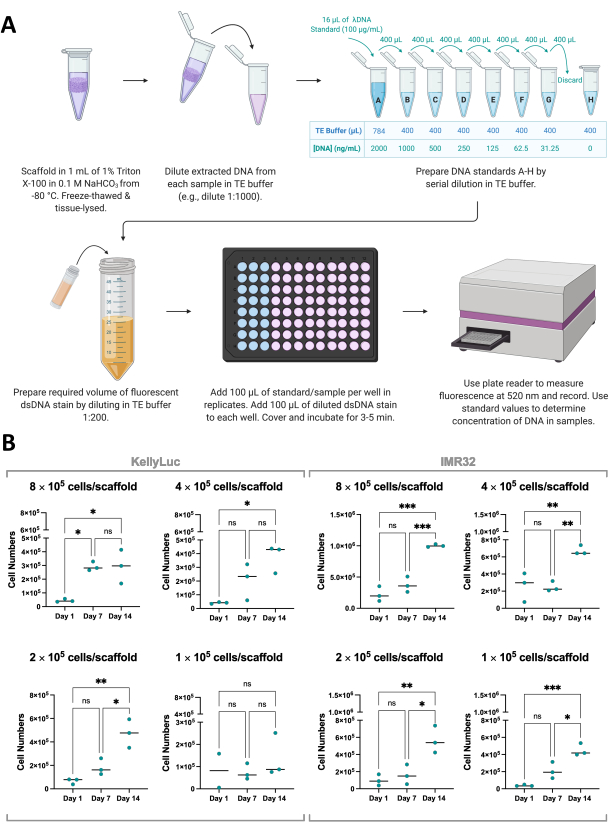
איור 8: כימות דנ"א המופק מתאים בפיגומים. (A) תהליך של כימות dsDNA מתאים שגדלו על פיגומים מבוססי קולגן באמצעות כתם dsDNA פלואורסצנטי. (B) מספרי תאים מניתוח כימות דנ"א על ידי צפיפות זריעה עבור תאי KellyLuc ו-IMR32 שגדלו ב-Coll-I-nHA במשך תקופה של 14 יום. מספרי תאים שכותרתם מתייחסים לצפיפות הזריעה הראשונית של תאים על פיגומים ביום 0. הדגימות הוערכו במשולש ביולוגי, המסומן על ידי נקודות משולשות, עם עמודות המייצגות את הממוצע. ANOVA חד-כיווני עם השוואות מרובות שימש לזיהוי הבדלים משמעותיים במספר התאים על פני שלוש נקודות הזמן, שצוינו בגרפים (ns P > 0.05, * P ≤ 0.05, ** P ≤ 0.01, *** P ≤ 0.001, **** P ≤ 0.0001). קיצורים: nHA = nanohydroxyapatite; Coll-I-nHA = פיגומי קולגן בתוספת nHA; dsDNA = DNA דו-גדילי; TE = Tris-EDTA; ANOVA = ניתוח שונות; ns = לא משמעותי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
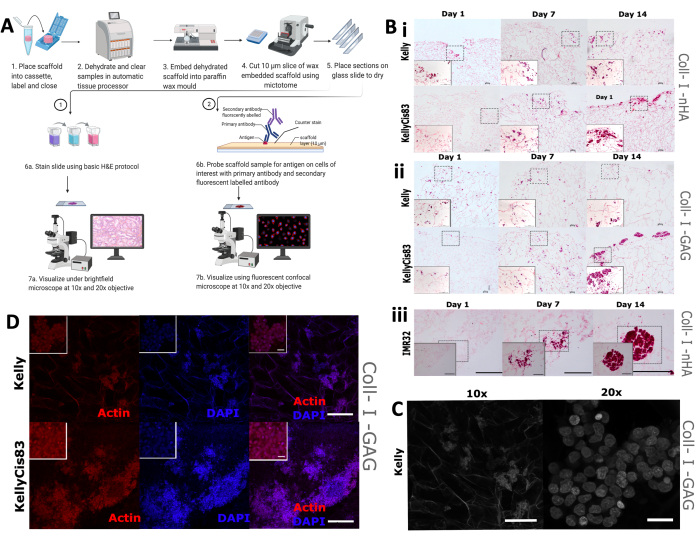
איור 9: שלבי עיבוד רקמות לניתוח אימונוהיסטוכימי של פיגומים. (A) ייצוג סכמטי של פרוטוקול עיבוד פיגומים לניתוח תמונה. תהליך זה מאפשר צביעה היסטולוגית שגרתית וחיטוט נוגדנים ספציפיים באמצעות נוגדנים ראשוניים ונוגדנים משניים המסומנים באופן פלואורסצנטי. (B) תמונות מייצגות של שלושה קווי תאי נוירובלסטומה הנתונים לצביעת H&E. תמונות H&E מצולמות בימים 1, 7, 14 כדי לעקוב אחר דפוסי גדילה במהלך הזמן של הניסוי. סרגל קנה מידה = 200 מיקרומטר. ריבועים מקווקווים מייצגים את האזור שנבחר לתמונות מוגדלות של 20x בקצה השמאלי התחתון. סרגל קנה מידה = 20 מיקרומטר. (i ו-ii) H&E של קווי תאי נוירובלסטומה של Kelly ו-KellyCis83 (פאנלים עליונים ותחתונים, בהתאמה) על שני סוגים של פיגומים מבוססי קולגן. (iii) H&E של קו תאי IMR32, המייצג גידול תאי מקובץ על פיגום Coll-I-nHA. (C) תמונה מייצגת של קו תאי קלי, נתון למיקרוסקופ קונפוקלי בשדה בהיר. הקולגן autofluorescence מאפשר הדמיה של פיגום נקבובי. 10x סרגל קנה מידה = 200 מיקרומטר, סרגל קנה מידה 20x = 20 מיקרומטר. (D) תמונה מייצגת של פיגומים משובצים ואחריה ניתוח על ידי IHC עם פאלואדין ו- DAPI בהגדלה של פי 10, סרגל קנה מידה = 200 מיקרומטר. ריבועים פנימיים קטנים יותר מייצגים תמונות מוגדלות (20x), סרגל קנה מידה = 20 מיקרומטר. קיצורים: nHA = nanohydroxyapatite; Coll-I-nHA = פיגומי קולגן בתוספת nHA; GAG = גליקוזאמינוגליקן; Coll-I-GAG = פיגומי קולגן בתוספת כונדרויטין-6-סולפט; H&E = hematoxylin ו eosin; IHC = אימונוהיסטוכימיה; DAPI = 4′,6-diamidino-2-phenylindole. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
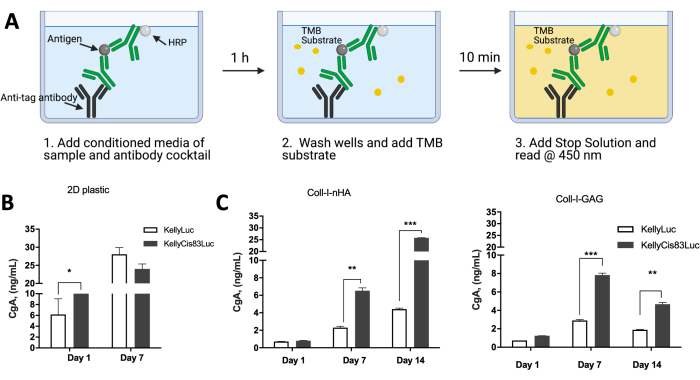
איור 10: ביטוי חלבונים על-ידי תאי נוירובלסטומה שגדלו על פיגומים תלת-ממדיים מבוססי קולגן בהשוואה לפלסטיק דו-ממדי. (A) סכמה של האופן שבו CgA ELISA בוצע על מדיה מותנית של תאים שגדלו על פלסטיק דו-ממדי או פיגומים תלת-ממדיים מבוססי קולגן. (B) רמות ביטוי חלבון CgA שנלקחו ממדיה מותנית של תאים שגדלו על חד-שכבה פלסטית דו-ממדית. כאשר התאים הגיעו למפגש לאחר 7 ימים, נקודת הזמן של 14 יום לא הייתה קריאה. ביום השביעי על פלסטיק, לא היה הבדל משמעותי ברמות CgA בין קווי התאים Kelly ו-KellyCis83. (C) CgA ELISA מבוצע באמצעות מדיה מותנית של תאים הגדלים על פיגומים מבוססי קולגן במשך 14 ימים רצופים. ביום השביעי, על שני פיגומי הקולגן, רמות CgA גבוהות יותר בקו התאים האגרסיבי יותר של KellyCis83, מה שמדגיש רמות רלוונטיות פיזיולוגיות יותר של CgA במטריצה תלת-ממדית בהשוואה לחד-שכבה דו-ממדית. נתון זה שונה מ- Curtin et al.17. קיצורים: תלת מימד = תלת מימדי; 2D = דו מימדי; CgA = כרומוגרנין A; ELISA = מבחן immunosorbent מקושר אנזים; nHA = nanohydroxyapatite; Coll-I-nHA = פיגומי קולגן בתוספת nHA; GAG = גליקוזאמינוגליקן; Coll-I-GAG = פיגומי קולגן בתוספת כונדרויטין-6-סולפט; TMB = 3,3',5,5'-tetramethylbenzidine; HRP = חזרת peroxidase. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מודל התא התלת-ממדי של פיגומים סרטניים הוכח ככלי רב ערך ורב-תכליתי להשגת תובנה מכניסטית לגבי גדילת תאי נוירובלסטומה, כדאיות וחדירה של תאים ב-TME32 פשוט. מודל הנוירובלסטומה התלת-ממדי המתואר כאן מחקה את ה-TME המינימלי ומספק נתונים רלוונטיים יותר מבחינה פיזיולוגית מאשר תרבית חד-שכבתית דו-ממדית. החיסרון העיקרי של תרבית תאים תלת-ממדית הוא מורכבות ניסויית מוגברת ומסגרות זמן ארוכות יותר. מתואר כאן פרוטוקול אופטימלי לזריעה, גדילה ותחזוקה של תאי נוירובלסטומה על פיגומים מבוססי קולגן, ואחריו ניתוחים ויישומים במורד הזרם, המניבים אפיון חזק של גדילת תאים. מטרתנו הייתה לקבל תובנות לגבי צפיפות זריעת התאים האופטימלית עבור הפיגומים, כדי ליצור סביבה צפויה וניתנת לשליטה להערכת טיפולים תרופתיים נגד סרטן בחלון ניסוי מהיר של 14 יום. השילוב של כל הפרוטוקולים הפשוטים המתוארים הללו מספק הערכה מקיפה היטב של צמיחת תאי נוירובלסטומה במערכת תרבית חוץ גופית מבוססת פיגומים.
הנקודות הקריטיות במערך הפרוטוקול הודגשו כדי לאפשר למדענים לבסס את אותו הדבר במעבדותיהם במהירות. לדוגמה, זמני הדגירה המצוינים לביצועים טובים יותר של בדיקת הכדאיות של התא הקולורימטרי מאפשרים חדירה עמוקה יותר של מגיב לתוך נקבוביות הפיגום כדי להגיע לכל התאים. יתר על כן, טכניקת צביעת dsDNA פלואורסצנטית היא חזקה ופשוטה; עם זאת, שחרור DNA מהפיגומים דורש ליזה תאית נמרצת מכיוון שהתאים "נלכדים" בתוך סיבי קולגן.
באמצעות בדיקת כימות הדנ"א הפשוטה שתוארה, אנו יכולים לזהות את שלב צמיחת היומן על פיגומים מבוססי קולגן לבדיקת תרופות אנטי-סרטניות באמצעות מודל זה. במסגרת הניסוי המתוארת, נעשה שימוש ב-4 צפיפויות ראשוניות של זריעת תאים עם תקופה כוללת של 14 יום ונקודות זמן לניתוח בימים 1, 7 ו-14. זיהינו שלתאי KellyLuc שנזרעו ב-4 × 105 תאים/פיגומים יש את חלון ההתרבות הפעיל המשמעותי ביותר בין ימים 7 ל-14. נתוני גידול שלב יומן זה יאפשרו פרשנות אמינה של ניסויים ציטוטוקסיים שונים בתאים. זה מבטל ספקולציות על כל ירידה בגדילה או מוות תאי כתוצאה מגידול מדוכא על פלטפורמת הנקבוביות התלת-ממדית ולא מרעילות סמים. כדאיות התא היא גם הערכה בשימוש נרחב עבור ההתאמה של פלטפורמות 3D כדי לתמוך בצמיחה של סוגי תאים שונים33,34. בעוד שישנן בדיקות רבות למדידת כדאיות התא, כולל צביעה חיה/מתה, מדידת ATP, מבחני התפשטות, מצאנו שהשימוש בבדיקת הכדאיות של התא הצבעוני הכחול של אלמר הוא טכניקה פשוטה ויעילה לתמיכה בנתוני כימות DNA.
השימוש המשולב בכימות DNA ויכולת קיום התא סיפק ראיות משלימות לכך שבממוצע, הצפיפות האופטימלית לזרע תאים על הפיגום כדי להשיג צמיחה מתמשכת על פני תקופה של 14 יום היא 2-4 × 105 תאים / פיגום. עם זאת, פרוטוקול זה יכול בקלות להיות מותאם כדי לספק מסגרות זמן ניסיוני שונות, נקודות זמן ניתוח, ויישומים במורד הזרם. למרות שפרוטוקול זה מתאר את הערכת צמיחת תאי המונוקולטורה של תאי נוירובלסטומה על פיגומים, הפיגומים ניתנים לשינוי בקלות לשימוש כפלטפורמה לתרבית משותפת, שתוארה על ידי אמרל ואחרים, שהשתמשו בפיגומי קולגן-GAG לתרבית משותפת של קרטינוציטים ופיברובלסטים בחקירה של ריפוי פצעים35.
המודל התלת-ממדי המתואר מאפשר הדמיה של גדילת תאים וחדירה באמצעות טכניקות מוכרות שונות, כגון אימונופלואורסנציה ו-H&E סטנדרטי. חשוב לדמיין את התאים יחד עם אפיון הצמיחה באמצעות בדיקות ביוכימיות בשל מגוון המורפולוגיה של התא ודפוסי הצמיחה על פיגומים. הבנת דפוס הגידול יכולה להניב תובנות לגבי התנהגות גדילה ותגובה עתידית לתרופות נגד סרטן. לדוגמה, גידול IMR32 באמצעות כימות דנ"א מניב דפוסים דומים לקלי, אם כי בהדמיה באמצעות H&E, IMR32 גדל בצבירים גדולים יותר מאשר קלי, שהציג צמיחה מפוזרת יותר (איור 9). דפוסי גידול מגוונים אלה של קווי תאים בפיגומים משקפים את התרחיש הקליני של הטרוגניות הגידול. בחינת התגובה לתרופות אנטי-סרטניות באמצעות פאנל של קווי תאים בעלי מורפולוגיות שונות בפיגומים תלת-ממדיים תגדיל את ערך הניבוי של תגובת המטופל לאותן תרופות.
זיהוי ביטוי גנים או חלבונים יכול להתבצע גם באמצעות גישות אחרות כגון RT-qPCR או ELISA אם החלבון המעניין מופרש. סמן חלופי של התקדמות נוירובלסטומה, כרומוגרנין A (CgA)36, שימש בנוסף לאפיון צמיחת תאי נוירובלסטומה בתלת-ממד. כפי שתואר בעבודה קודמת17, הפרשת CgA גדלה ככל שהתאים התרבו (איור 10). בעוד שתרבית תאים חד-שכבתית לא יכלה ללכוד עלייה זו, מכיוון שמשמעות ההתרבות הייתה שהתאים הגיעו למפגש מלא בצלחות התרבית, השימוש בפיגומי הקולגן התלת-ממדיים איפשר הערכה ממושכת של הפרשת CgA.
מודל תלת-ממדי זה במבחנה עשוי שלא להתאים לכל שאלות המחקר לחקר נוירובלסטומה, ביולוגיה ותגובה לטיפולים. אחת המגבלות היא חדירה לא אחידה של תאים בתוך פיגומים והיווצרות צבירי תאים בגדלים שונים, התלויה בקו תאים נתון ועלולה להוביל לדיפוזיה בלתי נשלטת של חומרי מזון ותרופות בדיקה. תכונה זו משפיעה על החוסן בסינון הטיפולי. עם זאת, למרות מגבלה זו, חשוב לקחת בחשבון כי גידולים מקומיים הם גם הטרוגניים בגודל ובפיזור תאים סרטניים ומכילים סוגי תאים רבים אחרים בתוך רקמת הגידול. כדי להתגבר על מגבלה זו, אנו מציעים להשתמש בכל פיגום המאוכלס בתאים כמיקרו-רקמה אחת שעבורה יותאמו הפרמטרים הבאים: (א) זמני הדגירה של מגיב יכולת הקיום של התא להגיע לתאים ולצברי התא, ו-(ב) שכיבה של התאים במאגר טריטון X-100 על ידי עיבוד מקדים של תאים על פיגומים עם לייזר רקמות כדי לשחרר את הדנ"א של התאים שנמצאים עמוק בתוך הפיגומים.
מגבלה טכנית נוספת של פרוטוקול זה היא היעדר בדיקות מכניות של כל אצווה של פיגומים שיוצרו לאחרונה עבור דגם זה. עם זאת, שימוש בתהליך הייצור החזק של הפיגומים, אשר אופיינו בהרחבה ביחס לתכונות פיזיקליות וכימיות של הפיגומים, כגון מודולוס דחיסה ומתיחה, נקבוביות ומבנה נקבוביות חזותי, והומוגניות, מבטיח כי איכויות הפיגום נשמרות באמצעות אצוות 21,24,27,30,37.
לסיכום, מאמר זה מציג סדרה של שיטות פשוטות לניתוח גדילת תאים על פיגומים מבוססי קולגן. ניתן להחליף הן את ציר הזמן הניסויי והן את נקודות הניתוח בהתאם לשאלות המחקר הספציפיות. פרוטוקול זה ניתן להתאמה גם לסוגי תאים אחרים. התוצאות המוצגות לעיל מספקות ראיות כיצד אוסף זה של שיטות נתן תובנה לגבי צפיפות הזריעה האופטימלית עבור שורות תאי נוירובלסטומה שונים כדי ליצור צמיחה מתמשכת במשך 14 ימים. שילוב התוצאות המתקבלות מכל השיטות בפרוטוקול זה מניב הבנה מעולה של גדילת תאים בתוך מטריצת הקולגן התלת-ממדית. שימוש עתידי במודל זה יכלול ככל הנראה מערכות תרבות משותפת ספציפיות לנוירובלסטומה TME ובדיקות של תרופות אנטי-סרטניות חדשניות שונות.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי המרכז הלאומי לחקר ילדים (NCRC), מועצת המחקר האירית (IRC) ונוירובלסטומה בריטניה. האיורים נוצרו באמצעות BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| Cells | |||
| IMR-32 | ATCC | CCL-127 | |
| Kelly | ECACC | 82110411 | |
| KellyCis83 | Made in lab – derived from Kelly (Piskareva et al., 2015) | - | Increasing exposure to cisplatin. Cross resistance acquired |
| SH-SY5Y | ATCC | CRL-2266 | |
| Disposable | |||
| 0.22 µm syringe filter | Millex | SLHP033RS | |
| 1.5 mL Eppendorf tube | Eppendorf | 0030 120.086 | |
| 100 mL sterile Pot | Starstedt | - | |
| 10 mL plastic pipette | Cellstar | 607 180 | |
| 15 mL Falcon tube | Starstedt | 62.554.502 | |
| 25 mL plastic pipette | Cellstar | 760 180 | |
| 50 mL Falcon tube | Starstedt | 62.547.254 | |
| 5 mL plastic pipette | Cellstar | 606 180 | |
| 6 mm Biopsy punches | Kai Medical | BP-60F | |
| Aluminium foil | - | - | |
| Cover Slip | Menzel-Glaser | - | |
| HYPERflask | Corning | CLS10030 | |
| Microscope slides | Thermo Scientific | J1840AMNT | |
| Opaque black 96-well plate | Costar | 3915 | |
| Sterile P10 tips | Starlab | S1121-3810 | |
| Sterile P1000 tips | Starlab | S1122-1830 | |
| Sterile P20 tips | Starlab | S1123-1810 | |
| Sterile P200 tips | Starlab | S1120-8810 | |
| T-175 (175 cm2 flask) | Sarstedt | 83.3912 | |
| T-75 (75 cm2 flask) | Sarstedt | 83.3911.302 | |
| Translucent clear 96 well plate | Cellstar | 655180 | |
| Translucent non-adherent 24 well plates | Cellstar | 83.3922.500 | |
| Equipment | |||
| Autoclave | Astell | - | |
| Automatic tissue processor | Leica | TP1020 | |
| Centrifuge 5804 | Eppendorf | - | |
| Hemocytometer | Hausser Scientific | - | |
| Incubator | ThermoScientific | - | |
| Microtome | Leica | RM2255 | |
| Oven | Memmert | Calibrated by: Cruinn diagnostics Ltd | |
| P10 pipette | Gilson | ||
| P100 pipette | Gilson | ||
| P1000 pipette | Gilson | ||
| P20 pipette | Gilson | Calibrated by: Cruinn diagnostics Ltd | |
| P200 pipette | Gilson | Calibrated by: Cruinn diagnostics Ltd | |
| Paraffin section flotation bath | Electrothermal | MH8517 | Calibrated by: Cruinn diagnostics Ltd |
| Pipette electronic dispenser | Corning | StripipetterUltra | Calibrated by: Cruinn diagnostics Ltd |
| Plate cooler | Leica | EG1140C | Calibrated by: Cruinn diagnostics Ltd |
| Refrigerator -20 °C | Liebherr | - | |
| Refrigerator -80 °C | Liebherr | - | |
| Refrigerator 4 °C | Liebherr | - | |
| Seesaw Rocker | DLAb | SK-D1807-E | |
| Spectrophotometer – Victor3V Platereader | PerkinElmer | 1420 | |
| Tissue culture hood/Laminar flow hood | GMI | 8038-30-1044 | |
| Tissue Lyser | Qiagen | TissueLyser LT | |
| Tweezers | - | - | |
| Water bath | Grant | - | |
| Wax embedder | Leica | EG1140H | |
| Materials | |||
| 1 L Water | Adrona - Biosciences | 568 | |
| 1% Triton-X | Sigma Aldrich | 9002-93-1 | |
| 10x PBS tablets | Sigma Aldrich | P4417-100TAB | |
| 37% paraformaldehyde | Sigma-Aldrich | F8775 | |
| Alamar Blue Cell Viability Reagent | Invitrogen | DAL1100 | |
| Collagen- glycosaminoglycan scaffold | Tissue engineering research group (TERG) | ||
| Collagen-nanohydroxyapatite scaffold | Tissue engineering research group (TERG) | ||
| dH20 | Adrona - Biosciences | 568 | |
| Eosin | Sigma-Aldrich | E4009 | Made as per: (Cunniffe et al., 2010, Fitzgerald et al., 2015; O’Brien et al., 2005) |
| EtOH | Sigma-Aldrich | 1.00983.2500 | Made as per: (Cunniffe et al., 2010, Fitzgerald et al., 2015; O’Brien et al., 2005) |
| F12 | Gibco | 21765-029 | |
| FBS | Gibco | 10270-106 | |
| Hemaytoxylin | Sigma-Aldrich | HHS32-1L | |
| L-Glutamine | Gibco | 25030-024 | |
| MEM | Gibco | 21090-022 | |
| miRNA easy Kit | Qiagen | 217004 | |
| MNEAA’s | Gibco | 11140-035 | |
| Penicillin/streptomycin | Gibco | 015140-122 | |
| Qiazol | Qiagen | 79306 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| RPMI | Gibco | 21875-034 | |
| Sodium bicarbonate | Sigma Aldrich | S7795-500G | |
| Tissue embedding Medium | Sigma | A6330-4LB | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| Software | |||
| Excel | - | Excel 2016 | |
| ImageJ | - | - | |
| Prism | - | Version 9 |
References
- Davidoff, A. M. Neuroblastoma. Seminars in Pediatric Surgery. 21 (1), 2-14 (2012).
- Matthay, K. K., et al. Neuroblastoma. Nature Reviews Disease Primers. 2, 16078 (2016).
- Costard, L. S., Hosn, R. R., Ramanayake, H., O'Brien, F. J., Curtin, C. M. Influences of the 3D microenvironment on cancer cell behaviour and treatment responsiveness: a recent update on lung, breast and prostate cancer models. Acta Biomaterialia. , (2021).
- Borriello, L., Seeger, R. C., Asgharzadeh, S., Declerck, Y. A. More than the genes, the tumor microenvironment in neuroblastoma. Cancer Letters. 380 (1), 304-318 (2016).
- Walker, C., Mojares, E., Del Río Hernández, A. Role of extracellular matrix in development and cancer progression. International Journal of Molecular Sciences. 19 (10), 3028 (2018).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Schultz, G. S., Davidson, J. M., Kirsner, R. S., Bornstein, P., Herman, I. M. Dynamic reciprocity in the wound microenvironment. Wound Repair and Regeneration. 19 (2), 134-148 (2011).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Provenzano, P. P., et al. Collagen density promotes mammary tumor initiation and progression. BMC Medicine. 6, 11 (2008).
- Provenzano, P. P., et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Medicine. 4, 38 (2006).
- Ouellette, J. N., et al. Navigating the collagen jungle: The biomedical potential of fiber organization in cancer. Bioengineering. 8 (2), 1-19 (2021).
- Kreger, S. T., Voytik-Harbin, S. L. Hyaluronan concentration within a 3D collagen matrix modulates matrix viscoelasticity, but not fibroblast response. Matrix Biology. 28 (6), 336-346 (2009).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hume, R. D., et al. Tumour cell invasiveness and response to chemotherapeutics in adipocyte invested 3D engineered anisotropic collagen scaffolds. Scientific Reports. 8 (1), 12658 (2018).
- Fitzgerald, K. A., et al. The use of collagen-based scaffolds to simulate prostate cancer bone metastases with potential for evaluating delivery of nanoparticulate gene therapeutics. Biomaterials. 66, 53-66 (2015).
- Sapudom, J., Pompe, T. Biomimetic tumor microenvironments based on collagen matrices. Biomaterials Science. 6 (8), 2009-2024 (2018).
- Curtin, C., et al. A physiologically relevant 3D collagen-based scaffold-neuroblastoma cell system exhibits chemosensitivity similar to orthotopic xenograft models. Acta Biomaterialia. 70, 84-97 (2018).
- Gavin, C., et al. Neuroblastoma invasion strategies are regulated by the extracellular matrix. Cancers. 13 (4), 1-23 (2021).
- Ridky, T. W., Chow, J. M., Wong, D. J., Khavari, P. A. Invasive three-dimensional organotypic neoplasia from multiple normal human epithelia. Nature Medicine. 16 (12), 1450-1456 (2010).
- Casal, e. J., Crane, J. S. . Biochemistry, Glycosaminoglycans. , (2019).
- O'Brien, F. J., Harley, B. A., Yannas, I. V., Gibson, L. J. The effect of pore size on cell adhesion in collagen-GAG scaffolds. Biomaterials. 26 (4), 433-441 (2005).
- O'Brien, F. J., Harley, B. A., Yannas, I. V., Gibson, L. Influence of freezing rate on pore structure in freeze-dried collagen-GAG scaffolds. Biomaterials. 25 (6), 1077-1086 (2004).
- Haugh, M. G., Murphy, C. M., McKiernan, R. C., Altenbuchner, C., O'Brien, F. J. Crosslinking and mechanical properties significantly influence cell attachment, proliferation, and migration within collagen glycosaminoglycan scaffolds. Tissue Engineering. Part A. 17 (9-10), 1201-1208 (2011).
- Murphy, C. M., Haugh, M. G., O'Brien, F. J. The effect of mean pore size on cell attachment, proliferation and migration in collagen-glycosaminoglycan scaffolds for bone tissue engineering. Biomaterials. 31 (3), 461-466 (2010).
- Haugh, M. G., Jaasma, M. J., O'Brien, F. J. The effect of dehydrothermal treatment on the mechanical and structural properties of collagen-GAG scaffolds. Journal of Biomedical Materials Research - Part A. 89 (2), 363-369 (2009).
- Lowe, B., Hardy, J. G., Walsh, L. J. Optimizing nanohydroxyapatite nanocomposites for bone tissue engineering. ACS Omega. 5 (1), 1-9 (2020).
- Cunniffe, G. M., Dickson, G. R., Partap, S., Stanton, K. T., O'Brien, F. J. Development and characterisation of a collagen nano-hydroxyapatite composite scaffold for bone tissue engineering. Journal of Materials Science. Materials in Medicine. 21 (8), 2293-2298 (2010).
- DuBois, S. G., et al. Metastatic sites in stage IV and IVS neuroblastoma correlate with age, tumor biology, and survival. Journal of Pediatric Hematology/Oncology. 21 (3), 181-189 (1999).
- Ryan, A. J., Gleeson, J. P., Matsiko, A., Thompson, E. M., O'Brien, F. J. Effect of different hydroxyapatite incorporation methods on the structural and biological properties of porous collagen scaffolds for bone repair. Journal of Anatomy. 227 (6), 732-745 (2015).
- Tierney, C. M., et al. The effects of collagen concentration and crosslink density on the biological, structural and mechanical properties of collagen-GAG scaffolds for bone tissue engineering. Journal of the Mechanical Behavior of Biomedical Materials. 2 (2), 202-209 (2009).
- Cox, R. F., Jenkinson, A., Pohl, K., O'Brien, F. J., Morgan, M. P. Osteomimicry of mammary adenocarcinoma cells in vitro; increased expression of bone matrix proteins and proliferation within a 3D collagen environment. PLoS One. 7 (7), 41679 (2012).
- Nolan, J. C., et al. Preclinical models for neuroblastoma: advances and challenges. Cancer Letters. 474, 53-62 (2020).
- Sirivisoot, S., Pareta, R., Harrison, B. S. Protocol and cell responses in threedimensional conductive collagen gel scaffolds with conductive polymer nanofibres for tissue regeneration. Interface Focus. 4 (1), 20130050 (2014).
- Thevenot, P., Nair, A., Dey, J., Yang, J., Tang, L. Method to analyze three-dimensional cell distribution and infiltration in degradable scaffolds. Tissue Engineering. Part C-Methods. 14 (4), 319-331 (2008).
- do Amaral, R. J. F. C., et al. Functionalising collagen-based scaffolds with platelet-rich plasma for enhanced skin wound healing potential. Frontiers in Bioengineering and Biotechnology. 7, 371 (2019).
- Gkolfinopoulos, S., Tsapakidis, K., Papadimitriou, K., Papamichael, D., Kountourakis, P. Chromogranin A as a valid marker in oncology: Clinical application or false hopes. World Journal of Methodology. 7 (1), 9-15 (2017).
- O'Brien, F. J., et al. The effect of pore size on permeability and cell attachment in collagen scaffolds for tissue engineering. Technology and Health Care. 15 (1), 3-17 (2007).
Erratum
Formal Correction: Erratum: Three-dimensional In Vitro Biomimetic Model of Neuroblastoma using Collagen-based Scaffolds
Posted by JoVE Editors on 6/23/2022. Citeable Link.
An erratum was issued for: Three-dimensional In Vitro Biomimetic Model of Neuroblastoma using Collagen-based Scaffolds. The Authors section was updated.
The Authors section was updated from:
Ciara Gallagher*1,2,3
Catherine Murphy*1,2,3
Fergal J. O’Brien3,4,5
Olga Piskareva1,2,3,5,6
1Cancer Bioengineering Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
2School of Pharmacy and Biomolecular Sciences, RCSI University of Medicine and Health Sciences, Dublin, Ireland
3Tissue Engineering Research Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
4Trinity Centre for Bioengineering, Trinity College Dublin, Dublin, Ireland
5Advanced Materials and Bioengineering Research Centre (AMBER), RCSI and TCD, Dublin, Ireland
6National Children’s Research Centre, Our Lady's Children's Hospital Crumlin, Dublin, Ireland
* These authors contributed equally
to:
Ciara Gallagher*1,2,3
Catherine Murphy*1,2,3
Graeme Kelly4
Fergal J. O’Brien3,5,6
Olga Piskareva1,2,3,6,7
1Cancer Bioengineering Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
2School of Pharmacy and Biomolecular Sciences, RCSI University of Medicine and Health Sciences, Dublin, Ireland
3Tissue Engineering Research Group, Department of Anatomy and Regenerative Medicine, RCSI University of Medicine and Health Sciences, Dublin, Ireland
4Department of Chemistry, Royal College of Surgeons in Ireland (RCSI), 123 St. Stephen’s Green, Dublin 2, Ireland
5Trinity Centre for Bioengineering, Trinity College Dublin, Dublin, Ireland
6Advanced Materials and Bioengineering Research Centre (AMBER), RCSI and TCD, Dublin, Ireland
7National Children’s Research Centre, Our Lady's Children's Hospital Crumlin, Dublin, Ireland
* These authors contributed equally
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved