A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج قابل للتطوير لدراسة آثار إصابة القوة الحادة في سمك الحمار الوحشي البالغ
In This Article
Summary
قمنا بتعديل نموذج انخفاض الوزن Marmarou لسمك الحمار الوحشي الكبار لفحص اتساع نطاق الأمراض بعد إصابات الدماغ الرضية القوة الحادة (TBI) والآليات الكامنة وراء تجديد الخلايا العصبية اللاحقة. هذا النموذج TBI قوة حادة قابلة للتطوير، ويحفز TBI خفيفة، معتدلة، أو شديدة، ويستعرض عدم التجانس الإصابة لوحظ في TBI الإنسان.
Abstract
إصابات الدماغ الرضية بقوة بلانت (TBI) هي الشكل الأكثر شيوعا لصدمة الرأس ، والتي تمتد عبر مجموعة من الشدات وتسفر عن آثار ثانوية معقدة وغير متجانسة. في حين لا توجد آلية لاستبدال أو تجديد الخلايا العصبية المفقودة بعد TBI في البشر، حمار وحشي تمتلك القدرة على تجديد الخلايا العصبية في جميع أنحاء الجسم، بما في ذلك الدماغ. لدراسة اتساع الأمراض المعروضة في حمار وحشي بعد TBI قوة حادة ودراسة الآليات الكامنة وراء الاستجابة التجديدية العصبية اللاحقة، قمنا بتعديل القوارض المستخدمة عادة مارمارو انخفاض الوزن للاستخدام في حمار وحشي الكبار. نموذجنا البسيط TBI ذو القوة الحادة قابل للتطوير ، مما يؤدي إلى TBI خفيف أو معتدل أو شديد ، ويستعرض العديد من الأنماط الظاهرية التي لوحظت بعد TBI البشري ، مثل نوبات الاتصال وما بعد الصدمة ، والوذمة ، والأورام الدموية تحت الجافية وداخل الدماغ ، والإعاقات المعرفية ، كل منها يتم عرضه بطريقة تعتمد على شدة الإصابة. TBI تتمة، والتي تبدأ في الظهور في غضون دقائق من الإصابة، تهدأ والعودة إلى مستويات السيطرة غير التالفة تقريبا في غضون 7 أيام بعد الإصابة. تبدأ عملية التجديد في وقت مبكر من 48 ساعة بعد الإصابة (hpi) ، مع ذروة انتشار الخلايا التي لوحظت من قبل 60 hpi. وهكذا، لدينا حمار وحشي حاد القوة نموذج TBI تنتج الأمراض الإصابة الأولية والثانوية المميزة TBI مماثلة ل TBI الإنسان، والذي يسمح للتحقيق في بداية المرض والتقدم، جنبا إلى جنب مع آليات تجديد الخلايا العصبية التي هي فريدة من نوعها لسمك الحمار الوحشي.
Introduction
إصابات الدماغ الرضية (TBIs) هي أزمة صحية عالمية وسبب رئيسي للوفاة والعجز. في الولايات المتحدة، يعاني ما يقرب من 2.9 مليون شخص من TBI كل عام، وبين عامي 2006-2014 زادت الوفيات بسبب TBI أو TBI sequelae بأكثر من 50٪1. ومع ذلك ، تختلف TBIs في مسبباتها وعلم الأمراض والعرض السريري ويرجع ذلك إلى حد كبير جزئيا إلى آلية الإصابة (MOI) ، والتي تؤثر أيضا على استراتيجيات العلاج والتكهن المتوقع2. على الرغم من أن TBIs يمكن أن تنتج عن وزارة الداخلية المختلفة ، إلا أنها في الغالب نتيجة إما لصدمة اختراق أو قوة حادة. تمثل الصدمات المخترقة نسبة صغيرة من TBIs وتولد إصابة شديدة ومحلية يتم توطينها في مناطق الدماغ المباشرة والمحيطة بها3. وعلى النقيض من ذلك، فإن ال TBIs ذات القوة الحادة أكثر شيوعا بين عامة السكان، وتمتد على مجموعة من الشدات (خفيفة ومعتدلة وشديدة)، وتنتج إصابة منتشرة وغير متجانسة وعالمية تؤثر على مناطق الدماغ المتعددة1,4,5.
وقد استخدمت حمار وحشي (دانيو ريو) لفحص مجموعة واسعة من الشتائم العصبية التي تمتد الجهاز العصبي المركزي (CNS)6,7,8,9. تمتلك حمار وحشي أيضا ، على عكس الثدييات ، استجابة تجديدية فطرية وقوية لإصلاح تلف CNS10. تستخدم نماذج الصدمات الحالية لسمك الحمار الوحشي أساليب إصابة مختلفة، بما في ذلك الاختراق أو الطرد أو الإهانة الكيميائية أو موجات الضغط11,12,13,14,15,16. ومع ذلك ، فإن كل من هذه الأساليب تستخدم MOI التي نادرا ما يعاني منها السكان البشريون ، وغير قابلة للتطوير عبر مجموعة من شدة الإصابة ، ولا تعالج التغايرية أو تتمة TBI المعتمدة على الشدة التي تم الإبلاغ عنها بعد TBI ذات القوة الحادة. تحد هذه العوامل من استخدام نموذج حمار وحشي لفهم الآليات الأساسية للأمراض المرتبطة بالشكل الأكثر شيوعا من TBI في السكان البشريين (إصابات القوة الحادة الخفيفة).
كنا نهدف إلى تطوير نموذج حمار وحشي TBI سريع وقابل للتطوير يوفر سبلا للتحقيق في أمراض الإصابات ، وتطور تتمة TBI ، والاستجابة التجديدية الفطرية. قمنا بتعديل القوارض Marmarou17 الشائعة الاستخدام وانخفاض الوزن وتطبيقها على حمار وحشي الكبار. هذا النموذج ينتج مجموعة قابلة للاستنساخ من الخطورة تتراوح بين معتدلة، معتدلة، إلى شديدة. يلخص هذا النموذج أيضا جوانب متعددة من أمراض TBI البشرية ، بطريقة تعتمد على الشدة ، بما في ذلك النوبات والوذمة والأورام الدموية تحت الجافية وداخل الدماغ ، وموت الخلايا العصبية ، والعجز المعرفي ، مثل التعلم وضعف الذاكرة. بعد أيام من الإصابة ، تتبدد الأمراض والعجز ، والعودة إلى مستويات تشبه الضوابط غير التالفة. بالإضافة إلى ذلك، يعرض هذا النموذج حمار وحشي انتشار قوي واستجابة تجديد الخلايا العصبية عبر neuroaxis بشأن شدة الإصابة.
هنا، نقدم تفاصيل نحو إعداد وتحريض الصدمة القوة الحادة، وتسجيل النوبات اللاحقة للصدمة، وتقييم إصابات الأوعية الدموية، وتعليمات حول إعداد أقسام الدماغ، والنهج لتحديد الوذمة، والبصيرة في الاستجابة التكاثرية بعد الإصابة.
Protocol
تم تربية سمك الحمار الوحشي وصيانته في منشأة نوتردام زيبرافيش في مركز فرايمان لعلوم الحياة. تمت الموافقة على الأساليب الموصوفة في هذه المخطوطة من قبل لجنة العناية بالحيوانات واستخدامها في جامعة نوتردام.
1. نموذج إصابات الدماغ الرضية
- إضافة 1 مل من 2-phenoxyethanol إلى 1 لتر من مياه النظام (60 ملغ من المحيط الفوري في 1 لتر من مياه RO deionized).
- إعداد خزان الإنعاش aerated تحتوي على 2 لتر من مياه النظام في درجة حرارة الغرفة.
- حدد الوزن المطلوب من تحمل الكرة والطول المطلوب وقطرها من الصلب / أنابيب بلاستيكية وتحديد الطاقة وقوة التأثير.
ملاحظة: يجب أن يكون الأنابيب قطرها الداخلي الذي يسمح للكرة تحمل لتمرير من خلال دون تغيير مسارها أو سرعة الحركة.- تحديد الطاقة الحركية عند الارتطام:

حيث، KE = الطاقة الحركية، م = كتلة (في كجم)، ز = قوة الجاذبية، ح = الارتفاع (في م) من نقطة الهبوط إلى الأسماك.
ملاحظة: يوفر هذا الطاقة الحركية في J. ضرب القيمة في 1,000 لتحديد mJ. ويستند KE على كائن متسارع، والذي يحدث عندما يتم إسقاط تحمل الكرة من موقف ثابت. - توليد TBI خفيفة (miTBI) باستخدام 7.62 سم الصلب طويلة / أنابيب بلاستيكية التي تنتهي 1.5 سم فوق لوحة على الجمجمة حمار وحشي (المسافة الإجمالية 9.1 سم) و1.5 غرام (6.4 مم القطر) حامل الكرة. هذه تنتج طاقة حركية من 1.33 دج. وقد تقرر تجريبيا أن يكون هذا الضرر يعادل miTBI على أساس علامات TBI المرضية المرضية الرئيسية ، مثل إصابة الأوعية الدموية ، وتشكيل الورم الدموي تحت الجافية / داخل الدماغ ، وموت الخلايا العصبية ، والإعاقات المعرفية التي اختللت إلى حد كبير ما تم الإبلاغ عنه في السكان البشريين بطريقة تعتمد على الشدة.
- حساب الطاقة الحركية miTBI =
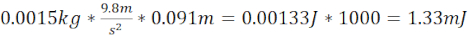
- توليد TBI معتدلة (moTBI) باستخدام 12.7 سم الصلب طويلة / أنابيب بلاستيكية التي تنتهي 1.5 سم فوق لوحة على الجمجمة حمار وحشي (المسافة الإجمالية 14.2 سم) و1.5 غرام (6.4 مم القطر) تحمل الكرة التي تنتج الطاقة الحركية من 2.08 mJ.
- حساب الطاقة الحركية moTBI =
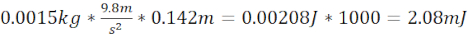
- توليد TBI شديدة (sTBI) باستخدام 7.62 سم الصلب طويلة / أنابيب بلاستيكية التي تنتهي 1.5 سم فوق لوحة على الجمجمة حمار وحشي (المسافة الإجمالية 9.1 سم) و3.3 غرام (8.38 مم القطر) حامل الكرة التي تنتج طاقة الحركية من 2.94 mJ.
- حساب الطاقة الحركية sTBI =

- تحديد الطاقة الحركية عند الارتطام:
- ملء طبق بيتري مع الطين النمذجة (الشكل 1، الخطوة 1) واستخدام أداة حادة (أي الجزء الخلفي من زوج من ملقط) لإنشاء منصة مرتفعة (5 سم × 1.5 سم) مع الطين النمذجة إضافية (الشكل 1، الخطوة 2).
- استخدم شفرة حلاقة لتقسيم المنصة المرفوعة بالطول إلى نصفين متساويين تقريبا (الشكل 1، الخطوة 3، الخط الأحمر المتقطع). شكل النصفين في قناة تستوعب طول سمكة بالغة (الشكل 1، الخطوة 4). استخدام الطين إضافية لبناء الجدران التي من شأنها تأمين ~ 2/3 من جسم السمك، وترك الرأس مكشوفة.
- العفن دعم صغير في منطقة الرأس المكشوفة عمودي على الجدران لدعم الرأس لتجنب دوران أو ارتداد الرأس عند الإصابة (الشكل 1، الخطوة 4).
ملاحظة: يجب أن تكون القناة عميقة بما يكفي لدعم الأسماك في وضع الظهر ولكن يجب أن تسمح للرأس بالراحة فوق الطين المحيط. بالإضافة إلى ذلك ، يجب أن يتبع دعم الرأس الانحناء الطبيعي للأسماك ، مما يدعم الفك السفلي والخياشيم. - تأكد من عدم إعاقة الوزن المسقط من جانب القناة (الشكل 1، الخطوة 4).
- إنشاء قرص الصلب قطرها 3 ملم باستخدام ثقب لكمة صغيرة و 22 غرام من الصلب وامض. يمكن استخدام كل قرص عدة مرات.
- تخدير سمكة واحدة عن طريق وضعها في كوب مع 50-100 مل من 1:1000 (1 مل/ 1 لتر، 0.1٪) 2-phenoxyethanol حتى لا يستجيب لقرصة الذيل.
- ضع السمكة، الجانب الظهري لأعلى، على قالب الطين داخل القناة بحيث يتم تأمين الجسم على الجانبين ووضع قرص فولاذي 3 مم 22 غرام على الرأس، يتمركز على نقطة التأثير المطلوبة (الشكل 1، الخطوة 5).
- تأكد من أن الأسماك تتماشى عموديا قدر الإمكان لتجنب رأسها من الميل إلى جانب واحد، مما قد يسبب تأثيرا متفاوتا.
- تأمين أنابيب الصلب / البلاستيك، وذلك باستخدام موقف حلقة القياسية ومشبك الذراع، وبالتالي فإن الجزء السفلي من الأنابيب هو 1.5 سم فوق رأس حمار وحشي (الشكل 1، الخطوة 6). تأكد من أن الأنابيب مستقيمة.
- ننظر إلى أسفل الأنابيب وضمان أن يتم محاذاة الأنابيب فوق لوحة الصلب.
- إسقاط الكرة تحمل (1.5 غرام ل TBI معتدلة ومعتدلة، و 3.3 غرام ل TBI الشديد) من ارتفاع محدد سلفا (موضح في الخطوات 1.3.3-1.3.5) أسفل الأنبوب على لوحة الصلب الموجودة فوق المنطقة العصبية التشريحية المطلوبة من الفائدة (على سبيل المثال، المخيخ، الشكل 1، الخطوة 5) لإنتاج TBI القوة الحادة لشدة الإصابة المطلوبة. ضع السمك المصاب في خزان للإنعاش ليتم مراقبته.
ملاحظة: اعتمادا على شدة الإصابة، قد تحدث الوفيات أو نوبات منشط كلوني. إذا كانت الأسماك لا تستجيب لفترة طويلة من الزمن بعد TBI، استخدم ماصة نقل أو ملقط لإدارة قرصة الذيل وتقييم للاستجابة للألم.
2. تسجيل المضبوطات بعد TBI في حمار وحشي الكبار
- تخدير وإصابة الأسماك وفقا لبروتوكول الإصابة المبينة في القسم 1 ووضع الأسماك المصابة في خزان الإنعاش مخدر من 2 لتر من مياه النظام.
- مراقبة الأسماك لأي علامات على نوبات ما بعد الصدمة تبدأ مباشرة بعد وضعها في خزان الإنعاش. تحديد وقت للمراقبة (أي ساعة واحدة) وتسجيل جميع أنشطة الضبط، بما في ذلك درجة الضبط (الموضحة أدناه)، ومدة كل عملية ضبط، والنسبة المئوية للأسماك التي تعرضت للمضبوطات (الشكل 2 ألف).
ملاحظة: يمكن أن تحدث النوبات فور الإصابة، بالإضافة إلى ساعات أو أيام بعد الإصابة. يمكن أن تستمر النوبات على المدى الطويل ويمكن أن تصاب سمكة واحدة بنوبات متعددة. 12- إن تحديد وقت للمراقبة قدره ساعة واحدة أو أكثر سيسفر عن تمثيل جيد للاتجاه العام لمعدلات المضبوطات. - تسجيل الأسماك باستخدام المبادئ التوجيهية Mussulini18 للأنماط الظاهرية للمضبوطات حمار وحشي الكبار.
ملاحظة: بدون استخدام برنامج التتبع، من الصعب تقييم درجات الضبطية أقل من 3 بشكل غير متحيز. ولذلك، ينبغي ألا تسجل سوى درجات الضبط التي تبلغ 3 درجات أو أكثر عند إجراء التقييم دون برامجيات حاسوبية.
3. تشريح الدماغ
- القتل الرحيم الأسماك في 1:500 (2 مل/1 لتر، 0.2٪) حل من 2-phenoxyethanol، حتى تتوقف حركات الخيشوم، وأنها غير تفاعلية لقرصة زعنفة، عند نقطة النهاية المرجوة.
- ملء طبق بيتري مع الطين النمذجة وخلق تجويف صغير لدعم الجسم أثناء تشريح.
- ضع السمكة، الجانب الظهري لأعلى، في قالب الطين. وضع دبوس تشريح واحد من خلال خط الوسط في منتصف الطريق إلى أسفل الجسم من الأسماك ودبوس الثاني ~ 5 ملم وراء قاعدة الرأس.
- تحت المجهر ضوء تشريح، قطع العصب البصري بصراحة مع زوج من ملقط دومون # 5 وإزالة العينين (الشكل 2A).
- توجيه الأسماك بحيث نهاية rostral هو أبعد عند النظر من خلال المجهر (الشكل 2B).
ملاحظة: الخطوات التالية هي للأفراد اليد اليمنى. قد يفضل الأفراد الأعسر تنفيذ الخطوات التالية في اتجاه معكوس. - استخدام ملقط # 5 لوضع ببطء نهاية واحدة من ملقط تحت لوحة الجدارية اليمنى، مما يجعل عمل مقص المتعمد تتحرك نحو نهاية rostral وإزالة لوحات الجدارية والجبهية اليمنى (الشكل 2C).
- الحفاظ على ملقط بزاوية 45 درجة أو أقل من أجل تجنب اختراق الدماغ أثناء تشريح.
- تدوير الأسماك 90 درجة في اتجاه عقارب الساعة. ضع نهاية واحدة من ملقط # 5 تحت لوحة الجدار الأيسر واستخدم نفس الحركة المقصية لإزالة اللوحات الجدارية والجبهية اليسرى التي تعرض الجانب الظهري بأكمله من الدماغ (الشكل 2D ، E).
- بصراحة عبر maxilla مع # 5 ملقط. الحفاظ على المصابيح الشمية وعدم إلحاق الضرر بها إذا كان هذا هو المنطقة ذات الأهمية.
- إزالة أوبركل الحق، قبل الكبريت، بين الوبركل، وشبهوكلي مع ملقط # 5 (الشكل 2F).
- استئصال العضلات بصراحة في نهاية caudal من افتتاح الجلجلة باستخدام ملقط # 5 ، وفضح الحبل الشوكي.
- بصراحة تحويل الحبل الشوكي مع ملقط # 5. ضع ملقط بعناية تحت الدماغ وإزالة الدماغ بلطف من الجلجلة.
ملاحظة: لا تقرص الدماغ أبدا. استخدام ملقط إلى "مهد" الدماغ أو استئصال caudally والاستفادة من الحبل الشوكي المكشوفة كنقطة قرصة للمناورة الدماغ. - إصلاح العقول إزالتها في 9 أجزاء 100٪ الإيثانول إلى 1 جزء 37٪ الفورمالديهايد بين عشية وضحاها في 4°C على منصة الروك.
4. دراسات Edema في الدماغ حمار وحشي
- تخدير وإصابة الأسماك وفقا لبروتوكول الإصابة المبين في القسم 1 والسماح للأسماك للتعافي في خزان للتعافي حتى تبدأ السباحة بحرية.
- ضع السمك مرة أخرى في ظروف السكن العادية بعد الإصابة لمدة يوم واحد.
- القتل الرحيم الأسماك في 1:500 2-phenoxyethanol، بعد مرور الوقت.
- تشريح الدماغ كله أو المنطقة ذات الاهتمام وفقا للبروتوكول المبين في القسم 3 ووضع الدماغ على الفور على قارب وزن صغير.
ملاحظة: توخي الحذر عند نقل الدماغ، وذلك باستخدام ملقط ناعم لوضعه بلطف على قارب الوزن دون طعن أو كشط الدماغ، مما قد يؤدي إلى فقدان الأنسجة. - تسمية (مع مجموعة الإصابات ورقم الدماغ) وتاري إضافية صغيرة تجفيف وزن القارب على مقياس. استخدم مقياسا مع القدرة على قياس 0.001 غرام كحد أدنى للحصول على قياس دقيق.
- نقل الدماغ إلى قارب وزن التجفيف القطران وتسجيل الوزن الرطب للدماغ. توجيه العقول بحيث وضع شقة على قارب الوزن مع الجانب الظهري التي تواجه.
- ضع قارب وزن التجفيف والدماغ في فرن التهجين تعيين إلى 60 درجة مئوية لمدة 8 ساعة.
- بعد التجفيف، قد يتمسك الدماغ بقارب وزن التجفيف وقد يكون من الصعب إزالته ونقله إلى قارب وزن صغير جديد. تجنب قرص الدماغ مع ملقط، لأن هذا قد يؤدي إلى تلف في الدماغ الجاف وفقدان الأنسجة. بدلا من ذلك، قرصة ملقط غرامة معا، وبدءا من الجانب البطني من الدماغ، مغرفة في حركة تصاعدية.
- تحديد محتوى الماء لكل دماغ باستخدام الصيغة (الشكل 4):
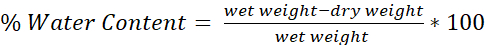
5. وضع العلامات انتشار الخلوية عبر neuroaxis وإعداد الأنسجة الثابتة.
- إعداد 10 M 5-إيثيل-2'-deoxyuridine (EdU) في 2 مل من ddH2O.
- تخدير 3 إلى 4 أسماك في وقت واحد في 50-100 مل من 1:1000 (1 مل/1 لتر، 0.1٪) 2-phenoxyethanol حتى الأسماك لا تستجيب لقرصة الذيل، في النقطة الزمنية المطلوبة بعد الإصابة (باستخدام البروتوكول المبين في القسم 1).
- جعل شق جزئي على اسفنجة مبللة ووضع سمكة واحدة في وقت واحد في الافتتاح، الجانب البطني حتى.
- استخدام إبرة 30 G لحقن ~ 40 ميكرولتر من 10 M EdU في جسم السمك. إعادة الأسماك إلى خزان عقد مليئة بمياه النظام.
ملاحظة: قد يتم إجراء الحقن المتكررة في نقاط زمنية مختلفة لتسمية عدد أكبر من الخلايا المنتشرة وقد تكون هناك حاجة إذا رغبت في فترة مطاردة أكبر من أسبوع واحد. - جمع العقول على النحو المبين في القسم 3 ووضعها كمجموعة في قارورة زجاجية 5 مل تحتوي على 2 مل من 9 أجزاء 100٪ الإيثانول إلى 1 جزء 37٪ الفورمالديهايد. إصلاح العقول في 4 درجة مئوية على منصة الروك.
ملاحظة: منصة الروك أو شاكر يحظر العقول من يستريح في الجزء السفلي وtelncephalon من العقول كلها من الشباك. - إعادة ترطيب العقول، في نفس القارورة الزجاجية المستخدمة لإصلاح العقول، في يغسل من سلسلة الإيثانول تنازلي، 75٪، 50٪، و 25٪، لمدة 15 دقيقة لكل منهما، تليها غسل 1.5 ساعة في 5٪ السكروز / برنامج تلفزيوني على الروك في درجة حرارة الغرفة. تخزين العقول في قارورة زجاجية بين عشية وضحاها في 30٪ السكروز / برنامج تلفزيوني في 4° C على منصة الروك.
- إزالة العقول من 30٪ السكروز / برنامج تلفزيوني ونقلها مع ملقط في لوحة 12 جيدا (مجموعة علاج واحدة لكل بئر) مع آبار مليئة محلول 2:1 تتكون من 2 أجزاء الأنسجة تجميد المتوسطة و 1 جزء 30٪ السكروز / PBS. احتضان العقول بين عشية وضحاها في 4 درجة مئوية على منصة الروك.
- نقل العقول إلى الصف التالي من الآبار داخل لوحة 12 بئر غمر العقول في TFM 100٪ لمدة 2-24 ساعة في 4 درجة مئوية.
- استخدام تشاك cryostat لتضمين العقول في TFM في الاتجاه المطلوب على الجليد الجاف.
- إجراء cryosectioning (16 ميكرومتر أقسام سميكة) وجمع المقاطع على الشرائح مشحونة إيجابيا. الشرائح الجافة على شريحة أكثر دفئا لمدة 1 ساعة ثم تخزينها في -80 درجة مئوية أو الاستمرار في الكيمياء المناعية.
- إعداد حاجز مسعور على الشريحة حول أقسام الأنسجة والسماح لتجف على شريحة أكثر دفئا لمدة 20 دقيقة.
- غسل لفترة وجيزة الشرائح في برنامج تلفزيوني لمدة 5 دقائق ثم مرتين في PBS-توين 20 (0.05٪) لمدة 10 دقيقة لكل منهما.
- إجراء الكشف عن EdU باستخدام مجموعة أدوات انتشار الخلايا EdU وإرشادات الشركة المصنعة.
- تحليل الشرائح وتحديد الخلايا الفلورية المسمى EdU باستخدام إما المجهر epifluorescent أو المجهر confocal. وسوف تكون هناك حاجة إلى حد أدنى من هدف 40x للتمييز بوضوح الخلايا الفردية.
النتائج
إعداد تلاعب الإصابة التعريفي يسمح وسيلة سريعة وتبسيطية لتقديم TBI قوة حادة قابلة للتطوير لسمك الحمار الوحشي الكبار. توفر شدة نموذج الإصابة المتدرج العديد من المقاييس التي يمكن التعرف عليها بسهولة للإصابة الناجحة ، على الرغم من أن إصابة الأوعية الدموية هي واحدة من أسهل وأبرز الأمراض (
Discussion
تركزت التحقيقات في الصدمات العصبية وما يرتبط بها من عواقب منذ فترة طويلة على نماذج القوارض التقليدية غير التجديدية20. وفي الآونة الأخيرة فقط طبقت الدراسات أشكالا مختلفة من الأضرار الناجمة عن الجهاز العصبي المركزي على النماذج التجديدية9,11,13,14,21....
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ويود المؤلفون أن يشكروا أعضاء مختبر هايد على مناقشاتهم المدروسة، وفنيي مركز فرايمان لعلوم الحياة على رعاية وتربية سمك الحمار الوحشي، وجامعة نوتردام للفحص المجهري البصري Core/NDIIF لاستخدام الأدوات وخدماتها. تم دعم هذا العمل من قبل مركز أبحاث زيبرافيش في جامعة نوتردام، ومركز الخلايا الجذعية والطب التجديدي في جامعة نوتردام، والمنح المقدمة من المعهد الوطني للعيون في NIH R01-EY018417 (DRH)، وبرنامج زمالة أبحاث الدراسات العليا التابع للمؤسسة الوطنية للعلوم (JTH)، وزمالة LTC نيل هايلاند من نوتردام (JTH)، زمالة حراس الحرية (JTH)، ومنحة بات تيلمان (JTH).
Materials
| Name | Company | Catalog Number | Comments |
| 2-phenoxyethanol | Sigma Alderich | 77699 | |
| #00 buckshot | Remington | RMS23770 | 3.3g weight for sTBI |
| #3 buckshot | Remington | RMS23776 | 1.5g weight for miTBI/moTBI |
| #5 Dumont forceps | WPI | 14098 | |
| 5-ethynyl-2’-deoxyuridine | Life Technologies | A10044 | EdU |
| 5ml glass vial | VWR | 66011-063 | |
| Click-iT EdU Cell Proliferation Kit | Life Technologies | C10340 | |
| CytoOne 12-well plate | USA Scientific | CC7682-7512 | |
| Instant Ocean | Instant Ocean | SS15-10 | |
| Super frost postiviely charged slides | VWR | 48311-703 | |
| Super PAP Pen Liquid Blocker | Ted Pella | 22309 | |
| Tissue freezing medium | VWR | 15148-031 |
References
- Centers for Disease Control and Prevention. Surveillance Report of Traumatic Brain Injury-related Emergency Department Visits, Hospitalizations, and Deaths-United States, 2014. Centers for Disease Control and Prevention, U.S. Department of Health and Human Services. , (2019).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell transplantation. 26 (7), 1118-1130 (2017).
- Santiago, L. A., Oh, B. C., Dash, P. K., Holcomb, J. B., Wade, C. E. A clinical comparison of penetrating and blunt traumatic brain injuries. Brain injury. 26 (2), 107-125 (2012).
- Korley, F. K., Kelen, G. D., Jones, C. M., Diaz-Arrastia, R. Emergency department evaluation of traumatic brain injury in the United States, 2009-2010. The Journal of Head Trauma Rehabilitation. 31 (6), 379-387 (2016).
- Faul, M., Xu, L., Wald, M., Coronado, V. . Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths. , (2010).
- Campbell, L. J., et al. Notch3 and DeltaB maintain Müller glia quiescence and act as negative regulators of regeneration in the light-damaged zebrafish retina. Glia. 69 (3), 546-566 (2021).
- Green, L. A., Nebiolo, J. C., Smith, C. J. Microglia exit the CNS in spinal root avulsion. PLoS Biology. 17 (2), 3000159 (2019).
- Hentig, J., Byrd-Jacobs, C. Exposure to zinc sulfate results in differential effects on olfactory sensory neuron subtypes in the adult zebrafish. International Journal of Molecular Sciences. 17 (9), 1445 (2016).
- Ito, Y., Tanaka, H., Okamoto, H., Oshima, T. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum. Developmental Biology. 342 (1), 26-38 (2010).
- Becker, C., Becker, T. Adult zebrafish as a model for successful central nervous system regeneration. Restorative Neurology and Neuroscience. 26 (2-3), 71-80 (2008).
- Alyenbawwi, H., et al. Seizures are a druggable mechanistic link between TBI and subsequent tauopathy. eLife. 10, 58744 (2021).
- Kaslin, J., Kroehne, V., Ganz, J., Hans, S., Brand, M. Distinct roles of neuroepithelia-like and radial glia-like progenitor cells in cerebellar regeneration. Development. 144 (8), 1462-1471 (2017).
- McCutcheon, V., et al. A novel model of traumatic brain injury in adult zebrafish demonstrates response to injury and treatment comparable with mammalian models. Journal of Neurotrauma. 34 (7), 1382-1393 (2017).
- Skaggs, K., Goldman, D., Parent, J. Excitotoxic brain injury in adult zebrafish stimulates neurogenesis and long-distance neuronal integration. Glia. 62 (12), 2061-2079 (2014).
- Kishimoto, N., Shimizu, K., Sawamoto, K. Neuronal regeneration in a zebrafish model of adult brain injury. Disease Models & Mechanisms. 5 (2), 200-209 (2012).
- Kroehne, V., Freudenreich, D., Hans, S., Kaslin, J., Brand, M. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors. Development. 138 (22), 4831-4841 (2011).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Mussulini, B. H., et al. Seizures induced by pentylenetetrazole in the adult zebrafish: a detailed behavioral characterization. PloS One. 8 (1), 54515 (2013).
- Kalueff, A., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injuries. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. eLife. 5, 13998 (2016).
- Yamamoto, S., Levin, H., Prough, D. Mild, moderate and severe: terminology implications for clinical and experimental traumatic brain injury. Current Opinion in Neurology. 31 (6), 672-680 (2008).
- Lund, S., et al. Moderate traumatic brain injury, acute phase course and deviations in physiological variables: an observational study. Scandinavian Journal of Trauma Resuscitation and Emergency Medicine. 24, 77 (2016).
- Levin, H., Arrastia, R. Diagnosis, prognosis, and clinical management of mild traumatic brain injury. The Lancet Neurology. 14 (5), 506-517 (2015).
- Ruff, R. M., et al. Recommendations for diagnosing a mild traumatic brain injury: a National Academy of Neuropsychology education paper. Archives of Clinical Neuropsychology: The Official Journal of the National Academy of Neuropsychologists. 24 (1), 3-10 (2009).
- Ganz, J., Brand, M. Adult neurogenesis in fish. Cold Spring Harbor Perspectives in Biology. 8 (7), 019018 (2016).
- Grandel, H., Kaslin, J., Ganz, J., Wenzel, I., Brand, M. Neural stem cells and neurogenesis in the adult zebrafish brain: origin, proliferation dynamics, migration and cell fate. Developmental Biology. 295, 263-277 (2006).
- Lahne, M., Nagashima, M., Hyde, D. R., Hitchcock, P. F. Reprogramming Muller glia to regenerate retinal neurons. Annual Review of Visual Science. 6, 171-193 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved