É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo escalável para estudar os efeitos da lesão por força bruta em zebrafish adulto
Neste Artigo
Resumo
Modificamos o modelo de queda de peso de Marmarou para o zebrafish adulto para examinar uma amplitude de patologias após lesão cerebral traumática por força bruta (TCE) e os mecanismos subjacentes à regeneração neuronal subsequente. Este modelo de TBI de força bruta é escalável, induz um TCE leve, moderado ou grave, e recapitula a heterogeneidade da lesão observada no TBI humano.
Resumo
Lesões cerebrais traumáticas por força bruta (TCE) são a forma mais comum de traumatismo craniano, que abrange uma série de gravidades e resulta em efeitos secundários complexos e heterogênios. Embora não haja mecanismo para substituir ou regenerar os neurônios perdidos após um TBI em humanos, os zebrafish possuem a capacidade de regenerar neurônios em todo o seu corpo, incluindo o cérebro. Para examinar a amplitude das patologias exibidas em zebrafish após um TBI de força bruta e estudar os mecanismos subjacentes à resposta regenerativa neuronal subsequente, modificamos a queda de peso comumente utilizada de roedor Marmarou para o uso em zebrafish adulto. Nosso modelo de TCE de força bruta simples é escalável, induzindo um TBI leve, moderado ou grave, e recapitula muitos dos fenótipos observados após o TCE humano, como convulsões de contato e pós-traumático, edema, hematomas subdural e intracerebral, e prejuízos cognitivos, cada um exibido de forma dependente de lesões. As sequelas do TCE, que começam a aparecer poucos minutos após a lesão, diminuem e retornam a níveis de controle quase intactos dentro de 7 dias após a lesão. O processo regenerativo começa já em 48 horas após a lesão (hpi), com a proliferação de células máximas observada por 60 hpi. Assim, nosso modelo de TBI de força bruta de zebrafish produz patologias tbi primárias e secundárias características semelhantes às TBI humanas, o que permite investigar o início e a progressão da doença, juntamente com os mecanismos de regeneração neuronal que é exclusivo do zebrafish.
Introdução
Lesões cerebrais traumáticas (TBIs) são uma crise de saúde global e uma das principais causas de morte e incapacidade. Nos Estados Unidos, cerca de 2,9 milhões de pessoas experimentam um TCE a cada ano, e entre 2006-2014 a mortalidade por sequelas de TCE ou TCE aumentou mais de 50% 1. No entanto, os TBIs variam em sua etiologia, patologia e apresentação clínica devido, em grande parte, ao mecanismo de lesão (MOI), que também influencia as estratégias de tratamento e previu o prognóstico2. Embora os TBIs possam resultar de vários MOI, eles são predominantemente o resultado de um trauma penetrante ou contundente. Traumas penetrantes representam uma pequena porcentagem de TBIs e geram uma lesão grave e focal localizada nas regiões cerebrais próximas e circundantes3. Em contraste, as TBIs de força bruta são mais comuns na população geral, abrangem uma série de gravidades (leves, moderadas e graves) e produzem uma lesão difusa, heterogênea e global que afeta múltiplas regiões cerebrais1,4,5.
Os zebrafish (Danio rerio) têm sido utilizados para examinar uma ampla gama de insultos neurológicos que abrangem o sistema nervoso central (CNS)6,7,8,9. Os zebrafish também possuem, ao contrário dos mamíferos, uma resposta regenerativa inata e robusta para reparar danos do CNS10. Os modelos atuais de trauma de zebrafish utilizam vários métodos de lesão, incluindo penetração, excisão, insulto químico ou ondas de pressão11,12,13,14,15,16. No entanto, cada um desses métodos utiliza um MOI que raramente é experimentado pela população humana, não é escalável em uma série de gravidades de lesões, e não aborda a heterogeneidade ou sequência de TCE dependente da gravidade relatada após tbi de força bruta. Esses fatores limitam o uso do modelo de zebrafish para compreender os mecanismos subjacentes das patologias associadas à forma mais comum de TCE na população humana (lesões leves por força bruta).
Nosso objetivo foi desenvolver um modelo rápido e escalável de zebrafish TBI de força bruta que fornece caminhos para investigar a patologia da lesão, a progressão das sequelas do TCE e a resposta regenerativa inata. Modificamos a queda de peso do roedor Marmarou17 comumente usado e aplicamos-no a zebrafish adulto. Este modelo produz uma gama reprodutível de gravidades que variam de leve, moderada, a grave. Este modelo também recapitula múltiplas facetas da patologia do TCE humano, de forma dependente da gravidade, incluindo convulsões, edema, hematomas subdurais e intracerebrais, morte celular neuronal e déficits cognitivos, como aprendizado e prejuízo de memória. Dias após lesões, patologias e déficits se dissipam, retornando a níveis semelhantes a controles não danificados. Além disso, este modelo de zebrafish exibe uma resposta robusta de proliferação e regeneração neuronal através da neuroaxis em relação à gravidade da lesão.
Aqui, fornecemos detalhes para a configuração e indução de trauma por força bruta, pontuação de convulsões pós-traumáticas, avaliação de lesões vasculares, instruções sobre a preparação de seções cerebrais, abordagens para quantificar edema, e insights sobre a resposta proliferativa após lesão.
Protocolo
Os zebrafish foram criados e mantidos na instalação de zebrafish de Notre Dame no Centro de Ciências da Vida de Freimann. Os métodos descritos neste manuscrito foram aprovados pelo Comitê de Cuidado e Uso de Animais da Universidade de Notre Dame.
1. Paradigma de lesão cerebral traumática
- Adicione 1 mL de 2-phenoxyetanol a 1 L de água do sistema (60 mg de Oceano Instantâneo em 1 L de água de RO desionizada).
- Prepare um tanque de recuperação aerado contendo 2 L de água do sistema à temperatura ambiente.
- Selecione o peso desejado do rolamento da esfera e um comprimento e diâmetro desejados de tubos de aço/plástico e determine a força de energia e impacto.
NOTA: A tubulação deve ter um diâmetro interno que permita que o rolamento da esfera passe sem alterar seu caminho ou velocidade de movimento.- Determine a energia cinética após o impacto:

Onde, KE = energia cinética, m = massa (em kg), g = força gravitacional, h = altura (em m) do ponto de gota para o peixe.
NOTA: Isso fornece energia cinética em J. Multiplique o valor por 1.000 para determinar mJ. O KE é baseado em um objeto acelerado, que ocorre quando o rolamento da esfera é derrubado de uma posição estacionária. - Gere um TBI leve (miTBI) utilizando tubos de aço/plástico de 7,62 cm de comprimento que terminam 1,5 cm acima da placa no crânio do zebrafish (distância total de 9,1 cm) e um rolamento de esfera de 1,5 g (6,4 mm de diâmetro). Estes produzem uma energia cinética de 1,33 mJ. Este dano foi empiricamente decidido ser equivalente a um miTBI baseado em marcadores TBI fisioterológicos chave, como lesão vascular, formação de hematoma subdural/intracerebral, morte celular neuronal e prejuízos cognitivos que em grande parte recapitulavam o que foi relatado na população humana de forma dependente da gravidade.
- Calcular energia cinética miTBI =
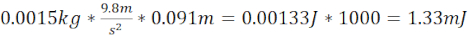
- Gere um TBI moderado (moTBI) utilizando tubos de aço/plástico de 12,7 cm de comprimento que terminam 1,5 cm acima da placa no crânio do zebrafish (distância total de 14,2 cm) e um rolamento de esfera de 1,5 g (6,4 mm de diâmetro) que produz energia cinética de 2,08 mJ.
- Calcular moTBI de energia cinética =
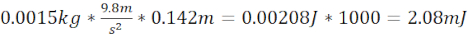
- Gere um TBI (sTBI) grave usando tubos de aço/plástico de 7,62 cm de comprimento que terminam 1,5 cm acima da placa no crânio do zebrafish (distância total de 9,1 cm) e um rolamento de esfera de 8,38 mm de diâmetro que produz uma energia cinética de 2,94 mJ.
- Calcular energia cinética sTBI =

- Determine a energia cinética após o impacto:
- Encha uma placa de Petri com argila de modelagem (Figura 1, passo 1) e use um instrumento contundente (ou seja, a parte de trás de um par de fórceps) para criar uma plataforma elevada (5 cm x 1,5 cm) com argila de modelagem adicional (Figura 1, passo 2).
- Use uma lâmina de barbear para dividir a plataforma elevada longitudinalmente em duas metades aproximadamente iguais (Figura 1, passo 3, linha tracejada vermelha). Forme as duas metades em um canal que acomoda o comprimento de um peixe adulto (Figura 1, passo 4). Use argila adicional para construir paredes que garantam ~2/3 do corpo do peixe, deixando a cabeça exposta.
- Molde um pequeno suporte na região da cabeça exposta perpendicular às paredes para apoiar a cabeça para evitar rotação ou recuo da cabeça após o ferimento (Figura 1, passo 4).
NOTA: O canal deve ser profundo o suficiente para apoiar o peixe em uma posição dorsal- up, mas ainda deve permitir que a cabeça descanse acima da argila circundante. Além disso, o suporte para a cabeça deve seguir a curvatura natural do peixe, suportando a mandíbula inferior e as brânquias. - Certifique-se de que o peso caído não seja impedido pelos lados do canal (Figura 1, passo 4).
- Crie um disco de aço de 3 mm de diâmetro usando um mini furo-perfurador e um pisca-pisca de aço de 22 g. Cada disco pode ser usado várias vezes.
- Anestesia um peixe colocando-o em um béquer com 50-100 mL de 1:1000 (1 mL/1 L, 0,1%) 2-fenoxitanol até que não seja respondetivo ao aperto de cauda.
- Coloque o peixe, lado dorsal para cima, no molde de argila dentro do canal para que o corpo seja fixado nas laterais e coloque um disco de aço de 3 mm 22 g na cabeça, centrado sobre o ponto de impacto desejado (Figura 1, passo 5).
- Certifique-se de que o peixe esteja alinhado o mais perpendicularmente possível para evitar que sua cabeça se incline para um lado, o que poderia causar um impacto desigual.
- Fixar o tubo de aço/plástico, utilizando um suporte de anel padrão e grampo de braço, de modo que a parte inferior da tubulação está 1,5 cm acima da cabeça do zebrafish (Figura 1, passo 6). Certifique-se de que a tubulação está reta.
- Olhe para baixo da tubulação e certifique-se de que o tubo está alinhado acima da placa de aço.
- Solte o rolamento da esfera (1,5 g para TBI leve e moderado, e 3,3 g para TCE grave) de uma altura predeterminada (descrita nas Etapas 1.3.3-1.3.5) descendo a tubulação sobre a placa de aço localizada sobre a região neuroanatómica desejada de interesse (por exemplo, cerebelo, Figura 1, passo 5) para produzir o TBI de força bruta para a gravidade desejada da lesão. Coloque os peixes feridos em um tanque de recuperação para serem monitorados.
NOTA: Dependendo da gravidade da lesão, a mortalidade ou as convulsões tônica-clonicas podem ocorrer. Se o peixe não responder por um período prolongado de tempo após o TBI, use uma pipeta de transferência ou fórceps para administrar uma pinça traseira e avaliar uma resposta à dor.
2. Pontuação de convulsões pós-TCE no zebrafish adulto
- Anestesiar e ferir os peixes de acordo com o protocolo de lesão descrito na seção 1 e colocar os peixes feridos em um tanque de recuperação aerado de 2 L de água do sistema.
- Observe o peixe para qualquer sinal de convulsões pós-traumáticas começando imediatamente após ser colocado no tanque de recuperação. Estabeleça um tempo de observação (ou seja, 1 h) e regisse toda a atividade convulsiva, incluindo o escore de convulsão (descrito abaixo), duração de cada convulsão e o percentual de peixes que sofreram convulsões (Figura 2A).
NOTA: As convulsões podem ocorrer imediatamente após ferimentos, bem como horas ou dias pós-TCE. As convulsões podem persistir a longo prazo e um único peixe pode ter múltiplas convulsões. Estabelecer um tempo de observação de 1 h ou mais produzirá uma boa representação da tendência geral das taxas de apreensão. - Escore peixe usando as diretrizes mussulini18 para fenótipos de apreensão de zebrafish adultos.
NOTA: Sem usar o software de rastreamento, é difícil avaliar os escores de convulsão abaixo de 3 imparcialmente. Portanto, apenas escores de convulsão de 3 ou mais devem ser registrados quando a avaliação está sendo realizada sem software.
3. Dissecção cerebral
- Eutanize o peixe em uma solução de 1:500 (2 mL/1 L, 0,2%) de 2-fenoxinotanol, até que os movimentos da brânquia cessem, e eles não são ativos para fin pinch, no ponto final desejado.
- Encha uma placa de Petri com argila modeladora e crie uma pequena cavidade para apoiar o corpo durante a dissecação.
- Coloque o peixe, lado dorsal para cima, no molde de argila. Coloque um pino de dissecção através da linha média no meio do corpo do peixe e um segundo pino ~5 mm atrás da base da cabeça.
- Sob um microscópio de luz dissecando, corte sem rodeios o nervo óptico com um par de fórceps De Dumont #5 e remova os olhos (Figura 2A).
- Oriente o peixe para que a extremidade rostral seja mais distante quando olhar através do microscópio (Figura 2B).
NOTA: As seguintes etapas são para indivíduos destros. Os canhotos podem preferir realizar as seguintes etapas em uma orientação espelhada. - Use fórceps #5 para colocar lentamente uma extremidade dos fórceps sob a placa parietal direita, fazendo uma ação deliberada de tesoura movendo-se em direção à extremidade rostral e remover as placas parietal e frontal direita (Figura 2C).
- Mantenha os fórceps em um ângulo de 45° ou inferior, a fim de evitar penetrar o cérebro durante a dissecção.
- Gire o peixe 90° no sentido horário. Coloque uma extremidade das fórceps #5 sob a placa parietal esquerda e use o mesmo movimento da tesoura para remover as placas parietal esquerda e frontal expondo todo o aspecto dorsal do cérebro (Figura 2D,E).
- Transectar sem rodeios a maxila com fórceps nº 5. Preservar as lâmpadas olfativas e não danificá-las se esta for a região de interesse.
- Remova o opercle direito, o preopercle, o interopercle e o subóperculo com fórceps #5 (Figura 2F).
- Ressecção direta da musculatura na extremidade caudal da abertura do calvarium usando fórceps #5, expondo a medula espinhal.
- Transectar sem rodeios a medula espinhal com fórceps nº 5. Coloque cuidadosamente fórceps sob o cérebro e remova suavemente o cérebro do calvario.
NOTA: Nunca belisque o cérebro. Use fórceps para "embalar" o cérebro ou resseccionar caudalmente e utilizar a medula espinhal exposta como um ponto de beliscão para manobrar o cérebro. - Fixar os cérebros removidos em 9 partes 100% etanol para 1 parte 37% formaldeído durante a noite a 4°C em uma plataforma roqueiro.
4. Estudos de edema no cérebro de zebrafish
- Anestesiar e ferir peixes de acordo com o protocolo de lesão descrito na seção 1 e permitir que os peixes se recuperem em um tanque de recuperação até que comecem a nadar livremente.
- Coloque os peixes de volta nas condições normais de habitação pós-lesão por 1 dia.
- Eutanize o peixe em 1:500 2-phenoxyetanol, depois que o tempo passou.
- Disseque todo o cérebro ou região de interesse de acordo com o protocolo descrito na seção 3 e coloque o cérebro imediatamente em um pequeno barco de pesagem.
NOTA: Tenha cuidado ao transferir o cérebro, usando fórceps finos para colocá-lo suavemente no barco de pesagem sem esfaquear ou raspar o cérebro, o que pode resultar na perda de tecido. - Rotular (com grupo de lesões e número cerebral) e tare um barco de pesagem de secagem menor adicional em uma escala. Use uma balança com a capacidade de medir um mínimo de 0,001 g para obter uma medição precisa.
- Transfira o cérebro para o barco de pesagem de secagem e regisse o peso úmido do cérebro. Oriente os cérebros para que eles deitem-se sobre o barco de pesagem com o lado dorsal virado para cima.
- Coloque o barco de pesagem de secagem e o cérebro em um forno de hibridização definido a 60 °C por 8h.
- Após a secagem, o cérebro pode ficar grudado no barco de pesagem de secagem e pode ser difícil de remover e transferir para um novo pequeno barco de pesagem tared. Evite beliscar o cérebro com fórceps, pois isso pode resultar em danos ao cérebro seco e perda de tecido. Em vez disso, aperte os fórceps finos juntos e, começando pelo lado ventral do cérebro, colher em um movimento ascendente.
- Determinar o teor de água de cada cérebro usando a fórmula (Figura 4):
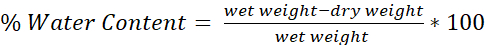
5. Rotular a proliferação celular através da neuroaxis e preparar tecido fixo.
- Prepare 10 mM 5-ethynyl-2'-deoxyuridina (EdU) em 2 mL de ddH2O.
- Anestesiar 3 a 4 peixes de cada vez em 50-100 mL de 1:1000 (1 mL/1 L, 0,1%) 2-fenoxiyetanol até que o peixe não responda ao aperto de cauda, no ponto de tempo desejado após a lesão (usando o protocolo delineado na seção 1).
- Faça uma incisão parcial em uma esponja molhada e coloque um peixe de cada vez na abertura, lado ventral para cima.
- Use uma agulha de 30 G para injetar ~40 μL de 10 mM EdU no corpo do peixe. Devolva o peixe para um tanque de retenção cheio de água do sistema.
NOTA: As injeções repetidas podem ser realizadas em diferentes pontos de tempo para rotular um maior número de células proliferadoras e podem ser necessárias se um período de perseguição superior a 1 semana for desejado. - Colete cérebros como descrito na seção 3 e coloque-os como um grupo em um frasco de vidro de 5 mL contendo 2 mL de 9 partes 100% etanol para 1 parte 37% formaldeído. Fixar os cérebros a 4 °C em uma plataforma de roqueiro.
NOTA: Uma plataforma de roqueiro ou agitador proíbe que os cérebros descansem na parte inferior e o telencephalon de cérebros inteiros de enrolar. - Cérebros de reidratação, no mesmo frasco de vidro usado para fixar cérebros, em lavagens de etanol descendente série, 75%, 50%, e 25%, para 15 minutos cada, seguido por uma lavagem de 1,5 h em 5% de sacarose/PBS em um roqueiro à temperatura ambiente. Armazene os cérebros em um frasco de vidro durante a noite em 30% de sacarose/PBS a 4° C em uma plataforma de roqueiro.
- Remova os cérebros de 30% de sacarose/PBS e transfira-os com fórceps para uma placa de 12 poços (um grupo de tratamento por poço) com poços preenchidos com uma solução 2:1 consistindo de 2 partes de tecido congelante médio e 1 parte 30% de sacarose/PBS. Incubar os cérebros durante a noite a 4 °C em uma plataforma de roqueiro.
- Transfira cérebros para a próxima linha de poços dentro da placa de 12 poços submersos cérebros em 100% TFM para 2-24 h a 4 °C.
- Use um mandril criostat para incorporar os cérebros em TFM na orientação desejada sobre gelo seco.
- Realize o criosectioning (seções de 16 μm de espessura) e colete as seções em slides carregados positivamente. Seque lâminas em um aquecedor de slides por 1h e depois armazene a -80 °C ou continue com a imunohistoquímica.
- Prepare uma barreira hidrofóbica na lâmina ao redor das seções teciduais e deixe secar em um aquecedor de slides por 20 minutos.
- Lave brevemente os slides em PBS por 5 min e depois duas vezes em PBS-Tween 20 (0,05%) por 10 min cada.
- Realize a detecção da EdU usando o Kit de Proliferação de Células EdU e as instruções do fabricante.
- Analise os slides e quantifique as células fluorescentes rotuladas por EdU usando um microscópio epifluorescente ou um microscópio confocal. Um mínimo de 40x de objetivo será necessário para distinguir claramente células individuais.
Resultados
A preparação da plataforma de indução de lesões permite um meio rápido e simplista de fornecer um TBI escalável de força bruta aos zebrafish adultos. A gravidade classificada do modelo de lesão fornece várias métricas facilmente identificáveis de lesões bem sucedidas, embora a lesão vascular seja uma das patologias mais fáceis e proeminentes (Figura 3). A variedade de peixes utilizada durante a lesão pode tornar este indicador mais fácil ou mais difícil de identificar. Ao u...
Discussão
As investigações de neurotrauma e sequelas associadas têm sido centradas em modelos tradicionais de roedores não regenerativos20. Somente recentemente, estudos aplicaram várias formas de dano de CNS aos modelos regenerativos9,11,13,14,21. Embora perspicazes, esses modelos são limitados pelo uso de um método de lesão pouco visto ...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer aos membros do laboratório Hyde por suas discussões pensativas, os técnicos do Freimann Life Sciences Center para cuidados e criação de zebrafish, e o Núcleo de Microscopia Óptica da Universidade de Notre Dame/NDIIF pelo uso de instrumentos e seus serviços. Este trabalho foi apoiado pelo Centro de Pesquisa de Zebrafish da Universidade de Notre Dame, pelo Centro de Células-Tronco e Medicina Regenerativa da Universidade de Notre Dame, e bolsas do National Eye Institute of NIH R01-EY018417 (DRH), do National Science Foundation Graduate Research Fellowship Program (JTH), LTC Neil Hyland Fellowship of Notre Dame (JTH), Sentinelas da Sociedade da Liberdade (JTH) e a Bolsa Pat Tillman (JTH).
Materiais
| Name | Company | Catalog Number | Comments |
| 2-phenoxyethanol | Sigma Alderich | 77699 | |
| #00 buckshot | Remington | RMS23770 | 3.3g weight for sTBI |
| #3 buckshot | Remington | RMS23776 | 1.5g weight for miTBI/moTBI |
| #5 Dumont forceps | WPI | 14098 | |
| 5-ethynyl-2’-deoxyuridine | Life Technologies | A10044 | EdU |
| 5ml glass vial | VWR | 66011-063 | |
| Click-iT EdU Cell Proliferation Kit | Life Technologies | C10340 | |
| CytoOne 12-well plate | USA Scientific | CC7682-7512 | |
| Instant Ocean | Instant Ocean | SS15-10 | |
| Super frost postiviely charged slides | VWR | 48311-703 | |
| Super PAP Pen Liquid Blocker | Ted Pella | 22309 | |
| Tissue freezing medium | VWR | 15148-031 |
Referências
- Centers for Disease Control and Prevention. Surveillance Report of Traumatic Brain Injury-related Emergency Department Visits, Hospitalizations, and Deaths-United States, 2014. Centers for Disease Control and Prevention, U.S. Department of Health and Human Services. , (2019).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell transplantation. 26 (7), 1118-1130 (2017).
- Santiago, L. A., Oh, B. C., Dash, P. K., Holcomb, J. B., Wade, C. E. A clinical comparison of penetrating and blunt traumatic brain injuries. Brain injury. 26 (2), 107-125 (2012).
- Korley, F. K., Kelen, G. D., Jones, C. M., Diaz-Arrastia, R. Emergency department evaluation of traumatic brain injury in the United States, 2009-2010. The Journal of Head Trauma Rehabilitation. 31 (6), 379-387 (2016).
- Faul, M., Xu, L., Wald, M., Coronado, V. . Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths. , (2010).
- Campbell, L. J., et al. Notch3 and DeltaB maintain Müller glia quiescence and act as negative regulators of regeneration in the light-damaged zebrafish retina. Glia. 69 (3), 546-566 (2021).
- Green, L. A., Nebiolo, J. C., Smith, C. J. Microglia exit the CNS in spinal root avulsion. PLoS Biology. 17 (2), 3000159 (2019).
- Hentig, J., Byrd-Jacobs, C. Exposure to zinc sulfate results in differential effects on olfactory sensory neuron subtypes in the adult zebrafish. International Journal of Molecular Sciences. 17 (9), 1445 (2016).
- Ito, Y., Tanaka, H., Okamoto, H., Oshima, T. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum. Developmental Biology. 342 (1), 26-38 (2010).
- Becker, C., Becker, T. Adult zebrafish as a model for successful central nervous system regeneration. Restorative Neurology and Neuroscience. 26 (2-3), 71-80 (2008).
- Alyenbawwi, H., et al. Seizures are a druggable mechanistic link between TBI and subsequent tauopathy. eLife. 10, 58744 (2021).
- Kaslin, J., Kroehne, V., Ganz, J., Hans, S., Brand, M. Distinct roles of neuroepithelia-like and radial glia-like progenitor cells in cerebellar regeneration. Development. 144 (8), 1462-1471 (2017).
- McCutcheon, V., et al. A novel model of traumatic brain injury in adult zebrafish demonstrates response to injury and treatment comparable with mammalian models. Journal of Neurotrauma. 34 (7), 1382-1393 (2017).
- Skaggs, K., Goldman, D., Parent, J. Excitotoxic brain injury in adult zebrafish stimulates neurogenesis and long-distance neuronal integration. Glia. 62 (12), 2061-2079 (2014).
- Kishimoto, N., Shimizu, K., Sawamoto, K. Neuronal regeneration in a zebrafish model of adult brain injury. Disease Models & Mechanisms. 5 (2), 200-209 (2012).
- Kroehne, V., Freudenreich, D., Hans, S., Kaslin, J., Brand, M. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors. Development. 138 (22), 4831-4841 (2011).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Mussulini, B. H., et al. Seizures induced by pentylenetetrazole in the adult zebrafish: a detailed behavioral characterization. PloS One. 8 (1), 54515 (2013).
- Kalueff, A., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injuries. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. eLife. 5, 13998 (2016).
- Yamamoto, S., Levin, H., Prough, D. Mild, moderate and severe: terminology implications for clinical and experimental traumatic brain injury. Current Opinion in Neurology. 31 (6), 672-680 (2008).
- Lund, S., et al. Moderate traumatic brain injury, acute phase course and deviations in physiological variables: an observational study. Scandinavian Journal of Trauma Resuscitation and Emergency Medicine. 24, 77 (2016).
- Levin, H., Arrastia, R. Diagnosis, prognosis, and clinical management of mild traumatic brain injury. The Lancet Neurology. 14 (5), 506-517 (2015).
- Ruff, R. M., et al. Recommendations for diagnosing a mild traumatic brain injury: a National Academy of Neuropsychology education paper. Archives of Clinical Neuropsychology: The Official Journal of the National Academy of Neuropsychologists. 24 (1), 3-10 (2009).
- Ganz, J., Brand, M. Adult neurogenesis in fish. Cold Spring Harbor Perspectives in Biology. 8 (7), 019018 (2016).
- Grandel, H., Kaslin, J., Ganz, J., Wenzel, I., Brand, M. Neural stem cells and neurogenesis in the adult zebrafish brain: origin, proliferation dynamics, migration and cell fate. Developmental Biology. 295, 263-277 (2006).
- Lahne, M., Nagashima, M., Hyde, D. R., Hitchcock, P. F. Reprogramming Muller glia to regenerate retinal neurons. Annual Review of Visual Science. 6, 171-193 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados