JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
성인 얼룩말 피시의 무딘 힘 부상의 효과를 연구하는 확장 가능한 모델
요약
우리는 무딘 힘 외상성 뇌 손상 (TBI) 및 후속 신경 재생의 기초 메커니즘에 따라 병리학의 폭을 검사하기 위해 성인 얼룩말 물고기에 대한 Marmarou 체중 드롭 모델을 수정했습니다. 이 무딘 힘 TBI 모델은 확장 가능, 온화한 유도, 보통, 또는 심한 TBI, 인간의 TBI에서 관찰 부상 이질성을 다시 수상.
초록
무딘 힘 외상성 뇌 손상 (TBI) 머리 외상의 가장 일반적인 형태, 이는 단절의 범위에 걸쳐 복잡 하 고 이종이 불 쌍이 이차 효과 결과. 인간에서 TBI다음 잃어버린 뉴런을 대체하거나 재생하는 메커니즘은 없지만, 제브라피쉬는 뇌를 포함하여 몸 전체에 뉴런을 재생하는 능력을 가지고 있습니다. 무딘 힘 TBI다음 얼룩말 피시에 전시 된 병리학의 폭을 검사하고 후속 뉴런 재생 반응의 기초 메커니즘을 연구하기 위해, 우리는 성인 얼룩말 피시에 사용하기 위해 일반적으로 사용되는 설치류 Marmarou 체중 방울을 수정했습니다. 우리의 간단한 무딘 힘 TBI 모델은 확장 가능, 온화한 유도, 보통, 또는 심한 TBI, 그리고 접촉 과 외상 후 발작, 부종, 경막 및 추적 혈종 혈종, 인지 장애등 인간의 TBI 다음 관찰 표현형의 많은 재구성, 각각 부상 심각도 의존적 인 방식으로 표시. 부상 후 몇 분 이내에 나타나기 시작하는 TBI 후유한은 부상 후 7 일 이내에 거의 손상되지 않은 제어 수준으로 돌아갑니다. 재생 과정은 부상 후 48시간(hpi)부터 시작하며, 최고 세포 증식은 60마치에 의해 관찰됩니다. 따라서, 우리의 zebrafish 무딘 힘 TBI 모형은 제브라피시에 유일하게 신경 재생의 기계장치와 더불어 질병 개시 및 진행을 조사할 수 있는 인간 TBI와 유사한 특징적인 1 차 및 이차 상해 TBI 병리를 생성합니다.
서문
외상성 뇌 손상 (TbIs)은 글로벌 건강 위기와 사망과 장애의 주요 원인입니다. 미국에서는 매년 약 290만 명이 TBI를 경험하고, 2006-2014년 사이에 TBI 또는 TBI 후유로 인한 사망률은 50%1 이상 증가했습니다. 그러나, 결핵은 그들의 병인학, 병리학 및 임상 프리젠 테이션에서 주로 상해의 기계장치에 부분적으로 기인합니다 (MOI), 이는 또한 처리 전략 및 예측 예후2에 영향을 미칩니다. 비록 결핵은 다양 한 MOI에서 발생할 수 있습니다., 그들은 주로 관통 또는 무딘 힘 외상의 결과. 관통 외상은 결핵의 작은 비율을 나타내고 즉각적이고 주변 찔린 뇌 부위에 국한되는 심각하고 초점 상해를 생성3. 대조적으로, 무딘 힘 TBI는 일반 인구에서 일반적입니다, 단절의 범위에 걸쳐 (온화한, 보통, 심한), 여러 뇌 영역에 영향을 미치는 확산, 이질성, 글로벌 상해를 생산1,4,5.
Zebrafish (Danio rerio)는 중추 신경계 (CNS)6,7,8,9에 걸친 광범위한 신경 학적 모욕을 검사하는 데 활용되었습니다. Zebrafish는 또한 포유류와 달리 CNS 손상을 복구하기 위한 선천적이고 강력한 재생 반응을 가지고 있습니다10. 현재 zebrafish 외상 모델은 침투, 절제, 화학 적 모욕 또는 압력 파동을 포함한 다양한 부상 방법을 사용합니다11,12,13,14,15,16. 그러나, 이들 각각의 방법은 거의 인간 인구에 의해 경험되지 않는 MOI를 활용, 부상 단절의 범위에 걸쳐 확장 할 수 없습니다, 무딘 힘 TBI 후보고 이질성 또는 심각도 의존 TBI 후이를 해결하지 않습니다. 이러한 요인은 인간 인구에서 TBI의 일반적인 형태와 관련된 병리학의 기본 메커니즘을 이해하기 위해 제브라피시 모델의 사용을 제한 (가벼운 무딘 힘 부상).
우리는 상해 병리학, TBI 후유증의 진행 및 타고난 재생 반응을 조사할 수 있는 방법을 제공하는 신속하고 확장 가능한 무딘 힘 TBI 제브라피시 모델을 개발하는 것을 목표로 했습니다. 우리는 일반적으로 사용되는 설치류 Marmarou17 체중 방울을 수정하고 성인 얼룩말 물고기에 적용했습니다. 이 모델은 온화하고 중간정도에서 중증에 이르는 다양한 절단 범위를 산출합니다. 이 모델은 또한 발작, 부종, 경막 및 추적 혈종, 신경 세포 죽음 및 학습 및 기억 장애와 같은 인지 적자를 포함하여 심각도 의존적 방식으로 인간 TBI 병리학의 여러 측면을 재구성합니다. 부상 후 며칠, 병리학 및 적자가 사라지고 손상되지 않은 컨트롤과 유사한 수준으로 돌아갑니다. 추가적으로, 이 제브라피쉬 모형은 상해 엄격에 관하여 신경축에 걸쳐 강력한 증식 및 신경 재생 반응을 표시합니다.
여기에서는 무딘 힘 외상의 설정 및 유도, 외상 후 발작 점수, 혈관 부상 평가, 뇌 섹션 준비 지침, 부종 정량화 에 대한 접근 및 부상 후 의 확산 반응에 대한 통찰력을 제공합니다.
프로토콜
브라위피쉬는 프레이만 생명과학 센터의 노틀담 제브라피시 시설에서 자랐으며 유지되었습니다. 이 원고에 설명 된 방법은 노틀담 동물 관리 및 사용위원회의 대학에 의해 승인되었다.
1. 외상성 뇌 손상 패러다임
- 시스템 물 1L에 2-페녹시에탄올 1mL를 추가하십시오(1L의 탈온화 된 RO 물에 인스턴트 오션 60 mg).
- 실온에서 2L의 시스템 물을 포함하는 배수 복구 탱크를 준비합니다.
- 원하는 볼 베어링 무게와 강철/플라스틱 튜브의 원하는 길이 와 직경을 선택하고 에너지와 충격력을 결정합니다.
참고: 튜브는 경로 나 이동 속도를 변경하지 않고 볼 베어링이 통과 할 수있는 내부 직경을 가져야합니다.- 충격에 따라 운동 에너지를 결정합니다.

여기서, KE = 운동 에너지, m = 질량(kg), g = 중력, h = 높이(m)가 드롭포인트에서 물고기까지.
참고: J. J. 에서 운동 에너지를 1,000으로 곱하여 mJ를 결정합니다. KE 는 볼 베어링이 고정 된 위치에서 떨어질 때 발생하는 가속 물체를 기반으로합니다. - 얼룩말 두개골 (총 거리 9.1cm)과 1.5g (6.4mm 직경) 볼 베어링의 플레이트 위 1.5cm를 끝내는 7.62cm 길이의 강철 / 플라스틱 튜브를 사용하여 온화한 TBI (miTBI)를 생성합니다. 이들은 1.33 mJ의 운동 에너지를 생성합니다. 이 손상은 경험적으로 혈관 상해, 경막막/무산혈 혈종 형성, 신경 세포 죽음 및 심각도 의존적인 방식으로 인간 인구에서 보고된 것을 크게 회수하는 인식 손상과 같은 주요 병리학TBI 마커에 근거를 둔 miTBI에 해당하기로 결정되었습니다.
- 운동 에너지 miTBI 계산 =
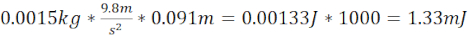
- 제브라피쉬 두개골(총 거리 14.2cm)과 2.08mJ의 운동 에너지를 생성하는 1.5g(직경 6.4mm) 볼 베어링의 플레이트 위로 1.5cm 를 끝내는 12.7cm 길이의 강철/플라스틱 튜브를 사용하여 적당한 TBI(moTBI)를 생성합니다.
- 운동 에너지 moTBI 계산 =
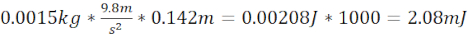
- 7.62cm 길이의 강철/플라스틱 튜브를 사용하여 심한 TBI(sTBI)를 생성하여 제브라피쉬 두개골(총 거리 9.1cm)과 3.3g(직경 8.38mm) 볼 베어링의 플레이트 위로 1.5cm 를 종료하여 2.94mJ의 운동 에너지를 생성합니다.
- 운동 에너지 sTBI 계산 =

- 충격에 따라 운동 에너지를 결정합니다.
- 페트리 접시에 모델링 점토(도 1, 1단계)를 채우고 무딘 악기(즉, 집게 의 뒷면)를 사용하여 추가 모델링 점토(그림 1, 2단계)가 있는 제기 플랫폼(5cm x 1.5cm)을 만듭니다.
- 면도날을 사용하여 제기된 플랫폼을 대략 2개의 동일한 반으로 세로로 나눕니다(그림 1, 3단계, 빨간색 파선). 두 반쪽을 성인 물고기의 길이를 수용 하는 채널로 형성 (그림 1, 단계 4). 추가 점토를 사용하여 물고기 몸의 ~ 2/3을 고정하여 머리를 노출시키는 벽을 구축하십시오.
- 부상 시 헤드의 회전이나 반동을 피하기 위해 헤드를 지지하기 위해 벽에 수직으로 노출된 헤드 부위에 작은 지지체를 성형한다(도 1, 4단계).
참고: 채널은 등쪽에서 물고기를 지원할 만큼 깊어야 하지만 여전히 머리가 주변 점토 위에 안주하도록 해야 합니다. 또한, 머리 지원은 낮은 하악골과 아가미를 지원하는 물고기의 자연적인 곡률을 따라야한다. - 떨어뜨린 중량이 채널의 측면에 의해 방해되지 않았는지 확인합니다(그림 1, 4단계).
- 미니 홀 펀치와 22g 스틸 깜박임으로 직경 3mm의 강철 디스크를 만듭니다. 각 디스크는 여러 번 사용될 수 있습니다.
- 1:1000(1mL/1 L, 0.1%) 2-페녹시에탄올이 꼬리 꼬집기까지 50-100mL의 비커에 배치하여 한 마리의 물고기를 마취시킵니다.
- 물고기, 등쪽 을 위로 배치, 몸이 측면에 고정되도록 채널 내의 점토 금형에 원하는 충격 점을 중심으로 머리에 3mm 22g 강철 디스크를 배치 (도 1, 단계 5).
- 물고기가 머리를 한쪽으로 기울지 않도록 가능한 한 수직으로 정렬되어 고르지 못한 영향을 줄 수 있습니다.
- 표준 링 스탠드와 암 클램프를 사용하여 강철/플라스틱 튜브를 고정하므로 튜브의 바닥은 제브라피시의 머리 위로 1.5cm 입니다(그림 1, 6단계). 튜브가 직선인지 확인하십시오.
- 튜브를 내려다보고 튜브가 강판 위에 정렬되었는지 확인합니다.
- 볼 베어링(경미하고 중간 정도의 TBI의 경우 1.5g, 중증 TBI의 경우 3.3g)를 소정의 높이(1.3.3-1.3.5단계설명)에서 원하는 신경해부학 적 영역 위에 위치한 강판에 튜브를 내려 놓아 원하는 신경해부학적 영역(예를 들어, 소뇌, 도 1, 5 단계 5)을 원하는 중증도에 대한 무딘 TBI 의 중증도를 생성한다. 부상당한 물고기를 복구 탱크에 배치하여 모니터링합니다.
참고: 부상의 심각도에 따라 사망률 또는 토닉 클로닉 발작이 발생할 수 있습니다. 물고기가 TBI 다음 시간의 장시간 동안 응답하지 않는 경우, 꼬리 핀치를 관리하고 통증 반응을 평가하기 위해 전송 파이펫 이나 집게를 사용합니다.
2. 성인 얼룩말피에서 TBI 후 발작 점수
- 섹션 1에 설명된 부상 프로토콜에 따라 물고기를 마취하고 다치게하고 부상당한 물고기를 시스템 물 2 L의 배수 복구 탱크에 놓습니다.
- 복구 탱크에 배치 된 직후시작 외상 후 발작의 흔적에 대한 물고기를 관찰. 관찰 시간(즉, 1h)을 설정하고 발작 점수(아래에 설명됨), 각 발작 의 지속 시간 및 발작을 경험한 물고기의 백분율을 포함한 모든 발작 활동을 기록합니다(그림 2A).
참고: 발작은 부상 시 즉시 발생할 수 있으며, TBI 이후의 시간 또는 일도 발생할 수 있습니다. 발작은 장기적으로 지속될 수 있고 단 하나 물고기는 다중 발작이 있을 수 있습니다. 1 시간 이상 관측 시간을 설정하면 발작 률의 전반적인 추세를 잘 나타낼 수 있습니다. - 성인 얼룩말 물고기 발작 표현형에 대한 Mussulini18 지침을 사용하여 물고기 점수.
참고: 추적 소프트웨어를 사용하지 않고는 발작 점수를 3 미만으로 평가하기가 어렵습니다. 따라서 소프트웨어 없이 평가가 수행될 때 3개 이상 발작 점수만 기록해야 합니다.
3. 뇌 해부
- 아가미 운동이 중단될 때까지 2-페녹시에탄올의 1:500(2mL/1 L, 0.2%) 용액으로 물고기를 안락사시키고 원하는 엔드포인트에서 핀 핀치에 반응하지 않습니다.
- 페트리 접시에 모델링 점토를 채우고 해부 중에 몸을 지탱할 수 있는 작은 캐비티를 만듭니다.
- 물고기, 등쪽을 점토 몰드에 올려 놓습니다. 물고기의 몸체 중간에 중간선을 통해 해부 핀 1개를 놓고 머리 의 밑면 뒤에 두 번째 핀 ~5mm를 놓습니다.
- 해부하는 빛 현미경에서, 무뚝뚝하게 #5 Dumont 집게의 쌍으로 시신경을 끊고 눈을 제거합니다 (그림 2A).
- 현미경을 통해 볼 때 장편 끝이 가장 멀리 되도록 물고기를 지향 (그림 2B).
참고: 다음 단계는 오른손잡이 개인을 위한 것입니다. 왼손잡이 개인은 미러 방향으로 다음 단계를 수행하는 것을 선호할 수 있습니다. - #5 집게를 사용하여 집안판의 한쪽 끝을 천천히 배치하여 고의적인 가위 동작이 로스트랄 끝으로 이동하고 오른쪽 정수리 및 정면 플레이트(그림 2C)를 제거합니다.
- 해부 동안 뇌를 관통하지 않도록 집게를 45° 이하의 각도로 유지하십시오.
- 물고기를 시계 방향으로 90° 회전시. 왼쪽 정수리 플레이트 아래에 #5 집게의 한쪽 끝을 놓고 동일한 가위 동작을 사용하여 뇌의 전체 등쪽 측면을 노출하는 왼쪽 정수리 및 전두엽 판을 제거합니다(그림 2D, E).
- #5 포셉으로 맥실라를 무뚝뚝하게 변형시합니다. 후각 전구를 보존하고 관심 영역인 경우 손상되지 않습니다.
- #5 포셉(그림 2F)으로 오른쪽 오퍼클, 프리오퍼클, 인터로퍼클 및 서브퍼클을 제거합니다.
- #5 포셉을 사용하여 칼바륨 개구부의 caudal 끝에 있는 근육을 무뚝뚝하게 절제하여 척수를 노출시십시오.
- #5 포셉으로 척수를 무뚝뚝하게 변질합니다. 조심스럽게 뇌 아래에 집게를 배치하고 부드럽게 칼바륨에서 뇌를 제거합니다.
참고 : 뇌를 꼬집어하지 마십시오. 집게를 사용하여 뇌를 "요람"하거나 caudally 절제하고 노출된 척수를 뇌를 기동하는 핀치 포인트로 활용하십시오. - 로커 플랫폼에서 4°C에서 하룻밤 사이에 9부 100% 에탄올에서 1부 37% 포름알데히드로 제거된 뇌를 수정합니다.
4. 제브라피쉬 뇌에 대한 부종 연구
- 섹션 1에 설명된 부상 프로토콜에 따라 물고기를 마취하고 다치게하고 물고기가 자유롭게 수영을 시작할 때까지 복구 탱크에서 회복 할 수 있도록합니다.
- 1 일 동안 정상적인 주택 조건에 다시 물고기를 배치합니다.
- 시간이 경과 한 후, 1:500 2-페녹시에탄올에서 물고기를 안락사.
- 섹션 3에 설명된 프로토콜에 따라 전체 뇌 또는 관심 영역을 해부하고 뇌를 작은 계량 보트에 즉시 배치합니다.
참고: 두뇌를 옮길 때주의를 기울여야 하며, 미세한 집게를 사용하여 뇌를 찌르거나 긁지 않고 계량 보트에 부드럽게 배치하여 조직의 손실을 초래할 수 있습니다. - 라벨 (부상 그룹과 뇌 수) 및 규모에 추가 작은 건조 계량 보트를 타고. 정확한 측정을 위해 최소 0.001g을 측정할 수 있는 스케일을 사용합니다.
- 타르 건조 계량 보트에 뇌를 전송하고 뇌의 젖은 무게를 기록합니다. 그들은 등쪽 측이 위를 향하고 무게 보트에 평평하게 누워 있도록 뇌를 오리엔팅.
- 건조 계량 보트와 뇌를 혼성화 오븐에 넣고 8시간 동안 60°C로 설정합니다.
- 건조 후, 뇌는 건조 계량 보트에 충실 할 수 있으며 제거하고 새로운 타르 작은 무게 보트로 전송하기 어려울 수 있습니다. 이 건조 한 두뇌에 손상 및 조직의 손실 귀 착될 수 있습니다, 집게와 두뇌를 꼬집어 하지 마십시오. 대신, 미세 한 집게를 함께 꼬집어, 뇌의 복부 측면에서 시작, 위쪽으로 움직임에 국자.
- 수식을 사용하여 각 뇌의 수분 함량을 결정합니다(그림 4):
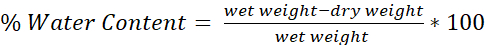
5. 신경축을 가로 질러 세포 증식을 표시하고 고정 된 조직을 준비.
- ddH2O 의 2mL에서 10mM 5-에티닐-2'-데옥시리딘(EdU)을 준비한다.
- 1:1000mL(1mL/1 L, 0.1%) 2-페녹시에탄올에서 한 번에 3~4마리의 물고기를 마취하여 물고기가 꼬리 꼬집어 반응하지 않을 때까지(섹션 1에 설명된 프로토콜 사용).
- 젖은 스폰지에 부분 절개를하고 개구부, 복부 측면에 한 번에 하나의 물고기를 배치합니다.
- 30G 바늘을 사용하여 10mM EdU의 ~40 μL을 물고기의 몸에 주입하십시오. 물고기는 시스템 물로 채워진 지주 탱크로 돌아갑니다.
참고: 반복 주사는 다른 시점에서 수행될 수 있고 증식 세포의 더 많은 수를 레이블을 지정하고 1 주 이상의 추적 기간이 원하는 경우 필요할 수 있습니다. - 섹션 3에 설명된 대로 뇌를 수집하고 9부 100% 에탄올의 2mL를 포함하는 5mL 유리 바이알에 1부 37% 포름알데히드로 배치한다. 로커 플랫폼에서 4°C에서 뇌를 수정합니다.
참고: 로커 또는 셰이커 플랫폼은 뇌가 바닥에 쉬고 전체 뇌의 텔렌스팔론이 컬링되는 것을 금지합니다. - 뇌를 고치는 데 사용되는 유리 유리 바이알에서, 내림차순 에탄올 시리즈의 세척, 75%, 50%, 25%, 각각 15분, 실온에서 로커에 5%의 자당/PBS로 1.5h 세척이 뒤따랐다. 로커 플랫폼에 4° C에서 30% 자당/PBS에 밤새 유리 유리 병에 두뇌를 저장합니다.
- 30% 자당/PBS에서 뇌를 제거하고 12웰 플레이트(웰당 1개의 치료그룹)로 이송하고, 2부조직 동결배지와 1부 30%의 자당/PBS로 구성된 2:1 용액으로 채워진 웰을 이체한다. 로커 플랫폼에서 4°C에서 하룻밤 동안 뇌를 배양합니다.
- 4°C에서 2-24h에 대해 100% TFM에서 12웰 플레이트 내의 다음 웰행으로 뇌를 옮기는다.
- 냉동 척을 사용하여 TFM에 뇌를 건조 얼음의 원하는 방향으로 포함시킵니다.
- 저온 절제 (16 μm 두께 의 섹션)를 수행하고 양전하 슬라이드의 섹션을 수집합니다. 1 시간 동안 슬라이드 워머에 건조 슬라이드 다음 -80 ° C에 저장하거나 면역 작용으로 계속.
- 조직 섹션 주위 슬라이드에 소수성 장벽을 준비하고 20 분 동안 슬라이드 워머에 건조 할 수 있습니다.
- PBS에서 슬라이드를 5분 간 간 간략하게 씻어낸 다음 PBS-Tween 20(0.05%)에서 각각 10분 동안 두 번 세척합니다.
- EdU 세포 증식 키트 및 제조업체의 지침을 사용하여 EdU 탐지를 수행합니다.
- 슬라이드를 분석하고 형광 EdU 표지 된 세포를 상피 현미경 또는 공초점 현미경을 사용하여 정량화합니다. 개별 셀을 명확하게 구분하려면 최소 40배의 목표가 필요합니다.
결과
부상 유도 장비를 준비하면 성인 얼룩말물고기에 확장 가능한 무딘 힘 TBI를 제공하는 빠르고 단순한 수단을 사용할 수 있습니다. 부상 모델의 등급 심각도는 혈관 부상이 가장 쉽고 눈에 띄는 병리학 중 하나이지만 성공적인 부상의 몇 가지 쉽게 식별 할 수있는 메트릭을 제공합니다 (그림 3). 부상 중에 사용되는 물고기의 변형은이 지표를 쉽게 또는 식별하기 어렵게 만들 ?...
토론
신경 외상 및 관련 후유증에 대한 조사는 오랫동안 기존의 비 재생 설치류 모델에 중점을 두어 왔습니다20. 최근에는 재생 모델에 다양한 형태의 CNS 손상을 적용한 연구9,11,13,14,21. 통찰력이 있지만, 이러한 모델은 인간 인구에서 흔히 볼 수 없는 부상 방법(?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 그들의 사려 깊은 토론에 대한 하이드 실험실 구성원을 감사하고 싶습니다, 제브라피시 관리 및 축산에 대한 프레이만 생명 과학 센터 기술자, 그리고 악기와 서비스의 사용에 대한 노틀담 광학 현미경 코어 / NDIIF 의 대학. 이 작품은 노틀담 대학의 제브라피시 연구 센터, 노틀담 대학의 줄기 세포 및 재생 의학 센터, NIH R01-EY018417 (DRH), 국립 과학 재단 대학원 연구 펠로우십 프로그램 (JTH), 노트르 담 (JTH)의 LTC 닐 하이랜드 펠로우십의 국립 안과 연구소에서 보조금을 지원받았습니다. 자유 펠로우십(JTH)과 팻 틸만 장학금(JTH)의 센티넬.
자료
| Name | Company | Catalog Number | Comments |
| 2-phenoxyethanol | Sigma Alderich | 77699 | |
| #00 buckshot | Remington | RMS23770 | 3.3g weight for sTBI |
| #3 buckshot | Remington | RMS23776 | 1.5g weight for miTBI/moTBI |
| #5 Dumont forceps | WPI | 14098 | |
| 5-ethynyl-2’-deoxyuridine | Life Technologies | A10044 | EdU |
| 5ml glass vial | VWR | 66011-063 | |
| Click-iT EdU Cell Proliferation Kit | Life Technologies | C10340 | |
| CytoOne 12-well plate | USA Scientific | CC7682-7512 | |
| Instant Ocean | Instant Ocean | SS15-10 | |
| Super frost postiviely charged slides | VWR | 48311-703 | |
| Super PAP Pen Liquid Blocker | Ted Pella | 22309 | |
| Tissue freezing medium | VWR | 15148-031 |
참고문헌
- Centers for Disease Control and Prevention. Surveillance Report of Traumatic Brain Injury-related Emergency Department Visits, Hospitalizations, and Deaths-United States, 2014. Centers for Disease Control and Prevention, U.S. Department of Health and Human Services. , (2019).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell transplantation. 26 (7), 1118-1130 (2017).
- Santiago, L. A., Oh, B. C., Dash, P. K., Holcomb, J. B., Wade, C. E. A clinical comparison of penetrating and blunt traumatic brain injuries. Brain injury. 26 (2), 107-125 (2012).
- Korley, F. K., Kelen, G. D., Jones, C. M., Diaz-Arrastia, R. Emergency department evaluation of traumatic brain injury in the United States, 2009-2010. The Journal of Head Trauma Rehabilitation. 31 (6), 379-387 (2016).
- Faul, M., Xu, L., Wald, M., Coronado, V. . Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths. , (2010).
- Campbell, L. J., et al. Notch3 and DeltaB maintain Müller glia quiescence and act as negative regulators of regeneration in the light-damaged zebrafish retina. Glia. 69 (3), 546-566 (2021).
- Green, L. A., Nebiolo, J. C., Smith, C. J. Microglia exit the CNS in spinal root avulsion. PLoS Biology. 17 (2), 3000159 (2019).
- Hentig, J., Byrd-Jacobs, C. Exposure to zinc sulfate results in differential effects on olfactory sensory neuron subtypes in the adult zebrafish. International Journal of Molecular Sciences. 17 (9), 1445 (2016).
- Ito, Y., Tanaka, H., Okamoto, H., Oshima, T. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum. Developmental Biology. 342 (1), 26-38 (2010).
- Becker, C., Becker, T. Adult zebrafish as a model for successful central nervous system regeneration. Restorative Neurology and Neuroscience. 26 (2-3), 71-80 (2008).
- Alyenbawwi, H., et al. Seizures are a druggable mechanistic link between TBI and subsequent tauopathy. eLife. 10, 58744 (2021).
- Kaslin, J., Kroehne, V., Ganz, J., Hans, S., Brand, M. Distinct roles of neuroepithelia-like and radial glia-like progenitor cells in cerebellar regeneration. Development. 144 (8), 1462-1471 (2017).
- McCutcheon, V., et al. A novel model of traumatic brain injury in adult zebrafish demonstrates response to injury and treatment comparable with mammalian models. Journal of Neurotrauma. 34 (7), 1382-1393 (2017).
- Skaggs, K., Goldman, D., Parent, J. Excitotoxic brain injury in adult zebrafish stimulates neurogenesis and long-distance neuronal integration. Glia. 62 (12), 2061-2079 (2014).
- Kishimoto, N., Shimizu, K., Sawamoto, K. Neuronal regeneration in a zebrafish model of adult brain injury. Disease Models & Mechanisms. 5 (2), 200-209 (2012).
- Kroehne, V., Freudenreich, D., Hans, S., Kaslin, J., Brand, M. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors. Development. 138 (22), 4831-4841 (2011).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Mussulini, B. H., et al. Seizures induced by pentylenetetrazole in the adult zebrafish: a detailed behavioral characterization. PloS One. 8 (1), 54515 (2013).
- Kalueff, A., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injuries. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. eLife. 5, 13998 (2016).
- Yamamoto, S., Levin, H., Prough, D. Mild, moderate and severe: terminology implications for clinical and experimental traumatic brain injury. Current Opinion in Neurology. 31 (6), 672-680 (2008).
- Lund, S., et al. Moderate traumatic brain injury, acute phase course and deviations in physiological variables: an observational study. Scandinavian Journal of Trauma Resuscitation and Emergency Medicine. 24, 77 (2016).
- Levin, H., Arrastia, R. Diagnosis, prognosis, and clinical management of mild traumatic brain injury. The Lancet Neurology. 14 (5), 506-517 (2015).
- Ruff, R. M., et al. Recommendations for diagnosing a mild traumatic brain injury: a National Academy of Neuropsychology education paper. Archives of Clinical Neuropsychology: The Official Journal of the National Academy of Neuropsychologists. 24 (1), 3-10 (2009).
- Ganz, J., Brand, M. Adult neurogenesis in fish. Cold Spring Harbor Perspectives in Biology. 8 (7), 019018 (2016).
- Grandel, H., Kaslin, J., Ganz, J., Wenzel, I., Brand, M. Neural stem cells and neurogenesis in the adult zebrafish brain: origin, proliferation dynamics, migration and cell fate. Developmental Biology. 295, 263-277 (2006).
- Lahne, M., Nagashima, M., Hyde, D. R., Hitchcock, P. F. Reprogramming Muller glia to regenerate retinal neurons. Annual Review of Visual Science. 6, 171-193 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유