Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yetişkin Zebra Balıklarında Künt Kuvvet Yaralanmasının Etkilerini Incelemek İçin Ölçeklenebilir Bir Model
Bu Makalede
Özet
Yetişkin zebra balığı için Marmarou ağırlık düşürme modelini, künt travmatik beyin hasarı (TBI) ve sonraki nöronal yenilenmenin altında kalan mekanizmaların ardından çok çeşitli patolojileri incelemek üzere değiştirdik. Bu künt kuvvetli TBI modeli ölçeklenebilir, hafif, orta veya şiddetli bir TBI'ya neden oluyor ve insan TBI'sında gözlenen yaralanma heterojenliğini yeniden özetler.
Özet
Künt cisim travmatik beyin yaralanmaları (TBI), bir dizi şiddete yayılan ve karmaşık ve heterojen ikincil etkilerle sonuçlanan en yaygın kafa travması şeklidir. İnsanlarda bir TBI'ı takip eden kayıp nöronları değiştirmek veya yenilemek için bir mekanizma olmasa da, zebra balıkları beyin de dahil olmak üzere vücutlarında nöronları yenileme yeteneğine sahiptir. Zebra balıklarında künt kuvvette bir TBI'dan sonra sergilenen patolojilerin genişliğini incelemek ve sonraki nöronal rejeneratif yanıtın altında yatan mekanizmaları incelemek için, yetişkin zebra balıklarında kullanım için yaygın olarak kullanılan kemirgen Marmarou ağırlık düşüşünü değiştirdik. Basit künt kuvvet TBI modelimiz ölçeklenebilir, hafif, orta veya şiddetli bir TBI'a neden olur ve temas ve travma sonrası nöbetler, ödem, subdural ve intraserebral hematomlar ve bilişsel bozukluklar gibi insan TBI'sını takiben gözlenen fenotiplerin çoğunu yeniden kapsüller, her biri yaralanma şiddetine bağlı olarak görüntülenir. Yaralanmadan birkaç dakika sonra ortaya çıkmaya başlayan TBI sekel, yaralanma sonrası 7 gün içinde hasarsız kontrol seviyelerine iner ve geri döner. Rejeneratif süreç yaralanma sonrası 48 saat (hpi) kadar erken başlar ve en yüksek hücre çoğalması 60 hpi ile gözlenir. Bu nedenle, zebra balığı künt kuvvet TBI modelimiz, zebra balığına özgü nöronal rejenerasyon mekanizmaları ile birlikte hastalık başlangıcını ve ilerlemesini araştırmaya izin veren insan TBI'sına benzer karakteristik birincil ve ikincil yaralanma TBI patolojileri üretir.
Giriş
Travmatik beyin yaralanmaları (TMI'ler) küresel bir sağlık krizidir ve önde gelen bir ölüm ve sakatlık nedenidir. Amerika Birleşik Devletleri'nde her yıl yaklaşık 2,9 milyon kişi bir TBI yaşamektedir ve 2006-2014 yılları arasında TBI veya TBI sekellerine bağlı ölüm oranı% 50'nin üzerinde artmıştır. Bununla birlikte, TBİ'ler etiyoloji, patoloji ve klinik sunumlarında büyük ölçüde tedavi stratejilerini etkileyen ve prognozu tahmin eden yaralanma mekanizmasına (MOI) bağlı olarak değişmektedir2. TMI'ler çeşitli MOI'lerden sonuçlanabilir, ancak ağırlıklı olarak delici veya künt cisim travmasının sonucudur. Penetrasyon travmaları TMI'lerin küçük bir yüzdesini temsil eder ve yakın ve çevresindeki impaled beyin bölgelerine lokalize olan ciddi ve odaksal bir yaralanma oluşturur3. Buna karşılık, künt kuvvetli DTI'ler genel popülasyonda daha yaygındır, bir dizi şiddete (hafif, orta ve şiddetli) yayılır ve birden fazla beyin bölgesini etkileyen dağınık, heterojen ve küresel bir yaralanma üretir1,4,5.
Zebra balığı (Danio rerio), merkezi sinir sistemini (CNS) 6,7,8,9'a kadar kapsayan çok çeşitli nörolojik hakaretleri incelemek için kullanılmıştır. Zebra balığı ayrıca, memelilerin aksine, CNS hasarını onarmak için doğuştan gelen ve sağlam bir rejeneratif yanıta sahiptir10. Mevcut zebra balığı travma modelleri penetrasyon, eksizyon, kimyasal hakaret veya basınç dalgaları dahil olmak üzere çeşitli yaralanma yöntemleri kullanır11,12,13,14,15,16. Bununla birlikte, bu yöntemlerin her biri insan nüfusu tarafından nadiren yaşanan, çeşitli yaralanma şiddetlerinde ölçeklenebilir olmayan ve künt kuvvet TBI'dan sonra bildirilen heterojenliği veya şiddete bağlı TBI sekelini ele almayan bir MOI kullanır. Bu faktörler, insan popülasyonunda en yaygın TBI formuyla ilişkili patolojilerin altında kalan mekanizmaları anlamak için zebra balığı modelinin kullanımını sınırlar (hafif künt kuvvet yaralanmaları).
Yaralanma patolojisini, TBI sekelinin ilerlemesini ve doğuştan gelen rejeneratif yanıtı araştırmak için yollar sağlayan hızlı ve ölçeklenebilir kör kuvvette bir TBI zebra balığı modeli geliştirmeyi amaçladık. Yaygın olarak kullanılan kemirgen Marmarou17 ağırlık düşüşünü değiştirdik ve yetişkin zebra balıklarına uyguladık. Bu model, hafif, orta ve şiddetli arasında tekrarlanabilir bir önem aralığı sağlar. Bu model ayrıca insan TBI patolojisinin nöbetler, ödem, subdural ve intraserebral hematomlar, nöronal hücre ölümü ve öğrenme ve hafıza bozukluğu gibi bilişsel eksiklikler de dahil olmak üzere şiddete bağlı bir şekilde birden fazla yönünü rekapitulate eder. Yaralanmadan sonraki günler, patolojiler ve açıklar dağılır ve hasarsız kontrollere benzeyen seviyelere geri döner. Ek olarak, bu zebra balığı modeli, yaralanma şiddeti ile ilgili olarak nöroaksilerde sağlam bir çoğalma ve nöronal rejenerasyon yanıtı görüntüler.
Burada, künt cisim travmasının kurulumu ve indüksiyonu, travma sonrası nöbetlerin puanlanması, damar yaralanmalarının değerlendirilmesi, beyin bölümlerinin hazırlanmasına ilişkin talimatlar, ödemi ölçme yaklaşımları ve yaralanmadan sonraki proliferatif yanıt hakkında bilgi veriyoruz.
Protokol
Zebra balıkları, Freimann Yaşam Bilimleri Merkezi'ndeki Notre Dame Zebra balığı tesisinde yetiştirildi ve bakımı yapıldı. Bu yazıda açıklanan yöntemler Notre Dame Üniversitesi Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır.
1. Travmatik beyin hasarı paradigması
- 1 L sistem suyuna 1 mL 2-fenoksyethanol ekleyin (1 L deiyonize RO suyunda 60 mg Hazır Okyanus).
- Oda sıcaklığında 2 L sistem suyu içeren havalandırılmış bir geri kazanım tankı hazırlayın.
- Bilyalı rulmanın istenen ağırlığını ve çelik/plastik borunun istenen uzunluğunu ve çapını seçin ve enerji ve darbe kuvvetini belirleyin.
NOT: Boru, bilyalı rulmanın yolunu veya hareket hızını değiştirmeden geçmesini sağlayan bir iç çapa sahip olmalıdır.- Çarpma üzerine kinetik enerjiyi belirleyin:

Burada , KE = kinetik enerji, m = kütle (kg olarak), g = yerçekimsel kuvvet, h = yükseklik (m içinde) düşme noktasından balığa.
NOT: Bu, J.'de kinetik enerji sağlar mJ'yi belirlemek için değeri 1.000 ile çarpın. KE , bilyalı rulman sabit bir konumdan düşürüldüğünde ortaya çıkan hızlandırıcı bir nesneye dayanır. - Zebra balığı kafatasındaki plakanın 1,5 cm üzerinde (toplam mesafe 9,1 cm) ve 1,5 g (6,4 mm çapında) bilyalı rulman üzerinde biten 7,62 cm uzunluğunda çelik/plastik boru kullanarak hafif bir TBI (miTBI) oluşturun. Bunlar 1.33 mJ kinetik enerji üretir. Bu hasarın, damar hasarı, subdural/intraserebral hematom oluşumu, nöronal hücre ölümü ve insan popülasyonunda bildirilenleri büyük ölçüde şiddete bağlı bir şekilde nükseden bilişsel bozukluklar gibi temel patofizyolojik TBI belirteçlerine dayanan bir miTBI'ye eşdeğer olduğuna ampirik olarak karar verildi.
- Kinetik enerji miTBI = hesapla
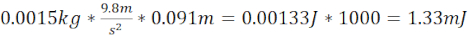
- Zebra balığı kafatasındaki plakadan 1,5 cm yukarıda biten 12,7 cm uzunluğunda çelik/plastik boru (toplam mesafe 14,2 cm) ve 2,08 mJ kinetik enerji üreten 1,5 g (6,4 mm çapında) bilyalı rulman kullanarak orta derecede bir TBI (moTBI) oluşturun.
- Kinetik enerji moTBI = hesaplayın
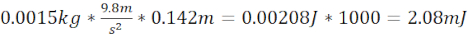
- Zebra balığı kafatasındaki plakadan 1,5 cm yukarıda biten 7,62 cm uzunluğunda çelik/plastik boru (toplam mesafe 9,1 cm) ve 2,94 mJ kinetik enerji üreten 3,3 g (8,38 mm çapında) bilyalı rulman kullanarak ciddi bir TBI (sTBI) oluşturun.
- Kinetik enerji sTBI = hesapla

- Çarpma üzerine kinetik enerjiyi belirleyin:
- Bir Petri kabını modelleme kili ile doldurun (Şekil 1, adım 1) ve ek modelleme kili (Şekil 1, adım 2) ile yükseltilmiş bir platform (5 cm x 1,5 cm) oluşturmak için kör bir alet (yani bir çift tokmak) kullanın.
- Yükseltilmiş platformu uzunlamasına yaklaşık iki eşit yarıya bölmek için bir jilet kullanın (Şekil 1, adım 3, kırmızı kesik çizgi). İki yarıyı yetişkin bir balığın uzunluğunu barındıran bir kanala dönüştürün (Şekil 1, adım 4). Balık vücudunun ~ 2/ 3'lerini sabitleyecek ve başı açıkta bırakacak duvarlar inşa etmek için ek kil kullanın.
- Başın yaralanma üzerine dönmesini veya geri tepmesini önlemek için başı desteklemek için duvarlara dik açık baş bölgesinde küçük bir destek kalıplama (Şekil 1, adım 4).
NOT: Kanal, balıkları dorsal-up pozisyonda destekleyecek kadar derin olmalı, ancak yine de başın çevredeki kilin üzerinde dinlenmesine izin vermelidir. Ek olarak, baş desteği balığın doğal eğriliğini takip etmeli, alt mandibula ve solungaçları desteklemelidir. - Düşen ağırlığın kanalın kenarları tarafından engellenmediğine emin olun (Şekil 1, adım 4).
- Mini delik delme ve 22 g çelik yanıp sönme kullanarak 3 mm çapında bir çelik disk oluşturun. Her disk birden çok kez kullanılabilir.
- Bir balığı, kuyruk kıskacına tepkisiz olana kadar 50-100 mL 1:1000 (1 mL/1 L, %0,1) 2-fenoksyethanol içeren bir kabın içine yerleştirerek uyuşturun.
- Balığı, dorsal tarafı yukarı, kanal içindeki kil kalıbına yerleştirin, böylece vücut yanlara sabitlenmiştir ve kafaya istenen darbe noktasının üzerine ortalanmış 3 mm 22 g çelik bir disk yerleştirin (Şekil 1, adım 5).
- Kafasının bir tarafa eğilmesini önlemek için balığın mümkün olduğunca dik bir şekilde hizalanarak düzensiz bir darbeye neden olduğundan emin olun.
- Çelik/plastik boruyu standart bir halka standı ve kol kelepçesi kullanarak sabitleyin, böylece borunun tabanı zebra balığının başının 1,5 cm üzerindedir (Şekil 1, adım 6). Borunun düz olduğundan emin olun.
- Boruya bakın ve borunun çelik plakanın üzerine hizalı olduğundan emin olun.
- Bilyalı rulmanı düşürün (hafif ve orta TBI için 1,5 g, ve şiddetli TBI için 3.3 g) önceden belirlenmiş bir yükseklikten (Adım 1.3.3-1.3.5'te açıklanmıştır) boruyu istenen nöroanatomik ilgi alanı üzerinde bulunan çelik plakaya (örneğin, beyincik, Şekil 1, adım 5) indirerek, istenen yaralanma şiddeti için kör kuvvette TBI üretmek için. Yaralı balıkları izlenecek bir kurtarma tankına yerleştirin.
NOT: Yaralanmanın şiddetine bağlı olarak mortalite veya tonik-klonik nöbetler meydana gelebilir. Balıklar TBI'ı takip eden uzun bir süre boyunca tepkisiz kalırsa, kuyruk sıkışması uygulamak ve ağrı yanıtı için değerlendirmek için bir transfer pipeti veya forseps kullanın.
2. Yetişkin zebra balıklarında TBI sonrası nöbetlerin puanlama
- Bölüm 1'de belirtilen yaralanma protokolüne göre balıkları uyuşturun ve yaralayın ve yaralı balıkları 2 L sistem suyundan oluşan havalandırılmış bir geri kazanım tankına yerleştirin.
- Kurtarma tankına yerleştirildikten hemen sonra başlayan travma sonrası nöbet belirtileri için balıkları gözlemleyin. Bir gözlem süresi (yani 1 saat) belirleyin ve nöbet skoru (aşağıda açıklanmıştır), her nöbetin süresi ve nöbet geçiren balıkların yüzdesi de dahil olmak üzere tüm nöbet aktivitelerini kaydedin (Şekil 2A).
NOT: Nöbetler yaralanmadan hemen sonra ve TBI sonrası saatler veya günler meydana gelebilir. Nöbetler uzun süre devam edebilir ve tek bir balık birden fazla nöbete sahip olabilir. 1 saat veya daha uzun bir gözlem süresi belirlemek, genel nöbet oranları eğiliminin iyi bir temsilini sağlayacaktır. - Yetişkin zebra balığı nöbet fenotipleri için Mussulini18 yönergelerini kullanarak balık puanlama.
NOT: İzleme yazılımını kullanmadan, 3'ün altındaki nöbet puanlarını tarafsız bir şekilde değerlendirmek zordur. Bu nedenle, değerlendirme yazılım olmadan yapılırken yalnızca 3 veya daha büyük nöbet puanları kaydedilmelidir.
3. Beyin diseksiyonu
- Balıkları 2 fenoksyethanol çözeltisinin 1:500 (2 mL/1 L, %0,2) çözeltisinde, solungaç hareketleri sona erene kadar ötenazileyin ve istenen uç noktada fin sıkışmasına tepkisizdirler.
- Bir Petri kabını modelleme kili ile doldurun ve diseksiyon sırasında vücudu desteklemek için küçük bir boşluk oluşturun.
- Balıkları, dorsal tarafı yukarı, kil kalıbına yerleştirin. Bir diseksiyon pimini balığın vücudunun yarısında orta çizgiden ve başın tabanının arkasına ~5 mm ikinci bir pim yerleştirin.
- Diseksiyonlu ışık mikroskobu altında, optik siniri bir çift #5 Dumont düsturla açıkça koparın ve gözleri çıkarın (Şekil 2A).
- Mikroskoptan bakıldığında rostral ucun en uzak olması için balığı yönlendirin (Şekil 2B).
NOT: Aşağıdaki adımlar sağ elini kullanan kişiler içindir. Solak bireyler aşağıdaki adımları yansıtılmış bir yönde gerçekleştirmeyi tercih edebilir. - Tosturların bir ucunun sağ parietal plakanın altına yavaşça yerleştirilmesi için #5 tokmak kullanın, rostral uca doğru hareket eden kasıtlı bir makas eylemi oluşturun ve sağ parietal ve ön plakaları çıkarın (Şekil 2C).
- Diseksiyon sırasında beyne nüfuz etmemek için toparlamaları 45° veya daha düşük bir açıda tutun.
- Balığı saat yönünde 90° döndürün. #5'lik ön uçların bir ucunun sol parietal plakanın altına yerleştirin ve beynin tüm dorsal yönünü açığa çıkaran sol parietal ve frontal plakaları çıkarmak için aynı makas hareketini kullanın (Şekil 2D, E).
- Maxilla'ya #5 toksip ile sertçe transect. Koku ampullerini koruyun ve ilgi çekici bir bölgeyse onlara zarar verme.
- #5 emişli doğru opercle, preopercle, interopercle ve subopercle'ı kaldırın (Şekil 2F).
- Kalvarium açıklığının kaudal ucundaki kasları #5ps kullanarak sert bir şekilde resecting, omuriliği açığa.
- Omuriliği #5ps ile açıkça transect. Beynin altına dikkatlice tokmak yerleştirin ve beyni yavaşça calvariumdan çıkarın.
NOT: Beyni asla çimdiklemedi. Beyni "beşik" etmek veya kaudally resect yapmak için asaları kullanın ve beyni manevra yapmak için açıkta kalan omuriliği bir tutam noktası olarak kullanın. - Çıkarılan beyinleri 9 parçada% 100 etanol ila 1 bölüm% 37 formaldehit bir rocker platformunda 4 ° C'de bir gecede sabitler.
4. Zebra balığı beyninde ödem çalışmaları
- Bölüm 1'de belirtilen yaralanma protokolüne göre balıkları uyuşturun ve yaralanın ve balıkların serbestçe yüzmeye başlayana kadar bir kurtarma tankında iyileşmesine izin verin.
- Balıkları 1 gün boyunca yaralanma sonrası normal barınma koşullarına geri yerleştirin.
- Zaman geçtikten sonra balığı 1:500 2-fenoksyethanol'da ötenazi edin.
- Bölüm 3'te belirtilen protokole göre tüm beyni veya ilgi çekici bölgeyi parçalara parçalar ve beyni hemen küçük bir tartım teknesine yerleştirin.
NOT: Beyni aktarırken, ince tokmaklar kullanarak beyni bıçaklamadan veya kazımadan tartım teknesine hafifçe yerleştirin, bu da doku kaybına neden olabilir. - Etiket (yaralanma grubu ve beyin numarası ile) ve bir ölçekte ek bir küçük kurutma tartım teknesini daralayın. Doğru bir ölçüm elde etmek için en az 0,001 g ölçme yeteneğine sahip bir ölçek kullanın.
- Beyni katranlı kurutma tartı teknesine aktarın ve beynin ıslak ağırlığını kaydedin. Beyinleri, sırt tarafı yukarı bakacak şekilde tartım teknesinde düz yatasınlar diye yönlendirin.
- Kurutma tartım teknesini ve beynini 8 saat boyunca 60 °C'ye ayarlanmış bir melezleme fırınına yerleştirin.
- Kuruduktan sonra, beyin kurutma tartı teknesine yapışabilir ve çıkarılması ve yeni bir katranlı küçük tartı teknesine aktarılması zor olabilir. Kuru beyinde hasara ve doku kaybına neden olabileceğinden, beyni tokmaklarla sıkıştırmaktan kaçının. Bunun yerine, ince asaları birbirine sıkıştırın ve beynin ventral tarafından başlayarak yukarı doğru bir hareketle kepçeleyin.
- Formülü kullanarak her beynin su içeriğini belirleyin (Şekil 4):
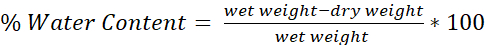
5. Nöroaksiler boyunca hücresel çoğalma etiketleme ve sabit doku hazırlama.
- 2 mL ddH2O'da 10 mM 5-etil-2'-deoksiyridin (EdU) hazırlayın.
- 1:1000'ün 50-100 mL'sinde (%1 mL/1 L, %0,1) 2-fenoksyethanol'da, yaralanmayı takiben istenen zaman noktasında (bölüm 1'de belirtilen protokolü kullanarak) bir seferde 3 ila 4 balığı uyuşturun.
- Islak bir sünger üzerinde kısmi bir kesi yapın ve açıklığa, ventral tarafa her seferinde bir balık yerleştirin.
- Balığın vücuduna ~40 μL 10 mM EdU enjekte etmek için 30 G iğne kullanın. Balıkları sistem suyuyla dolu bir tutma tankına geri verin.
NOT: Daha fazla sayıda çoğalan hücreyi etiketlemek için farklı zaman noktalarında tekrarlanan enjeksiyonlar yapılabilir ve 1 haftadan uzun bir kovalama süresi isteniyorsa gerekebilir. - Bölüm 3'te belirtildiği gibi beyinleri toplayın ve 9 parçanın 2 mL'sini içeren 5 mL'lik bir cam şişeye grup olarak yerleştirin% 100 etanol ila 1 bölüm% 37 formaldehit. Beyinleri 4 °C'de bir rocker platformunda sabitle.
NOT: Bir rocker veya shaker platformu, beyinlerin altta dinlenmesini ve tüm beyinlerin teleensefalonun kıvrılmalarını yasaklar. - Beyinleri, beyinleri düzeltmek için kullanılan aynı cam şişede, alçalan etanol serisinin yıkamalarında, her biri 15 dakika boyunca% 75, % 50 ve% 25 oranında yeniden sulayın, ardından oda sıcaklığında bir rocker üzerinde% 5 sakkaroz / PBS'de 1.5 h yıkama. Beyinleri bir gecede bir rocker platformunda 4° C'de% 30 sakkaroz / PBS'de bir cam şişede saklayın.
- Beyinleri% 30 sakkaroz / PBS'den çıkarın ve forseps ile 2 parça doku dondurma ortamından ve 1 bölüm% 30 sakkaroz / PBS'den oluşan 2:1 çözeltisi ile dolu kuyularla 12 kuyulu bir plakaya (kuyu başına bir tedavi grubu) aktarın. Beyinleri bir gecede 4 °C'de bir rocker platformunda kuluçkaya yatırın.
- 4 °C'de 2-24 saat boyunca %100 TFM'de beyinleri 12 kuyuya batırarak bir sonraki kuyu sırasına aktarın.
- Beyinleri TFM'ye kuru buzun üzerine istediğiniz yönde gömmek için kriyostat aynası kullanın.
- Kriyoseksiyon (16 μm kalınlığında bölümler) gerçekleştirin ve bölümleri pozitif yüklü slaytlarda toplayın. Slaytlar 1 saat boyunca bir slayt ısıtıcısı üzerinde kurulayın ve ardından -80 ° C'de saklayın veya immünhistokimya ile devam edin.
- Doku bölümlerinin etrafındaki kaydıranda hidrofobik bir bariyer hazırlayın ve 20 dakika boyunca bir slayt ısıtıcısı üzerinde kurumaya bırakın.
- Slaytları PBS'de 5 dakika ve ardından PBS-Tween 20'de (%0,05) iki kez 10 dakika boyunca kısaca yıkayın.
- EdU Hücre Çoğalma Kiti'ni ve üreticinin talimatlarını kullanarak EdU algılamasını gerçekleştirin.
- Slaytları analiz edin ve floresan EdU etiketli hücreleri epifluoresan mikroskop veya konfokal mikroskop kullanarak ölçün. Bireysel hücreleri net bir şekilde ayırt etmek için en az 40x hedef gerekecektir.
Sonuçlar
Yaralanma indüksiyon makinesinin hazırlanması, yetişkin zebra balıklarına ölçeklenebilir kör kuvvette bir TBI sunmanın hızlı ve basit bir yoluna olanak tanır. Yaralanma modelinin dereceli şiddeti, vasküler yaralanma en kolay ve en belirgin patolojilerden biri olmasına rağmen, kolayca tanımlanabilen başarılı yaralanma ölçümleri sağlar (Şekil 3). Yaralanma sırasında kullanılan balıkların suşu, bu göstergenin tanımlanmasını kolaylaştırabilir veya zorlaştı...
Tartışmalar
Nörotrauma ve ilişkili sekellerin araştırılması uzun zamandır geleneksel rejeneratif olmayan kemirgen modellerine odaklanmaktadır20. Sadece son zamanlarda çalışmalar rejeneratif modellere çeşitli CNS hasarı formları uyguladı9,11,13,14,21. Anlayışlı olsa da, bu modeller ya insan popülasyonunda nadiren görülen bir ya...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, Hyde laboratuvar üyelerine düşünceli tartışmaları için, zebra balığı bakımı ve bakımı için Freimann Yaşam Bilimleri Merkezi teknisyenlerine ve Notre Dame Üniversitesi Optik Mikroskopi Çekirdeği / NDIIF'e enstrümanların kullanımı ve hizmetleri için teşekkür eder. Bu çalışma Notre Dame Üniversitesi Zebra Balığı Araştırmaları Merkezi, Notre Dame Üniversitesi Kök Hücre ve Rejeneratif Tıp Merkezi tarafından desteklendi ve NIH R01-EY018417 Ulusal Göz Enstitüsü (DRH), Ulusal Bilim Vakfı Lisansüstü Araştırma Burs Programı (JTH), LTC Neil Hyland Notre Dame Bursu (JTH), Özgürlük Bursu Nöbetçileri (JTH) ve Pat Tillman Bursu (JTH).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-phenoxyethanol | Sigma Alderich | 77699 | |
| #00 buckshot | Remington | RMS23770 | 3.3g weight for sTBI |
| #3 buckshot | Remington | RMS23776 | 1.5g weight for miTBI/moTBI |
| #5 Dumont forceps | WPI | 14098 | |
| 5-ethynyl-2’-deoxyuridine | Life Technologies | A10044 | EdU |
| 5ml glass vial | VWR | 66011-063 | |
| Click-iT EdU Cell Proliferation Kit | Life Technologies | C10340 | |
| CytoOne 12-well plate | USA Scientific | CC7682-7512 | |
| Instant Ocean | Instant Ocean | SS15-10 | |
| Super frost postiviely charged slides | VWR | 48311-703 | |
| Super PAP Pen Liquid Blocker | Ted Pella | 22309 | |
| Tissue freezing medium | VWR | 15148-031 |
Referanslar
- Centers for Disease Control and Prevention. Surveillance Report of Traumatic Brain Injury-related Emergency Department Visits, Hospitalizations, and Deaths-United States, 2014. Centers for Disease Control and Prevention, U.S. Department of Health and Human Services. , (2019).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell transplantation. 26 (7), 1118-1130 (2017).
- Santiago, L. A., Oh, B. C., Dash, P. K., Holcomb, J. B., Wade, C. E. A clinical comparison of penetrating and blunt traumatic brain injuries. Brain injury. 26 (2), 107-125 (2012).
- Korley, F. K., Kelen, G. D., Jones, C. M., Diaz-Arrastia, R. Emergency department evaluation of traumatic brain injury in the United States, 2009-2010. The Journal of Head Trauma Rehabilitation. 31 (6), 379-387 (2016).
- Faul, M., Xu, L., Wald, M., Coronado, V. . Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths. , (2010).
- Campbell, L. J., et al. Notch3 and DeltaB maintain Müller glia quiescence and act as negative regulators of regeneration in the light-damaged zebrafish retina. Glia. 69 (3), 546-566 (2021).
- Green, L. A., Nebiolo, J. C., Smith, C. J. Microglia exit the CNS in spinal root avulsion. PLoS Biology. 17 (2), 3000159 (2019).
- Hentig, J., Byrd-Jacobs, C. Exposure to zinc sulfate results in differential effects on olfactory sensory neuron subtypes in the adult zebrafish. International Journal of Molecular Sciences. 17 (9), 1445 (2016).
- Ito, Y., Tanaka, H., Okamoto, H., Oshima, T. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum. Developmental Biology. 342 (1), 26-38 (2010).
- Becker, C., Becker, T. Adult zebrafish as a model for successful central nervous system regeneration. Restorative Neurology and Neuroscience. 26 (2-3), 71-80 (2008).
- Alyenbawwi, H., et al. Seizures are a druggable mechanistic link between TBI and subsequent tauopathy. eLife. 10, 58744 (2021).
- Kaslin, J., Kroehne, V., Ganz, J., Hans, S., Brand, M. Distinct roles of neuroepithelia-like and radial glia-like progenitor cells in cerebellar regeneration. Development. 144 (8), 1462-1471 (2017).
- McCutcheon, V., et al. A novel model of traumatic brain injury in adult zebrafish demonstrates response to injury and treatment comparable with mammalian models. Journal of Neurotrauma. 34 (7), 1382-1393 (2017).
- Skaggs, K., Goldman, D., Parent, J. Excitotoxic brain injury in adult zebrafish stimulates neurogenesis and long-distance neuronal integration. Glia. 62 (12), 2061-2079 (2014).
- Kishimoto, N., Shimizu, K., Sawamoto, K. Neuronal regeneration in a zebrafish model of adult brain injury. Disease Models & Mechanisms. 5 (2), 200-209 (2012).
- Kroehne, V., Freudenreich, D., Hans, S., Kaslin, J., Brand, M. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors. Development. 138 (22), 4831-4841 (2011).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Mussulini, B. H., et al. Seizures induced by pentylenetetrazole in the adult zebrafish: a detailed behavioral characterization. PloS One. 8 (1), 54515 (2013).
- Kalueff, A., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injuries. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. eLife. 5, 13998 (2016).
- Yamamoto, S., Levin, H., Prough, D. Mild, moderate and severe: terminology implications for clinical and experimental traumatic brain injury. Current Opinion in Neurology. 31 (6), 672-680 (2008).
- Lund, S., et al. Moderate traumatic brain injury, acute phase course and deviations in physiological variables: an observational study. Scandinavian Journal of Trauma Resuscitation and Emergency Medicine. 24, 77 (2016).
- Levin, H., Arrastia, R. Diagnosis, prognosis, and clinical management of mild traumatic brain injury. The Lancet Neurology. 14 (5), 506-517 (2015).
- Ruff, R. M., et al. Recommendations for diagnosing a mild traumatic brain injury: a National Academy of Neuropsychology education paper. Archives of Clinical Neuropsychology: The Official Journal of the National Academy of Neuropsychologists. 24 (1), 3-10 (2009).
- Ganz, J., Brand, M. Adult neurogenesis in fish. Cold Spring Harbor Perspectives in Biology. 8 (7), 019018 (2016).
- Grandel, H., Kaslin, J., Ganz, J., Wenzel, I., Brand, M. Neural stem cells and neurogenesis in the adult zebrafish brain: origin, proliferation dynamics, migration and cell fate. Developmental Biology. 295, 263-277 (2006).
- Lahne, M., Nagashima, M., Hyde, D. R., Hitchcock, P. F. Reprogramming Muller glia to regenerate retinal neurons. Annual Review of Visual Science. 6, 171-193 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır