Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle évolutif pour étudier les effets des blessures contondantes chez le poisson-zèbre adulte
Dans cet article
Résumé
Nous avons modifié le modèle de perte de poids de Marmarou pour le poisson-zèbre adulte afin d’examiner un large éventail de pathologies à la suite d’une lésion cérébrale traumatique (TCC) contondante et des mécanismes sous-jacents à la régénération neuronale ultérieure. Ce modèle de TCC à force contondante est évolutif, induit un TCC léger, modéré ou sévère et récapitule l’hétérogénéité des lésions observée dans le TCC humain.
Résumé
Les lésions cérébrales traumatiques contondantes (TCC) sont la forme la plus courante de traumatisme crânien, qui couvre une gamme de gravités et entraîne des effets secondaires complexes et hétérogènes. Bien qu’il n’y ait pas de mécanisme pour remplacer ou régénérer les neurones perdus à la suite d’un TCC chez l’homme, le poisson-zèbre possède la capacité de régénérer les neurones dans tout son corps, y compris le cerveau. Pour examiner l’étendue des pathologies présentées chez le poisson-zèbre à la suite d’un TCC contondant et pour étudier les mécanismes sous-jacents à la réponse régénérative neuronale ultérieure, nous avons modifié la perte de poids du rongeur Marmarou couramment utilisée pour l’utilisation chez le poisson-zèbre adulte. Notre modèle de TCC simple à force contondante est évolutif, induisant un TCC léger, modéré ou sévère, et récapitule de nombreux phénotypes observés après un TCC humain, tels que les crises de contact et post-traumatiques, l’œdème, les hématomes sous-duraux et intracérébraux et les troubles cognitifs, chacun affiché de manière dépendante de la gravité de la blessure. Les séquelles du TCC, qui commencent à apparaître dans les minutes qui suivent la blessure, disparaissent et reviennent à des niveaux de contrôle presque intacts dans les 7 jours suivant la blessure. Le processus de régénération commence dès 48 heures après la blessure (HPI), avec le pic de prolifération cellulaire observé par 60 hpi. Ainsi, notre modèle de TCC à force contondante du poisson-zèbre produit des pathologies de TCC primaires et secondaires caractéristiques similaires au TCC humain, ce qui permet d’étudier l’apparition et la progression de la maladie, ainsi que les mécanismes de régénération neuronale uniques au poisson-zèbre.
Introduction
Les lésions cérébrales traumatiques (TCC) sont une crise sanitaire mondiale et l’une des principales causes de décès et d’invalidité. Aux États-Unis, environ 2,9 millions de personnes subissent un TCC chaque année, et entre 2006 et 2014, la mortalité due à un TCC ou à des séquelles de TCC a augmenté de plus de 50 %1. Cependant, les traumatismes crâniens varient dans leur étiologie, leur pathologie et leur présentation clinique en grande partie en raison du mécanisme de blessure (MOI), qui influence également les stratégies de traitement et le pronostic prévu2. Bien que les traumatismes crâniens puissent résulter de divers MOI, ils sont principalement le résultat d’un traumatisme pénétrant ou contondant. Les traumatismes pénétrants représentent un faible pourcentage des traumatismes crâniens et génèrent une lésion grave et focale qui est localisée dans les régions immédiates et environnantes du cerveau empalé3. En revanche, les traumatismes crâniens à force contondante sont plus fréquents dans la population générale, couvrent une gamme de gravités (légères, modérées et graves) et produisent une lésion diffuse, hétérogène et globale affectant plusieurs régions du cerveau1,4,5.
Le poisson-zèbre (Danio rerio) a été utilisé pour examiner un large éventail d’insultes neurologiques couvrant le système nerveux central (SNC)6,7,8,9. Le poisson-zèbre possède également, contrairement aux mammifères, une réponse régénérative innée et robuste pour réparer les dommages causés au SNC10. Les modèles actuels de traumatisme du poisson-zèbre utilisent diverses méthodes de blessure, y compris la pénétration, l’excision, l’insulte chimique ou les ondes de pression11,12,13,14,15,16. Cependant, chacune de ces méthodes utilise un MOI qui est rarement vécu par la population humaine, n’est pas évolutif dans une gamme de gravités de blessures et ne traite pas de l’hétérogénéité ou de la séquelle dépendante de la gravité du TCC signalée après un TCC à force contondante. Ces facteurs limitent l’utilisation du modèle du poisson-zèbre pour comprendre les mécanismes sous-jacents des pathologies associées à la forme la plus courante de TCC dans la population humaine (blessures contondantes légères).
Nous avions pour objectif de développer un modèle de poisson-zèbre TBI à force contondante rapide et évolutif qui offre des moyens d’étudier la pathologie des blessures, la progression des séquelles du TCC et la réponse régénérative innée. Nous avons modifié la perte de poids du rongeur Marmarou17 couramment utilisée et l’avons appliquée au poisson-zèbre adulte. Ce modèle donne une gamme reproductible de gravités allant de légère, modérée à sévère. Ce modèle récapitule également de multiples facettes de la pathologie du TCC humain, en fonction de la gravité, y compris les convulsions, l’œdème, les hématomes sous-duraux et intracérébraux, la mort des cellules neuronales et les déficits cognitifs, tels que les troubles de l’apprentissage et de la mémoire. Quelques jours après la blessure, les pathologies et les déficits se dissipent, revenant à des niveaux ressemblant à des témoins non endommagés. De plus, ce modèle de poisson-zèbre montre une réponse robuste de prolifération et de régénération neuronale à travers le neuroaxe en ce qui concerne la gravité des blessures.
Ici, nous fournissons des détails sur la mise en place et l’induction des traumatismes contondants, la notation des crises post-traumatiques, l’évaluation des lésions vasculaires, des instructions sur la préparation des sections cérébrales, des approches pour quantifier l’œdème et un aperçu de la réponse proliférative après une blessure.
Protocole
Les poissons-zèbres ont été élevés et entretenus dans l’installation de poisson-zèbre de Notre Dame du Freimann Life Sciences Center. Les méthodes décrites dans ce manuscrit ont été approuvées par le Comité de soins et d’utilisation des animaux de l’Université de Notre Dame.
1. Paradigme de la lésion cérébrale traumatique
- Ajouter 1 mL de 2-phénoxyéthanol à 1 L d’eau système (60 mg d’Instant Ocean dans 1 L d’eau d’OI désionisée).
- Préparer un réservoir de récupération aéré contenant 2 L d’eau du système à température ambiante.
- Sélectionnez le poids souhaité du roulement à billes et la longueur et le diamètre souhaités des tubes en acier / plastique et déterminez l’énergie et la force d’impact.
REMARQUE: Le tube doit avoir un diamètre intérieur qui permet au roulement à billes de passer sans changer sa trajectoire ou sa vitesse de mouvement.- Déterminer l’énergie cinétique lors de l’impact :

Où, KE = énergie cinétique, m = masse (en kg), g = force gravitationnelle, h = hauteur (en m) du point de chute au poisson.
REMARQUE: Cela fournit de l’énergie cinétique dans J. Multipliez la valeur par 1 000 pour déterminer mJ. KE est basé sur un objet accélérant, qui se produit lorsque le roulement à billes est lâché d’une position stationnaire. - Générez un TCC léger (miTBI) à l’aide d’un tube en acier/plastique de 7,62 cm de long qui se termine à 1,5 cm au-dessus de la plaque sur le crâne du poisson-zèbre (distance totale de 9,1 cm) et d’un roulement à billes de 1,5 g (6,4 mm de diamètre). Ceux-ci produisent une énergie cinétique de 1,33 mJ. Ces dommages ont été empiriquement décidés comme étant équivalents à un MITBI basé sur des marqueurs physiopathologiques clés du TCC, tels que les lésions vasculaires, la formation d’hématome sous-dural / intracérébral, la mort des cellules neuronales et les troubles cognitifs qui récapitulaient en grande partie ce qui a été rapporté dans la population humaine d’une manière dépendante de la gravité.
- Calculer l’énergie cinétique miTBI =
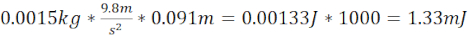
- Générez un TCC modéré (moTBI) à l’aide d’un tube en acier/plastique de 12,7 cm de long qui se termine à 1,5 cm au-dessus de la plaque sur le crâne du poisson-zèbre (distance totale de 14,2 cm) et d’un roulement à billes de 1,5 g (6,4 mm de diamètre) qui produit une énergie cinétique de 2,08 mJ.
- Calculer l’énergie cinétique moTBI =
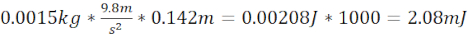
- Générez un TCC sévère (sTBI) à l’aide d’un tube en acier/plastique de 7,62 cm de long qui se termine à 1,5 cm au-dessus de la plaque sur le crâne du poisson-zèbre (distance totale de 9,1 cm) et d’un roulement à billes de 3,3 g (8,38 mm de diamètre) qui produit une énergie cinétique de 2,94 mJ.
- Calculer l’énergie cinétique sTBI =

- Déterminer l’énergie cinétique lors de l’impact :
- Remplissez une boîte de Petri avec de la pâte à modeler (Figure 1, étape 1) et utilisez un instrument contondant (c.-à-d. le dos d’une paire de pinces) pour créer une plate-forme surélevée (5 cm x 1,5 cm) avec de la pâte à modeler supplémentaire (Figure 1, étape 2).
- Utilisez une lame de rasoir pour diviser la plate-forme surélevée dans le sens de la longueur en deux moitiés approximativement égales (Figure 1, étape 3, ligne pointillée rouge). Formez les deux moitiés dans un chenal qui s’adapte à la longueur d’un poisson adulte (Figure 1, étape 4). Utilisez de l’argile supplémentaire pour construire des murs qui sécuriseront ~ 2/3 du corps du poisson, laissant la tête exposée.
- Mouler un petit support dans la région de la tête exposée perpendiculairement aux parois pour soutenir la tête afin d’éviter la rotation ou le recul de la tête en cas de blessure (Figure 1, étape 4).
REMARQUE: Le canal doit être assez profond pour soutenir le poisson en position dorsale, mais doit toujours permettre à la tête de reposer au-dessus de l’argile environnante. De plus, le support de la tête doit suivre la courbure naturelle du poisson, soutenant la mandibule inférieure et les branchies. - Assurez-vous que le poids perdu n’est pas gêné par les côtés du canal (Figure 1, étape 4).
- Créez un disque en acier de 3 mm de diamètre à l’aide d’un mini perforateur et d’un solin en acier de 22 g. Chaque disque peut être utilisé plusieurs fois.
- Anesthésiez un poisson en le plaçant dans un bécher avec 50 à 100 mL de 1:1000 (1 mL/1 L, 0,1%) de 2-phénoxyéthanol jusqu’à ce qu’il ne réponde plus au pincement de la queue.
- Placez le poisson, côté dorsal vers le haut, sur le moule en argile à l’intérieur du canal afin que le corps soit fixé sur les côtés et placez un disque en acier de 3 mm 22 g sur la tête, centré sur le point d’impact souhaité (Figure 1, étape 5).
- Assurez-vous que le poisson est aligné aussi perpendiculairement que possible pour éviter que sa tête ne s’incline d’un côté, ce qui pourrait causer un impact inégal.
- Fixez le tube en acier/plastique à l’aide d’un support d’anneau standard et d’une pince à bras, de sorte que le fond du tube soit à 1,5 cm au-dessus de la tête du poisson-zèbre (Figure 1, étape 6). Assurez-vous que le tube est droit.
- Regardez le tube et assurez-vous que le tube est aligné au-dessus de la plaque d’acier.
- Laisser tomber le roulement à billes (1,5 g pour les traumatismes crâniens légers et modérés et 3,3 g pour les traumatismes crâniens graves) d’une hauteur prédéterminée (décrite aux étapes 1.3.3 à 1.3.5) le long du tube sur la plaque d’acier située au-dessus de la région neuroanatomique d’intérêt souhaitée (p. ex., cervelet, figure 1, étape 5) pour produire le TCC à force contondante pour la gravité souhaitée de la blessure. Placez les poissons blessés dans un réservoir de récupération à surveiller.
REMARQUE: Selon la gravité de la blessure, la mortalité ou des crises tonico-cloniques peuvent survenir. Si les poissons ne répondent pas pendant une période prolongée après le TCC, utilisez une pipette de transfert ou une pince pour administrer un pincement de la queue et évaluer la réponse à la douleur.
2. Marquer les crises après le TCC chez le poisson-zèbre adulte
- Anesthésier et blesser les poissons conformément au protocole de blessure décrit à la section 1 et placer les poissons blessés dans un réservoir de récupération aéré de 2 L d’eau du système.
- Observez le poisson pour tout signe de crises post-traumatiques commençant immédiatement après avoir été placé dans le réservoir de récupération. Établissez une durée d’observation (c.-à-d. 1 h) et consignez toutes les activités de saisie, y compris le score de crise (décrit ci-dessous), la durée de chaque crise et le pourcentage de poissons qui ont subi des crises (figure 2A).
REMARQUE: Les convulsions peuvent survenir immédiatement après une blessure, ainsi que des heures ou des jours après le TCC. Les crises peuvent persister à long terme et un seul poisson peut avoir plusieurs crises. La fixation d’un temps d’observation de 1 h ou plus donnera une bonne représentation de la tendance globale des taux de saisies. - Évaluez les poissons à l’aide des lignes directrices Mussulini18 pour les phénotypes de saisie de poisson-zèbre adulte.
REMARQUE: Sans utiliser le logiciel de suivi, il est difficile d’évaluer les scores de crise inférieurs à 3 de manière impartiale. Par conséquent, seuls les scores de saisie de 3 ou plus doivent être enregistrés lorsque l’évaluation est effectuée sans logiciel.
3. Dissection cérébrale
- Euthanasier les poissons dans une solution de 2-phénoxyéthanol à 1:500 (2 mL/1 L, 0,2 %), jusqu’à ce que les mouvements des branchies cessent et qu’ils ne réagissent pas au pincement des nageoires, à l’extrémité souhaitée.
- Remplissez une boîte de Pétri avec de la pâte à modeler et créez une petite cavité pour soutenir le corps pendant la dissection.
- Placez le poisson, côté dorsal vers le haut, dans le moule en argile. Placez une broche de dissection à travers la ligne médiane à mi-chemin du corps du poisson et une deuxième broche ~ 5 mm derrière la base de la tête.
- Sous un microscope à lumière disséquante, coupez brutalement le nerf optique avec une paire de pinces Dumont #5 et retirez les yeux (Figure 2A).
- Orientez le poisson de manière à ce que l’extrémité rostrale soit la plus éloignée lorsque vous regardez au microscope (Figure 2B).
REMARQUE: Les étapes suivantes s’adressent aux droitiers. Les gauchers peuvent préférer effectuer les étapes suivantes dans une orientation en miroir. - Utilisez la pince #5 pour placer lentement une extrémité de la pince sous la plaque pariétale droite, en effectuant une action délibérée des ciseaux vers l’extrémité rostrale et en retirant les plaques pariétales et frontales droites (Figure 2C).
- Maintenez la pince à un angle de 45° ou moins afin d’éviter de pénétrer dans le cerveau pendant la dissection.
- Faites pivoter le poisson de 90° dans le sens des aiguilles d’une montre. Placez une extrémité de la pince #5 sous la plaque pariétale gauche et utilisez le même mouvement de ciseaux pour retirer les plaques pariétales et frontales gauches exposant tout l’aspect dorsal du cerveau (Figure 2D,E).
- Transectez brutalement le maxillaire avec une pince #5. Préservez les bulbes olfactifs et ne les endommagez pas si c’est la région d’intérêt.
- Retirez l’opercle, le préopercle, l’interopérecule et le sous-opératoire droits à l’aide de la pince n° 5 (Figure 2F).
- Réséquez brutalement la musculature à l’extrémité caudale de l’ouverture du calvarium à l’aide de la pince n ° 5, exposant la moelle épinière.
- Transectez brutalement la moelle épinière avec la pince n ° 5. Placez soigneusement les pinces sous le cerveau et retirez doucement le cerveau du calvarium.
REMARQUE: Ne pincez jamais le cerveau. Utilisez des pinces pour « bercer » le cerveau ou réséquer caudalement et utilisez la moelle épinière exposée comme point de pincement pour manœuvrer le cerveau. - Fixez les cerveaux retirés dans 9 parties 100% d’éthanol à 1 partie 37% de formaldéhyde pendant la nuit à 4 ° C sur une plate-forme à bascule.
4. Études sur l’œdème dans le cerveau du poisson-zèbre
- Anesthésier et blesser les poissons conformément au protocole de blessure décrit à la section 1 et permettre aux poissons de récupérer dans un aquarium de récupération jusqu’à ce qu’ils commencent à nager librement.
- Replacez les poissons dans les conditions normales de logement après la blessure pendant 1 jour.
- Euthanasier le poisson dans du 1:500 2-phénoxyéthanol, après que le temps se soit écoulé.
- Disséquez tout le cerveau ou la région d’intérêt selon le protocole décrit à la section 3 et placez le cerveau immédiatement sur un petit bateau de pesée.
REMARQUE: Soyez prudent lors du transfert du cerveau, en utilisant une pince fine pour le placer doucement sur le bateau de pesée sans poignarder ou gratter le cerveau, ce qui pourrait entraîner la perte de tissu. - Étiquetez (avec le groupe de blessure et le numéro de cerveau) et tarez un petit bateau de séchage supplémentaire sur une balance. Utilisez une balance capable de mesurer un minimum de 0,001 g pour obtenir une mesure précise.
- Transférez le cerveau sur le bateau de pesage de séchage goudronné et enregistrez le poids humide du cerveau. Orientez les cerveaux de manière à ce qu’ils reposent à plat sur le bateau de pesée avec la face dorsale vers le haut.
- Placez le bateau de pesée de séchage et le cerveau dans un four d’hybridation réglé à 60 °C pendant 8 h.
- Après séchage, le cerveau peut coller au bateau de pesée de séchage et peut être difficile à enlever et à transférer sur un nouveau petit bateau de pesage goudronné. Évitez de pincer le cerveau avec une pince, car cela pourrait entraîner des dommages au cerveau sec et une perte de tissu. Au lieu de cela, pincez les pinces fines ensemble et, en commençant par le côté ventral du cerveau, ramassez dans un mouvement ascendant.
- Déterminez la teneur en eau de chaque cerveau à l’aide de la formule (Figure 4) :
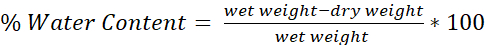
5. Marquage de la prolifération cellulaire à travers le neuroaxe et préparation des tissus fixes.
- Préparer 10 mM de 5-éthyynyl-2'-désoxyuridine (EdU) dans 2 mL de ddH2O.
- Anesthésier 3 à 4 poissons à la fois dans 50 à 100 mL de 1:1000 (1 mL/1 L, 0,1 %) 2-phénoxyéthanol jusqu’à ce que les poissons ne répondent plus au pincement de la queue, au moment souhaité après la blessure (en utilisant le protocole décrit à la section 1).
- Faites une incision partielle sur une éponge humide et placez un poisson à la fois dans l’ouverture, côté ventral vers le haut.
- Utilisez une aiguille de 30 G pour injecter environ 40 μL de 10 mM EdU dans le corps du poisson. Remettez le poisson dans un réservoir de rétention rempli d’eau du système.
REMARQUE: Des injections répétées peuvent être effectuées à différents moments pour étiqueter un plus grand nombre de cellules proliférantes et peuvent être nécessaires si une période de poursuite de plus de 1 semaine est souhaitée. - Recueillir les cerveaux comme indiqué à la section 3 et les placer en groupe dans un flacon en verre de 5 mL contenant 2 mL de 9 parties 100% éthanol à 1 partie 37% formaldéhyde. Fixez les cerveaux à 4 °C sur une plate-forme à bascule.
REMARQUE: Une plate-forme à bascule ou à secoueur interdit aux cerveaux de se reposer au fond et au télencéphale de cerveaux entiers de s’enrouler. - Réhydrater les cerveaux, dans le même flacon en verre utilisé pour fixer les cerveaux, dans des lavages de séries d’éthanol descendantes, 75%, 50% et 25%, pendant 15 minutes chacun, suivis d’un lavage de 1,5 h dans du saccharose / PBS à 5% sur une bascule à température ambiante. Conservez les cerveaux dans un flacon en verre pendant la nuit dans 30% de saccharose / PBS à 4 ° C sur une plate-forme à bascule.
- Retirer les cerveaux de 30% de saccharose / PBS et les transférer avec des pinces dans une plaque de 12 puits (un groupe de traitement par puits) avec des puits remplis d’une solution 2: 1 composée de 2 parties de milieu de congélation tissulaire et 1 partie de saccharose / PBS à 30%. Incuber les cerveaux pendant la nuit à 4 °C sur une plate-forme à bascule.
- Transférer les cerveaux à la rangée suivante de puits à l’intérieur de la plaque de 12 puits submergeant les cerveaux dans 100% TFM pendant 2-24 h à 4 ° C.
- Utilisez un mandrin cryostat pour intégrer les cerveaux dans TFM dans l’orientation souhaitée sur la glace carbonique.
- Effectuer la cryosection (sections de 16 μm d’épaisseur) et recueillir les sections sur des lames chargées positivement. Sécher les lames sur un chauffe-lames pendant 1 h, puis les conserver à -80 °C ou continuer avec l’immunohistochimie.
- Préparez une barrière hydrophobe sur la glissière autour des sections de tissu et laissez sécher sur un chauffe-lames pendant 20 min.
- Lavez brièvement les lames dans PBS pendant 5 minutes, puis deux fois dans PBS-Tween 20 (0,05%) pendant 10 minutes chacune.
- Effectuez la détection de l’EdU à l’aide du kit de prolifération de cellules EdU et des instructions du fabricant.
- Analysez les lames et quantifiez les cellules fluorescentes marquées EdU à l’aide d’un microscope épifluorescent ou d’un microscope confocal. Un objectif minimum de 40x sera nécessaire pour distinguer clairement les cellules individuelles.
Résultats
La préparation de la plate-forme d’induction des blessures permet un moyen rapide et simpliste de fournir un TCC à force contondante évolutive aux poissons-zèbres adultes. La gravité graduée du modèle de blessure fournit plusieurs mesures facilement identifiables de la blessure réussie, bien que la lésion vasculaire soit l’une des pathologies les plus faciles et les plus importantes (Figure 3). La souche de poisson utilisée pendant la blessure peut rendre cet indicateur plus fa...
Discussion
Les recherches sur le neurotraumatisme et les séquelles associées ont longtemps été centrées sur des modèles traditionnels de rongeurs non régénératifs20. Ce n’est que récemment que des études ont appliqué diverses formes de lésions du SNC à des modèles régénératifs9,11,13,14,21. Bien que perspicaces, ces modèles so...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier les membres du laboratoire Hyde pour leurs discussions réfléchies, les techniciens du Freimann Life Sciences Center pour les soins et l’élevage du poisson-zèbre, et le noyau de microscopie optique / NDIIF de l’Université de Notre Dame pour l’utilisation des instruments et de leurs services. Ce travail a été soutenu par le Center for Zebrafish Research de l’Université de Notre Dame, le Center for Stem Cells and Regenerative Medicine de l’Université de Notre Dame, et des subventions du National Eye Institute of NIH R01-EY018417 (DRH), du National Science Foundation Graduate Research Fellowship Program (JTH), du LTC Neil Hyland Fellowship of Notre Dame (JTH), Sentinels of Freedom Fellowship (JTH) et Pat Tillman Scholarship (JTH).
matériels
| Name | Company | Catalog Number | Comments |
| 2-phenoxyethanol | Sigma Alderich | 77699 | |
| #00 buckshot | Remington | RMS23770 | 3.3g weight for sTBI |
| #3 buckshot | Remington | RMS23776 | 1.5g weight for miTBI/moTBI |
| #5 Dumont forceps | WPI | 14098 | |
| 5-ethynyl-2’-deoxyuridine | Life Technologies | A10044 | EdU |
| 5ml glass vial | VWR | 66011-063 | |
| Click-iT EdU Cell Proliferation Kit | Life Technologies | C10340 | |
| CytoOne 12-well plate | USA Scientific | CC7682-7512 | |
| Instant Ocean | Instant Ocean | SS15-10 | |
| Super frost postiviely charged slides | VWR | 48311-703 | |
| Super PAP Pen Liquid Blocker | Ted Pella | 22309 | |
| Tissue freezing medium | VWR | 15148-031 |
Références
- Centers for Disease Control and Prevention. Surveillance Report of Traumatic Brain Injury-related Emergency Department Visits, Hospitalizations, and Deaths-United States, 2014. Centers for Disease Control and Prevention, U.S. Department of Health and Human Services. , (2019).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell transplantation. 26 (7), 1118-1130 (2017).
- Santiago, L. A., Oh, B. C., Dash, P. K., Holcomb, J. B., Wade, C. E. A clinical comparison of penetrating and blunt traumatic brain injuries. Brain injury. 26 (2), 107-125 (2012).
- Korley, F. K., Kelen, G. D., Jones, C. M., Diaz-Arrastia, R. Emergency department evaluation of traumatic brain injury in the United States, 2009-2010. The Journal of Head Trauma Rehabilitation. 31 (6), 379-387 (2016).
- Faul, M., Xu, L., Wald, M., Coronado, V. . Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths. , (2010).
- Campbell, L. J., et al. Notch3 and DeltaB maintain Müller glia quiescence and act as negative regulators of regeneration in the light-damaged zebrafish retina. Glia. 69 (3), 546-566 (2021).
- Green, L. A., Nebiolo, J. C., Smith, C. J. Microglia exit the CNS in spinal root avulsion. PLoS Biology. 17 (2), 3000159 (2019).
- Hentig, J., Byrd-Jacobs, C. Exposure to zinc sulfate results in differential effects on olfactory sensory neuron subtypes in the adult zebrafish. International Journal of Molecular Sciences. 17 (9), 1445 (2016).
- Ito, Y., Tanaka, H., Okamoto, H., Oshima, T. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum. Developmental Biology. 342 (1), 26-38 (2010).
- Becker, C., Becker, T. Adult zebrafish as a model for successful central nervous system regeneration. Restorative Neurology and Neuroscience. 26 (2-3), 71-80 (2008).
- Alyenbawwi, H., et al. Seizures are a druggable mechanistic link between TBI and subsequent tauopathy. eLife. 10, 58744 (2021).
- Kaslin, J., Kroehne, V., Ganz, J., Hans, S., Brand, M. Distinct roles of neuroepithelia-like and radial glia-like progenitor cells in cerebellar regeneration. Development. 144 (8), 1462-1471 (2017).
- McCutcheon, V., et al. A novel model of traumatic brain injury in adult zebrafish demonstrates response to injury and treatment comparable with mammalian models. Journal of Neurotrauma. 34 (7), 1382-1393 (2017).
- Skaggs, K., Goldman, D., Parent, J. Excitotoxic brain injury in adult zebrafish stimulates neurogenesis and long-distance neuronal integration. Glia. 62 (12), 2061-2079 (2014).
- Kishimoto, N., Shimizu, K., Sawamoto, K. Neuronal regeneration in a zebrafish model of adult brain injury. Disease Models & Mechanisms. 5 (2), 200-209 (2012).
- Kroehne, V., Freudenreich, D., Hans, S., Kaslin, J., Brand, M. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors. Development. 138 (22), 4831-4841 (2011).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Mussulini, B. H., et al. Seizures induced by pentylenetetrazole in the adult zebrafish: a detailed behavioral characterization. PloS One. 8 (1), 54515 (2013).
- Kalueff, A., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injuries. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. eLife. 5, 13998 (2016).
- Yamamoto, S., Levin, H., Prough, D. Mild, moderate and severe: terminology implications for clinical and experimental traumatic brain injury. Current Opinion in Neurology. 31 (6), 672-680 (2008).
- Lund, S., et al. Moderate traumatic brain injury, acute phase course and deviations in physiological variables: an observational study. Scandinavian Journal of Trauma Resuscitation and Emergency Medicine. 24, 77 (2016).
- Levin, H., Arrastia, R. Diagnosis, prognosis, and clinical management of mild traumatic brain injury. The Lancet Neurology. 14 (5), 506-517 (2015).
- Ruff, R. M., et al. Recommendations for diagnosing a mild traumatic brain injury: a National Academy of Neuropsychology education paper. Archives of Clinical Neuropsychology: The Official Journal of the National Academy of Neuropsychologists. 24 (1), 3-10 (2009).
- Ganz, J., Brand, M. Adult neurogenesis in fish. Cold Spring Harbor Perspectives in Biology. 8 (7), 019018 (2016).
- Grandel, H., Kaslin, J., Ganz, J., Wenzel, I., Brand, M. Neural stem cells and neurogenesis in the adult zebrafish brain: origin, proliferation dynamics, migration and cell fate. Developmental Biology. 295, 263-277 (2006).
- Lahne, M., Nagashima, M., Hyde, D. R., Hitchcock, P. F. Reprogramming Muller glia to regenerate retinal neurons. Annual Review of Visual Science. 6, 171-193 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon