このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
成虫ゼブラフィッシュにおける鈍力損傷の影響を研究するスケーラブルモデル
要約
私たちは、成人ゼブラフィッシュのマルマルー重量降下モデルを変更し、鈍力外傷性脳損傷(TBI)とその後の神経再生の基礎となるメカニズムに続く幅広い病理を調べた。この鈍力TBIモデルはスケーラブルであり、軽度、中等度、または重度のTBIを誘導し、ヒトTBIで観察された傷害の不均一性を再現する。
要約
鈍力外傷性脳損傷(TBI)は、重症の範囲に及び、複雑で異種の二次的な影響をもたらす頭部外傷の最も一般的な形態である。人間のTBIに続いて失われたニューロンを置き換えたり再生したりするメカニズムはありませんが、ゼブラフィッシュは脳を含む全身のニューロンを再生する能力を持っています。鈍い力TBIに続くゼブラフィッシュに示された病理の広さを調べ、その後の神経細胞再生応答の基礎となるメカニズムを研究するために、我々は成体ゼブラフィッシュで使用するために一般的に使用されるげっ歯類マルマルー重量降下を改変した。当社の単純な鈍力TBIモデルは、スケーラブルで、軽度、中等度、または重度のTBIを誘導し、接触および心的外傷後発作、浮腫、硬膜下および脳内血腫、認知障害など、ヒトTBIに続いて観察される表現型の多くを再現し、それぞれ傷害重症性に依存して表示されます。TBIの続編は、怪我の数分以内に現れ始め、治まり、怪我後7日以内に損傷を受けていない制御レベルに戻ります。再生プロセスは、早期に48時間の傷害後(hpi)を開始し、60 hpiによってピーク細胞増殖が観察される。したがって、当社のゼブラフィッシュ鈍力TBIモデルは、ヒトTBIと同様の特徴的な一次および二次傷害TBI病理を産生し、ゼブラフィッシュに特有の神経再生のメカニズムと共に、疾患の発症および進行を調査することを可能にする。
概要
外傷性脳損傷(TTB)は、世界的な健康危機であり、死亡および障害の主要な原因です。米国では、毎年約290万人がTBIを経験し、2006年から2014年の間にTBIまたはTBIの後遺による死亡率は50%以上増加しました。しかし、TISは、治療戦略や予後予測に影響を与える傷害のメカニズム(MOI)の一部に大きく起因する病因、病理、および臨床提示が異なる。TIは様々なMOIから生じる可能性がありますが、主に貫通性または鈍い力の外傷の結果です。貫通性外傷は、TIのごく一部を表し、即時および周囲の衝突脳領域3に局在する重度および焦点損傷を生成する。対照的に、鈍力TISは、一般集団でより一般的であり、重症の範囲(軽度、中等度、重度)にまたがり、複数の脳領域に影響を与える拡散、異種、および世界的傷害を生じる1,4,5。
ゼブラフィッシュ(Danio rerio)は、中枢神経系(CNS)6,7,8,9に及ぶ広範な神経学的侮辱を調べるために利用されてきた。ゼブラフィッシュはまた、哺乳類とは異なり、CNS損傷を修復するための先天的かつ堅牢な回生応答を有する10。現在のゼブラフィッシュ外傷モデルは、浸透、切除、化学的侮辱、または圧力波11,12,13,14,15,16を含む様々な傷害方法を使用しています。しかしながら、これらの各方法は、ヒト集団がめったに経験しないMOIを利用し、傷害の重大性の範囲にわたってスケーラブルではなく、鈍力TBI後に報告された不均一性または重症度依存性TBIの後遺症に対処しない。これらの要因は、ヒト集団におけるTBIの最も一般的な形態(軽度の鈍い力損傷)に関連する病理の根本的なメカニズムを理解するためにゼブラフィッシュモデルの使用を制限する。
我々は、傷害病理、TBI後遺の進行、および先天的な再生応答を調査する道を提供する、迅速かつスケーラブルな鈍力TBIゼブラフィッシュモデルを開発することを目指した。私たちは、一般的に使用されるげっ歯類Marmarou17 重量低下を変更し、成体ゼブラフィッシュに適用しました。このモデルは、軽度から中程度、重度まで、再現可能な範囲の重症度を生み出します。このモデルはまた、発作、浮腫、硬膜下および脳内血腫、神経細胞死、および学習および記憶障害などの認知障害を含む重症度依存的な方法で、ヒトTBI病理の複数の側面を再現する。怪我の数日後、病理および欠損は消散し、損傷を受けていないコントロールに似たレベルに戻る。さらに、このゼブラフィッシュモデルは、傷害重症度に関する神経軸全体にわたる堅牢な増殖および神経再生応答を示す。
ここでは、鈍い力外傷の設定と誘導、外傷後発作の採点、血管損傷の評価、脳切片の準備に関する指示、浮腫を定量化するアプローチ、および傷害後の増殖反応に関する洞察に向けた詳細を提供する。
プロトコル
ゼブラフィッシュは、フライマン生命科学センターのノートルダム・ゼブラフィッシュ施設で飼育されました。この原稿に記載されている方法は、ノートルダム大学動物のケアと使用委員会によって承認されました.
1. 外傷性脳損傷パラダイム
- 1 Lのシステム水(脱イオン化RO水の1 Lで60mgのインスタントオーシャン)に2-フェノキシエタノールを1 mL加えます。
- 室温で2Lのシステム水を含む気泡回収タンクを準備します。
- ボールベアリングの所望の重量と鋼/プラスチックチューブの所望の長さと直径を選択し、エネルギーと衝撃力を決定します。
注:チューブは、ボールベアリングがパスや移動速度を変更せずに通過することを可能にする内径を持っている必要があります。- 衝撃時の運動エネルギーを決定します。

ここで、 KE =運動エネルギー、 m =質量(kg)、 g =重力、 h =高さ(m)はドロップポイントから魚へ。
注: これは J. mJ を決定するために値に 1,000 を掛ける運動エネルギーを提供します。 KE は、ボールベアリングが静止位置から落とされたときに発生する加速物体に基づいています。 - ゼブラフィッシュの頭蓋骨のプレートの上に1.5cm(全距離9.1cm)と1.5g(直径6.4mm)のボールベアリングを終了する長さ7.62cmのスチール/プラスチックチューブを使用して、穏やかなTBI(miTBI)を生成します。これらは1.33 mJの運動エネルギーを生成する。この損傷は、血管損傷、硬膜下/脳内血腫形成、神経細胞死、およびヒト集団で報告されたものを重症度依存的に大部分再現した認知障害などの主要な病態生理学的TBIマーカーに基づくmiTBIと同等であると経験的に決定された。
- 運動エネルギー miTBI を計算する =
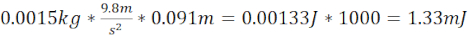
- ゼブラフィッシュの頭蓋骨のプレート上の1.5cm(全距離14.2cm)の長さ1.5cmのスチール/プラスチックチューブと、2.08mJの運動エネルギーを生成する1.5g(直径6.4mm)のボールベアリングを使用して、適度なTBI(moTBI)を生成します。
- 運動エネルギー moTBI を計算する =
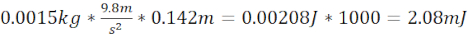
- ゼブラフィッシュの頭蓋骨のプレートの上に1.5cm(全距離9.1cm)の長さ7.5cmの鋼/プラスチックチューブを使用して、2.94mJの運動エネルギーを生成する3.3g(直径8.38mm)のボールベアリングを使用して、重度のTBI(sTBI)を生成します。
- 運動エネルギー sTBI を計算する =

- 衝撃時の運動エネルギーを決定します。
- ペトリ皿にモデリングクレイ(図1、ステップ1)を充填し、鈍い楽器(すなわち、鉗子の背面)を使用して、追加のモデリングクレイ(図1、ステップ2)で隆起したプラットフォーム(5cm x 1.5 cm)を作成します。
- カミソリのブレードを使用して、上げられたプラットフォームを縦に 2 つのほぼ等しい半分に分割します (図 1、ステップ 3、赤い破線)。2つの半分を成魚の長さに合うチャネルに形成します(図1、ステップ4)。追加の粘土を使用して、魚の体の〜2/3を固定し、頭を露出させたままにする壁を構築します。
- 壁に垂直に露出した頭部領域に小さな支持体を成形し、損傷時に頭部の回転や反動を避けるために頭を支える(図1、ステップ4)。
注:チャネルは、後回しの位置で魚をサポートするのに十分な深さでなければなりませんが、それでも頭が周囲の粘土の上に休むことを許可する必要があります。さらに、ヘッドサポートは、下顎下およびエラを支える魚の自然な湾曲に従う必要があります。 - ドロップされた重みがチャネルの側面によって妨げられないようにします(図 1、ステップ 4)。
- ミニホールパンチと22 gのスチールフラッシュを使用して、直径3mmのスチールディスクを作成します。各ディスクは複数回使用できます。
- 1匹の魚を1:1000(1 mL/1 L,0.1%)の50-100mLでビーカーに入れ、尾ピンチに反応しなくなるまで2フェノキシエタノールを麻酔します。
- 魚、後側を上に、粘土の型をチャネル内に置き、本体が側面に固定され、3mm 22gのスチールディスクをヘッドに配置し、所望の衝撃点を中心にします(図1、ステップ5)。
- 魚が頭が片側に傾くのを避けるためにできるだけ垂直に整列し、不均一な衝撃を引き起こす可能性があることを確認してください。
- 標準的なリングスタンドとアームクランプを使用してスチール/プラスチックチューブを固定し、チューブの底部がゼブラフィッシュの頭の上に1.5cmになるようにします(図1、ステップ6)。チューブがまっすぐであることを確認します。
- チューブを見下ろし、チューブが鋼板の上に揃っていることを確認します。
- ボールベアリング(軽度および中等度のTBIの場合は1.5 g、重度のTBIの場合は3.3 g)を所定の高さ(ステップ1.3.3-1.3.5で説明)から、所望の神経解剖学的領域(例えば、小脳、図1、ステップ5)上に位置する鋼板にチューブを下に落とし(例えば、小脳、 図1、ステップ5)、 所望の重症度に対する鈍い力TBIを生成する。負傷した魚を監視する回復タンクに入れます。
注:傷害の重症度によっては、死亡率または強壮性クロニック発作が起こることがあります。TBIに続いて魚が長期間反応しない場合は、移管ピペットまたは鉗子を使用してテールピンチを投与し、痛みの反応を評価します。
2. 成人ゼブラフィッシュにおけるTBI後のスコアリング
- セクション1に概説されている傷害プロトコルに従って魚を麻酔し、傷付き、負傷した魚をシステム水の2 Lの気泡回収タンクに入れます。
- 回復タンクに入れられた直後に始まる心的外傷後発作の兆候について魚を観察してください。観察時間(すなわち、1時間)を設定し、発作スコア(後述)、各発作の持続時間、および発作を経験した魚の割合を含むすべての発作活動を記録する(図2A)。
注:発作は、傷害時だけでなく、TBI後の時間または日にすぐに発生する可能性があります。発作は長期間持続し、単一の魚は複数の発作を持つことができます。観察時間を1時間以上に設定すると、発作率の全体的な傾向を良好に表現できます。 - 大人のゼブラフィッシュの発作のフェノタイプのためのMussulini18ガイドラインを使用して魚をスコア。
注:トラッキングソフトウェアを使用しないと、3未満の発作スコアを公平に評価することは困難です。したがって、評価をソフトウェアなしで実行する場合は、3以上の発作スコアのみを記録する必要があります。
3. 脳解剖
- 2-フェノキシエタノールの1:500(2 mL/1 L、0.2%)溶液で魚を安楽死させ、ギルの動きが止まるまで、そして彼らは望ましいエンドポイントでフィンピンチに反応しない。
- ペトリ皿をモデリング粘土で満たし、解剖中に体を支えるために小さな空洞を作成します。
- 粘土の型に魚、裏側を上に置きます。魚の体の途中で中線を通して1つの解剖ピンを置き、2番目のピンは頭の基部の後ろに5mm以上置きます。
- 解剖光顕微鏡の下で、#5デュモン鉗子のペアで視神経をぶっきらぼうに切断し、目を取り除く(図2A)。
- 顕微鏡を見ながら、ロストラルの端が最も遠いように魚の向きを付ける(図2B)。
注: 次の手順は、右利きの個人向けです。左利きの個人は、鏡面の向きで次の手順を実行することを好む場合があります。 - #5鉗子を使用して、鉗子の一方の端をゆっくりと右頭頂板の下に置き、下地に向かって意図的にはさみ作用を行い、右頭頂板と前頭板を取り除きます(図2C)。
- 解剖中に脳を貫通しないように、鉗子を45°以下の角度に保ちます。
- 魚を時計回りに90°回転させます。#5鉗子の一端を左頭頂板の下に置き、同じシザーモーションを使用して、脳の裏側面全体を露出させる左頭頂板と前頭板を取り除きます(図2D,E)。
- #5鉗子で上顎をぶっきらぼうにトランセクトします。嗅球を保持し、これが関心のある領域である場合は、それらを損傷しないでください。
- #5 鉗子で右のオーペルクル、前耳、相互運用機能、およびサブパートを取り除きます(図 2F)。
- #5鉗子を使用してカルバリウム開口部の尾部端で筋肉を鈍く切除し、脊髄を露出させる。
- #5鉗子で脊髄をぶっきらぼうにトランセクトする。慎重に脳の下に鉗子を配置し、穏やかにカルバリウムから脳を除去します。
注:決して脳をつまむ。鉗子を使って脳を「揺りかご」にしたり、切除したりして、露出した脊髄をピンチポイントとして利用して脳を操縦します。 - 取り外した脳を9部100%エタノールで1部37%ホルムアルデヒドに1部固定し、ロッカープラットフォーム上で4°Cで一晩で修正します。
4. ゼブラフィッシュ脳における浮腫研究
- セクション1に概説されている傷害プロトコルに従って魚を麻酔し、怪我をさせ、魚が自由に泳ぎ始めるまで回復タンクで回復できるようにします。
- 1日間の通常の住宅条件で魚を置きます。
- 時間が経過した後、1:500 2-フェノキシエタノールで魚を安楽死させます。
- セクション3で概説されているプロトコルに従って脳全体または関心領域を解剖し、小さな計量ボートの上にすぐに脳を置く。
注:脳を移す際は、細かい鉗子を使って脳を刺したり掻いたりすることなく、体重のボートに優しく置き、組織を失う可能性があります。 - ラベル(傷害群および脳番号を有する)およびタンはスケールでボートを重量を量る追加の小さい乾燥を量る。正確な測定を得るために最低0.001 gを測定する能力を持つスケールを使用しなさい。
- タール乾燥重量ボートに脳を移し、脳の濡れた重量を記録する。彼らは後ろ側を上に向けて計量ボートに平らに横たわるように脳の向きを合わせた。
- 乾燥重量のボートと脳を60°Cに設定したハイブリダイゼーションオーブンに8時間置きます。
- 乾燥後、脳は乾燥重量ボートに固執し、取り外し、新しいタール小重量船に移すのが難しい場合があります。これは、乾燥した脳への損傷や組織の損失をもたらす可能性があるため、鉗子で脳をつまむのを避けてください。代わりに、細かい鉗子を一緒につまみ、脳の腹側から始めて、上向きの動きですくいます。
- 式を使用して各脳の水分量を決定します(図4)。
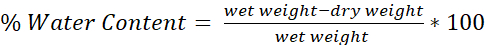
5. 神経軸全体で細胞増殖を標識し、固定組織を準備する。
- ddH2Oの2 mLで10 mM 5-エチニル-2'デオキシウリジン(EdU)を準備します。
- 1:1000(1 mL/1 L,0.1%)の50~100mLで一度に3~4匹の魚を麻酔し、魚が尾ピンチに反応しなくなるまで2-フェノキシエタノールを、損傷後の所望の時点で(セクション1に概説したプロトコルを使用)
- 濡れたスポンジに部分的な切開を行い、開口部に一度に1匹の魚を置き、腹側を上に置きます。
- 魚の体に10 mM EdUの〜40 μLを注入するために30 G針を使用してください。魚をシステム水で満たされた保持タンクに戻します。
注:繰り返し注射は、増殖細胞の数を多くラベル付けするために異なる時点で実行され、1週間を超える追跡期間が望まれる場合に必要になることがあります。 - セクション3で概説されているように脳を収集し、9部の2 mLを含む5mLガラスバイアルにグループとして配置します 100% エタノール 17% ホルムアルデヒド.ロッカープラットフォーム上の4°Cで脳を固定します。
注:ロッカーやシェーカープラットフォームは、脳が底部に休み、脳全体の脳全体のテレンシアロンがカールするのを禁止します。 - 脳を水分補給し、脳を固定するために使用される同じガラスバイアルで、降順エタノールシリーズの洗浄で、75%、50%、および25%、それぞれ15分間、室温でロッカー上の5%スクロース/PBSで1.5時間洗浄する。ロッカープラットフォーム上の4°Cで30%スクロース/PBSで一晩ガラスバイアルに脳を保管してください。
- 30%スクロース/PBSから脳を取り除き、2つの部分組織凍結媒体と1部30%スクロース/PBSからなる2:1溶液で満たされた井戸で満たされた12ウェルプレート(ウェルあたり1つの治療グループ)に鉗子でそれらを移す。ロッカープラットフォーム上の4°Cで一晩脳をインキュベートします。
- 4°Cで2〜24時間100%TFMで脳を12ウェルプレート没入脳内の井戸の次の行に脳を移す。
- クライオスタットチャックを使用して、ドライアイス上の所望の向きでTFMに脳を埋め込みます。
- 凍結切断(16 μm厚いセクション)を実行し、正に帯電したスライド上のセクションを収集します。スライドウォーマー上のドライスライドを1時間スライドし、-80°Cで保存するか、免疫検査を継続します。
- 組織切片の周りのスライドに疎水性バリアを準備し、スライドウォーマーで20分間乾燥させます。
- スライドをPBSで5分間短く洗い、PBS-Tween 20(0.05%)でそれぞれ10分間2回洗浄します。
- EdU細胞増殖キットとメーカーの指示を使用して、EdU検出を実行します。
- スライドを分析し、蛍光性のEdU標識細胞を、蛍光顕微鏡または共焦点顕微鏡を用いて定量化します。個々の細胞を明確に区別するには、最低40倍の目標が必要です。
結果
傷害誘導リグを準備することで、大人のゼブラフィッシュにスケーラブルな鈍力TBIを提供する迅速かつ単純な手段が可能になります。傷害モデルの等級重症度は、血管損傷が最も簡単で最も顕著な病理の1つであるが、成功した傷害のいくつかの容易に識別可能な指標を提供する(図3)。怪我の間に使用される魚の株は、この指標を識別しやすくしたり、識別するのが難し...
ディスカッション
神経外傷および関連する後遺症の調査は、長い間、伝統的な非再生げ歯類モデル20を中心としてきた。最近になってようやく、再生モデル9,11,13,14,21に様々な形態のCNS損傷を適用した研究が行なわれます。洞察力はありますが、これらのモデルは、人間?...
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、ハイドラボのメンバーが思慮深い議論をしてくれたことに感謝し、ゼブラフィッシュケアと畜産のためのフライマンライフサイエンスセンターの技術者、およびノートルダム大学光学顕微鏡コア/NDIIFが機器とそのサービスを使用してくれたことに感謝したいと考えています。この研究は、ノートルダム大学ノートルダム大学ゼブラフィッシュ研究センター、ノートルダム大学幹細胞再生医療センター、国立科学財団大学院研究フェローシッププログラム(JTH)NIH R01-EY018417(DRH)の国立眼科研究所からの助成金によって支援されました。 自由フェローシップのセンチネル(JTH)とパット・ティルマン奨学金(JTH)。
資料
| Name | Company | Catalog Number | Comments |
| 2-phenoxyethanol | Sigma Alderich | 77699 | |
| #00 buckshot | Remington | RMS23770 | 3.3g weight for sTBI |
| #3 buckshot | Remington | RMS23776 | 1.5g weight for miTBI/moTBI |
| #5 Dumont forceps | WPI | 14098 | |
| 5-ethynyl-2’-deoxyuridine | Life Technologies | A10044 | EdU |
| 5ml glass vial | VWR | 66011-063 | |
| Click-iT EdU Cell Proliferation Kit | Life Technologies | C10340 | |
| CytoOne 12-well plate | USA Scientific | CC7682-7512 | |
| Instant Ocean | Instant Ocean | SS15-10 | |
| Super frost postiviely charged slides | VWR | 48311-703 | |
| Super PAP Pen Liquid Blocker | Ted Pella | 22309 | |
| Tissue freezing medium | VWR | 15148-031 |
参考文献
- Centers for Disease Control and Prevention. Surveillance Report of Traumatic Brain Injury-related Emergency Department Visits, Hospitalizations, and Deaths-United States, 2014. Centers for Disease Control and Prevention, U.S. Department of Health and Human Services. , (2019).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell transplantation. 26 (7), 1118-1130 (2017).
- Santiago, L. A., Oh, B. C., Dash, P. K., Holcomb, J. B., Wade, C. E. A clinical comparison of penetrating and blunt traumatic brain injuries. Brain injury. 26 (2), 107-125 (2012).
- Korley, F. K., Kelen, G. D., Jones, C. M., Diaz-Arrastia, R. Emergency department evaluation of traumatic brain injury in the United States, 2009-2010. The Journal of Head Trauma Rehabilitation. 31 (6), 379-387 (2016).
- Faul, M., Xu, L., Wald, M., Coronado, V. . Traumatic Brain Injury in the United States: Emergency Department Visits, Hospitalizations and Deaths. , (2010).
- Campbell, L. J., et al. Notch3 and DeltaB maintain Müller glia quiescence and act as negative regulators of regeneration in the light-damaged zebrafish retina. Glia. 69 (3), 546-566 (2021).
- Green, L. A., Nebiolo, J. C., Smith, C. J. Microglia exit the CNS in spinal root avulsion. PLoS Biology. 17 (2), 3000159 (2019).
- Hentig, J., Byrd-Jacobs, C. Exposure to zinc sulfate results in differential effects on olfactory sensory neuron subtypes in the adult zebrafish. International Journal of Molecular Sciences. 17 (9), 1445 (2016).
- Ito, Y., Tanaka, H., Okamoto, H., Oshima, T. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum. Developmental Biology. 342 (1), 26-38 (2010).
- Becker, C., Becker, T. Adult zebrafish as a model for successful central nervous system regeneration. Restorative Neurology and Neuroscience. 26 (2-3), 71-80 (2008).
- Alyenbawwi, H., et al. Seizures are a druggable mechanistic link between TBI and subsequent tauopathy. eLife. 10, 58744 (2021).
- Kaslin, J., Kroehne, V., Ganz, J., Hans, S., Brand, M. Distinct roles of neuroepithelia-like and radial glia-like progenitor cells in cerebellar regeneration. Development. 144 (8), 1462-1471 (2017).
- McCutcheon, V., et al. A novel model of traumatic brain injury in adult zebrafish demonstrates response to injury and treatment comparable with mammalian models. Journal of Neurotrauma. 34 (7), 1382-1393 (2017).
- Skaggs, K., Goldman, D., Parent, J. Excitotoxic brain injury in adult zebrafish stimulates neurogenesis and long-distance neuronal integration. Glia. 62 (12), 2061-2079 (2014).
- Kishimoto, N., Shimizu, K., Sawamoto, K. Neuronal regeneration in a zebrafish model of adult brain injury. Disease Models & Mechanisms. 5 (2), 200-209 (2012).
- Kroehne, V., Freudenreich, D., Hans, S., Kaslin, J., Brand, M. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors. Development. 138 (22), 4831-4841 (2011).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Mussulini, B. H., et al. Seizures induced by pentylenetetrazole in the adult zebrafish: a detailed behavioral characterization. PloS One. 8 (1), 54515 (2013).
- Kalueff, A., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injuries. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. eLife. 5, 13998 (2016).
- Yamamoto, S., Levin, H., Prough, D. Mild, moderate and severe: terminology implications for clinical and experimental traumatic brain injury. Current Opinion in Neurology. 31 (6), 672-680 (2008).
- Lund, S., et al. Moderate traumatic brain injury, acute phase course and deviations in physiological variables: an observational study. Scandinavian Journal of Trauma Resuscitation and Emergency Medicine. 24, 77 (2016).
- Levin, H., Arrastia, R. Diagnosis, prognosis, and clinical management of mild traumatic brain injury. The Lancet Neurology. 14 (5), 506-517 (2015).
- Ruff, R. M., et al. Recommendations for diagnosing a mild traumatic brain injury: a National Academy of Neuropsychology education paper. Archives of Clinical Neuropsychology: The Official Journal of the National Academy of Neuropsychologists. 24 (1), 3-10 (2009).
- Ganz, J., Brand, M. Adult neurogenesis in fish. Cold Spring Harbor Perspectives in Biology. 8 (7), 019018 (2016).
- Grandel, H., Kaslin, J., Ganz, J., Wenzel, I., Brand, M. Neural stem cells and neurogenesis in the adult zebrafish brain: origin, proliferation dynamics, migration and cell fate. Developmental Biology. 295, 263-277 (2006).
- Lahne, M., Nagashima, M., Hyde, D. R., Hitchcock, P. F. Reprogramming Muller glia to regenerate retinal neurons. Annual Review of Visual Science. 6, 171-193 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved