Method Article
مقايسة مضان لتقييم نفاذية الحاجز البطاني القلبي الوعائي الدقيق في نموذج الفئران لنقص التروية / إعادة التروية
* These authors contributed equally
In This Article
Summary
هنا ، نصف طريقة لتقييم الحاجز البطاني للأوعية الدقيقة القلبية وظيفيا بعد إصابة نقص التروية / إعادة التروية من خلال قياس متوسط شدة التألق ل 70,000 Da FITC-dexterrn المتسرب مقارنة ب Evans Blue.
Abstract
تعتبر علاجات إعادة التوعي للشرايين الجناة ، بغض النظر عن التدخل التاجي عن طريق الجلد وتطعيم مجازة الشريان التاجي ، أفضل استراتيجية لتحسين التشخيص السريري للمرضى الذين يعانون من متلازمة الشريان التاجي الحادة (ACS). ومع ذلك ، يمكن أن يؤدي إعادة تروية عضلة القلب بعد إعادة التوعي الفعالة إلى موت كبير لخلايا عضلة القلب وانهيار بطانة الشريان التاجي ، والمعروف باسم إقفار عضلة القلب / إصابة إعادة التروية (MIRI). عادة ، تحافظ الخلايا البطانية وتوصلاتها الضيقة بين الخلايا بشكل تعاوني على الحاجز البطاني للأوعية الدموية الدقيقة ونفاذيته المنخفضة نسبيا ولكنها تفشل في مناطق إعادة التروية.
يساهم فرط نفاذية بطانة الأوعية الدموية الدقيقة الناجم عن نقص التروية / إعادة التروية (IR) في وذمة عضلة القلب ، وزيادة تسلل الخلايا المؤيدة للالتهابات ، وتفاقم النزيف داخل القلب ، مما قد يؤدي إلى تفاقم تشخيص ACS. يبدو أن المتتبع المستخدم في هذه الدراسة - 70,000 Da FITC-dextaren ، وهو جزيء جلوكوز متفرع مسمى بفلورسين إيزوثيوسيانات (FITC) - أكبر من أن يتسلل إلى بطانة الأوعية الدموية الدقيقة القلبية في الظروف العادية. ومع ذلك ، فهي قادرة على التسلل إلى حاجز مكسور بعد MIRI. وبالتالي ، كلما زادت نفاذية البطانة ، زاد تراكم FITC-dextran في الفضاء بين الخلايا خارج الأوعية الدموية. وبالتالي ، يمكن أن تشير شدة التألق من FITC إلى نفاذية الحاجز البطاني للأوعية الدموية الدقيقة. يستفيد هذا البروتوكول من FITC-dextran لتقييم الحاجز البطاني للأوعية الدموية الدقيقة للقلب وظيفيا ، والذي يتم اكتشافه بواسطة نظام تصوير مرضي كمي آلي.
Introduction
حقيقة أن عددا متزايدا من المرضى الذين يعانون من أمراض القلب التاجية قد استفادوا من علاجات إعادة التوعي لعقود لا تنفي العواقب المميتة لمرض العدوى والأوعية الدموية. كما وصفه Yellon و Hausenloy ، يمكن أن يعزى ما يقرب من 30٪ من حجم الاحتشاء النهائي إلى MIRI1. الخلل البطاني القلبي للأوعية الدموية الدقيقة هو الآلية الأساسية الكامنة وراء MIRI وظاهرة "عدم إعادة التدفق" وهو هدف للعديد من عوامل حماية القلب والمسارات الكلاسيكية الواقيةللقلب 2. علاوة على ذلك ، يمكن أن تؤدي فرط نفاذية البطانة للأوعية الدقيقة إلى وذمة عضلة القلب3 والتسلل المفرط للخلايا المؤيدة للالتهابات ، بما في ذلك العدلات4 ، والضامة ، وخلايا الدمالجنسي 5.
يعمل الإجهاد التأكسدي الناجم عن MIRI والسيتوكينات المؤيدة للالتهابات المبالغ فيها ، مثل أعضاء عائلة عامل نخر الورم6 وعائلة الإنترلوكين7 ، على تنشيط مسارات إشارات موت الخلايا المبرمج الخلوي لتسريع موت عضلة القلب الإقفارية. تخترق كريات الدم الحمراء الحاجز البطاني الضعيف وتتراكم في المصفوفة خارج الخلية (ECM) لتكوين ورم دموي داخل القلب8. تعمل البروتينات المعدنية المصفوفة المشتقة من البلاعم والعدلات على تفكيك الكولاجين في ECM ، مما يزيد من خطر حدوث مضاعفات ميكانيكية وتمدد الأوعية الدموية البطيني بعد الاحتشاء9. وبالتالي ، فإن نفاذية الحاجز البطاني هي علامة حاسمة للتقييم التنبؤي لاحتشاء عضلة القلب الحاد وتشير إلى شدة MIRI إلى حد ما.
FITC-dextran عبارة عن مجموعة من السكريات تتكون من أطوال مختلفة من جزيئات الجلوكوز المتفرعة ذات الوزن الجزيئي التي تتراوح من 4,000 دالتون إلى 70,000 دال. يستخدم على نطاق واسع كمتتبع قياسي لإثبات نفاذية أغشية الخلايا والحواجز الفسيولوجية الوظيفية مثل الحاجز الدموي الدماغي10 والأغشية المخاطية11 في ظل علاجات محددة وظروف مرضية. تختلف نفاذية غشاء معين باختلاف المواد وفقا لأوزانها الجزيئية. عادة ، يقتصر الألبومين على الأوعية الدقيقة القلبية. ومع ذلك ، يمكن أن تخترق البطانة في المرحلة المبكرة من الأشعة تحت الحمراء ، مما يسبب وذمة عضلة القلب. نظرا لأن الوزن الجزيئي للألبومين يبلغ حوالي 68,000 Da ، فإن 70,000 Da FITC-dextran سيكون عاملا مناسبا لإثبات فرط النفاذية البطانية بعد الأشعة تحت الحمراء. علاوة على ذلك ، تم اعتماد ديكستران على نطاق واسع للحفاظ على حجم الدم والضغط التناضحي الغرواني لمرضى الصدمة ، وتستخدم أدوات التتبع المسماة FITC في العديد من الدراسات في الجسم الحي أو في المختبر مع القليل من الآثار الضارة.
بالإضافة إلى FITC-dextran ، تم قياس نفاذية البطانة باستخدام تلطيخ إيفانز الأزرق (EB). بعد الحقن في الدورة الدموية ، يرتبط EB بألبومين المصل بإحكام ويشكل12 مركبا. وبالتالي ، يمكن استخدام مركب EB-albumin ، وليس EB وحده ، لقياس النفاذية ، مما يعني أن دقة هذه الطريقة القائمة على EB يمكن أن تتأثر بتركيزات مختلفة من ألبومين المصل في الأشخاص التجريبيين. بالإضافة إلى ذلك ، تم الإبلاغ عن أن EB يسمم أعضاء التجارب ، وخاصة القلب والكبد والرئتين ، عن طريق التنكس الخلوي وزيادة نفاذية الأوعيةالدموية 13. سيكون الإندوثيليوم الذي يخضع لنقص التروية / إعادة التروية أكثر حساسية لمثل هذه الآثار الضارة من البطانة الطبيعية ، والتي يمكن أن تربك أهمية النتائج التجريبية.
بالمقارنة مع صبغة EB ، فإن FITC-dextern خارجي ، وتقارب الارتباط بالألبومين لا يكاد يذكر. ومن ثم ، يظل FITC-dextran في الحالة الحرة ولا يرتبط بالجزيئات الكبيرة ، مثل الألبومين وبروتينات الأنسجة. وبالتالي ، إذا تم تناوله وفقا لوزن الجسم ، يمكن أن يعمل FITC-dextran بتركيز دم متساو ولا يتأثر بالاختلافات الفردية في تركيز الألبومين في الدم وحجم الدم. تم استخدام Tongxinluo (TXL) ، وهو دواء صيني تقليدي ، لاختبار الحساسية التشخيصية لهذه الطريقة. يقلل TXL من MIRI من خلال الحفاظ على البنية الفوقية الخلوية البطانية وسلامة الحاجز البطاني14. يستخدم TXL أيضا لعلاج الذبحة الصدرية وتحسين عدم ارتجاع عضلة القلب بعد الاحتشاءسريريا 15. يحتوي على Radix ginseng و Buthus martensi و Hirudo و Eupolyphaga seu steleophaga و Scolopendra subspinipes و Periostracum cicadae و Radix paeoniae rubra و Semen ziziphi spinosae و Lignum dalbergiae odoriferae و Lignum santali albi و Borneolum syntheticum. ثبت أن TXL يحمي بطانة الأوعية الدموية الدقيقة عبر مسار MEK / ERK16 والآليات بوساطة أكسيد النيتريك البطاني5،17 ويخفف من إصابة نقص التروية / إعادة التروية (IRI) للأعضاء18 ، وخاصة القلب ، بطريقة تعتمد على الجرعة. هنا ، تم تغذية الفئران ب 0.5 جم / كجم من مسحوق TXL (جرعة مكافئة لتلك المستخدمة سريريا في البشر) كما هو موضح19. توفر هذه الورقة طريقة لتقييم الحاجز البطاني للأوعية الدقيقة للقلب بعد الأشعة تحت الحمراء من خلال قياس شدة التألق الإجمالية ل 70,000 Da FITC-dextran مقارنة ب EB.
Protocol
أجريت التجارب على وفقا ل "دليل رعاية واستخدام المختبر" الصادر عن المعاهد الوطنية الأمريكية للصحة (بيثيسدا ، ماريلاند ، الولايات المتحدة الأمريكية ، منشور المعاهد الوطنية للصحة رقم 85-23 ، تمت مراجعته عام 1996) و "لائحة رعاية واستخدام التجارب" لمجلس بكين لرعاية (1996). تمت الموافقة على بروتوكول الدراسة من قبل لجنة رعاية التجريبية في مستشفى الفواي. تم استخدام ذكور فئران Sprague-Dawley من فئة SPF (الفئران SD) التي تزن 150-180 جم في هذه الدراسة.
1. تحضير الكواشف والمواد والمعدات
- تحضير الكواشف والمحاليل بما في ذلك 70٪ إيثانول ، FITC-dextern (70،000 Da ، مذاب في محلول ملحي مثلج لصنع محلول 10٪ وزن / حجم للاستخدام) ، كريم إزالة الشعر ، وسط تركيب مع 4 '، 6-diamidino-2-phenylindole (DAPI ، 0.5-10 ميكروغرام / مل) ، 1٪ وزن / حجم EB / محلول ملحي ، و 5٪ وزن / حجم محلول ملحي بنتوباربيتال الصوديوم / المحلول الملحي (مخزن في 4 درجات مئوية في الظلام).
- تعقيم جميع الأدوات والمواد الجراحية مسبقا ، بما في ذلك الشريط الجراحي ؛ منصات الشاش قفازات جراحية 16 ز أنبوب القصبة الهوائية; حقنة الأنسولين مقص التشغيل ملقط تشريح كبير ومنحني ؛ ملقط تشريح مستقيم ؛ ملقط البعوض المستقيم ملقط البعوض المنحني الباعدات (انتشار 30 مم) ؛ حاملات الإبر الدقيقة 5 سم ؛ 3-0 خياطة بولي بروبلين (إبرة مستدقة) ؛ و 6-0 خياطة بولي بروبلين (إبرة مستديرة).
- تحقق وتأكد من أن جميع المعدات ، بما في ذلك نظام الاحترار بدرجة الحرارة الثابتة ، ونظام الإضاءة ، وجهاز التنفس الصناعي ، ونظام التصوير الكمي الآلي للأمراض ، وتقطيع التجميد بالأشعة فوق البنفسجية ، في حالة جيدة.
2. تحضير الفئران للعمليات الجراحية
- قسم جميع فئران SD إلى مجموعة شام ومجموعة IR ومجموعة TXL (مجموعة IR + TXL) بشكل عشوائي.
ملاحظة: في هذا البروتوكول ، تم تعيين ستة فئران بشكل عشوائي لكل مجموعة ، ن = 6. - قم بوزن كل فأر SD ، وسجل الوزن ، واحسب جرعة TXL التي سيتم إعطاؤها لكل فأر.
- يتم تطبيق الإيبوبروفين بجرعة 30 ملغ/كغ عن طريق التزقيم لكل فأر قبل 12 ساعة على الأقل من بضع الصدر لتخفيف الألم والضيق قبل الجراحة.
- يتناول مسحوق فائق النعومة من TXL بجرعة 0.5 غ/كغ عن طريق التزقيم لمدة 12 ساعة و1 ساعة لكل فأر SD في مجموعة IR+TXL قبل التخدير، كما هو موضح19.
- تطهير طاولة العمليات بنسبة 70٪ من الإيثانول وضع الأدوات والمواد الجراحية المعقمة على السطح المطهر.
- اضبط درجة حرارة نظام الاحترار بدرجة حرارة ثابتة للحفاظ على درجة حرارة جسم الفئران عند 37 ± 1 درجة مئوية.
3. إنشاء نموذج الفئران لإقفار القلب / إعادة التروية
- حقن 5٪ وزن / حجم محلول ملحي مخيم من الصوديوم / الفوسفات (PBS) بجرعة 50 مجم / كجم (0.1 مل / 100 جم من وزن الجسم) في تجويف البطن لتخدير الفئران. جهز موقع الجراحة عن طريق إزالة الفراء بعناية من الرقبة إلى الصدر عن طريق الحلاقة أو استخدام كريم مزيل الشعر.
- اضبط موضع اللسان برفق حسب الحاجة باستخدام ملاقط معقمة وامسح إفراز الجهاز التنفسي بكرات قطنية معقمة. حافظ على المزمار بوضوح وأدخل أنبوبا قصدايا في القصبة الهوائية برفق.
- قم بتوصيل أنبوب القصبة الهوائية بجهاز التنفس الصناعي الذي يدور بسرعة 65-80 نفسا في الدقيقة واضبط حجم المد والجزر عند 4-5 مل عن طريق تثبيت رأس الفئران وأطرافها.
- ضع ستارة معقمة فوق الفئران ، وقم بتطهير منطقة التشغيل بصبغة اليود متبوعة بنسبة 70٪ من الإيثانول ، وكرر هذا الإجراء ثلاث مرات.
- قم بعمل شق طفيلي يسار على مستوى المساحة الوربية الرابعة لفضح العضلة الصدرية اليسرى والصدرية الصغرى.
- تشريح اللفافة بين العضلة الصدرية الكبرى والصدرية الصغرى باستخدام تقنية تشريح حادة لفضح الفضاء الرابع الأيسر.
ملاحظة: تجنب تلف الأنسجة المفرط وإصابة الأوعية الدموية التي قد تسبب نزيفا حادا ووفاة بعد الجراحة. - قم بتشريح العضلات الوربية ، ووضع ضام الصدر داخل المساحة الوربية الرابعة ، ثم انشر الأضلاع.
- تمزيق التامور وإزالة الأنسجة الدهنية المرفقة.
ملاحظة: تجنب إتلاف الأعضاء الأخرى بالأدوات الجراحية الحادة ، وخاصة الرئتين. يمكن أن يؤدي تلف الرئتين إلى تطور استرواح الصدر واسترواح الصدر الدموي أثناء العملية ، مما يتسبب في عواقب تشاطرية تتراوح من اضطرابات ديناميكية الدم إلى انخفاض بقاء. - تلاعب بموضع الغدة الصعترية وفضح الشريان الأورطي الصاعد والأذينين الأيسر برفق. تحديد وربط الشريان الأمامي الأيسر القريب (LAD) بشكل عابر لمدة 45 دقيقة باستخدام خياطة 6-0 من مادة البولي بروبيلين (انظر الشكل 1 A-D).
ملاحظة: هذا الإجراء مطابق لفئران التحكم الزائفة باستثناء أن LAD غير مرتبط. - قم بإزالة ضام الصدر وارسم الضلوع معا في نمط خياطة متقطعة باستخدام خياطة 3-0 من مادة البولي بروبلين.
- استعادة الضغط السلبي داخل الصدر لضمان التنفس الفعال.
ملاحظة: يمكن استخدام طريقتين لاستعادة الضغط السلبي داخل الصدر: أنا) قبل إغلاق تجويف الصدر ، يمكن للباحثين توصيل مخرج الهواء لجهاز التنفس الصناعي لمدة دورتين لتضخيم الرئتين. ب) يمكن سحب الهواء المتبقي في تجويف الصدر باستخدام حقنة بعد إغلاق المساحة الوربية. - بعد إزالة الشعر وتطهيره ، قم بعمل شق في الطرف السفلي الأيمن وتشريح اللفافة السطحية من الوريد الفخذي الأيمن.
- قم بفك الربط وتحقق من ظروف التنفس والدورة الدموية بعد إحداث نقص تروية عضلة القلب لمدة 45 دقيقة.
- حقن 10٪ (وزن / حجم) FITC-dextran/محلول ملحي في الوريد الفخذي عند 0.15 مل / 100 جرام من وزن الجسم ، واضغط على الوريد الفخذي لمدة 1 دقيقة باستخدام كرات قطنية معقمة لوقف النزيف (الشكل 2 أ ، ب).
ملاحظة: بدلا من ذلك، يتم حقن 1٪ وزن / حجم محلول ملحي من EB / محلول ملحي في الوريد الفخذي بجرعة 0.5 مل / 100 جرام من وزن الجسم. - قم بخياطة الشقوق بخياطة 3-0 من مادة البولي بروبيلين وتطهير الشقوق ، متبوعا بتسكين ما بعد الجراحة بالإيبوبروفين ، كما هو موضح أعلاه.
4. تحضير شرائح الأنسجة المجمدة لقياس التألق
- حقن 5٪ وزن / حجم محلول الصوديوم البنتوباربيتال / PBS بجرعة 150 مجم / كجم (0.3 مل / 100 جم من وزن الجسم) داخل الصفاق لتخدير الفئران بعمق بعد 3 ساعات من إعادة تروية عضلة القلب.
- شق تجويف البطن وفضح الشريان الأورطي البطني والوريد الأجوف (انظر في الشكل 3 أ).
- حقن 50 مل من PBS المثلج في الوريد الأجوف بثبات ، وقطع الشريان الأورطي البطني لطرد الدم من عضلة القلب ، وحصاد القلب.
ملاحظة: لاحظ التغيرات في الرئتين والكبد. يشير الكبد المتعرق إلى أن المحلول الملحي يتم حقنه بدقة في الوريد الأجوف (انظر في الشكل 3 ج) ، وتعتبر الرئة الشاحبة علامة على عضلة القلب جيدة الانتشار (انظر في الشكل 3 ب). - في غرفة مظلمة ، اشطف القلب بمحلول ملحي مثلج أو PBS برفق لإزالة أي دم متبقي و FITC-dextrann (أو EB) من غرف القلب.
- اقطع القلب عن الربط وتخلص من عضلة القلب فوق الربط.
- قم بتضمين القلب في قوالب مع مركب التضمين متبوعا بالتخزين عند -80 درجة مئوية.
- قم بتفريغ الأنسجة المجمدة من قوالب التضمين وتحميلها على حاملات العينات في غرفة مسبقة التبريد -20 درجة مئوية في قطاعة التجميد.
- اضبط سمك شريحة واحدة على 5-8 ميكرومتر وقم بتقطيع الأنسجة عند نقطة منتصف محور قمة القاعدة تقريبا (على سبيل المثال ، منتصف نقص التروية).
- قم بتحميل الأنسجة المقطعة على شرائح المجهر اللاصق وأغلق كل شريحة بقطرة واحدة (حوالي 40 ميكرولتر) من وسط تركيب الفلورسنت الذي يحتوي على DAPI.
- احتفظ بالشرائح في صندوق جاف ومظلم.
ملاحظة: إذا تعذر مسح الشرائح ضوئيا على الفور ، فقم بتخزينها في مكان جاف وبارد ومظلم لمنع تكون ماء المكثفات وإخماد الفلورة.
5. قياس التألق وتحليل البيانات
- قم بإعداد نظام التصوير وتحقق من البرنامج المتصل بالماسح الضوئي.
- قم بتحميل الشرائح في أرفف الشرائح وإدخالها في الماسحة الضوئية.
- افتح برنامج الماسح الضوئي للشرائح (انظر جدول المواد) وقم بإعداد بروتوكول تعرض جديد بالنقر فوق تحرير البروتوكول | الجديد....
ملاحظة: إذا لم يكن الماسح الضوئي أو البرنامج التابع له متوفرا، فقد يكون المجهر متحد البؤر بالليزر (انظر جدول المواد) أو غيرها من الماسحات الضوئية العادية للشرائح مع وضع التألق (انظر جدول المواد) بديلا للماسح الضوئي الكمي الآلي. - أعد تسمية البروتوكول والدراسة ، وحدد وضع التألق .
- تحديد مسح الشرائح بالكامل | دقة البكسل والمناطق متعددة الأطياف | دقة البكسل هي 0.25 ميكرومتر (40x) على التوالي.
- انقر فوق تحرير عوامل التصفية والنطاقات ... لتحديد عمود عوامل تصفية فحص الشرائح بالكامل وعمود نطاقات المنطقة متعددة الأطياف .
ملاحظة: إذا تم استخدام EB ، فحدد عوامل تصفية مسح الشرائح بالكامل | DAPI و Texas Red أو AF495. إذا تم استخدام FITC-dextran ، فحدد نطاقات المنطقة متعددة الأطياف | DAPI و FITC أو AF488. - انقر فوق تحرير التعرضات ... وقم بتحميل شركة الاتصالات.
- حدد الفتحة المستهدفة وانقر فوق Take Overview.
ملاحظة: يتطلب هذا فحصا ساطعا لكل قسم من أقسام القلب. حدد عضلة القلب للتركيز أو حدد المنطقة بشكل أعمى. - حدد الشريحة المستهدفة ، واضبط ارتفاع المرحلة على حوالي -50 ميكرومتر ، وانقر فوق التركيز التلقائي.
- انقر فوق التعرض الكامل للمسح الضوئي (مللي ثانية) - DAPI | التعريض التلقائي.
ملاحظة: لا يجب أن يكون وقت تعرض DAPI لكل شريحة هو نفسه لأن الصور التي تحتوي على DAPI تستخدم لتوضيح المقاطع العرضية للقلب ، والتي تكون ملائمة لتحديد منطقة عضلة القلب ولكن ليس لحساب كثافة التألق. - انقر فوق التعرض الكامل للمسح الضوئي (مللي ثانية) - FITC | التعريض التلقائي.
ملاحظة: انقر فوق التعرض للمسح الضوئي الكامل (مللي ثانية) - تكساس الأحمر | التعريض الضوئي التلقائي في حالة استخدام EB. من المهم أن تتذكر وتأكد من أن وقت التعرض ل FITC أو Texas Red هو نفسه في جميع عمليات مسح الشرائح. - انقر فوق التركيز التلقائي مرة أخرى وتأكد من أن الشريحة في بؤرة التركيز.
- انقر فوق رجوع واحفظ البروتوكول.
- كرر الخطوات 5.7-5.14 لكل شريحة.
- ارجع إلى الصفحة الرئيسية وانقر على مسح الشرائح.
- حدد فتحة ، وأعد تسمية جميع الشرائح ، وحدد بروتوكول التعريض المقابل لكل شريحة.
- امسح الشرائح ضوئيا والتقط الصور.
- افتح الصور باستخدام برنامج عارض الشرائح لعمليات المسح الضوئي (انظر جدول المواد).
- تكبير جميع الصور إلى حد متساو نسبيا.
- لقطة وحفظ الصور .tiff.
ملاحظة: من الأفضل حفظ الصور مع وبدون أشرطة مقياس في نفس الوقت. يمكن استخدام الصور ذات أشرطة المقياس للنشر ، بينما يمكن استخدام الصور التي لا تحتوي على أشرطة مقياس للتحليل الإحصائي. - افتح برنامج ImageJ ، وانقر فوق تحليل ، وحدد تعيين القياس.
- حدد المنطقة | كثافة متكاملة.
- افتح الصورة في قناة FITC مع الصورة J.
- انقر فوق تحليل مرة أخرى وسجل القيمة الرقمية للكثافة المتكاملة (IntDen) التي تظهر.
ملاحظة: نظرا لأن أشرطة المقياس في الصور يمكن الخلط بينها وبين التدرج الرمادي للتألق بواسطة أجهزة الكمبيوتر، استخدم الصور التي لا تحتوي على أشرطة مقياس لقياس IntDen. - أغلق صورة FITC وافتح الصورة في قناة DAPI.
- حدد المقطع العرضي لعضلة القلب.
- انقر فوق تحليل وجمع بيانات المنطقة .
- احسب نسب IntDen/Area (متوسط التألق) لكل قلب.
- إدخال جميع النسب في برنامج التحليل الإحصائي.
النتائج
قبل إجراء اختبار FITC-dextran لتقييم التغيرات في نفاذية بطانة القلب بعد الأشعة تحت الحمراء ، نوصي بشدة بإجراء التجارب من قبل نفس الباحث المتخصص في إنشاء نموذج الأشعة تحت الحمراء لعضلة القلب في الفئران للتأكد من أن الشرايين التاجية مسدودة في نفس الموضع بنجاح ، وأن نسب المساحة الإقفارية / المساحة الكلية ثابتة بين جميع الفئران. كما هو موضح في الشكل 1 أ ، ب ، تعرض القلب (المشار إليه بالسهم الأصفر) ، وتشكلت حلقة (يشار إليها بالسهم الأخضر) في عضلة القلب الموجودة في الجدار الأمامي للبطين الأيسر ، حوالي 2 مم تحت حافة الزائدة الأذينية اليسرى مع أنبوب سيليكون شعري 0.5 مم (القطر الداخلي) وخياطة 6-0. كما هو موضح في الشكل 1 ج ، عندما تم تثبيت الحلقة ، تحول عضلة القلب الإقفارية من اللون الوردي إلى اللون الوردي الرمادي (المشار إليه بالسهم الأبيض) على الفور.
علاوة على ذلك ، ارتد عضلة القلب واستعاد لونه الوردي فور فك الحلقة ، كما هو موضح في الشكل 1 د. بعد فك الحلقة ، تم إجراء شق مواز للمحور الطويل لعظم الفخذ في الفخذ الداخلي. تم الكشف عن الوريد الفخذي وثقبه بحقنة الأنسولين ، كما هو موضح في الشكل 2 أ ، ب. بعد إعادة تروية 3 ساعات ، تم إجراء شق "V" في أسفل البطن ، وتم تشريح الشريان الأورطي البطني والوريد الأجوف من الصفاق (الشكل 3 أ). تم حقن محلول ملحي بارد في الوريد الأجوف برفق ، وتم قطع الشريان الأورطي البطني لمنع جدار البطين من التمدد بشكل مفرط بسبب الضغط داخل البطين الذي من شأنه أن يؤثر على هيكله النسيجي المرضي. تشير الرئتان المبيضتان (السهم الأحمر في الشكل 3 ب) والكبد في الشكل 3 ج إلى أن الأنسجة كانت جيدة التسخين بالمحلول الملحي.
وبالتالي ، لم يكن هناك فرق كبير في مساحة المقطع العرضي بين المجموعات الثلاث: 1.00 ± 0.08 في مجموعة الشام مقابل 0.97 ± 0.08 في مجموعة IR مقابل 1.02 ± 0.04 في مجموعة IR + TXL (الشكل 4 أ ، ن = 6 في كل مجموعة ، ص > 0.05 بين أي مجموعتين). كما هو موضح في الشكل 4 ب ، ج ، كان متوسط شدة التألق الأخضر في الأقسام بأكملها من فئران الشام منخفضا للغاية. في المقابل ، زاد التألق المنبعث من FITC-dextran بشكل ملحوظ في مجموعة الأشعة تحت الحمراء ، وتم تطبيعها إلى مجموعة الشام (5.52 ± 0.85 في مجموعة الأشعة تحت الحمراء مقابل 1.00 ± 0.19 في مجموعة الشام ، ن = 6 ، ص < 0.05). علاوة على ذلك ، فإن مسحوق TXL فائق النعومة ، المعروف بحماية بطانة الأوعية الدموية الدقيقة للقلب14،16 ، عكس بشكل ملحوظ كثافة التألق الأعلى الناجمة عن الأشعة تحت الحمراء (2.87 ± 0.52 في مجموعة IR + TXL مقابل 5.52 ± 0.85 في مجموعة الأشعة تحت الحمراء ، ن = 6 ، ص < 0.05). أشارت صور عضلة القلب الإقليمية إلى أن FITC-dextrans تراكمت بأغلبية ساحقة في المصفوفة خارج الخلية ولكن ليس في الأوعية الدقيقة ، وأن TXL حسنت وظيفة الحاجز البطاني (الشكل 5).
بالمقارنة مع FITC-dextran ، قد يكون EB بديلا دون المستوى الأمثل لأن EB أدنى من 70,000 Da FITC-dextaren في كل من جودة الصورة والحساسية. وبالمثل ، لم يكن هناك فرق كبير في مساحة المقطع العرضي بين المجموعات الثلاث: 1.00 ± 0.08 في مجموعة الشام مقابل 0.97 ± 0.08 في مجموعة الأشعة تحت الحمراء مقابل 0.98 ± 0.05 في مجموعة IR + TXL (الشكل التكميلي S1A ، ن = 6 في كل مجموعة ، ص > 0.05 بين أي مجموعتين). كما هو موضح في الشكل التكميلي S1B ، C ، كان متوسط شدة التألق الأحمر في المقاطع العرضية الكاملة من فئران الشام أعلى نسبيا ، خاصة في الشغاف والنخاب. على الرغم من أن التألق الأحمر المنبعث من EB زاد بشكل حاد في مجموعة IR (4.41 ± 0.66 في مجموعة IR مقابل 1.00 ± 0.22 في مجموعة الشام ، ن = 6 ، ص < 0.05) ، لم يكن الفرق بين مجموعات IR + TXL و IR كبيرا (3.73 ± 0.47 في مجموعة IR + TXL مقابل 4.41 ± 0.66 في مجموعة IR ، ن = 6 ، ص = 0.0956).
علاوة على ذلك ، تم اختبار هذه الطريقة في نموذج احتشاء عضلة القلب (MI) (الشكل التكميلي S2). في مجموعة الحقن الأول (MII) منالقلب ، تم حقن محلول FITC-dexterrn (بنفس التركيز المذكور سابقا) في الدورة الدموية قبل 5 دقائق من ربط LAD. كان هذا على النقيض من محلول FITC-dextran الذي تم حقنه مباشرة بعد الربط في فئران MIL (Myocarial Infarction Ligation first) الموصوف سابقا في هذا البروتوكول. ومن المثير للاهتمام ، أن كميات قليلة فقط من FITC-dextaren تم تفيرها في ECM لعضلة القلب المصابة في فئران MI من كلا المجموعتين ، ويشار إليها بضعف شدة التألق الأخضر في الشكل التكميلي S2.
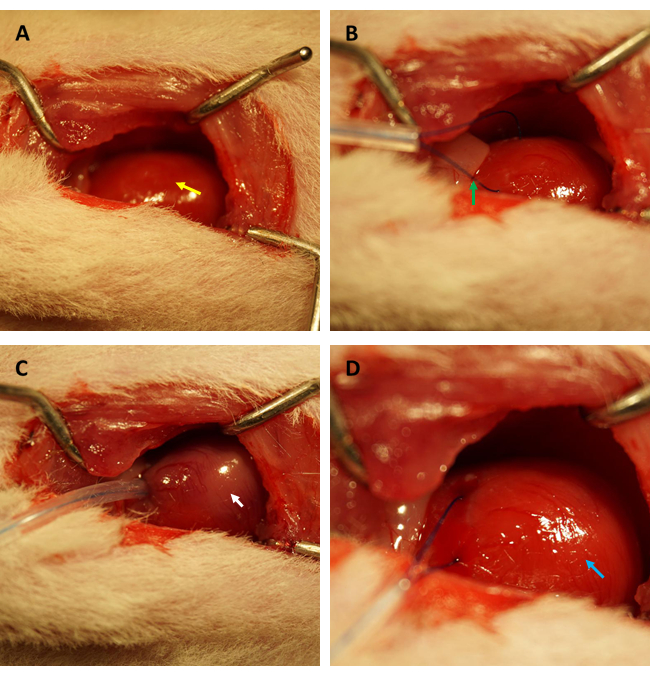
الشكل 1: المجال البصري لبضع الصدر وإنشاء نقص التروية / إعادة التروية في نموذج الفئران. (أ) تعريض قلب الفئران (يشار إليه بالسهم الأصفر)؛ (ب) تشكيل حلقة لتطويق الشريان التاجي (يشار إليه بالسهم الأخضر) ؛ (ج) تثبيت الحلقة وإحداث نقص تروية عضلة القلب لمدة 45 دقيقة (يشار إليه بالسهم الأبيض) ؛ (د) تخفيف الحلقة والسماح بإعادة تروية عضلة القلب لمدة 3 ساعات (يشار إليه بالسهم الأزرق). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
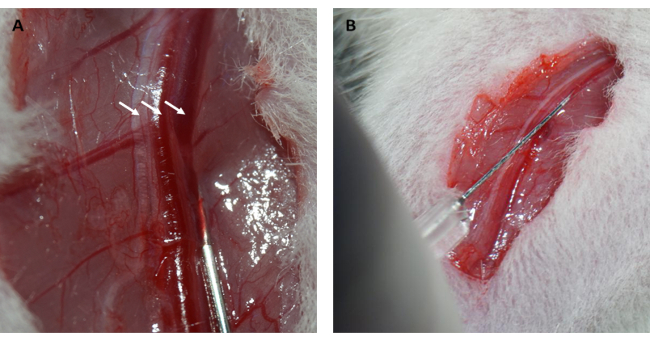
الشكل 2: تشريح الوريد الفخذي والحقن في الوريد. (أ) تعريض الوريد الفخذي (يشار إلى العصب الفخذي بالسهم الموجود على اليسار ؛ يشار إلى الشريان الفخذي بالسهم الموجود في المنتصف ؛ يشار إلى الوريد الفخذي بالسهم الموجود على اليمين). (ب) حقن محلول FITC-dextern في الوريد الفخذي بحقنة الأنسولين. اختصار: FITC = فلورسين إيزوثيوسيانات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
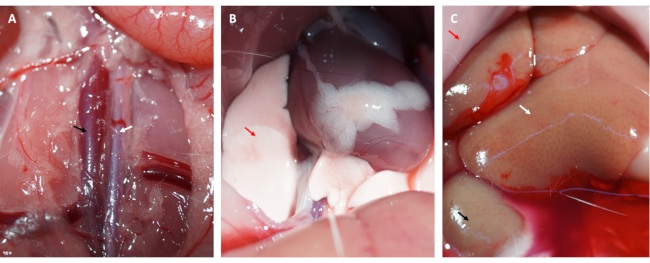
الشكل 3: نضح الأنسجة وأعراض التروية الفعالة. (أ) تشريح الشريان الأورطي البطني والوريد الأجوف (يشار إلى الشريان الأورطي البطني بالسهم الأبيض ؛ يشار إلى الوريد الأجوف بالسهم الأسود). (ب) الرئتان المبيضتان من أعراض التروية الكافية. (ج) الغشاء المخاطي المبيض والكلى المبيضة والكبد المتعرق كلها أعراض للتروية الكافية (السهم الأحمر: الغشاء المخاطي ؛ السهم الأبيض: الكبد ؛ السهم الأسود: الكلى). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: صور تمثيلية وتحليل متوسط شدة التألق بواسطة تلطيخ FITC-dextran. (أ) مساحة المقطع العرضي النسبية لكل مجموعة تطبيعها مع مساحة مجموعة الشام (ص > 0.05) ؛ (ب) شدة التألق النسبية في قناة FITC لكل مجموعة تطبيعها مع تلك الخاصة بمجموعة الشام؛ (ج) صور تمثيلية بتكبير 9,5 أضعاف في كل مجموعة. أشرطة المقياس = 800 ميكرومتر. ANOVA أحادي الاتجاه مع مقارنات Tukey متعددة المجموعات اللاحقة . * ضد مجموعة الشام ، ص < 0.05 ؛ # مقابل مجموعة الأشعة تحت الحمراء ، ص < 0.05. تظهر الرسوم البيانية الشريطية متوسط المجموعة ± SD. الاختصارات: IR = نقص التروية / إعادة التروية. TXL = Tongxinluo ؛ FITC = فلوريسين إيزوثيوسيانات. DAPI = 4',6-diamidino-2-phenylindole; ANOVA = تحليل التباين ؛ SD = الانحراف المعياري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: صور تمثيلية لمناطق الاهتمام بتكبير 200x لكل مجموعة بعد تلطيخ FITC-dextran. أشرطة المقياس = 50 ميكرومتر. الاختصارات: FITC = فلورسين إيزوثيوسيانات. DAPI = 4 '، 6-diamidino-2-phenylindole. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: صور تمثيلية وتحليل متوسط شدة التألق بواسطة تلطيخ إيفانز الأزرق. (أ) مساحة المقطع العرضي النسبية لكل مجموعة تطبيعها مع مساحة مجموعة الشام (ع > 0.05)؛ (ب) شدة التألق النسبية في قناة تكساس الحمراء لكل مجموعة تطبيعها مع تلك الخاصة بمجموعة الشام ؛ (ج) الصور التمثيلية في كل مجموعة. ANOVA أحادي الاتجاه مع مقارنات Tukey متعددة المجموعات اللاحقة . أشرطة المقياس = 800 ميكرومتر * مقابل مجموعة الشام ، ص < 0.05. تظهر الرسوم البيانية الشريطية متوسط المجموعة ± SD. الاختصارات: IR = نقص التروية / إعادة التروية. TXL = Tongxinluo ؛ DAPI = 4',6-diamidino-2-phenylindole; ANOVA = تحليل التباين ؛ SD = الانحراف المعياري. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S2: صور تمثيلية بتكبير 9.5x لتلوين FITC-dextern في نموذج احتشاء عضلة القلب. أشرطة المقياس = 800 ميكرومتر. الاختصارات: MII = حقن احتشاء عضلة القلب أولا (حقن FITC-dextران قبل احتشاء عضلة القلب) ؛ MIL = ربط احتشاء عضلة القلب أولا (حقن FITC-dexterrn مباشرة بعد احتشاء عضلة القلب) ؛ FITC = فلوريسين إيزوثيوسيانات. DAPI = 4 '، 6-diamidino-2-phenylindole. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تقدم هذه الورقة بروتوكولا لتقييم الخلل الوظيفي في الحاجز البطاني القلبي بعد التعرض لجهاز التصدي المتعدد القلب. وتجدر الإشارة إلى أن هناك العديد من الخطوات الحاسمة في هذا البروتوكول التي تحدد موثوقية ودقة النتائج. يجب تنفيذ جميع الخطوات التي تنطوي على FITC-dextern في غرفة مظلمة. يجب تخزين محاليل FITC-dextran / المحلول الملحي في درجة حرارة 4 درجات مئوية ولفها بورق القصدير. بالإضافة إلى ذلك ، يجب ربط الشرايين التاجية ، كما هو موضح في الشكل 1 ، بحيث يمكن إعادة إنفاذ عضلة القلب فور فك الحلقة. يمكن للباحثين اختيار خيوط البولي إيثيلين 5-0 أو 6-0 لأن الخيوط الرقيقة التي تقل عن 7-0 من المرجح أن تقطع ألياف عضلة القلب والأوعية. الأهم من ذلك ، يجب حقن محلول التتبع في الأوردة الفخذية وليس في أوردة الذيل. يجب أن يكون كل قلب جيدا ومضففا جيدا بمحلول ملحي مثلج قبل التضحية به وبعده ، على التوالي.
يميل العديد من الباحثين المتخصصين في MIRI إلى دراسة البنية الفرعية الخلوية المعطلة للبطانة في المرحلة المبكرة من إعادة تروية عضلة القلب - تكوين أجسام موت الخلايا المبرمج ، وتورم الميتوكوندريا ، والوصلات غير الطبيعية بين الخلايا - لإثبات فرط نفاذية البطانة عن طريق الفحص المجهري الإلكتروني. تم استخدام النشاف المناعي أيضا لقياس نفاذية الأوعية الدموية الدقيقة لأن الانخفاض في مستويات بروتينات الاقتران الضيقة يعتبر الآلية الأساسية لإصابة البطانة وخلل الحاجز البطاني بمرور الوقت. على سبيل المثال ، يعد VE-cadherin20 و β-catenin21 من العناصر الرئيسية لتقاطعات الالتصاق البطانية من خلية إلى خلية ، وتساهم هذه الوصلات في الحفاظ على سلامة الأوعيةالدموية 22. تشارك التقاطعات الضيقة ، مثل JAM-A23،24 و occludin25 ، أيضا بشكل تعاوني في بناء الحاجز البطاني في الدورة الدموية.
حاليا ، يشير عدد متزايد من الدراسات إلى أن وظيفة الميتوكوندريا وتوازن الميتوكوندريا يمكن أن يكونا أهدافا رئيسية للمسارات الوقائية ضد إصابة إعادة التروية. كما ورد في الدراسات الفيزيولوجية المرضية والدوائية ، يمكن أن يلعب الانقسام القلبي دورا مهما في الموت الخلوي للبطانة وعضلة القلب الناجم عن الأشعة تحت الحمراء26. بالإضافة إلى ذلك ، قد يحمي انشطار الميتوكوندريا ، والبروتينات في الميتوكوندريا ، ومراقبة جودة الميتوكوندريا عضلة القلب عالية الخطورة في المناطق المعاد تقصيرها27،28. تركز الطرق المذكورة أعلاه بشكل أكبر على إظهار آليات أو أسباب فرط النفاذية المختلفة أكثر من إظهار نفاذية البطانة بشكل مباشر وبصري. علاوة على ذلك ، فإن تحضير العينة للفحص المجهري الإلكتروني معقد وخطير. من المحتمل أن تؤدي محاليل الجلوتارالديهايد والأسيتون والحمض الأوسميك المستخدمة في المجهر الإلكتروني إلى تطاير وتآكل الغشاء المخاطي والملتحمة والجلد ، بل إنها تهدد الأرواح إذا تم استخدامها في بيئات غير خاضعة للرقابة.
بالمقارنة مع هذه الطرق غير المباشرة والمهددة للحياة ، فإن هذه الطريقة ، التي تقيس شدة التألق المنبعثة من تسرب FITC-dextran ، مثالية لتقييم نفاذية الأوعية الدموية الدقيقة للقلب. أولا ، لا يمكن ل 70,000 Da FITC-dextern اختراق البطانة في ظل الظروف الفسيولوجية العادية ولكن يمكن أن يدخل الفضاء الخلالي لعضلة القلب تحت الأشعة تحت الحمراء ، مما يسمح بتمييز واضح بين الفئران تحت علاجات مختلفة. بالإضافة إلى ذلك ، يتم حقن محلول FITC-dexterrn في الدم عبر الأوردة الفخذية ، مما يضمن حقن كل السائل في الدورة الدموية للفئران. في المقابل ، يكون حقن وريد الذيل أكثر صعوبة في الفئران لأن وريد الذيل غير واضح ومغطى بطبقة سميكة. علاوة على ذلك ، على عكس التثبيت المنتظم للبارافورمالدهيد وتضمين البارافين ، يتم تبسيط علاج أنسجة عضلة القلب وتحسينه باستخدام تقنية القسم المرضي للتجميد السريع المستخدمة في هذه الدراسة. قد يخفف وقت التخزين القصير والبيئة المقاومة للضوء والحفظ بالتبريد معا من تبريد التألق ل FITC.
والأهم من ذلك ، أن هذه الطريقة يمكن أن تقلل من تحيز الاختيار أثناء التحليل الإحصائي. نقوم بإجراء نضح كاف للقلب مع محلول ملحي لضمان إخراج كل الدم الممزوج ب FITC-dextran تقريبا من عضلة القلب وغرف القلب ، والتي يمكن أن تقضي على التألق المنبعث من أي FITC متبقي في الأوعية. إذا لم يكن الأمر كذلك ، فيجب استبعاد التألق المدمج مع الشعيرات الدموية وقصه بشكل مصطنع. أثناء جمع الأنسجة من مناطق الاهتمام ، لم يتم ملاحظة أي حدود بصرية بين عضلة القلب الإقفارية وعضلة القلب البعيدة ، خاصة بعد تلطيخ صبغة EB. وقد أعاق ذلك جمع العينات من هذه المناطق التمثيلية. باستخدام الطريقة الموضحة هنا ، يمكن للباحثين الحصول على صور لأقسام كاملة وتحليل شدة التألق باستخدام ماسح ضوئي كمي.
ومن المثير للاهتمام أن صبغة EB يمكن أن تكون بديلا ، وإن كان دون المستوى الأمثل ، ل FITC-dextran. بالمقارنة مع ظروف التخزين القاسية نسبيا ل FITC-dextran ، يمكن أن يظل مسحوق EB أو محلوله مستقرا في درجة حرارة الغرفة لفترة طويلة. بالإضافة إلى ذلك ، يعد EB غير مكلف نسبيا بالنسبة لمعظم المؤسسات. ومع ذلك ، يمكن أن تحد بعض العيوب من تطبيقه. أولا ، يظهر تلطيخ EB حساسية أقل من FITC-dextran ، مما قد يقلل من الاختلافات بين المجموعات ويزيد من حجم العينة لكل مجموعة. إلى جانب ذلك ، يظهر EB التصاق أقوى بالبروتينات. يتم تلطيخ الشغاف والنخابين بسهولة أكبر بواسطة EB ، مما قد يؤثر على نتائج كثافة التألق. علاوة على ذلك ، فإن عيوب التعبئة الواضحة في منطقة إعادة التروية تقلل بشكل ملحوظ من جودة الصورة ، مما قد يحد من استخدام EB.
لتوسيع تطبيق هذه الطريقة في نموذج MI ، تم اختبار الطريقة في نموذج MI. أولا ، تم حقن FITC-dexterrn في الأوعية الدموية بعد ربط LAD. كما هو متوقع ، انبعث مستوى منخفض من التألق من الشريحة لأن FITC-dextern في تدفق الدم لا يمكن أن يمر عبر الموقع المرتبط ، ولم يدخل أي FITC-dextern المنطقة الإقفارية. تم تطبيق FITC-dextran أيضا قبل 5 دقائق من الربط لضمان مرور FITC-dextran إلى جميع الأعضاء. وبالتالي ، فشل FITC-dexterrn في اختراق بطانة الأوعية الدموية الدقيقة ربما لأنه لا يوجد ضغط نضح في الأوعية الدموية المربوطة يمكن أن يدفع FITC-dextern عبر البطانة. بشكل عام ، ربما تتطلب هذه الطريقة مزيدا من التعديل لتلبية تطبيقها في نموذج MI.
على الرغم من المزايا المذكورة أعلاه ، هناك قيود على هذه الطريقة. أولا ، لم يتم اختبار هذا البروتوكول في نماذج الأشعة تحت الحمراء للحيوانات الأخرى ، مما قد يحد من تطبيقه في الدراسات قبل السريرية والسريرية. ثانيا ، تعتبر الأصباغ التي تحمل علامة FITC أغلى من الأصباغ الشائعة الأخرى مثل EB. ومع ذلك ، على عكس EB ، حيث أن محلول FITC-dextern بنسبة 10٪ وزن / v ، المخفف بالمصل ، نادرا ما يغير لون عضلة القلب ، ويمكن إجراء تلطيخ FITC-dextaren والتلوين المزدوج EB / 2،3،5-triphenyltetrazole chloride (TTC) في نفس القلب ، والذي يمكن أن يقلل من الميزانية فيما يتعلق بعدد والأصباغ المستخدمة. أخيرا ، قد لا يكون الماسح الضوئي للشرائح المستخدم في هذه الدراسة - الماسح الضوئي الكمي للشرائح والأدوات المماثلة - متاحا في بعض المختبرات. باختصار ، يقدم هذا البروتوكول طريقة مبسطة وموثوقة ومرئية للكشف عن نفاذية بطانة الأوعية الدموية الدقيقة للقلب في نموذج الأشعة تحت الحمراء في الفئران باستخدام مقايسة مضان بناء على نظام تصوير علم الأمراض الكمي الآلي. يوضح هذا البروتوكول أن 70,000 Da FITC-dextran يعمل بشكل أفضل من EB في التقييم الوظيفي للحاجز البطاني للأوعية الدقيقة للقلب بعد إصابة الأشعة تحت الحمراء.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذه الدراسة بمنح من البرنامج الوطني للبحث والتطوير الرئيسي في الصين (رقم 2017YFC1700503) والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 81874461 ورقم 81774292).
Materials
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
References
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -. D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -. H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59 (2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349 (2019).
- Li, B. -. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032 (2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037 (2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403 (2018).
- Zhang, H. -. T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -. H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775 (2017).
- Yu, Z. -. H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -. X., Wang, P., Wang, N. -. N., Li, S. -. D., Yang, M. -. H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485 (2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23 (2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156 (2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved