Method Article
用于评估缺血/再灌注大鼠模型中心脏微血管内皮屏障通透性的荧光测定
* 这些作者具有相同的贡献
摘要
在这里,我们描述了一种通过测量外渗 70,000 Da FITC-葡聚糖与 Evans Blue 相比的平均荧光强度来功能评估缺血/再灌注损伤后心脏微血管内皮屏障的方法。
摘要
无论经皮冠状动脉介入治疗和冠状动脉旁路移植术,罪魁祸首动脉的血运重建治疗都被认为是改善急性冠脉综合征 (ACS) 患者临床预后的最佳策略。尽管如此,有效血运重建后的心肌再灌注可引发严重的心肌细胞死亡和冠状动脉内皮塌陷,称为心肌缺血/再灌注损伤 (MIRI)。通常,内皮细胞及其细胞间紧密连接协同维持微血管内皮屏障及其相对较低的通透性,但在再灌注区域失败。
缺血/再灌注 (IR) 诱导的微血管内皮高通透性导致心肌水肿、促炎细胞浸润增加和心肌内出血加重,这可能会使 ACS 的预后恶化。本研究中使用的示踪剂 - 70,000 Da FITC-葡聚糖,一种由异硫氰酸荧光素 (FITC) 标记的支链葡萄糖分子 - 似乎太大,无法在正常情况下浸润心脏微血管内皮。然而,它能够在 MIRI 之后渗透到破损的屏障中。因此,内皮通透性越高,FITC-葡聚糖在血管外细胞间隙中积累的越多。因此,来自 FITC 的荧光强度可以指示微血管内皮屏障的通透性。该方案利用 FITC-葡聚糖来评估心脏微血管内皮屏障的功能,这由自动定量病理成像系统检测。
引言
几十年来,越来越多的冠心病患者受益于血运重建疗法,这一事实并不能否定 MIRI 的致命后果。正如 Yellon 和 Hausenloy 所描述的,大约 30% 的最终梗死面积可归因于 MIRI1。心脏微血管内皮功能障碍是 MIRI 和“无回流”现象的核心机制,是许多心脏保护剂和经典心脏保护途径的目标2。此外,微血管的内皮高通透性会引发心肌水肿3 和促炎细胞的过度浸润,包括中性粒细胞4 、巨噬细胞和节细胞5。
MIRI 诱导的氧化应激和过表达的促炎细胞因子,如肿瘤坏死因子家族6 和白细胞介素家族7 的成员,激活细胞凋亡的信号通路,加速缺血性心肌的死亡。红细胞穿透脆弱的内皮屏障并积聚在细胞外基质 (ECM) 中形成心肌内血肿8。巨噬细胞和中性粒细胞来源的基质金属蛋白酶分解 ECM 中的胶原蛋白,这增加了机械并发症和梗死后室性动脉瘤的风险9。因此,内皮屏障的通透性是急性心肌梗死预后评估的关键标志,在一定程度上标志着 MIRI 的严重程度。
FITC-葡聚糖是一系列多糖,由分子量从 4,000 Da 到 70,000 Da 不等的不同长度的支链葡萄糖分子组成。它被广泛用作标准示踪剂,以证明细胞膜、功能生理屏障(如血脑屏障10)和粘膜11 在特定处理和病理条件下的通透性。一种特定膜的通透性因物质的分子量而异。通常,白蛋白仅限于心脏微血管;但在 IR 早期可穿透内皮,引起心肌水肿。由于白蛋白的分子量约为 68,000 Da,因此 70,000 Da FITC-葡聚糖将是证明 IR 后内皮高通透性的合适试剂。此外,葡聚糖已被广泛用于维持休克患者的血容量和胶体渗透压,FITC 标记的示踪剂用于许多 体内 或 体外 研究,几乎没有不良反应。
除了 FITC-葡聚糖外,还用 Evans Blue (EB) 染色测量了内皮通透性。注射到血液循环中后,EB 与血清白蛋白紧密结合并形成复合物12。因此,这种 EB-白蛋白复合物,而不是单独的 EB,可用于通透性的测量,这意味着这种基于 EB 的方法的准确性会受到实验对象中不同浓度血清白蛋白的影响。此外,据报道,EB 会通过细胞变性和血管通透性增加毒害实验动物的器官,尤其是心脏、肝脏和肺13。接受缺血/再灌注的内皮细胞比正常内皮细胞对这种有害影响更敏感,这可能会混淆实验结果的意义。
与 EB 染料相比,FITC-葡聚糖是外源性的,与白蛋白的结合亲和力可以忽略不计。因此,FITC-葡聚糖保持游离状态,不受白蛋白和组织蛋白等大分子的束缚。因此,如果根据体重给药,FITC-葡聚糖可以在相同的血液浓度下起作用,并且不受血清白蛋白浓度和血容量个体差异的影响。采用中药通心络 (TXL) 检测该方法的诊断敏感性。天仙液通过维持内皮细胞超微结构和内皮屏障完整性来降低 MIRI14。天仙液也用于治疗心绞痛,临床上改善梗死后心肌无回流15。它包含人参、Buthus martensi、Hirudo、Eupolyphaga seu steleophaga、Scolopendra subspinipes、Periostracum cicadae、Radix paeoniae rubra、Semen ziziphi spinosae、Lignum dalbergiae odoriferae、Lignum santali albi 和 Borneolum syntheticum。天仙液已被证明可通过 MEK/ERK 通路16 和内皮一氧化氮合酶介导的机制 5,17 保护微血管内皮细胞,并以剂量依赖性方式减轻器官18 的缺血/再灌注损伤 (IRI),尤其是心脏。在这里,如19所述,用 0.5 g/kg TXL 粉末(与人类临床使用的剂量相当)喂养大鼠。本文提供了一种通过测量与 EB 相比外渗的 70,000 Da FITC-葡聚糖的总荧光强度来功能评估 IR 后心脏微血管内皮屏障的方法。
研究方案
根据美国国立卫生研究院颁布的《实验动物护理和使用指南》(美国马里兰州贝塞斯达,NIH 出版物第 85-23 号,1996 年修订)和北京动物护理委员会(1996 年)发布的“实验动物护理和使用条例”进行动物实验。该研究方案得到了阜外医院实验动物护理委员会的批准。本研究使用体重为 150-180 g 的雄性 SPF 级 Sprague-Dawley 大鼠 (SD 大鼠)。
1. 试剂、材料和设备的制备
- 制备试剂和溶液,包括 70% 乙醇、FITC-葡聚糖(70,000 Da,溶于冰冷的盐水中制成 10% w/v 溶液供使用)、脱毛霜、含 4',6-二脒基-2-苯基吲哚的封固剂(DAPI,0.5-10 μg/mL),1% w/v EB/盐水溶液和 5% w/v 戊巴比妥钠/盐水溶液(在 4 °C 避光中储存)。
- 提前对所有手术工具和材料进行消毒,包括手术胶带;纱布垫;手术手套;16 G 气管插管;胰岛素注射器;作剪刀;大型弯曲的解剖钳;直解剖钳;直蚊钳;弯曲的蚊子镊子;牵开器 (30 mm Spread);5 cm 微针架;3-0 聚丙烯缝合线(锥形针);和 6-0 聚丙烯缝合线(圆针)。
- 检查并确保所有设备,包括恒温加热系统、照明系统、呼吸机、自动定量病理成像系统和紫外线冷冻切片机,都处于良好状态。
2. 为大鼠进行外科手术准备
- 将所有 SD 大鼠随机分为 Sham 组、IR 组和 TXL 组 (IR+TXL 组)。
注意:在该方案中,每组随机分配 6 只大鼠,n=6。 - 称量每只 SD 大鼠,记录体重,并计算每只大鼠要施用的 TXL 剂量。
- 在开胸手术前至少 12 小时通过管饲法向每只大鼠施用 30 mg/kg 剂量的布洛芬,以减轻术前疼痛和痛苦。
- 如所述,在麻醉前,通过管饲法 12 小时和 1 小时向 IR+TXL 组的每只 SD 大鼠以 0.5 g/kg 的剂量给予超细 TXL 粉末,如19 所示。
- 用 70% 乙醇对手术台进行消毒,并将消毒的手术工具和材料放在消毒的表面上。
- 调节恒温加热系统的温度,使大鼠的体温保持在 37 ± 1 °C。
3. 建立大鼠心脏缺血/再灌注模型
- 以 50 mg/kg(0.1 mL/100 g 体重)的剂量将 5% w/v 戊巴比妥钠/磷酸盐缓冲盐水 (PBS) 溶液注射到腹腔中以麻醉大鼠。通过剃须或使用脱毛膏小心地去除从颈部到胸部的毛皮,准备手术部位。
- 根据需要用消毒过的镊子轻轻调整舌头的位置,并用消毒过的棉球擦拭呼吸道分泌物。保持声门清晰可见,并将气管插管轻轻插入气管。
- 将气管插管连接到以每分钟 65-80 次呼吸的速度旋转的呼吸机上,并通过固定大鼠的头部和四肢将潮气量调整为 4-5 mL。
- 将无菌窗帘放在大鼠身上,用碘酊剂和 70% 乙醇对手术区域进行消毒,然后重复此过程 3 次。
- 在第四肋间隙水平做一个左胸骨旁切口,露出左胸大肌和胸小肌。
- 使用钝器解剖技术解剖胸大肌和胸小肌之间的筋膜,露出左第四肋间隙。
注意:避免过度的组织损伤和血管损伤,否则会导致严重出血和术后死亡。 - 解剖肋间肌,将胸部牵开器置于第四肋间隙内,然后张开肋骨。
- 撕开心包并去除附着的脂肪组织。
注意:避免使用锋利的手术器械损伤其他器官,尤其是肺部。肺部损伤会导致手术过程中发生气胸和气胸,导致从血流动力学障碍到动物存活率降低等严重后果。 - 纵胸腺的位置,轻轻地暴露升主动脉和左心房。识别并用 6-0 聚丙烯缝合线瞬时连接左前降支 (LAD) 近端 45 分钟(参见图 1 A-D)。
注意:该程序与假对照大鼠相同,只是 LAD 未结扎。 - 拆下胸部牵开器,用 3-0 聚丙烯缝合线以间断缝合模式将肋骨拉在一起。
- 恢复负胸内压,以确保有效呼吸。
注意:可以使用两种方法来恢复胸腔内负压:i) 在关闭胸腔之前,研究人员可以堵塞呼吸机的出风口 2 个周期以使肺部充气。ii) 肋间隙关闭后,可以用注射器抽出留在胸腔中的空气。 - 脱毛消毒后,在右下肢切开,从右股静脉解剖浅筋膜。
- 诱发心肌缺血 45 分钟后松开结扎并检查呼吸和循环情况。
- 以 0.15 mL/100 g 体重将 10% (w/v) FITC-葡聚糖/盐水溶液注射到股静脉中,并用无菌棉球按压股静脉 1 分钟以止血(图 2A、B)。
注:或者,以 0.5 mL/100 g 体重的剂量将 1% w/v EB/盐水溶液注射到股静脉中。 - 如上所述,用 3-0 聚丙烯缝合线缝合切口并对切口进行消毒,然后用布洛芬进行术后镇痛。
4. 制备用于荧光测量的冷冻组织切片
- 以 150 mg/kg (0.3 mL/100 g 体重) 的剂量腹膜内注射 5% w/v 戊巴比妥钠/PBS 溶液,以在心肌再灌注 3 小时后对大鼠进行深度麻醉。
- 切开腹腔,露出腹主动脉和腔静脉(见 图 3A)。
- 将 50 mL 冰冷的 PBS 稳定注入腔静脉,切开腹主动脉以冲洗心肌中的血液,并收获心脏。
注意:观察肺和肝的变化。出汗的肝脏表明盐水被准确地注射到腔静脉中(见 图 3C),而苍白的肺被认为是心肌灌注良好的标志(见 图3B)。 - 在暗室中,用冰冷的生理盐水或 PBS 轻轻冲洗心脏,以去除心腔中残留的血液和 FITC-葡聚糖(或 EB)。
- 从结扎处切掉心脏,丢弃结扎上方的心肌。
- 用包埋化合物将心脏包埋在模具中,然后在-80°C下储存。
- 从包埋模具中取出冷冻组织,并将其加载到冷冻切片机的预冷 -20 °C 腔室中的样品架上。
- 将单个切片的厚度调整为 5-8 μm,并在大约基顶点轴的中点(例如,缺血的中间)处切片组织。
- 将切片的组织加载到粘性显微镜载玻片上,并用一滴(约 40 μL)含有 DAPI 的荧光封固剂密封每个切片。
- 将载玻片放在干燥避光的盒子中。
注意:如果无法立即扫描载玻片,请将其存放在干燥、阴凉和黑暗的地方,以防止形成冷凝水和荧光猝灭。
5. 荧光测量和数据分析
- 设置成像系统并检查连接到扫描仪的软件。
- 将玻片装入玻片架中,然后将其插入扫描仪中。
- 打开玻片扫描仪软件(参见 材料表),然后单击 Edit Protocol |新增功能。。。。
注:如果扫描仪或其附属软件不可用,激光共聚焦显微镜(参见 材料表)或其他具有荧光模式的普通载玻片扫描仪(参见 材料表)可能是自动定量荧光扫描仪的替代品。 - 重命名方案和研究,然后选择 荧光 模式。
- 定义全玻片扫描 |像素分辨率和多光谱区域 |像素分辨率分别为 0.25 μm (40x)。
- 单击 Edit Filters and Bands..., 选择 Whole Slide Scan Filters 列和 Multispectral Region Bands 列。
注:如果使用 EB,请选择 “全玻片扫描过滤器”|”DAPI 和 Texas Red 或 AF495。如果使用 FITC-葡聚糖,请选择 多光谱区域波段 |DAPI 和 FITC 或 AF488。 - 点击 Edit Exposures...(编辑曝光)... ,然后加载运营商。
- 选择目标插槽,然后单击 Take overview。
注意:这将对每个心脏部分进行明场扫描。选择要聚焦的心肌或盲目选择区域。 - 选择目标载玻片,将 载物台高度 调整为大约 -50 μm,然后单击 Auto Focus。
- 单击 “Whole Scan Exposure(ms)-DAPI” |自动曝光。
注意:每张幻灯片的 DAPI 曝光时间不必相同,因为使用 DAPI 的图像来说明心脏的横截面,这有助于勾勒心肌区域,但不能计算荧光密度。 - 单击 “全扫描曝光(毫秒)-FITC” |自动曝光。
注意:单击 “全扫描曝光(毫秒)-德州红” |Autoexpos (如果使用 EB)。重要的是要记住并确保 FITC 或 Texas Red 的曝光时间在所有玻片扫描中都相同。 - 再次单击 Auto Focus 并确保幻灯片处于焦点上。
- 单击 Back 并保存协议。
- 对每张幻灯片重复步骤 5.7-5.14。
- 返回主页并单击 Scan Slides。
- 选择一个插槽,重命名所有幻灯片,然后为每张幻灯片选择相应的曝光协议。
- 扫描载玻片并捕获图像。
- 使用幻灯片查看器软件打开图像以进行扫描(请参阅 材料表)。
- 将所有图像放大到相对相等的程度。
- 将图像快照并保存为 .tiff。
注意:最好同时保存带和不带比例尺的图像。带有比例尺的图像可用于发布,而没有比例尺的图像可用于统计分析。 - 打开 ImageJ 软件,单击 分析,然后选择 设置测量。
- 选择 区域 |积分密度。
- 使用图像 J 在 FITC 通道中打开图像。
- 再次单击 Analyze(分析 )并记录出现的积分密度 (IntDen) 的数值。
注意:由于图像中的比例尺可能会被计算机误认为是荧光的灰度,因此请使用没有比例尺的图像来测量 IntDen。 - 关闭 FITC 图像,然后在 DAPI 通道中打开该图像。
- 勾勒出心肌的横截面。
- 单击 Analyze and collect Area data( 分析和 收集 区域 数据)。
- 计算每个心脏的 IntDen/Area (荧光平均值) 的比率。
- 在统计分析软件中输入所有比率。
结果
在进行 FITC-葡聚糖测定以评估 IR 后心脏内皮通透性的变化之前,我们强烈建议由专门建立大鼠心肌 IR 模型的同一研究人员进行实验,以确认冠状动脉成功闭塞在同一位置,并且缺血面积/总面积的比率在所有大鼠之间是恒定的。如图 1A、B 所示,心脏(由黄色箭头表示)暴露出来,并且在位于左心室前壁的心肌中形成一个环(由绿色箭头表示),在左心耳边缘下方约 2 毫米处,带有 0.5 毫米(内径)毛细管硅胶管和 6-0 缝合线。如图 1C 所示,当环被固定时,缺血心肌立即从粉红色变为灰粉红色(由白色箭头表示)。
此外,在环松开后,心肌立即再灌注并恢复其粉红色,如图 1D 所示。松开环后,在大腿内侧平行于股骨长轴做一个切口。股静脉暴露并用胰岛素注射器穿刺,如图 2A、B 所示。再灌注 3 小时后,在下腹部做一个 “V ”形切口,并从腹膜中解剖腹主动脉和腔静脉(图 3A)。将冷盐水轻轻注入腔静脉,并切开腹主动脉,以防止脑室壁因脑室内压而过度拉伸,从而影响其组织病理学结构。漂白的肺( 图 3B 中的红色箭头)和 图 3C 中的肝脏表明组织用盐水灌注良好。
因此,三组之间的横截面积没有显着差异:假手术组为 1.00 ± 0.08 与 IR 组为 0.97 ± 0.08 与 IR+TXL 组为 1.02 ± 0.04(图 4A,每组 n = 6,p > 0.05 在任意两组之间)。如图 4B,C 所示,假大鼠整个切片中绿色荧光的平均强度极低。相比之下,外渗的 FITC-葡聚糖发出的荧光在 IR 组中显著增加,标准化为 Sham 组 (IR 组为 5.52 ± 0.85,而 Sham 组为 1.00 ± 0.19,n = 6,p < 0.05)。此外,已知可保护心脏微血管内皮的 TXL 超细粉末14,16,显著逆转了 IR 诱导的高荧光强度(IR+TXL 组为 2.87 ± 0.52,IR 组为 5.52 ± 0.85,n = 6,p < 0.05)。区域心肌的图像表明,FITC-葡聚糖压倒性地积累在细胞外基质中,但不在微血管中积累,并且 TXL 改善了内皮屏障功能(图 5)。
与 FITC-葡聚糖相比,EB 可能是一种次优替代方案,因为 EB 在图像质量和灵敏度上都不如 70,000 Da FITC-葡聚糖。同样,三组之间的横截面积无显著差异:假手术组为 1.00 ± 0.08 vs. IR 组为 0.97 ± 0.08 vs. IR+TXL 组为 0.98 ± 0.05(补充图 S1A,每组 n = 6,任意两组之间 p > 0.05)。如 补充图 S1B,C 所示,假大鼠整个横截面中红色荧光的平均强度相对较高,尤其是在心内膜和心外膜。虽然 IR 组 EB 发出的红色荧光急剧增加 (IR 组为 4.41 ± 0.66 vs. Sham 组为 1.00 ± 0.22,n = 6,p < 0.05),但 IR+TXL 组和 IR 组之间的差异不显著(IR+TXL 组为 3.73 ± 0.47,IR 组为 4.41 ± 0.66, n = 6,p = 0.0956)。
此外,该方法在心肌梗死 (MI) 模型中进行了测试(补充图 S2)。在 Myocardial Infarction Injection first (MII) 组中,在 LAD 连接前 5 分钟将 FITC-葡聚糖溶液 (如前所述的相同浓度) 注射到循环中。这与本协议前面描述的 MIL 大鼠 (Myocardial Infarction Ligation) 连接后立即注射的 FITC-葡聚糖溶液形成对比。有趣的是,在两组的 MI 大鼠中,只有少量的 FITC-葡聚糖外渗到受伤心肌的 ECM 中,在 补充图 S2 中由微弱的绿色荧光强度表示。
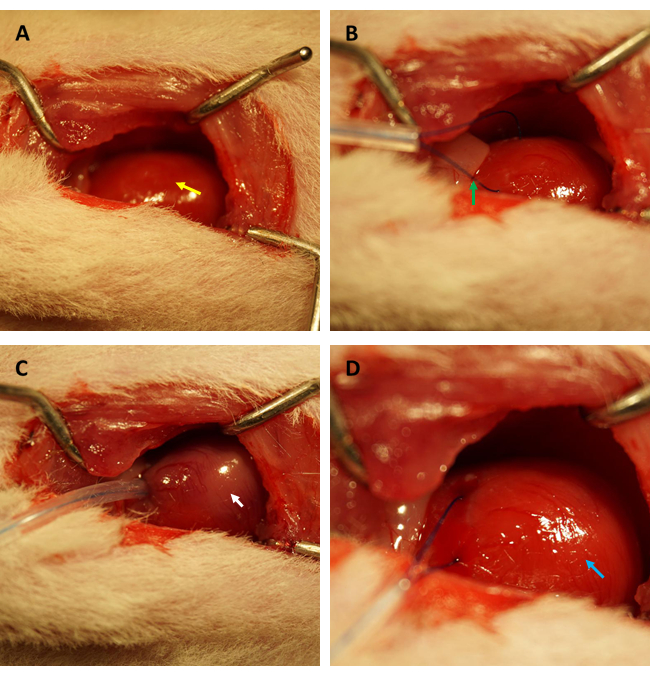
图 1:大鼠模型中开胸术的视野和缺血/再灌注的建立。 (A) 露出大鼠的心脏(用黄色箭头表示);(B) 形成一个环来环绕冠状动脉(用绿色箭头表示);(C) 固定环并诱导心肌缺血 45 分钟(由白色箭头表示);(D) 松开袢,让心肌再灌注 3 小时(由蓝色箭头表示)。 请单击此处查看此图的较大版本。
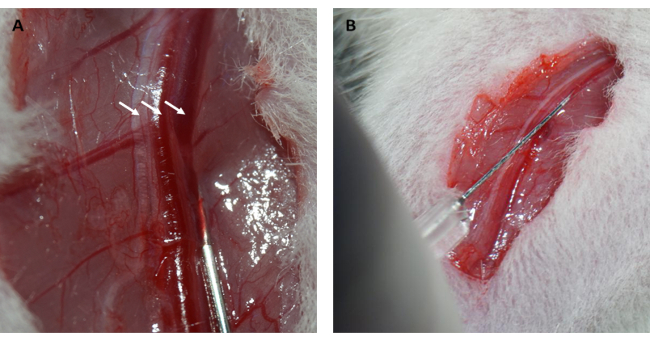
图 2:股静脉夹层和静脉注射。 (A) 暴露股静脉(股神经由左侧箭头表示;股动脉由中间的箭头表示;股静脉由右侧的箭头表示)。(B) 用胰岛素注射器将 FITC-葡聚糖溶液注射到股静脉中。缩写:FITC = 异硫氰酸荧光素。 请单击此处查看此图的较大版本。
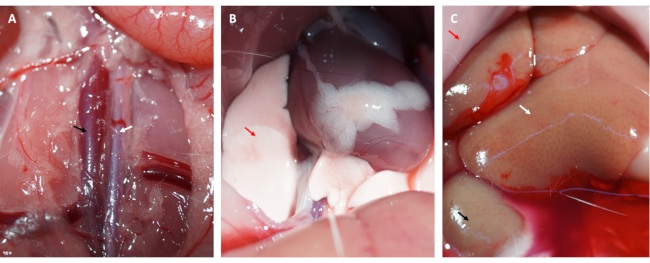
图 3:组织灌注和有效灌注的症状。 (A) 解剖腹主动脉和腔静脉(腹主动脉由白色箭头表示;腔静脉由黑色箭头表示)。(B) 漂白的肺是灌注充足的症状;(C) 漂白的粘膜、漂白的肾脏和出汗的肝脏都是充分灌注的症状(红色箭头:粘膜;白色箭头:肝脏;黑色箭头:肾脏)。 请单击此处查看此图的较大版本。

图 4:通过 FITC-葡聚糖染色对平均荧光强度的代表性图像和分析。 (A) 归一化为 Sham 组的每组相对横截面积 (p > 0.05);(B) 每组 FITC 通道中的相对荧光强度归一化为 Sham 组的荧光强度;(C) 每组中 9.5 倍放大倍率的代表性图像。比例尺 = 800 μm。使用 Tukey 的 事后 多组比较的单向方差分析。* vs. Sham 组,p < 0.05;# vs. IR 组,p < 0.05。条形图显示 SD ±组均值。缩写: IR = 缺血/再灌注;TXL = 同心罗;FITC = 异硫氰酸荧光素;DAPI = 4',6-二脒基-2-苯基吲哚;方差分析 = 方差分析;SD = 标准差。 请单击此处查看此图的较大版本。

图 5:FITC-葡聚糖染色后每组在 200 倍放大倍率下感兴趣区域的代表性图像。 比例尺 = 50 μm。缩写: FITC = 异硫氰酸荧光素;DAPI = 4',6-二脒基-2-苯基吲哚。 请单击此处查看此图的较大版本。
补充图 S1:埃文思蓝染色的平均荧光强度的代表性图像和分析。 (A) 与 Sham 组的相对横截面积归一化为 Sham 组的相对横截面积 (p > 0.05);(B) 每组 Texas 红色通道中的相对荧光强度归一化为 Sham 组的荧光强度;(C) 每组中的代表性图像。使用 Tukey 的 事后 多组比较的单向方差分析。比例尺 = 800 μm。* vs. Sham 组,p < 0.05。条形图显示 SD ±组均值。缩写: IR = 缺血/再灌注;TXL = 同心罗;DAPI = 4',6-二脒基-2-苯基吲哚;方差分析 = 方差分析;SD = 标准差。 请点击此处下载此文件。
补充图 S2:心肌梗死模型中 FITC-葡聚糖染色的 9.5 倍放大率的代表性图像。 比例尺 = 800 μm。缩写:MII=心肌梗死先注射(心肌梗死前注射FITC-葡聚糖);MIL = 首先进行心肌梗死结扎(心肌梗死后立即注射 FITC-葡聚糖);FITC = 异硫氰酸荧光素;DAPI = 4',6-二脒基-2-苯基吲哚。 请点击此处下载此文件。
讨论
本文提出了一种方案来评估暴露于 MIRI 后心脏内皮屏障功能障碍。应该注意的是,该协议中有几个关键步骤决定了结果的可靠性和准确性。所有涉及 FITC-葡聚糖的步骤均应在暗室中进行。FITC-葡聚糖/盐水溶液必须储存在 4 °C 并用锡箔包裹。此外,必须结扎冠状动脉,如图 1 所示,以便在袢松动后可以立即对心肌进行再灌注。研究人员可以选择 5-0 或 6-0 聚乙烯缝合线,因为低于 7-0 的较细线更有可能切断心肌纤维和血管。重要的是,示踪剂溶液应注射到股静脉而不是尾静脉中。每颗心脏在被处死之前和之后,应分别用冰冷的盐水灌注和冲洗。
许多专门研究 MIRI 的研究人员倾向于研究心肌再灌注早期内皮细胞结构被破坏的情况——凋亡小体的形成、线粒体肿胀和细胞间连接异常——以通过电子显微镜检查证明内皮的高通透性。免疫印迹也被用于测量微血管通透性,因为紧密连接蛋白水平的降低被认为是随着时间的推移内皮损伤和内皮屏障功能障碍的核心机制。例如,VE-钙粘蛋白20 和 β-catenin21 是内皮细胞间粘附连接的关键元件,这些连接有助于维持血管完整性22。紧密连接,如 JAM-A23,24 和 occludin25,也协同参与循环系统中内皮屏障的构建。
目前,越来越多的研究表明,线粒体功能和线粒体稳态可能是防止再灌注损伤的保护途径的关键目标。正如病理生理学和药理学研究报道的那样,线粒体自噬可在 IR26 诱导的内皮细胞和心肌细胞死亡中发挥重要作用。此外,线粒体裂变、线粒体蛋白质稳态和线粒体质量控制可以保护再灌注区域的高危心肌27,28。上述方法更侧重于证明高通透性的不同机制或原因,而不是直接和直观地显示内皮通透性。此外,用于电子显微镜检查的样品制备复杂且危险。电子显微镜检查中使用的戊二醛、丙酮和锇酸溶液可能会挥发和腐蚀粘膜、结膜和皮肤,如果在不受控制的环境中使用,甚至会威胁生命。
与这些间接和危及生命的方法相比,这种方法测量 FITC-葡聚糖外渗发出的荧光强度,是评估心脏微血管通透性的理想选择。首先,70,000 Da FITC-葡聚糖在正常生理条件下不能穿透内皮,但在 IR 下可以进入心肌间质间隙,这使得不同处理下的大鼠之间有明显的区分。此外,FITC-葡聚糖溶液通过股静脉注射到血液中,这保证了所有液体都被注射到大鼠的循环中。相比之下,大鼠的尾静脉注射更困难,因为尾静脉模糊不清,覆盖着厚厚的层。此外,与常规的多聚甲醛固定和石蜡包埋不同,使用本研究中使用的快速冷冻病理切片技术简化和优化了心肌组织治疗。储存时间短、避光环境和冷冻保存可以共同减轻 FITC 的荧光猝灭。
更重要的是,这种方法可以最大限度地减少统计分析过程中的选择偏差。我们用生理盐水进行足够的心脏灌注,以确保几乎所有与 FITC-葡聚糖混合的血液都从心肌和心腔中喷出,这可以消除残留在血管中的任何 FITC 发出的荧光。如果不是这种情况,则应排除与毛细管合并的荧光并人工修剪。在从感兴趣区域收集组织时,缺血心肌和远端心肌之间未观察到视觉边界,尤其是在 EB 染料染色后。这阻碍了从这些代表性地区收集样本。使用本文描述的方法,研究人员可以获得整个切片的图像,并使用定量滑块扫描仪分析荧光强度。
有趣的是,EB 染料可以是 FITC-葡聚糖的替代品,尽管不是最佳选择。与 FITC-葡聚糖相对苛刻的储存条件相比,EB 粉末或其溶液可以在室温下长期保持稳定。此外,EB 对于大多数机构来说相对便宜。尽管如此,某些缺点可能会限制其应用。首先,EB 染色的敏感性低于 FITC-葡聚糖,这可能低估了组间的差异并增加每组的样本量。此外,EB 对蛋白质的粘附性更强。心内膜和心外膜更容易被 EB 染色,这会影响荧光密度的结果。此外,再灌注区明显的填充缺陷显着降低了图像质量,这可能会限制 EB 的使用。
为了扩展该方法在 MI 模型中的应用,该方法在 MI 模型中进行了测试。首先,在 LAD 结扎后将 FITC-葡聚糖注射到血管中。正如预期的那样,由于血流中的 FITC-葡聚糖无法通过连接部位,并且没有 FITC-葡聚糖进入缺血区域,因此切片发出低水平的荧光。连接前 5 分钟也应用 FITC-葡聚糖,以确保 FITC-葡聚糖进入所有器官。因此,FITC-葡聚糖未能穿透微血管内皮,可能是因为结扎血管中的灌注压力不能驱动 FITC-葡聚糖穿过内皮。一般来说,这种方法可能需要更多的修改才能满足它在 MI 模型中的应用。
尽管具有上述优点,但这种方法存在局限性。首先,该方案未在其他动物的 IR 模型中进行测试,这可能会限制其在临床前和临床研究中的应用。其次,FITC 标记的染料比 EB 等其他常见染料更昂贵。然而,与 EB 不同的是,由于用血清稀释的 10% w/v FITC-葡聚糖溶液很少改变心肌的颜色,FITC-葡聚糖染色和 EB/2,3,5-三苯基四唑氯化物 (TTC) 双重染色可以在同一心脏中进行,这可以减少动物数量和所用染料的预算。最后,本研究中使用的玻片扫描仪 - 定量幻灯片扫描仪和类似仪器 - 在某些实验室中可能不可用。总之,该方案提出了一种简化、可靠和可视化的方法,用于使用基于自动定量病理成像系统的荧光测定在大鼠的 IR 模型中检测心脏微血管内皮通透性。该方案表明,70,000 Da FITC-葡聚糖在 IR 损伤后心脏微血管内皮屏障的功能评估中表现优于 EB。
披露声明
作者声明没有利益冲突。
致谢
本研究得到了国家重点研发计划(No. 2017YFC1700503)和国家自然科学基金(No. 81874461 and No. 81774292)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
参考文献
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -. D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -. H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59 (2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349 (2019).
- Li, B. -. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032 (2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037 (2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403 (2018).
- Zhang, H. -. T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -. H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775 (2017).
- Yu, Z. -. H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -. X., Wang, P., Wang, N. -. N., Li, S. -. D., Yang, M. -. H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485 (2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23 (2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156 (2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。