Method Article
虚血/再灌流ラットモデルにおける心臓微小血管内皮バリアの透過性を評価するための蛍光アッセイ
* これらの著者は同等に貢献しました
要約
ここでは、血管外漏出した70,000 Da FITC-デキストランの平均蛍光強度をEvans Blueと比較して測定することにより、虚血/再灌流障害後の心臓微小血管の内皮バリアを機能的に評価する方法について述べる。
要約
原因動脈の血行再建術は、経皮的冠動脈インターベンションや冠動脈バイパス移植に関係なく、急性冠症候群 (ACS) 患者の臨床予後を改善するための最良の戦略と考えられています。それにもかかわらず、効果的な血行再建術後の心筋再灌流は、心筋虚血/再灌流障害(MIRI)として知られる重大な心筋細胞死と冠状動脈内皮虚脱を引き起こす可能性があります。通常、内皮細胞とその細胞間タイトジャンクションは、微小血管内皮バリアとその比較的低い透過性を協調的に維持しますが、再灌流領域では失敗します。
虚血/再灌流(IR)によって誘発される微小血管内皮過透過性は、心筋浮腫、炎症誘発性細胞の浸潤の増加、および心筋内出血の悪化に寄与し、ACSの予後を悪化させる可能性があります。.この研究で使用されたトレーサー (70,000 Da FITC-デキストラン) は、フルオレセイン イソチオシアネート (FITC) によって標識された分岐グルコース分子であり、通常の状態では心臓微小血管内皮に浸潤するには大きすぎるようです。ただし、MIRI後に壊れたバリアに侵入することはできます。したがって、内皮透過性が高いほど、FITC-デキストランは血管外細胞間空間に蓄積します。したがって、FITCからの蛍光強度は、微小血管内皮バリアの透過性を示すことができます。このプロトコルでは、FITC-デキストランを利用して、心臓の微小血管内皮バリアを機能的に評価し、これは自動化された定量的病理イメージングシステムによって検出されます。
概要
何十年にもわたって血行再建術の恩恵を受ける冠状動脈性心臓病の患者が増えているという事実は、MIRIの致命的な結果を否定するものではありません。Yellon と Hausenloy が説明したように、最終的な梗塞サイズの約 30% は MIRI1 に起因する可能性があります。心臓微小血管内皮機能障害は、MIRIと「ノーリフロー」現象の根底にある中核的なメカニズムであり、多くの心臓保護剤と古典的な心臓保護経路の標的です2。さらに、微小血管の内皮過透過性は、心筋浮腫3 および好中球4、マクロファージ、およびエルスロサイト5を含む炎症誘発性細胞の過剰浸潤を引き起こす可能性がある。
MIRIによって誘発される酸化ストレスと過剰発現した炎症誘発性サイトカイン(腫瘍壊死因子ファミリー6 およびインターロイキンファミリー7のメンバーなど)は、細胞アポトーシスのシグナル伝達経路を活性化して虚血性心筋の死を促進します。赤血球は脆弱な内皮バリアを貫通し、細胞外マトリックス(ECM)に蓄積して心筋内血腫8を形成します。マクロファージおよび好中球由来のマトリックスメタロプロテイナーゼは、ECMでコラーゲンを分解し、機械的合併症および梗塞後心室動脈瘤のリスクを高めます9。したがって、内皮バリアの透過性は、急性心筋梗塞の予後評価にとって重要な兆候であり、MIRIの重症度をある程度示しています。
FITC-デキストランは、4,000 Daから70,000 Daまでの分子量の異なる長さの分岐グルコース分子からなる多糖類の配列です。これは、特定の治療および病理学的条件下での細胞膜、血液脳関門10などの機能生理学的障壁、および粘膜11 の透過性を実証するための標準トレーサーとして広く使用されています。1つの特定のメンブレンの透過性は、分子量に応じて物質によって異なります。通常、アルブミンは心臓の微小血管に限定されます。ただし、IRの初期段階で内皮を貫通し、心筋浮腫を引き起こす可能性があります。アルブミンの分子量は約68,000Daであるため、IR後に内皮過透過性を示すには70,000DaのFITC-デキストランは適切な薬剤であると考えられる。また、デキストランはショック患者の血液量やコロイド浸透圧の維持に広く採用されており、FITC標識トレーサーは多くの in vivo または in vitro 試験で使用されていますが、副作用はほとんどありません。
FITC-デキストランに加えて、内皮透過性はエバンスブルー(EB)染色で測定されています。血液循環に注射した後、EBは血清アルブミンにしっかりと結合し、複合体を形成します12。したがって、EB単独ではなく、このEB-アルブミン複合体を透過性の測定に使用することができ、これは、このようなEBベースの方法の精度が、実験対象における血清アルブミンの異なる濃度によって影響を受ける可能性があることを意味する。さらに、EBは、細胞の変性や血管透過性の増加を通じて、実験動物の臓器、特に心臓、肝臓、肺を毒することが報告されています13。虚血/再灌流を受けている内皮は、正常な内皮よりもそのような有害な影響に対してより敏感であり、実験結果の重要性を混乱させる可能性があります。
EB色素と比較して、FITC-デキストランは外因性であり、アルブミンへの結合親和性はごくわずかです。したがって、FITC-デキストランは遊離状態のままであり、アルブミンや組織タンパク質などの高分子に結合しません。したがって、体重に応じて投与すれば、FITC-デキストランは等しい血中濃度で作用し、血清アルブミン濃度と血液量の個人差の影響を受けません。伝統的な漢方薬であるTongxinluo(TXL)を使用して、この方法の診断感度をテストしました。TXLは、内皮細胞の超微細構造と内皮バリアの完全性を維持することにより、MIRIを減少させる14。TXLは、狭心症の治療や梗塞後の心筋の無リフローの改善にも臨床的に使用されています15。Radix ginseng、Buthus martensi、Hirudo、Eupolyphaga seu steleophaga、Scolopendra subspinipes、Periostracum cicadae、Radix paeoniae rubra、Semen ziziphi spinosae、Lignum dalbergiae odoriferae、Lignum santali albi、およびBorneolum syntheticumが含まれています。TXLは、MEK/ERK経路16および内皮一酸化窒素シンターゼ媒介メカニズム5,17を介して微小血管内皮を保護し、臓器18、特に心臓の虚血/再灌流障害(IRI)を用量依存的に緩和することが示されています。ここでは、ラットに0.5g/kgのTXL粉末(ヒトで臨床的に使用されたものと同等の用量)を与えられた19。この論文は、EBと比較した血管外漏出70,000 Da FITC-デキストランの総蛍光強度の測定を通じて、IR後の心臓微小血管の内皮バリアを機能的に評価する方法を提供します。
プロトコル
動物実験は、米国国立衛生研究所(NIH)が発行した「実験動物の管理と使用に関するガイド」(Bethesda, MD, USA, NIH Publication No. 85-23, revised 1996)および北京動物管理協議会の「実験動物の管理と使用に関する規則」(1996年)に従って行われました。この研究プロトコルは、福和病院の実験動物管理委員会によって承認されました。この研究では、体重150〜180 gの雄のSPFクラスSprague-Dawleyラット(SDラット)を使用しました。
1. 試薬・材料・機器の調製
- 70%エタノール、FITC-デキストラン(70,000 Da、氷冷生理食塩水に溶解して10% w/v溶液を調製)、脱毛クリーム、4',6-ジアミジノ-2-フェニルインドール(DAPI、0.5-10 μg/mL)、1% w/v EB/生理食塩水、5% w/v ペントバルビタールナトリウム/生理食塩水(暗所4°Cで保存)を含む試薬と溶液を調製します。
- 手術用テープを含むすべての手術器具と材料を事前に滅菌してください。ガーゼパッド;手術用手袋;16 G気管内チューブ;インスリン注射器;はさみの操作;大きく湾曲した解剖鉗子。まっすぐな解剖鉗子;まっすぐな蚊の鉗子;湾曲した蚊の鉗子;リトラクター(30mmスプレッド);5cmマイクロニードルホルダー;3-0ポリプロピレン縫合糸(テーパー針);6-0ポリプロピレン縫合糸(丸針)。
- 恒温温システム、照明システム、人工呼吸器、自動定量病理イメージングシステム、紫外線凍結スライサーを含むすべての機器が良好な状態にあることを確認します。
2. 外科的処置のためのラットの準備
- すべてのSDラットを偽グループ、IRグループ、TXLグループ(IR+TXLグループ)にランダムに分けます。
注:このプロトコルでは、6匹のラットが各グループ(n = 6)にランダムに割り当てられました。 - 各SDラットの体重を量り、体重を記録し、各ラットに投与するTXLの用量を計算します。
- イブプロフェンを30 mg / kgの用量で各ラットに強制経口投与し、開胸術の少なくとも12時間前に投与して、術前の痛みと苦痛を軽減します。.
- 記載されている19のように、麻酔前にIR+TXL群の各SDラットに12時間および1時間強制することにより、0.5g / kgの用量でTXLの超微粉末を投与する。
- 手術台を70%エタノールで消毒し、滅菌した手術器具と材料を消毒した表面に置きます。
- ラットの体温を37°C±1°Cに維持するために、恒温温システムの温度を調整します。
3. 心虚血・再灌流のラットモデルを確立する
- 50 mg / kg(0.1 mL / 100 g体重)の用量で5%w / vペントバルビタールナトリウム/リン酸緩衝生理食塩水(PBS)溶液を腹腔内に注入して、ラットに麻酔をかけます。.シェービングまたは脱毛クリームを使用して首から胸部までの毛皮を慎重に取り除き、手術部位を準備します。
- 滅菌したピンセットで必要に応じて舌の位置を優しく調整し、滅菌した綿球で呼吸器分泌物を拭きます。声門がはっきりと見えるようにし、気管内に気管チューブをそっと挿入します。
- 気管内チューブを毎分65〜80回の呼吸で旋回する人工呼吸器に接続し、ラットの頭と手足を固定して一回換気量を4〜5mLに調整します。
- 滅菌ドレープをラットにかぶせ、手術領域をヨウ素のチンキ剤と続いて70%エタノールで消毒し、この手順を3回繰り返します。
- 第 4 肋間腔のレベルで左胸骨切開を行い、左大胸筋と小胸筋を露出させます。
- 鈍角解剖技術を使用して、大胸筋と小胸筋の間の筋膜を解剖し、左第4肋間腔を露出させます。
注:重度の出血や術後の死亡を引き起こす過度の組織損傷や血管損傷は避けてください。 - 肋間筋を解剖し、胸部リトラクターを第4肋間腔内に配置してから、肋骨を広げます。
- 心膜を引き裂き、付着した脂肪組織を取り除きます。
注:鋭利な手術器具、特に肺で他の臓器に損傷を与えないでください。肺が損傷すると、手術中に気胸や気胸が発症し、血行動態障害から動物の生存率の低下まで、不協和音的な結果を引き起こす可能性があります。 - 胸腺の位置を操作し、上行する大動脈と左心房を優しく露出させます。近位左前下行 (LAD) 動脈を 6-0 ポリプロピレン縫合糸で 45 分間一過性に同定し、結紮します ( 図 1 A-D を参照)。
注:この手順は、LADが結紮されないことを除いて、偽対照ラットと同じです。 - 胸部リトラクターを取り外し、3-0ポリプロピレン縫合糸で肋骨を縫合パターンで引き寄せます。
- 胸腔内陰圧を回復させ、効果的な呼吸を確保します。
注:陰性胸腔内圧を回復するには、2つの方法を使用できます:i)胸腔を閉じる前に、研究者は人工呼吸器の排気口を2サイクル塞いで肺を膨らませることができます。ii) 胸腔内に残っている空気は、肋間腔を閉じた後、注射器で引き出すことができます。 - 脱毛と消毒後、右下肢を切開し、右大腿静脈から表在筋膜を解剖します。
- 結紮を緩め、心筋虚血を45分間誘発した後、呼吸と循環の状態を確認します。
- 0.15 mL/100 g体重で大腿静脈に10%(w / v)FITC-デキストラン/生理食塩水を注入し、滅菌綿球で大腿静脈を1分間押して出血を止めます(図2A、B)。
注:あるいは、0.5 mL / 100 g体重の用量で1%w / v EB /生理食塩水を大腿静脈に注入します。. - 切開部を3-0ポリプロピレン縫合糸で縫い合わせ、切開部を消毒し、上記のようにイブプロフェンで術後鎮痛を行います。
4. 蛍光測定用凍結組織切片の調製
- 5% w / v ペントバルビタールナトリウム/ PBS溶液を150 mg / kg(0.3 mL / 100 g体重)の用量で腹腔内に注入し、心筋再 ?? 流の3時間後にラットを深く麻酔します。.
- 腹腔にスリットを入れ、腹部大動脈と大静脈を露出させます( 図3Aを参照)。
- 氷冷したPBS50mLを大静脈に着実に注入し、腹部大動脈を切開して心筋から血液を洗い流し、心臓を摘出します。
注:肺と肝臓の変化を観察します。発汗する肝臓は、生理食塩水が大静脈に正確に注入されていることを示唆しており( 図3Cを参照)、青白い肺はよく灌流された心筋の兆候と考えられています( 図3Bを参照)。 - 暗い部屋で、氷のように冷たい生理食塩水またはPBSで心臓をやさしく洗い流し、心臓の部屋から残っている血液とFITC-デキストラン(またはEB)を取り除きます。
- 結紮から心臓を切り取り、結紮の上の心筋を廃棄します。
- 埋埋込コンパウンドを型に埋め込んでから、-80°Cで保存します。
- 凍結した組織を埋め込み型から取り出し、凍結スライサーの-20°Cチャンバーで予冷したサンプルホルダーにロードします。
- 1つのスライスの厚さを5〜8μmに調整し、基部-頂点軸のほぼ中間点(例:虚血の中央)で組織をスライスします。
- スライスした組織を接着性顕微鏡スライドにロードし、各スライスをDAPIを含む蛍光封入剤1滴(約40μL)で密封します。
- スライドは乾燥した暗い箱に保管してください。
注意: スライドをすぐにスキャンできない場合は、凝縮水の形成や蛍光の消光を防ぐために、乾燥した涼しい暗い場所に保管してください。
5. 蛍光測定とデータ解析
- イメージングシステムを設定し、スキャナーに接続されているソフトウェアを確認します。
- スライドをスライドシェルフにセットし、スキャナーに挿入します。
- スライドスキャナーソフトウェアを開き( 資料の表を参照)、 Edit Protocol |新機能。。。。
注意: スキャナーまたはその関連ソフトウェアが利用できない場合は、レーザー共焦点顕微鏡( 材料の表を参照)または蛍光モードを備えた他の通常のスライドスキャナー( 材料の表を参照)が、自動定量蛍光スキャナーの代替品となる場合があります。 - プロトコールとスタディの名前を変更し、 蛍光 モードを選択します。
- ホールスライドスキャンの定義 |ピクセル解像度とマルチスペクトル領域 |ピクセル解像度はそれぞれ0.25μm(40倍)です。
- 「 Edit Filters and Bands... 」をクリックして、「 Whole Slide Scan Filters」 列と「 Multispectral Region Bands 」列を選択します。
注:EBを使用する場合は、[ ホールスライドスキャンフィルター]を選択します|DAPI および Texas RedまたはAF495。FITC-dextran を使用する場合は、 Multispectral Region Bands |DAPI と FITC または AF488。 - 「露出の編集...」をクリックし、キャリアをロードします。
- ターゲットスロットを選択し、[ Take overview]をクリックします。
注:これにより、各心臓セクションの明視野スキャンが行われます。ピントを合わせるために心筋を選択するか、盲目的に領域を選択します。 - 対象のスライドを選択し、 ステージの高さ を約-50μmに調整して、 オートフォーカスをクリックします。
- Whole Scan Exposure(ms)-DAPIをクリックします。自動露出。
注:DAPIを使用した画像は心臓の断面を示すために使用されるため、各スライドのDAPIの露光時間は同じである必要はありません。これは、心筋の面積の輪郭を描くのに便利ですが、蛍光密度を計算するのには便利です。 - Whole Scan Exposure(ms)-FITC |自動露出。
注: [Whole Scan Exposure(ms)-Texas Red |EB を使用している場合は自動露出 します。FITCまたはTexas Redの露光時間がすべてのスライドスキャンで同じであることを覚えておいて、確認することが重要です。 - [オートフォーカス]をもう一度クリックし、スライドにピントが合っていることを確認します。
- [戻る]をクリックして、プロトコルを保存します。
- スライドごとに手順5.7〜5.14を繰り返します。
- ホームページに戻り、[ スライドのスキャン]をクリックします。
- スロットを選択し、すべてのスライドの名前を変更して、各スライドに対応する露出プロトコルを選択します。
- スライドをスキャンして画像をキャプチャします。
- スキャン用のスライドビューアソフトウェアで画像を開きます( 資料の表を参照)。
- すべての画像を比較的均等に拡大します。
- スナップショットを撮り、.tiffとして画像を保存します。
注:スケールバーありとなしの画像を同時に保存することをお勧めします。縮尺バーのある画像は公開に使用でき、縮尺バーのない画像は統計分析に使用できます。 - ImageJソフトウェアを開き、[ 分析]をクリックして、[ 測定を設定]を選択します。
- エリア選択 |統合密度。
- FITC チャネルのイメージをイメージ J で開きます。
- 再度 Analyze をクリックし、表示される積分密度(IntDen)の数値を記録します。
注:画像内のスケールバーは、コンピューターによって蛍光のグレースケールと間違われる可能性があるため、スケールバーのない画像を使用してIntDenを測定してください。 - FITCイメージを閉じ、DAPIチャネルでイメージを開きます。
- 心筋の断面の輪郭を描きます。
- 「分析」をクリックし、エリアデータを収集します。
- 各心臓のIntDen/Area(蛍光の平均)の比率を計算します。
- 統計分析ソフトウェアにすべての比率を入力します。
結果
IR後の心臓内皮透過性の変化を評価するためにFITCデキストランアッセイを実行する前に、ラットの心筋IRモデルの確立を専門とする同じ研究者が実験を行い、冠動脈が同じ位置で正常に閉塞し、虚血領域/総面積の比率がすべてのラットで一定であることを確認することを強くお勧めします。図1A,Bに示すように、心臓(黄色矢印)を露出させ、左心室前壁に位置する心筋、左心耳の縁から約2mm下、0.5mm(内径)のキャピラリーシリコーンチューブと6-0縫合糸でループ(緑矢印)を形成した。図1Cに見られるように、ループを固定すると、虚血性心筋はすぐにピンク色から灰色がかったピンク色(白い矢印で示されています)に変わりました。
さらに、 図1Dに示すように、ループが緩んだ直後に心筋が再灌流され、ピンク色に回復しました。ループを緩めた後、大腿部の内側の大腿骨の長軸に平行に切開を行った。大腿静脈を露出させ、 図2A、Bに示すようにインスリン注射器で穿刺しました。3時間の再灌流後、下腹部に「V」字切開を行い、腹膜から腹部大動脈と大静脈を解剖しました(図3A)。冷たい生理食塩水を大静脈に穏やかに注入し、腹部大動脈を切開して、病理組織構造に影響を与える脳室内圧によって心室壁が過度に伸びるのを防ぎました。漂白された肺( 図3Bの赤い矢印)と 図3C の肝臓は、組織が生理食塩水で十分に再灌流されたことを示しています。
その結果、3つのグループ間で断面積に有意差はありませんでした:Shamグループで1.00±0.08、IRグループで0.97±0.08、IR+TXLグループで1.02±0.04(図4A、各グループでn = 6、任意の2つのグループ間でp>0.05)。図4B,Cに示すように、シャムラットの全切片における緑色蛍光の平均強度は極めて低かった。対照的に、血管外漏出したFITC-デキストランが放出する蛍光は、偽のグループに正規化されたIR群で顕著に増加しました(IR群で5.52±0.85対S.00±偽群で0.19、n = 6、p < 0.05)。さらに、心臓微小血管内皮を保護することが知られているTXL超微粉末14,16は、IRによって誘発される高い蛍光強度を著しく逆転させました(IR+TXL群で2.87 ± 0.52 vs IR群で5.52 ± 0.85、n = 6、p < 0.05)。所属心筋の画像は、FITC-デキストランが細胞外マトリックスに圧倒的に蓄積し、微小血管には蓄積しないこと、およびTXLが内皮バリア機能を改善することを示しました(図5)。
FITC-デキストランと比較すると、EBは画質と感度の両方で70,000 Da FITC-デキストランより劣るため、EBは最適ではない選択肢となる可能性があります。同様に、3つのグループ間で断面積に有意差はありませんでした:偽グループの1.00 ± 0.08 vs IRグループの0.97 ± 0.08 vs IR+TXLグループの0.98 ± 0.05(補足図S1A、各グループのn = 6、任意の2つのグループ間でp>0.05)。 補足図S1B,Cに示すように、シャムラットの全断面積における赤色蛍光の平均強度は、特に心内膜と心外膜において比較的高かった。EBによる赤色蛍光はIR群で急激に増加した(IR群±4.41 0.66 vs Sham群±1.00 0.22、n = 6、p < 0.05)、IR+TXL群とIR群の差は有意ではなかった(IR+TXL群3.73 ± 0.47 vs IR群±4.41 0.66 n = 6、p = 0.0956)。
さらに、この方法は心筋梗塞(MI)モデルでテストされました(補足図S2)。心筋Iおよびnjection I注入ファースト(MII)群では、LAD結紮の5分前にFITC-デキストラン溶液(前述の濃度と同じ濃度)を循環内に注入した。これは、このプロトコルで前述したMILラットのライゲーション直後に注入されたFITC-デキストラン溶液(心筋梗塞が最初に)とは対照的でした。興味深いことに、両群の心筋憂鬱ラットでは、損傷した心筋のECMに低量のFITC-デキストランが血管外漏出したことは、補足図S2の弱い緑色蛍光強度で示されています。
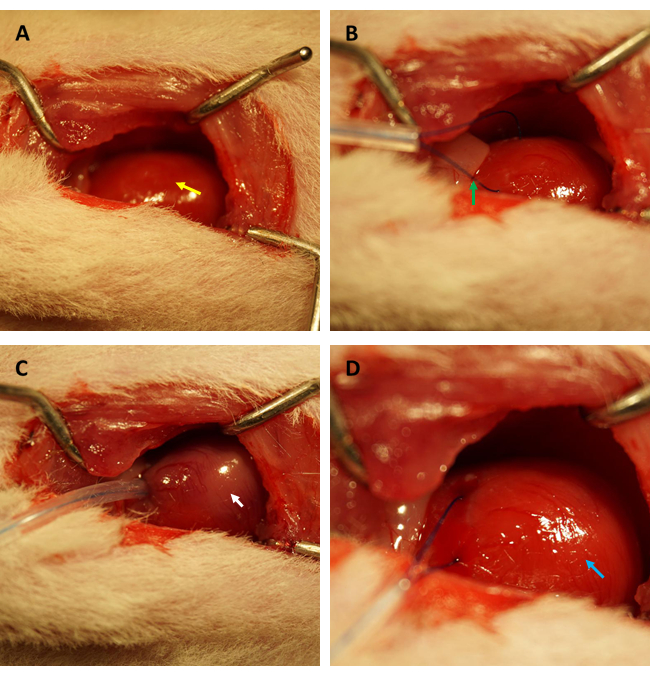
図1:ラットモデルにおける開胸術の視野と虚血/再灌流の確立。 (A)ラットの心臓を露出させる(黄色の矢印で示される)。(b)冠状動脈を囲むループを形成する(緑色の矢印で示される)ステップと、(c)ループを固定し、心筋虚血を45分間誘発する(白い矢印で示される)。(D)ループを緩め、心筋の再灌流を3時間可能にします(青い矢印で示されています)。 この図の拡大版を表示するには、ここをクリックしてください。
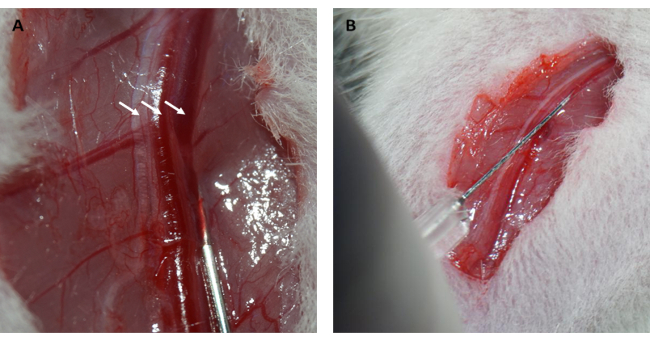
図2:大腿静脈の解剖と静脈注射。 (A)大腿静脈の露出(大腿神経は左の矢印、大腿動脈は中央の矢印、大腿静脈は右の矢印)を露出させる。(B)インスリン注射器でFITC-デキストラン溶液を大腿静脈に注入します。略語:FITC =フルオレセインイソチオシアネート。 この図の拡大版を表示するには、ここをクリックしてください。
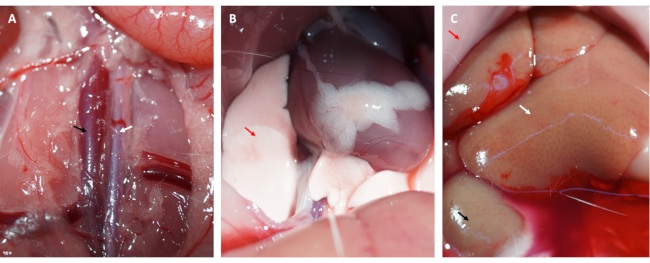
図3:組織灌流と効率的な灌流の症状(A)腹部大動脈と大静脈の解剖(腹部大動脈は白矢印で示し、大静脈は黒矢印で示しています)。(B)漂白された肺は、適切な灌流の症状です。(C)漂白された粘膜、漂白された腎臓、および発汗した肝臓はすべて適切な灌流の症状です(赤矢印:粘膜、白矢印:肝臓、黒矢印:腎臓)。この図の拡大版を表示するには、ここをクリックしてください。

図4:代表的な画像とFITCデキストラン染色による平均蛍光強度の分析 (A)各グループの相対断面積をシャムグループの相対断面積に正規化(p > 0.05);(B)各群のFITCチャネルにおける相対蛍光強度を、シャム群のそれに正規化した。(C)各群の倍率9.5倍の代表画像。スケールバー = 800 μm。Tukey の 事後 多重グループ比較による一元配置 ANOVA。* vs. シャムグループ、p < 0.05;# 対 IR グループ、p < 0.05。棒グラフはSD±群平均を示しています。略語:IR = 虚血/再灌流;TXL = トンシンルオ;FITC = フルオレセインイソチオシアネート;DAPI=4',6-ジアミジノ-2-フェニルインドール;ANOVA = 分散分析SD = 標準偏差。 この図の拡大版を表示するには、ここをクリックしてください。

図5:FITC-デキストラン染色後の各群の200倍の倍率での関心領域の代表的な画像。 スケールバー = 50 μm。略語:FITC =フルオレセインイソチオシアネート;DAPI=4',6-ジアミジノ-2-フェニルインドール。 この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:代表的な画像とEvans Blue染色による平均蛍光強度の分析。 (A)各グループの相対断面積をシャムグループの相対断面積に正規化したもの(p > 0.05)。(B)各群のテキサス赤チャネルにおける相対蛍光強度を、シャム群のそれに正規化した。(C)各グループを代表する画像。Tukey の 事後 多重グループ比較による一元配置 ANOVA。スケールバー = 800 μm. * 対 偽グループ、p < 0.05。棒グラフはSD±群平均を示しています。略語:IR = 虚血/再灌流;TXL = トンシンルオ;DAPI=4',6-ジアミジノ-2-フェニルインドール;ANOVA = 分散分析SD = 標準偏差。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:心筋梗塞モデルにおけるFITC-デキストラン染色の9.5倍倍率での代表的な画像。 スケールバー = 800 μm。略語:MII =心筋梗塞注射が最初に(心筋梗塞の前にFITC-デキストランを注射する);MIL = 心筋梗塞結紮が最初に (心筋梗塞の直後に FITC-デキストランを注射する);FITC = フルオレセインイソチオシアネート;DAPI=4',6-ジアミジノ-2-フェニルインドール。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この論文は、MIRIにさらされた後の心臓内皮バリアの機能不全を評価するためのプロトコルを提示します。このプロトコルには、結果の信頼性と精度を決定するいくつかの重要なステップがあることに注意してください。FITC-デキストランを含むすべての手順は、暗い部屋で実行する必要があります。FITC-デキストラン/生理食塩水は4°Cで保存し、スズ箔で包む必要があります。さらに、 図1に示すように、ループが緩んだ直後に心筋を再灌流できるように、冠状動脈を結紮する必要があります。研究者は、7-0未満の細いストリングが心筋繊維や血管を切断する可能性が高いため、5-0または6-0ポリエチレン縫合糸を選択できます。重要なのは、トレーサー溶液は尾静脈ではなく大腿静脈に注入する必要があるということです。各心臓は、犠牲になる前と後にそれぞれ氷のように冷たい生理食塩水で十分に灌流され、よくすすがれる必要があります。
MIRIを専門とする多くの研究者は、心筋再灌流の初期段階における内皮の細胞内構造の破壊(アポトーシス体の形成、ミトコンドリアの腫脹、細胞間接合の異常)を研究し、電子顕微鏡検査を通じて内皮の過透過性を証明しようとする傾向があります。イムノブロッティングは、タイト結合タンパク質のレベルの低下が内皮損傷および経時的な内皮バリアの機能不全の中核的なメカニズムと見なされているため、微小血管透過性の測定にも使用されています。例えば、VE−カドヘリン20およびβ−カテニン21は、内皮細胞間接着接合の重要な要素であり、これらの結合は血管完全性の維持に寄与する22。JAM-A23,24やオクルージン25などのタイトジャンクションも、循環器系の内皮バリアの構築に協力して関与します。
現在、ミトコンドリア機能とミトコンドリアの恒常性が再灌流障害に対する保護経路の主要な標的となり得ることを示唆する研究が増えています。病態生理学的および薬理学的研究で報告されているように、マイトファジーは、IR26によって誘発される内皮および心筋の細胞死に重要な役割を果たす可能性があります。さらに、ミトコンドリア分裂、ミトコンドリアタンパク質静止、およびミトコンドリアの品質管理は、再灌流領域27,28の高リスク心筋を保護する可能性がある。上記の方法は、内皮透過性を直接かつ視覚的に表示することよりも、過透過性の異なるメカニズムまたは原因を示すことに重点を置いています。また、電子顕微鏡検査のための試料調製は複雑で危険です。電子顕微鏡で使用されるグルタルアルデヒド、アセトン、および浸透酸溶液は、おそらく粘膜、結膜、および皮膚を揮発して侵食し、制御されていない環境で使用されると生命を脅かすことさえあります。
これらの間接的で生命を脅かす方法と比較して、FITC-デキストラン血管外漏出によって放出される蛍光強度を測定するこの方法は、心臓の微小血管透過性を評価するのに理想的です。まず、70,000 Da FITC-デキストランは、通常の生理学的条件下では内皮を貫通できませんが、IR下では心筋間質腔に入ることができるため、異なる治療を受けたラット間で明確に区別できます。さらに、FITC-デキストラン溶液は大腿静脈を介して血液に注入されるため、すべての液体がラットの循環に注入されます。対照的に、ラットでは尾静脈の注入が難しく、尾静脈が不明瞭で厚い層で覆われています。さらに、通常のパラホルムアルデヒド固定やパラフィン包埋とは異なり、心筋組織の治療は、この研究で使用された急速凍結病理切片技術を使用して簡素化および最適化されます。短い保存時間、耐光環境、および凍結保存により、FITCの蛍光消光が緩和される可能性があります。
さらに重要なことに、この方法により、統計分析中の選択バイアスを最小限に抑えることができます。FITCデキストランと混合されたほぼすべての血液が心筋と心腔から排出されるように、生理食塩水による十分な心臓灌流を行い、血管内に残っているFITCが放出する蛍光を排除することができます。そうでない場合は、毛細血管と融合した蛍光を排除し、人工的にトリミングする必要があります。関心のある領域から組織を採取している間、特にEB色素染色後、虚血性心筋と遠隔心筋との間に視覚的な境界は観察されませんでした。これにより、これらの代表的な地域からのサンプルの収集が妨げられました。本明細書に記載の方法を使用して、研究者は、全切片の画像を取得し、定量的スライダースキャナーを使用して蛍光強度を分析することができる。
興味深いことに、EB染料は、最適ではないものの、FITC-デキストランの代替品となる可能性があります。FITC-デキストランの比較的厳しい保存条件と比較して、EB粉末またはその溶液は室温で長期間安定な状態を保つことができます。さらに、EBはほとんどの機関にとって比較的安価です。それにもかかわらず、特定の欠点はその適用を制限する可能性があります。まず、EB染色はFITC-デキストランよりも感度が低いため、グループ間の違いが過小評価され、各グループのサンプルサイズが増加する可能性があります。また、EBはタンパク質への接着力が強いです。心内膜と心外膜はEBによって染色されやすく、蛍光密度の結果に影響を与える可能性があります。さらに、再灌流領域に明らかな充填欠陥があると、画質が著しく低下し、EBの使用が制限される可能性があります。
この手法を MI モデルで適用するために、この手法を MI モデルでテストしました。まず、LAD結紮後にFITC-デキストランを血管に注入しました。予想通り、血流中のFITC-デキストランが結紮部位を通過できず、FITC-デキストランが虚血領域に入らなかったため、スライスから低レベルの蛍光が放出されました。また、結紮の5分前にFITC-デキストランを塗布し、FITC-デキストランがすべての臓器に確実に通過するようにしました。その結果、FITC-デキストランは、おそらく結紮された血管内の灌流圧が内皮を介してFITC-デキストランを駆動できないため、微小血管内皮を貫通できませんでした。一般に、この方法は、MIモデルでのアプリケーションを満たすために、おそらく大幅に多くの変更が必要です。
上記の利点にもかかわらず、この方法には制限があります。まず、このプロトコルは他の動物のIRモデルでは試験されていないため、前臨床および臨床研究での適用が制限される可能性があります。第二に、FITC標識色素は、EBなどの他の一般的な色素よりも高価です。ただし、EBとは異なり、血清で希釈した10% w/v FITC-デキストラン溶液は心筋の色をほとんど変えないため、FITC-デキストラン染色とEB/2,3,5-トリフェニルテトラゾールクロリド(TTC)の二重染色を同じ心臓で行うことができ、動物の数と使用する染料に関して予算を削減できます。最後に、この研究で使用したスライドスキャナー(Quantitative Slide Scannerおよび同様の機器)は、一部の研究室では利用できない場合があります。要約すると、このプロトコルは、自動化された定量的病理イメージングシステムに基づく蛍光アッセイを使用して、ラットのIRモデルにおける心臓微小血管内皮透過性を検出するための、簡素化された信頼性の高い視覚的な方法を提供します。このプロトコルは、70,000 Da FITC-デキストランが、IR損傷後の心臓微小血管の内皮バリアの機能評価においてEBよりも優れたパフォーマンスを発揮することを示しています。
開示事項
著者は、利益相反を宣言しません。
謝辞
本研究は、中国国家重点研究開発プログラム(第2017YFC1700503号)および中国国家自然科学基金会(第81874461号および第81774292号)の助成を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
参考文献
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59(2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349(2019).
- Li, B. -R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032(2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037(2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403(2018).
- Zhang, H. -T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775(2017).
- Yu, Z. -H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -X., Wang, P., Wang, N. -N., Li, S. -D., Yang, M. -H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485(2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23(2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156(2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved