Method Article
허혈/재관류의 쥐 모델에서 심장 미세혈관 내피 장벽의 투과성을 평가하기 위한 형광 분석
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 허혈/재관류 손상 후 심장 미세혈관의 내피 장벽을 Evans Blue와 비교하여 유출된 70,000 Da FITC-dextran의 평균 형광 강도를 측정하여 기능적으로 평가하는 방법을 설명합니다.
초록
경피적 관상동맥 중재술 및 관상동맥 우회술과 관계없이 원인 동맥에 대한 혈관재생요법은 급성 관상동맥 증후군(ACS) 환자의 임상적 예후를 개선하기 위한 최선의 전략으로 간주됩니다. 그럼에도 불구하고, 효과적인 혈관재생술 후 심근 재관류는 심근허혈/재관류 손상(MIRI)으로 알려진 심각한 심근세포 사멸 및 관상동맥 내피 허탈을 유발할 수 있습니다. 일반적으로 내피 세포와 세포 간 밀접 연접은 미세혈관 내피 장벽과 상대적으로 낮은 투과성을 협력적으로 유지하지만 재관류 영역에서는 실패합니다.
허혈/재관류(IR)에 의해 유도된 미세혈관 내피 과투과성은 심근부종, 전염증성 세포의 침투 증가, 심근내 출혈 악화에 기여하여 ACS의 예후를 악화시킬 수 있습니다. 이 연구에 사용된 추적자인 70,000 Da FITC-덱스트란은 플루오레세인 이소티오시아네이트(FITC)로 표지된 분지 포도당 분자로, 정상 조건에서 심장 미세혈관 내피에 침투하기에는 너무 큰 것으로 보입니다. 그러나 MIRI 이후 부서진 장벽에 침투할 수 있습니다. 따라서 내피 투과성이 높을수록 혈관 외 세포 간 공간에 더 많은 FITC-덱스트란이 축적됩니다. 따라서 FITC의 형광 강도는 미세혈관 내피 장벽의 투과성을 나타낼 수 있습니다. 이 프로토콜은 FITC-dextran을 활용하여 심장 미세혈관 내피 장벽을 기능적으로 평가하며, 이는 자동화된 정량적 병리학 이미징 시스템에 의해 감지됩니다.
서문
수십 년 동안 관상동맥 심장질환을 앓고 있는 환자의 수가 증가하고 있다는 사실이 MIRI의 치명적인 결과를 부정하는 것은 아닙니다. 옐론(Yellon)과 하우젠로이(Hausenloy)가 설명한 바와 같이, 최종 경색 크기의 약 30%는 MIRI1에 기인할 수 있습니다. 심장 미세혈관 내피 기능 장애는 MIRI 및 "리플로우 없음(no-reflow)" 현상의 기저에 있는 핵심 메커니즘이며, 많은 심장 보호제와 고전적인 심장 보호 경로의 표적입니다2. 더욱이, 미세혈관의 내피 과투과성은 심근부종3 과 호중구4, 대식세포, 직후구5를 포함한 전염증성 세포의 과잉 침투를 유발할 수 있습니다.
MIRI 유발 산화 스트레스와 종양괴사인자(tumor necrosis factor)계열 6 및 인터루킨 계열(interleukin family7)과 같은 과발현된 전염증성 사이토카인(pro-inflammatory cytokine)은 세포 사멸의 신호 경로를 활성화하여 허혈성 심근의 사멸을 가속화합니다. 적혈구는 취약한 내피 장벽을 관통하여 세포외 기질(ECM)에 축적되어 심근내 혈종을 형성합니다8. 대식세포 및 호중구 유래 기질 금속단백분해효소는 ECM에서 콜라겐을 분해하여 기계적 합병증 및 경색 후 심실 동맥류의 위험을 증가시킨다9. 따라서 내피 장벽의 투과성은 급성 심근 경색의 예후 평가에 중요한 신호이며 MIRI의 중증도를 어느 정도 표시합니다.
FITC-dextran은 4,000Da에서 70,000Da에 이르는 분자량의 다양한 길이의 분지 포도당 분자로 구성된 다당류의 배열입니다. 특정 치료 및 병리학적 조건에서 세포막, 혈액-뇌 장벽(blood-brain barrier)10 및 점막(mucosal membranes)11과 같은 기능적 생리학적 장벽의 투과성을 입증하기 위한 표준 추적자로 널리 사용됩니다. 하나의 특정 멤브레인의 투과성은 분자량에 따라 다른 물질에 따라 다릅니다. 일반적으로 알부민은 심장 미세혈관으로 제한됩니다. 그러나 IR의 초기 단계에서 내피를 관통하여 심근 부종을 유발할 수 있습니다. 알부민의 분자량이 약 68,000 Da이므로 70,000 Da FITC-덱스트란은 IR 후 내피 과투과성을 입증하기에 적합한 제제가 될 수 있습니다. 또한, 쇼크 환자의 혈액량과 콜로이드 삼투압을 유지하기 위해 덱스트란이 널리 채택되고 있으며, FITC 표지 추적자는 부작용이 거의 없는 수많은 생체 내 또는 체외 연구에서 사용됩니다.
FITC-dextran 외에도 Evans Blue(EB) 염색으로 내피 투과성을 측정했습니다. 혈액 순환계에 주입 된 후 EB는 혈청 알부민에 단단히 결합하여 복합체12를 형성합니다. 따라서, EB 단독이 아닌 이 EB-알부민 복합체는 투과성 측정에 사용될 수 있으며, 이는 이러한 EB 기반 방법의 정확도가 실험 대상에서 혈청 알부민의 다른 농도에 의해 영향을 받을 수 있음을 의미합니다. 또한, EB는 세포 변성 및 혈관 투과성 증가를 통해 실험 동물의 장기, 특히 심장, 간, 폐를 중독시키는 것으로 보고되었습니다13. 허혈/재관류를 받는 내피는 정상 내피보다 이러한 해로운 영향에 더 민감하여 실험 결과의 중요성을 혼동할 수 있습니다.
EB 염료와 비교했을 때, FITC-덱스트란은 외인성이며, 알부민에 대한 결합 친화력은 무시할 수 있는 수준입니다. 따라서 FITC-덱스트란은 자유 상태로 유지되며 알부민 및 조직 단백질과 같은 거대분자에 결합되지 않습니다. 따라서 체중에 따라 투여하면 FITC-덱스트란은 동일한 혈중 농도에서 작용할 수 있으며 혈청 알부민 농도 및 혈액량의 개인차에 영향을 받지 않습니다. 이 방법의 진단 민감도를 테스트하기 위해 중국 전통 의학인 Tongxinluo(TXL)를 사용했습니다. TXL은 내피 세포 미세구조와 내피 장벽 무결성을 유지함으로써 MIRI를 감소시킨다14. TXL은 또한 협심증을 치료하고 경색 후 심근 무리플로우를 개선하는 데 임상적으로 사용된다15. 기수 인삼, Buthus martensi, Hirudo, Eupolyphaga seu steleophaga, Scolopendra subspinipes, Periostracum cicadae, Radix paeoniae rubra, Semen ziziphi spinosae, Lignum dalbergiae odoriferae, Lignum santali albi 및 Borneolum syntheticum을 포함합니다. TXL은 MEK/ERK 경로16 및 내피 산화질소 합성효소 매개 메커니즘 5,17을 통해 미세혈관 내피를 보호하고, 용량 의존적 방식으로 장기18, 특히 심장의 허혈/재관류 손상(IRI)을 완화하는 것으로 나타났습니다. 여기서, 쥐에게 0.5 g/kg TXL 분말(인간에서 임상적으로 사용되는 것과 동일한 용량)을 기술한 바와 같이 먹였다19. 본 논문은 EB와 비교하여 유출된 70,000 Da FITC-dextran의 총 형광 강도를 측정하여 IR 후 심장 미세혈관의 내피 장벽을 기능적으로 평가하는 방법을 제공합니다.
프로토콜
동물실험은 미국 국립보건원(National Institutes of Health)에서 발행한 "실험동물의 관리 및 사용에 관한 지침"(Bethesda, MD, USA, NIH Publication No. 85-23, 1996년 개정)과 베이징 동물관리위원회(Beijing Council on Animal Care)의 "실험동물의 관리 및 사용에 관한 규정(Regulation to the Care and Use of Experimental Animals)"(1996)에 따라 수행되었다. 이 연구 프로토콜은 Fuwai Hospital의 실험 동물 관리 위원회(Care of Experimental Animals Committee)의 승인을 받았습니다. 이 연구에는 체중이 150-180g인 수컷 SPF급 Sprague-Dawley 쥐(SD 쥐)가 사용되었습니다.
1. 시약, 재료 및 장비의 준비
- 70% 에탄올, FITC-덱스트란(70,000Da, 얼음처럼 차가운 식염수에 용해시켜 10% w/v 용액 사용), 제모 크림, 4',6-디아미디노-2-페닐린돌(DAPI, 0.5-10μg/mL), 1% w/v EB/식염수 및 5% w/v 펜토바르비탈 나트륨/식염수(어두운 곳에서 4°C에 보관)가 포함된 장착 배지를 포함한 시약 및 용액을 준비합니다.
- 수술 테이프를 포함한 모든 수술 도구와 재료를 미리 살균하십시오. 거즈 패드; 수술 용 장갑; 16G 기관내관; 인슐린 주사기; 작동 가위; 크고 구부러진 절개 겸자; 직선 해부 겸자; 스트레이트 모기 집게; 구부러진 모기 집게; 견인기(30mm 스프레드); 5cm 마이크로니들 홀더; 3-0 폴리프로필렌 봉합사(테이퍼 바늘); 및 6-0 폴리프로필렌 봉합사(둥근 바늘).
- 항온 온난화 시스템, 조명 시스템, 인공호흡기, 자동 정량 병리학 영상 시스템, 자외선 동결 슬라이서를 포함한 모든 장비가 양호한 상태인지 확인하고 확인하십시오.
2. 외과 적 절차를 위해 쥐를 준비시키는 것
- 모든 SD 랫트를 Sham 그룹, IR 그룹 및 TXL 그룹(IR+TXL 그룹)으로 무작위로 나눕니다.
참고: 이 프로토콜에서는 6마리의 쥐가 각 그룹에 무작위로 할당되었습니다(n=6). - 각 SD 쥐의 무게를 측정하고, 무게를 기록하고, 각 쥐에 대해 투여할 TXL의 용량을 계산합니다.
- 개흉술 최소 12시간 전에 각 쥐에게 30mg/kg의 용량으로 이부프로펜을 투여하여 수술 전 통증과 고통을 완화합니다.
- 19에 기술된 바와 같이 마취 전 IR+TXL 그룹의 각 SD 랫트에게 12시간 및 1시간 동안 0.5g/kg의 용량으로 TXL의 초미세 분말을 투여합니다.
- 수술대를 70% 에탄올로 소독하고 멸균된 수술 도구와 재료를 소독된 표면에 놓습니다.
- 쥐의 체온을 37 ± 1 °C로 유지하기 위해 항온 온난화 시스템의 온도를 조정하십시오.
3. 심장 허혈/재관류의 랫트 모델 수립
- 5% w/v 펜토바르비탈 나트륨/인산염 완충 식염수(PBS) 용액을 50mg/kg(0.1mL/100g 체중)의 용량으로 복강에 주입하여 쥐를 마취합니다. 면도를 하거나 제모 크림을 사용하여 목에서 가슴까지의 털을 조심스럽게 제거하여 수술 부위를 준비합니다.
- 멸균된 핀셋으로 필요에 따라 혀의 위치를 부드럽게 조정하고 멸균된 면봉으로 호흡기 분비물을 닦아냅니다. 성문이 잘 보이도록 하고 기관내관을 기관에 부드럽게 삽입합니다.
- 기관내관을 분당 65-80회 순환하는 인공호흡기에 연결하고 쥐의 머리와 팔다리를 고정하여 일회 호흡량을 4-5mL로 조정합니다.
- 쥐 위에 멸균 드레이프를 씌우고 요오드 팅크와 70% 에탄올로 수술 부위를 소독한 다음 이 절차를 세 번 반복합니다.
- 네 번째 늑간 공간 수준에서 왼쪽 흉골 주위 절개를 만들어 왼쪽 근육 대흉근과 소흉근을 노출시킵니다.
- 뭉툭한 해부 기법을 사용하여 근육 대흉근과 작은흉근 사이의 근막을 절개하여 왼쪽 네 번째 늑간 공간을 노출시킵니다.
알림: 심각한 출혈 및 수술 후 사망을 유발할 수 있는 과도한 조직 손상 및 혈관 손상을 피하십시오. - 늑간 근육을 절개하고 네 번째 늑간 공간 내에 흉부 견인기를 배치한 다음 갈비뼈를 벌립니다.
- 심낭을 찢고 부착된 지방 조직을 제거합니다.
알림: 날카로운 수술 도구로 다른 장기, 특히 폐를 손상시키지 마십시오. 폐가 손상되면 수술 중 기흉과 혈흉이 발생할 수 있으며, 이는 혈역학적 장애에서 동물 생존 감소에 이르기까지 불투명 윤리적 결과를 초래할 수 있습니다. - 흉선의 위치를 조작하고 상행 대동맥과 좌심방을 부드럽게 노출시킵니다. 6-0 폴리프로필렌 봉합사로 45분 동안 일시적으로 근위 좌측 전방 하강(LAD) 동맥을 확인하고 접합합니다( 그림 1 A-D 참조).
참고: 이 절차는 LAD가 결찰되지 않는다는 점을 제외하고는 가짜 대조군 쥐에 대해 동일합니다. - 흉부 견인기를 제거하고 3-0 폴리프로필렌 봉합사로 중단된 봉합사 패턴으로 갈비뼈를 함께 당깁니다.
- 효과적인 호흡을 보장하기 위해 음의 흉곽 내압을 복원합니다.
참고: 음의 흉곽 내압을 복원하기 위해 두 가지 방법을 사용할 수 있습니다: i) 흉강을 닫기 전에 연구원은 인공호흡기의 공기 배출구를 2주기 동안 막아 폐를 팽창시킬 수 있습니다. ii) 흉강에 남아 있는 공기는 늑간 공간을 봉합한 후 주사기로 빼낼 수 있습니다. - 제모 및 소독 후 오른쪽 하지를 절개하고 오른쪽 대퇴 정맥에서 표재성 근막을 절개합니다.
- 결찰을 풀고 45분 동안 심근허혈을 유도한 후 호흡 및 순환 상태를 확인합니다.
- 체중 0.15mL/100g으로 10%(w/v)의 FITC-덱스트란/식염수를 대퇴정맥에 주입하고 멸균 면봉으로 대퇴정맥을 1분 동안 눌러 출혈을 멈춥니다(그림 2A, B).
참고: 또는 체중 0.5mL/100g의 용량으로 1% w/v EB/식염수를 대퇴 정맥에 주입합니다. - 절개 부위를 3-0 폴리프로필렌 봉합사로 꿰매고 절개 부위를 소독한 후 위에서 설명한 대로 이부프로펜으로 수술 후 진통제를 실시합니다.
4. 형광 측정을 위한 냉동 조직 조각의 준비
- 5% w/v 펜토바르비탈 나트륨/PBS 용액을 150mg/kg(0.3mL/100g 체중)의 복강내 투여량으로 주입하여 심근 재관류 3시간 후 쥐를 깊이 마취합니다.
- 복강을 절단하고 대동맥 복부와 대정맥을 노출시킵니다( 그림 3A 참조).
- 얼음처럼 차가운 PBS 50mL를 대정맥에 꾸준히 주입하고 대동맥 복부를 절개하여 심근에서 혈액을 씻어낸 다음 심장을 적출합니다.
참고: 폐와 간의 변화를 관찰하십시오. 간에서 땀이 난다는 것은 식염수가 대정맥에 정확하게 주입되었다는 것을 의미하며( 그림 3C 참조), 창백한 폐는 관류가 잘 된 심근의 징후로 간주됩니다( 그림 3B 참조). - 어두운 방에서 얼음처럼 차가운 식염수 또는 PBS로 심장을 부드럽게 헹구어 심장실에 남아 있는 혈액과 FITC-덱스트란(또는 EB)을 제거합니다.
- 결찰에서 심장을 절단하고 결찰 위의 심근을 버립니다.
- 임베딩 컴파운드가 있는 금형에 심장을 삽입한 다음 -80°C에서 보관합니다.
- 임베딩 몰드에서 얼린 조직을 꺼내 냉동 슬라이서의 사전 냉각된 -20°C 챔버에서 샘플 홀더에 로드합니다.
- 단일 절편의 두께를 5-8 μm로 조정하고 기저-정점 축의 대략 중간 지점(예: 허혈의 중간)에서 조직을 절편화합니다.
- 얇게 썬 조직을 접착 현미경 슬라이드에 로드하고 DAPI가 포함된 형광 장착 매체 한 방울(약 40μL)로 각 조각을 밀봉합니다.
- 슬라이드를 건조하고 어두운 상자에 보관하십시오.
알림: 슬라이드를 즉시 스캔할 수 없는 경우 건조하고 서늘하며 어두운 곳에 보관하여 응축수 형성 및 형광 담금질을 방지하십시오.
5. 형광 측정 및 데이터 분석
- 이미징 시스템을 설정하고 스캐너에 연결된 소프트웨어를 확인합니다.
- 슬라이드 선반에 슬라이드를 넣고 스캐너에 삽입합니다.
- 슬라이드 스캐너 소프트웨어( 재료 표 참조)를 열고 Edit Protocol(프로토콜 편집) | 새로운....
참고: 스캐너 또는 관련 소프트웨어를 사용할 수 없는 경우 레이저 컨포칼 현미경( 재료 표 참조) 또는 형광 모드가 있는 기타 일반 슬라이드 스캐너( 재료 표 참조)가 자동화된 정량 형광 스캐너의 대안이 될 수 있습니다. - 프로토콜과 연구의 이름을 바꾸고 형광 모드를 선택합니다.
- 전체 슬라이드 스캔 정의 | Pixel Resolution 및 Multispectral 영역 | 픽셀 해상도는 각각 0.25μm(40x)입니다.
- Edit Filters and Bands...를 클릭하여 Whole Slide Scan Filters 열과 Multispectral Region Bands 열을 선택합니다.
참고: EB를 사용하는 경우 전체 슬라이드 스캔 필터 | DAPI 및 텍사스 레드 또는 AF495. FITC-dextran을 사용하는 경우 Multispectral Region Bands | DAPI 및 FITC 또는 AF488. - Edit Exposures...를 클릭하고 캐리어를 로드합니다.
- 대상 슬롯을 선택하고 Take overview(테이크 오버뷰)를 클릭합니다.
참고: 이것은 각 심장 섹션의 명시야 스캔을 수행합니다. 초점을 맞출 심근을 선택하거나 무턱대고 영역을 선택하십시오. - 대상 슬라이드를 선택하고 스테이지 높이 를 약 -50μm로 조정한 다음 자동 초점을 클릭합니다.
- 전체 스캔 노출(ms)-DAPI | 자동 노출.
참고: DAPI가 있는 이미지는 심근 영역을 설명하는 데 편리하지만 형광 밀도를 계산하는 데는 편리하지 않은 심장 단면을 설명하는 데 사용되기 때문에 각 슬라이드에 대한 DAPI의 노출 시간이 같을 필요는 없습니다. - 전체 스캔 노출(ms)-FITC | 자동 노출.
참고: 전체 스캔 노출(ms)-텍사스 레드 | EB를 사용하는 경우 자동 노출. FITC 또는 Texas Red의 노출 시간이 모든 슬라이드 스캔에서 동일하다는 것을 기억하고 확인하는 것이 중요합니다. - 자동 초점을 다시 클릭하고 슬라이드에 초점이 맞춰져 있는지 확인합니다.
- 뒤로를 클릭하고 프로토콜을 저장합니다.
- 각 슬라이드에 대해 5.7-5.14단계를 반복합니다.
- 홈 페이지로 돌아가서 슬라이드 스캔을 클릭합니다.
- 슬롯을 선택하고, 모든 슬라이드의 이름을 바꾼 다음, 각 슬라이드에 해당하는 노출 프로토콜을 선택합니다.
- 슬라이드를 스캔하고 이미지를 캡처합니다.
- 스캔을 위해 슬라이드 뷰어 소프트웨어로 이미지를 엽니다( 재료 표 참조).
- 모든 이미지를 비교적 동일한 정도로 확대합니다.
- 스냅샷을 찍고 이미지를 .tiff로 저장합니다.
참고: 스케일 바가 있는 이미지와 없는 이미지를 동시에 저장하는 것이 좋습니다. 축척 막대가 있는 이미지는 게시에 사용할 수 있고 축척 막대가 없는 이미지는 통계 분석에 사용할 수 있습니다. - ImageJ 소프트웨어를 열고 분석을 클릭한 다음 측정 설정을 선택합니다.
- 영역 선택 | 통합 밀도.
- FITC 채널에서 영상 J를 사용하여 영상을 엽니다.
- Analyze( 분석 )를 다시 클릭하고 나타나는 통합 밀도(IntDen)의 수치를 기록합니다.
참고: 이미지의 눈금 막대는 컴퓨터에 의해 형광의 회색조로 오인될 수 있으므로 눈금 막대가 없는 이미지를 사용하여 IntDen을 측정하십시오. - FITC 이미지를 닫고 DAPI 채널에서 이미지를 엽니다.
- 심근의 단면을 간략하게 설명합니다.
- Analyze and collect Area data(영역 데이터 분석 및 수집)를 클릭합니다.
- 각 심장에 대한 IntDen/Area(형광 평균)의 비율을 계산합니다.
- 통계 분석 소프트웨어에 모든 비율을 입력합니다.
결과
IR 후 심장 내피 투과성의 변화를 평가하기 위해 FITC-dextran assay를 수행하기 전에 쥐의 심근 IR 모델 확립을 전문으로 하는 동일한 연구자가 실험을 수행하여 관상 동맥이 동일한 위치에서 성공적으로 폐색되고 모든 쥐에서 허혈 면적/총 면적의 비율이 일정함을 확인할 것을 강력히 권장합니다. 도 1A,B에서 볼 수 있듯이, 심장(노란색 화살표로 표시)이 노출되고, 좌심실 전벽에 위치한 심근에 0.5mm(내경)의 모세관 실리콘 튜브와 6-0 봉합사가 있는 좌심방 부속기 가장자리 아래 약 2mm에 루프(녹색 화살표로 표시)가 형성되었습니다. 그림 1C에서 볼 수 있듯이, 고리를 고정하면 허혈성 심근이 즉시 분홍색에서 회분홍색(흰색 화살표로 표시)으로 변했습니다.
더욱이, 심근은 그림 1D에서 볼 수 있듯이 고리가 느슨해진 직후 재관류되어 분홍색을 회복했습니다. 고리를 느슨하게 한 후, 허벅지 안쪽에 있는 대퇴골의 긴 축과 평행하게 절개했습니다. 대퇴 정맥은 그림 2A, B와 같이 인슐린 주사기로 노출되고 구멍을 뚫었습니다. 3시간 재관류 후 하복부를 "V"자로 절개하고 복막에서 대동맥 복부와 대정맥을 절개했습니다(그림 3A). 한포식염수를 대정맥에 부드럽게 주입하고, 대동맥 복부를 절제하여 조직병리학적 구조에 영향을 줄 수 있는 뇌실내 압력으로 인해 심실벽이 과도하게 늘어나는 것을 방지했습니다. 표백된 폐( 그림 3B의 빨간색 화살표)와 그림 3C 의 간은 조직에 식염수가 잘 관류되었음을 나타냅니다.
결과적으로, 세 그룹 간의 단면적에는 유의한 차이가 없었다: Sham 그룹 1.00 ± 0.08 대 IR 그룹 0.97 ± 0.08 대 IR+TXL 그룹 1.02 ± 0.04 (그림 4A, 각 그룹에서 n = 6, 두 그룹 간 p > 0.05). 그림 4B, C에서 볼 수 있듯이, Sham 쥐의 전체 섹션에서 녹색 형광의 평균 강도는 매우 낮았습니다. 대조적으로, 외측된 FITC-덱스트란에 의해 방출된 형광은 IR 그룹에서 현저하게 증가하여 Sham 그룹으로 정규화되었습니다(IR 그룹에서 5.52 ± 0.85 대 Sham 그룹에서 1.00 ± 0.19, n = 6, p < 0.05). 또한, 심장 미세혈관 내피14,16을 보호하는 것으로 알려진 TXL 초미세 분말은 IR에 의해 유도된 더 높은 형광 강도를 현저하게 역전시켰습니다(IR+TXL 그룹에서 2.87 ± 0.52 대 IR 그룹에서 5.52 ± 0.85, n = 6, p < 0.05). 국소 심근의 이미지는 FITC-덱스트란이 세포외 기질에는 압도적으로 축적되지만 미세혈관에는 축적되지 않았으며, TXL이 내피 장벽 기능을 개선했음을 보여주었습니다(그림 5).
FITC-dextran과 비교했을 때, EB는 이미지 품질과 감도 모두에서 70,000 Da FITC-dextran보다 열등하기 때문에 EB는 차선의 대안이 될 수 있습니다. 마찬가지로, 세 그룹 간의 단면적에서도 유의미한 차이가 없었다: Sham 그룹 1.00 ± 0.08 대 IR 그룹 0.97 ± 0.08 대 IR+TXL 그룹 0.98 ± 0.05 (보충 그림 S1A, 각 그룹 n = 6, 두 그룹 간 p > 0.05). 보충 그림 S1B,C에서 볼 수 있듯이, Sham 쥐의 전체 단면에서 적색 형광의 평균 강도는 특히 심내막과 심내막에서 상대적으로 높았습니다. EB가 방출하는 적색 형광은 IR 그룹에서 급격히 증가했지만(IR 그룹 4.41 ± 0.66 대 Sham 그룹 1.00 ± 0.22, n = 6, p < 0.05), IR+TXL과 IR 그룹 간의 차이는 크지 않았습니다(IR+TXL 그룹 3.73 ± 0.47 vs. IR 그룹 4.41 ± 0.66, n = 6, p = 0.0956).
또한, 이 방법은 심근경색(MI) 모델(보충 그림 S2)에서 테스트되었습니다. M요드 Infarction Injection first(MII) 그룹에서는 LAD 결찰술 5분 전에 FITC-덱스트란 용액(앞서 언급한 것과 동일한 농도)을 순환계에 주입했습니다. 이는 이 프로토콜에서 앞서 설명한 MIL 랫트(M요심 Infarction Ligation이 먼저)에서 결찰 직후 주입된 FITC-덱스트란 용액과 대조적이었습니다. 흥미롭게도, 두 그룹 모두의 MI 쥐에서 손상된 심근의 ECM으로 소량의 FITC-dextran만이 유출되었으며, 이는 보충 그림 S2에서 약한 녹색 형광 강도로 표시되었습니다.
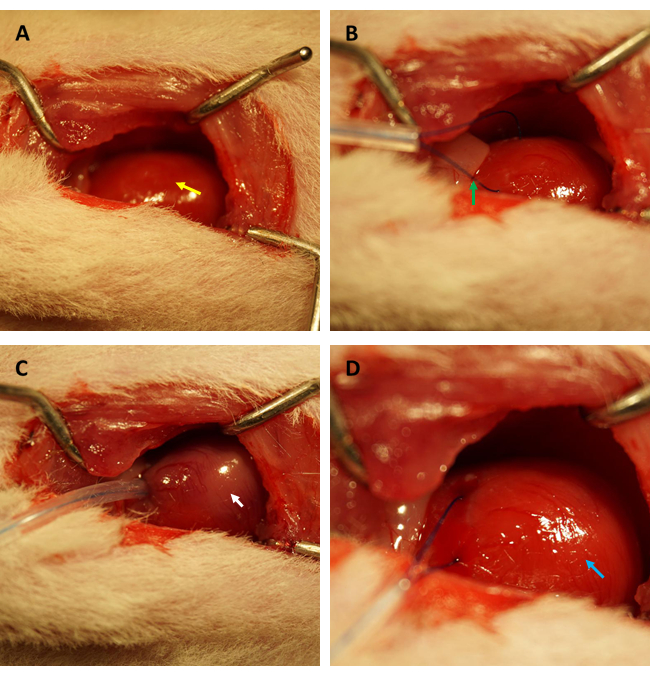
그림 1: 개흉술의 시야와 쥐 모델에서 허혈/재관류의 확립. (A) 쥐의 심장을 노출시키는 것(노란색 화살표로 표시); (B) 관상동맥을 둘러싸기 위한 고리를 형성하는 것(녹색 화살표로 표시); (C) 루프를 고정하고 45분 동안 심근허혈을 유발합니다(흰색 화살표로 표시). (D) 루프를 풀고 3시간 동안 심근 재관류를 허용합니다(파란색 화살표로 표시). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
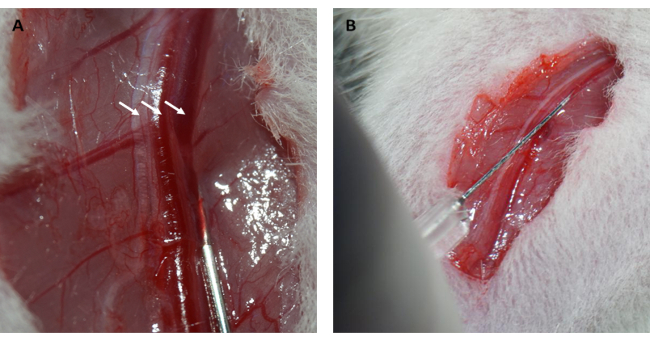
그림 2: 대퇴 정맥 절개 및 정맥 주사. (A) 대퇴정맥을 노출하는 경우(대퇴 신경은 왼쪽 화살표, 대퇴 동맥은 가운데 화살표, 대퇴 정맥은 오른쪽 화살표로 표시). (B) 인슐린 주사기로 FITC-dextran 용액을 대퇴 정맥에 주입하는 것. 약기 : FITC = 플루오레세인 이소티오시아네이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
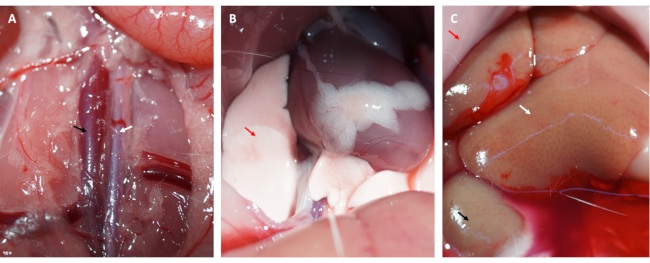
그림 3: 조직 관류 및 효율적인 관류의 증상. (A) 복부 대동맥과 대정맥을 해부합니다(복부 대동맥은 흰색 화살표, 대정맥은 검은색 화살표로 표시). (B) 폐가 백화되어 적절한 관류의 증상입니다. (C) 표백된 점막, 표백된 신장, 땀이 나는 것은 모두 적절한 관류의 증상입니다(빨간색 화살표: 점막, 흰색 화살표: 간, 검은색 화살표: 신장). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 대표적인 이미지와 FITC-dextran 염색에 의한 평균 형광 강도 분석. (A) Sham 그룹의 상대적 단면적으로 정규화된 각 그룹의 상대 단면적(p > 0.05); (B) Sham 그룹의 FITC 채널로 정규화된 각 그룹의 FITC 채널에서의 상대적 형광 강도; (C) 각 그룹에서 9.5배 배율의 대표 이미지. 눈금 막대 = 800μm. Tukey의 사후 다중 그룹 비교를 사용한 일원 분산 분석. * vs. 샴 그룹, p < 0.05; # vs. IR 그룹, p < 0.05. 막대 그래프는 그룹 평균± SD를 보여줍니다. 약어: IR = 허혈/재관류; TXL = 퉁신뤄; FITC = 플루오레세인 이소티오시아네이트; DAPI = 4',6-디아미디노-2-페닐린돌; ANOVA = 분산 분석; SD = 표준 편차. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: FITC-dextran 염색 후 각 그룹의 200배 배율에서 관심 영역의 대표 이미지. 눈금 막대 = 50μm. 약어: FITC = 플루오레세인 이소티오시아네이트; DAPI = 4',6-디아미디노-2-페닐린돌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1: Evans Blue 염색에 의한 평균 형광 강도의 대표 이미지 및 분석. (A) Sham 그룹의 상대적 단면적으로 정규화된 각 그룹의 상대적 단면적(p > 0.05) (B) Sham 그룹의 것으로 정규화된 각 그룹의 텍사스 적색 채널에서의 상대적 형광 강도; (C) 각 그룹의 대표 이미지. Tukey의 사후 다중 그룹 비교를 사용한 일원 분산 분석. 스케일 바 = 800μm. * vs. 샴 그룹, p < 0.05. 막대 그래프는 그룹 평균± SD를 보여줍니다. 약어: IR = 허혈/재관류; TXL = 퉁신뤄; DAPI = 4',6-디아미디노-2-페닐린돌; ANOVA = 분산 분석; SD = 표준 편차. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S2: 심근경색 모델에서 FITC-dextran 염색의 9.5배 배율에서 대표 이미지. 눈금 막대 = 800μm. 약어: MII = 심근경색 주사 먼저 (심근경색 전에 FITC-dextran 주사); MIL = 심근경색 결찰 먼저 (심근경색 직후 FITC-dextran 주입); FITC = 플루오레세인 이소티오시아네이트; DAPI = 4',6-디아미디노-2-페닐린돌. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 논문은 MIRI에 노출된 후 심장 내피 장벽의 기능 장애를 평가하기 위한 프로토콜을 제시합니다. 이 프로토콜에는 결과의 신뢰성과 정확성을 결정하는 몇 가지 중요한 단계가 있다는 점에 유의해야 합니다. FITC-dextran과 관련된 모든 단계는 어두운 방에서 수행해야 합니다. FITC-덱스트란/식염수는 4°C에서 보관하고 주석 호일로 싸야 합니다. 또한, 그림 1과 같이 관상동맥을 결찰해야 고리가 느슨해진 직후 심근을 재관류할 수 있습니다. 연구자들은 5-0 또는 6-0 폴리에틸렌 봉합사를 선택할 수 있는데, 7-0 미만의 얇은 끈은 심근 섬유와 혈관을 절단할 가능성이 더 높기 때문입니다. 중요한 것은 추적자 용액을 꼬리 정맥이 아닌 대퇴 정맥에 주입해야 한다는 것입니다. 각 심장은 각각 제물로 바치기 전과 후에 얼음처럼 차가운 식염수로 잘 헹구고 잘 헹궈야 합니다.
MIRI를 전문으로 하는 많은 연구자들은 전자 현미경 검사를 통해 내피의 과투과성을 증명하기 위해 심근 재관류의 초기 단계에서 내피의 파괴된 세포 내 구조(세포자멸사체의 형성, 미토콘드리아 팽창, 비정상적인 세포 간 접합부)를 연구하는 경향이 있습니다. 면역블로팅은 또한 미세혈관 투과성을 측정하는 데 사용되었는데, 이는 밀접 결합 단백질(tight 결합 단백질) 수준의 감소가 시간이 지남에 따라 내피 손상 및 내피 장벽의 오작동의 핵심 메커니즘으로 간주되기 때문입니다. 예를 들어, VE-cadherin20 및 β-catenin21은 내피 세포 간 접착 접합의 핵심 요소이며, 이러한 연결은 혈관 무결성22 유지에 기여합니다. JAM-A23,24 및 occludin25와 같은 밀접 연접도 순환계의 내피 장벽 구축에 협력적으로 참여합니다.
현재 점점 더 많은 연구에서 미토콘드리아 기능과 미토콘드리아 항상성이 재관류 손상에 대한 보호 경로의 핵심 표적이 될 수 있음을 시사합니다. 병태생리학 및 약리학 연구에서 보고된 바와 같이, 미토파지는 IR26에 의해 유도된 내피와 심근의 세포 사멸에 중요한 역할을 할 수 있습니다. 또한, 미토콘드리아 분열(mitochondrial fission), 미토콘드리아 단백질화(mitochondrial proteostasis) 및 미토콘드리아 품질 관리(mitochondrial quality control)는 재관류 영역에서 고위험 심근을 보호할 수 있다27,28. 위의 방법은 내피 투과성을 직접적이고 시각적으로 표시하는 것보다 과투과성의 다양한 메커니즘 또는 원인을 입증하는 데 더 중점을 둡니다. 또한 전자 현미경 검사를 위한 시료 준비는 복잡하고 위험합니다. 전자 현미경 검사에 사용되는 글루타르알데히드, 아세톤 및 삼투산 용액은 점막, 결막 및 피부를 휘발시키고 침식할 수 있으며, 통제되지 않은 환경에서 사용할 경우 생명을 위협할 수도 있습니다.
이러한 간접적이고 생명을 위협하는 방법과 비교했을 때, FITC-dextran extravasation에 의해 방출되는 형광 강도를 측정하는 이 방법은 심장 미세혈관 투과성을 평가하는 데 이상적입니다. 첫째, 70,000 Da FITC-dextran은 정상적인 생리학적 조건에서는 내피를 통과할 수 없지만 IR 하에서 심근 간질 공간으로 들어갈 수 있어 다른 치료를 받는 쥐를 명확하게 구별할 수 있습니다. 또한 FITC-덱스트란 용액은 대퇴 정맥을 통해 혈액에 주입되어 모든 액체가 쥐의 순환계에 주입되도록 합니다. 대조적으로, 꼬리 정맥 주입은 꼬리 정맥이 불분명하고 두꺼운 지층으로 덮여 있기 때문에 쥐에서 더 어렵습니다. 또한, 일반적인 파라포름알데히드 고정 및 파라핀 임베딩과 달리 심근 조직 치료는 본 연구에서 사용된 급속 동결 병리학적 절편 기술을 사용하여 단순화되고 최적화되었습니다. 짧은 보관 시간, 내광 환경 및 냉동 보존은 함께 FITC의 형광 소멸을 완화할 수 있습니다.
더 중요한 것은 이 방법이 통계 분석 중에 선택 편향을 최소화할 수 있다는 것입니다. FITC-dextran과 혼합된 거의 모든 혈액이 심근과 심실에서 배출되도록 식염수로 충분한 심장 관류를 수행하여 혈관에 남아 있는 FITC에서 방출되는 형광을 제거할 수 있습니다. 그렇지 않은 경우 모세혈관과 병합된 형광을 배제하고 인위적으로 트리밍해야 합니다. 관심 영역에서 조직을 수집하는 동안, 특히 EB 염료 염색 후 허혈성 심근과 원격 심근 사이에 시각적 경계가 관찰되지 않았습니다. 이것은 이러한 대표적인 지역에서 샘플을 수집하는 데 방해가 되었습니다. 본 명세서에 기술된 방법을 사용하여, 연구자들은 전체 절편의 이미지를 획득하고 정량적 슬라이더 스캐너를 사용하여 형광 강도를 분석할 수 있다.
흥미롭게도 EB 염료는 차선책이기는 하지만 FITC-dextran의 대안이 될 수 있습니다. FITC-덱스트란의 상대적으로 가혹한 보관 조건과 비교하여 EB 분말 또는 그 용액은 실온에서 오랫동안 안정적으로 유지될 수 있습니다. 또한 EB는 대부분의 기관에서 상대적으로 저렴합니다. 그럼에도 불구하고 특정 단점으로 인해 적용이 제한될 수 있습니다. 첫째, EB 염색은 FITC-dextran보다 민감도가 낮아 그룹 간의 차이를 과소평가하고 각 그룹의 샘플 크기를 증가시킬 수 있습니다. 또한 EB는 단백질에 대한 접착력이 더 강합니다. 심내막과 심외막은 EB에 의해 더 쉽게 염색되며, 이는 형광 밀도의 결과에 영향을 미칠 수 있습니다. 또한 재관류 영역의 명백한 충전 결함은 이미지 품질을 현저히 저하시켜 EB의 사용을 제한할 수 있습니다.
MI 모델에서 이 방법의 적용을 확장하기 위해 이 방법은 MI 모델에서 테스트되었습니다. 먼저 LAD 결찰술 후 FITC-dextran을 혈관에 주입했습니다. 예상했던 대로, 혈류 내 FITC-dextran이 결찰 부위를 통과할 수 없고 FITC-dextran이 허혈 부위에 들어가지 않았기 때문에 슬라이스에서 낮은 수준의 형광이 방출되었습니다. FITC-dextran은 또한 FITC-dextran이 모든 장기로 통과할 수 있도록 결찰 5분 전에 적용되었습니다. 결과적으로, FITC-dextran은 미세혈관 내피를 관통하지 못했는데, 이는 결찰된 혈관의 관류 압력이 FITC-dextran을 내피를 통해 유도할 수 없기 때문일 것입니다. 일반적으로 이 방법은 MI 모델에서의 적용을 충족하기 위해 훨씬 더 많은 수정이 필요할 수 있습니다.
위의 장점에도 불구하고 이 방법에는 한계가 있습니다. 첫째, 이 프로토콜은 다른 동물의 IR 모델에서 테스트되지 않았으므로 전임상 및 임상 연구에서의 적용이 제한될 수 있습니다. 둘째, FITC 표지 염료는 EB와 같은 다른 일반 염료보다 비쌉니다. 그러나 EB와 달리 혈청으로 희석한 10% w/v FITC-덱스트란 용액은 심근의 색이 거의 변하지 않기 때문에 FITC-덱스트란 염색과 EB/2,3,5-트리페닐테트라졸 클로라이드(TTC) 이중 염색을 동일한 심장에서 수행할 수 있어 동물 수와 사용되는 염료에 대한 예산을 줄일 수 있습니다. 마지막으로, 이 연구에 사용된 슬라이드 스캐너(Quantitative Slide Scanner) 및 이와 유사한 기기는 일부 실험실에서 사용할 수 없을 수 있습니다. 요약하면, 이 프로토콜은 자동화된 정량적 병리학 이미징 시스템을 기반으로 하는 형광 분석을 사용하여 쥐의 IR 모델에서 심장 미세혈관 내피 투과성을 검출하기 위한 간단하고 신뢰할 수 있으며 시각적인 방법을 제시합니다. 이 프로토콜은 IR 손상 후 심장 미세혈관의 내피 장벽에 대한 기능 평가에서 70,000 Da FITC-dextran이 EB보다 더 나은 성능을 발휘함을 보여줍니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
본 연구는 중국 국가핵심연구개발계획(No. 2017YFC1700503)과 중국국가자연과학재단(National Natural Science Foundation of China, No. 81874461, No. 81774292)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
참고문헌
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -. D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -. H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59 (2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349 (2019).
- Li, B. -. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032 (2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037 (2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403 (2018).
- Zhang, H. -. T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -. H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775 (2017).
- Yu, Z. -. H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -. X., Wang, P., Wang, N. -. N., Li, S. -. D., Yang, M. -. H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485 (2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23 (2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156 (2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유