Method Article
מבחן פלואורסצנטי להערכת החדירות של מחסום אנדותל מיקרו-וסקולרי לבבי במודל חולדה של איסכמיה/רפרפוזיה
* These authors contributed equally
In This Article
Summary
כאן, אנו מתארים שיטה להערכה תפקודית של מחסום האנדותל של מיקרו-כלי דם לבביים לאחר פגיעה באיסכמיה/רפרפוזיה באמצעות מדידת עוצמת הקרינה הממוצעת של 70,000 Da FITC-dextran בהשוואה ל-Evans Blue.
Abstract
טיפולי רה-וסקולריזציה לעורקים אשמים, ללא קשר להתערבות כלילית מלעורית והשתלת מעקף עורקים כליליים, נחשבים לאסטרטגיה הטובה ביותר לשיפור הפרוגנוזה הקלינית של חולים עם תסמונת כלילית חריפה (ACS). עם זאת, רפרפוזיה של שריר הלב לאחר רה-וסקולריזציה יעילה עלולה לעורר מוות משמעותי של קרדיומיוציטים וקריסת אנדותל כלילי, המכונה איסכמיה של שריר הלב/פגיעה ברפרופוזיה (MIRI). בדרך כלל, תאי אנדותל והצמתים ההדוקים הבין-תאיים שלהם שומרים בשיתוף פעולה על מחסום האנדותל המיקרו-וסקולרי ועל החדירות הנמוכה יחסית שלו, אך נכשלים באזורי רפרפוזיה.
חדירות יתר של אנדותל מיקרו-וסקולרי הנגרמת על ידי איסכמיה/רפרפוזיה (IR) תורמת לבצקת שריר הלב, חדירה מוגברת של תאים פרו-דלקתיים ודימום פנימי מחמיר, מה שעלול להחמיר את הפרוגנוזה של ACS. העוקב ששימש במחקר זה - 70,000 Da FITC-dextran, מולקולת גלוקוז מסועפת המסומנת על ידי פלואורסצאין איזותיוציאנט (FITC) - נראה גדול מכדי לחדור לאנדותל המיקרו-וסקולרי של הלב בתנאים רגילים. עם זאת, הוא מסוגל לחדור למחסום שבור לאחר MIRI. לפיכך, ככל שחדירות האנדותל גבוהה יותר, כך מצטבר יותר FITC-dextran בחלל הבין-תאי החוץ-וסקולרי. לפיכך, עוצמת הקרינה מ- FITC יכולה להצביע על חדירות מחסום האנדותל המיקרו-וסקולרי. פרוטוקול זה מנצל את ה-FITC-dextaren כדי להעריך את מחסום האנדותל המיקרו-וסקולרי של הלב מבחינה תפקודית, אשר מזוהה על ידי מערכת הדמיה פתולוגית כמותית אוטומטית.
Introduction
העובדה שמספר הולך וגדל של חולים עם מחלות לב כליליות נהנו מטיפולי רה-וסקולריזציה במשך עשרות שנים אינה שוללת את ההשלכות הקטלניות של MIRI. כפי שתוארו על ידי ילון והאוזנלוי, ניתן לייחס כ-30% מגודל האוטם הסופי ל-MIRI1. תפקוד לקוי של אנדותל כלי דם מיקרו-וסקולרי הוא מנגנון הליבה העומד בבסיס MIRI ותופעת "ללא זרימה חוזרת" והוא המטרה של חומרים רבים להגנה על הלב ומסלולי הגנה קרדיולוגייםקלאסיים 2. יתר על כן, חדירות יתר של כלי דם עלולה לעורר בצקת שריר הלב3 וחדירת יתר של תאים פרו-דלקתיים, כולל נויטרופילים4, מקרופאגים וארתרוציטים5.
מתח חמצוני המושרה על ידי MIRI וציטוקינים פרו-דלקתיים המתבטאים יתר על המידה, כגון בני משפחת גורם נמק הגידול6 ומשפחת אינטרלוקין7, מפעילים מסלולי איתות של אפופטוזיס תאים כדי להאיץ את מותו של שריר הלב האיסכמי. אריתרוציטים חודרים למחסום האנדותל הפגיע ומצטברים במטריצה החוץ-תאית (ECM) ליצירת המטומה אינטרמיורקרדיאלית8. מטריצות מטאלופרוטאינאזות שמקורן במקרופאגים ונויטרופילים מפרקות קולגן ב-ECM, מה שמגביר את הסיכון לסיבוך מכני ולמפרצת חדרית לאחר אוטם9. לפיכך, החדירות של מחסום האנדותל היא סימן מכריע להערכה הפרוגנוסטית של אוטם שריר הלב החריף ומסמנת את חומרת MIRI במידה מסוימת.
FITC-dextran הוא מערך של פוליסכרידים המורכב מאורכים שונים של מולקולות גלוקוז מסועפות במשקל מולקולרי שנע בין 4,000 Da ל-70,000 Da. הוא נמצא בשימוש נרחב כעוקב סטנדרטי כדי להדגים את החדירות של קרומי התאים, מחסומים פיזיולוגיים תפקודיים כגון מחסום הדם-מוח10 והריריות11 תחת טיפולים ספציפיים ומצבים פתולוגיים. החדירות של קרום ספציפי אחד משתנה עבור חומרים שונים בהתאם למשקלם המולקולרי. בדרך כלל, אלבומין מוגבל למיקרו-כלי לב; עם זאת, הוא יכול לחדור לאנדותל בשלב מוקדם של IR, ולגרום לבצקת שריר הלב. מכיוון שהמשקל המולקולרי של אלבומין הוא כ-68,000 Da, 70,000 Da FITC-dextan יהיה חומר מתאים להדגמת חדירות יתר של האנדותל לאחר IR. יתר על כן, דקסטרן אומץ באופן נרחב לשמירה על נפח הדם והלחץ האוסמוטי הקולואידי של חולי הלם, ועוקבים המסומנים ב-FITC משמשים במספר רב של מחקרים in vivo או in vitro עם מעט תופעות לוואי.
בנוסף ל-FITC-דקסטרן, נמדדה חדירות האנדותל עם צביעת אוונס בלו (EB). לאחר ההזרקה למחזור הדם, EB נקשר לאלבומין בסרום בחוזקה ויוצר קומפלקס12. לפיכך, קומפלקס EB-אלבומין זה, ולא EB בלבד, יכול לשמש למדידת חדירות, מה שאומר שהדיוק של שיטה מבוססת EB כזו יכול להיות מושפע מריכוזים שונים של אלבומין בסרום בנבדקים ניסיוניים. בנוסף, דווח כי EB מרעיל את איבריהם של חיות ניסוי, במיוחד הלב, הכבד והריאות, באמצעות ניוון תאי וחדירות מוגברת של כלי הדם13. אנדותל שעובר איסכמיה/רפרפוזיה יהיה רגיש יותר להשפעות מזיקות כאלה מאשר אנדותל רגיל, מה שיכול לבלבל את המשמעות של תוצאות הניסוי.
בהשוואה לצבע EB, FITC-dextern הוא אקסוגני, והזיקה הנדרשת לאלבומין זניחה. לפיכך, FITC-דקסטרן נשאר במצב חופשי ואינו קשור למקרומולקולות, כגון אלבומין וחלבוני רקמה. לפיכך, אם ניתן בהתאם למשקל הגוף, FITC-dextan יכול לעבוד בריכוז דם שווה ואינו מושפע מהבדלים אינדיבידואליים בריכוז האלבומין בסרום ובנפח הדם. Tongxinluo (TXL), רפואה סינית מסורתית, שימשה לבדיקת הרגישות האבחנתית של שיטה זו. TXL מפחית את MIRI על ידי שמירה על המבנה האולטרה-תאי האנדותל ושלמות מחסום האנדותל14. TXL משמש גם לריפוי תעוקת חזה ולשיפור אי זרימה חוזרת של שריר הלב לאחר אוטםקלינית 15. הוא מכיל ג'ינסנג Radix, Buthus martensi, Hirudo, Eupolyphaga seu steleophaga, Scolopendra subspinipes, Periostracum cicadae, Radix paeoniae rubra, זרע ziziphi spinosae, Lignum dalbergiae odoriferae, Lignum santali albi ו-Borneolum syntheticum. הוכח כי TXL מגן על האנדותל המיקרו-וסקולרי באמצעות מסלול MEK/ERK16 ומנגנוני סינתאז של תחמוצת החנקן האנדותל 5,17 ומקל על פגיעה באיסכמיה/רפרפוזיה (IRI) של איברים18, במיוחד הלב, באופן תלוי מינון. כאן, החולדות הוזנו באבקת TXL של 0.5 גרם/ק"ג (מינון שווה ערך לזה המשמש קלינית בבני אדם) כמתואר19. מאמר זה מספק שיטה להערכה תפקודית של מחסום האנדותל של מיקרו-כלי דם לבביים לאחר IR באמצעות מדידת עוצמת הקרינה הכוללת של 70,000 Da FITC-dextraated בהשוואה ל-EB.
Protocol
ניסויים בבעלי חיים בוצעו בהתאם ל"מדריך לטיפול ושימוש בחיות מעבדה" שהונפק על ידי המכונים הלאומיים לבריאות בארה"ב (בת'סדה, מרילנד, ארה"ב, פרסום מס' 85-23, מתוקן ב-1996) ו"התקנה לטיפול ושימוש בחיות ניסוי" של מועצת בייג'ינג לטיפול בבעלי חיים (1996). פרוטוקול המחקר אושר על ידי הוועדה לטיפול בחיות ניסוי של בית החולים פוואי. במחקר זה נעשה שימוש בחולדות Sprague-Dawley (חולדות SD) במשקל 150-180 גרם.
1. הכנת ריאגנטים, חומרים וציוד
- הכן ריאגנטים ותמיסות הכוללות 70% אתנול, FITC-דקסטרן (70,000 Da, מומס במי מלח קרים כקרח ליצירת תמיסה של 10% w/v לשימוש), קרם להסרת שיער, מדיום הרכבה עם 4',6-דיאמידינו-2-פנילינדול (DAPI, 0.5-10 מיקרוגרם/מ"ל), 1% w/v תמיסת EB/מלח, ו-5% w/v תמיסת נתרן/מי מלח פנטוברביטל (מאוחסן ב-4 מעלות צלזיוס בחושך).
- לעקר מראש את כל הכלים והחומרים הכירורגיים, כולל סרט כירורגי; רפידות גזה; כפפות כירורגיות; צינור אנדוטרכיאלי 16 G; מזרק אינסולין; מספריים להפעלה; מלקחיים גדולים ומעוקלים; מלקחיים ישרים לניתוח; מלקחיים ישרים נגד יתושים; מלקחיים מעוקלים נגד יתושים; מחזירים (פריסה של 30 מ"מ); מחזיקי מיקרו-מחט בגודל 5 ס"מ; 3-0 תפר פוליפרופילן (מחט מתחדדת); ותפר פוליפרופילן 6-0 (מחט עגולה).
- בדוק וודא שכל הציוד, כולל מערכת התחממות בטמפרטורה קבועה, מערכת תאורה, מאוורר, מערכת הדמיה פתולוגית כמותית אוטומטית ופורס הקפאה אולטרה סגול, במצב טוב.
2. הכנת החולדות להליכים הכירורגיים
- חלקו את כל חולדות ה-SD לקבוצת Sham, קבוצת IR וקבוצת TXL (קבוצת IR+TXL) באופן אקראי.
הערה: בפרוטוקול זה, שש חולדות הוקצו באופן אקראי לכל קבוצה, n=6. - שקלו כל חולדת SD, רשמו את המשקל וחשבו את מינון ה-TXL שיינתן עבור כל חולדה.
- יש לתת איבופרופן במינון של 30 מ"ג/ק"ג לכל חולדה לפחות 12 שעות לפני כריתת בית החזה כדי להקל על כאב ומצוקה לפני הניתוח.
- יש לתת אבקה דקה במיוחד של TXL במינון של 0.5 גרם/ק"ג עד 12 שעות ושעה לכל חולדה SD בקבוצת IR+TXL לפני ההרדמה, כמתואר19.
- חיטוי שולחן הניתוחים עם 70% אתנול והנחת הכלים והחומרים הכירורגיים המעוקרים על המשטח המחוטא.
- התאם את הטמפרטורה של מערכת התחממות הטמפרטורה הקבועה כדי לשמור על טמפרטורת הגוף של החולדות על 37 ±-1 מעלות צלזיוס.
3. לבסס מודל חולדה של איסכמיה/רפרפוזיה של הלב
- יש להזריק תמיסת מלח עם נתרן/פוספט (PBS) במינון של 50 מ"ג/ק"ג (0.1 מ"ל/100 גרם משקל גוף) לחלל הבטן כדי להרדים את החולדה. הכן את אתר הניתוח על ידי הסרה זהירה של הפרווה מהצוואר לחזה על ידי גילוח או שימוש בקרם אפילציה.
- התאימו בעדינות את מיקום הלשון לפי הצורך בעזרת פינצטה מעוקרת ונגבו את הפרשת הנשימה עם כדורי צמר גפן מעוקרים. שמור על הגלוטיס בבירור והכנס צינור אנדוטרכיאלי לקנה הנשימה בעדינות.
- חבר את הצינור האנדוטרכיאלי למכונת הנשמה המסתובבת במהירות של 65-80 נשימות לדקה והתאם את נפח הגאות ל-4-5 מ"ל על ידי קיבוע הראש והגפיים של החולדה.
- הניחו וילון סטרילי על החולדה, חטאו את אזור הניתוח בתמיסת יוד ואחריו 70% אתנול, וחזרו על הליך זה שלוש פעמים.
- בצע חתך פרסטרנלי שמאלי בגובה החלל הבין-צלעי הרביעי כדי לחשוף את שריר החזה השמאלי והחזה הקטן.
- נתח את הפאשיה בין musculus pectoralis major ל-pectoralis minor באמצעות טכניקת דיסקציה קהה כדי לחשוף את החלל הבין-צלעי הרביעי השמאלי.
הערה: הימנע מנזק מוגזם לרקמות ופגיעה בכלי הדם שתגרום לדימום חמור ולמוות לאחר הניתוח. - נתח את השרירים הבין-צלעיים, מקם מפסק חזה בתוך החלל הבין-צלעי הרביעי ואז פרש את הצלעות.
- קרע את קרום הלב והסר את רקמת השומן המחוברת.
הערה: הימנע מפגיעה באיברים אחרים עם מכשירים כירורגיים חדים, במיוחד הריאות. נזק לריאות יכול לגרום להתפתחות פנאומוטורקס והמופנאומוטורקס במהלך הניתוח, ולגרום להשלכות קקואתיות החל מהפרעות המודינמיות ועד הישרדות מופחתת של בעלי חיים. - תפעל את מיקום התימוס וחשוף בעדינות את אבי העורקים העולה והפרוזדורים השמאליים. זהה וקשר את העורק היורד הקדמי השמאלי הפרוקסימלי (LAD) באופן חולף למשך 45 דקות עם תפר פוליפרופילן 6-0 (ראה איור 1 A-D).
הערה: הליך זה זהה עבור חולדות הדברת דמה אלא שה-LAD אינו קשור. - הסר את מפסק החזה ומשוך את הצלעות יחד בתבנית תפר קטוע עם תפר פוליפרופילן 3-0.
- החזר לחץ תוך-חזה שלילי כדי להבטיח נשימה יעילה.
הערה: ניתן להשתמש בשתי שיטות כדי להחזיר לחץ תוך חזה שלילי: 1) לפני סגירת חלל החזה, החוקרים יכולים לחבר את יציאת האוויר של מכונת ההנשמה למשך 2 מחזורים כדי לנפח את הריאות. ii) ניתן לשאוב את האוויר שנותר בחלל החזה באמצעות מזרק לאחר סגירת החלל הבין-צלעי. - לאחר הסרת שיער וחיטוי, בצע חתך בגפה התחתונה הימנית ונתח את הפאשיה השטחית מווריד הירך הימני.
- שחרר את הקשירה ובדוק את תנאי הנשימה ומחזור הדם לאחר גרימת איסכמיה של שריר הלב למשך 45 דקות.
- יש להזריק 10% (w/v) תמיסת FITC-דקסטרן/מי מלח לווריד הירך במשקל גוף של 0.15 מ"ל/100 גרם, וללחוץ על וריד הירך למשך דקה אחת עם כדורי צמר גפן סטריליים כדי לעצור את הדימום (איור 2A,B).
הערה: לחלופין, יש להזריק תמיסת מלח של 1% w/v EB/מלח לווריד הירך במינון של 0.5 מ"ל/100 גרם משקל גוף. - תפר את החתכים בתפר פוליפרופילן 3-0 וחטא את החתכים, ואחריו משככי כאבים לאחר הניתוח עם איבופרופן, כמתואר לעיל.
4. הכנת פרוסות רקמה קפואות למדידת פלואורסצנטיות
- יש להזריק תמיסת נתרן פנטוברביטל 5% במינון של 150 מ"ג/ק"ג (0.3 מ"ל/100 גרם משקל גוף) תוך צפקית כדי להרדים את החולדות לעומק לאחר 3 שעות של עירוי שריר הלב.
- חתכו את חלל הבטן וחשפו את אבי העורקים הבטני ואת הווריד הנבוב (ראו באיור 3A).
- הזריקו 50 מ"ל של PBS קר כקרח לתוך הווריד הנבוב בהתמדה, חתכו את אבי העורקים הבטני כדי לשטוף דם משריר הלב וקצרו את הלב.
הערה: שימו לב לשינויים בריאות ובכבד. כבד מזיע מרמז על כך שתמיסת מלח מוזרקת במדויק לתוך הווריד הנבוב (ראו באיור 3C), וריאה חיוורת נחשבת לסימן לשריר הלב שזכה להזדמנויות טובות (ראו באיור 3B). - בחדר חשוך, שטפו את הלב במי מלח קרים כקרח או PBS בעדינות כדי להסיר את שאריות הדם ו-FITC-dextan (או EB) מחדרי הלב.
- נתק את הלב מהקשירה והשליך את שריר הלב מעל הקשירה.
- הטמיעו את הלב בתבניות עם תרכובת הטבעה ואחריה אחסון בטמפרטורה של -80 מעלות צלזיוס.
- פרקו את הרקמות הקפואות מתבניות ההטבעה והעמיסו אותן על מחזיקי דגימות בתא מקורר מראש של -20 מעלות צלזיוס של פורס הקפאה.
- התאם את עובי הפרוסה הבודדת ל-5-8 מיקרומטר וחתוך את הרקמה בערך בנקודת האמצע של ציר הבסיס-קודקוד (למשל, אמצע האיסכמיה).
- טען את הרקמה הפרוסה על שקופיות מיקרוסקופ דביקות ואטום כל פרוסה בטיפה אחת (כ-40 מיקרוליטר) של אמצעי הרכבה פלואורסצנטי המכיל DAPI.
- שמור את המגלשות בקופסה יבשה וחשוכה.
הערה: אם לא ניתן לסרוק את השקופיות באופן מיידי, אחסן אותן במקום יבש, קריר וחשוך כדי למנוע היווצרות מי עיבוי ומרווה פלואורסצנטי.
5. מדידת פלואורסצנטיות וניתוח נתונים
- הגדר את מערכת ההדמיה ובדוק את התוכנה המחוברת לסורק.
- טען את השקופיות במדפי השקופיות והכנס אותן לסורק.
- פתח את תוכנת סורק השקופיות (ראה טבלת החומרים) והגדר פרוטוקול חשיפה חדש על ידי לחיצה על ערוך פרוטוקול | חדש....
הערה: אם הסורק או התוכנה המסונפת אליו אינם זמינים, מיקרוסקופ לייזר קונפוקלי (ראה טבלת החומרים) או סורקי שקופיות רגילים אחרים עם מצב פלואורסצנטי (ראה טבלת החומרים) עשויים להוות חלופה לסורק הקרינה הכמותי האוטומטי. - שנה את שם הפרוטוקול והמחקר ובחר את מצב הקרינה .
- הגדרת סריקת שקופיות שלמה | רזולוציית פיקסלים ואזורים מולטי-ספקטרליים | רזולוציית פיקסלים כ-0.25 מיקרומטר (40x) בהתאמה.
- לחץ על ערוך מסננים ורצועות... כדי לבחור את העמודה מסנני סריקת שקופיות שלמים ואת העמודה רצועות אזור רב-ספקטרלי .
הערה: אם נעשה שימוש ב- EB, בחר מסנני סריקת שקופיות שלמות | DAPI וטקסס אדום או AF495. אם נעשה שימוש ב-FITC-dextran, בחר Multispectral Region Bands | DAPI ו-FITC או AF488. - לחץ על ערוך חשיפות ... וטען את הספק.
- בחר את משבצת היעד ולחץ על בצע סקירה כללית.
הערה: זה דורש סריקת שדה בהיר של כל חלק לב. בחר את שריר הלב למיקוד או בחר את האזור בצורה עיוורת. - בחר את שקופית היעד, התאם את גובה הבמה לכ-50 מיקרומטר ולחץ על פוקוס אוטומטי.
- לחץ על חשיפת סריקה שלמה (ms)-DAPI | חשיפה אוטומטית.
הערה: זמן החשיפה של DAPI עבור כל שקופית אינו חייב להיות זהה מכיוון שתמונות עם DAPI משמשות להמחשת חתכים של הלב, הנוחים לתיאור אזור שריר הלב אך לא לחישוב צפיפות הקרינה. - לחץ על חשיפת סריקה שלמה (ms)-FITC | חשיפה אוטומטית.
הערה: לחץ על חשיפה לסריקה שלמה (ms)-טקסס אדום | חשיפה אוטומטית בעת שימוש ב-EB. חשוב לזכור ולוודא שזמן החשיפה של FITC או Texas Red זהה בכל סריקות השקופיות. - לחץ שוב על פוקוס אוטומטי וודא שהשקופית ממוקדת.
- לחצו על הקודם ושמרו את הפרוטוקול.
- חזור על שלבים 5.7-5.14 עבור כל שקופית.
- חזור לדף הבית ולחץ על סרוק שקופיות.
- בחר חריץ, שנה את שמות כל השקופיות ובחר את פרוטוקול החשיפה המתאים עבור כל שקופית.
- סרוק את השקופיות וצלם את התמונות.
- פתח את התמונות עם תוכנת מציג שקופיות לסריקות (ראה טבלת החומרים).
- הגדל את כל התמונות במידה שווה יחסית.
- צלם ושמור תמונות .tiff.
הערה: עדיף לשמור את התמונות עם ובלי פסי קנה מידה בו זמנית. ניתן להשתמש בתמונות עם פסי קנה מידה לפרסום, ואילו תמונות ללא פסי קנה מידה יכולות לשמש לניתוח סטטיסטי. - פתחו את תוכנת ImageJ, לחצו על Analyze, ובחרו Set Measurement.
- בחר אזור | צפיפות משולבת.
- פתח את התמונה בערוץ FITC עם תמונה J.
- לחץ שוב על נתח ורשום את הערך המספרי של הצפיפות המשולבת (IntDen) שמופיע.
הערה: מכיוון שמחשבים עלולים לטעות בפסי קנה המידה בתמונות כגווני אפור של פלואורסצנטיות, השתמש בתמונות ללא פסי קנה מידה כדי למדוד את IntDen. - סגור את תמונת FITC ופתח את התמונה בערוץ DAPI.
- מתאר חתך רוחב של שריר הלב.
- לחץ על ניתוח ואיסוף נתוני אזור .
- חשב את היחסים של IntDen/Area (ממוצע הקרינה) עבור כל לב.
- הזנת כל היחסים בתוכנת ניתוח סטטיסטי.
תוצאות
לפני ביצוע בדיקת FITC-dextran להערכת השינויים בחדירות אנדותל הלב לאחר IR, אנו ממליצים בחום לערוך ניסויים על ידי אותו חוקר המתמחה בהקמת מודל IR של שריר הלב בחולדות כדי לאשר שהעורקים הכליליים חסומים באותו מיקום בהצלחה, והיחס בין השטח האיסכמי / השטח הכולל קבוע בין כל החולדות. כפי שמוצג באיור 1A,B, הלב (המסומן בחץ צהוב) נחשף, ולולאה (מסומנת בחץ ירוק) נוצרה בשריר הלב הממוקם בדופן הקדמית של החדר השמאלי, כ-2 מ"מ מתחת לקצה התוספתן הפרוזדורי השמאלי עם צינור סיליקון נימי בקוטר 0.5 מ"מ (קוטר פנימי) ותפר 6-0. כפי שניתן לראות באיור 1C, כאשר הלולאה הייתה מהודקת, שריר הלב האיסכמי הפך מוורוד לוורוד אפרפר (מסומן על ידי החץ הלבן) באופן מיידי.
יתר על כן, שריר הלב חזר והחזיר את צבעו הוורוד מיד לאחר שחרור הלולאה, כפי שמוצג באיור 1D. לאחר שחרור הלולאה, בוצע חתך במקביל לציר הארוך של עצם הירך בירך הפנימית. וריד הירך נחשף ונוקב באמצעות מזרק אינסולין, כפי שמוצג באיור 2A,B. לאחר זלוף חוזר של 3 שעות, בוצע חתך "V" בבטן התחתונה, ואבי העורקים הבטני והווריד הנבוב נותחו מהצפק (איור 3A). מי מלח קרים הוזרקו לתוך הווריד הנבוב בעדינות, ואבי העורקים הבטני נחתך כדי למנוע מתיחה מוגזמת של דופן החדר עקב הלחץ התוך חדרי שישפיע על המבנה ההיסטופתולוגי שלו. ריאות מולבנות (חץ אדום באיור 3B) וכבד באיור 3C מצביעים על כך שהרקמה הייתה מוחדרת היטב עם מי מלח.
כתוצאה מכך, לא היה הבדל משמעותי בשטח החתך בין שלוש הקבוצות: 1.00 ±-0.08 בקבוצת השאם לעומת 0.97 ±-0.08 בקבוצת ה-IR לעומת 1.02 ±-0.04 בקבוצת IR+TXL (איור 4A, n = 6 בכל קבוצה, p > 0.05 בין כל שתי הקבוצות). כפי שמוצג באיור 4B,C, העוצמה הממוצעת של הקרינה הירוקה בכל החלקים של חולדות השאם הייתה נמוכה ביותר. לעומת זאת, הקרינה הנפלטת על ידי FITC-דקסטרן אקסטרווזציה עלתה באופן ניכר בקבוצת ה-IR, מנורמלת לקבוצת ה-Sham (5.52 ±-0.85 בקבוצת ה-IR לעומת 1.00 ±-0.19 בקבוצת ה-Sham, n = 6, p < 0.05). יתר על כן, אבקת TXL סופר-דקה, הידועה כמגנה על האנדותל המיקרו-וסקולרי של הלב14,16, הפכה באופן ניכר את עוצמת הקרינה הגבוהה יותר הנגרמת על ידי IR (2.87 ± 0.52 בקבוצת IR + TXL לעומת 5.52 ± 0.85 בקבוצת IR, n = 6, p < 0.05). התמונות של שריר הלב האזורי הצביעו על כך ש-FITC-dextan הצטבר באופן גורף במטריצה החוץ-תאית אך לא במיקרו-כלי הדם, וכי TXL שיפר את תפקוד מחסום האנדותל (איור 5).
בהשוואה ל-FITC-dextran, EB עשוי להיות חלופה לא אופטימלית מכיוון ש-EB נחות מ-70,000 Da FITC-dextan הן באיכות התמונה והן ברגישות. באופן דומה, לא היה הבדל משמעותי בשטח החתך בין שלוש הקבוצות: 1.00 ±-0.08 בקבוצת השאם לעומת 0.97 ±-0.08 בקבוצת ה-IR לעומת 0.98 ±-0.05 בקבוצת IR+TXL (איור משלים S1A, n = 6 בכל קבוצה, p >-0.05 בין כל שתי הקבוצות). כפי שמוצג באיור משלים S1B,C, העוצמה הממוצעת של פלואורסצנטיות אדומה בחתכים שלמים של חולדות שאם הייתה גבוהה יחסית, במיוחד באנדוקרדיום ובאפיקרדיום. למרות שהפלואורסצנציה האדומה הנפלטת על ידי EB עלתה בחדות בקבוצת ה-IR (4.41 ±-0.66 בקבוצת ה-IR לעומת 1.00 ±-0.22 בקבוצת ה-Sham, n = 6, p < 0.05), ההבדל בין קבוצות IR+TXL ו-IR לא היה מובהק (3.73 ±-0.47 בקבוצת IR+TXL לעומת 4.41 ±-0.66 בקבוצת ה-IR, n = 6, p = 0.0956).
יתר על כן, שיטה זו נבדקה במודל אוטם שריר הלב (MI) (איור משלים S2). בקבוצת Myocardial Infarction Injection first (MII), תמיסת FITC-dextran (באותו ריכוז שהוזכר קודם לכן) הוזרקה למחזור הדם 5 דקות לפני קשירת LAD. זאת בניגוד לתמיסת FITC-dextán שהוזרקה מיד לאחר הקשירה בחולדות MIL (Myocardial Infarction Ligation first) שתוארה קודם לכן בפרוטוקול זה. מעניין שרק כמויות נמוכות של FITC-dextran נכנסו לתוך ה-ECM של שריר הלב הפגוע בחולדות MI משתי הקבוצות, מה שמצוין על ידי עוצמת פלואורסצנטיות ירוקה חלשה באיור משלים S2.
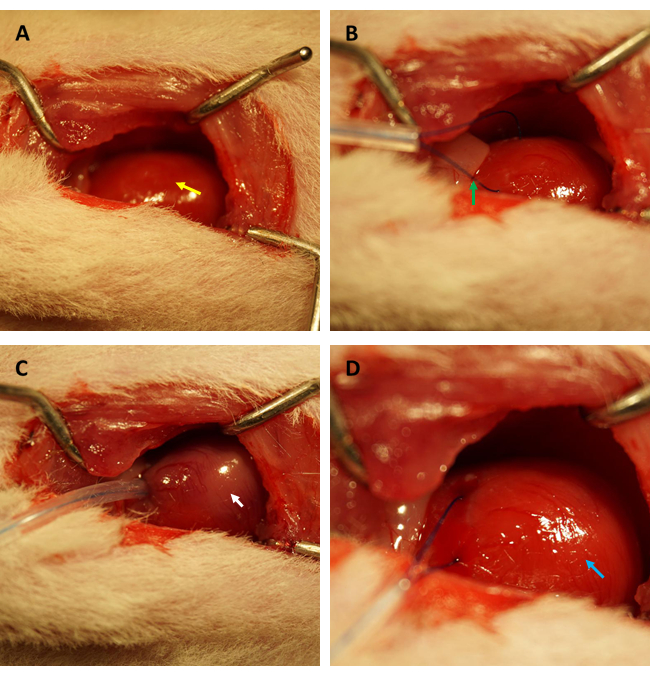
איור 1: שדה הראייה של כריתת בית החזה והתבססות איסכמיה/רפרפוזיה במודל חולדות. (A) חשיפת לב החולדה (מסומן בחץ צהוב); (B) יצירת לולאה כדי להקיף את העורק הכלילי (מסומן בחץ ירוק); (C) הידוק הלולאה וגרימת איסכמיה של שריר הלב למשך 45 דקות (מסומן בחץ לבן); (D) שחרור הלולאה ומתן אפשרות לזלוף שריר הלב למשך 3 שעות (מסומן על ידי החץ הכחול). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
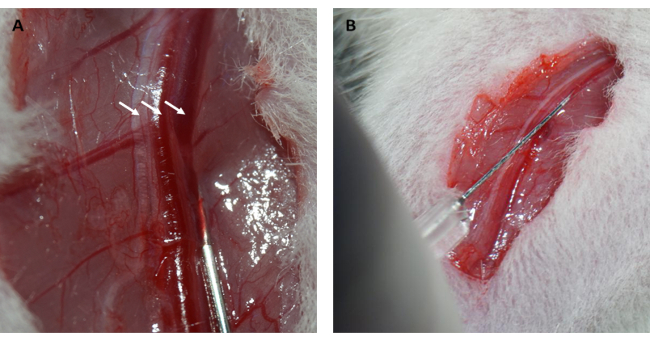
איור 2: דיסקציה של וריד הירך והזרקה תוך ורידית. (A) חשיפת וריד הירך (עצב הירך מסומן על ידי החץ משמאל; עורק הירך מסומן על ידי החץ באמצע; וריד הירך מסומן על ידי החץ מימין). (B) הזרקת תמיסת FITC-dextern לווריד הירך עם מזרק אינסולין. קיצור: FITC = פלואורסצאין איזותיוציאנט. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
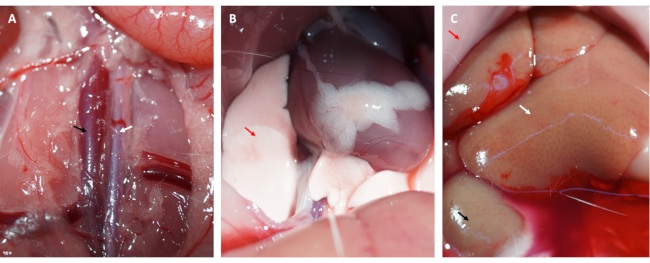
איור 3: זלוף רקמות ותסמינים של זלוף יעיל. (A) ניתוח אבי העורקים הבטני והווריד הנבוב (אבי העורקים הבטני מסומן על ידי החץ הלבן; הווריד הנבוב מסומן על ידי החץ השחור). (B) ריאות מולבנות הן סימפטום של זלוף מתאים; (C) רירית מולבנת, כליה מולבנת וכבד מזיע הם כולם תסמינים של זלוף הולם (חץ אדום: רירית; חץ לבן: כבד; חץ שחור: כליה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: תמונות מייצגות וניתוח של עוצמת הקרינה הממוצעת על ידי צביעת FITC-dextran. (A) שטח חתך יחסי של כל קבוצה מנורמל לזה של קבוצת Sham (עמ' > 0.05); (B) עוצמת הקרינה היחסית בערוץ ה-FITC של כל קבוצה מנורמלת לזו של קבוצת ה-Sham; (C) תמונות מייצגות בהגדלה של פי 9.5 בכל קבוצה. פסי קנה מידה = 800 מיקרומטר. ANOVA חד-כיווני עם השוואות מרובות קבוצות פוסט-הוק של Tukey. * נגד קבוצת שאם, עמ' < 0.05; # לעומת קבוצת IR, עמ' < 0.05. גרפי עמודות מראים ממוצע קבוצתי ± SD. קיצורים: IR = איסכמיה/רפרפוזיה; TXL = Tongxinluo; FITC = פלואורסצאין איזותיוציאנט; DAPI = 4',6-דיאמידינו-2-פנילינדול; ANOVA = ניתוח שונות; SD = סטיית תקן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: תמונות מייצגות של תחומי עניין בהגדלה של פי 200 של כל קבוצה לאחר צביעת FITC-dextran. פסי קנה מידה = 50 מיקרומטר. קיצורים: FITC = פלואורסצאין איזותיוציאנט; DAPI = 4',6-דיאמידינו-2-פנילינדול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים S1: תמונות מייצגות וניתוח של עוצמת הקרינה הממוצעת על ידי צביעת אוונס בלו. (A) שטח החתך היחסי של כל קבוצה מנורמל לזה של קבוצת Sham (עמ' > 0.05); (B) עוצמת הקרינה היחסית בערוץ האדום של טקסס של כל קבוצה מנורמלת לזו של קבוצת השאם; (C) תמונות מייצגות בכל קבוצה. ANOVA חד-כיווני עם השוואות מרובות קבוצות פוסט-הוק של Tukey. פסי קנה מידה = 800 מיקרומטר. * לעומת קבוצת שאם, עמ' < 0.05. גרפי עמודות מראים ממוצע קבוצתי ± SD. קיצורים: IR = איסכמיה/רפרפוזיה; TXL = Tongxinluo; DAPI = 4',6-דיאמידינו-2-פנילינדול; ANOVA = ניתוח שונות; SD = סטיית תקן. אנא לחץ כאן להורדת קובץ זה.
איור משלים S2: תמונות מייצגות בהגדלה של פי 9.5 של צביעת FITC-dextran במודל אוטם שריר הלב. פסי קנה מידה = 800 מיקרומטר. קיצורים: MII = הזרקת אוטם שריר הלב תחילה (הזרקת FITC-דקסטרן לפני אוטם שריר הלב); MIL = קשירת אוטם שריר הלב תחילה (הזרקת FITC-דקסטרן מיד לאחר אוטם שריר הלב); FITC = פלואורסצאין איזותיוציאנט; DAPI = 4',6-דיאמידינו-2-פנילינדול. אנא לחץ כאן להורדת קובץ זה.
Discussion
מאמר זה מציג פרוטוקול להערכת תפקוד לקוי של מחסום האנדותל הלבבי לאחר חשיפה ל-MIRI. יש לציין כי ישנם מספר שלבים מכריעים בפרוטוקול זה הקובעים את האמינות והדיוק של התוצאות. כל השלבים הכרוכים ב-FITC-dextán אמורים להתבצע בחדר חשוך. יש לאחסן את תמיסות ה-FITC-דקסטרן/מי מלח בטמפרטורה של 4 מעלות צלזיוס ולעטוף בנייר כסף. בנוסף, יש לקשור עורקים כליליים, כפי שמוצג באיור 1, כך שניתן יהיה להחזיר את שריר הלב מיד לאחר שחרור הלולאה. חוקרים יכולים לבחור בתפרי פוליאתילן 5-0 או 6-0 מכיוון שמיתרים דקים יותר מתחת ל-7-0 נוטים יותר לחתוך סיבי שריר הלב וכלי הדם. חשוב לציין, יש להזריק את תמיסת העוקב לוורידי הירך ולא לוורידי הזנב. כל לב צריך להיות חדור היטב ולשטוף היטב במי מלח קרים כקרח לפני ואחרי ההקרבה, בהתאמה.
חוקרים רבים המתמחים ב-MIRI נוטים לחקור את המבנה התת-תאי המשובש של האנדותל בשלב מוקדם יותר של רפרופוזיה של שריר הלב - היווצרות גופים אפופטוטיים, מיטוכונדריה נפוחה וצמתים בין-תאיים חריגים - כדי להוכיח את חדירות היתר של האנדותל באמצעות בדיקה מיקרוסקופית אלקטרונית. אימונובלוטינג שימש גם למדידת חדירות מיקרו-וסקולרית מכיוון שהירידה ברמות חלבוני הצירוף ההדוקים נחשבת למנגנון הליבה של פגיעה באנדותל ותפקוד לקוי של מחסום האנדותל לאורך זמן. לדוגמה, VE-cadherin20 ו-β-catenin21 הם מרכיבי מפתח בצמתים של הידבקות תא לתא, וקשרים אלה תורמים לשמירה על שלמות כלי הדם22. צמתים הדוקים, כגון JAM-A23,24 ואוקלודין25, משתתפים גם הם בשיתוף פעולה בבניית מחסום האנדותל במערכת הדם.
נכון לעכשיו, מספר הולך וגדל של מחקרים מצביעים על כך שתפקוד המיטוכונדריה והומאוסטזיס המיטוכונדריאלי יכולים להיות מטרות מפתח של מסלולי הגנה מפני פגיעות רפרפוזיה. כפי שדווח במחקרים פתופיזיולוגיים ופרמקולוגיים, מיטופגיה יכולה למלא תפקיד חשוב במוות התאי של האנדותל ושריר הלב הנגרם על ידי IR26. בנוסף, ביקוע מיטוכונדריאלי, פרוטאוסטזיס מיטוכונדריאלי ובקרת איכות מיטוכונדריאלית עשויים להגן על שריר הלב בסיכון גבוה באזורים מחודשים. השיטות לעיל מתמקדות יותר בהדגמת מנגנונים או גורמים שונים לחדירות יתר מאשר בהצגת חדירות אנדותל באופן ישיר וויזואלי. יתר על כן, הכנת דגימה לבדיקה מיקרוסקופית אלקטרונית היא מסובכת ומסוכנת. תמיסות גלוטרלדהיד, אצטון וחומצה אוסמית המשמשות במיקרוסקופ אלקטרונים ככל הנראה מנדפות ושוחקות את הרירית, הלחמית והעור, ואף מאיימות על חיים אם משתמשים בהן בסביבות לא מבוקרות.
בהשוואה לשיטות עקיפות ומסכנות חיים אלה, שיטה זו, המודדת את עוצמת הקרינה הנפלטת מאקסטרוואזציה של FITC-dextran, היא אידיאלית להערכת חדירות מיקרו-וסקולרית לבבית. ראשית, 70,000 Da FITC-dextran אינם יכולים לחדור דרך האנדותל בתנאים פיזיולוגיים רגילים אך יכולים להיכנס לחלל הבין-תאי של שריר הלב תחת IR, מה שמאפשר הבחנה ברורה בין חולדות בטיפולים שונים. בנוסף, תמיסת FITC-dextan מוזרקת לדם דרך ורידי הירך, מה שמבטיח שכל הנוזל מוזרק למחזור הדם של החולדה. לעומת זאת, הזרקת וריד הזנב קשה יותר בחולדות מכיוון שווריד הזנב אינו ברור ומכוסה בשכבה עבה. יתר על כן, בניגוד לקיבוע פרפורמלדהיד רגיל והטמעת פרפין, הטיפול ברקמת שריר הלב מפושט ומותאם באמצעות טכניקת החתך הפתולוגי בהקפאה מהירה המשמשת במחקר זה. זמן אחסון קצר, סביבה חסינת אור ושימור בהקפאה עשויים יחד להקל על כיבוי הקרינה של FITC.
חשוב מכך, שיטה זו יכולה למזער את הטיית הבחירה במהלך ניתוח סטטיסטי. אנו מבצעים מספיק זלוף לב עם מי מלח כדי להבטיח שכמעט כל הדם המעורבב עם FITC-dextan נשטף החוצה משריר הלב ומחדרי הלב, מה שיכול לחסל את הקרינה הנפלטת מכל FITC שנותר בכלי הדם. אם זה לא המקרה, יש לשלול פלואורסצנטיות הממוזגת עם נימים ולקצץ באופן מלאכותי. בעת איסוף רקמות מאזורי עניין, לא נצפה גבול חזותי בין שריר הלב האיסכמי לשריר הלב המרוחק, במיוחד לאחר צביעת צבע EB. זה עיכב את איסוף הדגימות מאזורים מייצגים אלה. באמצעות השיטה המתוארת כאן, חוקרים יכולים להשיג תמונות של קטעים שלמים ולנתח את עוצמת הקרינה באמצעות סורק מחוון כמותני.
מעניין שצבע EB יכול להוות חלופה, אם כי לא אופטימלית, ל-FITC-dextern. בהשוואה לתנאי האחסון הקשים יחסית של FITC-dextran, אבקת EB או תמיסתה יכולים להישאר יציבים בטמפרטורת החדר לאורך זמן. בנוסף, EB זול יחסית עבור רוב המוסדות. עם זאת, חסרונות מסוימים עלולים להגביל את יישומו. ראשית, צביעת EB מראה רגישות נמוכה יותר מאשר FITC-dextn, מה שעלול להמעיט בהערכת ההבדלים בין הקבוצות ולהגדיל את גודל המדגם של כל קבוצה. חוץ מזה, EB מראה הידבקות חזקה יותר לחלבונים. האנדוקרדיום והאפיקרדיום נצבעים ביתר קלות על ידי EB, מה שיכול להשפיע על תוצאות צפיפות הקרינה. יתר על כן, פגמי מילוי ברורים באזור הרפרפוזיה מפחיתים באופן ניכר את איכות התמונה, מה שעלול להגביל את השימוש ב-EB.
כדי להרחיב את היישום של שיטה זו במודל MI, השיטה נבדקה במודל MI. ראשית, FITC-דקסטרן הוזרק לכלי הדם לאחר קשירת LAD. כצפוי, רמה נמוכה של פלואורסצנטיות נפלטה מהפרוסה מכיוון ש-FITC-דקסטרן בזרימת הדם אינו יכול לעבור דרך האתר הקשור, ואף FITC-דקסטרן לא נכנס לאזור האיסכמי. FITC-dextran הוחל גם 5 דקות לפני הקשירה כדי להבטיח מעבר של FITC-dextern לכל האיברים. כתוצאה מכך, FITC-dextran לא הצליח לחדור לאנדותל המיקרו-וסקולרי כנראה מכיוון ששום לחץ זלוף בכלי דם קשורים לא יכול להניע את FITC-dextan דרך האנדותל. בדרך כלל, שיטה זו כנראה דורשת שינוי משמעותי יותר כדי לספק את היישום שלה במודל MI.
למרות היתרונות לעיל, ישנן מגבלות לשיטה זו. ראשית, פרוטוקול זה לא נבדק במודלים של IR של בעלי חיים אחרים, מה שעשוי להגביל את יישומו במחקרים פרה-קליניים וקליניים. שנית, צבעים עם תווית FITC יקרים יותר מצבעים נפוצים אחרים כגון EB. עם זאת, בניגוד ל-EB, מכיוון שתמיסת 10% w/v FITC-dextran, מדוללת בסרום, משנה לעתים רחוקות את צבע שריר הלב, צביעת FITC-dextern וצביעה כפולה של EB/2,3,5-triphenyltetrazole chloride (TTC) עשויה להתבצע באותו לב, מה שיכול לקצץ את התקציב ביחס למספר בעלי החיים והצבעים בהם נעשה שימוש. לבסוף, ייתכן שסורק השקופיות ששימש במחקר זה - סורק השקופיות הכמותי ומכשירים דומים - לא יהיה זמין במעבדות מסוימות. לסיכום, פרוטוקול זה מציג שיטה פשוטה, אמינה וויזואלית לזיהוי חדירות אנדותל מיקרו-וסקולרי לבבי במודל IR בחולדות באמצעות בדיקת פלואורסצנטיות המבוססת על מערכת הדמיה פתולוגית כמותית אוטומטית. פרוטוקול זה מדגים כי 70,000 Da FITC-dextan מתפקד טוב יותר מ-EB בהערכה התפקודית של מחסום האנדותל של מיקרו-כלי דם לבביים לאחר פגיעה ב-IR.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
מחקר זה נתמך על ידי מענקים מתוכנית המחקר והפיתוח הלאומית של סין (מס' 2017YFC1700503) והקרן הלאומית למדעי הטבע של סין (מס' 81874461 ומס' 81774292).
Materials
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
References
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59(2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349(2019).
- Li, B. -R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032(2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037(2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403(2018).
- Zhang, H. -T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775(2017).
- Yu, Z. -H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -X., Wang, P., Wang, N. -N., Li, S. -D., Yang, M. -H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485(2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23(2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156(2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved